Epivir 150mg Lamivudine Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Epivir y cómo se usa?
Epivir 150 mg es un medicamento recetado que se usa para tratar los síntomas de la infección por VIH y la hepatitis B crónica. Epivir 150 mg se puede usar solo o con otros medicamentos.
Epivir pertenece a una clase de medicamentos llamados Agentes de Hepatitis B/Hepatitis C; VIH, NRTI.
No se sabe si Epivir es seguro y efectivo en niños menores de 3 meses de edad.
¿Cuáles son los posibles efectos secundarios de Epivir 150 mg?
Epivir puede causar efectos secundarios graves que incluyen:
- urticaria,
- respiración dificultosa,
- hinchazón de la cara, los labios, la lengua o la garganta,
- dolor muscular inusual,
- dolor de estómago,
- vómitos,
- frecuencia cardíaca irregular,
- mareo,
- siento frio,
- debilidad,
- cansancio,
- dolor intenso en la parte superior del estómago que se extiende a la espalda,
- náuseas,
- frecuencia cardíaca rápida,
- hinchazón alrededor de su abdomen,
- dolor de estómago superior derecho,
- pérdida de apetito,
- orina oscura,
- heces de color arcilla,
- coloración amarillenta de la piel o los ojos (ictericia),
- fiebre,
- sudores nocturnos,
- glándulas inflamadas,
- herpes labial,
- tos,
- sibilancias,
- Diarrea,
- pérdida de peso,
- dificultad para hablar o tragar,
- problemas con el equilibrio o el movimiento de los ojos,
- sensación de picazón,
- hinchazón en el cuello o la garganta (agrandamiento de la tiroides),
- cambios menstruales y
- impotencia
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Epivir incluyen:
- náuseas,
- Diarrea,
- dolor de cabeza,
- fiebre,
- cansancio,
- malestar general,
- dolor de oído o sensación de llenura,
- problemas para escuchar,
- drenaje del oído,
- irritabilidad en un niño,
- congestión nasal,
- estornudos,
- dolor de garganta, y
- tos
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Epivir. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
ADVERTENCIA
EXACERBACIONES DE LA HEPATITIS B, Y DISTINTAS FORMULACIONES DE EPIVIR.
Exacerbaciones de la hepatitis B
Se han informado exacerbaciones agudas graves de la hepatitis B en pacientes coinfectados con el virus de la hepatitis B (VHB) y el virus de la inmunodeficiencia humana (VIH-1) y que suspendieron EPIVIR. La función hepática debe controlarse de cerca con seguimiento clínico y de laboratorio durante al menos varios meses en pacientes que interrumpen EPIVIR y están coinfectados con VIH-1 y VHB. Si corresponde, se puede justificar el inicio de una terapia contra la hepatitis B [ver ADVERTENCIAS Y PRECAUCIONES].
Diferencias importantes entre los productos que contienen lamivudina
Los comprimidos de EPIVIR de 150 mg y la solución oral (utilizados para tratar la infección por VIH-1) contienen una dosis mayor del ingrediente activo (lamivudina) que los comprimidos y la solución oral de EPIVIR-HBV (utilizados para tratar la infección crónica por VHB). Los pacientes con infección por VIH-1 deben recibir solo formas de dosificación apropiadas para el tratamiento del VIH-1 [ver ADVERTENCIAS Y PRECAUCIONES].
DESCRIPCIÓN
EPIVIR (también conocido como 3TC) es una marca de lamivudina, un análogo de nucleósido sintético con actividad contra el VIH-1 y el VHB. El nombre químico de lamivudina es (2R,cis)-4-amino-1(2-hidroximetil-1,3-oxatiolan-5-il)-(1H)-pirimidin-2-ona. Lamivudina es el enantiómero (-) de un análogo dideoxi de la citidina. Lamivudina también se conoce como (-)2',3'-didesoxi, 3'tiacitidina. Tiene una fórmula molecular de C8H11N3O3S y un peso molecular de 229,3 g por mol. Tiene la siguiente fórmula estructural:
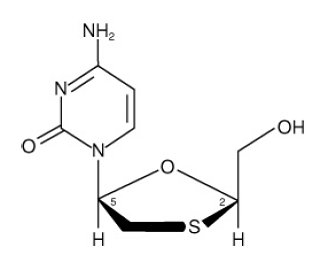
Lamivudina es un sólido cristalino de color blanco a blanquecino con una solubilidad de aproximadamente 70 mg por ml en agua a 20 °C.
Los comprimidos de EPIVIR 150 mg son para administración oral. Cada comprimido recubierto con película ranurado de 150 mg contiene 150 mg de lamivudina y los ingredientes inactivos hipromelosa, estearato de magnesio, celulosa microcristalina, polietilenglicol, polisorbato 80, glicolato de almidón sódico y dióxido de titanio.
Cada comprimido recubierto con película de 300 mg contiene 300 mg de lamivudina y los ingredientes inactivos óxido de hierro negro, hipromelosa, estearato de magnesio, celulosa microcristalina, polietilenglicol, polisorbato 80, glicolato de almidón sódico y dióxido de titanio.
EPIVIR solución oral es para administración oral. Un mililitro (1 ml) de EPIVIR solución oral contiene 10 mg de lamivudina (10 mg por ml) en una solución acuosa y los ingredientes inactivos sabores artificiales de fresa y plátano, ácido cítrico (anhidro), metilparabeno, propilenglicol, propilparabeno, citrato de sodio (dihidrato) y sacarosa (200 mg).
INDICACIONES
EPIVIR 150 mg es un análogo de nucleósido indicado en combinación con otros agentes antirretrovirales para el tratamiento de la infección por el virus de la inmunodeficiencia humana tipo 1 (VIH-1).
Limitaciones de uso
- La dosificación de este producto es para el VIH-1 y no para el VHB.
DOSIFICACIÓN Y ADMINISTRACIÓN
Dosis recomendada para pacientes adultos
La dosis recomendada de EPIVIR 150 mg en adultos infectados por el VIH-1 es de 300 mg al día, administrados como 150 mg por vía oral dos veces al día o 300 mg por vía oral una vez al día con o sin alimentos. Si se administra lamivudina a un paciente infectado por el VIH-1 y el VHB, se debe usar la dosis indicada para la terapia del VIH-1 como parte de un régimen de combinación apropiado [ver ADVERTENCIAS Y PRECAUCIONES ].
Dosis recomendada para pacientes pediátricos
El comprimido ranurado de 150 mg de EPIVIR es la formulación preferida para los pacientes pediátricos infectados por el VIH-1 que pesan al menos 14 kg y para quienes es adecuada una forma de dosificación sólida. Antes de prescribir comprimidos ranurados de EPIVIR, se debe evaluar la capacidad de tragar comprimidos de los pacientes pediátricos. Para los pacientes que no pueden tragar comprimidos de 150 mg de EPIVIR de manera segura y confiable, se puede recetar la formulación de solución oral [ver ADVERTENCIAS Y PRECAUCIONES ]. La dosis oral recomendada de comprimidos de 150 mg de EPIVIR para pacientes pediátricos infectados por el VIH-1 se presenta en la Tabla 1.
Solucion Oral
La dosis recomendada de EPIVIR 150 mg solución oral en pacientes pediátricos infectados por el VIH-1 a partir de los 3 meses de edad es de 5 mg por kg por vía oral dos veces al día o 10 mg por kg por vía oral una vez al día (hasta un máximo de 300 mg al día). administrado en combinación con otros agentes antirretrovirales [ver FARMACOLOGÍA CLÍNICA ]. Tenga en cuenta la carga viral del VIH-1 y el recuento/porcentaje de células CD4+ al seleccionar el intervalo de dosificación para pacientes que inician el tratamiento con solución oral [ver ADVERTENCIAS Y PRECAUCIONES , FARMACOLOGÍA CLÍNICA ].
Pacientes con insuficiencia renal
La dosis de EPIVIR 150 mg se ajusta de acuerdo con la función renal. Los ajustes de dosis se enumeran en la Tabla 2 [ver FARMACOLOGÍA CLÍNICA ].
No se requiere una dosis adicional de EPIVIR 150 mg después de la hemodiálisis de rutina (4 horas) o la diálisis peritoneal.
Aunque no hay datos suficientes para recomendar un ajuste de dosis específico de EPIVIR en pacientes pediátricos con insuficiencia renal, se debe considerar una reducción de la dosis y/o un aumento del intervalo de dosificación.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Tabletas ranuradas de EPIVIR
Los comprimidos ranurados de EPIVIR contienen 150 mg de lamivudina. Los comprimidos son comprimidos recubiertos con película, blancos, con forma de diamante, ranurados y grabados con “GX CJ7” en ambos lados.
EPIVIR Tabletas
Los comprimidos de EPIVIR contienen 300 mg de lamivudina. Los comprimidos son grises, con forma de diamante modificado, recubiertos con película y grabados con "GX EJ7" en un lado y lisos en el reverso.
EPIVIR Solución oral
EPIVIR solución oral contiene 10 mg de lamivudina por 1 ml. La solución es un líquido transparente, de incoloro a amarillo pálido, con sabor a fresa y plátano.
Almacenamiento y manipulación
EPIVIR Las tabletas ranuradas contienen 150 mg de lamivudina, son blancas, con forma de diamante, recubiertas con película y grabadas con "GX CJ7" en ambos lados. Empaquetado de la siguiente manera:
Frasco de 60 tabletas ( CDN 49702-203-18) con cierre de seguridad para niños.
EPIVIR Los comprimidos contienen 300 mg de lamivudina, son grises, tienen forma de diamante modificado, están recubiertos con una película y están grabados con "GX EJ7" en un lado y lisos en el reverso. Empaquetado de la siguiente manera:
Frasco de 30 comprimidos ( CDN 49702-204-13) con cierre de seguridad para niños.
Almacenamiento recomendado
Guarde las tabletas de EPIVIR a 25 °C (77 °F); excursiones permitidas a 15° a 30°C (59° a 86°F) [ver Temperatura ambiente controlada por USP ].
La solución oral de EPIVIR es un líquido transparente, de incoloro a amarillo pálido, con sabor a fresa y plátano. Cada ml de la solución contiene 10 mg de lamivudina. Empaquetado de la siguiente manera:
Frasco de plástico de 240 mL (NDC 49702-205-48) con cierre a prueba de niños. Este producto no requiere reconstitución.
Almacenar en frascos bien cerrados a 25°C (77°F) [ver Temperatura ambiente controlada por USP ].
Fabricado para: ViiV Healthcare Research Triangle Park, NC 27709. por: GlaxoSmithKline Research Triangle Park, NC 27709, Fabricado bajo acuerdo con Shire Pharmaceuticals Group plc. Revisado: abril de 2018
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas se analizan en otras secciones de la etiqueta:
- Exacerbaciones de la hepatitis B [ver ADVERTENCIA EN CAJA , ADVERTENCIAS Y PRECAUCIONES ].
- Acidosis láctica y hepatomegalia severa con esteatosis [ver ADVERTENCIAS Y PRECAUCIONES ].
- Descompensación hepática en pacientes coinfectados con VIH-1 y hepatitis C [ver ADVERTENCIAS Y PRECAUCIONES ].
- Pancreatitis [ver ADVERTENCIAS Y PRECAUCIONES ].
- Síndrome de reconstitución inmunitaria [ver ADVERTENCIAS Y PRECAUCIONES ].
Experiencia en ensayos clínicos
Experiencia en ensayos clínicos en sujetos adultos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica clínica.
El perfil de seguridad de EPIVIR 150 mg en adultos se basa principalmente en 3568 sujetos infectados por el VIH-1 en 7 ensayos clínicos.
Las reacciones adversas más comunes son dolor de cabeza, náuseas, malestar general, fatiga, signos y síntomas nasales, diarrea y tos.
Las reacciones adversas clínicas seleccionadas en más o igual al 5 % de los sujetos durante el tratamiento con EPIVIR 150 mg dos veces al día más RETROVIR 200 mg 3 veces al día durante un máximo de 24 semanas se enumeran en la Tabla 3.
pancreatitis
Se observó pancreatitis en 9 de 2613 sujetos adultos (0,3 %) que recibieron 150 mg de EPIVIR en ensayos clínicos controlados EPV20001, NUCA3001, NUCB3001, NUCA3002, NUCB3002 y NUCB3007 [ver ADVERTENCIAS Y PRECAUCIONES ].
EPIVIR 300 mg una vez al día
Los tipos y frecuencias de reacciones adversas clínicas notificadas en sujetos que recibieron EPIVIR 300 mg una vez al día o EPIVIR 150 mg dos veces al día (en regímenes de combinación de 3 fármacos en EPV20001 y EPV40001) durante 48 semanas fueron similares.
Las anormalidades de laboratorio seleccionadas observadas durante la terapia se resumen en la Tabla 4.
Las frecuencias de anormalidades de laboratorio seleccionadas informadas en sujetos que recibieron EPIVIR 300 mg una vez al día o EPIVIR 150 mg dos veces al día (en regímenes de combinación de 3 fármacos en EPV20001 y EPV40001) fueron similares.
Experiencia en ensayos clínicos en sujetos pediátricos
EPIVIR solución oral se ha estudiado en 638 sujetos pediátricos de 3 meses a 18 años en 3 ensayos clínicos.
Reacciones adversas clínicas seleccionadas y hallazgos físicos con una frecuencia mayor o igual al 5% durante la terapia con EPIVIR 4 mg por kg dos veces al día más RETROVIR 160 mg por m² 3 veces al día en pacientes sin tratamiento previo (menos o igual a 56 días de tratamiento antirretroviral). terapia) los sujetos pediátricos se enumeran en la Tabla 5.
pancreatitis
Se ha observado pancreatitis, que ha sido mortal en algunos casos, en sujetos pediátricos que habían recibido tratamiento previo con nucleósidos antirretrovirales que recibían EPIVIR solo o en combinación con otros agentes antirretrovirales. En un ensayo abierto de escalada de dosis (NUCA2002), 14 sujetos (14 %) desarrollaron pancreatitis mientras recibían monoterapia con EPIVIR. Tres de estos sujetos murieron por complicaciones de pancreatitis. En un segundo ensayo abierto (NUCA2005), 12 sujetos (18 %) desarrollaron pancreatitis. En el ensayo ACTG300, no se observó pancreatitis en 236 sujetos aleatorizados a EPIVIR 150 mg más RETROVIR. Se observó pancreatitis en 1 sujeto en este ensayo que recibió EPIVIR de etiqueta abierta en combinación con RETROVIR y ritonavir luego de la interrupción de la monoterapia con didanosina [ver ADVERTENCIAS Y PRECAUCIONES ].
Parestesias Y Neuropatías Periféricas
Se informaron parestesias y neuropatías periféricas en 15 sujetos (15 %) en el ensayo NUCA2002, 6 sujetos (9 %) en el ensayo NUCA2005 y 2 sujetos (menos del 1 %) en el ensayo ACTG300.
Las anormalidades de laboratorio seleccionadas experimentadas por sujetos pediátricos sin tratamiento previo (menor o igual a 56 días de tratamiento antirretroviral) se enumeran en la Tabla 6.
Sujetos pediátricos Dosificación una vez al día frente a dos veces al día (COL105677)
En el ensayo ARROW se evaluó la seguridad de una dosis de EPIVIR de 150 mg una vez al día en comparación con dos veces al día. La evaluación de seguridad primaria en el ensayo ARROW se basó en eventos adversos de Grado 3 y Grado 4. La frecuencia de eventos adversos de Grado 3 y 4 fue similar entre los sujetos aleatorizados a la dosis de una vez al día en comparación con los sujetos aleatorizados a la dosis de dos veces al día. El investigador consideró que un evento de hepatitis de Grado 4 en la cohorte de una vez al día tenía una causalidad incierta y el investigador consideró que todos los demás eventos adversos de Grado 3 o 4 no estaban relacionados.
Neonatos
Se dispone de información limitada de seguridad a corto plazo de 2 ensayos pequeños no controlados en Sudáfrica en recién nacidos que recibieron lamivudina con o sin zidovudina durante la primera semana de vida después del tratamiento materno que comenzó en la semana 38 o 36 de gestación [ver FARMACOLOGÍA CLÍNICA ]. Las reacciones adversas seleccionadas informadas en estos recién nacidos incluyeron aumento de las pruebas de función hepática, anemia, diarrea, alteraciones electrolíticas, hipoglucemia, ictericia y hepatomegalia, erupción cutánea, infecciones respiratorias y sepsis; Fallecieron 3 neonatos (1 por gastroenteritis con acidosis y convulsiones, 1 por lesión traumática y 1 por causas desconocidas). Se informaron otros dos casos de gastroenteritis o diarrea no mortales, uno de ellos con convulsiones; 1 bebé tenía insuficiencia renal transitoria asociada con deshidratación. La ausencia de grupos de control limita las evaluaciones de causalidad, pero se debe suponer que los lactantes expuestos perinatalmente pueden tener riesgo de reacciones adversas comparables a las notificadas en pacientes pediátricos y adultos infectados por el VIH-1 tratados con regímenes combinados que contienen lamivudina. Se desconocen los efectos a largo plazo de la exposición a lamivudina en el útero y en lactantes.
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de EPIVIR. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño desconocido, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco. Estas reacciones se han elegido para su inclusión debido a una combinación de su gravedad, frecuencia de notificación o posible conexión causal con lamivudina.
cuerpo como un todo
Redistribución/acumulación de grasa corporal.
Endocrino y Metabólico
Hiperglucemia.
General
Debilidad. Anemia hemática y linfática (incluyendo aplasia pura de glóbulos rojos y anemias severas que progresan con la terapia).
Hepático y Pancreático
Acidosis láctica y esteatosis hepática [ver ADVERTENCIAS Y PRECAUCIONES ], exacerbaciones posteriores al tratamiento de la hepatitis B [ver ADVERTENCIAS Y PRECAUCIONES ].
Hipersensibilidad
Anafilaxia, urticaria.
musculoesquelético
Debilidad muscular, elevación de CPK, rabdomiolisis. Piel Alopecia, prurito.
INTERACCIONES CON LA DROGAS
Fármacos que inhiben los transportadores de cationes orgánicos
Lamivudina se elimina predominantemente en la orina mediante secreción catiónica orgánica activa. Se debe considerar la posibilidad de interacciones con otros fármacos administrados simultáneamente, particularmente cuando su vía principal de eliminación es la secreción renal activa a través del sistema de transporte catiónico orgánico (p. ej., trimetoprima) [ver FARMACOLOGÍA CLÍNICA ]. No se dispone de datos sobre interacciones con otros fármacos que tengan mecanismos de eliminación renal similares a los de lamivudina.
Sorbitol
La coadministración de dosis únicas de lamivudina y sorbitol resultó en una reducción dependiente de la dosis de sorbitol en las exposiciones a lamivudina. Cuando sea posible, evite el uso de medicamentos que contengan sorbitol con lamivudina [ver ADVERTENCIAS Y PRECAUCIONES , FARMACOLOGÍA CLÍNICA ].
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Pacientes con coinfección por el virus de la hepatitis B
Exacerbaciones posteriores al tratamiento de la hepatitis
Se han producido pruebas clínicas y de laboratorio de exacerbaciones de la hepatitis después de la suspensión de lamivudina. Estas exacerbaciones se han detectado principalmente por elevaciones séricas de ALT además de la reaparición del ADN del VHB. Aunque la mayoría de los eventos parecen haber sido autolimitados, en algunos casos se han informado muertes. Se han informado eventos similares a partir de la experiencia posterior a la comercialización después de cambios de regímenes de tratamiento del VIH-1 que contienen lamivudina a regímenes que no contienen lamivudina en pacientes infectados tanto con el VIH-1 como con el VHB. Se desconoce la relación causal con la interrupción del tratamiento con lamivudina. Los pacientes deben ser monitoreados de cerca con seguimiento clínico y de laboratorio durante al menos varios meses después de suspender el tratamiento.
Diferencias importantes entre los productos que contienen lamivudina
Los comprimidos de EPIVIR 150 mg y la solución oral contienen una dosis más alta del mismo ingrediente activo (lamivudina) que los comprimidos de EPIVIR-HBV y la solución oral de EPIVIR-HBV. EPIVIR-HBV se desarrolló para pacientes con hepatitis B crónica. La formulación y la dosis de lamivudina en EPIVIR-HBV no son apropiadas para pacientes coinfectados con VIH-1 y VHB. No se ha establecido la seguridad y eficacia de lamivudina para el tratamiento de la hepatitis B crónica en pacientes coinfectados con VIH-1 y VHB. Si se prescribe el tratamiento con EPIVIR-HBV para la hepatitis B crónica en un paciente con infección por VIH-1 no reconocida o no tratada, es probable que se produzca una rápida aparición de resistencia al VIH-1 debido a la dosis subterapéutica y a la inadecuación del tratamiento monoterapéutico del VIH-1. Si se toma la decisión de administrar lamivudina a pacientes coinfectados con VIH-1 y VHB, se debe usar EPIVIR 150 mg comprimidos, EPIVIR 150 mg solución oral u otro producto que contenga la dosis más alta de lamivudina como parte de un régimen de combinación apropiado.
Aparición de VHB resistente a lamivudina
No se ha establecido la seguridad y eficacia de lamivudina para el tratamiento de la hepatitis B crónica en sujetos con infección dual por VIH-1 y VHB (consulte la información de prescripción completa de EPIVIR-VHB). También se ha notificado la aparición de variantes del virus de la hepatitis B asociadas con la resistencia a lamivudina en sujetos infectados por el VIH-1 que han recibido regímenes antirretrovirales que contienen lamivudina en presencia de infección concurrente por el virus de la hepatitis B.
Acidosis láctica y hepatomegalia severa con esteatosis
Se han notificado acidosis láctica y hepatomegalia grave con esteatosis, incluidos casos mortales, con el uso de análogos de nucleósidos, incluido EPIVIR. La mayoría de estos casos han sido en mujeres. El sexo femenino y la obesidad pueden ser factores de riesgo para el desarrollo de acidosis láctica y hepatomegalia grave con esteatosis en pacientes tratados con análogos de nucleósidos antirretrovirales. El tratamiento con EPIVIR debe suspenderse en cualquier paciente que desarrolle hallazgos clínicos o de laboratorio que sugieran acidosis láctica o hepatotoxicidad pronunciada, que puede incluir hepatomegalia y esteatosis incluso en ausencia de elevaciones marcadas de transaminasas.
Uso con regímenes basados en interferón y ribavirina
Los estudios in vitro han demostrado que la ribavirina puede reducir la fosforilación de análogos de nucleósidos de pirimidina como lamivudina. Aunque no se observó evidencia de una interacción farmacocinética o farmacodinámica (p. ej., pérdida de la supresión virológica de VIH-1/VHC) cuando se coadministró ribavirina con lamivudina en pacientes coinfectados con VIH-1/VHC [ver FARMACOLOGÍA CLÍNICA ], se ha producido descompensación hepática (algunas fatales) en pacientes coinfectados con VIH-1/VHC que recibieron terapia antirretroviral combinada para VIH-1 e interferón alfa con o sin ribavirina. Los pacientes que reciben interferón alfa con o sin ribavirina y EPIVIR deben ser monitoreados de cerca por toxicidades asociadas al tratamiento, especialmente descompensación hepática. La suspensión de EPIVIR 150 mg debe considerarse médicamente adecuada. También se debe considerar la reducción de la dosis o la interrupción del interferón alfa, la ribavirina o ambos si se observa un empeoramiento de las toxicidades clínicas, incluida la descompensación hepática (p. ej., Child-Pugh superior a 6). Consulte la información de prescripción completa de interferón y ribavirina.
pancreatitis
En pacientes pediátricos con antecedentes de exposición previa a nucleósidos antirretrovirales, antecedentes de pancreatitis u otros factores de riesgo significativos para el desarrollo de pancreatitis, se debe usar EPIVIR 150 mg con precaución. El tratamiento con EPIVIR 150 mg debe suspenderse de inmediato si se presentan signos clínicos, síntomas o anomalías de laboratorio que sugieran pancreatitis [ver REACCIONES ADVERSAS ].
Síndrome de Reconstitución Inmune
Se ha notificado síndrome de reconstitución inmunitaria en pacientes tratados con terapia antirretroviral combinada, incluido EPIVIR. Durante la fase inicial del tratamiento antirretroviral combinado, los pacientes cuyo sistema inmunitario responde pueden desarrollar una respuesta inflamatoria a infecciones oportunistas indolentes o residuales (como infección por Mycobacterium avium, citomegalovirus, neumonía por Pneumocystis jirovecii [PCP] o tuberculosis), lo que puede requerir una evaluación adicional y tratamiento
También se ha informado que ocurren trastornos autoinmunitarios (como la enfermedad de Graves, la polimiositis y el síndrome de Guillain-Barré) en el contexto de la reconstitución inmunitaria; sin embargo, el tiempo de aparición es más variable y puede ocurrir muchos meses después del inicio del tratamiento.
Tasas de supresión virológica más bajas y mayor riesgo de resistencia viral con solución oral
Los sujetos pediátricos que recibieron EPIVIR 150 mg de solución oral (en dosis basadas en bandas de peso de aproximadamente 8 mg por kg por día) junto con otras soluciones orales antirretrovirales en cualquier momento en el ensayo ARROW tuvieron tasas más bajas de supresión virológica, menor exposición a lamivudina en plasma y desarrollaron resistencia viral con más frecuencia que aquellos que reciben comprimidos de EPIVIR [ver FARMACOLOGÍA CLÍNICA , Microbiología , Estudios clínicos ].
El comprimido ranurado de EPIVIR es la formulación preferida para los pacientes pediátricos infectados por el VIH-1 que pesan al menos 14 kg y para quienes es adecuada una forma de dosificación sólida. Siempre que sea posible, se debe usar un régimen de solo tabletas para evitar una interacción potencial con sorbitol [ver FARMACOLOGÍA CLÍNICA ]. Considere un control más frecuente de la carga viral del VIH-1 cuando se trate con EPIVIR 150 mg solución oral.
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA (Información para el paciente).
Pacientes con coinfección por hepatitis B o C
Informar a los pacientes coinfectados por el VIH-1 y el VHB que se ha producido un deterioro de la enfermedad hepática en algunos casos cuando se interrumpió el tratamiento con lamivudina. Aconseje a los pacientes que analicen cualquier cambio en el régimen con su proveedor de atención médica [ver ADVERTENCIAS Y PRECAUCIONES ].
Informe a los pacientes con coinfección por VIH-1/VHC que se ha producido descompensación hepática (alguna fatal) en pacientes coinfectados por VIH-1/VHC que reciben terapia antirretroviral combinada para VIH-1 e interferón alfa con o sin ribavirina [ver ADVERTENCIAS Y PRECAUCIONES ].
Diferencias en las formulaciones de EPIVIR
Indique a los pacientes que las tabletas y la solución oral de EPIVIR de 150 mg contienen una dosis más alta del mismo ingrediente activo (lamivudina) que las tabletas y la solución oral de EPIVIR-HBV. Si se toma la decisión de incluir lamivudina en el régimen de tratamiento del VIH-1 de un paciente coinfectado con VIH-1 y VHB, se debe usar la formulación y la dosis de lamivudina en EPIVIR (no EPIVIR-VHB) [ver ADVERTENCIAS Y PRECAUCIONES ].
Acidosis láctica/hepatomegalia con esteatosis
Informe a los pacientes que se han notificado casos de acidosis láctica y hepatomegalia grave con esteatosis con el uso de análogos de nucleósidos y otros antirretrovirales. Aconseje a los pacientes que dejen de tomar EPIVIR si desarrollan síntomas clínicos que sugieran acidosis láctica o hepatotoxicidad pronunciada [ver ADVERTENCIAS Y PRECAUCIONES ].
Riesgo de pancreatitis
Aconseje a los padres o tutores que vigilen a los pacientes pediátricos para detectar signos y síntomas de pancreatitis [ver ADVERTENCIAS Y PRECAUCIONES ].
Síndrome de Reconstitución Inmune
Aconseje a los pacientes que informen a su proveedor de atención médica de inmediato sobre cualquier signo y síntoma de infección, ya que la inflamación de una infección previa puede ocurrir poco después de la terapia antirretroviral combinada, incluso cuando se inicia EPIVIR [ver ADVERTENCIAS Y PRECAUCIONES ].
Tasas de supresión virológica más bajas y mayor riesgo de resistencia viral con solución oral
Aconseje a los pacientes que se debe usar un régimen de solo tabletas cuando sea posible debido a una mayor tasa de fracaso del tratamiento entre los sujetos pediátricos que recibieron la solución oral EPIVIR concomitantemente con otras soluciones orales antirretrovirales [ver ADVERTENCIAS Y PRECAUCIONES ].
Contenido de sacarosa de la solución oral de EPIVIR
Aconseje a los pacientes diabéticos que cada dosis de 15 ml de solución oral de EPIVIR contiene 3 gramos de sacarosa (1 ml = 200 mg de sacarosa) [ver DESCRIPCIÓN ].
Registro de Embarazo
Informe a los pacientes que existe un registro de exposición durante el embarazo que monitorea los resultados del embarazo en mujeres expuestas a EPIVIR durante el embarazo [ver Uso en poblaciones específicas ].
Lactancia
Indique a las mujeres con infección por VIH-1 que no amamanten porque el VIH-1 puede transmitirse al bebé a través de la leche materna [ver Uso en poblaciones específicas ].
Dosis olvidada
Indique a los pacientes que si olvidan una dosis de EPIVIR 150 mg, la tomen tan pronto como lo recuerden. Aconseje a los pacientes que no dupliquen su próxima dosis ni tomen más de la dosis prescrita [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
EPIVIR y RETROVIR son marcas comerciales propiedad del grupo de empresas ViiV Healthcare o con licencia para este.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Carcinogénesis
Los estudios de carcinogenicidad a largo plazo con lamivudina en ratones y ratas no mostraron evidencia de potencial carcinogénico en exposiciones de hasta 10 veces (ratones) y 58 veces (ratas) la exposición humana a la dosis recomendada de 300 mg.
mutagénesis
Lamivudina fue mutagénica en un ensayo de linfoma de ratón L5178Y y clastogénica en un ensayo citogenético utilizando linfocitos humanos cultivados. Lamivudina no fue mutagénica en un ensayo de mutagenicidad microbiana, en un ensayo de transformación celular in vitro, en una prueba de micronúcleo de rata, en un ensayo citogenético de médula ósea de rata y en un ensayo de síntesis de ADN no programada en hígado de rata. Lamivudina no mostró evidencia de actividad genotóxica in vivo en la rata a dosis orales de hasta 2000 mg por kg, produciendo niveles plasmáticos de 35 a 45 veces mayores que en humanos a la dosis recomendada para la infección por VIH-1.
Deterioro de la fertilidad
En un estudio de rendimiento reproductivo, la lamivudina administrada a ratas en dosis de hasta 4000 mg por kg por día, produciendo niveles plasmáticos de 47 a 70 veces superiores a los de los humanos, no reveló evidencia de alteración de la fertilidad ni efecto sobre la supervivencia, el crecimiento y el desarrollo. al destete de la descendencia.
Uso en poblaciones específicas
El embarazo
Registro de exposición durante el embarazo
Existe un registro de exposición durante el embarazo que monitorea los resultados del embarazo en mujeres expuestas a EPIVIR durante el embarazo. Se recomienda a los proveedores de atención médica que registren a los pacientes llamando al Registro de embarazos con antirretrovirales (APR) al 1-800-258-4263.
Resumen de riesgos
Los datos disponibles de la APR no muestran ninguna diferencia en el riesgo general de defectos congénitos para lamivudina en comparación con la tasa de antecedentes para defectos congénitos del 2,7 % en la población de referencia del Programa de defectos congénitos del área metropolitana de Atlanta (MACDP) (ver Datos ). El APR usa el MACDP como la población de referencia de EE. UU. para defectos de nacimiento en la población general. El MACDP evalúa a las mujeres y los bebés de un área geográfica limitada y no incluye los resultados de los nacimientos que ocurrieron con menos de 20 semanas de gestación. La tasa de aborto espontáneo no se informa en la APR. La tasa de fondo estimada de aborto espontáneo en embarazos clínicamente reconocidos en la población general de los EE. UU. es del 15 % al 20 %. Se desconoce el riesgo de antecedentes de defectos congénitos importantes y abortos espontáneos para la población indicada.
En estudios de reproducción animal, la administración oral de lamivudina a conejas preñadas durante la organogénesis resultó en embrioletalidad a una exposición sistémica (AUC) similar a la dosis clínica recomendada; sin embargo, no se observaron efectos adversos en el desarrollo con la administración oral de lamivudina a ratas preñadas durante la organogénesis a concentraciones plasmáticas (Cmax) 35 veces la dosis clínica recomendada (ver Datos ).
Datos
Datos humanos
Según los informes prospectivos de la APR de más de 11 000 exposiciones a lamivudina durante el embarazo que resultaron en nacimientos vivos (incluidas más de 4500 expuestas en el primer trimestre), no hubo diferencia entre el riesgo general de defectos congénitos para lamivudina en comparación con la tasa de anomalías congénitas de fondo del 2,7% en la población de referencia estadounidense del MACDP. La prevalencia de defectos en los nacidos vivos fue del 3,1 % (IC del 95 %: del 2,6 % al 3,6 %) después de la exposición en el primer trimestre a regímenes que contenían lamivudina y del 2,8 % (IC del 95 %: del 2,5 % al 3,3 %) después de la exposición en el segundo/tercer trimestre. a los regímenes que contienen lamivudina.
La farmacocinética de lamivudina se estudió en mujeres embarazadas durante 2 ensayos clínicos realizados en Sudáfrica. Los ensayos evaluaron la farmacocinética en 16 mujeres a las 36 semanas de gestación usando 150 mg de lamivudina dos veces al día con zidovudina, 10 mujeres a las 38 semanas de gestación usando 150 mg de lamivudina dos veces al día con zidovudina y 10 mujeres a las 38 semanas de gestación usando lamivudina 300 mg dos veces diariamente sin otros antirretrovirales. Estos ensayos no fueron diseñados o potenciados para proporcionar información sobre la eficacia. Las concentraciones de lamivudina fueron generalmente similares en muestras de suero materno, neonatal y de cordón umbilical. En un subconjunto de sujetos, se recolectaron muestras de líquido amniótico luego de la ruptura natural de las membranas y se confirmó que lamivudina atraviesa la placenta en humanos. Según los datos limitados en el momento del parto, la mediana (rango) de las concentraciones de lamivudina en el líquido amniótico fue 3,9 (1,2 a 12,8) veces mayor en comparación con la concentración sérica materna pareada (n = 8).
Datos de animales
Lamivudina se administró por vía oral a ratas preñadas (a 90, 600 y 4000 mg por kg por día) y conejos (a 90, 300 y 1000 mg por kg por día y a 15, 40 y 90 mg por kg por día) durante la organogénesis (en los días de gestación 7 a 16 [rata] y 8 a 20 [conejo]). No se observó evidencia de malformaciones fetales debidas a lamivudina en ratas y conejos a dosis que produjeron concentraciones plasmáticas (Cmax) aproximadamente 35 veces mayores que la exposición humana a la dosis diaria recomendada. Se observó evidencia de embrioletalidad temprana en conejos a exposiciones sistémicas (AUC) similares a las observadas en humanos, pero no hubo indicios de este efecto en ratas a concentraciones plasmáticas (Cmax) 35 veces más altas que la exposición humana a la dosis diaria recomendada . Los estudios en ratas preñadas mostraron que lamivudina se transfiere al feto a través de la placenta. En el estudio de fertilidad/desarrollo pre y posnatal en ratas, se administró lamivudina por vía oral en dosis de 180, 900 y 4000 mg por kg por día (desde antes del apareamiento hasta el día 20 posnatal). En el estudio, el desarrollo de la descendencia, incluida la fertilidad y el rendimiento reproductivo, no se vio afectado por la administración materna de lamivudina.
Lactancia
Resumen de riesgos
Los Centros para el Control y la Prevención de Enfermedades recomiendan que las madres infectadas por el VIH-1 en los Estados Unidos no amamanten a sus bebés para evitar el riesgo de transmisión posnatal de la infección por el VIH-1. Lamivudina está presente en la leche humana. No hay información sobre los efectos de lamivudina en el lactante o los efectos de las drogas en la producción de leche. Debido al potencial de (1) transmisión del VIH-1 (en bebés VIH negativos), (2) desarrollo de resistencia viral (en bebés VIH positivos) y (3) reacciones adversas en un bebé amamantado, indique a las madres que no amamanten. si están recibiendo EPIVIR.
Uso pediátrico
Se ha establecido la seguridad y eficacia de EPIVIR 150 mg en combinación con otros agentes antirretrovirales en pacientes pediátricos de 3 meses de edad y mayores. El comprimido ranurado de EPIVIR es la formulación preferida para los pacientes pediátricos infectados por el VIH-1 que pesan al menos 14 kg y para quienes una forma de dosificación sólida es adecuada porque los sujetos pediátricos que recibieron la solución oral de 150 mg de EPIVIR tuvieron tasas más bajas de supresión virológica, menor exposición a lamivudina en plasma , y desarrollaron resistencia viral con más frecuencia que los que recibieron comprimidos de EPIVIR de 150 mg en el ensayo ARROW [ver DOSIFICACIÓN Y ADMINISTRACIÓN , ADVERTENCIAS Y PRECAUCIONES , REACCIONES ADVERSAS , FARMACOLOGÍA CLÍNICA , Estudios clínicos ].
Uso geriátrico
Los ensayos clínicos de EPIVIR no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes. En general, se debe tener precaución en la administración de EPIVIR en pacientes de edad avanzada debido a la mayor frecuencia de disminución de la función hepática, renal o cardíaca, y de enfermedades concomitantes u otra terapia farmacológica [ver DOSIFICACIÓN Y ADMINISTRACIÓN , FARMACOLOGÍA CLÍNICA ].
Pacientes con función renal alterada
Se recomienda una reducción de la dosis de EPIVIR 150 mg para pacientes con insuficiencia renal [ver DOSIFICACIÓN Y ADMINISTRACIÓN , FARMACOLOGÍA CLÍNICA ].
SOBREDOSIS
No existe un tratamiento específico conocido para la sobredosis de EPIVIR. Si se produce una sobredosis, se debe controlar al paciente y aplicar el tratamiento de apoyo estándar según sea necesario. Debido a que se eliminó una cantidad insignificante de lamivudina mediante hemodiálisis (4 horas), diálisis peritoneal ambulatoria continua y diálisis peritoneal automatizada, no se sabe si la hemodiálisis continua brindaría un beneficio clínico en un evento de sobredosis de lamivudina.
CONTRAINDICACIONES
EPIVIR 150 mg está contraindicado en pacientes con una reacción de hipersensibilidad previa a lamivudina.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
Lamivudina es un agente antirretroviral [ver Microbiología ].
Farmacocinética
Farmacocinética en adultos
Las propiedades farmacocinéticas de lamivudina se han estudiado en sujetos adultos infectados por el VIH-1 asintomáticos después de la administración de dosis intravenosas (IV) únicas que oscilan entre 0,25 y 8 mg por kg, así como dosis orales únicas y múltiples (régimen de dos veces al día). oscilando entre 0,25 y 10 mg por kg.
Las propiedades farmacocinéticas de lamivudina también se han estudiado en dosis orales únicas y múltiples que oscilan entre 5 mg y 600 mg por día administradas a sujetos infectados por el VHB.
Las propiedades farmacocinéticas en estado estacionario del comprimido de EPIVIR de 300 mg una vez al día durante 7 días en comparación con el comprimido de EPIVIR de 150 mg dos veces al día durante 7 días se evaluaron en un ensayo cruzado en 60 sujetos sanos. EPIVIR 300 mg una vez al día resultó en exposiciones a lamivudina que fueron similares a EPIVIR 150 mg dos veces al día con respecto al AUC24,ss en plasma; sin embargo, la Cmax,ss fue un 66 % más alta y el valor mínimo fue un 53 % más bajo en comparación con el régimen de 150 mg dos veces al día. Las exposiciones intracelulares de trifosfato de lamivudina en células mononucleares de sangre periférica también fueron similares con respecto a AUC24,ss y Cmax24,ss; sin embargo, los valores mínimos fueron más bajos en comparación con el régimen de 150 mg dos veces al día. La variabilidad entre sujetos fue mayor para las concentraciones intracelulares de trifosfato de lamivudina frente a las concentraciones plasmáticas mínimas de lamivudina.
La farmacocinética de lamivudina se evaluó en 12 sujetos adultos infectados por el VIH-1 que recibieron una dosis de 150 mg de lamivudina dos veces al día en combinación con otros agentes antirretrovirales. La media geométrica (IC del 95 %) para el AUC(0-12) fue de 5,53 (4,58, 6,67) mcg.h por ml y para la Cmax fue de 1,40 (1,17, 1,69) mcg por ml.
Absorción y biodisponibilidad
La biodisponibilidad absoluta en 12 sujetos adultos fue del 86 % ± 16 % (media ± DE) para el comprimido de 150 mg y del 87 % ± 13 % para la solución oral. Después de la administración oral de 2 mg por kg dos veces al día a 9 adultos con VIH-1, la concentración sérica máxima de lamivudina (Cmax) fue de 1,5 ± 0,5 mcg por ml (media ± DE). El área bajo la curva de concentración plasmática versus tiempo (AUC) y la Cmax aumentaron en proporción a la dosis oral en el rango de 0,25 a 10 mg por kg.
El índice de acumulación de lamivudina en adultos asintomáticos VIH-1 positivos con función renal normal fue de 1,50 después de 15 días de administración oral de 2 mg por kg dos veces al día.
Efectos de los alimentos en la absorción oral
Los comprimidos de EPIVIR 150 mg y la solución oral se pueden administrar con o sin alimentos. Una forma de dosificación de investigación de 25 mg de lamivudina se administró por vía oral a 12 sujetos infectados por el VIH-1 asintomáticos en 2 ocasiones, una vez en ayunas y otra con alimentos (1099 kcal; 75 gramos de grasa, 34 gramos de proteína, 72 gramos de carbohidratos). ). La absorción de lamivudina fue más lenta con alimentos (Tmax: 3,2 ± 1,3 horas) en comparación con el estado en ayunas (Tmax: 0,9 ± 0,3 horas); La Cmax en el estado de alimentación fue un 40 % ± 23 % (media ± DE) más baja que en el estado de ayunas. No hubo diferencias significativas en la exposición sistémica (AUC∞) en los estados con alimentos y en ayunas.
Distribución
El volumen aparente de distribución después de la administración IV de lamivudina a 20 sujetos fue de 1,3 ± 0,4 l por kg, lo que sugiere que lamivudina se distribuye en los espacios extravasculares. El volumen de distribución fue independiente de la dosis y no se correlacionó con el peso corporal.
La unión de lamivudina a las proteínas plasmáticas humanas es inferior al 36 %. Los estudios in vitro mostraron que en el rango de concentración de 0,1 a 100 mcg por ml, la cantidad de lamivudina asociada con los eritrocitos varió del 53 % al 57 % y fue independiente de la concentración.
Metabolismo
El metabolismo de lamivudina es una vía menor de eliminación. En humanos, el único metabolito conocido de lamivudina es el metabolito trans-sulfóxido (aproximadamente el 5% de una dosis oral después de 12 horas). No se han determinado las concentraciones séricas de este metabolito. Lamivudina no se metaboliza significativamente por las enzimas del citocromo P450.
Eliminación
La mayor parte de lamivudina se elimina sin cambios en la orina mediante secreción catiónica orgánica activa. En 9 sujetos sanos que recibieron una dosis oral única de 300 mg de lamivudina, el aclaramiento renal fue de 199,7 ± 56,9 ml por minuto (media ± DE). En 20 sujetos infectados por el VIH-1 que recibieron una dosis IV única, el aclaramiento renal fue de 280,4 ± 75,2 ml por minuto (media ± DE), lo que representa el 71 % ± 16 % (media ± DE) del aclaramiento total de lamivudina.
En la mayoría de los ensayos de dosis única en sujetos infectados por el VIH-1, sujetos infectados por el VHB o sujetos sanos con muestras de suero durante las 24 horas posteriores a la administración de la dosis, la vida media de eliminación media observada (t½) osciló entre 5 y 7 horas. En sujetos infectados con VIH-1, el aclaramiento total fue de 398,5 ± 69,1 ml por min (media ± SD). El aclaramiento oral y la vida media de eliminación fueron independientes de la dosis y el peso corporal en un rango de dosificación oral de 0,25 a 10 mg por kg.
Poblaciones Específicas
Pacientes con insuficiencia renal
Las propiedades farmacocinéticas de lamivudina se han determinado en un pequeño grupo de adultos infectados por el VIH-1 con insuficiencia renal (Tabla 7).
Tmax no se vio significativamente afectado por la función renal. En base a estas observaciones, se recomienda modificar la dosis de lamivudina en pacientes con insuficiencia renal [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Según un ensayo en sujetos por lo demás sanos con insuficiencia renal, la hemodiálisis aumentó la depuración de lamivudina de una media de 64 a 88 ml por minuto; sin embargo, la duración de la hemodiálisis (4 horas) fue insuficiente para alterar significativamente la exposición media a lamivudina después de la administración de una dosis única. La diálisis peritoneal ambulatoria continua y la diálisis peritoneal automatizada tienen efectos insignificantes sobre el aclaramiento de lamivudina. Por lo tanto, se recomienda, luego de la corrección de la dosis para el aclaramiento de creatinina, que no se realice ninguna modificación adicional de la dosis después de la hemodiálisis o la diálisis peritoneal de rutina.
Se desconocen los efectos de la insuficiencia renal sobre la farmacocinética de lamivudina en pacientes pediátricos.
Pacientes con insuficiencia hepática
Las propiedades farmacocinéticas de lamivudina se han determinado en adultos con insuficiencia hepática. Los parámetros farmacocinéticos no se alteraron por la disminución de la función hepática. No se ha establecido la seguridad y eficacia de lamivudina en presencia de enfermedad hepática descompensada.
Mujeres embarazadas
La farmacocinética de lamivudina se estudió en 36 mujeres embarazadas durante 2 ensayos clínicos realizados en Sudáfrica. La farmacocinética de lamivudina en mujeres embarazadas fue similar a la observada en adultas no embarazadas y en mujeres posparto. Las concentraciones de lamivudina fueron generalmente similares en muestras de suero materno, neonatal y de cordón umbilical.
Pacientes pediátricos
La farmacocinética de lamivudina se ha estudiado después de dosis únicas o repetidas de EPIVIR en 210 sujetos pediátricos. Los sujetos pediátricos que recibieron solución oral de lamivudina (dosis de aproximadamente 8 mg por kg por día) lograron concentraciones plasmáticas de lamivudina aproximadamente un 25 % más bajas en comparación con los adultos infectados por el VIH-1. Los sujetos pediátricos que recibieron comprimidos orales de lamivudina alcanzaron concentraciones plasmáticas comparables o ligeramente superiores a las observadas en adultos. La biodisponibilidad absoluta de EPIVIR comprimidos y solución oral es menor en niños que en adultos. La biodisponibilidad relativa de la solución oral de EPIVIR es aproximadamente un 40 % más baja que la de los comprimidos que contienen lamivudina en sujetos pediátricos, a pesar de que no hay diferencia en adultos. Es probable que las exposiciones más bajas a lamivudina en pacientes pediátricos que reciben EPIVIR 150 mg en solución oral se deban a la interacción entre lamivudina y soluciones concomitantes que contienen sorbitol (como ZIAGEN). El modelo de datos farmacocinéticos sugiere que se necesita aumentar la dosis de la solución oral de EPIVIR a 5 mg por kg por vía oral dos veces al día o 10 mg por kg por vía oral una vez al día (hasta un máximo de 300 mg por día) para lograr concentraciones suficientes de lamivudina [ver DOSIFICACIÓN Y ADMINISTRACIÓN ]. No hay datos clínicos en pacientes pediátricos infectados por el VIH-1 a los que se les administra junto con medicamentos que contienen sorbitol a esta dosis.
La farmacocinética de lamivudina dosificada una vez al día en sujetos pediátricos infectados con VIH-1 de 3 meses a 12 años de edad se evaluó en 3 ensayos (PENTA-15 [n = 17], PENTA 13 [n = 19] y ARROW PK [n = 35]). Los 3 ensayos fueron ensayos farmacocinéticos abiertos, cruzados y de 2 períodos de dosificación de abacavir y lamivudina dos veces frente a una vez al día. Estos 3 ensayos demostraron que la dosificación una vez al día proporciona un AUC0-24 similar a la dosificación dos veces al día de lamivudina a la misma dosis diaria total cuando se comparan los regímenes de dosificación dentro de la misma formulación (es decir, la solución oral o la formulación en comprimidos). La Cmax media fue aproximadamente un 80 % a un 90 % mayor con la dosis de lamivudina una vez al día en comparación con la dosis de dos veces al día.
Se evaluó la distribución de lamivudina en el líquido cefalorraquídeo (LCR) en 38 sujetos pediátricos después de múltiples dosis orales de lamivudina. Las muestras de LCR se recogieron entre 2 y 4 horas después de la dosis. A la dosis de 8 mg por kg por día, las concentraciones de lamivudina en LCR en 8 sujetos oscilaron entre 5,6 % y 30,9 % (media ± SD de 14,2 % ± 7,9 %) de la concentración en una muestra de suero simultánea, con concentraciones de lamivudina en LCR que oscilaron entre 0,04 a 0,3 mcg por ml.
Se dispone de datos farmacocinéticos y de seguridad limitados y no controlados de la administración de lamivudina (y zidovudina) a 36 lactantes de hasta 1 semana de edad en 2 ensayos en Sudáfrica. En estos ensayos, el aclaramiento de lamivudina se redujo sustancialmente en los recién nacidos de 1 semana de edad en relación con los sujetos pediátricos (mayores de 3 meses) estudiados previamente. No hay información suficiente para establecer el curso temporal de los cambios en el aclaramiento entre el período neonatal inmediato y los rangos de edad mayores de 3 meses [ver REACCIONES ADVERSAS ].
Pacientes geriátricos
No se ha estudiado la farmacocinética de lamivudina tras la administración de EPIVIR 150 mg a sujetos mayores de 65 años [ver Uso en poblaciones específicas ].
Pacientes masculinos y femeninos
No hay diferencias de género significativas o clínicamente relevantes en la farmacocinética de lamivudina.
Grupos raciales
No existen diferencias raciales significativas o clínicamente relevantes en la farmacocinética de lamivudina.
Estudios de interacción farmacológica
Efecto de lamivudina sobre la farmacocinética de otros agentes
Según los resultados del estudio in vitro, no se espera que la lamivudina en exposiciones terapéuticas al fármaco afecte la farmacocinética de los fármacos que son sustratos de los siguientes transportadores: polipéptido transportador de aniones orgánicos 1B1/3 (OATP1B1/3), proteína resistente al cáncer de mama (BCRP), Glicoproteína P (P-gp), proteína de extrusión de toxinas y múltiples fármacos 1 (MATE)1, MATE2-K, transportador de cationes orgánicos 1 (OCT)1, OCT2 u OCT3.
Efecto de otros agentes sobre la farmacocinética de lamivudina
Lamivudina es un sustrato de MATE1, MATE2-K y OCT2 in vitro. Se ha demostrado que trimetoprima (un inhibidor de estos transportadores de fármacos) aumenta las concentraciones plasmáticas de lamivudina. Esta interacción no se considera clínicamente significativa ya que no es necesario ajustar la dosis de lamivudina.
Lamivudina es un sustrato de P-gp y BCRP; sin embargo, considerando su biodisponibilidad absoluta (87%), es poco probable que estos transportadores desempeñen un papel significativo en la absorción de lamivudina. Por lo tanto, es poco probable que la coadministración de fármacos que son inhibidores de estos transportadores de eflujo afecte la disposición y eliminación de lamivudina.
interferón alfa
No hubo interacción farmacocinética significativa entre lamivudina e interferón alfa en un ensayo de 19 sujetos masculinos sanos [ver ADVERTENCIAS Y PRECAUCIONES ].
ribavirina
Los datos in vitro indican que la ribavirina reduce la fosforilación de lamivudina, estavudina y zidovudina. Sin embargo, no se observó interacción farmacocinética (p. ej., concentraciones plasmáticas o concentraciones de metabolitos activos trifosforilados intracelulares) ni farmacodinámica (p. ej., pérdida de la supresión virológica del VIH-1/VHC) cuando ribavirina y lamivudina (n = 18), estavudina (n = 10) , o zidovudina (n = 6) se coadministraron como parte de un régimen de múltiples fármacos a sujetos coinfectados con VIH-1/VHC [ver ADVERTENCIAS Y PRECAUCIONES ].
Sorbitol (Excipiente)
Se coadministraron soluciones de lamivudina y sorbitol a 16 sujetos adultos sanos en un ensayo cruzado, abierto, de secuencia aleatoria y de 4 períodos. Cada sujeto recibió una dosis única de 300 mg de solución oral de lamivudina sola o coadministrada con una dosis única de 3,2 gramos, 10,2 gramos o 13,4 gramos de sorbitol en solución. La coadministración de lamivudina con sorbitol resultó en disminuciones dependientes de la dosis del 20 %, 39 % y 44 % en el AUC(0-24), 14 %, 32 % y 36 % en el AUC(∞) y 28 %, 52% y 55% en la Cmax; de lamivudina, respectivamente.
Trimetoprim/sulfametoxazol
Lamivudina y TMP/SMX se coadministraron a 14 sujetos VIH-1 positivos en un ensayo cruzado, aleatorizado, abierto y de un solo centro. Cada sujeto recibió tratamiento con una dosis única de 300 mg de lamivudina y TMP 160 mg/SMX 800 mg una vez al día durante 5 días con la administración concomitante de lamivudina 300 mg con la quinta dosis en un diseño cruzado. La coadministración de TMP/SMX con lamivudina resultó en un aumento del 43 % ± 23 % (media ± DE) en el AUC∞ de lamivudina, una disminución del 29 % ± 13 % en el aclaramiento oral de lamivudina y una disminución del 30 % ± 36 % en aclaramiento renal de lamivudina. Las propiedades farmacocinéticas de TMP y SMX no se vieron alteradas por la administración conjunta con lamivudina. No hay información sobre el efecto sobre la farmacocinética de lamivudina de dosis más altas de TMP/SMX como las que se usan para tratar la PCP.
Zidovudina
No se observaron alteraciones clínicamente significativas en la farmacocinética de lamivudina o zidovudina en 12 sujetos adultos infectados por VIH-1 asintomáticos que recibieron una dosis única de zidovudina (200 mg) en combinación con dosis múltiples de lamivudina (300 mg cada 12 horas).
Microbiología
Mecanismo de acción
Lamivudina es un análogo nucleósido sintético. Intracelularmente, lamivudina se fosforila a su metabolito activo 5'-trifosfato, lamivudina trifosfato (3TC-TP). El principal modo de acción de 3TC-TP es la inhibición de la transcriptasa inversa (RT) del VIH-1 a través de la terminación de la cadena de ADN después de la incorporación del análogo de nucleótido.
Actividad antiviral
La actividad antiviral de lamivudina contra el VIH-1 se evaluó en una serie de líneas celulares, incluidos monocitos y linfocitos de sangre periférica humana (PBMC) frescos, utilizando ensayos de susceptibilidad estándar. Los valores de EC50 estaban en el rango de 0,003 a 15 microM (1 microM = 0,23 mcg por ml). Los valores medios de EC50 de lamivudina fueron 60 nM (rango: 20 a 70 nM), 35 nM (rango: 30 a 40 nM), 30 nM (rango: 20 a 90 nM), 20 nM (rango: 3 a 40 nM) , 30 nM (rango: 1 a 60 nM), 30 nM (rango: 20 a 70 nM), 30 nM (rango: 3 a 70 nM) y 30 nM (rango: 20 a 90 nM) contra los clados del VIH-1 AG y virus del grupo O (n = 3 excepto n = 2 para el clado B) respectivamente. Los valores de EC50 frente a aislados de VIH-2 (n = 4) oscilaron entre 0,003 y 0,120 microM en PBMC. Lamivudina no fue antagonista de todos los agentes anti-VIH probados. La ribavirina (50 microM) utilizada en el tratamiento de la infección crónica por VHC disminuyó la actividad anti-VIH-1 de lamivudina en 3,5 veces en las células MT-4.
Resistencia
Se han seleccionado variantes de VIH-1 resistentes a lamivudina en cultivos celulares. El análisis genotípico mostró que la resistencia se debía a una sustitución de un aminoácido específico en la transcriptasa inversa del VIH-1 en el codón 184 que cambiaba la metionina a valina o isoleucina (M184V/I).
Se han aislado de sujetos cepas de VIH-1 resistentes tanto a lamivudina como a zidovudina. La susceptibilidad de los aislados clínicos a lamivudina y zidovudina se controló en ensayos clínicos controlados. En sujetos que recibieron monoterapia con lamivudina o terapia combinada con lamivudina más zidovudina, los aislados de VIH-1 de la mayoría de los sujetos se volvieron fenotípica y genotípicamente resistentes a lamivudina dentro de las 12 semanas.
Análisis genotípico y fenotípico de aislamientos de VIH-1 en terapia de sujetos con falla virológica
Prueba EPV20001
Cincuenta y tres de 554 (10 %) sujetos inscritos en EPV20001 se identificaron como fallas virológicas (nivel de ARN del VIH-1 en plasma mayor o igual a 400 copias por ml) en la semana 48. Veintiocho sujetos se asignaron al azar a la lamivudina una vez grupo de tratamiento diario y 25 al grupo de tratamiento de lamivudina dos veces al día. La mediana de los niveles basales de ARN del VIH-1 en plasma de los sujetos del grupo de lamivudina una vez al día y del grupo de lamivudina dos veces al día fue de 4,9 log10 copias por ml y 4,6 log10 copias por ml, respectivamente.
El análisis genotípico de aislamientos en tratamiento de 22 sujetos identificados como fallas virológicas en el grupo de lamivudina una vez al día mostró que los aislamientos de 8 de 22 sujetos contenían una sustitución asociada a resistencia a lamivudina emergente del tratamiento (M184V o M184I), aislamientos de 0 de 22 los sujetos contenían sustituciones de aminoácidos emergentes del tratamiento asociadas con la resistencia a la zidovudina (M41L, D67N, K70R, L210W, T215Y/F o K219Q/E), y los aislamientos de 10 de 22 sujetos contenían sustituciones de aminoácidos emergentes del tratamiento asociadas con la resistencia a efavirenz ( L100I, K101E, K103N, V108I o Y181C).
El análisis genotípico de aislamientos en tratamiento de sujetos (n = 22) en el grupo de tratamiento con lamivudina dos veces al día mostró que los aislamientos de 5 de 22 sujetos contenían sustituciones de resistencia a lamivudina emergentes del tratamiento, los aislamientos de 1 de 22 sujetos contenían resistencia a zidovudina emergente del tratamiento sustituciones, y los aislamientos de 7 de 22 sujetos contenían sustituciones de resistencia a efavirenz emergentes del tratamiento.
El análisis fenotípico de aislamientos de VIH-1 emparejados en línea de base en terapia de sujetos (n = 13) que recibieron lamivudina una vez al día mostró que los aislamientos de 7 de 13 sujetos mostraron una disminución de 85 a 299 veces en la susceptibilidad a lamivudina, los aislamientos de 12 de 13 sujetos fueron susceptibles a la zidovudina, y los aislamientos de 8 de 13 sujetos exhibieron una disminución de 25 a 295 veces en la susceptibilidad a efavirenz.
El análisis fenotípico de aislamientos de VIH-1 en tratamiento emparejados al inicio de sujetos (n = 13) que recibieron lamivudina dos veces al día mostró que los aislamientos de 4 de 13 sujetos exhibieron una disminución de 29 a 159 veces en la susceptibilidad a lamivudina, los aislamientos de los 13 los sujetos eran susceptibles a la zidovudina, y los aislamientos de 3 de 13 sujetos exhibieron una disminución de 21 a 342 veces en la susceptibilidad a efavirenz.
Prueba EPV40001
Cincuenta sujetos recibieron lamivudina 300 mg una vez al día más zidovudina 300 mg dos veces al día más abacavir 300 mg dos veces al día y 50 sujetos recibieron lamivudina 150 mg más zidovudina 300 mg más abacavir 300 mg todos dos veces al día. La mediana de los niveles basales de ARN del VIH-1 en plasma para los sujetos de los 2 grupos fue de 4,79 log10 copias por ml y 4,83 log10 copias por ml, respectivamente. Catorce de 50 sujetos en el grupo de tratamiento con lamivudina una vez al día y 9 de 50 sujetos en el grupo de lamivudina dos veces al día se identificaron como fallas virológicas.
El análisis genotípico de aislamientos de VIH-1 en tratamiento de sujetos (n = 9) en el grupo de tratamiento con lamivudina una vez al día mostró que los aislamientos de 6 sujetos tenían una sustitución M184V asociada a resistencia a abacavir y/o lamivudina sola. Los aislados en tratamiento de sujetos (n = 6) que recibieron lamivudina dos veces al día mostraron que los aislados de 2 sujetos tenían M184V solo, y los aislados de 2 sujetos albergaban la sustitución de M184V en combinación con sustituciones de aminoácidos asociadas a la resistencia a la zidovudina.
El análisis fenotípico de aislamientos en tratamiento de sujetos (n = 6) que recibieron lamivudina una vez al día mostró que los aislamientos de VIH-1 de 4 sujetos exhibieron una disminución de 32 a 53 veces en la susceptibilidad a lamivudina. Los aislados de VIH-1 de estos 6 sujetos fueron susceptibles a la zidovudina.
El análisis fenotípico de aislamientos en tratamiento de sujetos (n = 4) que recibieron lamivudina dos veces al día mostró que los aislados de VIH-1 de 1 sujeto exhibieron una disminución de 45 veces en la susceptibilidad a lamivudina y una disminución de 4,5 veces en la susceptibilidad a zidovudina.
Pediatría
Los sujetos pediátricos que recibieron la solución oral de lamivudina junto con otras soluciones orales antirretrovirales (abacavir, nevirapina/efavirenz o zidovudina) en ARROW desarrollaron resistencia viral con mayor frecuencia que aquellos que recibieron tabletas. En la aleatorización a una dosis de una o dos veces al día de EPIVIR más abacavir, el 13 % de los sujetos que comenzaron con tabletas y el 32 % de los sujetos que comenzaron con la solución tenían sustituciones de resistencia. El perfil de resistencia observado en pediatría es similar al observado en adultos en términos de sustituciones genotípicas detectadas y frecuencia relativa, con las sustituciones detectadas con mayor frecuencia en M184 (V o I) [ver Estudios clínicos ].
Resistencia cruzada
Se ha observado resistencia cruzada entre los inhibidores de transcriptasa inversa análogos de nucleósidos (INTI). Los mutantes de VIH-1 resistentes a lamivudina fueron resistentes en cultivo celular a didanosina (ddI). También se espera resistencia cruzada con abacavir y emtricitabina ya que estas sustituciones selectas de M184V.
Estudios clínicos
El uso de EPIVIR se basa en los resultados de ensayos clínicos en sujetos infectados por el VIH-1 en regímenes combinados con otros agentes antirretrovirales. La información de ensayos con criterios de valoración clínicos o una combinación de recuentos de células CD4+ y mediciones de ARN del VIH-1 se incluye a continuación como documentación de la contribución de lamivudina a un régimen de combinación en ensayos controlados.
Sujetos Adultos
Ensayo clínico de punto final
NUCB3007 (CAESAR) fue un ensayo multicéntrico, doble ciego, controlado con placebo que comparó la terapia actual continua (zidovudina sola [62 % de los sujetos] o zidovudina con didanosina o zalcitabina [38 % de los sujetos]) con la adición de EPIVIR 150 mg o EPIVIR 150 mg más un inhibidor de la transcriptasa inversa no nucleósido en investigación (NNRTI), aleatorizado 1:2:1. Se inscribió un total de 1816 adultos infectados por el VIH-1 con 25 a 250 células CD4+ por mm³ (mediana = 122 células por mm³) al inicio del estudio: la edad media fue de 36 años, el 87 % eran hombres, el 84 % tenían experiencia con nucleósidos y El 16% no habían recibido tratamiento previo. La duración media del juicio fue de 12 meses. Los resultados se resumen en la Tabla 9.
Ensayos de punto final sustituto
Ensayos de análogos de nucleósidos duales
Los principales ensayos clínicos en el desarrollo inicial de lamivudina compararon combinaciones de lamivudina/zidovudina con monoterapia de zidovudina o con zidovudina más zalcitabina. Estos ensayos demostraron el efecto antiviral de lamivudina en una combinación de 2 fármacos. Los usos más recientes de lamivudina en el tratamiento de la infección por VIH-1 la incorporan en regímenes de múltiples medicamentos que contienen al menos 3 medicamentos antirretrovirales para mejorar la supresión viral.
Ensayos de punto final alternativo de comparación de regímenes de dosis en adultos sin tratamiento previo
EPV20001 fue un ensayo controlado, doble ciego y multicéntrico en el que los sujetos se aleatorizaron 1:1 para recibir EPIVIR 300 mg una vez al día o EPIVIR 150 mg dos veces al día, en combinación con zidovudina 300 mg dos veces al día y efavirenz 600 mg una vez al día. Se inscribieron un total de 554 adultos infectados por el VIH-1 sin tratamiento antirretroviral: hombres (79 %), blancos (50 %), mediana de edad de 35 años, recuentos iniciales de células CD4+ de 69 a 1089 células por mm³ (mediana = 362 células por mm³) y una mediana de ARN del VIH-1 en plasma inicial de 4,66 log10 copias por ml. Los resultados del tratamiento hasta las 48 semanas se resumen en la Figura 1 y la Tabla 10.
Figura 1: Respuesta virológica hasta la semana 48, EPV20001a,b (intención de tratar) 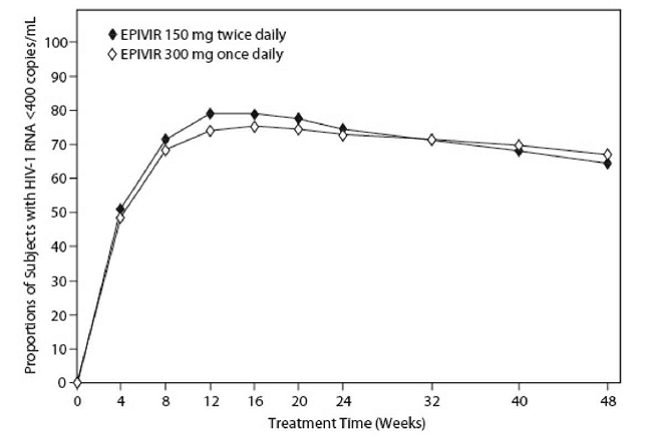
MONITOR Roche AMPLICOR HIV-1. b Los respondedores en cada visita son sujetos que habían logrado y mantenido menos de 400 copias por ml de ARN del VIH-1 sin interrupción en esa visita.
Las proporciones de sujetos con menos de 50 copias por ml de ARN del VIH-1 (a través del ensayo ultrasensible de Roche) hasta la semana 48 fueron del 61 % para los sujetos que recibieron EPIVIR 300 mg una vez al día y del 63 % para los sujetos que recibieron EPIVIR 150 mg dos veces al día. Los aumentos medios en los recuentos de células CD4+ fueron de 144 células por mm³ en la semana 48 en sujetos que recibieron EPIVIR 300 mg una vez al día y de 146 células por mm³ para sujetos que recibieron EPIVIR 150 mg dos veces al día.
En Tailandia se llevó a cabo un ensayo piloto pequeño, aleatorizado y abierto, EPV40001. Se inscribieron un total de 159 sujetos adultos sin tratamiento previo (hombres 32 %, asiáticos 100 %, mediana de edad 30 años, mediana inicial de recuento de células CD4+ de 380 células por mm³, mediana de ARN del VIH-1 en plasma de 4,8 log10 copias por ml). Dos de los brazos de tratamiento en este ensayo proporcionaron una comparación entre lamivudina 300 mg una vez al día (n = 54) y lamivudina 150 mg dos veces al día (n = 52), cada uno en combinación con zidovudina 300 mg dos veces al día y abacavir 300 mg dos veces al día. En análisis por intención de tratar de datos de 48 semanas, las proporciones de sujetos con ARN del VIH-1 por debajo de 400 copias por ml fueron del 61 % (33 de 54) en el grupo aleatorizado a lamivudina una vez al día y del 75 % (39 de 52) en el grupo aleatorizado para recibir los 3 medicamentos dos veces al día; las proporciones con ARN del VIH-1 por debajo de 50 copias por ml fueron del 54 % (29 de 54) en el grupo de lamivudina una vez al día y del 67 % (35 de 52) en el grupo de dos veces al día; y los aumentos medianos en los recuentos de células CD4+ fueron de 166 células por mm³ en el grupo de lamivudina una vez al día y de 216 células por mm³ en el grupo de dos veces al día.
Sujetos pediátricos
Ensayo clínico de punto final
ACTG300 fue un ensayo multicéntrico, aleatorizado y doble ciego que proporcionó la comparación de EPIVIR más RETROVIR (zidovudina) con la monoterapia con didanosina. Un total de 471 sujetos pediátricos sintomáticos, infectados por el VIH-1 y sin tratamiento previo (menos o igual a 56 días de tratamiento antirretroviral) se inscribieron en estos 2 grupos de tratamiento. La mediana de edad fue de 2,7 años (rango: 6 semanas a 14 años), el 58 % eran mujeres y el 86 % no eran blancas. El recuento inicial medio de células CD4+ fue de 868 células por mm³ (media: 1.060 células por mm³ y rango: 0 a 4.650 células por mm³ para sujetos menores o iguales a 5 años; media: 419 células por mm³ y rango: 0 a 1.555 células por mm³ para sujetos de más de 5 años) y el ARN del VIH-1 en plasma inicial medio fue de 5,0 log10 copias por ml. La mediana de duración del ensayo fue de 10,1 meses para los sujetos que recibieron 150 mg de EPIVIR más RETROVIR y de 9,2 meses para los sujetos que recibieron monoterapia con didanosina. Los resultados se resumen en la Tabla 11.
Dosificación una vez al día
ARROW (COL105677) fue un ensayo multicéntrico aleatorizado de 5 años que evaluó múltiples aspectos del manejo clínico de la infección por VIH-1 en sujetos pediátricos. Sujetos infectados por el VIH-1, sin tratamiento previo, de 3 meses a 17 años de edad, fueron inscritos y tratados con un régimen de primera línea que contenía EPIVIR 150 mg y abacavir, dosificado dos veces al día de acuerdo con las recomendaciones de la Organización Mundial de la Salud. Después de un mínimo de 36 semanas de tratamiento, a los sujetos se les dio la opción de participar en la aleatorización 3 del ensayo ARROW, que comparó la seguridad y la eficacia de la dosificación una vez al día con la dosificación dos veces al día de EPIVIR y abacavir, en combinación con un tercer antirretroviral. medicamento, por 96 semanas adicionales. De los 1206 sujetos originales de ARROW, 669 participaron en la aleatorización 3. La supresión virológica no era un requisito para la participación: al inicio de la aleatorización 3 (después de un mínimo de 36 semanas de tratamiento dos veces al día), el 75 % de los sujetos en la aleatorización dos veces al día cohorte fueron suprimidos virológicamente, en comparación con el 71% de los sujetos en la cohorte de una vez al día.
La proporción de sujetos con ARN del VIH-1 de menos de 80 copias por ml durante 96 semanas se muestra en la Tabla 12. Las diferencias entre las respuestas virológicas en los dos brazos de tratamiento fueron comparables entre las características iniciales de género y edad.
Los análisis por formulación demostraron que la proporción de sujetos con ARN del VIH-1 de menos de 80 copias por ml en la aleatorización y la semana 96 fue mayor en los sujetos que habían recibido formulaciones en comprimidos de EPIVIR 150 mg y abacavir (75 % [458/610] y 72 % [434/601]) que en aquellos que habían recibido formulaciones en solución (con EPIVIR 150 mg en solución administrados en dosis basadas en bandas de peso de aproximadamente 8 mg por kg por día) en cualquier momento (52 % [29/56] y 54 % [30/56]), respectivamente [ver ADVERTENCIAS Y PRECAUCIONES ]. Estas diferencias se observaron en cada uno de los diferentes grupos de edad evaluados.
INFORMACIÓN DEL PACIENTE
EPIVIR (EP-i-veer) (lamivudina) tabletas
EPIVIR (EP-i-veer) (lamivudina) solución oral
¿Cuál es la información más importante que debo saber sobre EPIVIR 150mg?
EPIVIR puede causar efectos secundarios graves, que incluyen:
- Empeoramiento del virus de la hepatitis B en personas que tienen infección por VIH-1. Si tiene infección por el VIH-1 (virus de la inmunodeficiencia humana tipo 1) y el virus de la hepatitis B (VHB), su VHB puede empeorar (brotar) si deja de tomar EPIVIR. Un “brote” es cuando su infección por VHB regresa repentinamente de una manera peor que antes. El empeoramiento de la enfermedad hepática puede ser grave y puede provocar la muerte.
- No te quedes sin EPIVIR. Vuelva a surtir su receta o hable con su proveedor de atención médica antes de que se le acabe el EPIVIR.
- No deje de tomar EPIVIR sin hablar primero con su proveedor de atención médica.
- Si deja de tomar EPIVIR, su proveedor de atención médica deberá controlar su salud con frecuencia y realizar análisis de sangre regularmente durante varios meses para controlar su hígado.
- Virus de la Hepatitis B Resistente (VHB). Si tiene VIH-1 y hepatitis B, el virus de la hepatitis B puede cambiar (mutar) durante su tratamiento con EPIVIR 150 mg y volverse más difícil de tratar (resistente).
- Usar con regímenes a base de interferón y ribavirina. Ha ocurrido un empeoramiento de la enfermedad hepática que ha causado la muerte en personas infectadas tanto con el VIH-1 como con el virus de la hepatitis C que están tomando medicamentos antirretrovirales y que también reciben tratamiento para la hepatitis C con interferón con o sin ribavirina. Si está tomando EPIVIR 150 mg e interferón con o sin ribavirina, informe a su proveedor de atención médica si tiene algún síntoma nuevo.
¿Qué es EPIVIR?
EPIVIR es un medicamento recetado que se usa junto con otros medicamentos antirretrovirales para tratar la infección por el virus de la inmunodeficiencia humana (VIH-1).
El VIH-1 es el virus que causa el Síndrome de Inmunodeficiencia Adquirida (SIDA).
Los comprimidos y la solución oral de EPIVIR (utilizados para tratar la infección por VIH-1) contienen una dosis más alta del mismo principio activo (lamivudina) que la del medicamento EPIVIR-HBV comprimidos y solución oral (utilizados para tratar el VHB). Si tiene tanto el VIH-1 como el VHB, no debe usar EPIVIR-VHB para tratar sus infecciones.
No se ha establecido la seguridad y eficacia de EPIVIR en niños menores de 3 meses.
¿Quién no debe tomar EPIVIR 150mg?
No tome EPIVIR si es alérgico a lamivudina o a cualquiera de los componentes de EPIVIR. Consulte el final de este folleto de información para el paciente para obtener una lista completa de los ingredientes de EPIVIR.
¿Qué debo decirle a mi proveedor de atención médica antes de tomar EPIVIR?
Antes de tomar EPIVIR 150 mg, informe a su proveedor de atención médica si:
- Tiene o ha tenido problemas hepáticos, incluida la infección por el virus de la hepatitis B o C.
- tiene problemas renales.
- tener diabetes Cada dosis de 15 ml (150 mg) de solución oral de EPIVIR contiene 3 gramos de sacarosa.
- está embarazada o planea quedar embarazada. Tomar EPIVIR durante el embarazo no se ha asociado con un mayor riesgo de defectos de nacimiento. Hable con su proveedor de atención médica si está embarazada o planea quedar embarazada. Registro de Embarazo. Hay un registro de embarazo para mujeres que toman medicamentos antirretrovirales durante el embarazo. El propósito de este registro es recopilar información sobre su salud y la de su bebé. Hable con su proveedor de atención médica sobre cómo puede participar en este registro.
- están amamantando o planean amamantar. No amamante si toma EPIVIR.
- No debe amamantar si tiene el VIH-1 debido al riesgo de transmitir el VIH-1 a su bebé.
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos a base de hierbas.
Algunos medicamentos interactúan con EPIVIR. Mantenga una lista de sus medicamentos y muéstresela a su proveedor de atención médica y farmacéutico cuando obtenga un nuevo medicamento. Puede pedirle a su proveedor de atención médica o farmacéutico una lista de medicamentos que interactúan con EPIVIR.
No empiece a tomar un medicamento nuevo sin consultar antes con su proveedor de atención médica. Su proveedor de atención médica puede decirle si es seguro tomar EPIVIR con otros medicamentos.
¿Cómo debo tomar EPIVIR?
- Tome EPIVIR exactamente como se lo indique su proveedor de atención médica.
- Si olvida una dosis de EPIVIR 150 mg, tómela tan pronto como lo recuerde. No tome 2 dosis al mismo tiempo ni tome más de lo que su proveedor de atención médica le indique.
- Permanezca bajo el cuidado de un proveedor de atención médica durante el tratamiento con EPIVIR.
- EPIVIR se puede tomar con o sin alimentos.
- Para niños de 3 meses en adelante, su proveedor de atención médica le recetará una dosis de EPIVIR de 150 mg según el peso corporal de su hijo.
- Informe a su proveedor de atención médica si usted o su hijo tienen problemas para tragar las tabletas. EPIVIR 150 mg también viene en forma líquida (solución oral).
- No te quedes sin EPIVIR. El virus en su sangre puede aumentar y el virus puede volverse más difícil de tratar. Cuando su suministro comience a agotarse, obtenga más de su proveedor de atención médica o farmacia.
- Si toma demasiado EPIVIR 150 mg, llame a su proveedor de atención médica o vaya de inmediato a la sala de emergencias del hospital más cercano.
¿Cuáles son los posibles efectos secundarios de EPIVIR 150mg?
- EPIVIR 150 mg puede causar efectos secundarios graves que incluyen:
- Consulte "¿Cuál es la información más importante que debo saber sobre EPIVIR 150 mg?"
- Acumulación de un ácido en la sangre (acidosis láctica). La acidosis láctica puede ocurrir en algunas personas que toman EPIVIR. La acidosis láctica es una emergencia médica grave que puede causar la muerte. Llame a su proveedor de atención médica de inmediato si presenta alguno de los siguientes síntomas que podrían ser signos de acidosis láctica:
- sentirse muy débil o cansado
- sentir frío, especialmente en los brazos y las piernas
- dolor muscular inusual (no normal)
- sentirse mareado o aturdido
- dificultad para respirar
- tiene latidos cardíacos rápidos o irregulares
- dolor de estómago con náuseas y vómitos
- Problemas hepáticos graves puede ocurrir en personas que toman EPIVIR. En algunos casos, estos graves problemas hepáticos pueden provocar la muerte. Su hígado puede agrandarse (hepatomegalia) y puede desarrollar grasa en su hígado (esteatosis). Llame a su proveedor de atención médica de inmediato si presenta alguno de los siguientes signos o síntomas de problemas hepáticos:
- su piel o la parte blanca de sus ojos se vuelve amarilla (ictericia)
- pérdida de apetito durante varios días o más
- náuseas
- orina oscura o "de color té"
- dolor, dolor o sensibilidad en el lado derecho del área del estómago
- heces de color claro (evacuaciones intestinales)
Es más probable que tenga acidosis láctica o problemas hepáticos graves si es mujer o tiene mucho sobrepeso (obesidad).
- Riesgo de inflamación del páncreas (pancreatitis). Los niños pueden estar en riesgo de desarrollar pancreatitis durante el tratamiento con EPIVIR si:
- han tomado medicamentos análogos de nucleósidos
- tiene antecedentes de pancreatitis en el pasado
- tiene otros factores de riesgo de pancreatitis
Llame a su proveedor de atención médica de inmediato si su hijo presenta signos y síntomas de pancreatitis, incluido dolor intenso en la parte superior del estómago, con o sin náuseas y vómitos. Su proveedor de atención médica puede indicarle que deje de administrar EPIVIR 150 mg a su hijo si los síntomas y los resultados de los análisis de sangre muestran que su hijo puede tener pancreatitis.
- Cambios en su sistema inmunológico (Síndrome de Reconstitución Inmune) puede ocurrir cuando comienza a tomar medicamentos contra el VIH-1. Su sistema inmunológico puede fortalecerse y comenzar a combatir infecciones que han estado ocultas en su cuerpo durante mucho tiempo. Informe a su proveedor de atención médica de inmediato si comienza a tener nuevos síntomas después de comenzar a tomar EPIVIR.
Los efectos secundarios más comunes de EPIVIR 150 mg en adultos incluyen:
- dolor de cabeza
- signos y síntomas nasales
- náuseas
- Diarrea
- generalmente no se siente bien
- cansancio
- tos
Los efectos secundarios más comunes de EPIVIR 150 mg en niños incluyen fiebre y tos.
Informe a su proveedor de atención médica si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de EPIVIR. Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar EPIVIR?
- Guarde las tabletas de EPIVIR de 150 mg y la solución oral a temperatura ambiente, entre 20 °C y 25 °C (68 °F y 77 °F).
- Mantenga los frascos de EPIVIR 150 mg solución oral bien cerrados.
Mantenga EPIVIR y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de EPIVIR.
A veces, los medicamentos se recetan para fines distintos a los enumerados en el folleto de información para el paciente. No use EPIVIR para una condición para la cual no fue recetado. No le dé EPIVIR a otras personas, incluso si tienen los mismos síntomas que usted. Puede que les haga daño.
Puede pedirle a su proveedor de atención médica o farmacéutico información sobre EPIVIR 150 mg que está escrita para profesionales de la salud.
Para obtener más información, visite www.viivhealthcare.com o llame al 1-877-844-8872.
¿Cuáles son los ingredientes de EPIVIR 150 mg?
Principio activo: lamivudina
Ingredientes inactivos:
EPIVIR 150 mg comprimidos recubiertos con película ranurados de 150 mg: hipromelosa, estearato de magnesio, celulosa microcristalina, polietilenglicol, polisorbato 80, glicolato de almidón sódico y dióxido de titanio.
EPIVIR 300 mg comprimidos recubiertos con película: óxido de hierro negro, hipromelosa, estearato de magnesio, celulosa microcristalina, polietilenglicol, polisorbato 80, glicolato de almidón sódico y dióxido de titanio.
EPIVIR 150 mg solución oral: sabores artificiales de fresa y plátano, ácido cítrico (anhidro), metilparabeno, propilenglicol, propilparabeno, citrato de sodio (dihidrato) y sacarosa (200 mg por ml).
Esta información para el paciente ha sido aprobada por la Administración de Drogas y Alimentos de los Estados Unidos.
