Tratamiento psiquiátrico: Strattera 10mg, 18mg, 25mg, 40mg Atomoxetine Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Strattera 40 mg y cómo se usa?
Strattera es un medicamento recetado que se usa para tratar los síntomas del trastorno por déficit de atención con hiperactividad (TDAH). Strattera 18 mg se puede usar solo o con otros medicamentos.
Strattera 10 mg es un inhibidor selectivo de la recaptación de norepinefrina.
No se sabe si Strattera es seguro y eficaz en niños menores de 2 años.
¿Cuáles son los posibles efectos secundarios de Strattera?
Strattera 25 mg puede causar efectos secundarios graves que incluyen:
- Dolor de pecho,
- dificultad para respirar,
- aturdimiento,
- alucinaciones,
- nuevos problemas de conducta,
- agresión,
- hostilidad,
- paranoia,
- dolor de estómago,
- Comezón,
- síntomas similares a la gripe,
- orina oscura,
- ictericia (coloración amarillenta de la piel o los ojos),
- micción dolorosa o difícil, y
- erección que es dolorosa o dura más de 4 horas
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Strattera 40 mg incluyen:
- náuseas,
- vómitos,
- dolor de barriga,
- estreñimiento,
- boca seca,
- pérdida de apetito,
- cambios de humor,
- sensación de cansancio,
- mareo,
- problemas para orinar y
- impotencia, dificultad para tener una erección,
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Strattera. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
ADVERTENCIA
IDEAS SUICIDAS EN NIÑOS Y ADOLESCENTES
STRATTERA (atomoxetina) aumentó el riesgo de ideación suicida en estudios a corto plazo en niños o adolescentes con trastorno por déficit de atención con hiperactividad (TDAH). Cualquiera que esté considerando el uso de STRATTERA 18 mg en un niño o adolescente debe sopesar este riesgo con la necesidad clínica. Las comorbilidades que ocurren con el TDAH pueden estar asociadas con un aumento en el riesgo de ideación y/o comportamiento suicida. Los pacientes que comienzan con la terapia deben ser monitoreados de cerca para detectar tendencias suicidas (pensamiento y comportamiento suicida), empeoramiento clínico o cambios inusuales en el comportamiento. Se debe advertir a las familias y cuidadores de la necesidad de una estrecha observación y comunicación con el prescriptor. STRATTERA 10 mg está aprobado para el TDAH en pacientes pediátricos y adultos. STRATTERA 40 mg no está aprobado para el trastorno depresivo mayor. Los análisis agrupados de ensayos controlados con placebo a corto plazo (6 a 18 semanas) de STRATTERA 10 mg en niños y adolescentes (un total de 12 ensayos con más de 2200 pacientes, incluidos 11 ensayos en TDAH y 1 ensayo en enuresis) han revelado un mayor riesgo de ideación suicida temprano durante el tratamiento en aquellos que recibieron STRATTERA en comparación con el placebo. El riesgo promedio de ideación suicida en pacientes que recibieron STRATTERA 25 mg fue del 0,4 % (5/1357 pacientes), en comparación con ninguno en los pacientes tratados con placebo (851 pacientes). No ocurrieron suicidios en estos ensayos [ver ADVERTENCIAS Y PRECAUCIONES ].
DESCRIPCIÓN
STRATTERA® (atomoxetina) es un inhibidor selectivo de la recaptación de norepinefrina. La atomoxetina HCl es el isómero R(-) según lo determinado por difracción de rayos X. La designación química es clorhidrato de (-)-N-metil-3-fenil-3-(o-toliloxi)-propilamina. La fórmula molecular es C17H21NO•HCl, que corresponde a un peso molecular de 291,82. La estructura química es:
La atomoxetina HCl es un sólido de color blanco a prácticamente blanco, que tiene una solubilidad en agua de 27,8 mg/mL.
Las cápsulas de STRATTERA están destinadas únicamente a la administración oral.
Cada cápsula contiene atomoxetina HCl equivalente a 10, 18, 25, 40, 60, 80 o 100 mg de atomoxetina. Las cápsulas también contienen almidón pregelatinizado y dimeticona. Las cubiertas de las cápsulas contienen gelatina, laurilsulfato de sodio y otros ingredientes inactivos. Las cubiertas de las cápsulas también contienen uno o más de los siguientes:
FD&C Blue No. 2, óxido de hierro amarillo sintético, dióxido de titanio, óxido de hierro rojo. Las cápsulas están impresas con tinta negra comestible.
INDICACIONES
Trastorno por Déficit de Atención/Hiperactividad (TDAH)
STRATTERA 25 mg está indicado para el tratamiento del Trastorno por Déficit de Atención e Hiperactividad (TDAH).
La eficacia de STRATTERA Capsules se estableció en siete ensayos clínicos en pacientes ambulatorios con TDAH: cuatro ensayos de 6 a 9 semanas en pacientes pediátricos (de 6 a 18 años), dos ensayos de 10 semanas en adultos y un ensayo de mantenimiento en pediatría (de 6 años). a 15) [ver Estudios clínicos ].
Consideraciones de diagnóstico
Un diagnóstico de TDAH (DSM-IV) implica la presencia de síntomas de hiperactividad-impulsividad o falta de atención que causan deterioro y que estaban presentes antes de los 7 años de edad. Los síntomas deben ser persistentes, deben ser más graves de lo que normalmente se observa en individuos con un nivel de desarrollo comparable, deben causar un deterioro clínicamente significativo, por ejemplo, en el funcionamiento social, académico u ocupacional, y deben estar presentes en 2 o más entornos, por ejemplo, la escuela (o el trabajo) y en casa. Los síntomas no deben explicarse mejor por otro trastorno mental.
Se desconoce la etiología específica del TDAH y no existe una única prueba diagnóstica. El diagnóstico adecuado requiere el uso no sólo de recursos médicos, sino también psicológicos, educativos y sociales especiales. El aprendizaje puede verse afectado o no. El diagnóstico debe basarse en una historia y evaluación completas del paciente y no únicamente en la presencia del número requerido de características del DSM-IV.
Para el tipo desatento, al menos 6 de los siguientes síntomas deben haber persistido durante al menos 6 meses: falta de atención a los detalles/errores por descuido, falta de atención sostenida, mala capacidad para escuchar, falta de seguimiento de las tareas, mala organización, evita las tareas requiere un esfuerzo mental sostenido, pierde cosas, se distrae fácilmente, olvidadizo. Para el tipo hiperactivo-impulsivo, al menos 6 de los siguientes síntomas deben haber persistido durante al menos 6 meses: inquietud/retorcimiento, levantarse del asiento, correr/trepar de forma inapropiada, dificultad con actividades tranquilas, “sobre la marcha”, hablar en exceso, balbucear respuestas, no puedo esperar su turno, intrusivo. Para un diagnóstico de tipo combinado, se deben cumplir los criterios de falta de atención e hiperactivo-impulsivo.
Necesidad de un programa de tratamiento integral
STRATTERA 18 mg está indicado como parte integral de un programa de tratamiento total para el TDAH que puede incluir otras medidas (psicológicas, educativas, sociales) para pacientes con este síndrome. El tratamiento farmacológico puede no estar indicado para todos los pacientes con este síndrome. El tratamiento farmacológico no está destinado al uso en pacientes que presenten síntomas secundarios a factores ambientales y/u otros trastornos psiquiátricos primarios, incluida la psicosis. La ubicación educativa adecuada es esencial en niños y adolescentes con este diagnóstico y la intervención psicosocial suele ser útil. Cuando las medidas correctivas por sí solas son insuficientes, la decisión de prescribir medicamentos de tratamiento farmacológico dependerá de la evaluación del médico sobre la cronicidad y gravedad de los síntomas del paciente.
DOSIFICACIÓN Y ADMINISTRACIÓN
Tratamiento agudo
Dosificación de niños y adolescentes de hasta 70 kg de peso corporal
STRATTERA 40 mg debe iniciarse con una dosis diaria total de aproximadamente 0,5 mg/kg y aumentar después de un mínimo de 3 días hasta una dosis diaria total objetivo de aproximadamente 1,2 mg/kg administrada como una dosis diaria única por la mañana o dividida en partes iguales. dosis por la mañana y al final de la tarde/primera hora de la noche. No se ha demostrado ningún beneficio adicional para dosis superiores a 1,2 mg/kg/día [ver Estudios clínicos ].
La dosis diaria total en niños y adolescentes no debe exceder 1,4 mg/kg o 100 mg, lo que sea menor.
Dosificación de niños y adolescentes de más de 70 kg de peso corporal y adultos
STRATTERA 18 mg debe iniciarse con una dosis diaria total de 40 mg y aumentarse después de un mínimo de 3 días hasta una dosis diaria total objetivo de aproximadamente 80 mg administrados como una dosis diaria única por la mañana o en dosis divididas uniformemente por la mañana y última hora de la tarde/primera hora de la noche. Después de 2 a 4 semanas adicionales, la dosis puede aumentarse hasta un máximo de 100 mg en pacientes que no hayan logrado una respuesta óptima. No hay datos que respalden una mayor eficacia a dosis más altas [ver Estudios clínicos ].
La dosis máxima diaria total recomendada en niños y adolescentes de más de 70 kg y adultos es de 100 mg.
Mantenimiento/Tratamiento Extendido
En general, se acepta que el tratamiento farmacológico del TDAH puede ser necesario durante períodos prolongados. El beneficio de mantener a los pacientes pediátricos (de 6 a 15 años de edad) con TDAH en STRATTERA 18 mg después de lograr una respuesta en un rango de dosis de 1,2 a 1,8 mg/kg/día se demostró en un ensayo controlado. Los pacientes asignados a STRATTERA en la fase de mantenimiento generalmente continuaron con la misma dosis utilizada para lograr una respuesta en la fase abierta. El médico que opte por usar STRATTERA durante períodos prolongados debe reevaluar periódicamente la utilidad a largo plazo del fármaco para el paciente individual [ver Estudios clínicos ].
Información general de dosificación
STRATTERA puede tomarse con o sin alimentos.
STRATTERA 40 mg se puede suspender sin disminuir gradualmente.
Las cápsulas de STRATTERA no están destinadas a abrirse, deben tomarse enteras [ver INFORMACIÓN DEL PACIENTE ].
No se ha evaluado sistemáticamente la seguridad de dosis únicas superiores a 120 mg y dosis diarias totales superiores a 150 mg.
Dosificación en poblaciones específicas
Ajuste de dosis para pacientes con insuficiencia hepática
Para aquellos pacientes con TDAH que tienen insuficiencia hepática (HI), se recomienda ajustar la dosis de la siguiente manera: Para pacientes con HI moderada (Child-Pugh Clase B), las dosis inicial y objetivo deben reducirse al 50% de la dosis normal (para pacientes sin HOLA). Para pacientes con HI grave (Child-Pugh Clase C), la dosis inicial y la dosis objetivo deben reducirse al 25 % de lo normal [ver Uso en poblaciones específicas ].
Ajuste de dosis para uso con un inhibidor potente de CYP2D6 o en pacientes que se sabe que son PM de CYP2D6
En niños y adolescentes de hasta 70 kg de peso corporal a los que se les administran inhibidores potentes de CYP2D6, por ejemplo, paroxetina, fluoxetina y quinidina, o en pacientes que se sabe que son PM de CYP2D6, STRATTERA debe iniciarse con 0,5 mg/kg/día y solo aumentarse a la dosis objetivo habitual de 1,2 mg/kg/día si los síntomas no mejoran después de 4 semanas y la dosis inicial es bien tolerada.
En niños y adolescentes de más de 70 kg de peso corporal y adultos a los que se les administró inhibidores potentes de CYP2D6, p. ej., paroxetina, fluoxetina y quinidina, STRATTERA debe iniciarse con 40 mg/día y solo aumentarse a la dosis objetivo habitual de 80 mg/día si los síntomas desaparecen. para mejorar después de 4 semanas y la dosis inicial es bien tolerada.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Cada cápsula contiene atomoxetina HCl equivalente a 10 mg (Opaque White, Opaco White), 18 mg (Opaque White, Opaco White), 25 mg (Opaque Blue, Opaco White), 40 mg (Opaque Blue, Opaco Blue), 60 mg (Opaque azul, dorado), 80 mg (marrón opaco, blanco opaco) o 100 mg (marrón opaco, marrón opaco) de atomoxetina.
Almacenamiento y manipulación
Almacenar a 25°C (77°F); se permiten excursiones de 15° a 30°C (59° a 86°F) [consulte Temperatura ambiente controlada por USP].
Comercializado por: Lilly USA, LLC Indianapolis, IN 46285, EE. UU. Revisado: mayo de 2017.
EFECTOS SECUNDARIOS
Experiencia en ensayos clínicos
STRATTERA 10 mg se administró a 5382 niños o adolescentes con TDAH y 1007 adultos con TDAH en estudios clínicos. Durante los ensayos clínicos de TDAH, 1625 niños y adolescentes fueron tratados durante más de 1 año y 2529 niños y adolescentes fueron tratados durante más de 6 meses.
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Ensayos clínicos en niños y adolescentes
Razones para la interrupción del tratamiento debido a reacciones adversas en ensayos clínicos en niños y adolescentes
En ensayos agudos controlados con placebo en niños y adolescentes, el 3,0 % (48/1613) de los sujetos con atomoxetina y el 1,4 % (13/945) de los sujetos con placebo suspendieron el tratamiento por reacciones adversas. En todos los estudios (incluidos los estudios abiertos y a largo plazo), el 6,3 % de los pacientes metabolizadores rápidos (EM) y el 11,2 % de los pacientes metabolizadores lentos (PM) interrumpieron el tratamiento debido a una reacción adversa. Entre los pacientes tratados con STRATTERA, irritabilidad (0,3%, N=5); somnolencia (0,3%, N=5); agresión (0,2%, N=4); náuseas (0,2%, N=4); vómitos (0,2%, N=4); dolor abdominal (0,2%, N=4); estreñimiento (0,1%, N=2); fatiga (0,1%, N=2); sentirse anormal (0,1%, N=2); y dolor de cabeza (0,1%, N=2) fueron los motivos de discontinuación informados por más de 1 paciente.
convulsiones
STRATTERA no se ha evaluado sistemáticamente en pacientes pediátricos con trastornos convulsivos, ya que estos pacientes fueron excluidos de los estudios clínicos durante las pruebas previas a la comercialización del producto. En el programa de desarrollo clínico, se informaron convulsiones en el 0,2% (12/5073) de los niños cuya edad promedio fue de 10 años (rango de 6 a 16 años). En estos ensayos clínicos, el riesgo de convulsiones entre los metabolizadores lentos fue del 0,3 % (1/293) en comparación con el 0,2 % (11/4741) para los metabolizadores rápidos.
Reacciones adversas comúnmente observadas en ensayos agudos controlados con placebo en niños y adolescentes
Las reacciones adversas comúnmente observadas asociadas con el uso de STRATTERA (incidencia del 2% o mayor) y no observadas con una incidencia equivalente entre los pacientes tratados con placebo (STRATTERA 40 mg de incidencia mayor que el placebo) se enumeran en la Tabla 2. Los resultados fueron similares en el BID y el ensayo QD, excepto como se muestra en la Tabla 3, que muestra los resultados BID y QD para reacciones adversas seleccionadas basadas en pruebas de Breslow-Day estadísticamente significativas. Las reacciones adversas observadas con mayor frecuencia en pacientes tratados con STRATTERA (incidencia del 5% o más y al menos el doble de la incidencia en pacientes con placebo, ya sea para dosificación BID o QD) fueron: náuseas, vómitos, fatiga, disminución del apetito, dolor abdominal y somnolencia (ver Tablas 2 y 3).
Datos adicionales de ensayos clínicos de TDAH (controlados y no controlados) han demostrado que aproximadamente del 5 al 10 % de los pacientes pediátricos experimentaron cambios potencialmente clínicamente importantes en la frecuencia cardíaca (≥20 latidos por minuto) o la presión arterial (≥15 a 20 mm Hg) [ver CONTRAINDICACIONES y ADVERTENCIAS Y PRECAUCIONES ].
Las siguientes reacciones adversas ocurrieron en al menos el 2 % de los pacientes niños y adolescentes con CYP2D6 PM y fueron significativamente más frecuentes desde el punto de vista estadístico en pacientes con PM en comparación con pacientes con CYP2D6 EM: insomnio (11 % de PM, 6 % de EM); disminución de peso (7% de PM, 4% de EM); estreñimiento (7% de PM, 4% de EM); depresión1 (7% de PM, 4% de EM); temblor (5% de PM, 1% de EM); excoriación (4% de PM, 2% de EM); insomnio medio (3% de PM, 1% de EM); conjuntivitis (3% de PM, 1% de EM); síncope (3% de PM, 1% de EM); despertar temprano en la mañana (2% de PM, 1% de EM); midriasis (2% de PM, 1% de EM); sedación (4% de PM, 2% de EM).
1La depresión incluye los siguientes términos: depresión, depresión mayor, síntomas depresivos, estado de ánimo deprimido, disforia.
Ensayos clínicos en adultos
Razones para la interrupción del tratamiento debido a reacciones adversas en ensayos agudos controlados con placebo en adultos
En los ensayos agudos controlados con placebo en adultos, el 11,3 % (61/541) de los sujetos con atomoxetina y el 3,0 % (12/405) de los sujetos con placebo suspendieron el tratamiento por reacciones adversas. Entre los pacientes tratados con STRATTERA, insomnio (0,9%, N=5); náuseas (0,9%, N=5); dolor torácico (0,6%, N=3); fatiga (0,6%, N=3); ansiedad (0,4%, N=2); disfunción eréctil (0,4%, N=2); cambios de humor (0,4%, N=2); nerviosismo (0,4%, N=2); palpitaciones (0,4%, N=2); y la retención urinaria (0,4%, N=2) fueron los motivos de suspensión informados por más de 1 paciente.
convulsiones
STRATTERA no ha sido evaluado sistemáticamente en pacientes adultos con un trastorno convulsivo ya que estos pacientes fueron excluidos de los estudios clínicos durante las pruebas previas a la comercialización del producto. En el programa de desarrollo clínico, se notificaron convulsiones en el 0,1 % (1/748) de los pacientes adultos. En estos ensayos clínicos, ningún metabolizador lento (0/43) informó convulsiones en comparación con el 0,1 % (1/705) de los metabolizadores rápidos.
Reacciones adversas comúnmente observadas en ensayos agudos controlados con placebo en adultos
Las reacciones adversas comúnmente observadas asociadas con el uso de STRATTERA (incidencia del 2% o mayor) y no observadas con una incidencia equivalente entre los pacientes tratados con placebo (STRATTERA 25 mg de incidencia mayor que el placebo) se enumeran en la Tabla 4. Las reacciones adversas observadas con mayor frecuencia en pacientes tratados con STRATTERA (incidencia del 5% o más y al menos el doble de la incidencia en pacientes con placebo) fueron: estreñimiento, sequedad de boca, náuseas, disminución del apetito, mareos, disfunción eréctil y vacilación urinaria (consulte la Tabla 4). Datos adicionales de ensayos clínicos de TDAH (controlados y no controlados) han demostrado que aproximadamente del 5 al 10 % de los pacientes adultos experimentaron cambios clínicamente importantes en la frecuencia cardíaca (≥20 latidos por minuto) o la presión arterial (≥15 a 20 mm Hg) [ver CONTRAINDICACIONES y ADVERTENCIAS Y PRECAUCIONES ].
Los siguientes eventos adversos ocurrieron en al menos el 2% de los pacientes adultos metabolizadores lentos (PM) de CYP2D6 y fueron significativamente más frecuentes desde el punto de vista estadístico en pacientes con PM en comparación con pacientes metabolizadores rápidos (EM) de CYP2D6: visión borrosa (4% de PM, 1% de EM) ); boca seca (35% de PM, 17% de EM); estreñimiento (11% de PM, 7% de EM); sentirse nervioso (5% de PM, 2% de EM); disminución del apetito (23% de PM, 15% de EM); temblor (5% de PM, 1% de EM); insomnio (19% de PM, 11% de EM); trastorno del sueño (7% de PM, 3% de EM); insomnio medio (5% de PM, 3% de EM); insomnio terminal (3% de PM, 1% de EM); retención urinaria (6% de PM, 1% de EM); disfunción eréctil (21% de PM, 9% de EM); trastorno de la eyaculación (6% de PM, 2% de EM); hiperhidrosis (15% de PM, 7% de EM); frialdad periférica (3% PMs, 1% EMs).
Disfunción sexual masculina y femenina
La atomoxetina parece afectar la función sexual en algunos pacientes. Los cambios en el deseo sexual, el rendimiento sexual y la satisfacción sexual no se evalúan bien en la mayoría de los ensayos clínicos porque necesitan una atención especial y porque los pacientes y los médicos pueden mostrarse reacios a discutirlos. En consecuencia, es probable que las estimaciones de la incidencia de la experiencia y el rendimiento sexuales adversos citados en la etiqueta del producto subestimen la incidencia real. La Tabla 4 anterior muestra la incidencia de efectos secundarios sexuales informados por al menos el 2 % de los pacientes adultos que tomaron STRATTERA en ensayos controlados con placebo.
No existen estudios adecuados y bien controlados que examinen la disfunción sexual con el tratamiento con STRATTERA 40 mg. Si bien es difícil conocer el riesgo preciso de disfunción sexual asociado con el uso de STRATTERA 40 mg, los médicos deben consultar de forma rutinaria acerca de tales posibles efectos secundarios.
Informes espontáneos posteriores a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de STRATTERA. A menos que se especifique lo contrario, estas reacciones adversas se han producido en adultos y niños y adolescentes. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Sistema cardiovascular - Prolongación del intervalo QT, síncope.
Efectos vasculares periféricos - El fenómeno de Raynaud.
Desordenes generales y condiciones administrativas del sitio - Letargo.
Sistema musculoesquelético - Rabdomiolisis.
Trastornos del sistema nervioso - Hipoestesia; parestesia en niños y adolescentes; alteraciones sensoriales; tics
Desórdenes psiquiátricos - Depresión y estado de ánimo deprimido; ansiedad, cambios en la libido.
convulsiones Se han notificado convulsiones en el período posterior a la comercialización. Los casos de convulsiones posteriores a la comercialización incluyen pacientes con trastornos convulsivos preexistentes y aquellos con factores de riesgo identificados de convulsiones, así como pacientes sin antecedentes ni factores de riesgo identificados de convulsiones. La relación exacta entre STRATTERA 40 mg y las convulsiones es difícil de evaluar debido a la incertidumbre sobre el riesgo de fondo de convulsiones en pacientes con TDAH.
Trastornos de la piel y del tejido subcutáneo - Alopecia, hiperhidrosis.
sistema urogenital - Dolor pélvico masculino; vacilación urinaria en niños y adolescentes; retención urinaria en niños y adolescentes.
INTERACCIONES CON LA DROGAS
Inhibidores de la monoaminooxidasa
Con otros fármacos que afectan las concentraciones cerebrales de monoaminas, se han notificado reacciones graves, a veces fatales (que incluyen hipertermia, rigidez, mioclonías, inestabilidad autonómica con posibles fluctuaciones rápidas de los signos vitales y cambios en el estado mental que incluyen agitación extrema que progresa a delirio y coma). ) cuando se toma en combinación con un IMAO. Algunos casos presentaron características semejantes al síndrome neuroléptico maligno. Tales reacciones pueden ocurrir cuando estos medicamentos se administran al mismo tiempo o muy cerca [ver CONTRAINDICACIONES ].
Efecto de los inhibidores de CYP2D6 sobre atomoxetina
En los metabolizadores rápidos (EM), los inhibidores de CYP2D6 (p. ej., paroxetina, fluoxetina y quinidina) aumentan las concentraciones plasmáticas en estado estacionario de atomoxetina a exposiciones similares a las observadas en los metabolizadores lentos (PM). En individuos con EM tratados con paroxetina o fluoxetina, el AUC de la atomoxetina es aproximadamente de 6 a 8 veces y la Css,max es aproximadamente de 3 a 4 veces mayor que la atomoxetina sola.
Los estudios in vitro sugieren que la coadministración de inhibidores del citocromo P450 con PM no aumentará las concentraciones plasmáticas de atomoxetina.
Fármacos antihipertensivos y agentes presores
Debido a los posibles efectos sobre la presión arterial, STRATTERA debe usarse con precaución con medicamentos antihipertensivos y agentes presores (p. ej., dopamina, dobutamina) u otros medicamentos que aumentan la presión arterial.
albuterol
STRATTERA debe administrarse con precaución a los pacientes que reciben tratamiento con albuterol administrado sistémicamente (oral o intravenoso) (u otros agonistas beta2) porque la acción del albuterol en el sistema cardiovascular puede potenciarse y provocar aumentos en la frecuencia cardíaca y la presión arterial. El albuterol (600 mcg iv durante 2 horas) indujo aumentos en la frecuencia cardíaca y la presión arterial. Estos efectos fueron potenciados por atomoxetina (60 mg dos veces al día durante 5 días) y fueron más marcados después de la coadministración inicial de albuterol y atomoxetina. Sin embargo, estos efectos sobre la frecuencia cardíaca y la presión arterial no se observaron en otro estudio después de la coadministración con una dosis inhalada de albuterol (200-800 mcg) y atomoxetina (80 mg una vez al día durante 5 días) en 21 sujetos asiáticos sanos que fueron excluidos por mala estado del metabolizador.
Efecto de la atomoxetina en las enzimas P450
La atomoxetina no causó una inhibición o inducción clínicamente importante de las enzimas del citocromo P450, incluidas CYP1A2, CYP3A, CYP2D6 y CYP2C9.
Sustrato CYP3A (p. ej., midazolam)
La coadministración de STRATTERA (60 mg dos veces al día durante 12 días) con midazolam, un compuesto modelo para fármacos metabolizados por CYP3A4 (dosis única de 5 mg), resultó en un aumento del 15 % en el AUC de midazolam. No se recomienda ajuste de dosis para fármacos metabolizados por CYP3A.
Sustrato CYP2D6 (p. ej., desipramina)
La coadministración de STRATTERA (40 o 60 mg BID durante 13 días) con desipramina, un compuesto modelo para fármacos metabolizados por CYP2D6 (dosis única de 50 mg), no alteró la farmacocinética de desipramina. No se recomienda ajuste de dosis para fármacos metabolizados por CYP2D6.
Alcohol
El consumo de etanol con STRATTERA 18 mg no modificó los efectos intoxicantes del etanol.
Metilfenidato
La coadministración de metilfenidato con STRATTERA 18 mg no aumentó los efectos cardiovasculares más allá de los observados con metilfenidato solo.
Fármacos altamente unidos a proteínas plasmáticas
Se realizaron estudios de desplazamiento de fármacos in vitro con atomoxetina y otros fármacos altamente ligados a concentraciones terapéuticas. La atomoxetina no afectó la unión de warfarina, ácido acetilsalicílico, fenitoína o diazepam a la albúmina humana. De manera similar, estos compuestos no afectaron la unión de atomoxetina a la albúmina humana.
Medicamentos que afectan el pH gástrico
Los medicamentos que elevan el pH gástrico (hidróxido de magnesio/hidróxido de aluminio, omeprazol) no tuvieron efecto sobre la biodisponibilidad de STRATTERA.
Abuso y dependencia de drogas
Sustancia controlada
STRATTERA no es una sustancia controlada.
Abuso
En un estudio aleatorizado, doble ciego, controlado con placebo, de potencial de abuso en adultos que comparó los efectos de STRATTERA y el placebo, STRATTERA no se asoció con un patrón de respuesta que sugiriera propiedades estimulantes o euforizantes.
Dependencia
Los datos de estudios clínicos en más de 2000 niños, adolescentes y adultos con TDAH y más de 1200 adultos con depresión mostraron solo incidentes aislados de desviación de drogas o autoadministración inapropiada asociada con STRATTERA. No hubo evidencia de síntomas de rebote o reacciones adversas que sugirieran un síndrome de abstinencia o interrupción del medicamento.
Experiencia con animales
Los estudios de discriminación de drogas en ratas y monos mostraron una generalización inconsistente del estímulo entre la atomoxetina y la cocaína.
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Ideación suicida
STRATTERA aumentó el riesgo de ideación suicida en estudios a corto plazo en niños y adolescentes con Trastorno por Déficit de Atención e Hiperactividad (TDAH). Los análisis combinados de ensayos controlados con placebo a corto plazo (6 a 18 semanas) de STRATTERA en niños y adolescentes han revelado un mayor riesgo de ideación suicida al principio del tratamiento en aquellos que reciben STRATTERA. Hubo un total de 12 ensayos (11 en TDAH y 1 en enuresis) en los que participaron más de 2200 pacientes (incluidos 1357 pacientes que recibieron STRATTERA y 851 que recibieron placebo). El riesgo promedio de ideación suicida en los pacientes que recibieron STRATTERA fue del 0,4 % (5/1357 pacientes), en comparación con ninguno en los pacientes tratados con placebo. Hubo 1 intento de suicidio entre estos aproximadamente 2200 pacientes, que ocurrió en un paciente tratado con STRATTERA. No se produjeron suicidios en estos ensayos. Todas las reacciones ocurrieron en niños de 12 años de edad o menores. Todas las reacciones ocurrieron durante el primer mes de tratamiento. Se desconoce si el riesgo de ideación suicida en pacientes pediátricos se extiende al uso a largo plazo. Un análisis similar en pacientes adultos tratados con STRATTERA para el TDAH o el trastorno depresivo mayor (MDD) no reveló un mayor riesgo de ideación o comportamiento suicida en asociación con el uso de STRATTERA.
Todos los pacientes pediátricos que reciben tratamiento con STRATTERA deben ser monitoreados apropiadamente y observados de cerca por empeoramiento clínico, tendencias suicidas y cambios inusuales en el comportamiento, especialmente durante los meses iniciales de un ciclo de terapia con medicamentos, o en momentos de cambios de dosis, ya sea aumentos o disminuciones. .
Se han notificado los siguientes síntomas con STRATTERA: ansiedad, agitación, ataques de pánico, insomnio, irritabilidad, hostilidad, agresividad, impulsividad, acatisia (inquietud psicomotora), hipomanía y manía. Aunque no se ha establecido un vínculo causal entre la aparición de tales síntomas y la aparición de impulsos suicidas, existe la preocupación de que tales síntomas puedan representar precursores de tendencias suicidas emergentes. Por lo tanto, los pacientes que estén siendo tratados con STRATTERA 40 mg deben ser observados para detectar la aparición de tales síntomas.
Se debe considerar la posibilidad de cambiar el régimen terapéutico, incluida la posibilidad de suspender el medicamento, en pacientes que experimenten tendencias suicidas emergentes o síntomas que podrían ser precursores de tendencias suicidas emergentes, especialmente si estos síntomas son graves o de inicio repentino, o no formaron parte del tratamiento. los síntomas de presentación del paciente.
Se debe alertar a las familias y cuidadores de pacientes pediátricos en tratamiento con STRATTERA 10 mg sobre la necesidad de monitorear a los pacientes para detectar la aparición de agitación, irritabilidad, cambios inusuales en el comportamiento y los demás síntomas descritos anteriormente, así como la aparición de tendencias suicidas, y para Informe tales síntomas de inmediato a los proveedores de atención médica. Dicho seguimiento debe incluir la observación diaria por parte de las familias y los cuidadores.
Daño hepático severo
Los informes posteriores a la comercialización indican que STRATTERA puede causar lesiones hepáticas graves. Aunque no se detectó evidencia de daño hepático en ensayos clínicos de alrededor de 6000 pacientes, ha habido casos raros de daño hepático clínicamente significativo que se consideraron probablemente o posiblemente relacionados con el uso de STRATTERA 40 mg en la experiencia posterior a la comercialización. También se han informado casos raros de insuficiencia hepática, incluido un caso que resultó en un trasplante de hígado. Debido al probable subregistro, es imposible proporcionar una estimación precisa de la verdadera incidencia de estas reacciones. Los casos informados de daño hepático ocurrieron dentro de los 120 días posteriores al inicio de atomoxetina en la mayoría de los casos y algunos pacientes presentaron enzimas hepáticas marcadamente elevadas [>20 X límite superior de lo normal (LSN)] e ictericia con niveles de bilirrubina significativamente elevados (>2 X ULN), seguido de recuperación tras la suspensión de atomoxetina. En un paciente, la lesión hepática, manifestada por enzimas hepáticas elevadas hasta 40 X ULN e ictericia con bilirrubina hasta 12 X ULN, reapareció tras la reexposición y fue seguida de recuperación tras la interrupción del fármaco, proporcionando evidencia de que STRATTERA probablemente causó la lesión hepática. Tales reacciones pueden ocurrir varios meses después de que se inicia la terapia, pero las anomalías de laboratorio pueden continuar empeorando durante varias semanas después de suspender el medicamento. El paciente descrito anteriormente se recuperó de su lesión hepática y no requirió un trasplante de hígado.
STRATTERA debe suspenderse en pacientes con ictericia o evidencia de laboratorio de daño hepático, y no debe reiniciarse. Se deben realizar pruebas de laboratorio para determinar los niveles de enzimas hepáticas ante el primer síntoma o signo de disfunción hepática (p. ej., prurito, orina oscura, ictericia, sensibilidad en el cuadrante superior derecho o síntomas “similares a la gripe” inexplicables) [ver Pruebas de laboratorio , INFORMACIÓN DEL PACIENTE ].
Eventos cardiovasculares graves
Muerte súbita y anomalías cardíacas estructurales preexistentes u otros problemas cardíacos graves
Niños y Adolescentes
Se ha notificado muerte súbita en asociación con el tratamiento con atomoxetina a las dosis habituales en niños y adolescentes con anomalías cardíacas estructurales u otros problemas cardíacos graves. Aunque algunos problemas cardíacos graves por sí solos conllevan un mayor riesgo de muerte súbita, la atomoxetina generalmente no debe usarse en niños o adolescentes con anomalías cardíacas estructurales graves conocidas, miocardiopatía, anomalías graves del ritmo cardíaco u otros problemas cardíacos graves que puedan aumentar su vulnerabilidad. a los efectos noradrenérgicos de la atomoxetina.
Adultos
Se han informado muertes súbitas, accidentes cerebrovasculares e infarto de miocardio en adultos que toman atomoxetina a las dosis habituales para el TDAH. Aunque también se desconoce el papel de la atomoxetina en estos casos de adultos, los adultos tienen una mayor probabilidad que los niños de tener anomalías cardíacas estructurales graves, miocardiopatía, anomalías graves del ritmo cardíaco, arteriopatía coronaria u otros problemas cardíacos graves. Se debe considerar no tratar a adultos con anomalías cardíacas clínicamente significativas.
Evaluación del estado cardiovascular en pacientes tratados con atomoxetina
Los niños, adolescentes o adultos que están siendo considerados para el tratamiento con atomoxetina deben tener un historial cuidadoso (incluida la evaluación de antecedentes familiares de muerte súbita o arritmia ventricular) y un examen físico para evaluar la presencia de enfermedad cardíaca, y deben recibir atención cardíaca adicional. evaluación si los hallazgos sugieren tal enfermedad (p. ej., electrocardiograma y ecocardiograma). Los pacientes que desarrollen síntomas como dolor torácico por esfuerzo, síncope inexplicable u otros síntomas que sugieran una enfermedad cardíaca durante el tratamiento con atomoxetina deben someterse a una evaluación cardíaca inmediata.
Efectos sobre la presión arterial y la frecuencia cardíaca
STRATTERA debe usarse con precaución en pacientes cuyas condiciones médicas subyacentes podrían empeorar por aumentos en la presión arterial o la frecuencia cardíaca, como ciertos pacientes con hipertensión, taquicardia o enfermedad cardiovascular o cerebrovascular. No debe usarse en pacientes con trastornos cardíacos o vasculares graves cuya condición se espera que se deteriore si experimentan aumentos clínicamente importantes en la presión arterial o la frecuencia cardíaca [ver CONTRAINDICACIONES ]. El pulso y la presión arterial deben medirse al inicio del estudio, después de los aumentos de dosis de STRATTERA y periódicamente durante el tratamiento para detectar posibles aumentos clínicamente importantes.
La siguiente tabla proporciona datos de ensayos clínicos controlados con placebo a corto plazo para las proporciones de pacientes que tienen un aumento en: presión arterial diastólica ≥15 mm Hg; presión arterial sistólica ≥20 mm Hg; frecuencia cardíaca mayor o igual a 20 lpm, tanto en la población pediátrica como en la adulta (ver Tabla 1).
En estudios de registro controlados con placebo en pacientes pediátricos, la taquicardia se identificó como un evento adverso en el 0,3 % (5/1597) de estos pacientes con STRATTERA 10 mg en comparación con el 0 % (0/934) de los pacientes que recibieron placebo. El aumento medio de la frecuencia cardíaca en pacientes metabolizadores rápidos (EM) fue de 5,0 latidos/minuto y en pacientes metabolizadores lentos (PM) de 9,4 latidos/minuto.
En los ensayos clínicos en adultos en los que se disponía del estado de EM/PM, el aumento medio de la frecuencia cardíaca en los pacientes con PM fue significativamente mayor que en los pacientes con EM (11 latidos/minuto frente a 7,5 latidos/minuto). Los efectos de la frecuencia cardíaca podrían ser clínicamente importantes en algunos pacientes con PM.
En estudios de registro controlados con placebo en pacientes adultos, la taquicardia se identificó como un evento adverso en el 1,5 % (8/540) de los pacientes con STRATTERA 25 mg en comparación con el 0,5 % (2/402) de los pacientes que recibieron placebo.
En ensayos clínicos en adultos en los que estaba disponible el estado de EM/PM, el cambio medio desde el inicio en la presión arterial diastólica en pacientes con PM fue mayor que en los pacientes con EM (4,21 frente a 2,13 mm Hg), al igual que el cambio medio desde el inicio en la presión arterial sistólica (PM : 2,75 frente a EM: 2,40 mm Hg). Los efectos de la presión arterial podrían ser clínicamente importantes en algunos pacientes con PM.
Se han informado casos de hipotensión ortostática y síncope en pacientes que toman STRATTERA. En estudios de registro de niños y adolescentes, el 0,2 % (12/5596) de los pacientes tratados con STRATTERA experimentaron hipotensión ortostática y el 0,8 % (46/5596) experimentaron síncope. En estudios de registro de niños y adolescentes a corto plazo, el 1,8 % (6/340) de los pacientes tratados con STRATTERA experimentó hipotensión ortostática en comparación con el 0,5 % (1/207) de los pacientes tratados con placebo. No se informó síncope durante los estudios de registro de TDAH controlados con placebo en niños y adolescentes a corto plazo. STRATTERA 10 mg debe usarse con precaución en cualquier condición que pueda predisponer a los pacientes a la hipotensión o condiciones asociadas con cambios bruscos en la frecuencia cardíaca o la presión arterial.
Aparición de nuevos síntomas psicóticos o maníacos
Los síntomas psicóticos o maníacos emergentes del tratamiento, por ejemplo, alucinaciones, pensamientos delirantes o manía en niños y adolescentes sin antecedentes de enfermedad psicótica o manía, pueden ser causados por atomoxetina a las dosis habituales. Si se presentan tales síntomas, se debe considerar el posible papel causal de la atomoxetina y se debe considerar la interrupción del tratamiento. En un análisis combinado de múltiples estudios controlados con placebo a corto plazo, tales síntomas ocurrieron en aproximadamente el 0,2 % (4 pacientes con reacciones de 1939 expuestos a atomoxetina durante varias semanas a las dosis habituales) de los pacientes tratados con atomoxetina en comparación con 0 de 1056 pacientes tratados con placebo.
Detección de pacientes para el trastorno bipolar
En general, se debe tener especial cuidado al tratar el TDAH en pacientes con trastorno bipolar comórbido debido a la posible inducción de un episodio mixto/maníaco en pacientes con riesgo de trastorno bipolar. Se desconoce si alguno de los síntomas descritos anteriormente representa tal conversión. Sin embargo, antes de iniciar el tratamiento con STRATTERA 40 mg, los pacientes con síntomas depresivos comórbidos deben ser evaluados adecuadamente para determinar si tienen riesgo de trastorno bipolar; dicha evaluación debe incluir un historial psiquiátrico detallado, incluidos antecedentes familiares de suicidio, trastorno bipolar y depresión.
Comportamiento agresivo u hostilidad
Los pacientes que comienzan el tratamiento para el TDAH deben ser monitoreados por la aparición o el empeoramiento de un comportamiento agresivo u hostil. El comportamiento agresivo o la hostilidad se observa a menudo en niños y adolescentes con TDAH. En ensayos clínicos controlados pediátricos a corto plazo, 21/1308 (1,6 %) de los pacientes tratados con atomoxetina frente a 9/806 (1,1 %) de los pacientes tratados con placebo notificaron espontáneamente eventos adversos relacionados con la hostilidad emergente del tratamiento (razón de riesgo global de 1,33 [95 % IC 0.67-2.64 – no estadísticamente significativo]). En ensayos clínicos controlados con placebo en adultos, 6/1697 (0,35 %) de los pacientes con atomoxetina frente a 4/1560 (0,26 %) de los pacientes tratados con placebo notificaron espontáneamente eventos adversos relacionados con la hostilidad emergente del tratamiento (índice de riesgo global de 1,38 [IC del 95 %] 0.39-4.88 – no estadísticamente significativo]). Aunque esta no es una evidencia concluyente de que STRATTERA 10 mg provoque comportamiento agresivo u hostilidad, estos comportamientos se observaron con mayor frecuencia en ensayos clínicos entre niños, adolescentes y adultos tratados con STRATTERA en comparación con placebo.
Eventos alérgicos
Aunque son poco frecuentes, se han informado reacciones alérgicas, incluidas reacciones anafilácticas, edema angioneurótico, urticaria y erupción cutánea, en pacientes que toman STRATTERA.
Efectos sobre el flujo de salida de orina de la vejiga
En ensayos controlados con TDAH en adultos, las tasas de retención urinaria (1,7 %, 9/540) y vacilación urinaria (5,6 %, 30/540) aumentaron entre los sujetos que recibieron atomoxetina en comparación con los sujetos que recibieron placebo (0 %, 0/402; 0,5 %, 2/402, respectivamente). Dos sujetos adultos con atomoxetina y ningún sujeto con placebo interrumpieron los ensayos clínicos controlados debido a la retención urinaria. Una queja de retención urinaria o vacilación urinaria debe considerarse potencialmente relacionada con atomoxetina.
priapismo
Se han informado casos raros de priapismo posteriores a la comercialización, definidos como erección del pene dolorosa y no dolorosa que dura más de 4 horas, en pacientes pediátricos y adultos tratados con STRATTERA. Las erecciones se resolvieron en casos en los que se disponía de información de seguimiento, algunos después de la suspensión de STRATTERA. Se requiere atención médica inmediata en caso de sospecha de priapismo.
Efectos sobre el crecimiento
Los datos sobre los efectos a largo plazo de STRATTERA 25 mg en el crecimiento provienen de estudios abiertos y los cambios de peso y altura se comparan con los datos normativos de la población. En general, el aumento de peso y altura de los pacientes pediátricos tratados con STRATTERA va a la zaga de lo previsto por los datos de población normativos durante los primeros 9 a 12 meses de tratamiento. Posteriormente, el aumento de peso se recupera y aproximadamente a los 3 años de tratamiento, los pacientes tratados con STRATTERA han ganado un promedio de 17,9 kg, 0,5 kg más de lo previsto por sus datos iniciales. Después de aproximadamente 12 meses, el aumento de altura se estabiliza y, a los 3 años, los pacientes tratados con STRATTERA 40 mg han ganado un promedio de 19,4 cm, 0,4 cm menos de lo previsto por sus datos iniciales (consulte la Figura 1 a continuación).
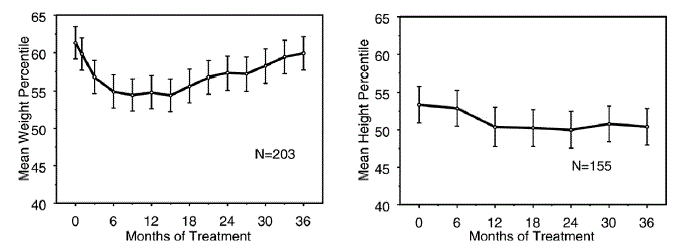
Figura 1: Percentiles medios de peso y altura a lo largo del tiempo para pacientes con tres años de tratamiento con STRATTERA 40 mg
Este patrón de crecimiento fue generalmente similar independientemente del estado puberal en el momento del inicio del tratamiento. Los pacientes que eran prepúberes al comienzo del tratamiento (niñas ≤8 años, niños ≤9 años) ganaron un promedio de 2,1 kg y 1,2 cm menos de lo previsto después de tres años. Los pacientes que eran puberales (niñas > 8 a ≤ 13 años, niños > 9 a ≤ 14 años) o puberales tardíos (niñas > 13 años, niños > 14 años) tuvieron aumentos promedio de peso y altura que estaban cerca o excedieron los previstos después de tres años de tratamiento.
El crecimiento siguió un patrón similar tanto en los metabolizadores rápidos como lentos (EM, PM). Los PM tratados durante al menos dos años ganaron un promedio de 2,4 kg y 1,1 cm menos de lo previsto, mientras que los EM ganaron un promedio de 0,2 kg y 0,4 cm menos de lo previsto.
En estudios controlados a corto plazo (hasta 9 semanas), los pacientes tratados con STRATTERA perdieron una media de 0,4 kg y aumentaron una media de 0,9 cm, en comparación con una ganancia de 1,5 kg y 1,1 cm en los pacientes tratados con placebo. En un ensayo controlado de dosis fija, el 1,3 %, el 7,1 %, el 19,3 % y el 29,1 % de los pacientes perdieron al menos el 3,5 % de su peso corporal en los grupos de dosis de placebo, 0,5, 1,2 y 1,8 mg/kg/día.
Se debe controlar el crecimiento durante el tratamiento con STRATTERA.
Pruebas de laboratorio
No se requieren pruebas de laboratorio de rutina.
Metabolismo CYP2D6
Los metabolizadores lentos (PM) de CYP2D6 tienen un AUC 10 veces mayor y una concentración máxima 5 veces mayor a una dosis dada de STRATTERA 25 mg en comparación con los metabolizadores rápidos (EM). Aproximadamente el 7% de una población caucásica son PM. Hay pruebas de laboratorio disponibles para identificar los PM CYP2D6. Los niveles en sangre de los PM son similares a los que se obtienen al tomar inhibidores potentes de CYP2D6. Los niveles sanguíneos más altos en PM conducen a una tasa más alta de algunos efectos adversos de STRATTERA [ver REACCIONES ADVERSAS ].
Uso concomitante de inhibidores potentes de CYP2D6 o uso en pacientes que se sabe que son PM de CYP2D6
La atomoxetina se metaboliza principalmente por la vía CYP2D6 a 4-hidroxiatomoxetina. Puede ser necesario ajustar la dosis de STRATTERA cuando se coadministra con inhibidores potentes de CYP2D6 (p. ej., paroxetina, fluoxetina y quinidina) o cuando se administra a PM de CYP2D6. [Ver DOSIFICACIÓN Y ADMINISTRACIÓN y INTERACCIONES CON LA DROGAS ].
Información de asesoramiento para pacientes
Ver aprobado por la FDA INFORMACIÓN DEL PACIENTE .
Información general
Los médicos deben indicar a sus pacientes que lean la Guía del medicamento antes de comenzar la terapia con STRATTERA y que la vuelvan a leer cada vez que renueven la receta.
Los prescriptores u otros profesionales de la salud deben informar a los pacientes, sus familias y sus cuidadores sobre los beneficios y riesgos asociados con el tratamiento con STRATTERA y deben asesorarlos sobre su uso apropiado. El prescriptor o el profesional de la salud debe instruir a los pacientes, sus familias y sus cuidadores para que lean la Guía del medicamento y debe ayudarlos a comprender su contenido. Los pacientes deben tener la oportunidad de discutir el contenido de la Guía del medicamento y obtener respuestas a cualquier pregunta que puedan tener.
Se debe informar a los pacientes sobre los siguientes problemas y pedirles que alerten a su prescriptor si ocurren mientras toman STRATTERA.
Riesgo de suicidio
Se debe alentar a los pacientes, sus familias y sus cuidadores a estar alerta ante la aparición de ansiedad, agitación, ataques de pánico, insomnio, irritabilidad, hostilidad, agresividad, impulsividad, acatisia (inquietud psicomotora), hipomanía, manía, otros cambios inusuales en el comportamiento. , depresión e ideación suicida, especialmente al principio del tratamiento con STRATTERA y cuando se ajusta la dosis. Se debe aconsejar a las familias y cuidadores de los pacientes que observen la aparición de tales síntomas en el día a día, ya que los cambios pueden ser abruptos. Dichos síntomas deben informarse al médico o al profesional de la salud del paciente, especialmente si son graves, de inicio repentino o no formaban parte de los síntomas que presentaba el paciente. Síntomas como estos pueden estar asociados con un mayor riesgo de pensamientos y conductas suicidas e indican la necesidad de un control muy estricto y posiblemente cambios en la medicación.
Daño hepático severo
Se debe advertir a los pacientes que inician STRATTERA que se puede desarrollar una lesión hepática grave. Se debe indicar a los pacientes que se comuniquen con su médico de inmediato si desarrollan prurito, orina oscura, ictericia, sensibilidad en el cuadrante superior derecho o síntomas "similares a la gripe" inexplicables [ver ADVERTENCIAS Y PRECAUCIONES ].
agresión u hostilidad
Se debe indicar a los pacientes que llamen a su médico lo antes posible si notan un aumento en la agresión u hostilidad.
priapismo
Se han informado casos raros de priapismo posteriores a la comercialización, definidos como erección del pene dolorosa y no dolorosa que dura más de 4 horas, en pacientes pediátricos y adultos tratados con STRATTERA. Se debe informar a los padres o tutores de los pacientes pediátricos que toman STRATTERA 25 mg y de los pacientes adultos que toman STRATTERA que el priapismo requiere atención médica inmediata.
irritante ocular
STRATTERA es un irritante ocular. Las cápsulas de STRATTERA no están diseñadas para abrirse. En caso de que el contenido de la cápsula entre en contacto con el ojo, el ojo afectado debe enjuagarse inmediatamente con agua y consultar a un médico. Las manos y cualquier superficie potencialmente contaminada deben lavarse lo antes posible.
Interacción fármaco-fármaco
Se debe indicar a los pacientes que consulten a un médico si están tomando o planean tomar medicamentos recetados o de venta libre, suplementos dietéticos o remedios a base de hierbas.
El embarazo
Se debe indicar a las pacientes que consulten a un médico si están amamantando, embarazadas o pensando en quedar embarazadas mientras toman STRATTERA.
Alimento
Los pacientes pueden tomar STRATTERA 25 mg con o sin alimentos.
Dosis olvidada
Si los pacientes olvidan una dosis, se les debe indicar que la tomen lo antes posible, pero no deben tomar más de la cantidad diaria total prescrita de STRATTERA en un período de 24 horas.
Interferencia con el rendimiento psicomotor
Se debe instruir a los pacientes para que tengan cuidado cuando conduzcan un automóvil o operen maquinaria peligrosa hasta que estén razonablemente seguros de que su desempeño no se ve afectado por la atomoxetina.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Carcinogénesis
El clorhidrato de atomoxetina no fue cancerígeno en ratas y ratones cuando se administró en la dieta durante 2 años en dosis promedio ponderadas en el tiempo de hasta 47 y 458 mg/kg/día, respectivamente. La dosis más alta utilizada en ratas es aproximadamente 8 y 5 veces la dosis máxima en humanos en niños y adultos, respectivamente, en base a mg/m2. Se estima que los niveles plasmáticos (AUC) de atomoxetina a esta dosis en ratas son 1,8 veces (metabolizadores rápidos) o 0,2 veces (metabolizadores lentos) los de los seres humanos que reciben la dosis humana máxima. La dosis más alta utilizada en ratones es aproximadamente 39 y 26 veces la dosis máxima en humanos en niños y adultos, respectivamente, en mg/m2.
mutagénesis
El clorhidrato de atomoxetina dio negativo en una serie de estudios de genotoxicidad que incluyeron un ensayo de mutación puntual inversa (prueba de Ames), un ensayo de linfoma de ratón in vitro, una prueba de aberración cromosómica en células de ovario de hámster chino, una prueba de síntesis de ADN no programada en hepatocitos de rata y una Prueba de micronúcleos in vivo en ratones. Sin embargo, hubo un ligero aumento en el porcentaje de células de ovario de hámster chino con diplocromosomas, lo que sugiere una endorreduplicación (aberración numérica).
El metabolito N-desmetilatomoxetina HCl fue negativo en la prueba de Ames, el ensayo de linfoma de ratón y la prueba de síntesis de ADN no programada.
Deterioro de la fertilidad
Atomoxetina HCl no afectó la fertilidad en ratas cuando se administró en la dieta en dosis de hasta 57 mg/kg/día, que es aproximadamente 6 veces la dosis máxima en humanos en base a mg/m2.
Uso en poblaciones específicas
El embarazo
Embarazo Categoría C
Se trataron conejas preñadas con hasta 100 mg/kg/día de atomoxetina por sonda durante todo el período de organogénesis. A esta dosis, en 1 de 3 estudios, se observó una disminución de los fetos vivos y un aumento de las reabsorciones tempranas. Se observaron ligeros aumentos en las incidencias de origen atípico de la arteria carótida y arteria subclavia ausente. Estos hallazgos se observaron a dosis que causaron una ligera toxicidad materna. La dosis sin efecto para estos hallazgos fue de 30 mg/kg/día. La dosis de 100 mg/kg es aproximadamente 23 veces la dosis humana máxima en mg/m2; Se estima que los niveles plasmáticos (AUC) de atomoxetina a esta dosis en conejos son 3,3 veces (metabolizadores rápidos) o 0,4 veces (metabolizadores lentos) los de los seres humanos que reciben la dosis humana máxima.
Las ratas se trataron con hasta aproximadamente 50 mg/kg/día de atomoxetina (aproximadamente 6 veces la dosis humana máxima en mg/m2) en la dieta desde 2 semanas (hembras) o 10 semanas (machos) antes del apareamiento hasta el final. períodos de organogénesis y lactancia. En 1 de 2 estudios, se observaron disminuciones en el peso y la supervivencia de las crías. La disminución de la supervivencia de las crías también se observó con 25 mg/kg (pero no con 13 mg/kg). En un estudio en el que se trató a ratas con atomoxetina en la dieta desde 2 semanas (hembras) o 10 semanas (machos) antes del apareamiento durante todo el período de organogénesis, se observó una disminución del peso fetal (solo hembras) y un aumento en la incidencia de Se observó osificación incompleta del arco vertebral en fetos con 40 mg/kg/día (aproximadamente 5 veces la dosis humana máxima en mg/m2) pero no con 20 mg/kg/día.
No se observaron efectos fetales adversos cuando se trató a ratas preñadas con hasta 150 mg/kg/día (aproximadamente 17 veces la dosis máxima en humanos en mg/m2) por sonda durante todo el período de organogénesis. No se han realizado estudios adecuados y bien controlados en mujeres embarazadas. STRATTERA 18 mg no debe usarse durante el embarazo a menos que el beneficio potencial justifique el riesgo potencial para el feto.
Trabajo y entrega
El parto en ratas no se vio afectado por atomoxetina. Se desconoce el efecto de STRATTERA sobre el trabajo de parto y el parto en humanos.
Madres lactantes
La atomoxetina y/o sus metabolitos se excretaron en la leche de ratas. No se sabe si la atomoxetina se excreta en la leche humana. Se debe tener precaución si se administra STRATTERA a una mujer lactante.
Uso pediátrico
Cualquiera que esté considerando el uso de STRATTERA en un niño o adolescente debe sopesar los riesgos potenciales con la necesidad clínica [ver CUADRO DE ADVERTENCIA y ADVERTENCIAS Y PRECAUCIONES ]. La farmacocinética de atomoxetina en niños y adolescentes es similar a la de los adultos. No se ha evaluado la seguridad, eficacia y farmacocinética de STRATTERA en pacientes pediátricos menores de 6 años.
Se realizó un estudio en ratas jóvenes para evaluar los efectos de la atomoxetina sobre el crecimiento y el desarrollo neuroconductual y sexual. Las ratas se trataron con 1, 10 o 50 mg/kg/día (aproximadamente 0,2, 2 y 8 veces, respectivamente, la dosis máxima en humanos en mg/m2) de atomoxetina administrada por sonda desde el período posnatal temprano (Día 10 de edad) hasta la edad adulta. Ligeros retrasos en el inicio de la permeabilidad vaginal (todas las dosis) y separación del prepucio (10 y 50 mg/kg), ligeras disminuciones en el peso del epidídimo y el número de espermatozoides (10 y 50 mg/kg) y una ligera disminución en los cuerpos lúteos (50 mg/kg). /kg), pero no hubo efectos sobre la fertilidad o el desempeño reproductivo. Se observó un ligero retraso en el inicio de la erupción de los incisivos con 50 mg/kg. Se observó un ligero aumento en la actividad motora el día 15 (machos con 10 y 50 mg/kg y hembras con 50 mg/kg) y el día 30 (hembras con 50 mg/kg), pero no el día 60 de edad. No hubo efectos en las pruebas de aprendizaje y memoria. Se desconoce el significado de estos hallazgos para los humanos.
Uso geriátrico
No se ha evaluado la seguridad, eficacia y farmacocinética de STRATTERA 10 mg en pacientes geriátricos.
insuficiencia hepática
La exposición a atomoxetina (AUC) aumenta, en comparación con sujetos normales, en sujetos EM con insuficiencia hepática moderada (Child-Pugh Clase B) (aumento de 2 veces) y grave (Child-Pugh Clase C) (aumento de 4 veces). Se recomienda ajustar la dosis en pacientes con insuficiencia hepática moderada o grave [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Insuficiencia renal
Los sujetos EM con enfermedad renal en etapa terminal tuvieron una mayor exposición sistémica a la atomoxetina que los sujetos sanos (aproximadamente un aumento del 65 %), pero no hubo diferencia cuando se corrigió la exposición por dosis de mg/kg. Por lo tanto, STRATTERA 25 mg puede administrarse a pacientes con TDAH con enfermedad renal en etapa terminal o grados menores de insuficiencia renal utilizando el régimen de dosificación normal.
Género
El sexo no influyó en la disposición de atomoxetina.
Origen étnico
El origen étnico no influyó en la disposición de atomoxetina (excepto que los PM son más comunes en los caucásicos).
Pacientes con enfermedad concomitante
Tics en pacientes con TDAH y trastorno de Tourette comórbido
La atomoxetina administrada en un rango de dosis flexible de 0,5 a 1,5 mg/kg/día (dosis media de 1,3 mg/kg/día) y el placebo se compararon en 148 sujetos pediátricos aleatorizados (edad 717 años) con un diagnóstico DSM-IV de TDAH y trastorno de tics comórbido en un estudio de 18 semanas, doble ciego, controlado con placebo en el que la mayoría (80 %) se inscribió en este ensayo con el trastorno de Tourette (trastorno de Tourette: 116 sujetos; trastorno de tic motor crónico: 29 sujetos). Un análisis de no inferioridad reveló que STRATTERA 10 mg no empeoró los tics en estos pacientes según lo determinado por la puntuación total de la escala global de gravedad de los tics de Yale (YGTSS). De 148 pacientes que entraron en la fase de tratamiento agudo, 103 (69,6%) pacientes interrumpieron el estudio. El motivo principal de la interrupción en los grupos de tratamiento con atomoxetina (38 de 76 pacientes, 50,0 %) y placebo (45 de 72 pacientes, 62,5 %) se identificó como falta de eficacia y la mayoría de los pacientes interrumpieron en la Semana 12. Esta fue la primera visita en la que los pacientes con un CGI-S≥4 también podrían cumplir con los criterios de "sin respuesta clínica" (CGI-S se mantuvo igual o aumentó desde el inicio del estudio) y ser elegible para ingresar a un estudio de extensión abierto con atomoxetina. Ha habido informes posteriores a la comercialización de tics [ver REACCIONES ADVERSAS ].
Ansiedad en pacientes con TDAH y trastornos de ansiedad comórbidos
En dos ensayos posteriores a la comercialización, doble ciego, controlados con placebo, se demostró que el tratamiento de pacientes con TDAH y trastornos de ansiedad comórbidos con STRATTERA 10 mg no empeora su ansiedad.
En un ensayo doble ciego controlado con placebo de 12 semanas de duración, 176 pacientes, de 8 a 17 años de edad, que cumplían con los criterios del DSM-IV para el TDAH y al menos uno de los trastornos de ansiedad del trastorno de ansiedad por separación, trastorno de ansiedad generalizada o fobia social fueron aleatorio. Después de una introducción doble ciego con placebo de 2 semanas, se inició STRATTERA 25 mg a 0,8 mg/kg/día con aumento a una dosis objetivo de 1,2 mg/kg/día (dosis mediana 1,30 mg/kg/día +/-0,29 mg/kg/día). STRATTERA no empeoró la ansiedad en estos pacientes según lo determinado por la Escala de calificación de ansiedad pediátrica (PARS). De los 158 pacientes que completaron la introducción doble ciego con placebo, 26 (16%) pacientes interrumpieron el estudio.
En un ensayo independiente, doble ciego, controlado con placebo, de 16 semanas de duración, se aleatorizaron 442 pacientes de 18 a 65 años que cumplían con los criterios del DSM-IV para el TDAH y el trastorno de ansiedad social en adultos (el 23 % de los cuales también padecía el trastorno de ansiedad generalizada). Después de una introducción doble ciego con placebo de 2 semanas, se inició STRATTERA 10 mg a 40 mg/día hasta una dosis máxima de 100 mg/día (dosis diaria media 83 mg/día +/-19,5 mg/día). STRATTERA 18 mg no empeoró la ansiedad en estos pacientes según lo determinado por la Escala de Ansiedad Social de Liebowitz (LSAS). De los 413 pacientes que completaron la introducción doble ciego con placebo, 149 (36,1 %) pacientes interrumpieron el estudio. Ha habido informes de ansiedad posteriores a la comercialización [ver REACCIONES ADVERSAS ] .
SOBREDOSIS
Experiencia humana
Hay experiencia limitada en ensayos clínicos con sobredosis de STRATTERA. Durante la poscomercialización, se informaron muertes relacionadas con una sobredosis de ingestión mixta de STRATTERA 10 mg y al menos otro fármaco. No ha habido informes de muerte por sobredosis de STRATTERA solo, incluidas las sobredosis intencionales en cantidades de hasta 1400 mg. En algunos casos de sobredosis con STRATTERA, se han notificado convulsiones. Los síntomas más comúnmente informados que acompañan a las sobredosis agudas y crónicas de STRATTERA fueron síntomas gastrointestinales, somnolencia, mareos, temblores y comportamiento anormal. También se han informado hiperactividad y agitación. También se han observado signos y síntomas compatibles con una activación del sistema nervioso simpático de leve a moderada (p. ej., taquicardia, aumento de la presión arterial, midriasis, sequedad de boca). La mayoría de los eventos fueron de leves a moderados. Con menos frecuencia, ha habido informes de prolongación del intervalo QT y cambios mentales, que incluyen desorientación y alucinaciones [ver FARMACOLOGÍA CLÍNICA ].
Manejo de sobredosis
Consulte con un centro de control de intoxicaciones certificado para obtener orientación y asesoramiento actualizados. Debido a que la atomoxetina se une en gran medida a las proteínas, es poco probable que la diálisis sea útil en el tratamiento de la sobredosis.
CONTRAINDICACIONES
Hipersensibilidad
STRATTERA está contraindicado en pacientes con hipersensibilidad conocida a la atomoxetina u otros componentes del producto [ver ADVERTENCIAS Y PRECAUCIONES ].
Inhibidores de la monoaminooxidasa (IMAO)
STRATTERA no debe tomarse con un IMAO o dentro de las 2 semanas posteriores a la interrupción de un IMAO. El tratamiento con un IMAO no debe iniciarse dentro de las 2 semanas posteriores a la suspensión de STRATTERA. Con otros medicamentos que afectan las concentraciones de monoamina en el cerebro, ha habido informes de reacciones graves, a veces fatales (que incluyen hipertermia, rigidez, mioclonías, inestabilidad autonómica con posibles fluctuaciones rápidas de los signos vitales y cambios en el estado mental que incluyen agitación extrema que progresa a delirio y coma) cuando se toma en combinación con un IMAO. Algunos casos presentaron características semejantes al síndrome neuroléptico maligno. Tales reacciones pueden ocurrir cuando estos medicamentos se administran al mismo tiempo o muy cerca [ver INTERACCIONES CON LA DROGAS ].
Glaucoma de ángulo estrecho
En ensayos clínicos, el uso de STRATTERA se asoció con un mayor riesgo de midriasis y, por lo tanto, no se recomienda su uso en pacientes con glaucoma de ángulo estrecho.
Feocromocitoma
Se han informado reacciones graves, que incluyen presión arterial elevada y taquiarritmia, en pacientes con feocromocitoma o antecedentes de feocromocitoma que recibieron STRATTERA. Por lo tanto, STRATTERA 18 mg no debe ser tomado por pacientes con feocromocitoma o antecedentes de feocromocitoma.
Trastornos cardiovasculares graves
STRATTERA 40 mg no debe usarse en pacientes con trastornos cardíacos o vasculares graves cuya condición se espera que se deteriore si experimentan aumentos en la presión arterial o la frecuencia cardíaca que podrían ser clínicamente importantes (por ejemplo, 15 a 20 mm Hg en la presión arterial o 20 latidos por minuto en la frecuencia cardíaca). [Ver ADVERTENCIAS Y PRECAUCIONES ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
Se desconoce el mecanismo preciso por el cual la atomoxetina produce sus efectos terapéuticos en el trastorno por déficit de atención con hiperactividad (TDAH), pero se cree que está relacionado con la inhibición selectiva del transportador presináptico de norepinefrina, según se determinó en estudios ex vivo de captación y agotamiento de neurotransmisores. .
Farmacodinámica
Un análisis de exposición-respuesta que abarcó dosis de atomoxetina (0.5, 1.2 o 1.8 mg/kg/día) o placebo demostró que la exposición a atomoxetina se correlaciona con la eficacia medida por la Escala de Calificación del Trastorno por Déficit de Atención/Hiperactividad-IV-Versión para padres: administrada por el investigador y anotó. La relación exposición-eficacia fue similar a la observada entre la dosis y la eficacia con exposiciones medianas a las dos dosis más altas que dieron como resultado cambios casi máximos desde el inicio [ver Estudios clínicos ].
Electrofisiología cardíaca
El efecto de STRATTERA sobre la prolongación del intervalo QTc se evaluó en un estudio cruzado aleatorizado, doble ciego, positivo (moxifloxacina 400 mg) y controlado con placebo en varones sanos metabolizadores lentos de CYP2D6. Se administró STRATTERA (20 mg y 60 mg) dos veces al día durante 7 días a un total de 120 sujetos sanos. En el estudio no se observaron grandes cambios en el intervalo QTc (es decir, aumentos >60 ms desde el inicio, QTc absoluto >480 ms). Sin embargo, los pequeños cambios en el intervalo QTc no se pueden excluir del estudio actual, porque el estudio no logró demostrar la sensibilidad del ensayo. Hubo un ligero aumento en el intervalo QTc con el aumento de la concentración de atomoxetina.
Farmacocinética
La atomoxetina se absorbe bien después de la administración oral y se ve mínimamente afectada por los alimentos. Se elimina principalmente por metabolismo oxidativo a través de la vía enzimática del citocromo P450 2D6 (CYP2D6) y posterior glucuronidación. La atomoxetina tiene una vida media de aproximadamente 5 horas. Una fracción de la población (alrededor del 7 % de los caucásicos y el 2 % de los afroamericanos) son metabolizadores lentos (PM) de fármacos metabolizados por CYP2D6. Estos individuos tienen una actividad reducida en esta vía, lo que resulta en AUC 10 veces más altas, concentraciones plasmáticas máximas 5 veces más altas y una eliminación más lenta (vida media plasmática de aproximadamente 24 horas) de atomoxetina en comparación con personas con actividad normal [metabolizadores extensivos (EM) )]. Los fármacos que inhiben la CYP2D6, como la fluoxetina, la paroxetina y la quinidina, provocan aumentos similares en la exposición.
La farmacocinética de atomoxetina se ha evaluado en más de 400 niños y adolescentes en ensayos clínicos seleccionados, principalmente mediante estudios de farmacocinética poblacional. También se obtuvieron datos farmacocinéticos individuales de dosis única y estado estacionario en niños, adolescentes y adultos. Cuando las dosis se normalizaron a mg/kg, se observaron valores similares de semivida, Cmax y AUC en niños, adolescentes y adultos. El aclaramiento y el volumen de distribución después del ajuste por peso corporal también fueron similares.
Absorción y Distribución
La atomoxetina se absorbe rápidamente después de la administración oral, con una biodisponibilidad absoluta de alrededor del 63 % en los EM y del 94 % en los PM. Las concentraciones plasmáticas máximas (Cmax) se alcanzan aproximadamente de 1 a 2 horas después de la dosificación.
STRATTERA 18 mg se puede administrar con o sin alimentos. La administración de STRATTERA con una comida estándar rica en grasas en adultos no afectó el grado de absorción oral de atomoxetina (AUC), pero disminuyó la tasa de absorción, lo que resultó en una Cmáx un 37 % más baja y un retraso de la Tmáx de 3 horas. En ensayos clínicos con niños y adolescentes, la administración de STRATTERA con alimentos dio como resultado una Cmáx un 9 % más baja.
El volumen de distribución en estado estacionario después de la administración intravenosa es de 0,85 l/kg, lo que indica que la atomoxetina se distribuye principalmente en el agua corporal total. El volumen de distribución es similar en todo el rango de peso del paciente después de normalizar el peso corporal.
A concentraciones terapéuticas, el 98% de la atomoxetina en plasma se une a proteínas, principalmente a la albúmina.
Metabolismo y eliminación
La atomoxetina se metaboliza principalmente a través de la vía enzimática CYP2D6. Las personas con actividad reducida en esta vía (PM) tienen concentraciones plasmáticas más altas de atomoxetina en comparación con las personas con actividad normal (EM). Para los PM, el AUC de la atomoxetina es aproximadamente 10 veces mayor y la Css, max es aproximadamente 5 veces mayor que la de los EM. Hay pruebas de laboratorio disponibles para identificar los PM CYP2D6. La coadministración de STRATTERA con inhibidores potentes de CYP2D6, como fluoxetina, paroxetina o quinidina, produce un aumento sustancial en la exposición plasmática de atomoxetina y puede ser necesario ajustar la dosis [ver ADVERTENCIAS Y PRECAUCIONES ]. La atomoxetina no inhibió ni indujo la vía CYP2D6.
El principal metabolito oxidativo formado, independientemente del estado de CYP2D6, es la 4-hidroxiatomoxetina, que está glucuronizada. La 4-hidroxiatomoxetina es equipotente a la atomoxetina como inhibidor del transportador de norepinefrina, pero circula en el plasma a concentraciones mucho más bajas (1 % de la concentración de atomoxetina en los EM y 0,1 % de la concentración de atomoxetina en los PM). La 4-hidroxiatomoxetina se forma principalmente por CYP2D6, pero en los PM, la 4-hidroxiatomoxetina se forma a un ritmo más lento por varias otras enzimas del citocromo P450. La N-desmetilatomoxetina está formada por CYP2C19 y otras enzimas del citocromo P450, pero tiene una actividad farmacológica sustancialmente menor en comparación con la atomoxetina y circula en el plasma en concentraciones más bajas (5 % de la concentración de atomoxetina en los EM y 45 % de la concentración de atomoxetina en los PM).
El aclaramiento plasmático aparente medio de atomoxetina después de la administración oral en EM adultos es de 0,35 l/h/kg y la vida media media es de 5,2 horas. Después de la administración oral de atomoxetina a PM, el aclaramiento plasmático aparente medio es de 0,03 l/h/kg y la vida media media es de 21,6 horas. Para los PM, el AUC de la atomoxetina es aproximadamente 10 veces mayor y la Css, max es aproximadamente 5 veces mayor que la de los EM. La vida media de eliminación de 4-hidroxiatomoxetina es similar a la de N-desmetilatomoxetina (6 a 8 horas) en sujetos EM, mientras que la vida media de N-desmetilatomoxetina es mucho más prolongada en sujetos PM (34 a 40 horas).
La atomoxetina se excreta principalmente como 4-hidroxiatomoxetina-O-glucurónido, principalmente en la orina (más del 80 % de la dosis) y en menor medida en las heces (menos del 17 % de la dosis). Solo una pequeña fracción de la dosis de 40 mg de STRATTERA se excreta como atomoxetina inalterada (menos del 3 % de la dosis), lo que indica una amplia biotransformación.
[Ver Uso en poblaciones específicas ].
Estudios clínicos
Estudios de TDAH en niños y adolescentes
Estudios agudos
La eficacia de STRATTERA 40 mg en el tratamiento del TDAH se estableció en 4 estudios aleatorizados, doble ciego, controlados con placebo de pacientes pediátricos (de 6 a 18 años). Aproximadamente un tercio de los pacientes cumplían los criterios del DSM-IV para el subtipo de falta de atención y dos tercios cumplían los criterios para los subtipos de falta de atención e hiperactivo/impulsivo.
Los signos y síntomas del TDAH se evaluaron mediante una comparación del cambio medio desde el inicio hasta el punto final para los pacientes tratados con STRATTERA y con placebo mediante un análisis por intención de tratar de la medida de resultado primaria, el investigador administró y calificó la Escala de calificación del TDAH-IV- Puntuación total de la versión para padres (ADHDRS), incluidas las subescalas de hiperactividad/impulsividad e inatención. Cada ítem en el ADHDRS se asigna directamente a un criterio de síntoma para el TDAH en el DSM-IV.
En el Estudio 1, un estudio de tratamiento agudo, aleatorizado, doble ciego, controlado con placebo, de respuesta a la dosis, de 8 semanas de duración de niños y adolescentes de 8 a 18 años (N=297), los pacientes recibieron una dosis fija de STRATTERA (0,5, 1,2 o 1,8 mg/kg/día) o placebo. STRATTERA 10 mg se administró en una dosis dividida temprano en la mañana y al final de la tarde/primera hora de la noche. Con las 2 dosis más altas, las mejoras en los síntomas del TDAH fueron significativamente superiores desde el punto de vista estadístico en los pacientes tratados con STRATTERA en comparación con los pacientes tratados con placebo, según lo medido en la escala ADHDRS. La dosis de 1,8 mg/kg/día de STRATTERA de 25 mg no proporcionó ningún beneficio adicional al observado con la dosis de 1,2 mg/kg/día. La dosis de STRATTERA de 0,5 mg/kg/día no fue superior al placebo.
En el Estudio 2, un estudio de tratamiento agudo, aleatorizado, doble ciego, controlado con placebo, de 6 semanas de duración de niños y adolescentes de 6 a 16 años (N=171), los pacientes recibieron STRATTERA 40 mg o placebo. STRATTERA se administró como una dosis única temprano en la mañana y se ajustó según el peso según la respuesta clínica, hasta una dosis máxima de 1,5 mg/kg/día. La dosis final media de STRATTERA 10 mg fue de aproximadamente 1,3 mg/kg/día. Los síntomas del TDAH mejoraron significativamente desde el punto de vista estadístico con STRATTERA en comparación con el placebo, según lo medido en la escala ADHDRS. Este estudio demuestra que STRATTERA es eficaz cuando se administra una vez al día por la mañana.
En 2 estudios idénticos, de 9 semanas, agudos, aleatorizados, doble ciego, controlados con placebo de niños de 7 a 13 años (Estudio 3, N=147; Estudio 4, N=144), STRATTERA 40 mg y metilfenidato se compararon con placebo . STRATTERA 18 mg se administró en una dosis dividida temprano en la mañana y al final de la tarde (después de la escuela) y se ajustó según el peso de acuerdo con la respuesta clínica. La dosis máxima recomendada de STRATTERA fue de 2,0 mg/kg/día. La dosis final media de STRATTERA 18 mg para ambos estudios fue de aproximadamente 1,6 mg/kg/día. En ambos estudios, los síntomas del TDAH mejoraron más de manera estadísticamente significativa con STRATTERA 10 mg que con el placebo, según lo medido en la escala ADHDRS.
El examen de los subconjuntos de población según el género y la edad (
Estudio de Mantenimiento
La eficacia de STRATTERA 18 mg en el tratamiento de mantenimiento del TDAH se estableció en un estudio ambulatorio de niños y adolescentes (de 6 a 15 años). Los pacientes que cumplieron con los criterios del DSM-IV para el TDAH y que mostraron una respuesta continua durante aproximadamente 4 semanas durante una fase inicial de tratamiento abierto de 10 semanas con STRATTERA (1,2 a 1,8 mg/kg/día) se aleatorizaron para continuar con su dosis actual de STRATTERA (N =292) o al placebo (N=124) bajo tratamiento doble ciego para la observación de la recaída. La respuesta durante la fase abierta se definió como una puntuación CGI-ADHD-S ≤2 y una reducción de al menos un 25 % desde el inicio en la puntuación total ADHDRS-IV-Parent:Inv. Los pacientes que fueron asignados a STRATTERA y mostraron una respuesta continua durante aproximadamente 8 meses durante la primera fase de tratamiento doble ciego fueron nuevamente aleatorizados para continuar con su dosis actual de STRATTERA (N = 81) o para recibir placebo (N = 82) bajo tratamiento doble ciego. tratamiento para la observación de la recaída. La recaída durante la fase doble ciego se definió como un aumento de la puntuación de CGI-ADHD-S de al menos 2 desde el final de la fase abierta y la puntuación total de ADHDRS-IV-Parent:Inv vuelve a ≥90 % de la puntuación de entrada al estudio para 2 visitas consecutivas. En ambas fases doble ciego, los pacientes que recibieron tratamiento continuo con STRATTERA experimentaron tiempos de recaída significativamente más largos que los que recibieron placebo.
Estudios de TDAH en adultos
La eficacia de STRATTERA en el tratamiento del TDAH se estableció en 2 estudios clínicos aleatorizados, doble ciego, controlados con placebo de pacientes adultos, mayores de 18 años, que cumplían con los criterios del DSM-IV para el TDAH.
Los signos y síntomas del TDAH se evaluaron utilizando la versión de detección de la escala de evaluación del TDAH en adultos de Conners (CAARS), una escala de 30 ítems administrada por el investigador. La principal medida de eficacia fue la puntuación total de síntomas de TDAH de 18 ítems (la suma de las subescalas de falta de atención e hiperactividad/impulsividad de CAARS) evaluada mediante una comparación del cambio medio desde el inicio hasta el final mediante un análisis por intención de tratar.
En 2 estudios de tratamiento agudo idénticos, de 10 semanas, aleatorizados, doble ciego, controlados con placebo (Estudio 5, N=280; Estudio 6, N=256), los pacientes recibieron STRATTERA 25 mg o placebo. STRATTERA se administró en una dosis dividida temprano en la mañana y al final de la tarde/primera hora de la noche y se ajustó según la respuesta clínica en un rango de 60 a 120 mg/día. La dosis final media de STRATTERA 40 mg para ambos estudios fue de aproximadamente 95 mg/día. En ambos estudios, los síntomas del TDAH mejoraron significativamente desde el punto de vista estadístico con STRATTERA, según lo medido en la puntuación de los síntomas del TDAH de la escala CAARS.
El examen de los subconjuntos de población según el sexo y la edad (
INFORMACIÓN DEL PACIENTE
STRATTERA® (Stra-TAIR-a) (atomoxetina) Cápsulas
Lea la Guía del medicamento que viene con STRATTERA® antes de que usted o su hijo comiencen a tomarlo y cada vez que renueve su receta. Es posible que haya nueva información. Esta Guía del medicamento no reemplaza la conversación con su médico sobre su tratamiento o el tratamiento de su hijo con STRATTERA.
¿Cuál es la información más importante que debo saber sobre STRATTERA 18mg?
Se ha informado lo siguiente con el uso de STRATTERA:
Los niños y adolescentes a veces piensan en el suicidio y muchos informan que intentaron quitarse la vida. Los resultados de los estudios clínicos de STRATTERA con más de 2200 niños o adolescentes con TDAH sugieren que algunos niños y adolescentes pueden tener una mayor probabilidad de tener pensamientos o acciones suicidas. Aunque no ocurrieron suicidios en estos estudios, 4 de cada 1000 pacientes desarrollaron pensamientos suicidas. Dígale al médico de su niño o adolescente si su niño o adolescente (o tiene antecedentes familiares de):
- tiene enfermedad bipolar (enfermedad maníaco-depresiva)
- tuvo pensamientos o acciones suicidas antes de comenzar con STRATTERA
La posibilidad de pensamientos y acciones suicidas puede ser mayor:
- temprano durante el tratamiento con STRATTERA 10 mg
- durante los ajustes de dosis
Prevenga los pensamientos y acciones suicidas en su niño o adolescente al:
- prestar mucha atención al estado de ánimo, comportamiento, pensamientos y sentimientos de su niño o adolescente durante el tratamiento con STRATTERA 25 mg
- mantener todas las visitas de seguimiento con el médico de su niño o adolescente según lo programado
Esté atento a los siguientes signos en su niño o adolescente durante el tratamiento con STRATTERA 25 mg:
- ansiedad
- agitación
- ataques de pánico
- problemas para dormir
- irritabilidad
- hostilidad
- agresividad
- impulsividad
- inquietud
- manía
- depresión
- pensamientos suicidas
Llame al médico de su niño o adolescente de inmediato si presenta alguno de los signos anteriores, especialmente si son nuevos, repentinos o graves. Es posible que su niño o adolescente deba ser vigilado de cerca por pensamientos y acciones suicidas o que necesite un cambio en la medicina.
STRATTERA puede causar daño hepático en algunos pacientes. Llame a su médico de inmediato si usted o su hijo tienen los siguientes signos de problemas hepáticos:
- Comezón
- dolor en la parte superior derecha del vientre
- orina oscura
- piel u ojos amarillos
- síntomas parecidos a la gripe inexplicables
- muerte súbita en pacientes que tienen problemas cardíacos o defectos cardíacos
- accidente cerebrovascular y ataque al corazón en adultos
- aumento de la presión arterial y la frecuencia cardíaca
Informe a su médico si usted o su hijo tienen problemas cardíacos, defectos cardíacos, presión arterial alta o antecedentes familiares de estos problemas. Su médico debe examinarlo a usted oa su hijo cuidadosamente para detectar problemas cardíacos antes de comenzar con STRATTERA.
Su médico debe controlar su presión arterial o la presión arterial y la frecuencia cardíaca de su hijo con regularidad durante el tratamiento con STRATTERA.
Llame a su médico de inmediato si usted o su hijo tienen signos de problemas cardíacos, como dolor en el pecho, dificultad para respirar o desmayos mientras toman STRATTERA.
- nuevos síntomas psicóticos (como escuchar voces, creer cosas que no son ciertas, sospechar) o nuevos síntomas maníacos
Llame al médico de su niño o adolescente de inmediato si tiene algún síntoma mental nuevo. porque puede ser necesario considerar el ajuste o la suspensión del tratamiento con STRATTERA 40 mg.
¿Qué es STRATTERA 18mg?
STRATTERA es un medicamento inhibidor selectivo de la recaptación de norepinefrina. Se utiliza para el tratamiento del trastorno por déficit de atención e hiperactividad (TDAH). STRATTERA puede ayudar a aumentar la atención y disminuir la impulsividad y la hiperactividad en pacientes con TDAH.
STRATTERA 10 mg debe usarse como parte de un programa de tratamiento total para el TDAH que puede incluir asesoramiento u otras terapias.
STRATTERA no se ha estudiado en niños menores de 6 años.
¿Quién no debe tomar STRATTERA?
STRATTERA no debe tomarse si usted o su hijo:
- está tomando o ha tomado en los últimos 14 días un medicamento antidepresivo llamado inhibidor de la monoaminooxidasa o IMAO. Algunos nombres de medicamentos IMAO son Nardil® (sulfato de fenelzina), Parnate® (sulfato de tranilcipromina) y Emsam® (sistema transdérmico de selegilina).
- tiene un problema ocular llamado glaucoma de ángulo estrecho
- es alérgico a cualquier cosa en STRATTERA. Consulte el final de esta Guía del medicamento para obtener una lista completa de ingredientes.
- tiene o ha tenido un tumor raro llamado feocromocitoma.
STRATTERA puede no ser adecuado para usted o su hijo. Antes de comenzar con STRATTERA, informe a su médico o al médico de su hijo sobre todas las condiciones de salud (o antecedentes familiares de) que incluyen:
- tiene o ha tenido pensamientos o acciones suicidas
- problemas cardíacos, defectos cardíacos, latido cardíaco irregular, presión arterial alta o presión arterial baja
- problemas mentales, psicosis, manía, enfermedad bipolar o depresión
- problemas hepáticos Informe a su médico si usted o su hijo están embarazadas, planean quedar embarazadas o están amamantando.
¿Se puede tomar STRATTERA con otros medicamentos?
Informe a su médico sobre todos los medicamentos que usted o su hijo toman, incluidos los medicamentos recetados y de venta libre, las vitaminas y los suplementos a base de hierbas. STRATTERA y algunos medicamentos pueden interactuar entre sí y causar efectos secundarios graves. Su médico decidirá si STRATTERA se puede tomar con otros medicamentos.
Informe especialmente a su médico si usted o su hijo toman:
- medicamentos para el asma
- medicamentos antidepresivos, incluidos los IMAO
- medicamentos para la presión arterial
- medicamentos para el resfriado o la alergia que contienen descongestionantes
Conozca los medicamentos que usted o su hijo toman. Mantenga una lista de sus medicamentos con usted para mostrársela a su médico y farmacéutico.
No empiece a tomar ningún medicamento nuevo mientras esté tomando STRATTERA sin antes hablar con su médico.
¿Cómo se debe tomar STRATTERA?
- Tome STRATTERA 40 mg exactamente según lo prescrito. STRATTERA 18 mg viene en cápsulas de diferentes dosis. Su médico puede ajustar la dosis hasta que sea adecuada para usted o su hijo.
- No mastique, triture ni abra las cápsulas. Trague las cápsulas de STRATTERA enteras con agua u otros líquidos. Informe a su médico si usted o su hijo no pueden tragar STRATTERA 10 mg enteros. Es posible que sea necesario recetarle un medicamento diferente.
- Evite tocar una cápsula rota de STRATTERA de 18 mg. Lávese las manos y las superficies que tocaron una cápsula abierta de STRATTERA de 10 mg. Si algo del polvo entra en contacto con sus ojos o los ojos de su hijo, enjuáguelos con agua de inmediato y llame a su médico.
- STRATTERA se puede tomar con o sin alimentos.
- STRATTERA 10 mg generalmente se toma una o dos veces al día. Tome STRATTERA 25 mg a la misma hora todos los días para recordar. Si olvida una dosis de STRATTERA, tómela tan pronto como lo recuerde ese día. Si se salta un día de STRATTERA 10 mg, no duplique la dosis al día siguiente. Omita el día que se saltó.
- De vez en cuando, su médico puede suspender el tratamiento con STRATTERA 25 mg por un tiempo para controlar los síntomas del TDAH.
- Es posible que su médico realice controles regulares de la sangre, el corazón y la presión arterial mientras toma STRATTERA. Se debe controlar la estatura y el peso de los niños con frecuencia mientras toman STRATTERA. El tratamiento con STRATTERA puede suspenderse si se detecta algún problema durante estos controles.
- Si usted o su hijo toman demasiado STRATTERA o tienen una sobredosis, llame a su médico o al centro de toxicología de inmediato, o busque tratamiento de emergencia.
¿Cuáles son los posibles efectos secundarios de STRATTERA?
Ver “¿Cuál es la información más importante que debo saber sobre STRATTERA 10 mg?” para obtener información sobre pensamientos y acciones suicidas informados, otros problemas mentales, daño hepático grave y problemas cardíacos.
Otros efectos secundarios graves incluyen:
- reacciones alérgicas graves (llame a su médico si tiene problemas para respirar, ve hinchazón o urticaria, o experimenta otras reacciones alérgicas)
- ralentización del crecimiento (altura y peso) en los niños
- problemas para orinar incluyendo
- problemas para iniciar o mantener un chorro de orina
- no puede vaciar completamente la vejiga
Los efectos secundarios comunes en niños y adolescentes incluyen:
- dolor de barriga
- disminucion del apetito
- náuseas o vómitos
- mareo
- cansancio
- cambios de humor
Los efectos secundarios comunes en adultos incluyen:
- estreñimiento
- boca seca
- náuseas
- disminucion del apetito
- mareo
- efectos secundarios sexuales
- problemas para orinar
Otra información para niños, adolescentes y adultos:
- En raras ocasiones se han producido erecciones que no desaparecen (priapismo) durante el tratamiento con STRATTERA. Si tiene una erección que dura más de 4 horas, busque ayuda médica de inmediato. Debido al potencial de daño duradero, incluida la posible incapacidad para tener erecciones, un médico debe evaluar el priapismo de inmediato.
- STRATTERA 10 mg puede afectar su capacidad o la capacidad de su hijo para conducir u operar maquinaria pesada. Tenga cuidado hasta que sepa cómo STRATTERA 25 mg le afecta a usted oa su hijo.
- Hable con su médico si usted o su hijo tienen efectos secundarios molestos o que no desaparecen.
Esta no es una lista completa de posibles efectos secundarios. Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar STRATTERA?
- Guarde STRATTERA en un lugar seguro a temperatura ambiente, entre 15 y 30 °C (59 y 86 °F).
- Mantenga STRATTERA 40 mg y todos los medicamentos fuera del alcance de los niños.
Información general sobre STRATTERA
A veces, los medicamentos se recetan para fines distintos a los que se enumeran en la Guía del medicamento. No use STRATTERA 25 mg para una afección para la cual no fue recetado. No le dé STRATTERA a otras personas, incluso si tienen la misma condición. Puede que les haga daño.
Esta Guía del medicamento resume la información más importante sobre STRATTERA. Si desea obtener más información, hable con su médico. Puede pedirle a su médico o farmacéutico información sobre STRATTERA escrita para profesionales de la salud. Para obtener más información sobre STRATTERA, llame al 1-800-Lilly-Rx (1-800-545-5979) o visite www.strattera.com.
¿Cuáles son los ingredientes de STRATTERA 40 mg?
Ingrediente activo: clorhidrato de atomoxetina.
Ingredientes inactivos: almidón pregelatinizado, dimeticona, gelatina, lauril sulfato de sodio, FD&CBlue No. 2, óxido de hierro amarillo sintético, dióxido de titanio, óxido de hierro rojo y tinta negra comestible.
Esta Guía del medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de EE. UU.
