Arimidex 1mg Anastrozole Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Arimidex y cómo se usa?
Arimidex 1 mg es un medicamento recetado que se usa para tratar los síntomas del cáncer de mama en mujeres posmenopáusicas. Arimidex se puede usar solo o con otros medicamentos.
Arimidex pertenece a una clase de medicamentos llamados antineoplásicos, inhibidores de la aromatasa.
No se sabe si Arimidex es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Arimidex?
Arimidex puede causar efectos secundarios graves que incluyen:
- dificultad para respirar,
- fractura de hueso,
- glándulas inflamadas,
- náuseas,
- dolor de estómago superior,
- Comezón,
- cansancio,
- pérdida de apetito,
- orina oscura,
- heces de color arcilla,
- coloración amarillenta de la piel o los ojos (ictericia),
- entumecimiento o debilidad repentinos (especialmente en un lado del cuerpo),
- dolor de cabeza repentino e intenso,
- dificultad para hablar,
- problemas con la visión o el equilibrio,
- fiebre,
- dolor de garganta,
- hinchazón en la cara o la lengua,
- ardiendo en tus ojos,
- dolor de piel, y
- erupción cutánea roja o morada que se propaga (especialmente en la cara o la parte superior del cuerpo) con ampollas y descamación
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Arimidex incluyen:
- debilidad,
- Sofocos,
- entumecimiento o sensación de hormigueo en la piel,
- hinchazón en los tobillos o los pies,
- dolor o rigidez en las articulaciones,
- problemas con los dedos al agarrar,
- dolor de garganta,
- dolor de cabeza,
- dolor de espalda,
- dolor de huesos,
- depresión,
- cambios de humor,
- problemas para dormir (insomnio),
- Alta presión sanguínea,
- dolor de cabeza intenso,
- visión borrosa,
- latidos en el cuello o las orejas,
- náuseas,
- vómitos y
- sarpullido leve
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Arimidex. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
Las tabletas de ARIMIDEX (anastrozol) para administración oral contienen 1 mg de anastrozol, un inhibidor de la aromatasa no esteroideo. Se describe químicamente como 1,3-bencenodiacetonitrilo, a, a, a', a'-tetrametil-5-(1H-1,2,4-triazol-1-ilmetilo). Su fórmula molecular es C17H19N5 y su fórmula estructural es:
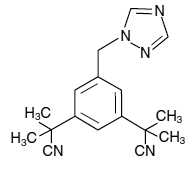
El anastrozol es un polvo blanquecino con un peso molecular de 293,4. El anastrozol tiene una solubilidad acuosa moderada (0,5 mg/ml a 25 °C); la solubilidad es independiente del pH en el rango fisiológico. El anastrozol es libremente soluble en metanol, acetona, etanol y tetrahidrofurano, y muy soluble en acetonitrilo.
Cada tableta contiene como ingredientes inactivos: lactosa, estearato de magnesio, hidroxipropilmetilcelulosa, polietilenglicol, povidona, glicolato de almidón de sodio y dióxido de titanio.
INDICACIONES
Tratamiento adyuvante
ARIMIDEX está indicado para el tratamiento adyuvante de mujeres posmenopáusicas con cáncer de mama temprano con receptor hormonal positivo.
Tratamiento de primera línea
ARIMIDEX 1 mg está indicado para el tratamiento de primera línea de mujeres posmenopáusicas con cáncer de mama localmente avanzado o metastásico con receptor hormonal positivo o receptor hormonal desconocido.
Tratamiento de segunda línea
ARIMIDEX 1 mg está indicado para el tratamiento del cáncer de mama avanzado en mujeres posmenopáusicas con progresión de la enfermedad después de la terapia con tamoxifeno. Los pacientes con enfermedad ER negativa y los pacientes que no respondieron a la terapia anterior con tamoxifeno rara vez respondieron a ARIMIDEX.
DOSIFICACIÓN Y ADMINISTRACIÓN
Dosis recomendada
La dosis de ARIMIDEX es de un comprimido de 1 mg una vez al día. Para pacientes con cáncer de mama avanzado, ARIMIDEX 1 mg debe continuarse hasta la progresión del tumor. ARIMIDEX se puede tomar con o sin alimentos.
Para el tratamiento adyuvante del cáncer de mama temprano en mujeres posmenopáusicas, se desconoce la duración óptima de la terapia. En el ensayo ATAC, se administró ARIMIDEX 1 mg durante cinco años [ver Estudios clínicos ].
No es necesario ajustar la dosis en pacientes con insuficiencia renal o en pacientes de edad avanzada [ver Uso en poblaciones específicas ].
Pacientes con insuficiencia hepática
No se recomiendan cambios en la dosis para pacientes con insuficiencia hepática de leve a moderada. ARIMIDEX no se ha estudiado en pacientes con insuficiencia hepática grave [ver Uso en poblaciones específicas ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Los comprimidos son blancos, biconvexos, recubiertos con película y contienen 1 mg de anastrozol. Las tabletas están impresas en un lado con un logotipo que consiste en una letra "A" (mayúscula) con una punta de flecha adherida al pie de la pata derecha extendida de la "A" y en el reverso con la marca de fuerza de la tableta "Adx 1 ”.
Almacenamiento y manipulación
Estos comprimidos se suministran en frascos de 30 comprimidos ( CDN 0310-0201-30).
Almacenamiento
Almacenar a temperatura ambiente controlada, 20-25°C (68-77°F) [ver USP ].
Distribuido por: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. Revisado: mayo de 2014EFECTOS SECUNDARIOS
Las reacciones adversas graves con ARIMIDEX que ocurren en menos de 1 de cada 10,000 pacientes son: 1) reacciones cutáneas como lesiones, úlceras o ampollas; 2) reacciones alérgicas con hinchazón de la cara, labios, lengua y/o garganta. Esto puede causar dificultad para tragar y/o respirar; y 3) cambios en los análisis de sangre de la función hepática, incluida la inflamación del hígado con síntomas que pueden incluir una sensación general de malestar, con o sin ictericia, dolor de hígado o inflamación del hígado.
Las reacciones adversas comunes (que ocurren con una incidencia de ≥ 10 %) en mujeres que toman ARIMIDEX 1 mg incluyen: sofocos, astenia, artritis, dolor, artralgia, hipertensión, depresión, náuseas y vómitos, sarpullido, osteoporosis, fracturas, dolor de espalda, insomnio, cefalea, dolor óseo, edema periférico, aumento de tos, disnea, faringitis y linfedema.
En el ensayo ATAC, la reacción adversa notificada con mayor frecuencia (> 0,1 %) que condujo a la interrupción del tratamiento en ambos grupos de tratamiento fueron los sofocos, aunque hubo menos pacientes que interrumpieron el tratamiento como resultado de los sofocos en el grupo de ARIMIDEX 1 mg.
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Experiencia en ensayos clínicos
Terapia adyuvante
Los datos de reacciones adversas para la terapia adyuvante se basan en el ensayo ATAC [ver Estudios clínicos ]. La mediana de duración del tratamiento adyuvante para la evaluación de seguridad fue de 59,8 meses y 59,6 meses para pacientes que recibieron ARIMIDEX 1 mg y tamoxifeno 20 mg, respectivamente.
Las reacciones adversas que ocurrieron con una incidencia de al menos el 5 % en cualquiera de los grupos de tratamiento durante el tratamiento o dentro de los 14 días posteriores al final del tratamiento se presentan en la Tabla 1.
Ciertas reacciones adversas y combinaciones de reacciones adversas se especificaron prospectivamente para el análisis, en función de las propiedades farmacológicas conocidas y los perfiles de efectos secundarios de los dos fármacos (consulte la Tabla 2).
Eventos cardiovasculares isquémicos
Entre los brazos de tratamiento en la población general de 6186 pacientes, no hubo diferencia estadística en los eventos cardiovasculares isquémicos (4 % de ARIMIDEX frente a 3 % de tamoxifeno).
En la población general, se notificó angina de pecho en 71/3092 (2,3 %) pacientes en el brazo de ARIMIDEX 1 mg y 51/3094 (1,6 %) pacientes en el brazo de tamoxifeno; se notificó infarto de miocardio en 37/3092 (1,2 %) pacientes en el brazo de ARIMIDEX 1 mg y 34/3094 (1,1 %) pacientes en el brazo de tamoxifeno.
En mujeres con cardiopatía isquémica preexistente 465/6186 (7,5 %), la incidencia de eventos cardiovasculares isquémicos fue del 17 % en pacientes con ARIMIDEX y del 10 % en pacientes con tamoxifeno. En esta población de pacientes, se notificó angina de pecho en 25/216 (11,6 %) pacientes que recibieron ARIMIDEX y 13/249 (5,2 %) pacientes que recibieron tamoxifeno; Se informó infarto de miocardio en 2/216 (0,9 %) pacientes que recibieron ARIMIDEX y 8/249 (3,2 %) pacientes que recibieron tamoxifeno.
Hallazgos de densidad mineral ósea
Los resultados del subestudio óseo del ensayo ATAC a los 12 y 24 meses demostraron que los pacientes que recibieron ARIMIDEX 1 mg tuvieron una disminución media en la densidad mineral ósea (DMO) tanto de la columna lumbar como de la cadera total en comparación con el valor inicial. Los pacientes que recibieron tamoxifeno tuvieron un aumento medio en la DMO de la columna lumbar y de la cadera total en comparación con el valor inicial.
Debido a que ARIMIDEX reduce los niveles de estrógeno circulante, puede causar una reducción en la densidad mineral ósea.
Un ensayo posterior a la comercialización evaluó los efectos combinados de ARIMIDEX 1 mg y el bisfosfonato risedronato sobre los cambios desde el inicio en la DMO y los marcadores de resorción y formación ósea en mujeres posmenopáusicas con cáncer de mama temprano positivo para receptores hormonales. Todos los pacientes recibieron suplementos de calcio y vitamina D. A los 12 meses, se observaron pequeñas reducciones en la densidad mineral ósea de la columna lumbar en pacientes que no recibieron bisfosfonatos. El tratamiento con bisfosfonatos preservó la densidad ósea en la mayoría de los pacientes con riesgo de fractura.
Las mujeres posmenopáusicas con cáncer de mama temprano programadas para recibir tratamiento con ARIMIDEX 1 mg deben controlar su estado óseo de acuerdo con las pautas de tratamiento ya disponibles para mujeres posmenopáusicas con un riesgo similar de fractura por fragilidad.
Colesterol
Durante el ensayo ATAC, se informó que más pacientes que recibieron ARIMIDEX 1 mg tenían un colesterol sérico elevado en comparación con los pacientes que recibieron tamoxifeno (9 % frente a 3,5 %, respectivamente).
Un ensayo posterior a la comercialización también evaluó cualquier efecto potencial de ARIMIDEX en el perfil de lípidos. En la población de análisis primario para lípidos (ARIMIDEX 1 mg solo), no hubo cambios clínicamente significativos en el C-LDL desde el inicio hasta los 12 meses y en el C-HDL desde el inicio hasta los 12 meses.
En la población secundaria para lípidos (ARIMIDEX+risedronato), tampoco hubo cambios clínicamente significativos en LDL-C y HDL-C desde el inicio hasta los 12 meses.
En ambas poblaciones para los lípidos, no hubo diferencias clínicamente significativas en el colesterol total (TC) o los triglicéridos séricos (TG) a los 12 meses en comparación con el valor inicial.
En este ensayo, el tratamiento durante 12 meses con ARIMIDEX 1 mg solo tuvo un efecto neutro sobre el perfil de lípidos. El tratamiento combinado con ARIMIDEX y risedronato también tuvo un efecto neutro sobre el perfil lipídico.
El ensayo proporciona evidencia de que las mujeres posmenopáusicas con cáncer de mama temprano programado para recibir tratamiento con ARIMIDEX 1 mg deben manejarse utilizando las pautas actuales del Programa Nacional de Educación sobre el Colesterol para el manejo basado en el riesgo cardiovascular de pacientes individuales con elevaciones de LDL.
Otras reacciones adversas
Los pacientes que recibieron ARIMIDEX tuvieron un aumento de los trastornos articulares (incluyendo artritis, artrosis y artralgia) en comparación con los pacientes que recibieron tamoxifeno. Los pacientes que recibieron ARIMIDEX tuvieron un aumento en la incidencia de todas las fracturas (específicamente fracturas de columna, cadera y muñeca) [315 (10%)] en comparación con los pacientes que recibieron tamoxifeno [209 (7%)].
Los pacientes que recibieron ARIMIDEX 1 mg tuvieron una mayor incidencia de síndrome del túnel carpiano [78 (2,5 %)] en comparación con los pacientes que recibieron tamoxifeno [22 (0,7 %)].
El sangrado vaginal ocurrió con más frecuencia en las pacientes tratadas con tamoxifeno que en las pacientes tratadas con ARIMIDEX, 317 (10 %) y 167 (5 %), respectivamente.
Las pacientes que recibieron ARIMIDEX tuvieron una menor incidencia de sofocos, sangrado vaginal, secreción vaginal, cáncer de endometrio, eventos tromboembólicos venosos y eventos cerebrovasculares isquémicos en comparación con las pacientes que recibieron tamoxifeno.
Resultados de seguridad de seguimiento promedio de 10 años del ensayo ATAC
Los resultados son consistentes con los análisis previos.
Las reacciones adversas graves fueron similares entre ARIMIDEX (50 %) y tamoxifeno (51 %).
- Los eventos cardiovasculares fueron consistentes con los perfiles de seguridad conocidos de ARIMIDEX y tamoxifeno.
- La incidencia acumulada de todas las primeras fracturas (tanto graves como no graves, ocurridas durante o después del tratamiento) fue mayor en el grupo de ARIMIDEX (15 %) en comparación con el grupo de tamoxifeno (11 %). Este aumento de la tasa de primera fractura durante el tratamiento no continuó en el período de seguimiento posterior al tratamiento.
- La incidencia acumulada de nuevos cánceres primarios fue similar en el grupo de ARIMIDEX 1 mg (13,7 %) en comparación con el grupo de tamoxifeno (13,9 %). De acuerdo con los análisis anteriores, el cáncer de endometrio fue mayor en el grupo de tamoxifeno (0,8 %) en comparación con el grupo de ARIMIDEX (0,2 %).
- El número total de muertes (durante o fuera del tratamiento) fue similar entre los grupos de tratamiento. Hubo más muertes relacionadas con el cáncer de mama en el grupo de tamoxifeno que en el grupo de tratamiento con ARIMIDEX 1 mg.
Terapia de primera línea
Las reacciones adversas que ocurrieron con una incidencia de al menos el 5 % en cualquiera de los grupos de tratamiento de los ensayos 0030 y 0027 durante o dentro de las 2 semanas posteriores al final del tratamiento se muestran en la Tabla 3.
Las experiencias adversas menos frecuentes informadas en pacientes que recibieron ARIMIDEX 1 mg l mg en el Ensayo 0030 o el Ensayo 0027 fueron similares a las informadas para la terapia de segunda línea.
Con base en los resultados de la terapia de segunda línea y el perfil de seguridad establecido de tamoxifeno, se analizaron estadísticamente las incidencias de 9 categorías de eventos adversos preespecificados potencialmente relacionados causalmente con una o ambas terapias debido a su farmacología. No se observaron diferencias significativas entre los grupos de tratamiento.
Terapia de segunda línea
ARIMIDEX 1 mg fue tolerado en dos ensayos clínicos controlados (es decir, los ensayos 0004 y 0005), con menos del 3,3 % de los pacientes tratados con ARIMIDEX y el 4,0 % de los pacientes tratados con acetato de megestrol que se retiraron debido a una reacción adversa.
La principal reacción adversa más común con ARIMIDEX que con el acetato de megestrol fue la diarrea. Las reacciones adversas informadas en más del 5 % de los pacientes en cualquiera de los grupos de tratamiento en estos dos ensayos clínicos controlados, independientemente de la causalidad, se presentan a continuación:
Cuerpo como un todo: síndrome gripal; fiebre; dolor de cuello; malestar; lesiones accidentales; infección
Cardiovascular: Hipertensión; tromboflebitis
Hepático: Gamma GT aumentó; SGOT aumentó; aumento de SGPT Hematológicos: Anemia; leucopenia
Metabólicas y Nutricionales: Aumento de la fosfatasa alcalina; pérdida de peso
Los niveles medios de colesterol total en suero aumentaron en 0,5 mmol/L entre los pacientes que recibieron ARIMIDEX. Se ha demostrado que los aumentos en el colesterol LDL contribuyen a estos cambios.
Musculoesquelético: Mialgia; artralgia; fractura patológica
Nervioso: Somnolencia; confusión; insomnio; ansiedad; nerviosismo
Respiratorio: Sinusitis; bronquitis; rinitis
Piel y apéndices: Adelgazamiento del cabello (alopecia); prurito
urogenitales: Infección del tracto urinario; dolor en los senos
Se analizaron estadísticamente las incidencias de los siguientes grupos de reacciones adversas potencialmente relacionadas causalmente con una o ambas terapias debido a su farmacología: aumento de peso, edema, enfermedad tromboembólica, trastornos gastrointestinales, sofocos y sequedad vaginal. Estos seis grupos y las reacciones adversas capturadas en los grupos se definieron prospectivamente. Los resultados se muestran en la tabla de abajo.
Experiencia posterior a la comercialización
Estas reacciones adversas son notificadas voluntariamente por una población de tamaño incierto. Por tanto, no siempre es posible estimar de forma fiable su frecuencia o establecer una relación causal con la exposición al fármaco. Se ha informado lo siguiente en el uso posterior a la aprobación de Arimidex:
- Eventos hepatobiliares que incluyen aumentos en la fosfatasa alcalina, alanina aminotransferasa, aspartato aminotransferasa, gamma-GT y bilirrubina; hepatitis
- Erupción incluyendo casos de trastornos mucocutáneos como eritema multiforme y síndrome de Stevens-Johnson
- Casos de reacciones alérgicas que incluyen angioedema, urticaria y anafilaxia [ver CONTRAINDICACIONES ]
- Mialgia, dedo en gatillo e hipercalcemia (con o sin aumento de la hormona paratiroidea)
INTERACCIONES CON LA DROGAS
tamoxifeno
La coadministración de anastrozol y tamoxifeno en pacientes con cáncer de mama redujo la concentración plasmática de anastrozol en un 27 %. Sin embargo, la administración conjunta de anastrozol y tamoxifeno no afectó la farmacocinética de tamoxifeno o N-desmetiltamoxifeno. En una mediana de seguimiento de 33 meses, la combinación de ARIMIDEX y tamoxifeno no demostró ningún beneficio de eficacia en comparación con el tamoxifeno en todos los pacientes, así como en la subpoblación con receptores hormonales positivos. Este brazo de tratamiento se suspendió del ensayo [ver Estudios clínicos ]. Según los resultados clínicos y farmacocinéticos del ensayo ATAC, el tamoxifeno no debe administrarse con anastrozol.
Estrógeno
Las terapias que contienen estrógenos no deben usarse con ARIMIDEX 1 mg ya que pueden disminuir su acción farmacológica.
warfarina
En un estudio realizado en 16 voluntarios varones, el anastrozol no alteró la exposición (medida por C max y AUC) ni la actividad anticoagulante (medida por el tiempo de protrombina, el tiempo de tromboplastina parcial activada y el tiempo de trombina) tanto de R- como de S-. warfarina
Citocromo P450 Según los resultados in vitro e in vivo, es poco probable que la administración concomitante de ARIMIDEX 1 mg afecte a otros fármacos como resultado de la inhibición del citocromo P450 [ver FARMACOLOGÍA CLÍNICA ].
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Eventos cardiovasculares isquémicos
En mujeres con cardiopatía isquémica preexistente, se observó una mayor incidencia de eventos cardiovasculares isquémicos con ARIMIDEX en el ensayo ATAC (17 % de las pacientes con ARIMIDEX 1 mg y 10 % de las pacientes con tamoxifeno). Considere los riesgos y beneficios de la terapia con ARIMIDEX en pacientes con cardiopatía isquémica preexistente [ver REACCIONES ADVERSAS ]
Efectos óseos
Los resultados del subestudio óseo del ensayo ATAC a los 12 y 24 meses demostraron que los pacientes que recibieron ARIMIDEX tuvieron una disminución media en la densidad mineral ósea (DMO) tanto de la columna lumbar como de la cadera total en comparación con el valor inicial. Los pacientes que recibieron tamoxifeno tuvieron un aumento medio en la DMO de la columna lumbar y de la cadera total en comparación con el valor inicial. Considere el monitoreo de la densidad mineral ósea en pacientes tratados con ARIMIDEX [ver REACCIONES ADVERSAS ].
Colesterol
Durante el ensayo ATAC, se informó que más pacientes que recibieron ARIMIDEX 1 mg tenían colesterol sérico elevado en comparación con los pacientes que recibieron tamoxifeno (9 % versus 3,5 %, respectivamente) [ver REACCIONES ADVERSAS ].
Información de asesoramiento para pacientes
Ver Etiquetado del paciente aprobado por la FDA (INFORMACIÓN DEL PACIENTE).
El embarazo
Se debe advertir a los pacientes que ARIMIDEX 1 mg puede causar daño fetal. También se les debe informar que ARIMIDEX 1 mg no es para uso en mujeres premenopáusicas; por lo tanto, si quedan embarazadas, deben dejar de tomar ARIMIDEX y comunicarse inmediatamente con su médico.
Reacciones alérgicas (hipersensibilidad)
Se debe informar a los pacientes de la posibilidad de reacciones alérgicas graves con hinchazón de la cara, labios, lengua y/o garganta (angioedema) que pueden causar dificultad para tragar y/o respirar y que busquen atención médica de inmediato.
Eventos cardiovasculares isquémicos
Se debe informar a los pacientes con cardiopatía isquémica preexistente que se ha observado una mayor incidencia de eventos cardiovasculares con el uso de 1 mg de ARIMIDEX en comparación con el uso de tamoxifeno. Si los pacientes tienen dolor torácico nuevo o que empeora o dificultad para respirar, deben buscar atención médica de inmediato.
Efectos óseos
Se debe informar a los pacientes que ARIMIDEX reduce el nivel de estrógeno. Esto puede conducir a una pérdida del contenido mineral de los huesos, lo que podría disminuir la fortaleza ósea. Una posible consecuencia de la disminución del contenido mineral de los huesos es un aumento del riesgo de fracturas.
Colesterol
Se debe informar a los pacientes que se puede observar un aumento en el nivel de colesterol mientras reciben ARIMIDEX.
Cosquillas, hormigueo o entumecimiento
Se debe informar a los pacientes que si experimentan cosquilleo, hormigueo o entumecimiento, deben informar a su proveedor de atención médica.
tamoxifeno
Se debe advertir a los pacientes que no tomen ARIMIDEX con tamoxifeno.
Dosis olvidadas
Informe a los pacientes que si olvidan una dosis, tómela tan pronto como lo recuerden. Si es casi la hora de su próxima dosis, omita la dosis olvidada y tome la siguiente dosis programada regularmente. Los pacientes no deben tomar dos dosis al mismo tiempo.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Un estudio de carcinogénesis convencional en ratas a dosis de 1,0 a 25 mg/kg/día (alrededor de 10 a 243 veces la dosis diaria máxima recomendada en humanos en mg/m²) administrada por sonda oral durante hasta 2 años reveló un aumento en la incidencia de adenoma y carcinoma hepatocelular y pólipos del estroma uterino en mujeres y adenoma tiroideo en hombres a la dosis alta. Se observó un aumento relacionado con la dosis en la incidencia de hiperplasia ovárica y uterina en mujeres. Con 25 mg/kg/día, los niveles plasmáticos de AUC0-24 h en ratas fueron de 110 a 125 veces más altos que el nivel exhibido en voluntarias posmenopáusicas a la dosis recomendada. Un estudio de carcinogenicidad por separado en ratones con dosis orales de 5 a 50 mg/kg/día (alrededor de 24 a 243 veces la dosis máxima diaria recomendada en humanos en mg/m²) durante hasta 2 años produjo un aumento en la incidencia de enfermedades benignas. tumores del estroma ovárico, epiteliales y de células de la granulosa en todos los niveles de dosis. También se observó un aumento relacionado con la dosis en la incidencia de hiperplasia ovárica en ratones hembra. Estos cambios ováricos se consideran efectos específicos de roedores de la inhibición de la aromatasa y tienen una importancia cuestionable para los seres humanos. La incidencia de linfosarcoma aumentó en hombres y mujeres con la dosis alta. A 50 mg/kg/día, los niveles de AUC en plasma en ratones fueron de 35 a 40 veces más altos que el nivel exhibido en voluntarias posmenopáusicas a la dosis recomendada.
No se ha demostrado que ARIMIDEX 1 mg sea mutagénico en pruebas in vitro (pruebas bacterianas Ames y E. coli, ensayo de mutación del gen CHO-K1) o clastogénico ya sea in vitro (aberraciones cromosómicas en linfocitos humanos) o in vivo (prueba de micronúcleo en ratas) .
La administración oral de anastrozol a ratas hembra (desde 2 semanas antes del apareamiento hasta el día 7 de embarazo) produjo una incidencia significativa de infertilidad y un número reducido de embarazos viables a 1 mg/kg/día (alrededor de 10 veces la dosis humana recomendada en mg/m²). y 9 veces mayor que el AUC0-24 h encontrado en voluntarias posmenopáusicas a la dosis recomendada). La pérdida de óvulos o fetos antes de la implantación aumentó con dosis iguales o superiores a 0,02 mg/kg/día (alrededor de una quinta parte de la dosis humana recomendada en base a mg/m²). Se observó recuperación de la fertilidad después de un período de 5 semanas sin dosificación que siguió a 3 semanas de dosificación. No se sabe si estos efectos observados en ratas hembra son indicativos de problemas de fertilidad en humanos.
Estudios de dosis múltiples en ratas a las que se les administró anastrozol durante 6 meses en dosis iguales o superiores a 1 mg/kg/día (lo que produjo anastrozol en plasma Cssmax y AUC 0-24 h que fueron 19 y 9 veces mayores que los valores respectivos encontrados en pacientes posmenopáusicas). voluntarias a la dosis recomendada) resultó en hipertrofia de los ovarios y la presencia de quistes foliculares. Además, se observaron úteros hiperplásicos en estudios de 6 meses en perras a las que se les administró dosis iguales o superiores a 1 mg/kg/día (que produjeron anastrozol en plasma Cssmax y AUC0-24 hr que fueron 22 veces y 16 veces más altas que las respectivas valores encontrados en mujeres posmenopáusicas a la dosis recomendada). No se sabe si estos efectos sobre los órganos reproductivos de los animales están asociados con problemas de fertilidad en mujeres premenopáusicas.
Uso en poblaciones específicas
El embarazo
Embarazo Categoría X [ver CONTRAINDICACIONES ]
ARIMIDEX puede causar daño fetal cuando se administra a una mujer embarazada y no ofrece ningún beneficio clínico a las mujeres premenopáusicas con cáncer de mama. ARIMIDEX está contraindicado en mujeres que están o pueden quedar embarazadas. En estudios con animales, el anastrozol causó fallas en el embarazo, aumento de las pérdidas de embarazo y signos de retraso en el desarrollo fetal. No existen estudios sobre el uso de ARIMIDEX 1 mg en mujeres embarazadas. Si se usa ARIMIDEX 1 mg durante el embarazo, o si la paciente queda embarazada mientras recibe este medicamento, se debe informar a la paciente sobre el peligro potencial para el feto y el riesgo potencial de pérdida del embarazo.
En estudios de reproducción en animales, ratas y conejas preñadas recibieron anastrozol durante la organogénesis en dosis iguales o superiores a 1 (ratas) y 1/3 (conejos) de la dosis humana recomendada en mg/m². En ambas especies, el anastrozol atravesó la placenta y hubo un aumento de las pérdidas de embarazo (aumento de las pérdidas antes y/o después de la implantación, aumento de la reabsorción y disminución del número de fetos vivos). En ratas, estos efectos estuvieron relacionados con la dosis y el peso de la placenta aumentó significativamente. Se produjo fetotoxicidad, incluido el retraso en el desarrollo fetal (es decir, osificación incompleta y peso corporal fetal reducido), en ratas con dosis de anastrozol que produjeron niveles plasmáticos máximos 19 veces más altos que los niveles séricos en humanos con la dosis terapéutica (AUC 0-24 horas 9 veces más alto) . En conejos, el anastrozol causó fallas en el embarazo a dosis iguales o superiores a 16 veces la dosis humana recomendada en mg/m² [ver Toxicología y/o Farmacología Animal ].
Madres lactantes
No se sabe si el anastrozol se excreta en la leche humana. Debido a que muchos fármacos se excretan en la leche humana y a la tumorigenicidad demostrada para el anastrozol en estudios con animales, o al potencial de reacciones adversas graves en los lactantes, se debe tomar la decisión de interrumpir la lactancia o interrumpir el fármaco, teniendo en cuenta la Importancia del fármaco para la madre.
Uso pediátrico
Los estudios clínicos en pacientes pediátricos incluyeron un ensayo controlado con placebo en niños púberes de edad adolescente con ginecomastia y un ensayo de un solo grupo en niñas con síndrome de McCune-Albright y pubertad precoz progresiva. No se ha demostrado la eficacia de ARIMIDEX 1 mg en el tratamiento de la ginecomastia puberal en varones adolescentes y en el tratamiento de la pubertad precoz en niñas con síndrome de McCune-Albright.
Estudio de Ginecomastia
Un estudio multicéntrico, aleatorizado, doble ciego, controlado con placebo inscribió a 80 niños con ginecomastia puberal de 11 a 18 años. Los pacientes fueron aleatorizados a un régimen diario de ARIMIDEX 1 mg o placebo. Después de 6 meses de tratamiento, no hubo diferencias estadísticamente significativas en el porcentaje de pacientes que experimentaron una reducción de ≥ 50 % en la ginecomastia (análisis de eficacia principal). Los análisis secundarios de eficacia (cambio absoluto en el volumen mamario, porcentaje de pacientes que tuvieron alguna reducción en el volumen calculado de ginecomastia, resolución del dolor mamario) fueron consistentes con el análisis primario de eficacia. Las concentraciones séricas de estradiol en el mes 6 de tratamiento se redujeron en un 15,4 % en el grupo de ARIMIDEX y en un 4,5 % en el grupo de placebo.
Las reacciones adversas que los investigadores evaluaron como relacionadas con el tratamiento ocurrieron en el 16,3 % de los pacientes tratados con ARIMIDEX y en el 8,1 % de los pacientes tratados con placebo, siendo las más frecuentes acné (7 % con ARIMIDEX y 2,7 % con placebo) y dolor de cabeza (7 % ARIMIDEX 1mg y 0% placebo); todas las demás reacciones adversas mostraron pequeñas diferencias entre los grupos de tratamiento. Un paciente tratado con ARIMIDEX 1 mg interrumpió el ensayo debido a agrandamiento testicular. El cambio medio sustraído del valor inicial en el volumen testicular después de 6 meses de tratamiento fue de + 6,6 ± 7,9 cm³ en los pacientes tratados con ARIMIDEX y de + 5,2 ± 8,0 cm³ en el grupo de placebo.
Estudio del síndrome de McCune-Albright
Se realizó un estudio multicéntrico, abierto, de un solo brazo, en 28 niñas con síndrome de McCune-Albright y pubertad precoz progresiva de 2 a
Cinco pacientes (18%) experimentaron reacciones adversas que se consideraron posiblemente relacionadas con ARIMIDEX. Estos fueron náuseas, acné, dolor en una extremidad, aumento de la alanina transaminasa y aspartato transaminasa y dermatitis alérgica.
Farmacocinética en pacientes pediátricos
Después de la administración múltiple de 1 mg una vez al día en pacientes pediátricos, el tiempo medio para alcanzar la concentración máxima de anastrozol fue de 1 hora. Los parámetros de disposición medios (rango) de anastrozol en pacientes pediátricos fueron descritos por un CL/F de 1,54 L/h (0,77-4,53 L/h) y V/F de 98,4 L (50,7-330,0 L). La vida media de eliminación terminal fue de 46,8 h, similar a la observada en mujeres posmenopáusicas tratadas con anastrozol por cáncer de mama. Según un análisis farmacocinético poblacional, la farmacocinética de anastrozol fue similar en niños con ginecomastia puberal y niñas con síndrome de McCune-Albright.
Uso geriátrico
En los estudios 0030 y 0027, alrededor del 50 % de los pacientes tenían 65 años o más. Los pacientes ≥ 65 años tuvieron una respuesta tumoral y un tiempo hasta la progresión del tumor moderadamente mejores que los pacientes
En el estudio ATAC, el 45 % de los pacientes tenían 65 años o más. La eficacia de ARIMIDEX 1 mg en comparación con tamoxifeno en pacientes de 65 años o más (N=1413 para ARIMIDEX y N=1410 para tamoxifeno, el cociente de riesgos instantáneos para la supervivencia libre de enfermedad fue de 0,93 [IC del 95 %: 0,80, 1,08]) fue menor que la eficacia observada en pacientes menores de 65 años (N=1712 para ARIMIDEX y N=1706 para tamoxifeno, el cociente de riesgos instantáneos para la supervivencia libre de enfermedad fue 0,79 [IC del 95 %: 0,67, 0,94]).
La farmacocinética de anastrozol no se ve afectada por la edad.
Insuficiencia renal
Dado que solo alrededor del 10% del anastrozol se excreta sin cambios en la orina, la insuficiencia renal no influye en el aclaramiento corporal total. No es necesario ajustar la dosis en pacientes con insuficiencia renal [ver DOSIFICACIÓN Y ADMINISTRACIÓN y FARMACOLOGÍA CLÍNICA ].
Deterioro hepático
Las concentraciones de anastrozol en plasma en los sujetos con cirrosis hepática estuvieron dentro del rango de concentraciones observadas en sujetos normales en todos los ensayos clínicos. Por lo tanto, tampoco es necesario ajustar la dosis en pacientes con cirrosis hepática estable. ARIMIDEX no se ha estudiado en pacientes con insuficiencia hepática grave [ver DOSIFICACIÓN Y ADMINISTRACIÓN y FARMACOLOGÍA CLÍNICA ].
SOBREDOSIS
Se han realizado ensayos clínicos con ARIMIDEX, hasta 60 mg en una dosis única administrada a voluntarios masculinos sanos y hasta 10 mg diarios administrados a mujeres posmenopáusicas con cáncer de mama avanzado; estas dosis fueron toleradas. No se ha establecido una dosis única de ARIMIDEX de 1 mg que provoque síntomas potencialmente mortales. No existe un antídoto específico para la sobredosis y el tratamiento debe ser sintomático. En el manejo de una sobredosis, considere que se pueden haber tomado múltiples agentes. Se puede inducir el vómito si el paciente está alerta. La diálisis puede ser útil porque ARIMIDEX no se une mucho a las proteínas. Está indicada la atención de apoyo general, incluida la monitorización frecuente de los signos vitales y la observación estrecha del paciente.
CONTRAINDICACIONES
Embarazo y mujeres premenopáusicas
ARIMIDEX 1 mg puede causar daño fetal cuando se administra a una mujer embarazada y no ofrece ningún beneficio clínico a las mujeres premenopáusicas con cáncer de mama. ARIMIDEX 1 mg está contraindicado en mujeres que están o pueden quedar embarazadas. No existen estudios adecuados y bien controlados en mujeres embarazadas que utilicen ARIMIDEX. Si se usa ARIMIDEX 1 mg durante el embarazo, o si la paciente queda embarazada mientras toma este medicamento, se debe informar a la paciente sobre el peligro potencial para el feto o el riesgo potencial de pérdida del embarazo [ver Uso en poblaciones específicas ].
Hipersensibilidad
ARIMIDEX 1 mg está contraindicado en cualquier paciente que haya mostrado una reacción de hipersensibilidad al fármaco oa alguno de los excipientes. Las reacciones observadas incluyen anafilaxia, angioedema y urticaria [ver REACCIONES ADVERSAS ]
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
Los estrógenos estimulan o mantienen el crecimiento de muchos cánceres de mama.
En las mujeres posmenopáusicas, los estrógenos se derivan principalmente de la acción de la enzima aromatasa, que convierte los andrógenos suprarrenales (principalmente androstenediona y testosterona) en estrona y estradiol. Por lo tanto, la supresión de la biosíntesis de estrógenos en los tejidos periféricos y en el propio tejido canceroso puede lograrse mediante la inhibición específica de la enzima aromatasa.
El anastrozol es un inhibidor selectivo de la aromatasa no esteroideo. Reduce significativamente las concentraciones séricas de estradiol y no tiene un efecto detectable sobre la formación de corticosteroides suprarrenales o aldosterona.
Farmacodinámica
Efecto sobre el estradiol
Las concentraciones séricas medias de estradiol se evaluaron en ensayos de dosificación diaria múltiple con 0,5, 1, 3, 5 y 10 mg de ARIMIDEX en mujeres posmenopáusicas con cáncer de mama avanzado. Se observó una supresión clínicamente significativa del estradiol sérico con todas las dosis. Las dosis de 1 mg y superiores dieron como resultado la supresión de las concentraciones séricas medias de estradiol hasta el límite inferior de detección (3,7 pmol/L). La dosis diaria recomendada, ARIMIDEX 1 mg, redujo el estradiol en aproximadamente un 70 % dentro de las 24 horas y en aproximadamente un 80 % después de 14 días de dosificación diaria. La supresión del estradiol sérico se mantuvo hasta 6 días después de suspender la dosificación diaria con ARIMIDEX 1 mg.
No se ha estudiado el efecto de ARIMIDEX 1 mg en mujeres premenopáusicas con cáncer de mama temprano o avanzado. Debido a que la aromatización de los andrógenos suprarrenales no es una fuente significativa de estradiol en mujeres premenopáusicas, no se esperaría que ARIMIDEX reduzca los niveles de estradiol en mujeres premenopáusicas.
Efecto sobre los corticosteroides
En ensayos de dosis diarias múltiples con 3, 5 y 10 mg, la selectividad de anastrozol se evaluó examinando los efectos sobre la síntesis de corticosteroides. Para todas las dosis, el anastrozol no afectó la secreción de cortisol o aldosterona al inicio o en respuesta a la ACTH. No es necesaria una terapia de reemplazo de glucocorticoides o mineralocorticoides con anastrozol.
Otros efectos endocrinos
En ensayos de dosificación diaria múltiple con 5 y 10 mg, se midió la hormona estimulante de la tiroides (TSH); no hubo aumento de TSH durante la administración de ARIMIDEX. ARIMIDEX no posee actividad progestágena, androgénica o estrogénica directa en animales, pero perturba los niveles circulantes de progesterona, andrógenos y estrógenos.
Farmacocinética
Absorción
La inhibición de la actividad de la aromatasa se debe principalmente al anastrozol, el fármaco original. La absorción de anastrozol es rápida y las concentraciones plasmáticas máximas generalmente ocurren dentro de las 2 horas posteriores a la administración en ayunas. Los estudios con fármacos radiomarcados han demostrado que el anastrozol administrado por vía oral se absorbe bien en la circulación sistémica. Los alimentos reducen la velocidad, pero no el grado total de absorción de anastrozol. La Cmax media de anastrozol disminuyó en un 16 % y la mediana de Tmax se retrasó de 2 a 5 horas cuando se administró anastrozol 30 minutos después de la comida. La farmacocinética de anastrozol es lineal en el rango de dosis de 1 a 20 mg y no cambia con dosis repetidas. La farmacocinética de anastrozol fue similar en pacientes y voluntarios sanos.
Distribución
Los niveles plasmáticos en estado estacionario son aproximadamente de 3 a 4 veces más altos que los niveles observados después de una dosis única de ARIMIDEX. Las concentraciones plasmáticas se aproximan a los niveles de estado estacionario aproximadamente a los 7 días de una dosis diaria. El anastrozol se une en un 40% a las proteínas plasmáticas en el rango terapéutico.
Metabolismo
El metabolismo de anastrozol ocurre por N-desalquilación, hidroxilación y glucuronidación. Se han identificado tres metabolitos de anastrozol (triazol, un conjugado de glucurónido de hidroxianastrozol y un conjugado de glucurónido del propio anastrozol) en el plasma y la orina humanos. El principal metabolito circulante de anastrozol, triazol, carece de actividad farmacológica.
Anastrozol inhibió las reacciones catalizadas por el citocromo P450 1A2, 2C8/9 y 3A4 in vitro con valores de Ki que fueron aproximadamente 30 veces más altos que los valores medios de Cmax en estado estacionario observados después de una dosis diaria de 1 mg. Anastrozol no tuvo efecto inhibitorio sobre las reacciones catalizadas por el citocromo P450 2A6 o 2D6 in vitro. La administración de una sola dosis de 30 mg/kg o dosis múltiples de 10 mg/kg de anastrozol a sujetos sanos no tuvo efecto sobre el aclaramiento de antipirina o la recuperación urinaria de los metabolitos de antipirina.
Excreción
El ochenta y cinco por ciento del anastrozol radiomarcado se recuperó en heces y orina. El metabolismo hepático representa aproximadamente el 85% de la eliminación de anastrozol. La eliminación renal representa aproximadamente el 10% del aclaramiento total. La vida media de eliminación promedio de anastrozol es de 50 horas.
Efecto del género y la edad
Se ha investigado la farmacocinética de anastrozol en voluntarias posmenopáusicas y pacientes con cáncer de mama. No se observaron efectos relacionados con la edad en el rango de 80 años.
Efecto de la raza
Los niveles séricos de estradiol y sulfato de estrona fueron similares entre las mujeres posmenopáusicas japonesas y caucásicas que recibieron 1 mg de anastrozol al día durante 16 días. Las concentraciones plasmáticas mínimas medias de anastrozol en estado estacionario en mujeres posmenopáusicas caucásicas y japonesas fueron de 25,7 y 30,4 ng/ml, respectivamente.
Efecto de la insuficiencia renal
Se ha investigado la farmacocinética de anastrozol en sujetos con insuficiencia renal. El aclaramiento renal de anastrozol disminuyó proporcionalmente con el aclaramiento de creatinina y fue aproximadamente un 50 % más bajo en voluntarios con insuficiencia renal grave (aclaramiento de creatinina DOSIFICACIÓN Y ADMINISTRACIÓN y Uso en poblaciones específicas ].
Efecto de la insuficiencia hepática
Se ha investigado la farmacocinética de anastrozol en sujetos con cirrosis hepática relacionada con el abuso de alcohol. El aclaramiento oral aparente (CL/F) de anastrozol fue aproximadamente un 30 % más bajo en sujetos con cirrosis hepática estable que en sujetos control con función hepática normal. Sin embargo, estas concentraciones plasmáticas aún se encontraban dentro del rango de valores observados en sujetos normales. No se estudió el efecto de la insuficiencia hepática grave. No es necesario ajustar la dosis para la cirrosis hepática estable [ver DOSIFICACIÓN Y ADMINISTRACIÓN y Uso en poblaciones específicas ].
Toxicología Animal Y/o Farmacología
Toxicología Reproductiva
Se ha encontrado que el anastrozol atraviesa la placenta después de la administración oral de 0,1 mg/kg en ratas y conejos (alrededor de 1 y 1,9 veces la dosis humana recomendada, respectivamente, sobre una base de mg/m²). Estudios en ratas y conejos a dosis iguales o superiores a 0,1 y 0,02 mg/kg/día, respectivamente (alrededor de 1 y 1/3, respectivamente, de la dosis humana recomendada en mg/m²), administrados durante el período de la organogénesis mostró que el anastrozol aumentaba las pérdidas de embarazo (aumento de pérdidas antes y/o después de la implantación, aumento de la reabsorción y disminución del número de fetos vivos); los efectos estaban relacionados con la dosis en ratas. El peso de la placenta aumentó significativamente en ratas con dosis de 0,1 mg/kg/día o más.
Se observó evidencia de fetotoxicidad, incluyendo retraso en el desarrollo fetal (es decir, osificación incompleta y peso corporal fetal reducido), en ratas a las que se les administró dosis de 1 mg/kg/día (que produjeron anastrozol en plasma Cssmax y AUC 0-24 h que fueron 19 veces y 9 veces mayor que los valores respectivos encontrados en voluntarias posmenopáusicas a la dosis recomendada). No hubo evidencia de teratogenicidad en ratas a las que se administraron dosis de hasta 1,0 mg/kg/día. En conejos, el anastrozol causó fallas en el embarazo a dosis iguales o superiores a 1,0 mg/kg/día (alrededor de 16 veces la dosis humana recomendada en base a mg/m²); no hubo evidencia de teratogenicidad en conejos a los que se administró 0,2 mg/kg/día (alrededor de 3 veces la dosis humana recomendada en base a mg/m²).
Estudios clínicos
Tratamiento adyuvante del cáncer de mama en mujeres posmenopáusicas
Un ensayo multicéntrico, doble ciego (ATAC) asignó al azar a 9366 mujeres posmenopáusicas con cáncer de mama operable al tratamiento adyuvante con ARIMIDEX 1 mg al día, tamoxifeno 20 mg al día o una combinación de los dos tratamientos durante cinco años o hasta la recurrencia de la enfermedad.
El criterio principal de valoración del ensayo fue la supervivencia libre de enfermedad (es decir, el tiempo transcurrido hasta la aparición de una recurrencia distante o local, o cáncer de mama contralateral o muerte por cualquier causa). Los criterios de valoración secundarios del ensayo incluyeron la supervivencia libre de enfermedad a distancia, la incidencia de cáncer de mama contralateral y la supervivencia global. En una mediana de seguimiento de 33 meses, la combinación de ARIMIDEX y tamoxifeno no demostró ningún beneficio de eficacia en comparación con el tamoxifeno en todos los pacientes, así como en la subpoblación con receptores hormonales positivos. Este brazo de tratamiento se suspendió del ensayo. Según los resultados clínicos y farmacocinéticos del ensayo ATAC, no se debe administrar tamoxifeno con anastrozol [ver INTERACCIONES CON LA DROGAS ].
Las características demográficas y otras características iniciales fueron similares entre los tres grupos de tratamiento (consulte la Tabla 7).
Los pacientes en los dos brazos de monoterapia del ensayo ATAC fueron tratados durante una mediana de 60 meses (5 años) y seguidos durante una mediana de 68 meses. La supervivencia libre de enfermedad en la población por intención de tratar mejoró de forma estadísticamente significativa [Hazard Ratio (HR) = 0,87, IC del 95 %: 0,78, 0,97, p = 0,0127] en el brazo de ARIMIDEX en comparación con el brazo de tamoxifeno. En la subpoblación con receptores hormonales positivos que representa aproximadamente el 84 % de los pacientes del ensayo, la supervivencia libre de enfermedad también mejoró significativamente desde el punto de vista estadístico (HR = 0,83, IC del 95 %: 0,73, 0,94, p = 0,0049) en el grupo de ARIMIDEX 1 mg en comparación con el brazo de tamoxifeno.
Figura 1: Supervivencia libre de enfermedad Curva de supervivencia de Kaplan Meier para todos los pacientes asignados al azar a ARIMIDEX 1 mg o monoterapia con tamoxifeno en el ensayo ATAC (por intención de tratar) 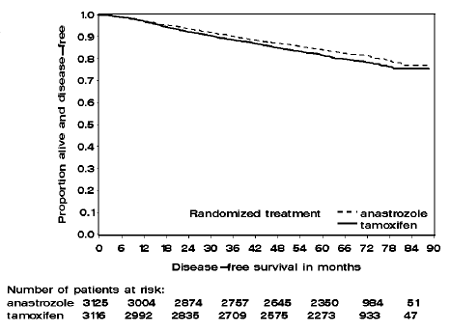
Figura 2: Supervivencia libre de enfermedad para la subpoblación con receptores hormonales positivos de pacientes asignados al azar a monoterapia con ARIMIDEX o tamoxifeno en el ensayo ATAC 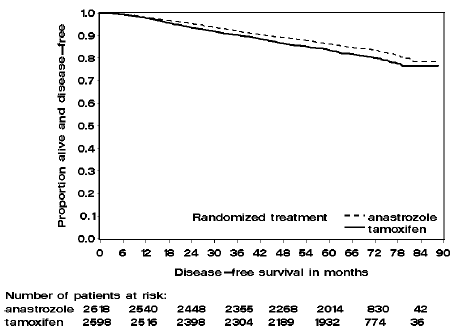
Los datos de supervivencia con un seguimiento de 68 meses se presentan en la Tabla 9.
En el grupo de pacientes que habían recibido quimioterapia adyuvante previa (N=698 para ARIMIDEX 1 mg y N=647 para tamoxifeno), el cociente de riesgos instantáneos para la supervivencia libre de enfermedad fue de 0,91 (IC del 95 %: 0,73 a 1,13) en el brazo de ARIMIDEX en comparación con el brazo de tamoxifeno.
La frecuencia de los eventos individuales en la población por intención de tratar y la subpoblación con receptores hormonales positivos se describen en la Tabla 8.
En la Tabla 9 se proporciona un resumen de los resultados de eficacia del estudio.
Mediana de 10 años de seguimiento Resultados de eficacia del ensayo ATAC
En un análisis posterior del ensayo ATAC, se siguió a los pacientes en los dos brazos de monoterapia durante una mediana de 120 meses (10 años). Los pacientes recibieron el tratamiento del estudio durante una mediana de 60 meses (5 años) (ver Tabla 10).
Figura 3: Supervivencia libre de enfermedad Curva de supervivencia de Kaplan Meier para todos los pacientes asignados al azar a monoterapia con ARIMIDEX o tamoxifeno en el ensayo ATAC (intención de tratar)a 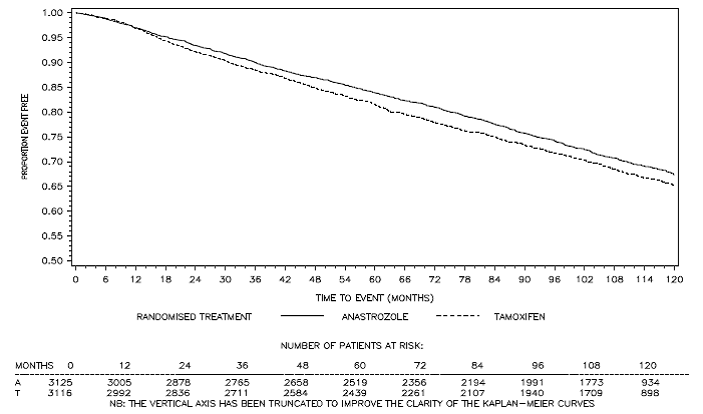
a La proporción de pacientes con seguimiento de 120 meses fue del 29,4%.
Figura 4: Supervivencia libre de enfermedad para la subpoblación con receptores hormonales positivos de pacientes asignados al azar a ARIMIDEX 1 mg o monoterapia con tamoxifeno en el ensayo ATACb 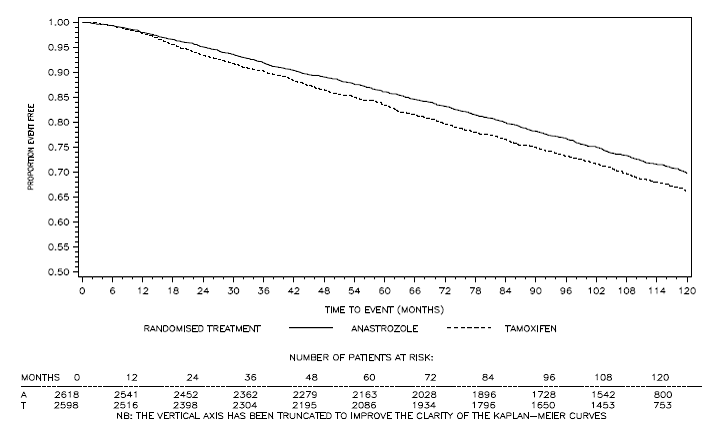
bLa proporción de pacientes con 120 meses de seguimiento fue del 29,8%.
Terapia de primera línea en mujeres posmenopáusicas con cáncer de mama avanzado
Se realizaron dos estudios clínicos controlados doble ciego de diseño similar (0030, un estudio norteamericano y 0027, un estudio predominantemente europeo) para evaluar la eficacia de ARIMIDEX 1 mg en comparación con tamoxifeno como terapia de primera línea para el receptor hormonal positivo o el receptor hormonal positivo. cáncer de mama metastásico o localmente avanzado desconocido en mujeres posmenopáusicas. Un total de 1021 pacientes entre 30 y 92 años de edad fueron aleatorizados para recibir tratamiento de prueba. Los pacientes fueron aleatorizados para recibir 1 mg de ARIMIDEX 1 mg una vez al día o 20 mg de tamoxifeno una vez al día. Los criterios de valoración primarios para ambos ensayos fueron el tiempo hasta la progresión del tumor, la tasa de respuesta objetiva del tumor y la seguridad.
Las características demográficas y otras características iniciales, incluidos los pacientes que tenían enfermedad medible y no medible, los pacientes que recibieron terapia adyuvante previa, el sitio de la enfermedad metastásica y el origen étnico fueron similares para los dos grupos de tratamiento en ambos ensayos. La siguiente tabla resume el estado de los receptores hormonales al ingreso de todos los pacientes aleatorizados en los ensayos 0030 y 0027.
Para los criterios de valoración primarios, el ensayo 0030 mostró que ARIMIDEX tuvo una ventaja estadísticamente significativa sobre el tamoxifeno (p=0,006) en cuanto al tiempo hasta la progresión del tumor; las tasas de respuesta objetiva del tumor fueron similares para ARIMIDEX 1 mg y tamoxifeno. El ensayo 0027 mostró que ARIMIDEX 1 mg y tamoxifeno tenían tasas de respuesta tumoral objetiva y tiempo hasta la progresión tumoral similares (consulte la Tabla 12 y las Figuras 5 y 6).
La Tabla 12 a continuación resume los resultados del ensayo 0030 y el ensayo 0027 para los criterios de valoración principales de eficacia.
Figura 5: Probabilidad de Kaplan-Meier del tiempo hasta la progresión de la enfermedad para todos los pacientes aleatorizados (intención de tratar) en el Ensayo 0030 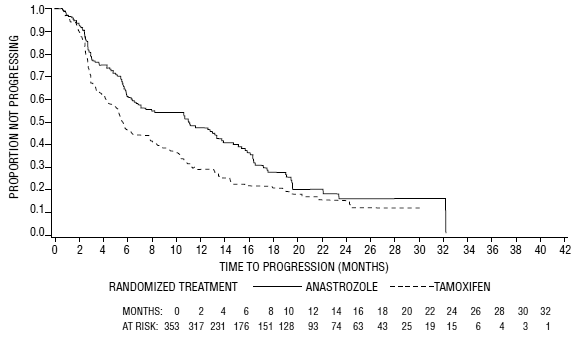
Figura 6: Probabilidad de tiempo hasta la progresión de Kaplan-Meier para todos los pacientes aleatorizados (intención de tratar) en el Ensayo 0027 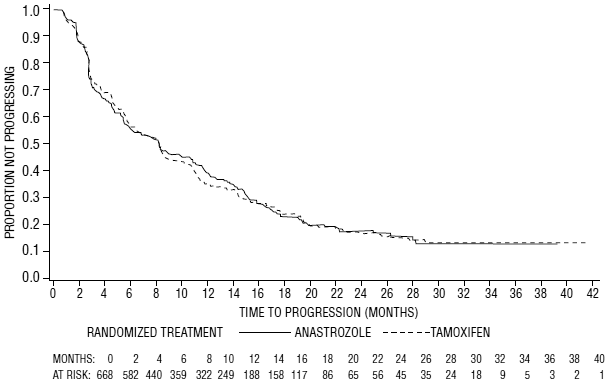
Los resultados de los criterios de valoración secundarios respaldaron los resultados de los criterios de valoración principales de eficacia. Hubo muy pocas muertes entre los grupos de tratamiento de ambos ensayos para sacar conclusiones sobre las diferencias de supervivencia general.
Terapia de segunda línea en mujeres posmenopáusicas con cáncer de mama avanzado que tuvieron progresión de la enfermedad después de la terapia con tamoxifeno
El anastrozol se estudió en dos ensayos clínicos controlados (0004, un estudio norteamericano; 0005, un estudio predominantemente europeo) en mujeres posmenopáusicas con cáncer de mama avanzado cuya enfermedad progresó después de la terapia con tamoxifeno para cáncer de mama avanzado o temprano. Algunos de los pacientes también habían recibido tratamiento citotóxico previo. La mayoría de los pacientes eran ER positivos; una fracción más pequeña eran ER desconocidos o ER negativos; los pacientes con RE negativos eran elegibles solo si habían tenido una respuesta positiva al tamoxifeno. Los pacientes elegibles con enfermedad medible y no medible fueron aleatorizados para recibir una dosis diaria única de 1 mg o 10 mg de ARIMIDEX o acetato de megestrol 40 mg cuatro veces al día. Los estudios fueron doble ciego con respecto a ARIMIDEX. El tiempo hasta la progresión y las tasas de respuesta objetiva (solo los pacientes con enfermedad medible podrían considerarse respondedores parciales) fueron las principales variables de eficacia. Las tasas de respuesta objetiva se calcularon según los criterios de la Unión Internacional Contra el Cáncer (UICC). También se calculó la tasa de enfermedad estable prolongada (más de 24 semanas), la tasa de progresión y la supervivencia.
Ambos ensayos incluyeron a más de 375 pacientes; la demografía y otras características iniciales fueron similares para los tres grupos de tratamiento en cada ensayo. Los pacientes del ensayo 0005 habían respondido mejor al tratamiento previo con tamoxifeno. De los pacientes ingresados que habían recibido tratamiento previo con tamoxifeno para la enfermedad avanzada (58 % en el ensayo 0004; 57 % en el ensayo 0005), el investigador principal informó que el 18 % de estos pacientes en el ensayo 0004 y el 42 % en el ensayo 0005 habían respondido. En el ensayo 0004, el 81 % de los pacientes tenían ER positivos, el 13 % eran ER desconocidos y el 6 % eran ER negativos. En el ensayo 0005, el 58 % de los pacientes tenían ER positivos, el 37 % eran ER desconocidos y el 5 % eran ER negativos. En el Ensayo 0004, el 62 % de los pacientes tenían enfermedad medible en comparación con el 79 % en el Ensayo 0005. Los sitios de enfermedad metastásica fueron similares entre los grupos de tratamiento para cada ensayo. En promedio, el 40% de los pacientes tenían metástasis en tejidos blandos; el 60% tenía metástasis óseas; y el 40% tenía metástasis viscerales (15% en el hígado).
Los resultados de eficacia de los dos estudios fueron similares a los presentados en la Tabla 13. En ambos estudios no hubo diferencias significativas entre los brazos de tratamiento con respecto a ninguno de los parámetros de eficacia enumerados en la siguiente tabla.
Cuando se agruparon los datos de los dos ensayos controlados, las tasas de respuesta objetiva y la mediana de los tiempos hasta la progresión y la muerte fueron similares para los pacientes asignados al azar a ARIMIDEX 1 mg y acetato de megestrol. No hay, en estos datos, ninguna indicación de que ARIMIDEX 10 mg sea superior a ARIMIDEX 1 mg.
INFORMACIÓN DEL PACIENTE
ARIMIDEX® Tabletas de A-rim-eh-dex (anastrozol) para administración oral
¿Cuál es la información más importante que debo saber sobre ARIMIDEX?
ARIMIDEX puede causar efectos secundarios graves que incluyen:
- enfermedad del corazón. Las mujeres con cáncer de mama temprano, que tienen antecedentes de obstrucción en las arterias del corazón (cardiopatía isquémica) y que toman ARIMIDEX 1 mg, pueden tener un aumento en los síntomas de disminución del flujo sanguíneo al corazón en comparación con mujeres similares que toman tamoxifeno.
Obtenga ayuda médica de inmediato si tiene dolor de pecho nuevo o que empeora o dificultad para respirar durante el tratamiento con ARIMIDEX.
¿Qué es ARIMIDEX®?
ARIMIDEX 1 mg es un medicamento recetado que se usa en mujeres después de la menopausia ("el cambio de vida") para:
- tratamiento del cáncer de mama temprano
- después de cirugía
- en mujeres cuyo cáncer de mama es receptor hormonal positivo
- el primer tratamiento del cáncer de mama que se ha diseminado al tejido cercano o a los ganglios linfáticos (localmente avanzado) o se ha diseminado a otras partes del cuerpo (metastásico), en mujeres cuyo cáncer de mama es receptor hormonal positivo o los receptores hormonales no se conocen
- tratamiento de cáncer de mama avanzado, si el cáncer ha crecido o la enfermedad se ha propagado después de la terapia con tamoxifeno
ARIMIDEX 1 mg no funciona en mujeres con cáncer de mama que no han pasado por la menopausia (mujeres premenopáusicas).
¿Quién no debe tomar ARIMIDEX?
No tome ARIMIDEX 1 mg si usted:
- está embarazada o puede quedar embarazada. ARIMIDEX puede dañar a su bebé nonato. Si queda embarazada mientras toma ARIMIDEX, informe a su médico de inmediato.
- no han pasado por la menopausia (son premenopáusicas)
- ha tenido una reacción alérgica grave al anastrozol o a cualquiera de los ingredientes de ARIMIDEX. Consulte el final de este folleto para obtener una lista completa de los ingredientes de ARIMIDEX. Los síntomas de una reacción alérgica grave a ARIMIDEX incluyen: hinchazón de la cara, los labios, la lengua o la garganta, dificultad para respirar o tragar, urticaria y picazón.
¿Qué debo decirle a mi médico antes de tomar ARIMIDEX 1 mg?
Antes de tomar ARIMIDEX, informe a su médico si usted:
- no han pasado por la menopausia. Hable con su médico si no está seguro.
- tiene o ha tenido un problema cardíaco
- le han dicho que tiene adelgazamiento de los huesos o debilidad (osteoporosis)
- tener colesterol alto
- tiene otras condiciones médicas
- está embarazada o planea quedar embarazada. ARIMIDEX puede dañar a su bebé nonato. Ver “¿Quién no debe tomar ARIMIDEX?”
- están amamantando o planean amamantar. No se sabe si ARIMIDEX pasa a la leche materna. Usted y su médico deben decidir si tomará ARIMIDEX 1 mg o si amamantará. Usted no debe hacer las dos cosas.
Informe a su médico sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos a base de hierbas. Informe especialmente a su médico si toma:
- tamoxifeno. no debes tomar ARIMIDEX si toma tamoxifeno. Tomar ARIMIDEX 1 mg con tamoxifeno puede reducir la cantidad de ARIMIDEX 1 mg en su sangre y puede causar que ARIMIDEX 1 mg no funcione tan bien.
- Medicamentos que contienen estrógeno. Es posible que ARIMIDEX 1 mg no funcione si se toma con alguno de estos medicamentos:
- Terapia de reemplazamiento de hormonas
- pastillas anticonceptivas
- cremas de estrógeno
- anillos vaginales
- ovulos vaginales
Conozca los medicamentos que toma. Mantenga una lista de ellos para mostrársela a su médico y farmacéutico cuando obtenga un medicamento nuevo.
¿Cómo debo tomar ARIMIDEX?
- Tome ARIMIDEX exactamente como se lo indique su médico.
- Continúe tomando ARIMIDEX hasta que su médico le indique que deje de hacerlo.
- ARIMIDEX 1 mg se puede tomar con o sin alimentos.
- Si olvida una dosis, tómela tan pronto como lo recuerde. Si es casi la hora de su próxima dosis, omita la dosis olvidada. Tome su próxima dosis programada regularmente. No tome dos dosis al mismo tiempo.
Si toma demasiado ARIMIDEX 1 mg, llame a su médico o acuda de inmediato a la sala de emergencias del hospital más cercano.
¿Cuáles son los posibles efectos secundarios de ARIMIDEX?
ARIMIDEX puede causar efectos secundarios graves que incluyen:
- Ver “¿Cuál es la información más importante que debo saber sobre ARIMIDEX?”
- adelgazamiento o debilidad de los huesos (osteoporosis). ARIMIDEX 1 mg reduce el estrógeno en su cuerpo, lo que puede hacer que sus huesos se vuelvan más delgados y débiles. Esto puede aumentar su riesgo de fracturas, especialmente de la columna vertebral, la cadera y la muñeca. Su médico puede ordenar una prueba de densidad mineral ósea
- antes de comenzar y durante el tratamiento con ARIMIDEX para comprobar si hay cambios en los huesos.
- aumento del colesterol en la sangre (grasa en la sangre). Es posible que su médico le haga análisis de sangre para comprobar su nivel de colesterol mientras esté tomando ARIMIDEX.
- reacciones de la piel Deje de tomar ARIMIDEX 1 mg y llame a su médico de inmediato si tiene lesiones en la piel, úlceras o ampollas.
- reacciones alérgicas graves. Obtenga ayuda médica de inmediato si tiene:
- hinchazón de la cara, los labios, la lengua o la garganta
- dificultad para tragar o respirar
- problemas hepáticos ARIMIDEX 1 mg puede causar inflamación del hígado y cambios en los análisis de sangre de la función hepática. Es posible que su médico lo revise. Deje de tomar ARIMIDEX 1 mg y llame a su médico de inmediato. si tiene alguno de estos signos o síntomas de un problema hepático:
- una sensación general de no estar bien
- coloración amarillenta de la piel o el blanco de los ojos
- dolor en el lado derecho de la zona del estómago (abdomen)
Los efectos secundarios comunes en mujeres que toman ARIMIDEX 1 mg incluyen:
- Sofocos
- debilidad
- dolores en las articulaciones
- dolor, rigidez o hinchazón de las articulaciones (artritis)
- dolor
- dolor de garganta
- Alta presión sanguínea
- depresión
- náuseas y vómitos
- sarpullido
- dolor de espalda
- problemas para dormir
- dolor de huesos
- dolor de cabeza
- hinchazón de las piernas, los tobillos o los pies
- aumento de la tos
- dificultad para respirar
- acumulación de líquido linfático en los tejidos del brazo afectado (linfedema)
ARIMIDEX también puede causarle cosquilleo, hormigueo o entumecimiento de la piel.
Informe a su médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de ARIMIDEX. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar ARIMIDEX 1mg?
- Guarde ARIMIDEX 1 mg a temperatura ambiente, entre 20 °C y 25 °C (68 °F y 77 °F).
Mantenga ARIMIDEX y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de ARIMIDEX.
A veces, los medicamentos se recetan para fines distintos a los enumerados en el folleto de información para el paciente. No tome ARIMIDEX 1mg para una condición para la cual no fue recetado. No le dé ARIMIDEX a otras personas, incluso si tienen los mismos síntomas que usted tiene. Puede que les haga daño.
Si desea obtener más información, hable con su médico. Puede pedirle a su farmacéutico o médico información sobre ARIMIDEX escrita para profesionales de la salud. Para más información llame al 1-866-992-9276 o visite www.ARIMIDEX.com.
¿Cuáles son los ingredientes de ARIMIDEX?
Ingrediente activo: anastrozol
Ingredientes inactivos: lactosa, estearato de magnesio, hidroxipropilmetilcelulosa, polietilenglicol, povidona, glicolato de almidón de sodio y dióxido de titanio.
