Diflucan 50mg, 100mg, 150mg, 200mg Fluconazole Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Diflucan y cómo se usa?
Diflucan es un medicamento recetado que se usa para tratar los síntomas de las infecciones fúngicas. Diflucan 50 mg se puede usar solo o con otros medicamentos.
Diflucan 100 mg pertenece a una clase de medicamentos llamados antifúngicos.
¿Cuáles son los efectos secundarios de Diflucan 150 mg?
Diflucan 100 mg puede causar efectos secundarios graves que incluyen:
- latidos del corazón rápidos o fuertes,
- aleteo en tu pecho,
- dificultad para respirar,
- mareo repentino,
- fiebre,
- escalofríos,
- dolor de cuerpo,
- sintomas de gripe,
- moretones o sangrado fácil,
- debilidad inusual,
- convulsiones (convulsiones),
- erupción cutánea o lesiones,
- pérdida de apetito,
- dolor de estómago superior,
- orina oscura,
- heces de color arcilla, y
- coloración amarillenta de los ojos o la piel (ictericia)
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Diflucan incluyen:
- náuseas,
- dolor de estómago,
- Diarrea,
- dolor de barriga,
- dolor de cabeza,
- mareos, y
- cambios en su sentido del gusto
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Diflucan. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
DIFLUCAN® (fluconazol), el primero de una nueva subclase de agentes antifúngicos triazólicos sintéticos, está disponible en tabletas para administración oral, como polvo para suspensión oral.
El fluconazol se designa químicamente como alcohol 2,4-difluoro-α,α1-bis(1H-1,2,4-triazol-1-ilmetil)bencílico con una fórmula empírica de C13H12F2N6O y un peso molecular de 306,3. La fórmula estructural es:
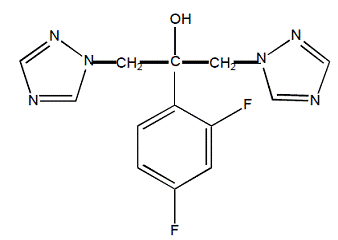
El fluconazol es un sólido cristalino blanco que es ligeramente soluble en agua y solución salina.
Las tabletas de DIFLUCAN contienen 50, 100, 150 o 200 mg de fluconazol y los siguientes ingredientes inactivos: celulosa microcristalina, fosfato de calcio dibásico anhidro, povidona, croscarmelosa sódica, tinte de laca de aluminio FD&C Red No. 40 y estearato de magnesio.
DIFLUCAN para suspensión oral contiene 350 mg o 1400 mg de fluconazol y los siguientes ingredientes inactivos: sacarosa, citrato de sodio dihidrato, ácido cítrico anhidro, benzoato de sodio, dióxido de titanio, dióxido de silicio coloidal, goma xantana y sabor a naranja natural. Después de la reconstitución con 24 ml de agua destilada o agua purificada (USP), cada ml de suspensión reconstituida contiene 10 mg o 40 mg de fluconazol.
INDICACIONES
DIFLUCAN (fluconazol) está indicado para el tratamiento de:
- Candidiasis vaginal (candidiasis vaginal por Candida).
- Candidiasis orofaríngea y esofágica. En estudios abiertos no comparativos de un número relativamente pequeño de pacientes, DIFLUCAN también fue eficaz para el tratamiento de infecciones del tracto urinario por Candida, peritonitis e infecciones sistémicas por Candida, incluidas la candidemia, la candidiasis diseminada y la neumonía.
- Meningitis criptocócica. Antes de recetar DIFLUCAN (fluconazol) a pacientes con SIDA y meningitis criptocócica, consulte Estudios clínicos sección. No se han realizado estudios que comparen DIFLUCAN 150 mg con anfotericina B en pacientes no infectados por el VIH.
Profilaxis
DIFLUCAN también está indicado para disminuir la incidencia de candidiasis en pacientes sometidos a trasplante de médula ósea que reciben quimioterapia citotóxica y/o radioterapia.
Se deben obtener muestras para cultivo de hongos y otros estudios de laboratorio relevantes (serología, histopatología) antes de la terapia para aislar e identificar los organismos causantes. La terapia puede instituirse antes de que se conozcan los resultados de los cultivos y otros estudios de laboratorio; sin embargo, una vez que estos resultados estén disponibles, la terapia antiinfecciosa debe ajustarse en consecuencia.
DOSIFICACIÓN Y ADMINISTRACIÓN
Dosis y administración en adultos
Dosís única
Candidiasis vaginal
La dosis recomendada de DIFLUCAN para la candidiasis vaginal es de 150 mg en dosis única oral.
Dosis Múltiple
DADO QUE LA ABSORCIÓN ORAL ES RÁPIDA Y CASI COMPLETA, LA DOSIS DIARIA DE DIFLUCAN (FLUCONAZOL) ES LA MISMA PARA LA ADMINISTRACIÓN ORAL (TABLETAS Y SUSPENSIÓN) E INTRAVENOSA. En general, se recomienda una dosis de carga del doble de la dosis diaria el primer día de tratamiento para lograr concentraciones plasmáticas cercanas al estado estacionario en el segundo día de tratamiento.
La dosis diaria de DIFLUCAN 100 mg para el tratamiento de infecciones distintas de la candidiasis vaginal debe basarse en el organismo infectante y la respuesta de la paciente al tratamiento. El tratamiento debe continuarse hasta que los parámetros clínicos o las pruebas de laboratorio indiquen que la infección fúngica activa ha remitido. Un período inadecuado de tratamiento puede conducir a la recurrencia de la infección activa. Los pacientes con SIDA y meningitis criptocócica o candidiasis orofaríngea recurrente por lo general requieren terapia de mantenimiento para prevenir la recaída.
Candidiasis orofaríngea
La dosis recomendada de DIFLUCAN para la candidiasis orofaríngea es de 200 mg el primer día, seguida de 100 mg una vez al día. La evidencia clínica de candidiasis orofaríngea generalmente se resuelve en varios días, pero el tratamiento debe continuarse durante al menos 2 semanas para disminuir la probabilidad de recaída.
Candidiasis esofágica
La dosis recomendada de DIFLUCAN 200 mg para la candidiasis esofágica es de 200 mg el primer día, seguida de 100 mg una vez al día. Se pueden usar dosis de hasta 400 mg/día, según el criterio médico de la respuesta del paciente a la terapia. Los pacientes con candidiasis esofágica deben recibir tratamiento durante un mínimo de tres semanas y durante al menos dos semanas después de la resolución de los síntomas.
Infecciones sistémicas por Candida
Para las infecciones sistémicas por Candida, incluidas la candidemia, la candidiasis diseminada y la neumonía, no se ha establecido la dosis terapéutica óptima ni la duración del tratamiento. En estudios abiertos no comparativos de un pequeño número de pacientes, se han utilizado dosis de hasta 400 mg diarios.
Infecciones del tracto urinario y peritonitis
Para el tratamiento de infecciones del tracto urinario y peritonitis por Candida, se han utilizado dosis diarias de 50 a 200 mg en estudios abiertos no comparativos de un pequeño número de pacientes.
Meningitis criptocócica
La dosis recomendada para el tratamiento de la meningitis criptocócica aguda es de 400 mg el primer día, seguida de 200 mg una vez al día. Se puede usar una dosis de 400 mg una vez al día, según el criterio médico de la respuesta del paciente a la terapia. La duración recomendada del tratamiento para la terapia inicial de la meningitis criptocócica es de 10 a 12 semanas después de que el cultivo del líquido cefalorraquídeo sea negativo. La dosis recomendada de DIFLUCAN 150 mg para la supresión de la recaída de la meningitis criptocócica en pacientes con SIDA es de 200 mg una vez al día.
Profilaxis en pacientes sometidos a trasplante de médula ósea
La dosis diaria recomendada de DIFLUCAN para la prevención de la candidiasis en pacientes sometidos a trasplante de médula ósea es de 400 mg, una vez al día. Los pacientes que se prevé que tengan granulocitopenia grave (menos de 500 células de neutrófilos/mm³) deben comenzar la profilaxis con DIFLUCAN varios días antes de la aparición anticipada de neutropenia y continuar durante 7 días después de que el recuento de neutrófilos supere las 1000 células/mm³.
Posología y administración en niños
El siguiente esquema de equivalencia de dosis generalmente debería proporcionar una exposición equivalente en pacientes pediátricos y adultos:
La experiencia con DIFLUCAN en recién nacidos se limita a estudios farmacocinéticos en recién nacidos prematuros. (Ver FARMACOLOGÍA CLÍNICA .) En base a la vida media prolongada observada en recién nacidos prematuros (edad gestacional de 26 a 29 semanas), estos niños, en las dos primeras semanas de vida, deben recibir la misma dosis (mg/kg) que en niños mayores, pero administrada cada 72 horas. Después de las dos primeras semanas, estos niños deben recibir la dosis una vez al día. No se dispone de información sobre la farmacocinética de DIFLUCAN en recién nacidos a término.
Candidiasis orofaríngea
La dosis recomendada de DIFLUCAN 150 mg para la candidiasis orofaríngea en niños es de 6 mg/kg el primer día, seguida de 3 mg/kg una vez al día. El tratamiento debe administrarse durante al menos 2 semanas para disminuir la probabilidad de recaída.
Candidiasis esofágica
Para el tratamiento de la candidiasis esofágica, la dosis recomendada de DIFLUCAN en niños es de 6 mg/kg el primer día, seguida de 3 mg/kg una vez al día. Se pueden usar dosis de hasta 12 mg/kg/día, según el criterio médico de la respuesta del paciente a la terapia. Los pacientes con candidiasis esofágica deben recibir tratamiento durante un mínimo de tres semanas y durante al menos 2 semanas después de la resolución de los síntomas.
Infecciones sistémicas por Candida
Para el tratamiento de la candidemia y las infecciones diseminadas por Candida, se han utilizado dosis diarias de 6 a 12 mg/kg/día en un estudio abierto no comparativo de un pequeño número de niños.
Meningitis criptocócica
Para el tratamiento de la meningitis criptocócica aguda, la dosis recomendada es de 12 mg/kg el primer día, seguida de 6 mg/kg una vez al día. Se puede usar una dosis de 12 mg/kg una vez al día, según el criterio médico de la respuesta del paciente a la terapia. La duración recomendada del tratamiento para la terapia inicial de la meningitis criptocócica es de 10 a 12 semanas después de que el cultivo del líquido cefalorraquídeo sea negativo. Para la supresión de la recaída de la meningitis criptocócica en niños con SIDA, la dosis recomendada de DIFLUCAN es de 6 mg/kg una vez al día.
Posología en pacientes con insuficiencia renal
El fluconazol se elimina principalmente por excreción renal como fármaco inalterado. No hay necesidad de ajustar la terapia de dosis única para la candidiasis vaginal debido al deterioro de la función renal. En pacientes con insuficiencia renal que recibirán dosis múltiples de DIFLUCAN, se debe administrar una dosis de carga inicial de 50 mg a 400 mg. Tras la dosis de carga, la dosis diaria (según indicación) debe basarse en la siguiente tabla:
Los pacientes en hemodiálisis deben recibir el 100% de la dosis recomendada después de cada hemodiálisis; en los días sin diálisis, los pacientes deben recibir una dosis reducida de acuerdo con su aclaramiento de creatinina.
Estos son ajustes de dosis sugeridos basados en la farmacocinética después de la administración de dosis múltiples. Es posible que se necesiten ajustes adicionales dependiendo de la condición clínica.
Cuando la creatinina sérica es la única medida disponible de la función renal, se debe utilizar la siguiente fórmula (basada en el sexo, el peso y la edad del paciente) para estimar el aclaramiento de creatinina en adultos:
Hombres: Peso (kg) × (140 – edad)/ 72 × creatinina sérica (mg/100 mL)
Hembras: 0,85 × por encima del valor
Aunque no se ha estudiado la farmacocinética de fluconazol en niños con insuficiencia renal, la reducción de la dosis en niños con insuficiencia renal debe ser paralela a la recomendada para adultos. La siguiente fórmula puede usarse para estimar el aclaramiento de creatinina en niños:
× longitud o altura lineal (cm)/creatinina sérica (mg/100 mL)
(Donde K=0,55 para niños mayores de 1 año y 0,45 para bebés).
Administración
DIFLUCAN 100mg se administra por vía oral. DIFLUCAN se puede tomar con o sin alimentos.
Instrucciones para mezclar la suspensión oral
Prepare una suspensión en el momento de la dispensación de la siguiente manera: golpee la botella hasta que todo el polvo fluya libremente. Para reconstituir, agregue 24 ml de agua destilada o agua purificada (USP) a la botella de fluconazol y agite vigorosamente para suspender el polvo. Cada botella entregará 35 ml de suspensión. Las concentraciones de las suspensiones reconstituidas son las siguientes:
Nota: Agite bien la suspensión oral antes de usar. Guarde la suspensión reconstituida entre 30 °C (86 °F) y 5 °C (41 °F) y deseche la porción no utilizada después de 2 semanas. Proteger de la congelación.
CÓMO SUMINISTRADO
DIFLUCAN 100mg Comprimidos Los comprimidos trapezoidales de color rosa que contienen 50, 100 ó 200 mg de fluconazol se envasan en frascos o blísters monodosis. Los comprimidos de fluconazol de 150 mg son de color rosa y de forma ovalada, envasados en un blíster unitario de dosis única.
Las tabletas de DIFLUCAN se suministran de la siguiente manera:
DIFLUCAN 50 mg Comprimidos : Grabado con “DIFLUCAN” y “50” en el anverso y “ROERIG” en el reverso.
CDN 0049-3410-30 Botellas de 30
DIFLUCAN 100 mg Comprimidos : Grabado con “DIFLUCAN” y “100” en el frente y “ROERIG” en el reverso.
CDN 0049-3420-30 Botellas de 30 CDN 0049-3420-41 Paquete de dosis unitaria de 100
DIFLUCAN 150 mg Comprimidos : Grabado con “DIFLUCAN” y “150” en el anverso y “ROERIG” en el reverso.
CDN 0049-3500-79 Paquete de dosis unitaria de 1
DIFLUCAN 200 mg Comprimidos : Grabado con “DIFLUCAN” y “200” en el anverso y “ROERIG” en el reverso.
CDN 0049-3430-30 Botellas de 30 CDN 0049-3430-41 Paquete de dosis unitaria de 100
Almacenamiento
Guarde las tabletas por debajo de 86 °F (30 °C).
DIFLUCAN 100mg para Suspensión Oral : DIFLUCAN para suspensión oral se suministra como un polvo con sabor a naranja para proporcionar 35 ml por frasco de la siguiente manera:
CDN 0049-3440-19 Fluconazol 350 mg por botella CDN 0049-3450-19 Fluconazol 1400 mg por botella
Almacenamiento
Almacene el polvo seco por debajo de 86 °F (30 °C). Guarde la suspensión reconstituida entre 30 °C (86 °F) y 5 °C (41 °F) y deseche la porción no utilizada después de 2 semanas. Proteger de la congelación.
Distribuido por: Roerig Division of Pfizer Inc., NY, NY 10017. Revisado: octubre de 2021
EFECTOS SECUNDARIOS
DIFLUCAN es generalmente bien tolerado.
En algunos pacientes, particularmente aquellos con enfermedades subyacentes graves como SIDA y cáncer, se han observado cambios en los resultados de las pruebas de función renal y hematológica y anomalías hepáticas durante el tratamiento con fluconazol y agentes comparativos, pero la importancia clínica y la relación con el tratamiento son inciertas.
En pacientes que reciben una dosis única para la candidiasis vaginal
Durante los estudios clínicos comparativos realizados en los Estados Unidos, 448 pacientes con candidiasis vaginal fueron tratadas con DIFLUCAN, dosis única de 150 mg. La incidencia global de efectos secundarios posiblemente relacionados con DIFLUCAN fue del 26 %. En 422 pacientes que recibieron agentes comparativos activos, la incidencia fue del 16%. Los eventos adversos relacionados con el tratamiento más comunes informados en los pacientes que recibieron una dosis única de 150 mg de fluconazol para la vaginitis fueron dolor de cabeza (13 %), náuseas (7 %) y dolor abdominal (6 %). Otros efectos secundarios informados con una incidencia igual o superior al 1 % incluyeron diarrea (3 %), dispepsia (1 %), mareos (1 %) y alteración del gusto (1 %). La mayoría de los efectos secundarios informados fueron de gravedad leve a moderada. En raras ocasiones, se han informado angioedema y reacciones anafilácticas en la experiencia de mercadeo.
En pacientes que reciben dosis múltiples para otras infecciones
Dieciséis por ciento de más de 4000 pacientes tratados con DIFLUCAN (fluconazol) en ensayos clínicos de 7 días o más experimentaron eventos adversos. El tratamiento se suspendió en el 1,5 % de los pacientes debido a eventos clínicos adversos y en el 1,3 % de los pacientes debido a anomalías en las pruebas de laboratorio.
Los eventos adversos clínicos se informaron con mayor frecuencia en pacientes infectados por el VIH (21 %) que en pacientes no infectados por el VIH (13 %); sin embargo, los patrones en pacientes infectados por el VIH y no infectados por el VIH fueron similares. Las proporciones de pacientes que interrumpieron el tratamiento debido a eventos clínicos adversos fueron similares en los dos grupos (1,5%).
Los siguientes eventos adversos clínicos relacionados con el tratamiento ocurrieron con una incidencia del 1 % o más en 4048 pacientes que recibieron DIFLUCAN 50 mg durante 7 días o más en ensayos clínicos: náuseas 3,7 %, dolor de cabeza 1,9 %, erupción cutánea 1,8 %, vómitos 1,7 %, dolor abdominal dolor 1,7% y diarrea 1,5%.
Hepatobiliar
En ensayos clínicos combinados y experiencia de mercadeo, ha habido casos raros de reacciones hepáticas graves durante el tratamiento con DIFLUCAN. (Ver ADVERTENCIAS .) El espectro de estas reacciones hepáticas ha variado desde leves elevaciones transitorias de las transaminasas hasta hepatitis clínica, colestasis e insuficiencia hepática fulminante, incluidas las muertes. Se observó que los casos de reacciones hepáticas fatales ocurrieron principalmente en pacientes con afecciones médicas subyacentes graves (predominantemente SIDA o malignidad) y, a menudo, mientras tomaban múltiples medicamentos concomitantes. Se han producido reacciones hepáticas transitorias, incluidas hepatitis e ictericia, en pacientes sin otros factores de riesgo identificables. En cada uno de estos casos, la función hepática volvió a la línea base al suspender DIFLUCAN.
En dos ensayos comparativos que evaluaron la eficacia de DIFLUCAN para la supresión de la recaída de la meningitis criptocócica, se observó un aumento estadísticamente significativo en los niveles medianos de AST (SGOT) desde un valor inicial de 30 UI/L a 41 UI/L en un ensayo y 34 UI/L a 66 UI/L en el otro. La tasa general de elevaciones de las transaminasas séricas de más de 8 veces el límite superior normal fue de aproximadamente el 1 % en los pacientes tratados con fluconazol en los ensayos clínicos. Estas elevaciones ocurrieron en pacientes con una enfermedad subyacente grave, predominantemente SIDA o neoplasias malignas, la mayoría de los cuales recibían múltiples medicamentos concomitantes, incluidos muchos que se sabe que son hepatotóxicos. La incidencia de transaminasas séricas anormalmente elevadas fue mayor en pacientes que tomaban DIFLUCAN concomitantemente con uno o más de los siguientes medicamentos: rifampicina, fenitoína, isoniazida, ácido valproico o agentes hipoglucemiantes de sulfonilurea oral.
Experiencia posterior a la comercialización
Además, los siguientes eventos adversos han ocurrido durante la experiencia posterior a la comercialización.
inmunológico: En casos raros, se ha informado anafilaxia (incluyendo angioedema, edema facial y prurito).
Cuerpo como un todo: Astenia, fatiga, fiebre, malestar general.
Cardiovascular: Prolongación del intervalo QT, torsade de pointes. (Ver PRECAUCIONES .)
Sistema nervioso central: Convulsiones, mareos.
Hematopoyético y Linfático: Leucopenia, incluyendo neutropenia y agranulocitosis, trombocitopenia.
Metabólico: Hipercolesterolemia, hipertrigliceridemia, hipopotasemia.
Gastrointestinal: Colestasis, boca seca, daño hepatocelular, dispepsia, vómitos.
Otros sentidos: Perversión del gusto.
Sistema musculoesquelético: mialgia.
Sistema nervioso: Insomnio, parestesia, somnolencia, temblor, vértigo.
Piel y apéndices: Pustulosis exantemática generalizada aguda, erupción medicamentosa incluida la erupción fija medicamentosa, aumento de la sudoración, trastornos cutáneos exfoliativos que incluyen el síndrome de Stevens-Johnson y la necrólisis epidérmica tóxica, reacción medicamentosa con eosinofilia y síntomas sistémicos (DRESS) (Ver ADVERTENCIAS ), alopecia.
Reacciones adversas en niños
El patrón y la incidencia de eventos adversos y anomalías de laboratorio registrados durante los ensayos clínicos pediátricos son comparables a los observados en adultos.
En ensayos clínicos de fase II/III realizados en los Estados Unidos y en Europa, 577 pacientes pediátricos, de 1 día a 17 años de edad, fueron tratados con DIFLUCAN en dosis de hasta 15 mg/kg/día durante un máximo de 1616 días. Trece por ciento de los niños experimentaron eventos adversos relacionados con el tratamiento. Los eventos informados con mayor frecuencia fueron vómitos (5 %), dolor abdominal (3 %), náuseas (2 %) y diarrea (2 %). El tratamiento se suspendió en el 2,3 % de los pacientes debido a eventos clínicos adversos y en el 1,4 % de los pacientes debido a anomalías en las pruebas de laboratorio. La mayoría de las anomalías de laboratorio relacionadas con el tratamiento fueron elevaciones de transaminasas o fosfatasa alcalina.
Porcentaje de pacientes con efectos secundarios relacionados con el tratamiento
INTERACCIONES CON LA DROGAS
(Ver CONTRAINDICACIONES .) El fluconazol es un inhibidor moderado de CYP2C9 y CYP3A4. El fluconazol también es un fuerte inhibidor de CYP2C19. Los pacientes tratados con DIFLUCAN, que también reciben tratamiento concomitante con medicamentos con una ventana terapéutica estrecha metabolizados a través de CYP2C9 y CYP3A4, deben ser monitoreados por reacciones adversas asociadas con los medicamentos administrados concomitantemente. Además de las interacciones observadas/documentadas que se mencionan a continuación, existe el riesgo de un aumento de la concentración plasmática de otros compuestos metabolizados por CYP2C9, CYP2C19 y CYP3A4 coadministrados con fluconazol. Por lo tanto, se debe tener precaución al usar estas combinaciones y se debe monitorear cuidadosamente a los pacientes. El efecto inhibidor de la enzima de fluconazol persiste de 4 a 5 días después de la interrupción del tratamiento con fluconazol debido a la larga vida media de fluconazol. Se han observado interacciones medicamentosas clínicamente o potencialmente significativas entre DIFLUCAN 200 mg y los siguientes agentes/clases y se describen con mayor detalle a continuación:
alfentanilo
Un estudio observó una reducción en el aclaramiento y el volumen de distribución, así como una prolongación de la t½ de alfentanilo luego del tratamiento concomitante con fluconazol. Un posible mecanismo de acción es la inhibición de CYP3A4 por parte de fluconazol. Puede ser necesario ajustar la dosis de alfentanilo.
amiodarona
La administración concomitante de fluconazol con amiodarona puede aumentar la prolongación del intervalo QT. Se debe tener precaución si es necesario el uso concomitante de fluconazol y amiodarona, especialmente con dosis altas de fluconazol (800 mg).
amitriptilina, nortriptilina
El fluconazol aumenta el efecto de la amitriptilina y la nortriptilina. La 5-nortriptilina y/o la S-amitriptilina pueden medirse al inicio de la terapia combinada y después de 1 semana. Si es necesario, se debe ajustar la dosis de amitriptilina/nortriptilina.
Anfotericina B
La administración simultánea de fluconazol y anfotericina B en ratones normales e inmunodeprimidos infectados mostró los siguientes resultados: un pequeño efecto antifúngico aditivo en la infección sistémica por Candida albicans, ninguna interacción en la infección intracraneal por Cryptococcus neoformans y antagonismo de los dos fármacos en la infección sistémica por A fumigatus Se desconoce el significado clínico de los resultados obtenidos en estos estudios.
Azitromicina
Un estudio abierto, aleatorizado, cruzado de tres vías en 18 sujetos sanos evaluó el efecto de una dosis oral única de 1200 mg de azitromicina en la farmacocinética de una dosis oral única de 800 mg de fluconazol, así como los efectos de fluconazol en la farmacocinética de azitromicina. No hubo interacción farmacocinética significativa entre fluconazol y azitromicina.
Bloqueadores de los canales de calcio
Ciertos antagonistas de los canales de calcio (nifedipina, isradipina, amlodipina, verapamilo y felodipina) son metabolizados por CYP3A4. El fluconazol tiene el potencial de aumentar la exposición sistémica de los antagonistas de los canales de calcio. Se recomienda un control frecuente de los eventos adversos.
Carbamazepina
El fluconazol inhibe el metabolismo de la carbamazepina y se ha observado un aumento de la carbamazepina sérica del 30%. Existe el riesgo de desarrollar toxicidad por carbamazepina. Puede ser necesario ajustar la dosis de carbamazepina dependiendo de las medidas de concentración/efecto.
Celecoxib
Durante el tratamiento concomitante con fluconazol (200 mg al día) y celecoxib (200 mg), la Cmáx y el AUC de celecoxib aumentaron un 68 % y un 134 %, respectivamente. Puede ser necesaria la mitad de la dosis de celecoxib cuando se combina con fluconazol.
Anticoagulantes tipo cumarina
El tiempo de protrombina puede aumentar en pacientes que reciben concomitantemente DIFLUCAN 150 mg y anticoagulantes de tipo cumarínico. En la experiencia posterior a la comercialización, al igual que con otros antifúngicos azólicos, se han informado eventos hemorrágicos (hematomas, epistaxis, hemorragia gastrointestinal, hematuria y melena) asociados con aumentos en el tiempo de protrombina en pacientes que reciben fluconazol junto con warfarina. Se recomienda un control cuidadoso del tiempo de protrombina en pacientes que reciben DIFLUCAN 50 mg y anticoagulantes de tipo cumarínico. Puede ser necesario ajustar la dosis de warfarina. (Ver FARMACOLOGÍA CLÍNICA : Estudios de interacción farmacológica .)
ciclofosfamida
La terapia combinada con ciclofosfamida y fluconazol produce un aumento de la bilirrubina sérica y la creatinina sérica. La combinación se puede utilizar teniendo en cuenta el riesgo de aumento de la bilirrubina sérica y la creatinina sérica.
ciclosporina
DIFLUCAN 100 mg aumenta significativamente los niveles de ciclosporina en pacientes con trasplante renal con o sin insuficiencia renal. Se recomienda un control cuidadoso de las concentraciones de ciclosporina y creatinina sérica en pacientes que reciben DIFLUCAN y ciclosporina. (Ver FARMACOLOGÍA CLÍNICA : Estudios de interacción farmacológica .) Esta combinación puede usarse reduciendo la dosis de ciclosporina dependiendo de la concentración de ciclosporina.
fentanilo
Se notificó un caso mortal de posible interacción fentanilo-fluconazol. El autor consideró que el paciente había muerto por intoxicación con fentanilo. Además, en un estudio cruzado aleatorizado con 12 voluntarios sanos, se demostró que el fluconazol retrasó significativamente la eliminación del fentanilo. La concentración elevada de fentanilo puede provocar depresión respiratoria.
Inhibidores de la HMG-CoA reductasa
El riesgo de miopatía y rabdomiolisis aumenta cuando se administra fluconazol junto con inhibidores de la HMG-CoA reductasa metabolizados a través de CYP3A4, como atorvastatina y simvastatina, o a través de CYP2C9, como fluvastatina. Si es necesaria una terapia concomitante, se debe observar al paciente para detectar síntomas de miopatía y rabdomiolisis y se debe monitorear la creatinina quinasa. Los inhibidores de la HMG-CoA reductasa deben suspenderse si se observa un aumento marcado en la creatinina quinasa o si se diagnostica o sospecha miopatía/rabdomiólisis.
hidroclorotiazida
En un estudio de interacción farmacocinética, la coadministración de dosis múltiples de hidroclorotiazida a voluntarios sanos que recibieron fluconazol aumentó las concentraciones plasmáticas de fluconazol en un 40 %. Un efecto de esta magnitud no debería requerir un cambio en el régimen de dosis de fluconazol en sujetos que reciben diuréticos concomitantes.
Ibrutinib
Los inhibidores moderados de CYP3A4, como fluconazol, pueden aumentar las concentraciones plasmáticas de ibrutinib y aumentar el riesgo de reacciones adversas asociadas con ibrutinib. Si se administran de forma concomitante ibrutinib y fluconazol, reduzca la dosis de ibrutinib como se indica en la información de prescripción de ibrutinib y el paciente debe ser monitoreado con frecuencia por cualquier reacción adversa asociada con ibrutinib.
lemborexante
La administración concomitante de fluconazol aumentó la Cmax y el AUC de lemborexant en aproximadamente 1,6 y 4,2 veces, respectivamente, lo que se espera que aumente el riesgo de reacciones adversas, como somnolencia. Evitar el uso concomitante de DIFLUCAN con lemborexant.
losartán
El fluconazol inhibe el metabolismo de losartán a su metabolito activo (E-31 74), que es responsable de la mayor parte del antagonismo del receptor de angiotensina II que se produce durante el tratamiento con losartán. Los pacientes deben tener su presión arterial monitoreada continuamente.
Metadona
El fluconazol puede aumentar la concentración sérica de metadona. Puede ser necesario ajustar la dosis de metadona.
Fármacos anti-inflamatorios no esteroideos
La Cmax y el AUC de flurbiprofeno aumentaron un 23 % y un 81 %, respectivamente, cuando se administró conjuntamente con fluconazol en comparación con la administración de flurbiprofeno solo. De manera similar, la Cmáx y el AUC del isómero farmacológicamente activo [S-(+)-ibuprofeno] aumentaron en un 15 % y un 82 %, respectivamente, cuando se administró fluconazol junto con ibuprofeno racémico (400 mg) en comparación con la administración de ibuprofeno racémico solo.
Aunque no se ha estudiado específicamente, fluconazol tiene el potencial de aumentar la exposición sistémica de otros fármacos antiinflamatorios no esteroideos (AINE) que son metabolizados por CYP2C9 (p. ej., naproxeno, lornoxicam, meloxicam, diclofenaco). Se recomienda un control frecuente de los eventos adversos y la toxicidad relacionados con los AINE. Puede ser necesario ajustar la dosis de AINE.
Olaparib
Los inhibidores moderados de CYP3A4, como el fluconazol, aumentan las concentraciones plasmáticas de olaparib; no se recomienda el uso concomitante. Si no se puede evitar la combinación, reduzca la dosis de olaparib como se indica en la información de prescripción de LYNPARZA® (olaparib).
Anticonceptivos orales
Se han realizado dos estudios farmacocinéticos con un anticonceptivo oral combinado utilizando dosis múltiples de fluconazol. No hubo efectos relevantes sobre el nivel hormonal en el estudio de 50 mg de fluconazol, mientras que con 200 mg diarios, las AUC de etinilestradiol y levonorgestrel aumentaron un 40 % y un 24 %, respectivamente. Por lo tanto, es poco probable que el uso de dosis múltiples de fluconazol a estas dosis tenga un efecto sobre la eficacia del anticonceptivo oral combinado.
Hipoglucemiantes orales
El uso de DIFLUCAN con agentes hipoglucemiantes orales puede precipitar una hipoglucemia clínicamente significativa; se informó una muerte por hipoglucemia en asociación con el uso combinado de DIFLUCAN 150 mg y gliburida. DIFLUCAN reduce el metabolismo de tolbutamida, gliburida y glipizida y aumenta la concentración plasmática de estos agentes. Cuando DIFLUCAN 100 mg se usa concomitantemente con estos u otros agentes hipoglucemiantes orales de sulfonilurea, las concentraciones de glucosa en sangre deben controlarse cuidadosamente y la dosis de la sulfonilurea debe ajustarse según sea necesario. (Ver FARMACOLOGÍA CLÍNICA : Estudios de interacción farmacológica .)
fenitoína
DIFLUCAN aumenta las concentraciones plasmáticas de fenitoína. Se recomienda un control cuidadoso de las concentraciones de fenitoína en pacientes que reciben DIFLUCAN 50 mg y fenitoína. (Ver FARMACOLOGÍA CLÍNICA : Estudios de interacción farmacológica .)
pimozida
Aunque no se ha estudiado in vitro ni in vivo, la administración concomitante de fluconazol con pimozida puede provocar la inhibición del metabolismo de pimozida. El aumento de las concentraciones plasmáticas de pimozida puede conducir a la prolongación del intervalo QT y raras ocasiones de torsade de pointes. Está contraindicada la coadministración de fluconazol y pimozida.
prednisona
Hubo un informe de caso de un paciente con trasplante de hígado tratado con prednisona que desarrolló insuficiencia de la corteza suprarrenal aguda cuando se interrumpió una terapia de 3 meses con fluconazol. La interrupción del fluconazol presumiblemente provocó un aumento de la actividad de CYP3A4 que condujo a un aumento del metabolismo de la prednisona. Los pacientes en tratamiento a largo plazo con fluconazol y prednisona deben ser monitoreados cuidadosamente por insuficiencia de la corteza suprarrenal cuando se interrumpe el tratamiento con fluconazol.
quinidina
Aunque no se ha estudiado in vitro ni in vivo, la administración concomitante de fluconazol con quinidina puede provocar la inhibición del metabolismo de la quinidina. El uso de quinidina se ha asociado con la prolongación del intervalo QT y casos raros de torsade de pointes. Está contraindicada la coadministración de fluconazol y quinidina. (Ver CONTRAINDICACIONES .)
rifabutina
Ha habido informes de que existe una interacción cuando fluconazol se administra concomitantemente con rifabutina, lo que lleva a un aumento de los niveles séricos de rifabutina hasta en un 80%. Ha habido informes de uveítis en pacientes a los que se les administró conjuntamente fluconazol y rifabutina. Los pacientes que reciben rifabutina y fluconazol concomitantemente deben ser monitoreados cuidadosamente. (Ver FARMACOLOGÍA CLÍNICA : Estudios de interacción farmacológica .)
rifampicina
La rifampicina mejora el metabolismo de DIFLUCAN administrado simultáneamente. Dependiendo de las circunstancias clínicas, se debe considerar aumentar la dosis de DIFLUCAN 200 mg cuando se administra con rifampicina. (Ver FARMACOLOGÍA CLÍNICA : Estudios de interacción farmacológica .)
Saquinavir
El fluconazol aumenta el AUC de saquinavir en aproximadamente un 50 %, la Cmax en aproximadamente un 55 % y disminuye el aclaramiento de saquinavir en aproximadamente un 50 % debido a la inhibición del metabolismo hepático de saquinavir por CYP3A4 y la inhibición de la glicoproteína P. Puede ser necesario ajustar la dosis de saquinavir.
Benzodiazepinas de acción corta
Luego de la administración oral de midazolam, fluconazol resultó en aumentos sustanciales en las concentraciones de midazolam y efectos psicomotores. Este efecto sobre el midazolam parece ser más pronunciado tras la administración oral de fluconazol que con fluconazol administrado por vía intravenosa. Si las benzodiazepinas de acción corta, que son metabolizadas por el sistema del citocromo P450, se administran de forma concomitante con fluconazol, se debe considerar la disminución de la dosis de benzodiazepina y los pacientes deben ser monitoreados adecuadamente. (Ver FARMACOLOGÍA CLÍNICA : Estudios de interacción farmacológica .)
Sirolimus
El fluconazol aumenta las concentraciones plasmáticas de sirolimus, presumiblemente al inhibir el metabolismo de sirolimus a través de CYP3A4 y la glicoproteína P. Esta combinación puede usarse con un ajuste de dosis de sirolimus dependiendo de las mediciones de efecto/concentración.
Tacrolimus
Fluconazol puede aumentar las concentraciones séricas de tacrolimus administrado por vía oral hasta 5 veces debido a la inhibición del metabolismo de tacrolimus a través de CYP3A4 en los intestinos. No se han observado cambios farmacocinéticos significativos cuando se administra tacrolimus por vía intravenosa. Los niveles elevados de tacrolimus se han asociado con nefrotoxicidad. La dosis de tacrolimus administrado por vía oral debe reducirse dependiendo de la concentración de tacrolimus. (Ver FARMACOLOGÍA CLÍNICA : Estudios de interacción farmacológica .)
teofilina
DIFLUCAN 50mg aumenta las concentraciones séricas de teofilina. Se recomienda un control cuidadoso de las concentraciones de teofilina sérica en pacientes que reciben DIFLUCAN 100 mg y teofilina. (Ver FARMACOLOGÍA CLÍNICA : Estudios de interacción farmacológica .)
tofacitinib
La exposición sistémica a tofacitinib aumenta cuando se coadministra tofacitinib con fluconazol. Reduzca la dosis de tofacitinib cuando se administre concomitantemente con fluconazol (es decir, de 5 mg dos veces al día a 5 mg una vez al día como se indica en la etiqueta de XELJANZ [tofacitinib]). (Ver FARMACOLOGÍA CLÍNICA : Estudios de interacción farmacológica .)
tolvaptán
La exposición plasmática a tolvaptán aumenta significativamente (200 % en AUC; 80 % en Cmax) cuando tolvaptán, un sustrato de CYP3A4, se administra junto con fluconazol, un inhibidor moderado de CYP3A4. Esta interacción puede resultar en el riesgo de un aumento significativo de reacciones adversas asociadas con tolvaptán, particularmente diuresis significativa, deshidratación e insuficiencia renal aguda. Si se administran concomitantemente tolvaptán y fluconazol, la dosis de tolvaptán debe reducirse como se indica en la información de prescripción de tolvaptán y el paciente debe ser monitoreado con frecuencia por cualquier reacción adversa asociada con tolvaptán.
triazolam
El fluconazol aumenta el AUC del triazolam (dosis única) en aproximadamente un 50 %, la Cmax en un 20 % a un 32 % y aumenta la t½ en un 25 % a un 50 % debido a la inhibición del metabolismo del triazolam. Pueden ser necesarios ajustes de dosis de triazolam.
Alcaloides de la Vinca
Aunque no se ha estudiado, el fluconazol puede aumentar los niveles plasmáticos de los alcaloides de la vinca (p. ej., vincristina y vinblastina) y provocar neurotoxicidad, que posiblemente se deba a un efecto inhibitorio sobre el CYP3A4.
vitamina a
Basado en un informe de caso en un paciente que recibió una terapia combinada con ácido todo-trans-retinoide (una forma ácida de la vitamina A) y fluconazol, se desarrollaron efectos indeseables relacionados con el sistema nervioso central (SNC) en forma de pseudotumor cerebral, que desapareció después de interrupción del tratamiento con fluconazol. Se puede utilizar esta combinación, pero se debe tener en cuenta la incidencia de efectos indeseables relacionados con el SNC.
Voriconazol
Evitar la administración concomitante de voriconazol y fluconazol. Se recomienda monitorear los eventos adversos y la toxicidad relacionados con el voriconazol; especialmente, si el voriconazol se inicia dentro de las 24 h posteriores a la última dosis de fluconazol. (Ver FARMACOLOGÍA CLÍNICA : Estudios de interacción farmacológica .)
Zidovudina
El fluconazol aumenta la Cmax y el AUC de zidovudina en un 84 % y un 74 %, respectivamente, debido a una disminución de aproximadamente un 45 % en el aclaramiento oral de zidovudina. La vida media de zidovudina también se prolongó en aproximadamente un 128 % después de la terapia combinada con fluconazol. Se debe monitorear a los pacientes que reciben esta combinación para detectar el desarrollo de reacciones adversas relacionadas con la zidovudina. Se puede considerar la reducción de la dosis de zidovudina.

Los médicos deben saber que no se han realizado estudios de interacción con medicamentos distintos a los enumerados en la sección FARMACOLOGÍA CLÍNICA, pero tales interacciones pueden ocurrir.
ADVERTENCIAS
PRECAUCIONES
General
Algunos azoles, incluido el fluconazol, se han asociado con la prolongación del intervalo QT en el electrocardiograma. El fluconazol provoca la prolongación del intervalo QT a través de la inhibición de la corriente del canal rectificador de potasio (Ikr). La prolongación del intervalo QT causada por otros medicamentos (como la amiodarona) puede amplificarse mediante la inhibición del citocromo P450 (CYP) 3A4. (Ver PRECAUCIONES : Interacciones con la drogas .) Durante la vigilancia posterior a la comercialización, ha habido casos raros de prolongación del intervalo QT y torsade de pointes en pacientes que toman fluconazol. La mayoría de estos informes involucraron a pacientes gravemente enfermos con múltiples factores de riesgo de confusión, como enfermedad cardíaca estructural, anomalías electrolíticas y medicamentos concomitantes que pueden haber contribuido. Los pacientes con hipopotasemia e insuficiencia cardíaca avanzada tienen un mayor riesgo de aparición de arritmias ventriculares potencialmente mortales y torsade de pointes.
Fluconazol debe administrarse con precaución a pacientes con estas condiciones potencialmente proarrítmicas.
El uso concomitante de fluconazol y eritromicina tiene el potencial de aumentar el riesgo de cardiotoxicidad (prolongación del intervalo QT, torsade de pointes) y, en consecuencia, muerte súbita del corazón. Esta combinación debe evitarse.
Fluconazol debe administrarse con precaución en pacientes con disfunción renal.
Se ha informado insuficiencia suprarrenal en pacientes que reciben azoles, incluido fluconazol. Se han notificado casos reversibles de insuficiencia suprarrenal en pacientes que reciben fluconazol.
DIFLUCAN 100 mg polvo para suspensión oral contiene sacarosa y no debe usarse en pacientes con deficiencia hereditaria de fructosa, glucosa/galactosa y sacarasa-isomaltasa.
Al conducir vehículos o utilizar máquinas, debe tenerse en cuenta que ocasionalmente pueden producirse mareos o convulsiones.
Dosís única
La conveniencia y la eficacia del régimen de fluconazol en comprimidos orales de dosis única para el tratamiento de las infecciones vaginales por hongos deben sopesarse frente a la aceptabilidad de una mayor incidencia de eventos adversos relacionados con el fármaco con DIFLUCAN (26 %) frente a los agentes intravaginales (16 %) en EE. UU. estudios clínicos comparativos. (Ver REACCIONES ADVERSAS y Estudios clínicos .)
Toxicología no clínica
Carcinogénesis, mutagénesis y deterioro de la fertilidad
El fluconazol no mostró evidencia de potencial carcinogénico en ratones y ratas tratados por vía oral durante 24 meses a dosis de 2,5 mg/kg/día, 5 mg/kg/día o 10 mg/kg/día (aproximadamente de 2 a 7 veces la dosis humana recomendada). ). Las ratas macho tratadas con 5 mg/kg/día y 10 mg/kg/día tuvieron una mayor incidencia de adenomas hepatocelulares.
Fluconazol, con o sin activación metabólica, fue negativo en las pruebas de mutagenicidad en cuatro cepas de S. typhimurium y en el sistema de linfoma de ratón L5178Y. Los estudios citogenéticos in vivo (células de médula ósea murina, luego de la administración oral de fluconazol) e in vitro (linfocitos humanos expuestos a fluconazol a 1000 mcg/mL) no mostraron evidencia de mutaciones cromosómicas.
El fluconazol no afectó la fertilidad de ratas macho o hembra tratadas por vía oral con dosis diarias de 5 mg/kg, 10 mg/kg o 20 mg/kg o con dosis parenterales de 5 mg/kg, 25 mg/kg o 75 mg. /kg, aunque el inicio del parto se retrasó ligeramente a 20 mg/kg PO. En un estudio perinatal intravenoso en ratas con 5 mg/kg, 20 mg/kg y 40 mg/kg, se observó distocia y prolongación del parto en algunas madres con 20 mg/kg (aproximadamente 5 a 15 veces la dosis humana recomendada ) y 40 mg/kg, pero no a 5 mg/kg. Las alteraciones en el parto se reflejaron en un ligero aumento en el número de crías muertas y una disminución de la supervivencia neonatal a estos niveles de dosis. Los efectos sobre el parto en ratas son consistentes con la propiedad de reducción de estrógeno específica de la especie producida por altas dosis de fluconazol. Tal cambio hormonal no se ha observado en mujeres tratadas con fluconazol. (Ver FARMACOLOGÍA CLÍNICA .)
El embarazo
Efectos teratogénicos
Potencial de daño fetal
Se debe evitar el uso durante el embarazo excepto en pacientes con infecciones fúngicas graves o potencialmente mortales en quienes se puede usar fluconazol si el beneficio anticipado supera el posible riesgo para el feto. Algunos informes de casos publicados describen un patrón de anomalías congénitas distintas en bebés expuestos en el útero a dosis altas de fluconazol materno (400 a 800 mg/día) durante la mayor parte o todo el primer trimestre. Estas anomalías informadas son similares a las observadas en estudios con animales. Se deben considerar medidas anticonceptivas eficaces en mujeres en edad fértil que están siendo tratadas con 400 a 800 mg/día de DIFLUCAN y deben continuar durante todo el período de tratamiento y durante aproximadamente 1 semana (5 a 6 semividas) después de la dosis final. Si se usa DIFLUCAN durante el embarazo, o si la paciente queda embarazada mientras toma el medicamento, se debe informar a la paciente sobre el peligro potencial para el feto. Los abortos espontáneos y las anomalías congénitas se han sugerido como riesgos potenciales asociados con 150 mg de fluconazol como dosis única o repetida en el primer trimestre del embarazo en base a estudios epidemiológicos retrospectivos. No hay estudios adecuados y bien controlados de DIFLUCAN 150 mg en mujeres embarazadas. (Ver ADVERTENCIAS : Potencial de daño fetal .)
Datos humanos
Los informes de casos describen un patrón distintivo y raro de defectos de nacimiento entre los bebés cuyas madres recibieron dosis altas (400 a 800 mg/día) de fluconazol durante la mayor parte o todo el primer trimestre del embarazo. Las características que se observan en estos bebés incluyen braquicefalia, facies anormal, desarrollo anómalo de la bóveda craneal, paladar hendido, arqueamiento femoral, costillas delgadas y huesos largos, artrogriposis y cardiopatía congénita. Estos efectos son similares a los observados en estudios con animales.
Los estudios epidemiológicos sugieren un riesgo potencial de aborto espontáneo y anomalías congénitas en lactantes cuyas madres fueron tratadas con 150 mg de fluconazol en dosis única o repetida en el primer trimestre, pero estos estudios epidemiológicos tienen limitaciones y estos hallazgos no se han confirmado en estudios clínicos controlados. juicios
Datos de animales
Se administró fluconazol por vía oral a conejas preñadas durante la organogénesis en dos estudios en dosis de 5 mg/kg, 10 mg/kg y 20 mg/kg y de 5 mg/kg, 25 mg/kg y 75 mg/kg, respectivamente. El aumento de peso materno se vio afectado en todos los niveles de dosis (aproximadamente 0,25 a 4 veces la dosis clínica de 400 mg según la comparación del área de superficie corporal [BSA]) y ocurrieron abortos con 75 mg/kg (aproximadamente 4 veces la dosis clínica de 400 mg según la comparación). BSA); no se observaron efectos fetales adversos.
En varios estudios en los que ratas preñadas recibieron fluconazol por vía oral durante la organogénesis, el aumento de peso materno se vio afectado y el peso de la placenta aumentó a 25 mg/kg. No hubo efectos fetales con 5 mg/kg o 10 mg/kg; se observaron aumentos en las variantes anatómicas fetales (costillas supernumerarias, dilatación de la pelvis renal) y retrasos en la osificación a dosis de 25 mg/kg y 50 mg/kg y superiores. En dosis que oscilan entre 80 y 320 mg/kg (aproximadamente de 2 a 8 veces la dosis clínica de 400 mg según el ASC), la embrioletalidad en ratas aumentó y las anomalías fetales incluyeron costillas onduladas, paladar hendido y osificación craneofacial anormal. Estos efectos son consistentes con la inhibición de la síntesis de estrógenos en ratas y pueden ser el resultado de los efectos conocidos de la disminución de estrógenos en el embarazo, la organogénesis y el parto.
Madres lactantes
El fluconazol estuvo presente en niveles bajos en la leche materna luego de la administración de una dosis única de 150 mg, según los datos de un estudio en 10 mujeres que amamantan que interrumpieron de forma temporal o permanente la lactancia entre 5 días y 19 meses después del parto. La dosis diaria estimada de fluconazol para lactantes a partir de la leche materna (suponiendo un consumo medio de leche de 150 ml/kg/día) basada en la concentración máxima media en leche (2,61 mcg/ml [rango: 1,57 a 3,65 mcg/ml] a las 5,2 horas dosis) fue de 0,39 mg/kg/día, que es aproximadamente el 13% de la dosis pediátrica recomendada para la candidiasis orofaríngea. (La dosis pediátrica indicada en la etiqueta es de 6 mg/kg/día el primer día, seguida de 3 mg/kg/día; la dosis infantil estimada es el 13 % de la dosis de mantenimiento de 3 mg/kg/día). No hay datos sobre los niveles de fluconazol en la leche después del uso repetido o después de dosis altas de fluconazol. Una encuesta publicada de 96 mujeres lactantes que fueron tratadas con 150 mg de fluconazol en días alternos (promedio de 7,3 cápsulas [rango de 1 a 29 cápsulas]) para la candidiasis mamaria asociada a la lactancia no informó reacciones adversas graves en los lactantes. Se debe tener precaución cuando se administre DIFLUCAN a una mujer lactante.
Uso pediátrico
Un ensayo controlado, aleatorizado y abierto ha demostrado que DIFLUCAN 100 mg es eficaz en el tratamiento de la candidiasis orofaríngea en niños de 6 meses a 13 años de edad. (Ver Estudios clínicos .)
El uso de DIFLUCAN 200 mg en niños con meningitis criptocócica, esofagitis por Candida o infecciones sistémicas por Candida está respaldado por la eficacia demostrada para estas indicaciones en adultos y por los resultados de varios estudios clínicos pediátricos pequeños no comparativos. Además, los estudios farmacocinéticos en niños (Ver FARMACOLOGÍA CLÍNICA ) han establecido una proporcionalidad de dosis entre niños y adultos. (Ver DOSIFICACIÓN Y ADMINISTRACIÓN .)
En un estudio no comparativo de niños con infecciones fúngicas sistémicas graves, la mayoría de las cuales eran candidemia, la eficacia de DIFLUCAN fue similar a la reportada para el tratamiento de la candidemia en adultos. De 17 sujetos con candidemia confirmada por cultivo, 11 de 14 (79 %) con síntomas basales (3 eran asintomáticos) tuvieron una cura clínica; 13/15 (87%) de los pacientes evaluables tuvieron una curación micológica al final del tratamiento, pero dos de estos pacientes recayeron a los 10 y 18 días, respectivamente, después de la interrupción de la terapia.
La eficacia de DIFLUCAN para la supresión de la meningitis criptocócica tuvo éxito en 4 de 5 niños tratados en un estudio de uso compasivo de fluconazol para el tratamiento de micosis graves o potencialmente mortales. No hay información sobre la eficacia de fluconazol para el tratamiento primario de la meningitis criptocócica en niños.
El perfil de seguridad de DIFLUCAN 200 mg en niños se estudió en 577 niños de 1 día a 17 años que recibieron dosis que oscilaron entre 1 y 15 mg/kg/día durante 1 a 1616 días. (Ver REACCIONES ADVERSAS .)
No se ha establecido la eficacia de DIFLUCAN en lactantes menores de 6 meses de edad. (Ver FARMACOLOGÍA CLÍNICA .) Un pequeño número de pacientes (29) con edades comprendidas entre 1 día y 6 meses han sido tratados de forma segura con DIFLUCAN.
Uso geriátrico
En pacientes sin SIDA, se informaron efectos secundarios posiblemente relacionados con el tratamiento con fluconazol en menos pacientes de 65 años o más (9 %, n = 339) que en pacientes más jóvenes (14 %, n = 2240). Sin embargo, no hubo una diferencia constante entre los pacientes mayores y los más jóvenes con respecto a los efectos secundarios individuales. De los efectos secundarios informados con mayor frecuencia (>1 %), sarpullido, vómitos y diarrea ocurrieron en mayor proporción en pacientes de mayor edad. Proporciones similares de pacientes mayores (2,4 %) y pacientes más jóvenes (1,5 %) interrumpieron el tratamiento con fluconazol debido a los efectos secundarios. En la experiencia posterior a la comercialización, los informes espontáneos de anemia e insuficiencia renal aguda fueron más frecuentes entre los pacientes de 65 años o más que entre los de 12 y 65 años. Sin embargo, debido a la naturaleza voluntaria de los informes y al aumento natural de la incidencia de anemia e insuficiencia renal en los ancianos, no es posible establecer una relación causal con la exposición al fármaco.
Los ensayos clínicos controlados de fluconazol no incluyeron un número suficiente de pacientes de 65 años o más para evaluar si responden de manera diferente a los pacientes más jóvenes en cada indicación. Otra experiencia clínica informada no ha identificado diferencias en las respuestas entre los ancianos y los pacientes más jóvenes.
El fluconazol se elimina principalmente por excreción renal como fármaco inalterado. Debido a que es más probable que los pacientes de edad avanzada tengan una función renal disminuida, se debe tener cuidado al ajustar la dosis según el aclaramiento de creatinina. Puede ser útil para controlar la función renal. (Ver FARMACOLOGÍA CLÍNICA y DOSIFICACIÓN Y ADMINISTRACIÓN .)
SOBREDOSIS
Ha habido informes de sobredosis con fluconazol acompañadas de alucinaciones y comportamiento paranoico.
En caso de sobredosis, se debe instaurar un tratamiento sintomático (con medidas de apoyo y lavado gástrico si está clínicamente indicado).
El fluconazol se excreta en gran parte en la orina. Una sesión de hemodiálisis de 3 horas disminuye los niveles plasmáticos en aproximadamente un 50%.
En ratones y ratas que recibieron dosis muy altas de fluconazol, los efectos clínicos en ambas especies incluyeron disminución de la motilidad y la respiración, ptosis, lagrimeo, salivación, incontinencia urinaria, pérdida del reflejo de enderezamiento y cianosis; la muerte a veces estaba precedida por convulsiones clónicas.
CONTRAINDICACIONES
DIFLUCAN (fluconazol) está contraindicado en pacientes que hayan mostrado hipersensibilidad al fluconazol oa alguno de sus excipientes. No hay información sobre hipersensibilidad cruzada entre fluconazol y otros agentes antifúngicos azoles. Se debe tener precaución al prescribir DIFLUCAN a pacientes con hipersensibilidad a otros azoles. La coadministración de otros fármacos que prolongan el intervalo QT y que se metabolizan a través de la enzima CYP3A4, como eritromicina, pimozida y quinidina, está contraindicada en pacientes que reciben fluconazol. (Ver FARMACOLOGÍA CLÍNICA : Estudios de interacción farmacológica y PRECAUCIONES .)
FARMACOLOGÍA CLÍNICA
Farmacocinética y Metabolismo
Las propiedades farmacocinéticas de fluconazol son similares tras la administración por vía intravenosa u oral. En voluntarios normales, la biodisponibilidad del fluconazol administrado por vía oral es superior al 90 % en comparación con la administración intravenosa. Se estableció la bioequivalencia entre el comprimido de 100 mg y ambas concentraciones de suspensión cuando se administró como una dosis única de 200 mg.
Las concentraciones plasmáticas máximas (Cmax) en voluntarios normales en ayunas ocurren entre 1 y 2 horas con una vida media de eliminación plasmática terminal de aproximadamente 30 horas (rango: 20 a 50 horas) después de la administración oral.
En voluntarios normales en ayunas, la administración de una dosis oral única de 400 mg de DIFLUCAN (fluconazol) conduce a una Cmáx media de 6,72 mcg/mL (rango: 4,12 a 8,08 mcg/mL) y después de dosis orales únicas de 50 a 400 mg, fluconazol las concentraciones plasmáticas y el área bajo la curva de concentración plasmática-tiempo (AUC) son proporcionales a la dosis.
Los datos de Cmax y AUC de un estudio del efecto de los alimentos que involucró la administración de tabletas de DIFLUCAN (fluconazol) a voluntarios sanos en ayunas y con una comida rica en grasas indicaron que la exposición al fármaco no se ve afectada por los alimentos. Por lo tanto, DIFLUCAN puede tomarse independientemente de las comidas. (Ver DOSIFICACIÓN Y ADMINISTRACIÓN .)
Las concentraciones en estado estacionario se alcanzan dentro de los 5 a 10 días posteriores a la administración de dosis orales de 50 a 400 mg una vez al día. La administración de una dosis de carga (el día 1) del doble de la dosis diaria habitual produce concentraciones plasmáticas cercanas al estado estacionario en el segundo día. El volumen aparente de distribución de fluconazol se aproxima al del agua corporal total. La unión a proteínas plasmáticas es baja (11 a 12%). Luego de dosis orales únicas o múltiples por hasta 14 días, el fluconazol penetra en todos los fluidos corporales estudiados (ver La mesa debajo ). En voluntarios normales, las concentraciones de fluconazol en la saliva fueron iguales o ligeramente mayores que las concentraciones plasmáticas, independientemente de la dosis, vía o duración de la dosificación. En pacientes con bronquiectasias, las concentraciones de fluconazol en el esputo luego de una dosis oral única de 150 mg fueron iguales a las concentraciones plasmáticas a las 4 y 24 horas posteriores a la dosis. En pacientes con meningitis fúngica, las concentraciones de fluconazol en el líquido cefalorraquídeo (LCR) son aproximadamente el 80 % de las concentraciones plasmáticas correspondientes.
Una dosis oral única de 150 mg de fluconazol administrada a 27 pacientes penetró en el tejido vaginal, dando como resultado una relación tejido:plasma que oscilaba entre 0,94 y 1,14 durante las primeras 48 horas posteriores a la administración.
Una dosis oral única de 150 mg de fluconazol administrada a 14 pacientes penetró en el fluido vaginal, dando como resultado una relación fluido:plasma que oscilaba entre 0,36 y 0,71 durante las primeras 72 horas posteriores a la dosificación.
En voluntarios normales, el fluconazol se elimina principalmente por excreción renal, y aproximadamente el 80 % de la dosis administrada aparece en la orina como fármaco inalterado. Alrededor del 11% de la dosis se excreta en la orina como metabolitos.
La farmacocinética de fluconazol se ve marcadamente afectada por la reducción de la función renal. Existe una relación inversa entre la vida media de eliminación y el aclaramiento de creatinina. Puede ser necesario reducir la dosis de DIFLUCAN en pacientes con insuficiencia renal. (Ver DOSIFICACIÓN Y ADMINISTRACIÓN .) Una sesión de hemodiálisis de 3 horas disminuye las concentraciones plasmáticas en aproximadamente un 50%.
En voluntarios normales, la administración de DIFLUCAN (dosis que oscilan entre 200 mg y 400 mg una vez al día durante un máximo de 14 días) se asoció con efectos pequeños e inconsistentes sobre las concentraciones de testosterona, las concentraciones de corticosteroides endógenos y la respuesta de cortisol estimulada por la hormona adrenocorticotrópica (ACTH).
Farmacocinética en niños
En niños, se han notificado los siguientes datos farmacocinéticos {Media (%cv)}:
El aclaramiento corregido por el peso corporal no se vio afectado por la edad en estos estudios. Se informa que el aclaramiento corporal medio en adultos es de 0,23 (17 %) ml/min/kg.
En recién nacidos prematuros (edad gestacional de 26 a 29 semanas), el aclaramiento medio (% cv) dentro de las 36 horas posteriores al nacimiento fue de 0,180 (35 %, N=7) ml/min/kg, que aumentó con el tiempo hasta una media de 0,218 ( 31 %, N=9) ml/min/kg seis días después y 0,333 (56 %, N=4) ml/min/kg 12 días después. De manera similar, la vida media fue de 73,6 horas, que disminuyó con el tiempo a una media de 53,2 horas seis días después y 46,6 horas 12 días después.
Farmacocinética en ancianos
Se realizó un estudio farmacocinético en 22 sujetos de 65 años de edad o mayores que recibieron una dosis oral única de 50 mg de fluconazol. Diez de estos pacientes estaban recibiendo diuréticos concomitantemente. La Cmax fue de 1,54 mcg/ml y se produjo 1,3 horas después de la dosis. El AUC medio fue de 76,4 ± 20,3 mcg•h/ml y la semivida terminal media fue de 46,2 horas. Estos valores de parámetros farmacocinéticos son más altos que los valores análogos informados para voluntarios masculinos jóvenes normales. La coadministración de diuréticos no alteró significativamente el AUC o la Cmax. Además, la depuración de creatinina (74 ml/min), el porcentaje de fármaco recuperado sin cambios en la orina (0 a 24 horas, 22 %) y las estimaciones de depuración renal de fluconazol (0,124 ml/min/kg) para los ancianos fueron generalmente más bajos que las de los voluntarios más jóvenes. Así, la alteración de la disposición de fluconazol en los ancianos parece estar relacionada con la función renal reducida característica de este grupo. Un gráfico de la semivida de eliminación terminal de cada sujeto frente al aclaramiento de creatinina en comparación con la semivida predicha: la curva de aclaramiento de creatinina derivada de sujetos normales y sujetos con diversos grados de insuficiencia renal indicó que 21 de 22 sujetos se encontraban dentro el límite de confianza del 95 % de las curvas de depuración de creatinina de semivida predichas. Estos resultados son consistentes con la hipótesis de que los valores más altos de los parámetros farmacocinéticos observados en los sujetos de edad avanzada en comparación con los voluntarios varones jóvenes normales se deben a la disminución de la función renal que se espera en los ancianos.
Estudios de interacción farmacológica
(Ver INTERACCIONES CON LA DROGAS )
Anticonceptivos orales
Los anticonceptivos orales se administraron en dosis única tanto antes como después de la administración oral de DIFLUCAN 50 mg una vez al día durante 10 días en 10 mujeres sanas. No hubo diferencia significativa en el AUC de etinilestradiol o levonorgestrel después de la administración de 50 mg de DIFLUCAN. El aumento medio del AUC de etinilestradiol fue del 6 % (rango: –47 a 108 %) y el AUC de levonorgestrel aumentó un 17 % (rango: –33 a 141 %).
En un segundo estudio, veinticinco mujeres normales recibieron dosis diarias de tabletas de 200 mg de DIFLUCAN y de 150 mg o de placebo durante dos períodos de diez días. Los ciclos de tratamiento se realizaron con un mes de diferencia y todos los sujetos recibieron DIFLUCAN durante un ciclo y placebo durante el otro. El orden de tratamiento del estudio fue aleatorio. Se administraron dosis únicas de una tableta anticonceptiva oral que contenía levonorgestrel y etinilestradiol el último día de tratamiento (Día 10) de ambos ciclos. Después de la administración de 200 mg de DIFLUCAN, el aumento porcentual medio del AUC de levonorgestrel en comparación con el placebo fue del 25 % (rango: –12 a 82 %) y el aumento porcentual medio del etinilestradiol en comparación con el placebo fue del 38 % (rango: –11 a 101%). Ambos aumentos fueron estadísticamente significativos diferentes del placebo.
Un tercer estudio evaluó la posible interacción de una dosis semanal de 300 mg de fluconazol en 21 mujeres normales que tomaban un anticonceptivo oral que contenía etinilestradiol y noretindrona. En este estudio cruzado de dos vías, doble ciego, aleatorizado, controlado con placebo, realizado durante tres ciclos de tratamiento anticonceptivo oral, la dosificación de fluconazol resultó en pequeños aumentos en las AUC medias de etinilestradiol y noretindrona en comparación con una dosificación similar de placebo. Las AUC medias de etinilestradiol y noretindrona aumentaron un 24 % (rango de IC del 95 %: 18 a 31 %) y 13 % (rango de IC del 95 %: 8 a 18 %), respectivamente, en relación con el placebo. El tratamiento con fluconazol no provocó una disminución en el AUC del etinilestradiol de ningún sujeto individual en este estudio en comparación con la dosis de placebo. Los valores individuales de AUC de noretindrona disminuyeron muy ligeramente (
cimetidina
DIFLUCAN 100 mg se administró como dosis oral única sola y dos horas después de una dosis única de cimetidina 400 mg a seis voluntarios masculinos sanos. Después de la administración de cimetidina, hubo una disminución significativa en el AUC y la Cmax de fluconazol. Hubo una disminución media ± SD en el AUC de fluconazol de 13 % ± 11 % (rango: –3,4 a –31 %) y la Cmax disminuyó 19 % ± 14 % (rango: –5 a –40 %). Sin embargo, la administración de 600 mg a 900 mg de cimetidina por vía intravenosa durante un período de cuatro horas (desde una hora antes hasta 3 horas después de una dosis oral única de DIFLUCAN 200 mg) no afectó la biodisponibilidad ni la farmacocinética de fluconazol en 24 voluntarios varones sanos. .
Neutralizador de acidez
La administración de Maalox® (20 mL) a 14 voluntarios masculinos normales inmediatamente antes de una dosis única de DIFLUCAN 100 mg no tuvo efecto sobre la absorción o eliminación de fluconazol.
hidroclorotiazida
La administración oral concomitante de 100 mg de DIFLUCAN y 50 mg de hidroclorotiazida durante 10 días en 13 voluntarios normales resultó en un aumento significativo en el AUC y Cmax de fluconazol en comparación con DIFLUCAN administrado solo. Hubo un aumento medio ± DE en el AUC y Cmax de fluconazol del 45 % ± 31 % (rango: 19 a 114 %) y 43 % ± 31 % (rango: 19 a 122 %), respectivamente. Estos cambios se atribuyen a una reducción media ± DE del aclaramiento renal del 30 % ± 12 % (rango: –10 a –50 %).
rifampicina
La administración de una dosis oral única de 200 mg de DIFLUCAN 200 mg después de 15 días de rifampicina administrada como 600 mg diarios en ocho voluntarios varones sanos resultó en una disminución significativa en el AUC de fluconazol y un aumento significativo en el aclaramiento oral aparente de fluconazol. Hubo una reducción media ± DE en el AUC de fluconazol de 23 % ± 9 % (rango: –13 a –42 %). El aclaramiento oral aparente de fluconazol aumentó un 32 % ± 17 % (rango: 16 a 72 %). La vida media de fluconazol disminuyó de 33,4 ± 4,4 horas a 26,8 ± 3,9 horas. (Ver PRECAUCIONES .)
warfarina
Hubo un aumento significativo en la respuesta del tiempo de protrombina (área bajo la curva de tiempo-tiempo de protrombina) después de una dosis única de warfarina (15 mg) administrada a 13 voluntarios masculinos normales después de DIFLUCAN 200 mg por vía oral administrado diariamente durante 14 días en comparación con la administración de warfarina sola. Hubo un aumento medio ± DE en la respuesta del tiempo de protrombina (área bajo la curva de tiempo de protrombina) de 7% ± 4% (rango: –2 a 13%). (Ver PRECAUCIONES .) La media se basa en datos de 12 sujetos, ya que uno de los 13 sujetos experimentó un aumento del doble en su respuesta del tiempo de protrombina.
fenitoína
El AUC de fenitoína se determinó después de 4 días de dosificación de fenitoína (200 mg diarios, por vía oral durante 3 días seguidos de 250 mg por vía intravenosa para una dosis) con y sin la administración de fluconazol (DIFLUCAN oral 200 mg diarios durante 16 días) en 10 hombres normales. voluntarios Hubo un aumento significativo en el AUC de la fenitoína. El aumento medio ± DE del AUC de la fenitoína fue del 88 % ± 68 % (rango: 16 a 247 %). Se desconoce la magnitud absoluta de esta interacción debido a la disposición intrínsecamente no lineal de la fenitoína. (Ver PRECAUCIONES .)
ciclosporina
Se determinaron el AUC y la Cmax de ciclosporina antes y después de la administración de 200 mg diarios de fluconazol durante 14 días en ocho pacientes con trasplante renal que habían estado en tratamiento con ciclosporina durante al menos 6 meses y con una dosis estable de ciclosporina durante al menos 6 semanas. Hubo un aumento significativo en el AUC, Cmax, Cmin (concentración de 24 horas) de ciclosporina y una reducción significativa en el aclaramiento oral aparente después de la administración de fluconazol. El aumento medio ± DE del AUC fue del 92 % ± 43 % (rango: 18 a 147 %). La Cmax aumentó 60% ± 48% (rango: –5 a 133%). La Cmáx aumentó 157% ± 96% (rango: 33 a 360%). El aclaramiento oral aparente disminuyó 45% ± 15% (rango: –15 a –60%). (Ver PRECAUCIONES .)
Zidovudina
Las concentraciones plasmáticas de zidovudina se determinaron en dos ocasiones (antes y después de fluconazol 200 mg diarios durante 15 días) en 13 voluntarios con SIDA o ARC que recibieron una dosis estable de zidovudina durante al menos dos semanas. Hubo un aumento significativo en el AUC de zidovudina luego de la administración de fluconazol. El aumento medio ± DE del AUC fue del 20 % ± 32 % (rango: –27 a 104 %). La relación entre el metabolito, GZDV y el fármaco original disminuyó significativamente después de la administración de fluconazol, de 7,6 ± 3,6 a 5,7 ± 2,2.
teofilina
La farmacocinética de la teofilina se determinó a partir de una dosis intravenosa única de aminofilina (6 mg/kg) antes y después de la administración oral de 200 mg diarios de fluconazol durante 14 días en 16 voluntarios masculinos normales. Hubo aumentos significativos en el AUC, la Cmax y la vida media de la teofilina con una disminución correspondiente en el aclaramiento. El AUC de teofilina media ± DE aumentó un 21 % ± 16 % (rango: –5 a 48 %). La Cmax aumentó 13% ± 17% (rango: –13 a 40%). El aclaramiento de teofilina disminuyó 16% ± 11% (rango: –32 a 5%). La vida media de la teofilina aumentó de 6,6 ± 1,7 horas a 7,9 ± 1,5 horas. (Ver PRECAUCIONES .)
quinidina
Aunque no se ha estudiado in vitro ni in vivo, la administración concomitante de fluconazol con quinidina puede provocar la inhibición del metabolismo de la quinidina. El uso de quinidina se ha asociado con la prolongación del intervalo QT y casos raros de torsade de pointes. Está contraindicada la coadministración de fluconazol y quinidina. (Ver CONTRAINDICACIONES y PRECAUCIONES .)
Hipoglucemiantes orales
Los efectos de fluconazol sobre la farmacocinética de los agentes hipoglucemiantes orales de sulfonilurea tolbutamida, glipizida y gliburida se evaluaron en tres estudios controlados con placebo en voluntarios normales. Todos los sujetos recibieron la sulfonilurea sola como dosis única y nuevamente como dosis única luego de la administración de DIFLUCAN 100 mg diarios durante 7 días. En estos tres estudios, 22/46 (47,8 %) de los pacientes tratados con DIFLUCAN y 9/22 (40,1 %) de los pacientes tratados con placebo experimentaron síntomas compatibles con hipoglucemia. (Ver PRECAUCIONES .)
tolbutamida
En 13 voluntarios masculinos normales, hubo un aumento significativo en el AUC y la Cmax de tolbutamida (dosis única de 500 mg) después de la administración de fluconazol. Hubo un aumento medio ± DE en el AUC de tolbutamida de 26 % ± 9 % (rango: 12 a 39 %). La Cmáx de tolbutamida aumentó un 11 % ± 9 % (rango: –6 a 27 %). (Ver PRECAUCIONES .)
Glipizida
El AUC y la Cmax de glipizida (dosis única de 2,5 mg) aumentaron significativamente tras la administración de fluconazol en 13 voluntarios varones normales. Hubo un aumento medio ± DE en AUC de 49 % ± 13 % (rango: 27 a 73 %) y un aumento en la Cmax de 19 % ± 23 % (rango: –11 a 79 %). (Ver PRECAUCIONES .)
Gliburida
El AUC y la Cmax de gliburida (dosis única de 5 mg) aumentaron significativamente tras la administración de fluconazol en 20 voluntarios varones normales. Hubo un aumento medio ± SD en el AUC de 44 % ± 29 % (rango: –13 a 115 %) y la Cmax aumentó 19 % ± 19 % (rango: –23 a 62 %). Cinco sujetos requirieron glucosa oral luego de la ingestión de gliburida después de 7 días de administración de fluconazol. (Ver PRECAUCIONES .)
rifabutina
Se han publicado informes de que existe una interacción cuando fluconazol se administra concomitantemente con rifabutina, lo que lleva a un aumento de los niveles séricos de rifabutina. (Ver PRECAUCIONES .)
Tacrolimus
Se han publicado informes de que existe una interacción cuando fluconazol se administra concomitantemente con tacrolimus, lo que lleva a un aumento de los niveles séricos de tacrolimus. (Ver PRECAUCIONES .)
midazolam
El efecto del fluconazol sobre la farmacocinética y la farmacodinámica del midazolam se examinó en un estudio cruzado aleatorizado en 12 voluntarios. En el estudio, los sujetos ingirieron placebo o 400 mg de fluconazol el día 1 seguido de 200 mg diarios desde el día 2 hasta el día 6. Además, se ingirió una dosis de 7,5 mg de midazolam por vía oral el primer día, 0,05 mg/kg por vía intravenosa el cuarto día y 7,5 mg por vía oral el sexto día. El fluconazol redujo el aclaramiento del midazolam intravenoso en un 51 %. El primer día de dosificación, fluconazol aumentó el AUC y la Cmax de midazolam en un 259 % y un 150 %, respectivamente. En el sexto día de dosificación, fluconazol aumentó el AUC y la Cmax de midazolam en un 259 % y un 74 %, respectivamente. Los efectos psicomotores del midazolam aumentaron significativamente después de la administración oral de midazolam, pero no se vieron afectados significativamente después del midazolam intravenoso.
Se realizó un segundo estudio aleatorizado, doble simulación, controlado con placebo, cruzado en tres fases para determinar el efecto de la vía de administración de fluconazol en la interacción entre fluconazol y midazolam. En cada fase, los sujetos recibieron fluconazol oral 400 mg y solución salina intravenosa; placebo oral y fluconazol intravenoso 400 mg; y placebo oral y solución salina IV. Se ingirió una dosis oral de 7,5 mg de midazolam después de fluconazol/placebo. El AUC y la Cmax de midazolam fueron significativamente mayores después de la administración oral que IV de fluconazol. El fluconazol oral aumentó el AUC y la Cmax de midazolam en un 272 % y un 129 %, respectivamente. El fluconazol IV aumentó el AUC y la Cmax de midazolam en un 244 % y un 79 %, respectivamente. Tanto el fluconazol oral como el intravenoso aumentaron los efectos farmacodinámicos del midazolam. (Ver PRECAUCIONES .)
Azitromicina
Un estudio abierto, aleatorizado, cruzado de tres vías en 18 sujetos sanos evaluó el efecto de una dosis oral única de 800 mg de fluconazol en la farmacocinética de una dosis oral única de azitromicina de 1200 mg, así como los efectos de la azitromicina en la farmacocinética de fluconazol. No hubo interacción farmacocinética significativa entre fluconazol y azitromicina.
Voriconazol
Voriconazol es un sustrato para las isoenzimas CYP2C9 y CYP3A4. La administración simultánea de voriconazol oral (400 mg cada 12 horas durante 1 día, luego 200 mg cada 12 horas durante 2,5 días) y fluconazol oral (400 mg el día 1, luego 200 mg cada 24 horas durante 4 días) a 6 sujetos masculinos sanos resultó en un aumento de la Cmáx. y AUCτ de voriconazol en un promedio de 57 % (90 % CI: 20 % a 107 %) y 79 % (90 % CI: 40 % a 128 %), respectivamente. En un estudio clínico de seguimiento que involucró a 8 sujetos masculinos sanos, la dosis reducida y/o la frecuencia de voriconazol y fluconazol no eliminó ni disminuyó este efecto. No se recomienda la administración concomitante de voriconazol y fluconazol a ninguna dosis. Se recomienda una estrecha vigilancia de los eventos adversos relacionados con voriconazol si se usa voriconazol de forma secuencial después de fluconazol, especialmente dentro de las 24 h posteriores a la última dosis de fluconazol. (Ver PRECAUCIONES .)
tofacitinib
La coadministración de fluconazol (400 mg el día 1 y 200 mg una vez al día durante 6 días [días 2 a 7]) y tofacitinib (dosis única de 30 mg el día 5) en sujetos sanos resultó en un aumento de los valores medios de AUC y Cmax de tofacitinib de aproximadamente 79 % (90 % IC: 64 % a 96 %) y 27 % (90 % IC: 12 % a 44 %), respectivamente, en comparación con la administración de tofacitinib solo. (Ver PRECAUCIONES .)
Microbiología
Mecanismo de acción
El fluconazol es un inhibidor altamente selectivo de la enzima lanosterol 14-α-desmetilasa dependiente del citocromo P450 fúngico. Esta enzima funciona para convertir el lanosterol en ergosterol. La pérdida posterior de esteroles normales se correlaciona con la acumulación de 14-α-metilesteroles en hongos y puede ser responsable de la actividad fungistática de fluconazol. La desmetilación de células de mamíferos es mucho menos sensible a la inhibición de fluconazol.
Resistencia
Es bien conocido el potencial de desarrollo de resistencia al fluconazol. Los aislados fúngicos que muestran una susceptibilidad reducida a otros azoles también pueden mostrar una susceptibilidad reducida al fluconazol. Se desconoce la frecuencia de desarrollo de resistencia a los medicamentos para los diversos hongos para los que está indicado este medicamento.
La resistencia al fluconazol puede surgir de una modificación en la calidad o cantidad de la enzima objetivo (lanosterol 14-α-desmetilasa), acceso reducido al objetivo del fármaco o alguna combinación de estos mecanismos.
Las mutaciones puntuales en el gen (ERG11) que codifica la enzima diana conducen a una diana alterada con menor afinidad por los azoles. La sobreexpresión de ERG11 da como resultado la producción de altas concentraciones de la enzima diana, lo que crea la necesidad de concentraciones intracelulares de fármaco más altas para inhibir todas las moléculas de enzima en la célula.
El segundo mecanismo principal de la resistencia a los fármacos implica la salida activa de fluconazol fuera de la célula a través de la activación de dos tipos de transportadores de salida de múltiples fármacos; los principales facilitadores (codificados por genes MDR) y los de la superfamilia de cassettes de unión a ATP (codificados por genes CDR). La regulación al alza del gen MDR conduce a la resistencia a fluconazol, mientras que la regulación al alza de los genes CDR puede conducir a la resistencia a múltiples azoles.
La resistencia en Candida glabrata por lo general incluye la regulación al alza de los genes CDR, lo que resulta en resistencia a múltiples azoles. Para un aislado donde la concentración inhibitoria mínima (MIC) se categoriza como Intermedia (16 a 32 mcg/mL), se recomienda la dosis más alta de fluconazol.
Candida krusei debe considerarse resistente a fluconazol. La resistencia en C. krusei parece estar mediada por una sensibilidad reducida de la enzima diana a la inhibición por el agente.
Ha habido informes de casos de superinfección con especies de Candida distintas de C. albicans, que a menudo no son inherentemente susceptibles a DIFLUCAN (p. ej., Candida krusei). Tales casos pueden requerir una terapia antimicótica alternativa.
Actividad antimicrobiana
Se ha demostrado que el fluconazol es activo contra la mayoría de los aislados de los siguientes microorganismos tanto in vitro como en infecciones clínicas.
Candida albicans Candida glabrata (Muchos aislados son medianamente susceptibles) Candida parapsilosis Candida tropicalis Cryptococcus neoformans
Los siguientes datos in vitro están disponibles, pero se desconoce su significado clínico. Al menos el 90 % de los siguientes hongos presentan una CIM in vitro inferior o igual al punto de corte susceptible para fluconazol (https://www.fda.gov/STIC) frente a aislamientos de género o grupo de organismos similares. Sin embargo, la eficacia de fluconazol en el tratamiento de infecciones clínicas debidas a estos hongos no se ha establecido en ensayos clínicos adecuados y bien controlados.
Candida dubliniensis Candida guilliermondii Candida kefyr Candida lusitaniae
Candida krusei debe considerarse resistente a fluconazol. La resistencia en C. krusei parece estar mediada por una sensibilidad reducida de la enzima diana a la inhibición por el agente.
Ha habido informes de casos de superinfección con especies de Candida distintas de C. albicans, que a menudo no son inherentemente susceptibles a DIFLUCAN (p. ej., Candida krusei). Tales casos pueden requerir una terapia antimicótica alternativa.
Pruebas de susceptibilidad
Para obtener información específica sobre los criterios interpretativos de las pruebas de susceptibilidad y los métodos de prueba asociados y los estándares de control de calidad reconocidos por la FDA para este medicamento, consulte: https://www.fda.gov/STIC.
Estudios clínicos
Meningitis criptocócica
En un estudio multicéntrico que comparó DIFLUCAN (200 mg/día) con anfotericina B (0,3 mg/kg/día) para el tratamiento de la meningitis criptocócica en pacientes con SIDA, un análisis multivariante reveló tres factores previos al tratamiento que predecían la muerte durante el curso de la terapia: estado mental, título de antígeno criptocócico en líquido cefalorraquídeo superior a 1:1024 y recuento de glóbulos blancos en líquido cefalorraquídeo inferior a 20 células/mm³. La mortalidad entre los pacientes de alto riesgo fue del 33 % y el 40 % para los pacientes con anfotericina B y DIFLUCAN, respectivamente (p=0,58), con muertes generales del 14 % (9 de 63 sujetos) y del 18 % (24 de 131 sujetos) para los 2 brazos de el estudio (p=0,48). Las dosis y los regímenes óptimos para pacientes con meningitis criptocócica aguda y con alto riesgo de fracaso del tratamiento aún no se han determinado. (Saag, et al. N Engl J Med 1992; 326:83-9.)
Candidiasis vaginal
Se realizaron dos estudios adecuados y bien controlados en los EE. UU. usando la tableta de 150 mg. En ambos, los resultados del régimen de fluconazol fueron comparables al régimen de control (clotrimazol o miconazol por vía intravaginal durante 7 días), tanto clínica como estadísticamente en la evaluación de un mes posterior al tratamiento.
La tasa de curación terapéutica, definida como una resolución completa de los signos y síntomas de la candidiasis vaginal (cura clínica), junto con un examen de KOH negativo y un cultivo negativo para Candida (erradicación microbiológica), fue del 55 % tanto en el grupo de fluconazol como en los productos vaginales. grupo.
Aproximadamente tres cuartas partes de las pacientes inscritas tenían vaginitis aguda (
Se informaron sustancialmente más eventos gastrointestinales en el grupo de fluconazol en comparación con el grupo del producto vaginal. La mayoría de los eventos fueron de leves a moderados. Debido a que el fluconazol se administró en una sola dosis, no se produjeron interrupciones.
Estudios pediátricos
Candidiasis orofaríngea
Se realizó un estudio comparativo abierto de la eficacia y seguridad de DIFLUCAN (2 a 3 mg/kg/día) y la nistatina oral (400 000 UI 4 veces al día) en niños inmunocomprometidos con candidiasis orofaríngea. Las tasas de respuesta clínica y micológica fueron mayores en los niños tratados con fluconazol.
Se notificó la curación clínica al final del tratamiento en el 86 % de los pacientes tratados con fluconazol en comparación con el 46 % de los pacientes tratados con nistatina. Micológicamente, el organismo infeccioso fue erradicado en el 76 % de los pacientes tratados con fluconazol, en comparación con el 11 % de los pacientes tratados con nistatina.
La proporción de pacientes con recaída clínica 2 semanas después de finalizar el tratamiento fue del 14 % para los sujetos que recibieron DIFLUCAN y del 16 % para los sujetos que recibieron nistatina. A las 4 semanas de finalizado el tratamiento, los porcentajes de pacientes con recidiva clínica fueron del 22% para DIFLUCAN 150mg y del 23% para nistatina.
INFORMACIÓN DEL PACIENTE
DIFLUCAN® (tinte-FLEW-kan) (fluconazol) Tabletas
Este prospecto contiene información importante sobre DIFLUCAN. No pretende reemplazar las instrucciones de su proveedor de atención médica. Lea esta información detenidamente antes de tomar DIFLUCAN. Pregúntele a su proveedor de atención médica si no entiende algo de esta información o si desea saber más sobre DIFLUCAN.
¿Qué es DIFLUCAN 100mg?
DIFLUCAN es un medicamento recetado que se usa para tratar las infecciones vaginales por hongos causadas por una levadura llamada Candida. DIFLUCAN 150 mg ayuda a detener el crecimiento excesivo de hongos en la vagina para que la infección por hongos desaparezca.
DIFLUCAN 150 mg es diferente de otros tratamientos para las infecciones vaginales por hongos porque es una tableta que se toma por vía oral. DIFLUCAN también se usa para otras condiciones. Sin embargo, este folleto solo trata sobre el uso de DIFLUCAN 50 mg para infecciones vaginales por hongos. Para obtener información sobre el uso de DIFLUCAN 200 mg por otros motivos, consulte a su proveedor de atención médica. Consulte la sección de este prospecto para obtener información sobre las infecciones vaginales por hongos.
¿Qué es una candidiasis vaginal?
Es normal que se encuentre cierta cantidad de levadura en la vagina. A veces comienza a crecer demasiada levadura en la vagina y esto puede causar una infección por levaduras. Las infecciones vaginales por hongos son comunes. Aproximadamente tres de cada cuatro mujeres adultas tendrán al menos una candidiasis vaginal durante su vida.
Algunos medicamentos y condiciones médicas pueden aumentar su probabilidad de contraer una candidiasis. Si está embarazada, tiene diabetes, usa píldoras anticonceptivas o toma antibióticos, es posible que tenga infecciones por hongos con más frecuencia que otras mujeres. La higiene personal y ciertos tipos de ropa pueden aumentar sus posibilidades de contraer una candidiasis. Pídale consejos a su proveedor de atención médica sobre lo que puede hacer para ayudar a prevenir las infecciones vaginales por hongos. Si contrae una candidiasis vaginal, es posible que tenga alguno de los siguientes síntomas:
- Comezón
- una sensación de ardor al orinar
- enrojecimiento
- dolor
- un flujo vaginal blanco y espeso que parece requesón
No tome DIFLUCAN si Ud.
- tomar los siguientes medicamentos:
- quinidina
- eritromicina
- pimozida
- es alérgico al fluconazol, el ingrediente activo de DIFLUCAN 50 mg o cualquiera de los ingredientes de DIFLUCAN. Consulte el final de este folleto de información para el paciente para obtener una lista completa de los ingredientes de DIFLUCAN.
Antes de tomar DIFLUCAN, informe a su proveedor de atención médica sobre todas sus afecciones médicas, si:
- tiene problemas hepáticos
- tiene problemas renales
- tiene problemas cardíacos, incluidas arritmias cardíacas
- tiene hipopotasemia (potasio bajo)
- está embarazada o planea quedar embarazada. Informe a su proveedor de atención médica de inmediato si queda embarazada mientras toma DIFLUCAN. Usted y su proveedor de atención médica decidirán si DIFLUCAN 100 mg es adecuado para usted. Si puede quedar embarazada, debe usar un método anticonceptivo (anticonceptivo) mientras toma DIFLUCAN y durante 1 semana después de su dosis final.
- están amamantando o planean amamantar. DIFLUCAN puede pasar a la leche materna. Hable con su proveedor de atención médica sobre la mejor manera de alimentar a su bebé mientras toma DIFLUCAN.
Antes de comenzar a tomar DIFLUCAN, informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos a base de hierbas. Informe especialmente a su proveedor de atención médica si toma:
- medicamentos para la diabetes como gliburida, tolbutamida, glipizida
- medicamentos para la presión arterial como hidroclorotiazida, losartán, amlodipina, verapamilo, nifedipina o felodipina
- anticoagulantes como la warfarina
- ciclosporina, tacrolimus o sirolimus (utilizados para prevenir el rechazo de trasplantes de órganos)
- rifampicina o rifabutina para la tuberculosis
- fenitoína o carbamazepina para controlar las convulsiones
- teofilina para controlar el asma
- quinidina (utilizada para corregir alteraciones del ritmo cardíaco)
- amiodarona (utilizado para tratar los latidos irregulares del corazón "arritmias")
- amitriptilina o nortriptilina para la depresión
- pimozida para enfermedades psiquiátricas
- anfotericina B o voriconazol para infecciones fúngicas
- eritromicina para infecciones bacterianas
- olaparib, ciclofosfamida o alcaloides de la vinca como vincristina o vinblastina para el tratamiento del cáncer
- fentanilo, alfentanilo o metadona para el dolor crónico
- ibrutinib utilizado para tratar el cáncer de sangre
- lemborexant, utilizado para el tratamiento del insomnio
- medicamentos hipolipemiantes como atorvastatina, simvastatina y fluvastatina
- medicamentos antiinflamatorios no esteroideos, incluidos celecoxib, ibuprofeno y naproxeno
- prednisona, un esteroide utilizado para tratar trastornos cutáneos, gastrointestinales, hematológicos o respiratorios
- medicamentos antivirales utilizados para tratar el VIH como saquinavir o zidovudina
- tofacitinib para la artritis reumatoide
- suplemento nutricional de vitamina a
- tolvaptán utilizado para tratar la hiponatremia (niveles bajos de sodio en la sangre) o para retardar el deterioro de la función renal
Dado que existen muchas marcas para estos medicamentos, consulte con su proveedor de atención médica o farmacéutico si tiene alguna pregunta.
¿Cómo debo tomar DIFLUCAN?
- Tome DIFLUCAN exactamente como se lo indique su proveedor de atención médica.
- Tome DIFLUCAN 100 mg por vía oral con o sin alimentos.
- Si toma demasiado DIFLUCAN 50 mg, llame a su proveedor de atención médica o vaya a la sala de emergencias más cercana de inmediato.
¿Qué debo evitar mientras tomo diflucan 150 mg?
DIFLUCAN puede causar mareos y convulsiones. No conduzca ni maneje maquinaria hasta que sepa cómo le afecta DIFLUCAN.
¿Cuáles son los posibles efectos secundarios de DIFLUCAN 150mg?
DIFLUCAN 50 mg puede causar efectos secundarios graves que incluyen:
- problemas hepáticos graves. Algunas personas con problemas médicos graves han desarrollado problemas hepáticos graves que pusieron en peligro la vida o provocaron la muerte mientras tomaban DIFLUCAN. A veces, estos problemas hepáticos pueden revertirse cuando deja de tomar DIFLUCAN. Informe a su proveedor de atención médica de inmediato si tiene síntomas de problemas hepáticos graves, incluidos:
- orina de color oscuro
- picazón severa en la piel
- coloración amarillenta de la piel y los ojos (ictericia)
- taburetes de colores claros
- cansancio
- vómitos
- pérdida de apetito
- reacciones alérgicas graves: En casos raros, se produjeron reacciones alérgicas graves (anafilaxia) mientras tomaba DIFLUCAN. Deje de tomar DIFLUCAN 50 mg, llame a su proveedor de atención médica o acuda de inmediato a la sala de emergencias del hospital más cercano si presenta algún signo o síntoma de una reacción alérgica, incluidos:
- dificultad para respirar
- fiebre
- hinchazón de los párpados
- tos
- erupción cutánea, urticaria, ampollas o descamación de la piel
- cara, boca, cuello o cualquier otra parte del cuerpo
- sibilancias
- latidos del corazón o de los oídos
- escalofríos
- problemas graves de la piel. Algunas personas con problemas médicos graves han desarrollado problemas graves en la piel que les han causado la muerte mientras tomaban DIFLUCAN. Informe a su proveedor de atención médica de inmediato si desarrolla un sarpullido mientras toma DIFLUCAN.
Los efectos secundarios más comunes de DIFLUCAN 200mg incluyen:
- dolor de cabeza
- mareo
- Diarrea
- dolor de estómago
- náuseas o malestar estomacal
- cambios en el sabor de los alimentos
Otros efectos secundarios incluyen:
- insuficiencia suprarrenal: Algunas personas que tomaron DIFLUCAN desarrollaron insuficiencia suprarrenal que fue reversible. Informe a su proveedor de atención médica de inmediato si tiene síntomas de insuficiencia suprarrenal, incluidos:
- fatiga duradera
- debilidad muscular
- pérdida de apetito
- pérdida de peso
- dolor de estómago
- mareo
- náuseas
- vómitos
- mareos o convulsiones.
Estos no son todos los posibles efectos secundarios de DIFLUCAN.
Llame a su proveedor de atención médica para recibir asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar DIFLUCAN?
Guarde las tabletas de DIFLUCAN a menos de 30 °C (86 °F).
Mantenga DIFLUCAN 50 mg y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de DIFLUCAN.
A veces, los medicamentos se recetan para fines distintos a los enumerados en el folleto de información para el paciente. No use DIFLUCAN 50 mg para una condición para la cual no fue recetado. No le dé DIFLUCAN a otras personas, incluso si tienen los mismos síntomas que usted tiene. Puede que les haga daño. Puede pedirle a su proveedor de atención médica información sobre DIFLUCAN 200 mg que está escrita para profesionales de la salud.
¿Cuáles son los ingredientes de DIFLUCAN 150mg?
Ingrediente activo: fluconazol
Ingredientes inactivos: celulosa microcristalina, fosfato de calcio dibásico anhidro, povidona, croscarmelosa de sodio, tinte de laca de aluminio FD&C Red No. 40 y estearato de magnesio.
Esta información para el paciente ha sido aprobada por la Administración de Drogas y Alimentos de EE. UU.
