Prometrium 100mg, 200mg Progesterone Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Prometrium 100 mg y cómo se usa?
Prometrium 200 mg es un medicamento recetado que se usa para prevenir y tratar los síntomas de la hiperplasia endometrial y los síntomas de la amenorrea secundaria (ausencia de menstruación o período). Prometrium se puede usar solo o con otros medicamentos.
Prometrium pertenece a una clase de medicamentos llamados progestágenos.
No se sabe si Prometrium 200 mg es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Prometrium?
Prometrium puede causar efectos secundarios graves, que incluyen:
- sangrado vaginal inusual,
- dolor o ardor al orinar,
- bulto en el pecho,
- problemas de visión repentinos,
- dolor de cabeza intenso,
- dolor detrás de los ojos,
- depresión,
- problemas para dormir,
- debilidad,
- cambios de humor,
- mareos severos,
- somnolencia,
- sensación de giro,
- confusión,
- dificultad para respirar,
- dolor o presión en el pecho,
- dolor que se extiende a la mandíbula o al hombro,
- náuseas,
- transpiración,
- dolor de estómago superior,
- Comezón,
- cansancio,
- pérdida de apetito,
- orina de color oscuro,
- heces de color arcilla,
- coloración amarillenta de la piel o los ojos (ictericia),
- entumecimiento o debilidad repentina,
- dolor de cabeza repentino e intenso,
- dificultad para hablar,
- dificultad para hablar o mantener el equilibrio,
- tos repentina,
- sibilancias,
- respiración rápida,
- tosiendo sangre,
- dolor de pierna,
- hinchazón en la pierna, y
- calor o enrojecimiento en una o ambas piernas
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Prometrium 100 mg incluyen:
- somnolencia,
- mareo,
- dolor en los senos,
- cambios de humor,
- dolor de cabeza,
- estreñimiento,
- Diarrea,
- acidez,
- hinchazón,
- hinchazón en las manos o los pies,
- dolor en las articulaciones,
- sofocos, y
- flujo vaginal
Informe a su médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Prometrium. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
ADVERTENCIA
TRASTORNOS CARDIOVASCULARES, CÁNCER DE MAMA Y PROBABLE DEMENCIA PARA LA TERAPIA CON ESTRÓGENOS Y PROGESTINA
Trastornos cardiovasculares y probable demencia
La terapia con estrógenos más progestágenos no debe usarse para la prevención de enfermedades cardiovasculares o demencia. (Ver Estudios clínicos y ADVERTENCIAS , Trastornos cardiovasculares y Probable demencia. )
El subestudio de estrógeno más progestina de la Iniciativa de salud de la mujer (WHI) informó un aumento del riesgo de trombosis venosa profunda, embolia pulmonar, accidente cerebrovascular e infarto de miocardio en mujeres posmenopáusicas (de 50 a 79 años de edad) durante 5,6 años de tratamiento con conjugados orales diarios. estrógenos (CE) [0,625 mg] combinados con acetato de medroxiprogesterona (MPA) [2,5 mg], en relación con el placebo. (Ver Estudios clínicos y ADVERTENCIAS , Desordenes cardiovasculares. )
El estudio auxiliar de estrógeno más progestina WHI Memory Study (WHIMS) del WHI informó un mayor riesgo de desarrollar demencia probable en mujeres posmenopáusicas de 65 años de edad o más durante 4 años de tratamiento con CE diarios (0,625 mg) combinados con MPA (2,5 mg ), en relación con el placebo. Se desconoce si este hallazgo se aplica a mujeres posmenopáusicas más jóvenes. (Ver Estudios clínicos y ADVERTENCIAS , probable demencia y PRECAUCIONES , Uso geriátrico .)
Cáncer de mama
El subestudio de estrógeno más progestina de la WHI también demostró un mayor riesgo de cáncer de mama invasivo. (Ver Estudios clínicos y ADVERTENCIAS , Neoplasias malignas, Cáncer de mama .)
En ausencia de datos comparables, se debe suponer que estos riesgos son similares para otras dosis de CE y MPA, y otras combinaciones y formas de dosificación de estrógenos y progestágenos.
Los progestágenos con estrógenos deben prescribirse en las dosis efectivas más bajas y durante el período más corto de acuerdo con los objetivos del tratamiento y los riesgos para cada mujer.
DESCRIPCIÓN
Las cápsulas de PROMETRIUM (progesterona, USP) contienen progesterona micronizada para administración oral. La progesterona tiene un peso molecular de 314,47 y una fórmula molecular de C21H30O2. La progesterona (pregn-4-ene-3, 20-diona) es un polvo cristalino, inodoro, de color blanco o blanco cremoso, prácticamente insoluble en agua, soluble en alcohol, acetona y dioxano y escasamente soluble en aceites vegetales, estable en el aire, con un punto de fusión entre 126° y 131°C. La fórmula estructural es:
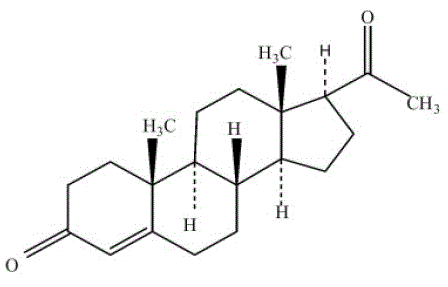
La progesterona se sintetiza a partir de un material de partida de origen vegetal y es químicamente idéntica a la progesterona de origen ovárico humano. Las cápsulas de PROMETRIUM están disponibles en múltiples concentraciones para permitir flexibilidad de dosificación para un manejo óptimo. Las cápsulas de PROMETRIUM contienen 100 mg o 200 mg de progesterona micronizada.
Los ingredientes inactivos de PROMETRIUM Capsules 100 mg incluyen: aceite de maní NF, gelatina NF, glicerina USP, lecitina NF, dióxido de titanio USP, FD&C Red No. 40 y D&C Yellow No. 10. Los ingredientes inactivos de PROMETRIUM 100 mg Capsules 200 mg incluyen : aceite de maní NF, gelatina NF, glicerina USP, lecitina NF, dióxido de titanio USP, D&C Yellow No. 10 y FD&C Yellow No. 6.
INDICACIONES
Las cápsulas de 200 mg de PROMETRIUM están indicadas para su uso en la prevención de la hiperplasia endometrial en mujeres posmenopáusicas no histerectomizadas que reciben tabletas de estrógenos conjugados. También están indicados para su uso en la amenorrea secundaria.
DOSIFICACIÓN Y ADMINISTRACIÓN
Prevención de la hiperplasia endometrial
Las cápsulas de 100 mg de PROMETRIUM deben administrarse como una dosis diaria única a la hora de acostarse, 200 mg por vía oral durante 12 días secuencialmente por ciclo de 28 días, a una mujer posmenopáusica con útero que recibe tabletas diarias de estrógenos conjugados.
Tratamiento de la amenorrea secundaria
Las cápsulas de 100 mg de PROMETRIUM se pueden administrar como una dosis diaria única de 400 mg a la hora de acostarse durante 10 días.
Algunas mujeres pueden tener dificultad para tragar las cápsulas de PROMETRIUM. Para estas mujeres, las cápsulas de PROMETRIUM deben tomarse con un vaso de agua mientras están de pie.
CÓMO SUMINISTRADO
PROMETRIUM (progesterona, USP) Cápsulas 100 mg son cápsulas redondas de color melocotón marcadas con la inscripción "SV" en negro.
CDN 0032-1708-01 (Botella de 100)
PROMETRIUM (progesterona, USP) Cápsulas 200 mg son cápsulas ovaladas de color amarillo pálido marcadas con la marca negra “SV2”.
CDN 0032-1711-01 (Botella de 100)
Almacenar a 25°C (77°F); se permiten excursiones de 15° a 30°C (59° a 86°F) [Consulte Temperatura ambiente controlada por USP].
Proteger de la humedad excesiva.
Dispense en un recipiente hermético resistente a la luz como se define en USP/NF, acompañado de un prospecto para el paciente.
Mantener fuera del alcance de los niños.
Fabricado por: Catalent Pharma Solutions, St. Petersburg, FL 33716. Revisado: septiembre de 2013
EFECTOS SECUNDARIOS
Ver CUADRO DE ADVERTENCIA , ADVERTENCIAS y PRECAUCIONES .
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
En un ensayo clínico multicéntrico, aleatorizado, doble ciego, controlado con placebo, se estudiaron los efectos de PROMETRIUM 100 mg Cápsulas sobre el endometrio en un total de 875 mujeres posmenopáusicas. La Tabla 6 enumera las reacciones adversas mayores o iguales al 2 por ciento de las mujeres que recibieron 200 mg diarios de PROMETRIUM Cápsulas cíclicas (12 días por ciclo de mes calendario) con 0,625 mg de estrógenos conjugados o placebo.
TABLA 6. Reacciones adversas (≥ 2 %) informadas en un ensayo controlado con placebo de 875 pacientes en mujeres posmenopáusicas durante un período de 3 años [Porcentaje (%) de pacientes informadas]
Efectos sobre la amenorrea secundaria
En un ensayo clínico multicéntrico, aleatorizado, doble ciego, controlado con placebo, se estudiaron los efectos de las cápsulas de PROMETRIUM sobre la amenorrea secundaria en 49 mujeres posmenopáusicas preparadas con estrógenos. La Tabla 7 enumera las reacciones adversas mayores o iguales al 5 por ciento de las mujeres que recibieron PROMETRIUM 100 mg Cápsulas o placebo.
TABLA 7. Reacciones adversas (≥ 5 %) informadas en pacientes que usaron 400 mg/día en un ensayo controlado con placebo en mujeres posmenopáusicas preparadas con estrógenos
En un estudio de dosificación posterior a la comercialización, multicéntrico, de grupos paralelos y abierto que consistió en tres ciclos de tratamiento consecutivos de 28 días, 220 mujeres premenopáusicas con amenorrea secundaria se aleatorizaron para recibir terapia diaria con estrógenos conjugados (0,625 mg de estrógenos conjugados) y cápsulas de 100 mg de PROMETRIUM, 300 mg por día (n=113) o cápsulas de PROMETRIUM, 400 mg por día (n=107) durante 10 días de cada ciclo de tratamiento. En general, las reacciones adversas emergentes del tratamiento informadas con mayor frecuencia, informadas en más del 5 por ciento de los sujetos, fueron náuseas, fatiga, micosis vaginal, nasofaringitis, infección del tracto respiratorio superior, dolor de cabeza, mareos, sensibilidad en los senos, distensión abdominal, acné. , dismenorrea, cambio de humor e infección del tracto urinario.
Experiencia posterior a la comercialización
Se han informado las siguientes reacciones adversas adicionales con PROMETRIUM 200 mg cápsulas. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable la frecuencia o establecer una relación causal con la exposición al fármaco.
Sistema genitourinario
carcinoma endometrial, hipospadia, muerte intrauterina, menorragia, trastorno menstrual, metrorragia, quiste ovárico, aborto espontáneo.
Cardiovascular
colapso circulatorio, cardiopatía congénita (incluyendo comunicación interventricular y conducto arterioso permeable), hipertensión, hipotensión, taquicardia.
Gastrointestinal
pancreatitis aguda, colestasis, hepatitis colestásica, disfagia, insuficiencia hepática, necrosis hepática, hepatitis, pruebas de función hepática aumentadas (incluyendo alanina aminotransferasa elevada, aspartato aminotransferasa elevada, gamma-glutamil transferasa elevada), ictericia, lengua hinchada.
Piel
alopecia, prurito, urticaria.
Ojos
visión borrosa, diplopía, alteración visual.
Sistema nervioso central
agresión, convulsión, despersonalización, depresión de la conciencia, desorientación, disartria, pérdida de la conciencia, parestesia, sedación, estupor, síncope (con y sin hipotensión), ataque isquémico transitorio, ideación suicida.
Durante la terapia inicial, algunas mujeres experimentaron una constelación de muchos o todos los siguientes síntomas: mareos extremos y/o somnolencia, visión borrosa, dificultad para hablar, dificultad para caminar, pérdida del conocimiento, vértigo, confusión, desorientación, sensación de ebriedad y dificultad para respirar.
Misceláneas
marcha anormal, reacción anafiláctica, artralgia, aumento de glucosa en sangre, asfixia, labio hendido, paladar hendido, dificultad para caminar, disnea, edema facial, sensación anormal, sensación de embriaguez, hipersensibilidad, asma, calambres musculares, opresión en la garganta, tinnitus, vértigo, pérdida de peso , aumento de peso.
INTERACCIONES CON LA DROGAS
Interacciones entre fármacos y pruebas de laboratorio
Los siguientes resultados de laboratorio pueden verse alterados por el uso de la terapia de estrógeno más progestágeno:
- Aumento de la retención de sulfobromoftaleína y otras pruebas de función hepática.
- Pruebas de coagulación: aumento de los factores de protrombina VII, VIII, IX y X.
- Determinación de pregnanediol.
- Función tiroidea: aumento de PBI y yodo unido a proteínas extraíbles en butanol y disminución de T3 valores de captación.
ADVERTENCIAS
Ver CUADRO DE ADVERTENCIA .
Trastornos cardiovasculares
Se ha informado un mayor riesgo de embolia pulmonar, trombosis venosa profunda (TVP), accidente cerebrovascular e infarto de miocardio con la terapia de estrógeno más progestágeno. Si cualquiera de estos ocurre o se sospecha, la terapia de estrógeno con progestágeno debe suspenderse inmediatamente.
Factores de riesgo de enfermedad vascular arterial (por ejemplo, hipertensión, diabetes mellitus, tabaquismo, hipercolesterolemia y obesidad) y/o tromboembolismo venoso (por ejemplo, antecedentes personales o familiares de tromboembolismo venoso [TEV], obesidad y lupus eritematoso sistémico ) debe gestionarse adecuadamente.
Carrera
En el subestudio de estrógeno más progestina de la Iniciativa de salud de la mujer (WHI), se informó un aumento estadísticamente significativo del riesgo de accidente cerebrovascular en mujeres de 50 a 79 años de edad que recibieron CE (0,625 mg) más MPA (2,5 mg) a diario en comparación con mujeres de la misma edad. grupo que recibió placebo (33 versus 25 por 10 000 mujeres-año). El aumento del riesgo se demostró después del primer año y persistió. (Ver Estudios clínicos .) En caso de que ocurra o se sospeche un derrame cerebral, la terapia con estrógeno más progestina debe suspenderse de inmediato.
Enfermedad coronaria
En el subestudio de estrógeno más progestina de la WHI, se notificó un aumento estadísticamente no significativo del riesgo de eventos de enfermedad coronaria (CC) (definidos como infarto de miocardio [IM] no fatal, IM silencioso o muerte por CC) en mujeres que recibieron EC diariamente (0,625 mg) más MPA (2,5 mg) en comparación con mujeres que recibieron placebo (41 frente a 34 por 10 000 años-mujer). Se demostró un aumento en el riesgo relativo en el año 1 y se informó una tendencia hacia la disminución del riesgo relativo en los años 2 a 5. (Ver Estudios clínicos .)
En mujeres posmenopáusicas con cardiopatía documentada (n = 2.763, edad media 66,7 años), en un ensayo clínico controlado de prevención secundaria de enfermedades cardiovasculares (Heart and Estrogen/Progestin Replacement Study [HERS]), tratamiento con CE diario (0,625 mg) más MPA (2,5 mg) no demostró ningún beneficio cardiovascular. Durante un seguimiento promedio de 4,1 años, el tratamiento con CE más MPA no redujo la tasa general de eventos de CHD en mujeres posmenopáusicas con enfermedad coronaria establecida. Hubo más eventos de CHD en el grupo tratado con EC más MPA que en el grupo de placebo en el año 1, pero no durante los años siguientes. Dos mil trescientas veintiuna (2321) mujeres del ensayo HERS original aceptaron participar en una extensión abierta de HERS, HERS II. El seguimiento promedio en HERS II fue de 2,7 años adicionales, para un total de 6,8 años en general. Las tasas de eventos de cardiopatía coronaria fueron comparables entre las mujeres del grupo CE más MPA y el grupo placebo en HERS, HERS II y en general.
Tromboembolismo venoso
En el subestudio de estrógeno más progestina de la WHI, se notificó una tasa estadísticamente significativa dos veces mayor de TEV (TVP y embolia pulmonar [EP]) en mujeres que recibieron diariamente CE (0,625 mg) más MPA (2,5 mg) en comparación con mujeres que recibieron placebo ( 35 frente a 17 por 10.000 mujeres-año). También se demostraron aumentos estadísticamente significativos en el riesgo de TVP (26 frente a 13 por 10 000 años-mujer) y EP (18 frente a 8 por 10 000 años-mujer). El aumento del riesgo de TEV se demostró durante el primer año y persistió. (Ver Estudios clínicos .) En caso de que ocurra o se sospeche un TEV, la terapia con estrógeno más progestágeno debe suspenderse de inmediato.
Si es factible, los estrógenos con progestágenos deben suspenderse al menos 4 a 6 semanas antes de una cirugía del tipo asociado con un mayor riesgo de tromboembolismo, o durante períodos de inmovilización prolongada.
Neoplasmas malignos
Cáncer de mama
El ensayo clínico aleatorizado más importante que proporciona información sobre el cáncer de mama en usuarias de estrógeno más progestágeno es el subestudio de la Iniciativa de Salud de la Mujer (WHI) de EC (0,625 mg) más MPA (2,5 mg) diarios. Después de un seguimiento medio de 5,6 años, el subestudio de estrógeno más progestina informó un aumento del riesgo de cáncer de mama invasivo en mujeres que tomaron diariamente EC más MPA. En este subestudio, el 26 por ciento de las mujeres informó el uso previo de terapia con estrógeno solo o estrógeno más progestágeno. El riesgo relativo de cáncer de mama invasivo fue de 1,24 (95 por ciento nCI, 1,01-1,54), y el riesgo absoluto fue de 41 frente a 33 casos por 10.000 mujeres-año, para EC más MPA en comparación con placebo. Entre las mujeres que informaron el uso previo de terapia hormonal, el riesgo relativo de cáncer de mama invasivo fue de 1,86 y el riesgo absoluto fue de 46 frente a 25 casos por 10.000 mujeres-año, para estrógeno más progestina en comparación con placebo. Entre las mujeres que informaron que no habían usado terapia hormonal anteriormente, el riesgo relativo de cáncer de mama invasivo fue de 1,09 y el riesgo absoluto fue de 40 frente a 36 casos por 10 000 años-mujer para EC más MPA en comparación con placebo. En el mismo subestudio, los cánceres de mama invasivos eran más grandes, tenían más probabilidades de tener ganglios positivos y se diagnosticaron en una etapa más avanzada en el grupo de CE (0,625 mg) más MPA (2,5 mg) en comparación con el grupo de placebo. La enfermedad metastásica fue rara, sin diferencia aparente entre los dos grupos. Otros factores pronósticos como el subtipo histológico, el grado y el estado del receptor hormonal no difirieron entre los grupos. (Ver Estudios clínicos .)
En consonancia con los ensayos clínicos de la WHI, los estudios observacionales también han informado un aumento del riesgo de cáncer de mama con la terapia de estrógeno más progestágeno, y un menor aumento del riesgo con la terapia de estrógeno solo, después de varios años de uso. El riesgo aumentó con la duración del uso y pareció volver al valor inicial durante aproximadamente 5 años después de suspender el tratamiento (solo los estudios observacionales tienen datos sustanciales sobre el riesgo después de suspenderlo). Los estudios observacionales también sugieren que el riesgo de cáncer de mama fue mayor y se hizo evidente antes con la terapia de estrógeno más progestina en comparación con la terapia de estrógeno solo. Sin embargo, estos estudios generalmente no han encontrado una variación significativa en el riesgo de cáncer de mama entre diferentes combinaciones, dosis o vías de administración de estrógeno más progestina.
Se ha informado que el uso de estrógeno más progestina da como resultado un aumento de mamografías anormales que requieren una evaluación adicional. Todas las mujeres deben someterse a exámenes de mama anuales por parte de un proveedor de atención médica y realizarse autoexámenes de mama mensuales. Además, los exámenes de mamografía deben programarse según la edad de la paciente, los factores de riesgo y los resultados de mamografías anteriores.
Cáncer endometrial
Se ha informado un aumento del riesgo de cáncer de endometrio con el uso de terapia de estrógeno sin oposición en una mujer con útero. El riesgo informado de cáncer de endometrio entre las usuarias de estrógenos sin oposición es aproximadamente de 2 a 12 veces mayor que entre las no usuarias, y parece depender de la duración del tratamiento y de la dosis de estrógenos. La mayoría de los estudios no muestran un aumento significativo del riesgo asociado con el uso de estrógenos durante menos de 1 año. El mayor riesgo parece estar asociado con el uso prolongado, con riesgos aumentados de 15 a 24 veces durante 5 a 10 años o más y se ha demostrado que este riesgo persiste durante al menos 8 a 15 años después de suspender la terapia con estrógenos.
Es importante la vigilancia clínica de todas las mujeres que usan terapia de estrógeno más progestágeno. Deben tomarse medidas de diagnóstico adecuadas, incluido el muestreo endometrial directo o aleatorio cuando esté indicado, para descartar malignidad en todos los casos de sangrado genital anormal persistente o recurrente no diagnosticado. No hay evidencia de que el uso de estrógenos naturales resulte en un perfil de riesgo endometrial diferente al de los estrógenos sintéticos de dosis de estrógeno equivalente. Se ha demostrado que agregar una progestina a la terapia de estrógeno en mujeres posmenopáusicas reduce el riesgo de hiperplasia endometrial, que puede ser un precursor del cáncer de endometrio.
Cáncer de ovarios
El subestudio de estrógeno más progestina de la WHI informó un aumento estadísticamente no significativo del riesgo de cáncer de ovario. Después de un seguimiento promedio de 5,6 años, el riesgo relativo de cáncer de ovario para CE más MPA versus placebo fue de 1,58 (95 por ciento nCI, 0,77 - 3,24). El riesgo absoluto de EC más MPA versus placebo fue de 4 versus 3 casos por 10 000 mujeres-año. En algunos estudios epidemiológicos, el uso de estrógenos más progestágenos y productos con estrógenos solos, en particular durante 5 años o más, se ha asociado con un mayor riesgo de cáncer de ovario. Sin embargo, la duración de la exposición asociada con un mayor riesgo no es consistente en todos los estudios epidemiológicos y algunos no informan asociación.
Probable demencia
En el Estudio de Memoria de la Iniciativa de Salud de la Mujer con estrógeno más progestina (WHIMS, por sus siglas en inglés), un estudio auxiliar de WHI, una población de 4532 mujeres posmenopáusicas de 65 a 79 años de edad se asignó al azar a EC (0,625 mg) más MPA (2,5 mg) o placebo.
En el estudio complementario de estrógeno más progestina WHIMS, después de un seguimiento promedio de 4 años, 40 mujeres en el grupo de EC más MPA y 21 mujeres en el grupo de placebo fueron diagnosticadas con probable demencia. El riesgo relativo de demencia probable para el estrógeno más progestágeno frente al placebo fue de 2,05 (IC del 95 %, 1,21-3,48). El riesgo absoluto de demencia probable para EC más MPA versus placebo fue de 45 versus 22 casos por 10,000 mujeres-año. Se desconoce si estos hallazgos se aplican a mujeres posmenopáusicas más jóvenes. (Ver Estudios clínicos y PRECAUCIONES , Uso geriátrico .)
Anomalías de la visión
Se ha informado trombosis vascular retinal en pacientes que reciben estrógeno. Interrumpa el tratamiento con estrógeno más progestágeno hasta que se realice un examen si hay una pérdida parcial o completa de la visión repentina, o si hay un inicio repentino de proptosis, diplopía o migraña. Si el examen revela papiledema o lesiones vasculares en la retina, la terapia con estrógeno más progestágeno debe suspenderse de forma permanente.
PRECAUCIONES
General
Adición de una progestina cuando una mujer no ha tenido una histerectomía
Los estudios de la adición de un progestágeno durante 10 o más días de un ciclo de administración de estrógenos, o diariamente con estrógenos en un régimen continuo, han informado una menor incidencia de hiperplasia endometrial que la inducida por el tratamiento con estrógenos solos. La hiperplasia endometrial puede ser un precursor del cáncer de endometrio.
Sin embargo, existen posibles riesgos que pueden estar asociados con el uso de progestágenos con estrógenos en comparación con los regímenes de estrógenos solos. Estos incluyen un mayor riesgo de cáncer de mama.
Retención de líquidos
La progesterona puede causar cierto grado de retención de líquidos. Las mujeres con condiciones que pueden estar influenciadas por este factor, como disfunción cardíaca o renal, requieren una observación cuidadosa.
Mareos y somnolencia
Las cápsulas de PROMETRIUM pueden causar mareos y somnolencia transitorios y deben usarse con precaución al conducir un vehículo motorizado o manejar maquinaria. Las cápsulas de PROMETRIUM deben tomarse como una dosis diaria única a la hora de acostarse.
Información del paciente
General
Este producto contiene aceite de maní y no debe usarse si es alérgico al maní.
Se recomienda a los médicos que analicen el contenido del prospecto de información para el paciente con los pacientes a quienes les recetan PROMETRIUM 100 mg en cápsulas.
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
No se ha probado la carcinogenicidad de la progesterona en animales por vía de administración oral. Cuando se implantó en ratones hembra, la progesterona produjo carcinomas mamarios, tumores de células de la granulosa de ovario y sarcomas del estroma endometrial. En perros, las inyecciones intramusculares a largo plazo produjeron hiperplasia nodular y tumores mamarios benignos y malignos. Las inyecciones subcutáneas o intramusculares de progesterona disminuyeron el período de latencia y aumentaron la incidencia de tumores mamarios en ratas previamente tratadas con un carcinógeno químico.
La progesterona no mostró evidencia de genotoxicidad en estudios in vitro para mutaciones puntuales o daño cromosómico. Los estudios in vivo de daño cromosómico han arrojado resultados positivos en ratones con dosis orales de 1000 mg/kg y 2000 mg/kg. Se ha demostrado que la progesterona administrada de forma exógena inhibe la ovulación en varias especies y se espera que las dosis altas administradas durante un período prolongado afecten la fertilidad hasta el cese del tratamiento.
El embarazo
Las cápsulas de PROMETRIUM no deben utilizarse durante el embarazo. (Ver CONTRAINDICACIONES ).
Embarazo Categoría B
Se han realizado estudios reproductivos en ratones con dosis de hasta 9 veces la dosis oral en humanos, en ratas con dosis de hasta 44 veces la dosis oral en humanos, en conejos con una dosis de 10 mcg/día administrada localmente dentro del útero mediante un dispositivo implantado , en conejillos de indias en dosis de aproximadamente la mitad de la dosis oral humana y en monos rhesus en dosis aproximadamente la dosis humana, todos basados en el área de superficie corporal, y han revelado poca o ninguna evidencia de alteración de la fertilidad o daño al feto debido a progesterona.
Mujeres en lactancia
Se han identificado cantidades detectables de progestágeno en la leche de mujeres lactantes que reciben progestágenos. Se debe tener precaución cuando se administren cápsulas de 100 mg de PROMETRIUM a mujeres lactantes.
Uso pediátrico
PROMETRIUM Cápsulas no está indicado en niños. No se han realizado estudios clínicos en la población pediátrica.
Uso geriátrico
No ha habido un número suficiente de mujeres geriátricas involucradas en estudios clínicos que utilizan PROMETRIUM Cápsulas para determinar si las personas mayores de 65 años difieren de los sujetos más jóvenes en su respuesta a PROMETRIUM 200 mg Cápsulas.
Estudio de la Iniciativa de Salud de la Mujer
En el subestudio de estrógeno más progestina de la Women's Health Initiative (WHI) (CE [0,625 mg] más MPA [2,5 mg] versus placebo, hubo un mayor riesgo relativo de accidente cerebrovascular no fatal y cáncer de mama invasivo en mujeres mayores de 65 años . (Ver Estudios clínicos y ADVERTENCIAS , Desordenes cardiovasculares y Neoplasmas malignos. )
Estudio de Memoria de la Iniciativa de Salud de la Mujer
En el Estudio de Memoria de la Iniciativa de Salud de la Mujer (WHIMS) de mujeres posmenopáusicas de 65 a 79 años de edad, hubo un mayor riesgo de desarrollar demencia probable en el estudio auxiliar de estrógeno más progestina en comparación con el placebo. (Ver Estudios clínicos y ADVERTENCIAS , Probable demencia. )
SOBREDOSIS
No se han realizado estudios de sobredosis en humanos. En caso de sobredosis, PROMETRIUM Cápsulas debe suspenderse y el paciente debe recibir tratamiento sintomático.
CONTRAINDICACIONES
Las cápsulas de PROMETRIUM no deben usarse en mujeres con cualquiera de las siguientes condiciones:
FARMACOLOGÍA CLÍNICA
Las cápsulas de 200 mg de PROMETRIUM son una forma de dosificación oral de progesterona micronizada que es químicamente idéntica a la progesterona de origen ovárico. La biodisponibilidad oral de la progesterona aumenta mediante la micronización.
Farmacocinética
Absorción
Después de la administración oral de progesterona como una formulación de cápsulas de gelatina blanda micronizada, las concentraciones séricas máximas se alcanzaron en 3 horas. Se desconoce la biodisponibilidad absoluta de la progesterona micronizada. La Tabla 1 resume los parámetros farmacocinéticos medios en mujeres posmenopáusicas después de cinco dosis orales diarias de PROMETRIUM Cápsulas de 100 mg como una formulación de cápsulas de gelatina blanda micronizada.
TABLA 1. Parámetros farmacocinéticos de PROMETRIUM 200 mg cápsulas
Las concentraciones de progesterona en suero parecieron lineales y proporcionales a la dosis luego de la administración de dosis múltiples de PROMETRIUM 200 mg en cápsulas de 100 mg en el rango de dosis de 100 mg por día a 300 mg por día en mujeres posmenopáusicas. Aunque no se estudiaron dosis superiores a 300 mg por día en mujeres, las concentraciones séricas de un estudio en voluntarios masculinos parecieron lineales y proporcionales a la dosis entre 100 mg por día y 400 mg por día. Los parámetros farmacocinéticos en voluntarios masculinos fueron generalmente consistentes con los observados en mujeres posmenopáusicas.
Distribución
La progesterona se une aproximadamente en un 96 a 99 por ciento a las proteínas séricas, principalmente a la albúmina sérica (50 a 54 por ciento) y a la transcortina (43 a 48 por ciento).
Metabolismo
La progesterona se metaboliza principalmente en el hígado en gran parte a pregnanedioles y pregnanolonas. Los pregnanedioles y las pregnanolonas se conjugan en el hígado a metabolitos de glucurónido y sulfato. Los metabolitos de progesterona que se excretan en la bilis pueden desconjugarse y metabolizarse más en el intestino mediante reducción, deshidroxilación y epimerización.
Excreción
Los conjugados de glucurónido y sulfato de pregnanediol y pregnanolona se excretan en la bilis y la orina. Los metabolitos de la progesterona se eliminan principalmente por vía renal. Los metabolitos de progesterona que se excretan en la bilis pueden sufrir un reciclaje enterohepático o pueden excretarse en las heces.
Poblaciones Especiales
La farmacocinética de PROMETRIUM Cápsulas no ha sido evaluada en pacientes obesos o con bajo peso corporal.
insuficiencia hepática
No se ha estudiado el efecto de la insuficiencia hepática sobre la farmacocinética de las cápsulas de 100 mg de PROMETRIUM.
Insuficiencia renal
No se ha estudiado el efecto de la insuficiencia renal sobre la farmacocinética de PROMETRIUM Cápsulas.
Interacción entre alimentos y medicamentos
La ingestión concomitante de alimentos aumentó la biodisponibilidad de las cápsulas de 100 mg de PROMETRIUM en relación con el estado de ayuno cuando se administró a mujeres posmenopáusicas en una dosis de 200 mg.
Interacciones con la drogas
El metabolismo de la progesterona por microsomas hepáticos humanos fue inhibido por ketoconazol (IC50
La coadministración de estrógenos conjugados y cápsulas de 200 mg de PROMETRIUM a 29 mujeres posmenopáusicas durante un período de 12 días resultó en un aumento en las concentraciones de estrona total (Cmax 3.68 ng/mL a 4.93 ng/mL) y concentraciones totales de equilina (Cmax 2.27 ng/mL a 3.22 ng/mL) y una disminución en las concentraciones circulantes de 17β estradiol (Cmax 0.037 ng/mL a 0.030 ng/mL). La vida media de los estrógenos conjugados fue similar con la coadministración de PROMETRIUM Capsules. La Tabla 2 resume los parámetros farmacocinéticos.
TABLA 2. Parámetros farmacocinéticos medios (± DE) para estradiol, estrona y equilina después de la coadministración de estrógenos conjugados de 0,625 mg y cápsulas de PROMETRIUM de 200 mg durante 12 días a mujeres posmenopáusicas
Estudios clínicos
Efectos sobre el endometrio
En un ensayo clínico aleatorizado, doble ciego, 358 mujeres posmenopáusicas, cada una con un útero intacto, recibieron tratamiento durante un máximo de 36 meses. Los grupos de tratamiento fueron: Cápsulas de PROMETRIUM a la dosis de 200 mg por día durante 12 días por ciclo de 28 días en combinación con estrógenos conjugados 0,625 mg por día (n=120); estrógenos conjugados 0,625 mg por día solamente (n=119); o placebo (n=119). Los sujetos en los tres grupos de tratamiento eran principalmente mujeres caucásicas (87 por ciento o más de cada grupo). Los resultados de la incidencia de hiperplasia endometrial en mujeres que recibieron hasta 3 años de tratamiento se muestran en la Tabla 3. Una comparación del grupo de tratamiento con PROMETRIUM Cápsulas más estrógenos conjugados con el grupo de estrógenos conjugados solos mostró una tasa significativamente menor de hiperplasia (6 por ciento producto combinado versus 64 por ciento de estrógeno solo) en el grupo de tratamiento de PROMETRIUM Cápsulas más estrógenos conjugados durante los 36 meses de tratamiento.
TABLA 3. Incidencia de hiperplasia endometrial en mujeres que reciben 3 años de tratamiento
Los tiempos para el diagnóstico de hiperplasia endometrial durante 36 meses de tratamiento se muestran en la Figura 1. Esta figura ilustra gráficamente que la proporción de pacientes con hiperplasia fue significativamente mayor para el grupo de estrógenos conjugados (64 por ciento) en comparación con el grupo de estrógenos conjugados más cápsulas de PROMETRIUM. (6 por ciento).
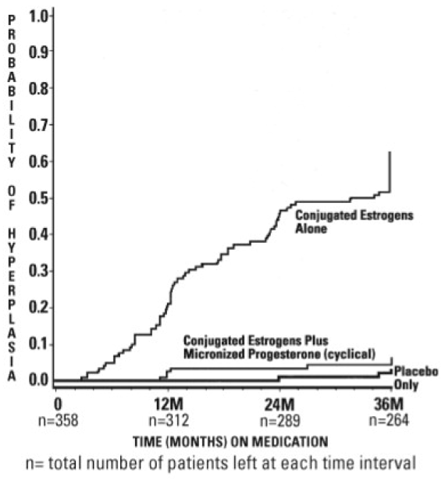
Figura 1. Tiempo hasta la hiperplasia en mujeres que reciben hasta 36 meses de tratamiento
Las tasas de interrupción debido a la hiperplasia durante los 36 meses de tratamiento se muestran en la Tabla 4. Para cualquier grado de hiperplasia, la tasa de interrupción para las pacientes que recibieron estrógenos conjugados más PROMETRIUM 100 mg en cápsulas fue similar a la del grupo de placebo solo, mientras que la la tasa de discontinuación para pacientes que recibieron estrógenos conjugados solos fue significativamente mayor. Las mujeres que interrumpieron el tratamiento de forma permanente debido a la hiperplasia tenían características demográficas similares a las de la población general del estudio.
TABLA 4. Tasa de discontinuación por hiperplasia durante 36 meses de tratamiento
Efectos sobre la amenorrea secundaria
En un estudio clínico aleatorizado, doble ciego, de un solo centro que incluyó a mujeres premenopáusicas con amenorrea secundaria durante al menos 90 días, la administración de 10 días de terapia con PROMETRIUM 200 mg en cápsulas dio como resultado que el 80 % de las mujeres experimentaran sangrado por deprivación dentro de los 7 días posteriores a la última dosis de cápsulas de 100 mg de PROMETRIUM, 300 mg por día (n=20), en comparación con el 10 por ciento de las mujeres que experimentaron sangrado por deprivación en el grupo de placebo (n=21).
En un estudio de dosificación posterior a la comercialización, multicéntrico, de grupos paralelos, abierto, que incluyó a mujeres premenopáusicas con amenorrea secundaria durante al menos 90 días, la administración de 10 días de PROMETRIUM 100 mg Cápsulas durante dos ciclos de tratamiento de 28 días, 300 mg por día (n= 107) o 400 mg por día (n=99), dio como resultado que el 73,8 % y el 76,8 % de las mujeres, respectivamente, experimentaran sangrado por privación.
La tasa de transformación secretora se evaluó en un estudio clínico multicéntrico, aleatorizado, doble ciego en mujeres posmenopáusicas preparadas con estrógenos. Las cápsulas de 100 mg de PROMETRIUM administradas por vía oral durante 10 días a 400 mg por día (n=22) indujeron cambios secretores completos en el endometrio en el 45 % de las mujeres en comparación con el 0 % en el grupo de placebo (n=23).
Un segundo estudio de dosificación posterior a la comercialización, multicéntrico, de grupos paralelos y abierto en mujeres premenopáusicas con amenorrea secundaria durante al menos 90 días también evaluó la tasa de transformación secretora. Todos los sujetos recibieron estrógenos conjugados orales diarios durante 3 ciclos de tratamiento consecutivos de 28 días y cápsulas de PROMETRIUM, 300 mg por día (n=107) o 400 mg por día (n=99) durante 10 días de cada ciclo de tratamiento. La tasa de transformación secretora completa fue del 21,5 por ciento y del 28,3 por ciento, respectivamente.
Estudios de la iniciativa de salud de la mujer
La Iniciativa de Salud de la Mujer (WHI, por sus siglas en inglés) inscribió a aproximadamente 27 000 mujeres posmenopáusicas predominantemente sanas en dos subestudios para evaluar los riesgos y beneficios de los estrógenos conjugados (CE) orales diarios [0,625 mg] solos o en combinación con acetato de medroxiprogesterona (MPA) [2,5 mg] en comparación con el placebo en la prevención de ciertas enfermedades crónicas. El criterio principal de valoración fue la incidencia de cardiopatía coronaria [(CC) definida como infarto de miocardio (IM) no mortal, IM silencioso y muerte por CC], con cáncer de mama invasivo como resultado adverso primario. Un "índice global" incluyó la aparición más temprana de CHD, cáncer de mama invasivo, accidente cerebrovascular, embolia pulmonar (EP), cáncer de endometrio (solo en el subestudio de EC más MPA), cáncer colorrectal, fractura de cadera o muerte por otra causa. Estos subestudios no evaluaron los efectos de CE solo o CE más MPA sobre los síntomas de la menopausia.
Subestudio de estrógeno más progestina de la WHI
El subestudio de estrógeno más progestina de la WHI se detuvo antes de tiempo. De acuerdo con la regla de interrupción predefinida, después de un seguimiento promedio de 5,6 años de tratamiento, el aumento del riesgo de cáncer de mama y eventos cardiovasculares superó los beneficios especificados incluidos en el "índice global". El exceso de riesgo absoluto de eventos en el “índice global” fue de 19 por 10.000 mujeres-año.
Para aquellos resultados incluidos en el "índice global" de WHI que alcanzaron significación estadística después de 5,6 años de seguimiento, el exceso de riesgo absoluto por 10 000 mujeres-año en el grupo tratado con CE más MPA fue de 7 eventos de cardiopatía coronaria más, 8 accidentes cerebrovasculares más, 10 EP más y 8 cánceres de mama invasivos más, mientras que las reducciones de riesgo absoluto por 10 000 mujeres-año fueron 6 cánceres colorrectales menos y 5 fracturas de cadera menos.
Los resultados del subestudio de estrógeno más progestina, que incluyó a 16 608 mujeres (promedio de 63 años de edad, rango de 50 a 79; 83,9 % blancas, 6,8 % negras, 5,4 % hispanas, 3,9 % otras) se presentan en la Tabla 5. Estos resultados reflejan centralmente datos adjudicados después de un seguimiento promedio de 5,6 años.
TABLA 5. Riesgo relativo y absoluto visto en el subestudio de estrógeno más progestina de WHI en un promedio de 5,6 años a, b
El momento del inicio de la terapia de estrógeno más progestina en relación con el comienzo de la menopausia puede afectar el perfil general de riesgos y beneficios. El subestudio de estrógeno más progestina de WHI estratificado por edad mostró en mujeres de 50 a 59 años de edad una tendencia no significativa hacia la reducción del riesgo de mortalidad general [índice de riesgo (HR) 0,69 (IC del 95 por ciento, 0,44-1,07)].
Estudio de Memoria de la Iniciativa de Salud de la Mujer
El estudio de memoria de la iniciativa de salud de la mujer con estrógeno más progestina (WHIMS, por sus siglas en inglés), un estudio auxiliar de WHI, inscribió a 4532 mujeres posmenopáusicas predominantemente sanas de 65 años de edad y mayores (el 47 % tenía entre 65 y 69 años; el 35 % tenía entre 70 y 74 años). edad y el 18 por ciento tenía 75 años o más) para evaluar los efectos de CE (0,625 mg) más MPA (2,5 mg) diarios sobre la incidencia de demencia probable (resultado principal) en comparación con el placebo.
Después de un seguimiento promedio de 4 años, el riesgo relativo de demencia probable para EC más MPA versus placebo fue de 2,05 (IC del 95 por ciento, 1,21 a 3,48). El riesgo absoluto de demencia probable para EC más MPA versus placebo fue de 45 versus 22 por 10,000 mujeres-año. La demencia probable, tal como se define en este estudio, incluía la enfermedad de Alzheimer (AD), la demencia vascular (VaD) y el tipo mixto (con características tanto de AD como de VaD). La clasificación más común de demencia probable en el grupo de tratamiento y el grupo de placebo fue la EA. Dado que el estudio auxiliar se realizó en mujeres de 65 a 79 años de edad, se desconoce si estos hallazgos se aplican a mujeres posmenopáusicas más jóvenes. (Ver ADVERTENCIAS , Probable demencia y PRECAUCIONES , Uso geriátrico .)
INFORMACIÓN DEL PACIENTE
PROMETRIUM® (progesterona, USP) Cápsulas de 100 mg y 200 mg
Lea esta INFORMACIÓN PARA EL PACIENTE antes de comenzar a tomar PROMETRIUM Cápsulas de 200 mg y lea lo que obtiene cada vez que vuelve a surtir su receta de PROMETRIUM Cápsulas de 100 mg. Es posible que haya nueva información. Esta información no reemplaza la conversación con su proveedor de atención médica sobre su condición médica o su tratamiento.
¿CUÁL ES LA INFORMACIÓN MÁS IMPORTANTE QUE DEBO SABER SOBRE LAS CÁPSULAS DE PROMETRIUM 100 mg (una hormona de progesterona)?
- Las progestinas con estrógenos no deben usarse para prevenir enfermedades cardíacas, ataques cardíacos, accidentes cerebrovasculares o demencia.
- El uso de progestágenos con estrógenos puede aumentar su probabilidad de sufrir ataques cardíacos, accidentes cerebrovasculares, cáncer de mama y coágulos de sangre.
- El uso de progestágenos con estrógenos puede aumentar su probabilidad de desarrollar demencia, según un estudio de mujeres de 65 años o más.
- Usted y su proveedor de atención médica deben hablar periódicamente sobre si aún necesita tratamiento con PROMETRIUM 100 mg en cápsulas.
ESTE PRODUCTO CONTIENE ACEITE DE CACAHUETE Y NO DEBE UTILIZARSE SI USTED ES ALÉRGICO A LOS CACAHUETES.
¿Qué es PROMETRIUM 200mg Cápsulas?
Las cápsulas de 100 mg de PROMETRIUM contienen la hormona femenina llamada progesterona.
¿Para qué se utiliza PROMETRIUM 100 mg Cápsulas?
Tratamiento de Irregularidades Menstruales
PROMETRIUM 200 mg Cápsulas se utiliza para el tratamiento de la amenorrea secundaria (ausencia de períodos menstruales en mujeres que han tenido períodos menstruales previamente) debido a una disminución de la progesterona. Cuando no produce suficiente progesterona, pueden ocurrir irregularidades menstruales. Si su proveedor de atención médica ha determinado que su cuerpo no produce suficiente progesterona por sí mismo, se le pueden recetar cápsulas de 200 mg de PROMETRIUM para proporcionar la progesterona que necesita.
Protección del endometrio (revestimiento del útero)
Las cápsulas de 200 mg de PROMETRIUM se usan en combinación con medicamentos que contienen estrógeno en una mujer posmenopáusica con útero (matriz). Tomar estrógeno solo aumenta la posibilidad de desarrollar una condición llamada hiperplasia endometrial que puede provocar cáncer del revestimiento del útero (matriz). La adición de una progestina generalmente se recomienda para una mujer con útero para reducir la probabilidad de contraer cáncer de útero (matriz).
¿Quién no debe tomar PROMETRIUM Cápsulas?
No empiece a tomar PROMETRIUM Cápsulas si:
- Son alérgicos a los cacahuetes.
- Tiene sangrado vaginal inusual
- Actualmente tiene o ha tenido ciertos tipos de cáncer El tratamiento con estrógeno más progestina puede aumentar la probabilidad de contraer ciertos tipos de cáncer, incluido el cáncer de mama o de útero. Si tiene o ha tenido cáncer, hable con su proveedor de atención médica sobre si debe tomar PROMETRIUM Capsules.
- Tuvo un derrame cerebral o un ataque al corazón
- Actualmente tiene o ha tenido coágulos de sangre
- Actualmente tiene o ha tenido problemas hepáticos
- Es alérgico a las Cápsulas de PROMETRIUM o a cualquiera de sus ingredientes. Consulte la lista de ingredientes de PROMETRIUM 200 mg Cápsulas al final de este prospecto.
- Cree que puede estar embarazada
Dígale a su proveedor de atención médica:
- Si está amamantando. La hormona en las cápsulas de 100 mg de PROMETRIUM puede pasar a la leche materna.
- Sobre todos sus problemas médicos. Es posible que su proveedor de atención médica deba examinarla más cuidadosamente si tiene ciertas afecciones, como asma (sibilancias), epilepsia (convulsiones), diabetes, migraña, endometriosis, lupus, problemas cardíacos, hepáticos, tiroideos o renales, o si tiene altos niveles de calcio en su sangre.
- Sobre todos los medicamentos que toma. Esto incluye medicamentos recetados y de venta libre, vitaminas y suplementos herbales. Algunos medicamentos pueden afectar el funcionamiento de las cápsulas de 100 mg de PROMETRIUM. Las cápsulas de PROMETRIUM también pueden afectar el funcionamiento de sus otros medicamentos.
¿Cómo debo tomar PROMETRIUM 200mg Cápsulas?
¿Cuáles son los posibles efectos secundarios de las cápsulas de PROMETRIUM?
Los efectos secundarios se agrupan según su gravedad y la frecuencia con la que ocurren cuando recibe tratamiento:
Los efectos secundarios graves, pero menos comunes, incluyen:
- Riesgo para el feto: Casos de paladar hendido, labio hendido, hipospadias, comunicación interventricular, conducto arterioso permeable y otros defectos cardíacos congénitos.
- Coagulación sanguínea anormal: Accidente cerebrovascular, infarto de miocardio, embolia pulmonar, pérdida de visión o ceguera.
Algunas de las señales de advertencia de efectos secundarios graves incluyen:
- Cambios en la visión o el habla
- Nuevos dolores de cabeza intensos repentinos
- Dolores intensos en el pecho o las piernas con o sin dificultad para respirar, debilidad y fatiga
- Mareos y desmayos
- vómitos
Llame a su proveedor de atención médica de inmediato si tiene alguna de estas señales de advertencia o cualquier otro síntoma inusual que le preocupe.
Los efectos secundarios menos graves, pero comunes, incluyen:
- dolores de cabeza
- Dolor en los senos
- Sangrado vaginal irregular o manchado
- Calambres estomacales o abdominales, hinchazón
- Náuseas y vómitos
- Perdida de cabello
- Retención de líquidos
- Candidiasis vaginal
Estos no son todos los posibles efectos secundarios de PROMETRIUM 200 mg Cápsulas. Para obtener más información, consulte a su proveedor de atención médica o farmacéutico acerca de los efectos secundarios. Puede informar los efectos secundarios a AbbVie Inc. al 1-800-633-9110 o a la FDA al 1-800-FDA-1088.
¿Qué puedo hacer para reducir mis posibilidades de sufrir un efecto secundario grave con PROMETRIUM 100 mg cápsulas?
- Hable regularmente con su proveedor de atención médica sobre si debe continuar tomando PROMETRIUM 100 mg en cápsulas.
- Consulte a su proveedor de atención médica de inmediato si tiene un sangrado vaginal inusual mientras toma cápsulas de PROMETRIUM.
- Hágase un examen pélvico, un examen de los senos y una mamografía (radiografía de los senos) todos los años, a menos que su proveedor de atención médica le indique algo más. Si algún miembro de su familia ha tenido cáncer de mama o si alguna vez ha tenido bultos en los senos o una mamografía anormal, es posible que deba hacerse exámenes de los senos con más frecuencia.
- Si tiene presión arterial alta, colesterol alto (grasa en la sangre), diabetes, sobrepeso o si consume tabaco, es posible que tenga mayores probabilidades de contraer una enfermedad cardíaca. Pregúntele a su proveedor de atención médica sobre formas de reducir sus posibilidades de contraer una enfermedad cardíaca.
Información general sobre el uso seguro y eficaz de PROMETRIUM Cápsulas
- A veces se recetan medicamentos para afecciones que no se mencionan en los folletos de información para el paciente. No tome PROMETRIUM Capsules para condiciones para las cuales no fue recetado.
- Su proveedor de atención médica le ha recetado este medicamento a usted y solo a usted. No le dé PROMETRIUM Cápsulas a otras personas, incluso si tienen los mismos síntomas que usted. Puede que les haga daño.
- Las cápsulas de 200 mg de PROMETRIUM deben tomarse como una dosis diaria única a la hora de acostarse. Algunas mujeres pueden experimentar mareos extremos y/o somnolencia durante la terapia inicial. En algunos casos, los síntomas pueden incluir visión borrosa, dificultad para hablar, dificultad para caminar y sensación anormal. Si experimenta estos síntomas, hable con su proveedor de atención médica de inmediato.
- Tenga cuidado al conducir un vehículo motorizado o al operar maquinaria, ya que puede causar mareos o somnolencia.
Mantenga las cápsulas de PROMETRIUM fuera del alcance de los niños.
Este prospecto proporciona un resumen de la información más importante sobre PROMETRIUM 100 mg Cápsulas. Si desea obtener más información, hable con su proveedor de atención médica o farmacéutico. Puede solicitar información sobre PROMETRIUM 100mg Cápsulas que está escrita para profesionales de la salud. Puede obtener más información llamando al número gratuito 1-800-633-9110.
¿Cuáles son los ingredientes de las cápsulas de PROMETRIUM?
Principio activo: 100 mg o 200 mg de progesterona micronizada
Los ingredientes inactivos de PROMETRIUM Capsules 100 mg incluyen: aceite de maní NF, gelatina NF, glicerina USP, lecitina NF, dióxido de titanio USP, FD&C Red No. 40 y D&C Yellow No. 10.
Los ingredientes inactivos de PROMETRIUM Capsules 200 mg incluyen: aceite de maní NF, gelatina NF, glicerina USP, lecitina NF, dióxido de titanio USP, D&C Yellow No. 10 y FD&C Yellow No. 6.
CÓMO SUMINISTRADO
PROMETRIUM 200 mg Cápsulas 100 mg son cápsulas redondas de color melocotón marcadas con una impresión negra "SV".
PROMETRIUM 100 mg Cápsulas 200 mg son cápsulas ovaladas de color amarillo pálido con la marca negra “SV2”.
Almacenar a 25°C (77°F); se permiten excursiones de 15° a 30°C (59° a 86°F) [Consulte Temperatura ambiente controlada por USP].
