Fosamax 35mg, 70mg Alendronate Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Fosamax 70mg y cómo se usa?
Fosamax 35mg es un medicamento recetado que se usa para prevenir y tratar ciertos tipos de pérdida ósea (osteoporosis) en adultos. Fosamax 70 mg se puede usar solo o con otros medicamentos.
Fosamax es un modificador del metabolismo del calcio, derivado de los bisfosfonatos.
No se sabe si Fosamax es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Fosamax?
Fosamax puede causar efectos secundarios graves que incluyen:
- Dolor de pecho
- acidez estomacal nueva o que empeora
- dolor o ardor debajo de las costillas o en la espalda
- acidez estomacal severa
- dolor ardiente en la parte superior del estómago o tos con sangre
- dolor nuevo o inusual en el muslo o la cadera
- dolor de mandibula
- entumecimiento
- hinchazón
- dolor severo en las articulaciones, huesos o músculos
- espasmos o calambres musculares
- entumecimiento o sensación de hormigueo alrededor de la boca o en los dedos de las manos o de los pies
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Fosamax incluyen:
- acidez
- dolor de barriga
- dolor de estómago
- náuseas
- Diarrea
- estreñimiento
- dolor de huesos
- dolor muscular
- dolor en las articulaciones
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Fosamax. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
FOSAMAX (alendronato sódico) es un bisfosfonato que actúa como un inhibidor específico de la resorción ósea mediada por osteoclastos. Los bisfosfonatos son análogos sintéticos del pirofosfato que se unen a la hidroxiapatita que se encuentra en los huesos.
El alendronato sódico se describe químicamente como trihidrato de sal monosódica del ácido bisfosfónico (4-amino-1-hidroxibutilideno).
La fórmula empírica del alendronato sódico es C4H12NNaO7P2 •3H2O y su peso de fórmula es 325,12. La fórmula estructural es:
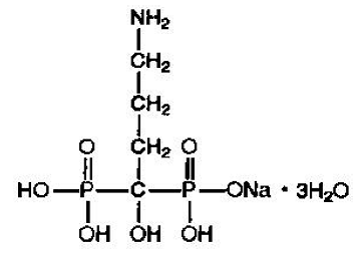
El alendronato de sodio es un polvo blanco, cristalino, no higroscópico. Es soluble en agua, muy poco soluble en alcohol y prácticamente insoluble en cloroformo.
Los comprimidos de FOSAMAX 70 mg para administración oral contienen 91,37 mg de sal monosódica trihidrato de alendronato, que es el equivalente molar de 70 mg de ácido libre, y los siguientes principios inactivos: celulosa microcristalina, lactosa anhidra, croscarmelosa sódica y estearato de magnesio.
INDICACIONES
Tratamiento® De La Osteoporosis En Mujeres Posmenopáusicas
FOSAMAX está indicado para el tratamiento de la osteoporosis en mujeres posmenopáusicas. En mujeres posmenopáusicas, FOSAMAX 70mg aumenta la masa ósea y reduce la incidencia de fracturas, incluidas las de cadera y columna (fracturas vertebrales por compresión). [Ver Estudios clínicos ]
Prevención de la osteoporosis en mujeres posmenopáusicas
FOSAMAX 70mg está indicado para la prevención de la osteoporosis posmenopáusica [ver Estudios clínicos ].
Tratamiento para aumentar la masa ósea en hombres con osteoporosis
FOSAMAX está indicado como tratamiento para aumentar la masa ósea en hombres con osteoporosis [ver Estudios clínicos ].
Tratamiento de la osteoporosis inducida por glucocorticoides
FOSAMAX está indicado para el tratamiento de la osteoporosis inducida por glucocorticoides en hombres y mujeres que reciben glucocorticoides en una dosis diaria equivalente a 7,5 mg o más de prednisona y que tienen una densidad mineral ósea baja [ver Estudios clínicos ].
Tratamiento de la enfermedad ósea de Paget
FOSAMAX 35mg está indicado para el tratamiento de la enfermedad ósea de Paget en hombres y mujeres. El tratamiento está indicado en pacientes con enfermedad ósea de Paget que tienen fosfatasa alcalina al menos dos veces el límite superior de lo normal, o aquellos que son sintomáticos, o aquellos en riesgo de futuras complicaciones de su enfermedad. [Ver Estudios clínicos ]
Importantes limitaciones de uso
No se ha determinado la duración óptima de uso. La seguridad y eficacia de FOSAMAX para el tratamiento de la osteoporosis se basan en datos clínicos de cuatro años de duración. Todos los pacientes en tratamiento con bisfosfonatos deben someterse a una reevaluación periódica de la necesidad de continuar el tratamiento. Se debe considerar la interrupción del fármaco en pacientes con bajo riesgo de fractura después de 3 a 5 años de uso. Los pacientes que interrumpan el tratamiento deben someterse a una reevaluación periódica del riesgo de fractura.
DOSIFICACIÓN Y ADMINISTRACIÓN
Aunque las tabletas de alendronato de 5 mg, 10 mg, 35 mg y 40 mg están disponibles en el mercado, FOSAMAX 35 mg ya no se comercializa en las concentraciones de 5 mg, 10 mg, 35 mg y 40 mg.
Aunque una solución oral de alendronato puede estar disponible en el mercado, la solución oral de 35 mg de FOSAMAX ya no se comercializa.
Tratamiento de la osteoporosis en mujeres posmenopáusicas
La dosis recomendada es:
- una tableta de 70 mg una vez por semana o
- un frasco de solución oral de 70 mg una vez por semana o
- una tableta de 10 mg una vez al día
Prevención de la osteoporosis en mujeres posmenopáusicas
La dosis recomendada es:
- una tableta de 35 mg una vez por semana o
- una tableta de 5 mg una vez al día
Tratamiento para aumentar la masa ósea en hombres con osteoporosis
La dosis recomendada es:
- una tableta de 70 mg una vez por semana o
- un frasco de solución oral de 70 mg una vez por semana o
- una tableta de 10 mg una vez al día
Tratamiento de la osteoporosis inducida por glucocorticoides
La dosis recomendada es una tableta de 5 mg una vez al día, excepto para las mujeres posmenopáusicas que no reciben estrógenos, para quienes la dosis recomendada es una tableta de 10 mg una vez al día.
Tratamiento de la enfermedad ósea de Paget
El régimen de tratamiento recomendado es de 40 mg una vez al día durante seis meses.
Retratamiento de la enfermedad de Paget
Se puede considerar el retratamiento con FOSAMAX 35 mg, luego de un período de evaluación posterior al tratamiento de seis meses en pacientes que hayan recaído, en función de los aumentos de la fosfatasa alcalina sérica, que se debe medir periódicamente. También se puede considerar el retratamiento en aquellos que no lograron normalizar su fosfatasa alcalina sérica.
Instrucciones de administración importantes
Indique a los pacientes que hagan lo siguiente:
- Tome FOSAMAX al menos media hora antes de la primera comida, bebida o medicamento del día solo con agua [ver Información de asesoramiento para pacientes ]. Es probable que otras bebidas (incluida el agua mineral), los alimentos y algunos medicamentos reduzcan la absorción de FOSAMAX [ver INTERACCIONES CON LA DROGAS ]. Esperar menos de 30 minutos o tomar FOSAMAX 70 mg con alimentos, bebidas (que no sean agua corriente) u otros medicamentos disminuirá el efecto de FOSAMAX 70 mg al disminuir su absorción en el cuerpo.
- Tome FOSAMAX al levantarse para el día. Para facilitar la llegada al estómago y reducir así la posibilidad de irritación esofágica, se debe tragar una tableta de FOSAMAX de 35 mg con un vaso lleno de agua (de 6 a 8 onzas). Para facilitar el vaciado gástrico, la solución oral de FOSAMAX 70 mg debe ir seguida de al menos 2 onzas (un cuarto de taza) de agua. Los pacientes no deben acostarse durante al menos 30 minutos y hasta después de su primera comida del día. FOSAMAX no debe tomarse a la hora de acostarse o antes de levantarse por la mañana. El incumplimiento de estas instrucciones puede aumentar el riesgo de experiencias esofágicas adversas [ver ADVERTENCIAS Y PRECAUCIONES y Información de asesoramiento para pacientes ].
Recomendaciones para la suplementación con calcio y vitamina D
Indique a los pacientes que tomen suplementos de calcio si la ingesta dietética es inadecuada [ver ADVERTENCIAS Y PRECAUCIONES ]. Los pacientes con mayor riesgo de insuficiencia de vitamina D (p. ej., mayores de 70 años, confinados en hogares de ancianos o enfermos crónicos) pueden necesitar suplementos de vitamina D. Los pacientes con síndromes de malabsorción gastrointestinal pueden requerir dosis más altas de suplementos de vitamina D y se debe considerar la medición de 25-hidroxivitamina D.
Los pacientes tratados con glucocorticoides deben recibir cantidades adecuadas de calcio y vitamina D.
Instrucciones de administración para dosis olvidadas
Si se olvida una dosis semanal de FOSAMAX, indique a los pacientes que tomen una dosis en la mañana después de que se acuerden. No deben tomar dos dosis el mismo día, sino que deben volver a tomar una dosis una vez a la semana, según lo programado originalmente en el día elegido.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
- Los comprimidos de 70 mg son comprimidos blancos, ovalados, sin recubrimiento, con el código 31 en una cara y el contorno de una imagen ósea en la otra.
Almacenamiento y manipulación
No. 3814 - FOSAMAX Comprimidos, 70 mg, son comprimidos blancos, ovalados, sin recubrimiento, con el código 31 en un lado y el contorno de una imagen ósea en el otro:
CDN 0006-0031-44 unidad de uso blíster de 4.
Almacenamiento
FOSAMAX Tabletas
Almacenar en un recipiente bien cerrado a temperatura ambiente, 15-30°C (59-86°F).
Distribuido por: Merck Sharp & Dohme Corp., una subsidiaria de MERCK & CO., INC., Whitehouse Station, NJ 08889, EE. UU. Revisado: agosto de 2019
EFECTOS SECUNDARIOS
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica clínica.
Tratamiento de la osteoporosis en mujeres posmenopáusicas
Dosificación diaria
La seguridad de FOSAMAX 35 mg en el tratamiento de la osteoporosis posmenopáusica se evaluó en cuatro ensayos clínicos en los que participaron 7453 mujeres de 44 a 84 años. El Estudio 1 y el Estudio 2 fueron estudios multicéntricos, doble ciego, controlados con placebo, de tres años, de diseño idéntico (Estados Unidos y Multinacional n=994); El Estudio 3 fue la cohorte de fracturas vertebrales de tres años del Fracture Intervention Trial [FIT] (n=2027) y el Estudio 4 fue la cohorte de fracturas clínicas de cuatro años de FIT (n=4432). En general, 3620 pacientes fueron expuestos al placebo y 3432 pacientes expuestos a FOSAMAX. En estos ensayos clínicos se incluyeron pacientes con enfermedad gastrointestinal preexistente y uso concomitante de medicamentos antiinflamatorios no esteroideos. En el Estudio 1 y el Estudio 2 todas las mujeres recibieron 500 mg de calcio elemental como carbonato. En el Estudio 3 y el Estudio 4, todas las mujeres con una ingesta dietética de calcio inferior a 1000 mg por día recibieron 500 mg de calcio y 250 unidades internacionales de vitamina D por día.
Entre los pacientes tratados con alendronato 10 mg o placebo en el Estudio 1 y el Estudio 2, y todos los pacientes en el Estudio 3 y el Estudio 4, la incidencia de mortalidad por todas las causas fue del 1,8 % en el grupo de placebo y del 1,8 % en el grupo de 35 mg de FOSAMAX. La incidencia de eventos adversos graves fue del 30,7 % en el grupo de placebo y del 30,9 % en el grupo de FOSAMAX. El porcentaje de pacientes que abandonaron el estudio debido a algún evento clínico adverso fue del 9,5% en el grupo placebo y del 8,9% en el grupo FOSAMAX 70mg. En la Tabla 1 se presentan las reacciones adversas de estos estudios consideradas por los investigadores como posiblemente, probablemente o definitivamente relacionadas con el fármaco en más o igual al 1 % de los pacientes tratados con FOSAMAX 35 mg o placebo.
Se han producido sarpullido y eritema.
Reacciones adversas gastrointestinales
Un paciente tratado con FOSAMAX (10 mg/día), que tenía antecedentes de enfermedad ulcerosa péptica y gastrectomía y que estaba tomando aspirina concomitante, desarrolló una úlcera anastomótica con hemorragia leve, que se consideró relacionada con el medicamento. Se suspendieron aspirina y FOSAMAX y el paciente se recuperó. En las poblaciones del Estudio 1 y el Estudio 2, entre el 49 % y el 54 % tenían antecedentes de trastornos gastrointestinales al inicio del estudio y entre el 54 % y el 89 % usaban medicamentos antiinflamatorios no esteroideos o aspirina en algún momento durante los estudios. [Ver ADVERTENCIAS Y PRECAUCIONES ]
Resultados de las pruebas de laboratorio
En estudios controlados, multicéntricos, doble ciego, se observaron disminuciones asintomáticas, leves y transitorias del calcio y el fosfato séricos en aproximadamente el 18 % y el 10 %, respectivamente, de los pacientes que tomaban FOSAMAX frente a aproximadamente el 12 % y el 3 % de los que tomaban placebo. Sin embargo, las incidencias de disminuciones en el calcio sérico a menos de 8,0 mg/dL (2,0 mM) y el fosfato sérico a menos o igual a 2,0 mg/dL (0,65 mM) fueron similares en ambos grupos de tratamiento.
Dosificación Semanal
La seguridad de FOSAMAX 70 mg una vez a la semana para el tratamiento de la osteoporosis posmenopáusica se evaluó en un estudio multicéntrico doble ciego de un año de duración que comparó FOSAMAX 70 mg una vez a la semana y FOSAMAX 10 mg al día. Los perfiles generales de seguridad y tolerabilidad de FOSAMAX 70 mg una vez a la semana y FOSAMAX 10 mg al día fueron similares. Las reacciones adversas consideradas por los investigadores como posiblemente, probablemente o definitivamente relacionadas con el fármaco en más del 1 % o igual de los pacientes en cualquiera de los grupos de tratamiento se presentan en la Tabla 2.
Prevención de la osteoporosis en mujeres posmenopáusicas
Dosificación diaria
La seguridad de FOSAMAX 5 mg/día en mujeres posmenopáusicas de 40 a 60 años de edad se evaluó en tres estudios doble ciego controlados con placebo en los que participaron más de 1400 pacientes aleatorizados para recibir FOSAMAX durante dos o tres años. En estos estudios, los perfiles generales de seguridad de FOSAMAX 5 mg/día y el placebo fueron similares. La interrupción de la terapia debido a cualquier evento adverso clínico ocurrió en el 7,5 % de los 642 pacientes tratados con FOSAMAX 5 mg/día y en el 5,7 % de los 648 pacientes tratados con placebo.
Dosificación Semanal
La seguridad de FOSAMAX 35 mg una vez a la semana en comparación con FOSAMAX 5 mg diarios se evaluó en un estudio multicéntrico doble ciego de un año de duración de 723 pacientes. Los perfiles generales de seguridad y tolerabilidad de FOSAMAX 35 mg una vez a la semana y FOSAMAX 5 mg al día fueron similares.
Las reacciones adversas de estos estudios consideradas por los investigadores como posiblemente, probablemente o definitivamente relacionadas con el fármaco en más o igual al 1 % de los pacientes tratados con FOSAMAX 35 mg una vez a la semana, FOSAMAX 5 mg/día o placebo se presentan en la Tabla 3. .
Uso concomitante con estrógeno/terapia de reemplazo hormonal
En dos estudios (de uno y dos años de duración) de mujeres posmenopáusicas con osteoporosis (total: n=853), el perfil de seguridad y tolerabilidad del tratamiento combinado con FOSAMAX 10 mg una vez al día y estrógeno ± progestágeno (n=354) fue consistentes con los de los tratamientos individuales.
Osteoporosis en hombres
En dos estudios multicéntricos, doble ciego, controlados con placebo en hombres (un estudio de dos años de FOSAMAX 10 mg/día y un estudio de un año de FOSAMAX 70 mg una vez a la semana), las tasas de interrupción del tratamiento debido a cualquier efecto adverso clínico evento fueron 2,7 % para FOSAMAX 10 mg/día frente a 10,5 % para placebo, y 6,4 % para FOSAMAX 70 mg una vez a la semana frente a 8,6 % para placebo. Las reacciones adversas consideradas por los investigadores como posiblemente, probablemente o definitivamente relacionadas con el fármaco en más o igual al 2 % de los pacientes tratados con FOSAMAX 70 mg o con placebo se presentan en la Tabla 4.
Osteoporosis inducida por glucocorticoides
En dos estudios multicéntricos, doble ciego, controlados con placebo, de un año de duración, en pacientes que recibieron tratamiento con glucocorticoides, los perfiles generales de seguridad y tolerabilidad de FOSAMAX 5 y 10 mg/día fueron generalmente similares a los del placebo. Las reacciones adversas consideradas por los investigadores como posiblemente, probablemente o definitivamente relacionadas con el fármaco en más o igual al 1 % de los pacientes tratados con FOSAMAX 5 o 10 mg/día o placebo se presentan en la Tabla 5.
El perfil general de seguridad y tolerabilidad en la población con osteoporosis inducida por glucocorticoides que continuó la terapia durante el segundo año de los estudios (FOSAMAX: n=147) fue consistente con el observado en el primer año.
Enfermedad ósea de Paget
En estudios clínicos (osteoporosis y enfermedad de Paget), los eventos adversos informados en 175 pacientes que tomaron FOSAMAX 40 mg/día durante 3 a 12 meses fueron similares a los de las mujeres posmenopáusicas tratadas con FOSAMAX 10 mg/día. Sin embargo, hubo un aumento aparente en la incidencia de reacciones adversas gastrointestinales superiores en pacientes que tomaban 40 mg/día de FOSAMAX (17,7 % de FOSAMAX frente a 10,2 % de placebo). Un caso de esofagitis y dos casos de gastritis dieron lugar a la interrupción del tratamiento.
Además, los investigadores consideraron que el dolor musculoesquelético (óseo, muscular o articular), que se ha descrito en pacientes con enfermedad de Paget tratados con otros bisfosfonatos, está posiblemente, probablemente o definitivamente relacionado con el fármaco en aproximadamente el 6 % de los pacientes. tratados con FOSAMAX 40 mg/día versus aproximadamente el 1 % de los pacientes tratados con placebo, pero rara vez dieron lugar a la interrupción del tratamiento. La interrupción de la terapia debido a cualquier evento adverso clínico ocurrió en el 6,4 % de los pacientes con enfermedad de Paget tratados con FOSAMAX 40 mg/día y en el 2,4 % de los pacientes tratados con placebo.
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de FOSAMAX. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Cuerpo como un todo: reacciones de hipersensibilidad incluyendo urticaria y angioedema. Se han informado síntomas transitorios de mialgia, malestar general, astenia y fiebre con FOSAMAX, típicamente asociados con el inicio del tratamiento. Ha ocurrido hipocalcemia sintomática, generalmente en asociación con condiciones predisponentes. Edema periférico.
Gastrointestinal: esofagitis, erosiones esofágicas, úlceras esofágicas, estenosis o perforación esofágica y ulceración orofaríngea. También se han notificado úlceras gástricas o duodenales, algunas graves y con complicaciones [ver DOSIFICACIÓN Y ADMINISTRACIÓN ; ADVERTENCIAS Y PRECAUCIONES ].
Se ha informado osteonecrosis mandibular localizada, generalmente asociada con extracción dental y/o infección local con cicatrización retardada [ver ADVERTENCIAS Y PRECAUCIONES ].
Musculoesquelético: dolor óseo, articular y/o muscular, ocasionalmente intenso e incapacitante [ver ADVERTENCIAS Y PRECAUCIONES ]; inflamación de articulaciones; fracturas subtrocantéricas y de diáfisis femoral de baja energía [ver ADVERTENCIAS Y PRECAUCIONES ].
Sistema nervioso: mareos y vértigo.
Pulmonar: Exacerbaciones agudas de asma.
Piel: erupción cutánea (ocasionalmente con fotosensibilidad), prurito, alopecia, reacciones cutáneas graves, incluido el síndrome de Stevens-Johnson y la necrólisis epidérmica tóxica.
Sentidos especiales: uveítis, escleritis o epiescleritis. Colesteatoma del conducto auditivo externo (osteonecrosis focal).
INTERACCIONES CON LA DROGAS
Suplementos de calcio/antiácidos
La administración conjunta de FOSAMAX y calcio, antiácidos o medicamentos orales que contienen cationes multivalentes interferirán con la absorción de FOSAMAX. Por lo tanto, indique a los pacientes que esperen al menos media hora después de tomar FOSAMAX 35 mg antes de tomar cualquier otro medicamento oral.
Aspirina
En estudios clínicos, la incidencia de eventos adversos gastrointestinales superiores aumentó en pacientes que recibieron terapia concomitante con dosis diarias de FOSAMAX 35 mg mayores a 10 mg y productos que contienen aspirina.
Fármacos anti-inflamatorios no esteroideos
FOSAMAX 35 mg puede administrarse a pacientes que toman medicamentos antiinflamatorios no esteroideos (AINE). En un estudio clínico controlado de 3 años (n=2027) durante el cual la mayoría de los pacientes recibieron AINE concomitantemente, la incidencia de eventos adversos gastrointestinales superiores fue similar en los pacientes que tomaron FOSAMAX 5 o 10 mg/día en comparación con los que tomaron placebo. Sin embargo, dado que el uso de AINE está asociado con irritación gastrointestinal, se debe tener precaución durante el uso concomitante con FOSAMAX.
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Reacciones adversas gastrointestinales superiores
FOSAMAX 35mg, al igual que otros bisfosfonatos administrados por vía oral, puede causar irritación local de la mucosa digestiva alta. Debido a estos posibles efectos irritantes y al potencial de empeoramiento de la enfermedad subyacente, se debe tener precaución cuando se administre FOSAMAX a pacientes con problemas gastrointestinales superiores activos (como esófago de Barrett conocido, disfagia, otras enfermedades esofágicas, gastritis, duodenitis o úlceras).
Se han informado experiencias adversas esofágicas, como esofagitis, úlceras esofágicas y erosiones esofágicas, ocasionalmente con sangrado y rara vez seguidas de estenosis o perforación esofágica, en pacientes que reciben tratamiento con bisfosfonatos orales, incluido FOSAMAX. En algunos casos, estos han sido graves y han requerido hospitalización. Por lo tanto, los médicos deben estar atentos a cualquier signo o síntoma que indique una posible reacción esofágica y se debe instruir a los pacientes para que descontinúen FOSAMAX 70 mg y busquen atención médica si desarrollan disfagia, odinofagia, dolor retroesternal o acidez estomacal nueva o que empeora.
El riesgo de experiencias adversas esofágicas graves parece ser mayor en pacientes que se acuestan después de tomar bisfosfonatos orales, incluido FOSAMAX 70 mg y/o que no tragan bisfosfonatos orales, incluido FOSAMAX 35 mg con el vaso lleno recomendado (6-8 onzas) de agua, y /o que continúan tomando bisfosfonatos orales, incluido FOSAMAX 70 mg, después de desarrollar síntomas que sugieran irritación esofágica. Por lo tanto, es muy importante que el paciente reciba y comprenda las instrucciones de dosificación completas [ver DOSIFICACIÓN Y ADMINISTRACIÓN ]. En pacientes que no pueden cumplir con las instrucciones de dosificación debido a una discapacidad mental, la terapia con FOSAMAX debe usarse bajo la supervisión adecuada.
Ha habido informes posteriores a la comercialización de úlceras gástricas y duodenales con el uso de bisfosfonatos orales, algunos graves y con complicaciones, aunque no se observó un aumento del riesgo en ensayos clínicos controlados [ver REACCIONES ADVERSAS ].
Metabolismo Mineral
La hipocalcemia debe corregirse antes de iniciar la terapia con FOSAMAX [ver CONTRAINDICACIONES ]. Otros trastornos que afectan el metabolismo mineral (como la deficiencia de vitamina D) también deben tratarse de manera efectiva. En pacientes con estas condiciones, se debe monitorear el calcio sérico y los síntomas de hipocalcemia durante la terapia con FOSAMAX.
Presumiblemente, debido a los efectos de FOSAMAX en el aumento del mineral óseo, pueden ocurrir pequeñas disminuciones asintomáticas en el calcio y el fosfato sérico, especialmente en pacientes con la enfermedad de Paget, en quienes la tasa de recambio óseo previa al tratamiento puede ser muy elevada, y en pacientes que reciben glucocorticoides, en quienes la absorción de calcio puede estar disminuida.
Asegurar una ingesta adecuada de calcio y vitamina D es especialmente importante en pacientes con enfermedad ósea de Paget y en pacientes que reciben glucocorticoides.
Dolor musculoesquelético
En la experiencia posterior a la comercialización, se ha informado dolor óseo, articular y/o muscular severo y ocasionalmente incapacitante en pacientes que toman bisfosfonatos que están aprobados para la prevención y el tratamiento de la osteoporosis [ver REACCIONES ADVERSAS ]. Esta categoría de medicamentos incluye FOSAMAX (alendronato). La mayoría de los pacientes eran mujeres posmenopáusicas. El tiempo de aparición de los síntomas varió de un día a varios meses después de comenzar el fármaco. Suspenda su uso si se desarrollan síntomas graves. La mayoría de los pacientes experimentaron un alivio de los síntomas después de suspender el tratamiento. Un subconjunto tuvo recurrencia de los síntomas cuando se volvió a exponer al mismo fármaco oa otro bisfosfonato.
En estudios clínicos controlados con placebo de FOSAMAX, los porcentajes de pacientes con estos síntomas fueron similares en los grupos de FOSAMAX 35 mg y placebo.
Osteonecrosis de la mandíbula
La osteonecrosis de la mandíbula (ONM), que puede ocurrir espontáneamente, generalmente se asocia con la extracción del diente y/o infección local con cicatrización retardada, y se ha informado en pacientes que toman bisfosfonatos, incluido FOSAMAX. Los factores de riesgo conocidos para la osteonecrosis de la mandíbula incluyen procedimientos dentales invasivos (p. ej., extracción dental, implantes dentales, cirugía ósea), diagnóstico de cáncer, terapias concomitantes (p. ej., quimioterapia, corticosteroides, inhibidores de la angiogénesis), mala higiene bucal y comorbilidad. trastornos (p. ej., enfermedad periodontal y/u otra enfermedad dental preexistente, anemia, coagulopatía, infección, dentaduras postizas mal ajustadas). El riesgo de ONM puede aumentar con la duración de la exposición a los bisfosfonatos.
Para los pacientes que requieren procedimientos dentales invasivos, la interrupción del tratamiento con bisfosfonatos puede reducir el riesgo de ONM. El juicio clínico del médico tratante y/o del cirujano oral debe guiar el plan de manejo de cada paciente en función de la evaluación de riesgo/beneficio individual.
Los pacientes que desarrollen osteonecrosis de la mandíbula durante la terapia con bisfosfonatos deben recibir atención de un cirujano oral. En estos pacientes, la cirugía dental extensa para tratar la ONM puede exacerbar la afección. Se debe considerar la interrupción del tratamiento con bisfosfonatos en función de la evaluación individual del riesgo/beneficio.
Fracturas subtrocantéricas y diafisarias femorales atípicas
Se han notificado fracturas atípicas, de baja energía o traumatismos de la diáfisis femoral en pacientes tratados con bisfosfonatos. Estas fracturas pueden ocurrir en cualquier parte de la diáfisis femoral desde justo debajo del trocánter menor hasta arriba del ensanchamiento supracondíleo y tienen una orientación transversal u oblicua corta sin evidencia de conminución. No se ha establecido la causalidad ya que estas fracturas también ocurren en pacientes osteoporóticos que no han sido tratados con bisfosfonatos.
Las fracturas de fémur atípicas ocurren con mayor frecuencia con un traumatismo mínimo o nulo en el área afectada. Pueden ser bilaterales y muchos pacientes informan dolor prodrómico en el área afectada, que generalmente se presenta como un dolor sordo en el muslo, semanas o meses antes de que ocurra una fractura completa. Varios informes señalan que los pacientes también estaban recibiendo tratamiento con glucocorticoides (p. ej., prednisona) en el momento de la fractura.
Se debe sospechar que cualquier paciente con antecedentes de exposición a bisfosfonatos que presente dolor en el muslo o la ingle tiene una fractura atípica y se debe evaluar para descartar una fractura de fémur incompleta. Los pacientes que presentan una fractura atípica también deben ser evaluados para detectar síntomas y signos de fractura en la extremidad contralateral. Se debe considerar la interrupción de la terapia con bisfosfonatos, en espera de una evaluación de riesgos/beneficios, de forma individual.
Insuficiencia renal
FOSAMAX 35 mg no se recomienda para pacientes con depuración de creatinina inferior a 35 ml/min.
Osteoporosis inducida por glucocorticoides
No se ha establecido el riesgo versus beneficio de FOSAMAX para el tratamiento con dosis diarias de glucocorticoides inferiores a 7,5 mg de prednisona o equivalente [ver INDICACIONES Y USO ]. Antes de iniciar el tratamiento, se debe determinar el estado hormonal gonadal de hombres y mujeres y considerar el reemplazo apropiado.
Se debe realizar una medición de la densidad mineral ósea al inicio de la terapia y repetirla después de 6 a 12 meses de tratamiento combinado con FOSAMAX y glucocorticoides.
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( Guía de medicamentos ).
Indique a los pacientes que lean la Guía del medicamento antes de iniciar la terapia con FOSAMAX y que la vuelvan a leer cada vez que renueven la receta.
Recomendaciones para la osteoporosis, incluidos suplementos de calcio y vitamina D
Indique a los pacientes que tomen suplementos de calcio y vitamina D, si la ingesta dietética diaria es inadecuada. El ejercicio con pesas debe considerarse junto con la modificación de ciertos factores conductuales, como el tabaquismo y/o el consumo excesivo de alcohol, si estos factores existen.
Instrucciones de dosificación
Indique a los pacientes que los beneficios esperados de FOSAMAX 70 mg solo se pueden obtener cuando se toma con agua corriente al levantarse al menos 30 minutos antes de la primera comida, bebida o medicamento del día. Se ha demostrado que incluso la dosificación con jugo de naranja o café reduce notablemente la absorción de FOSAMAX [ver FARMACOLOGÍA CLÍNICA ].
Indique a los pacientes que no mastiquen ni chupen la tableta debido a la posibilidad de ulceración orofaríngea.
Indique a los pacientes que traguen cada tableta de FOSAMAX con un vaso lleno de agua (de 6 a 8 onzas) para facilitar la llegada al estómago y así reducir la posibilidad de irritación esofágica. Indique a los pacientes que beban al menos 2 onzas (un cuarto de taza) de agua después de tomar FOSAMAX 70 mg solución oral, para facilitar el vaciamiento gástrico.
Indique a los pacientes que no se acuesten durante al menos 30 minutos y hasta después de su primera comida del día.
Indique a los pacientes que no tomen FOSAMAX a la hora de acostarse o antes de levantarse por la mañana. Se debe informar a los pacientes que el incumplimiento de estas instrucciones puede aumentar el riesgo de problemas esofágicos.
Indique a los pacientes que si desarrollan síntomas de enfermedad esofágica (como dificultad o dolor al tragar, dolor retroesternal o acidez estomacal nueva o que empeora) deben dejar de tomar FOSAMAX y consultar a su médico.
Si los pacientes olvidan una dosis de FOSAMAX 70 mg una vez a la semana, indíqueles que tomen una dosis a la mañana siguiente de lo que recuerden. No deben tomar dos dosis el mismo día, sino que deben volver a tomar una dosis una vez a la semana, según lo programado originalmente en el día elegido.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Los adenomas de la glándula de Harder (una glándula retroorbitaria que no está presente en los humanos) aumentaron en ratones hembra con dosis altas (p = 0,003) en un estudio de carcinogenicidad oral de 92 semanas con dosis de alendronato de 1, 3 y 10 mg/kg/ día (hombres) o 1, 2 y 5 mg/kg/día (mujeres). Estas dosis son equivalentes a aproximadamente 0,1 a 1 veces la dosis diaria clínica más alta recomendada de 40 mg en base al área de superficie, mg/m². Se desconoce la relevancia de este hallazgo para los humanos.
Los adenomas de células parafoliculares (tiroides) aumentaron en ratas macho que recibieron dosis altas (p = 0,003) en un estudio de carcinogenicidad oral de 2 años con dosis de 1 y 3,75 mg/kg de peso corporal. Estas dosis son equivalentes a aproximadamente 0,3 y 1 veces la dosis clínica diaria de 40 mg basada en el área de superficie, mg/m². Se desconoce la relevancia de este hallazgo para los seres humanos.
El alendronato no fue genotóxico en el ensayo de mutagénesis microbiana in vitro con y sin activación metabólica, en un ensayo de mutagénesis en células de mamífero in vitro, en un ensayo de elución alcalina in vitro en hepatocitos de rata y en un ensayo de aberración cromosómica in vivo en ratones. Sin embargo, en un ensayo de aberraciones cromosómicas in vitro en células de ovario de hámster chino, el alendronato dio resultados equívocos.
El alendronato no tuvo efecto sobre la fertilidad (macho o hembra) en ratas en dosis orales de hasta 5 mg/kg/día (aproximadamente 1 vez la dosis clínica diaria de 40 mg basada en el área de superficie, mg/m²).
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
Los datos disponibles sobre el uso de FOSAMAX en mujeres embarazadas son insuficientes para informar un riesgo asociado con el fármaco de resultados maternos o fetales adversos. Suspender FOSAMAX 35 mg cuando se reconozca el embarazo.
En estudios de reproducción en animales, la administración oral diaria de alendronato a ratas desde antes del apareamiento hasta el final de la gestación o la lactancia mostró una disminución de la supervivencia posterior a la implantación y una disminución del aumento de peso corporal de las crías a partir de dosis equivalentes a menos de la mitad de la dosis diaria clínica más alta recomendada de 40 mg ( basado en el área de superficie corporal, mg/m²). La administración oral de alendronato a ratas durante la organogénesis resultó en una reducción de la osificación fetal a partir de dosis 3 veces superiores a la dosis clínica diaria de 40 mg. No se observaron efectos fetales similares en conejas preñadas que recibieron dosis orales durante la organogénesis en dosis equivalentes a aproximadamente 10 veces la dosis clínica diaria de 40 mg.
Se produjeron partos tardíos o fallidos, parto prolongado y muertes maternas y fetales al final del embarazo debido a hipocalcemia materna en ratas con dosis orales tan bajas como una décima parte de la dosis clínica diaria de 40 mg (ver Datos ).
Los bisfosfonatos se incorporan a la matriz ósea, de la que se liberan gradualmente durante un período de años. La cantidad de bisfosfonato incorporada en el hueso adulto y disponible para su liberación en la circulación sistémica está directamente relacionada con la dosis y la duración del uso de bisfosfonato. En consecuencia, según el mecanismo de acción de los bisfosfonatos, existe un riesgo potencial de daño fetal, predominantemente esquelético, si una mujer queda embarazada después de completar un ciclo de terapia con bisfosfonatos. No se ha estudiado el impacto de variables como el tiempo entre el cese de la terapia con bisfosfonatos y la concepción, el bisfosfonato particular utilizado y la vía de administración (intravenosa versus oral) sobre el riesgo.
Se desconoce el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo para la(s) población(es) indicada(s). Todos los embarazos tienen un riesgo de fondo de defectos congénitos, pérdidas u otros resultados adversos. En la población general de los EE. UU., los riesgos de fondo estimados de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos son del 2 al 4 % y del 15 al 20 %, respectivamente.
Datos
Datos de animales
Los estudios de reproducción en ratas que recibieron dosis por vía oral desde antes del apareamiento hasta el final de la gestación o la lactancia mostraron una disminución de la supervivencia posterior a la implantación a partir de 2 mg/kg/día y una disminución del aumento de peso corporal a partir de 1 mg/kg/día, dosis equivalentes a menos de la mitad de las 40 mg de dosis clínica diaria basada en el área de superficie corporal, mg/m². La incidencia de osificación fetal incompleta en los huesos vertebrales, del cráneo y del esternón aumentó en ratas que recibieron dosis orales durante la organogénesis a partir de 10 mg/kg/día (aproximadamente 3 veces la dosis clínica diaria de 40 mg). No se observaron efectos fetales similares en conejas preñadas que recibieron dosis orales durante la organogénesis de hasta 35 mg/kg/día (equivalente a aproximadamente 10 veces la dosis clínica diaria de 40 mg).
Tanto el calcio total como el ionizado disminuyeron en ratas preñadas que recibieron dosis orales de 15 mg/kg/día de alendronato (aproximadamente 4 veces la dosis clínica diaria de 40 mg), lo que provocó retrasos y fallas en el parto. Se observó parto prolongado debido a la hipocalcemia materna cuando las ratas fueron tratadas desde antes del apareamiento hasta la gestación a partir de 0,5 mg/kg/día (aproximadamente una décima parte de la dosis clínica diaria de 40 mg). También se produjo maternotoxicidad (muertes al final del embarazo) en ratas hembra tratadas por vía oral con 15 mg/kg/día (aproximadamente 4 veces la dosis clínica diaria de 40 mg) durante diferentes períodos de gestación. Estas muertes maternas se redujeron pero no se eliminaron con la suspensión del tratamiento. La administración de suplementos de calcio en el agua de bebida o mediante minibomba subcutánea a ratas que recibieron una dosis oral de 15 mg/kg/día de alendronato no pudo mejorar la hipocalcemia ni prevenir las muertes maternas y neonatales relacionadas con la distocia. Sin embargo, la administración de suplementos de calcio por vía intravenosa previno las muertes maternas, pero no las neonatales.
Lactancia
Resumen de riesgos
No se sabe si el alendronato está presente en la leche materna humana, si afecta la producción de leche humana o si tiene efectos sobre el lactante. Los beneficios para el desarrollo y la salud de la lactancia materna se deben considerar junto con la necesidad clínica de la madre de FOSAMAX 70 mg y cualquier posible efecto adverso en el niño amamantado debido a FOSAMAX o a la afección materna subyacente.
Uso pediátrico
FOSAMAX 70mg no está indicado para uso en pacientes pediátricos.
La seguridad y eficacia de FOSAMAX se examinaron en un estudio aleatorizado, doble ciego, controlado con placebo de dos años de duración de 139 pacientes pediátricos, de 4 a 18 años de edad, con osteogénesis imperfecta (OI) severa. Ciento nueve pacientes fueron asignados al azar a 5 mg de FOSAMAX 35 mg diarios (peso inferior a 40 kg) o 10 mg de FOSAMAX 70 mg diarios (peso mayor o igual a 40 kg) y 30 pacientes a placebo. La puntuación Z media inicial de la DMO de la columna lumbar de los pacientes fue de -4,5. El cambio medio en la puntuación Z de la DMO de la columna lumbar desde el inicio hasta el mes 24 fue de 1,3 en los pacientes tratados con 35 mg de FOSAMAX y de 0,1 en los pacientes tratados con placebo. El tratamiento con FOSAMAX 35mg no redujo el riesgo de fractura. El 16 % de los pacientes con FOSAMAX que sufrieron una fractura confirmada radiológicamente en el Mes 12 del estudio presentaron un retraso en la cicatrización de la fractura (remodelación del callo) o falta de consolidación de la fractura cuando se evaluaron radiográficamente en el Mes 24, en comparación con el 9 % de los pacientes tratados con placebo. En los pacientes tratados con FOSAMAX, los datos de histomorfometría ósea obtenidos en el Mes 24 demostraron una disminución del recambio óseo y un retraso en el tiempo de mineralización; sin embargo, no hubo defectos de mineralización. No hubo diferencias estadísticamente significativas entre los grupos de FOSAMAX 35 mg y placebo en la reducción del dolor óseo. La biodisponibilidad oral en niños fue similar a la observada en adultos.
El perfil de seguridad general de FOSAMAX en pacientes con osteogénesis imperfecta tratados hasta por 24 meses fue generalmente similar al de los adultos con osteoporosis tratados con FOSAMAX. Sin embargo, hubo una mayor incidencia de vómitos en pacientes con osteogénesis imperfecta tratados con FOSAMAX en comparación con el placebo. Durante el período de tratamiento de 24 meses, se observaron vómitos en 32 de 109 (29,4 %) pacientes tratados con FOSAMAX 70 mg y 3 de 30 (10 %) pacientes tratados con placebo.
En un estudio farmacocinético, 6 de 24 pacientes pediátricos con osteogénesis imperfecta que recibieron una dosis oral única de FOSAMAX 35 o 70 mg desarrollaron fiebre, síntomas similares a los de la gripe y/o linfocitopenia leve dentro de las 24 a 48 horas posteriores a la administración. Estos eventos, que no duran más de 2 a 3 días y responden al paracetamol, son consistentes con una respuesta de fase aguda que se ha informado en pacientes que reciben bisfosfonatos, incluido FOSAMAX. [Ver REACCIONES ADVERSAS ]
Uso geriátrico
De los pacientes que recibieron FOSAMAX en el Fracture Intervention Trial (FIT), el 71 % (n=2302) tenía 65 años o más y el 17 % (n=550) tenía 75 años o más. De los pacientes que recibieron FOSAMAX 70 mg en los estudios de tratamiento de osteoporosis en mujeres de los Estados Unidos y multinacionales, estudios de osteoporosis en hombres, estudios de osteoporosis inducida por glucocorticoides y estudios de enfermedad de Paget [ver Estudios clínicos ], 45%, 54%, 37% y 70%, respectivamente, tenían 65 años o más. No se observaron diferencias generales en la eficacia o seguridad entre estos pacientes y los pacientes más jóvenes, pero no se puede descartar una mayor sensibilidad de algunos individuos mayores.
Insuficiencia renal
FOSAMAX 70 mg no se recomienda para pacientes con depuración de creatinina inferior a 35 ml/min. No es necesario ajustar la dosis en pacientes con valores de aclaramiento de creatinina entre 35 y 60 ml/min [ver FARMACOLOGÍA CLÍNICA ].
Deterioro hepático
Dado que existe evidencia de que el alendronato no se metaboliza ni se excreta en la bilis, no se realizaron estudios en pacientes con insuficiencia hepática. No es necesario ajustar la dosis [ver FARMACOLOGÍA CLÍNICA ].
SOBREDOSIS
Se observó una letalidad significativa después de dosis orales únicas en ratas y ratones hembra a 552 mg/kg (3256 mg/m²) y 966 mg/kg (2898 mg/m²), respectivamente. En los machos, estos valores fueron ligeramente superiores, 626 y 1280 mg/kg, respectivamente. No hubo letalidad en perros con dosis orales de hasta 200 mg/kg (4000 mg/m²).
No se dispone de información específica sobre el tratamiento de la sobredosificación con FOSAMAX. La sobredosis oral puede causar hipocalcemia, hipofosfatemia y eventos adversos gastrointestinales superiores, como malestar estomacal, acidez estomacal, esofagitis, gastritis o úlcera. Se debe administrar leche o antiácidos para unir alendronato. Debido al riesgo de irritación esofágica, no se debe inducir el vómito y el paciente debe permanecer completamente erguido.
La diálisis no sería beneficiosa.
CONTRAINDICACIONES
FOSAMAX 35mg está contraindicado en pacientes con las siguientes condiciones:
- Anomalías del esófago que retrasan el vaciamiento esofágico, como estenosis o acalasia [ver ADVERTENCIAS Y PRECAUCIONES ]
- Incapacidad para pararse o sentarse erguido durante al menos 30 minutos [ver DOSIFICACIÓN Y ADMINISTRACIÓN ; ADVERTENCIAS Y PRECAUCIONES ]
- No administre FOSAMAX 35 mg solución oral a pacientes con mayor riesgo de aspiración.
- Hipocalcemia [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hipersensibilidad a cualquier componente de este producto. Se han informado reacciones de hipersensibilidad que incluyen urticaria y angioedema [ver REACCIONES ADVERSAS ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
Los estudios en animales han indicado el siguiente modo de acción. A nivel celular, el alendronato muestra una localización preferencial en sitios de reabsorción ósea, específicamente debajo de los osteoclastos. Los osteoclastos se adhieren normalmente a la superficie del hueso pero carecen del borde ondulado que es indicativo de resorción activa. El alendronato no interfiere con el reclutamiento o la unión de los osteoclastos, pero inhibe la actividad de los osteoclastos. Los estudios en ratones sobre la localización de alendronato [3H] radiactivo en el hueso mostraron una captación aproximadamente 10 veces mayor en las superficies de los osteoclastos que en las superficies de los osteoblastos. Los huesos examinados 6 y 49 días después de la administración de [3H]alendronato en ratas y ratones, respectivamente, mostraron que se formó hueso normal encima del alendronato, que se incorporó dentro de la matriz. Mientras está incorporado en la matriz ósea, el alendronato no es farmacológicamente activo. Por lo tanto, el alendronato debe administrarse continuamente para suprimir los osteoclastos en las superficies de reabsorción recién formadas. La histomorfometría en babuinos y ratas mostró que el tratamiento con alendronato reduce el recambio óseo (es decir, el número de sitios en los que se remodela el hueso). Además, la formación ósea supera la reabsorción ósea en estos sitios de remodelación, lo que conduce a ganancias progresivas de masa ósea.

Farmacodinámica
El alendronato es un bisfosfonato que se une a la hidroxiapatita ósea e inhibe específicamente la actividad de los osteoclastos, las células de reabsorción ósea. El alendronato reduce la resorción ósea sin efecto directo sobre la formación ósea, aunque este último proceso finalmente se reduce porque la resorción y la formación óseas están acopladas durante el recambio óseo.
Osteoporosis en mujeres posmenopáusicas
La osteoporosis se caracteriza por una masa ósea baja que conduce a un mayor riesgo de fractura. El diagnóstico puede confirmarse por el hallazgo de masa ósea baja, evidencia de fractura en la radiografía, antecedentes de fractura osteoporótica o pérdida de altura o cifosis, indicativa de fractura vertebral (espinal). La osteoporosis ocurre tanto en hombres como en mujeres, pero es más común entre las mujeres después de la menopausia, cuando aumenta el recambio óseo y la tasa de reabsorción ósea supera la de formación ósea. Estos cambios dan como resultado una pérdida ósea progresiva y conducen a la osteoporosis en una proporción significativa de mujeres mayores de 50 años. Las fracturas, generalmente de la columna vertebral, la cadera y la muñeca, son las consecuencias comunes. Entre los 50 y los 90 años, el riesgo de fractura de cadera en mujeres blancas aumenta 50 veces y el riesgo de fractura vertebral entre 15 y 30 veces. Se estima que aproximadamente el 40% de las mujeres de 50 años sufrirán una o más fracturas de columna, cadera o muñeca relacionadas con la osteoporosis durante el resto de sus vidas. Las fracturas de cadera, en particular, se asocian con una morbilidad, discapacidad y mortalidad sustanciales.
Las dosis orales diarias de alendronato (5, 20 y 40 mg durante seis semanas) en mujeres posmenopáusicas produjeron cambios bioquímicos indicativos de una inhibición de la resorción ósea dependiente de la dosis, incluidas disminuciones en el calcio urinario y marcadores urinarios de la degradación del colágeno óseo (como la desoxipiridinolina y la N-telopéptidos unidos de colágeno tipo I). Estos cambios bioquímicos tendieron a volver a los valores iniciales tan pronto como 3 semanas después de la interrupción de la terapia con alendronato y no difirieron del placebo después de 7 meses.
El tratamiento a largo plazo de la osteoporosis con FOSAMAX 10 mg/día (hasta cinco años) redujo la excreción urinaria de marcadores de resorción ósea, desoxipiridinolina y N-telopéptidos reticulados de colágeno tipo l, en aproximadamente un 50 % y un 70 %, respectivamente , para alcanzar niveles similares a los observados en mujeres premenopáusicas sanas. Se observaron disminuciones similares en pacientes en estudios de prevención de osteoporosis que recibieron FOSAMAX 5 mg/día. La disminución en la tasa de reabsorción ósea indicada por estos marcadores fue evidente ya al mes y entre los tres y los seis meses alcanzó una meseta que se mantuvo durante todo el tratamiento con FOSAMAX. En estudios de tratamiento de la osteoporosis, FOSAMAX 10 mg/día disminuyó los marcadores de formación ósea, la osteocalcina y la fosfatasa alcalina específica del hueso en aproximadamente un 50 %, y la fosfatasa alcalina sérica total en aproximadamente un 25 a 30 % para alcanzar una meseta después de 6 a 12 meses. En estudios de prevención de la osteoporosis, FOSAMAX 5 mg/día disminuyó la osteocalcina y la fosfatasa alcalina sérica total en aproximadamente un 40 % y un 15 %, respectivamente. Se observaron reducciones similares en la tasa de recambio óseo en mujeres posmenopáusicas durante estudios de un año con FOSAMAX 70 mg una vez a la semana para el tratamiento de la osteoporosis y FOSAMAX 35 mg una vez a la semana para la prevención de la osteoporosis. Estos datos indican que la tasa de recambio óseo alcanzó un nuevo estado estacionario, a pesar del aumento progresivo de la cantidad total de alendronato depositado en el hueso.
Como resultado de la inhibición de la resorción ósea, también se observaron reducciones asintomáticas en las concentraciones séricas de calcio y fosfato después del tratamiento con FOSAMAX. En los estudios a largo plazo, las reducciones desde el inicio en el calcio sérico (aproximadamente 2 %) y el fosfato (aproximadamente 4 a 6 %) fueron evidentes el primer mes después del inicio de FOSAMAX 10 mg. No se observaron más disminuciones en el calcio sérico durante los cinco años de duración del tratamiento; sin embargo, el fosfato sérico volvió a los niveles previos al estudio durante los años tres a cinco. Se observaron reducciones similares con FOSAMAX 5 mg/día. En estudios de un año con FOSAMAX 35 y 70 mg una vez a la semana, se observaron reducciones similares a los 6 y 12 meses. La reducción del fosfato sérico puede reflejar no solo el balance mineral óseo positivo debido a FOSAMAX 70 mg, sino también una disminución en la reabsorción renal de fosfato.
Osteoporosis en hombres
El tratamiento de hombres con osteoporosis con FOSAMAX 10 mg/día durante dos años redujo la excreción urinaria de N-telopéptidos reticulados de colágeno tipo I en aproximadamente un 60 % y la fosfatasa alcalina específica del hueso en aproximadamente un 40 %. Se observaron reducciones similares en un estudio de un año en hombres con osteoporosis que recibieron FOSAMAX 70 mg una vez a la semana.
Osteoporosis inducida por glucocorticoides
El uso sostenido de glucocorticoides se asocia comúnmente con el desarrollo de osteoporosis y las fracturas resultantes (especialmente vertebrales, de cadera y de costillas). Ocurre tanto en hombres como en mujeres de todas las edades. La osteoporosis se produce como resultado de la inhibición de la formación ósea y el aumento de la reabsorción ósea, lo que da como resultado una pérdida ósea neta. El alendronato disminuye la resorción ósea sin inhibir directamente la formación ósea.
En estudios clínicos de hasta dos años' duración, FOSAMAX 5 y 10 mg/día redujeron los N-telopéptidos reticulados del colágeno tipo I (un marcador de la resorción ósea) en aproximadamente un 60 % y redujeron la fosfatasa alcalina específica del hueso y la fosfatasa alcalina sérica total (marcadores de la formación ósea) en un 60 %. aproximadamente del 15 al 30% y del 8 al 18%, respectivamente. Como resultado de la inhibición de la resorción ósea, FOSAMAX 5 y 10 mg/día indujeron disminuciones asintomáticas del calcio sérico (aproximadamente 1 a 2 %) y del fosfato sérico (aproximadamente 1 a 8 %).
Enfermedad ósea de Paget
La enfermedad ósea de Paget es un trastorno esquelético focal crónico caracterizado por un remodelado óseo muy aumentado y desordenado. La reabsorción ósea osteoclástica excesiva es seguida por la formación de hueso nuevo osteoblástico, lo que conduce al reemplazo de la arquitectura ósea normal por una estructura ósea desorganizada, agrandada y debilitada.
Las manifestaciones clínicas de la enfermedad de Paget varían desde ausencia de síntomas hasta morbilidad grave debido a dolor óseo, deformidad ósea, fracturas patológicas y complicaciones neurológicas y de otro tipo. La fosfatasa alcalina sérica, el índice bioquímico de actividad de la enfermedad más utilizado, proporciona una medida objetiva de la gravedad de la enfermedad y la respuesta al tratamiento.
FOSAMAX 70mg disminuye la tasa de reabsorción ósea directamente, lo que lleva a una disminución indirecta en la formación ósea. En ensayos clínicos, FOSAMAX 40 mg una vez al día durante seis meses produjo disminuciones significativas en la fosfatasa alcalina sérica, así como en los marcadores urinarios de degradación del colágeno óseo. Como resultado de la inhibición de la resorción ósea, FOSAMAX indujo disminuciones generalmente leves, transitorias y asintomáticas en el calcio y el fosfato séricos.
Farmacocinética
Absorción
En relación con una dosis intravenosa de referencia, la biodisponibilidad oral media de alendronato en mujeres fue del 0,64 % para dosis que oscilaron entre 5 y 70 mg cuando se administraron después de un ayuno nocturno y dos horas antes de un desayuno estándar. La biodisponibilidad oral del comprimido de 10 mg en hombres (0,59 %) fue similar a la de las mujeres cuando se administró después de un ayuno nocturno y 2 horas antes del desayuno.
FOSAMAX 70 mg solución oral y FOSAMAX 70 mg tableta son igualmente biodisponibles.
Se realizó un estudio que examinó el efecto del horario de una comida sobre la biodisponibilidad de alendronato en 49 mujeres posmenopáusicas. La biodisponibilidad disminuyó (en aproximadamente un 40 %) cuando se administraron 10 mg de alendronato 0,5 o 1 hora antes de un desayuno estándar, en comparación con la dosificación 2 horas antes de comer. En estudios de tratamiento y prevención de la osteoporosis, el alendronato fue eficaz cuando se administró al menos 30 minutos antes del desayuno.
La biodisponibilidad fue insignificante si el alendronato se administró con o hasta dos horas después de un desayuno estándar. La administración concomitante de alendronato con café o jugo de naranja redujo la biodisponibilidad en aproximadamente un 60%.
Distribución
Los estudios preclínicos (en ratas macho) muestran que el alendronato se distribuye transitoriamente a los tejidos blandos después de la administración intravenosa de 1 mg/kg, pero luego se redistribuye rápidamente a los huesos o se excreta en la orina. El volumen medio de distribución en estado estacionario, sin incluir el hueso, es de al menos 28 L en humanos. Las concentraciones de fármaco en plasma después de dosis orales terapéuticas son demasiado bajas (menos de 5 ng/mL) para la detección analítica. La unión a proteínas en el plasma humano es de aproximadamente el 78%.
Metabolismo
No hay evidencia de que el alendronato sea metabolizado en animales o humanos.
Excreción
Después de una dosis intravenosa única de alendronato [14C], aproximadamente el 50 % de la radiactividad se excretó en la orina dentro de las 72 horas y se recuperó poca o ninguna radiactividad en las heces. Después de una dosis intravenosa única de 10 mg, el aclaramiento renal de alendronato fue de 71 ml/min (64, 78; intervalo de confianza [IC] del 90 %) y el aclaramiento sistémico no superó los 200 ml/min. Las concentraciones plasmáticas se redujeron en más del 95% dentro de las 6 horas posteriores a la administración intravenosa. Se estima que la vida media terminal en humanos supera los 10 años, lo que probablemente refleja la liberación de alendronato del esqueleto. Con base en lo anterior, se estima que luego de 10 años de tratamiento oral con FOSAMAX (10 mg diarios) la cantidad de alendronato liberada diariamente por el esqueleto es aproximadamente el 25% de la absorbida por el tracto gastrointestinal.
Poblaciones Específicas
Género
La biodisponibilidad y la fracción de una dosis intravenosa excretada en la orina fueron similares en hombres y mujeres.
geriátrico
La biodisponibilidad y disposición (excreción urinaria) fueron similares en pacientes ancianos y jóvenes. No es necesario ajustar la dosis en pacientes de edad avanzada.
La raza
No se han estudiado las diferencias farmacocinéticas debidas a la raza.
Insuficiencia renal
Los estudios preclínicos muestran que, en ratas con insuficiencia renal, hay cantidades crecientes de fármaco presentes en el plasma, los riñones, el bazo y la tibia. En controles sanos, el fármaco que no se deposita en el hueso se excreta rápidamente en la orina. No se encontró evidencia de saturación de absorción ósea después de 3 semanas de administración de dosis intravenosas acumuladas de 35 mg/kg en ratas macho jóvenes. Aunque no se ha realizado ningún estudio farmacocinético formal de insuficiencia renal en pacientes, es probable que, al igual que en los animales, la eliminación de alendronato a través del riñón se reduzca en pacientes con insuficiencia renal. Por lo tanto, podría esperarse una acumulación algo mayor de alendronato en el hueso en pacientes con insuficiencia renal.
No es necesario ajustar la dosis para pacientes con depuración de creatinina de 35 a 60 ml/min. FOSAMAX 35 mg no se recomienda para pacientes con aclaramiento de creatinina inferior a 35 ml/min debido a la falta de experiencia con alendronato en insuficiencia renal.
Deterioro hepático
Dado que existe evidencia de que el alendronato no se metaboliza ni se excreta en la bilis, no se realizaron estudios en pacientes con insuficiencia hepática. No es necesario ajustar la dosis.
Interacciones con la drogas
Se demostró que la ranitidina intravenosa duplica la biodisponibilidad del alendronato oral. Se desconoce la importancia clínica de este aumento de la biodisponibilidad y si se producirán aumentos similares en pacientes que reciben antagonistas H2 orales.
En sujetos sanos, la prednisona oral (20 mg tres veces al día durante cinco días) no produjo un cambio clínicamente significativo en la biodisponibilidad oral de alendronato (un aumento medio que va del 20 al 44%).
Es probable que los productos que contienen calcio y otros cationes multivalentes interfieran con la absorción de alendronato.
Toxicología Animal Y/o Farmacología
Las actividades inhibitorias relativas sobre la resorción ósea y la mineralización de alendronato y etidronato se compararon en el ensayo de Schenk, que se basa en el examen histológico de las epífisis de ratas en crecimiento. En este ensayo, la dosis más baja de alendronato que interfirió con la mineralización ósea (lo que provocó osteomalacia) fue 6000 veces mayor que la dosis antirresortiva. La proporción correspondiente para el etidronato fue de uno a uno. Estos datos sugieren que es muy poco probable que el alendronato administrado en dosis terapéuticas induzca osteomalacia.
Estudios clínicos
Tratamiento de la osteoporosis en mujeres posmenopáusicas
Dosificación diaria
La eficacia de FOSAMAX 10 mg diarios se evaluó en cuatro ensayos clínicos. El estudio 1, un estudio clínico estadounidense de tres años, multicéntrico, doble ciego, controlado con placebo, inscribió a 478 pacientes con una puntuación T de DMO igual o inferior a menos 2,5 con o sin una fractura vertebral previa; El estudio 2, un estudio clínico multinacional, multicéntrico, doble ciego, controlado con placebo, de tres años de duración, inscribió a 516 pacientes con una puntuación T de DMO igual o inferior a menos 2,5 con o sin una fractura vertebral previa; Estudio 3, el Estudio de tres años del Fracture Intervention Trial (FIT), un estudio que inscribió a 2027 pacientes posmenopáusicas con al menos una fractura vertebral inicial; y el Estudio 4, el Estudio de cuatro años de FIT: un estudio que inscribió a 4432 pacientes posmenopáusicas con baja masa ósea pero sin una fractura vertebral inicial.
Efecto sobre la incidencia de fracturas
Para evaluar los efectos de FOSAMAX en la incidencia de fracturas vertebrales (detectadas por radiografía digitalizada; aproximadamente un tercio de estas fueron clínicamente sintomáticas), los estudios estadounidenses y multinacionales se combinaron en un análisis que comparó el placebo con los grupos de dosis combinadas de FOSAMAX (5 o 10 mg durante tres años o 20 mg durante dos años seguidos de 5 mg durante un año). Hubo una reducción estadísticamente significativa en la proporción de pacientes tratados con FOSAMAX 70 mg que experimentaron una o más fracturas vertebrales nuevas en relación con los tratados con placebo (3,2 % frente a 6,2 %; una reducción del riesgo relativo del 48 %). También se observó una reducción en el número total de nuevas fracturas vertebrales (4,2 frente a 11,3 por 100 pacientes). En el análisis combinado, los pacientes que recibieron FOSAMAX tuvieron una pérdida de estatura que fue estadísticamente significativamente menor que la observada en los que recibieron placebo (-3,0 mm frente a -4,6 mm).
El Fracture Intervention Trial (FIT) constaba de dos estudios en mujeres posmenopáusicas: el estudio de tres años de pacientes que tenían al menos una fractura vertebral radiográfica inicial y el estudio de cuatro años de pacientes con baja masa ósea pero sin una fractura vertebral inicial. En ambos estudios de FIT, el 96% de los pacientes aleatorizados completaron los estudios (es decir, tuvieron una visita de cierre al final programado del estudio); aproximadamente el 80 % de los pacientes seguían tomando la medicación del estudio al finalizar.
Ensayo de intervención de fracturas: estudio de tres años (pacientes con al menos una fractura vertebral radiográfica inicial)
Este estudio aleatorizado, doble ciego, controlado con placebo, de 2027 pacientes (FOSAMAX 70 mg, n=1022; placebo, n=1005) demostró que el tratamiento con FOSAMAX produjo reducciones estadísticamente significativas en la incidencia de fracturas a los tres años, como se muestra en la Tabla 6 .
Además, en esta población de pacientes con fractura vertebral basal, el tratamiento con FOSAMAX redujo significativamente la incidencia de hospitalizaciones (25,0% vs. 30,7%).
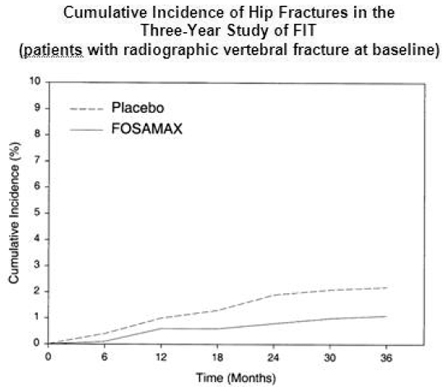
En el estudio de tres años de FIT, se produjeron fracturas de cadera en 22 (2,2 %) de 1005 pacientes con placebo y 11 (1,1 %) de 1022 pacientes con FOSAMAX, p=0,047. La Figura 1 muestra la incidencia acumulada de fracturas de cadera en este estudio.
Figura 1: Incidencia acumulada de fracturas de cadera en el estudio de tres años de FIT (pacientes con fractura vertebral radiográfica al inicio)
Ensayo de intervención de fracturas: estudio de cuatro años (pacientes con masa ósea baja pero sin una fractura vertebral radiográfica inicial)
Este estudio aleatorizado, doble ciego, controlado con placebo, de 4432 pacientes (FOSAMAX 70 mg, n=2214; placebo, n=2218) investigó más a fondo la reducción en la incidencia de fracturas debido a FOSAMAX. La intención del estudio era reclutar mujeres con osteoporosis, definida como una DMO basal del cuello femoral de al menos dos desviaciones estándar por debajo de la media de las mujeres adultas jóvenes. Sin embargo, debido a revisiones posteriores de los valores normativos para la DMO del cuello femoral, se encontró que el 31 % de los pacientes no cumplían con este criterio de ingreso y, por lo tanto, este estudio incluyó mujeres con osteoporosis y sin osteoporosis. Los resultados se muestran en la Tabla 7 para los pacientes con osteoporosis.
Resultados de fracturas en todos los estudios
En el estudio de tres años de FIT, FOSAMAX 35 mg redujo el porcentaje de mujeres que experimentaron al menos una fractura vertebral radiográfica nueva del 15,0 % al 7,9 % (reducción del riesgo relativo del 47 %, p
FOSAMAX redujo el porcentaje de mujeres que experimentaron múltiples (dos o más) nuevas fracturas vertebrales del 4,2 % al 0,6 % (87 % de reducción del riesgo relativo, p
Por lo tanto, FOSAMAX 35 mg redujo la incidencia de fracturas vertebrales radiográficas en mujeres con osteoporosis, hayan tenido o no una fractura vertebral radiográfica previa.
Efecto sobre la densidad mineral ósea
La eficacia de la densidad mineral ósea de FOSAMAX 10 mg una vez al día en mujeres posmenopáusicas, de 44 a 84 años de edad, con osteoporosis (densidad mineral ósea [DMO] de la columna lumbar de al menos 2 desviaciones estándar por debajo de la media premenopáusica) se demostró en cuatro estudios clínicos ciegos controlados con placebo de dos o tres años' duración.
La Figura 2 muestra los aumentos medios en la DMO de la columna lumbar, el cuello femoral y el trocánter en pacientes que recibieron 10 mg/día de FOSAMAX en relación con los pacientes tratados con placebo a los tres años para cada uno de estos estudios.
Figura 2: Estudios de tratamiento de la osteoporosis en mujeres posmenopáusicas Aumento de la DMO FOSAMAX 10 mg/día a los tres años
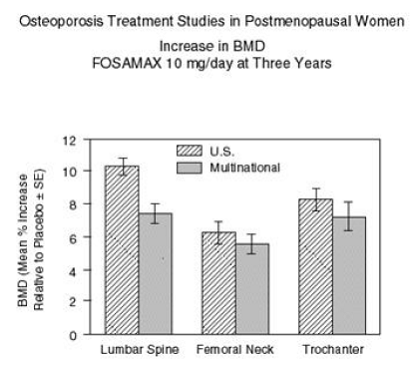
los tres años, se observaron aumentos significativos en la DMO, en relación tanto con el valor inicial como con el placebo, en cada sitio de medición en cada estudio en pacientes que recibieron FOSAMAX 10 mg/día. La DMO corporal total también aumentó significativamente en cada estudio, lo que sugiere que los aumentos en la masa ósea de la columna vertebral y la cadera no ocurrieron a expensas de otros sitios del esqueleto. Los aumentos en la DMO fueron evidentes a los tres meses y continuaron durante los tres años de tratamiento. (Consulte la Figura 3 para conocer los resultados de la columna lumbar). En la extensión de dos años de estos estudios, el tratamiento de 147 pacientes con FOSAMAX 10 mg/día dio como resultado aumentos continuos en la DMO en la columna lumbar y el trocánter (aumentos adicionales absolutos entre los años 3 y 5: columna lumbar, 0,94%; trocánter, 0,88%). Se mantuvo la DMO en cuello femoral, antebrazo y cuerpo total. FOSAMAX fue igualmente efectivo independientemente de la edad, la raza, la tasa inicial de recambio óseo y la DMO inicial en el rango estudiado (al menos 2 desviaciones estándar por debajo de la media premenopáusica).
Figura 3: Estudios de tratamiento de la osteoporosis en mujeres posmenopáusicas Curso temporal del efecto de FOSAMAX 10 mg/día versus placebo: cambio porcentual de la DMO de la columna lumbar desde el inicio
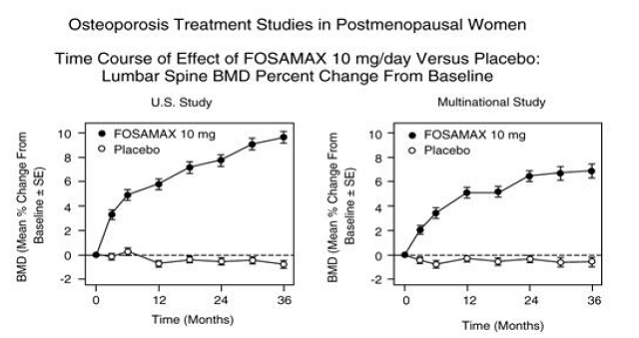
En pacientes con osteoporosis posmenopáusica tratadas con FOSAMAX 10 mg/día durante uno o dos años se evaluaron los efectos de la suspensión del tratamiento. Después de la interrupción, no hubo más aumentos en la masa ósea y las tasas de pérdida ósea fueron similares a las de los grupos de placebo.
Histología ósea
La histología ósea en 270 pacientes posmenopáusicas con osteoporosis tratadas con FOSAMAX en dosis de 1 a 20 mg/día durante uno, dos o tres años reveló una mineralización y una estructura normales, así como la disminución esperada en el recambio óseo en relación con el placebo. Estos datos, junto con la histología ósea normal y el aumento de la resistencia ósea observados en ratas y babuinos expuestos al tratamiento prolongado con alendronato, respaldan la conclusión de que el hueso formado durante el tratamiento con FOSAMAX 35 mg es de calidad normal.
Efecto sobre la altura
FOSAMAX, durante un período de tres o cuatro años, se asoció con reducciones estadísticamente significativas en la pérdida de altura frente a placebo en pacientes con y sin fracturas vertebrales radiográficas de referencia. Al final de los estudios FIT, las diferencias entre los grupos de tratamiento fueron de 3,2 mm en el estudio de tres años y de 1,3 mm en el estudio de cuatro años.
Dosificación Semanal
La equivalencia terapéutica de FOSAMAX 70 mg una vez a la semana (n=519) y FOSAMAX 10 mg al día (n=370) se demostró en un estudio multicéntrico doble ciego de un año de duración en mujeres posmenopáusicas con osteoporosis. En el análisis primario de los que completaron, los aumentos medios desde el inicio en la DMO de la columna lumbar al año fueron del 5,1 % (4,8, 5,4 %; IC del 95 %) en el grupo de 70 mg una vez a la semana (n = 440) y del 5,4 % ( 5,0, 5,8 %; IC del 95 %) en el grupo de 10 mg diarios (n=330). Los dos grupos de tratamiento también fueron similares con respecto a los aumentos de DMO en otros sitios del esqueleto. Los resultados del análisis por intención de tratar fueron consistentes con el análisis primario de los que completaron.
Uso concomitante con estrógeno/terapia de reemplazo hormonal (TRH)
Los efectos sobre la DMO del tratamiento con FOSAMAX 10 mg una vez al día y estrógenos conjugados (0,625 mg/día), ya sea solos o en combinación, se evaluaron en un estudio de dos años, doble ciego, controlado con placebo de mujeres osteoporóticas postmenopáusicas histerectomizadas (n= 425). A los dos años, los aumentos en la DMO de la columna lumbar desde el inicio fueron significativamente mayores con la combinación (8,3 %) que con estrógeno o FOSAMAX solos (ambos 6,0 %).
Los efectos sobre la DMO cuando se agregó FOSAMAX 35 mg a dosis estables (durante al menos un año) de TRH (estrógeno ± progestágeno) se evaluaron en un estudio de un año, doble ciego, controlado con placebo en mujeres postmenopáusicas con osteoporosis (n=428). La adición de FOSAMAX 10 mg una vez al día a la TRH produjo, al año, aumentos significativamente mayores en la DMO de la columna lumbar (3,7 %) frente a la TRH sola (1,1 %).
En estos estudios, se observaron aumentos significativos o tendencias favorables en la DMO para la terapia combinada en comparación con la TRH sola en la cadera total, el cuello femoral y el trocánter. No se observó ningún efecto significativo para la DMO corporal total.
Los estudios histomorfométricos de biopsias transilíacas en 92 sujetos mostraron una arquitectura ósea normal. En comparación con el placebo, hubo una supresión del recambio óseo del 98 % (según la evaluación de la superficie mineralizante) después de 18 meses de tratamiento combinado con FOSAMAX 35 mg y TRH, 94 % con FOSAMAX 35 mg solo y 78 % con TRH solo. No se han estudiado los efectos a largo plazo de la combinación de FOSAMAX 35 mg y TRH sobre la aparición de fracturas y la curación de fracturas.
Prevención de la osteoporosis en mujeres posmenopáusicas
Dosificación diaria
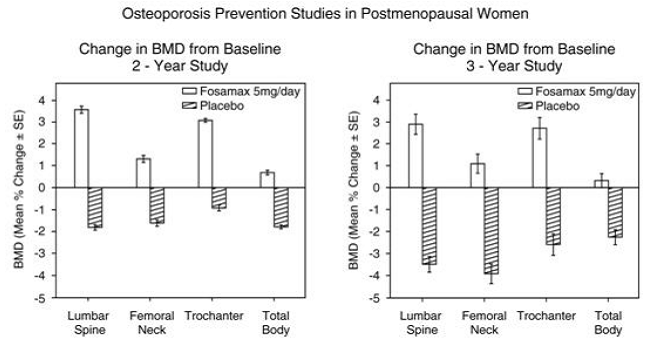
La prevención de la pérdida ósea se demostró en dos estudios doble ciego controlados con placebo de mujeres posmenopáusicas de 40 a 60 años de edad. Mil seiscientas nueve pacientes (FOSAMAX 5 mg/día; n=498) que tenían al menos seis meses de posmenopausia se ingresaron en un estudio de dos años sin tener en cuenta su DMO inicial. En el otro estudio, 447 pacientes (FOSAMAX 5 mg/día; n=88), que tenían entre seis meses y tres años de posmenopausia, fueron tratadas hasta por tres años. En los pacientes tratados con placebo, se observaron pérdidas de DMO de aproximadamente el 1 % por año en la columna vertebral, la cadera (cuello femoral y trocánter) y en todo el cuerpo. Por el contrario, FOSAMAX 5 mg/día previno la pérdida ósea en la mayoría de los pacientes e indujo aumentos significativos en la masa ósea media en cada uno de estos sitios (consulte la Figura 4). Además, FOSAMAX 5 mg/día redujo la tasa de pérdida ósea en el antebrazo aproximadamente a la mitad en comparación con el placebo. FOSAMAX 5 mg/día fue igualmente eficaz en esta población independientemente de la edad, el tiempo transcurrido desde la menopausia, la raza y la tasa de recambio óseo inicial.
Figura 4: Estudios de prevención de la osteoporosis en mujeres posmenopáusicas
Histología ósea
La histología ósea fue normal en los 28 pacientes biopsiados al final de los tres años que recibieron FOSAMAX en dosis de hasta 10 mg/día.
Dosificación Semanal
La equivalencia terapéutica de FOSAMAX 35 mg una vez a la semana (n=362) y FOSAMAX 5 mg al día (n=361) se demostró en un estudio multicéntrico doble ciego de un año de duración en mujeres posmenopáusicas sin osteoporosis. En el análisis principal de los que completaron, los aumentos medios desde el inicio en la DMO de la columna lumbar al año fueron del 2,9 % (2,6, 3,2 %; IC del 95 %) en el grupo de 35 mg una vez a la semana (n = 307) y del 3,2 % ( 2,9, 3,5 %; IC 95 %) en el grupo de 5 mg diarios (n=298). Los dos grupos de tratamiento también fueron similares con respecto a los aumentos de DMO en otros sitios del esqueleto. Los resultados del análisis por intención de tratar fueron consistentes con el análisis primario de los que completaron.
Tratamiento para aumentar la masa ósea en hombres con osteoporosis
La eficacia de FOSAMAX 35mg en hombres con osteoporosis hipogonadal o idiopática se demostró en dos estudios clínicos.
Dosificación diaria
Un estudio multicéntrico, doble ciego, controlado con placebo, de dos años de duración, de FOSAMAX 10 mg una vez al día, inscribió a un total de 241 hombres entre las edades de 31 y 87 años (promedio, 63). Todos los pacientes del ensayo tenían una puntuación T de DMO inferior o igual a -2 en el cuello femoral y menor o igual a -1 en la columna lumbar, o una fractura osteoporótica inicial y una puntuación T de DMO inferior o igual a -1. igual a -1 en el cuello femoral. A los dos años, los aumentos medios en relación con el placebo en la DMO en hombres que recibieron 10 mg/día de FOSAMAX fueron significativos en los siguientes sitios: columna lumbar, 5.3 %; cuello femoral, 2,6%; trocánter, 3,1%; y cuerpo total, 1,6%. El tratamiento con FOSAMAX 70 mg también redujo la pérdida de altura (FOSAMAX, -0,6 mm vs. placebo, -2,4 mm).
Dosificación Semanal
Un estudio multicéntrico, doble ciego, controlado con placebo, de un año de duración, de FOSAMAX 70 mg una vez a la semana, inscribió a un total de 167 hombres entre las edades de 38 y 91 años (promedio, 66). Los pacientes del estudio tenían una puntuación T de DMO inferior o igual a -2 en el cuello femoral y menor o igual a -1 en la columna lumbar, o una puntuación T de DMO inferior o igual a -2 en el columna lumbar y menor o igual a -1 en el cuello femoral, o una fractura osteoporótica basal y una puntuación T de DMO menor o igual a -1 en el cuello femoral. Al año, los aumentos medios en relación con el placebo en la DMO en hombres que recibieron FOSAMAX 70 mg una vez a la semana fueron significativos en los siguientes sitios: columna lumbar, 2.8 %; cuello femoral, 1,9%; trocánter, 2,0%; y cuerpo total, 1,2%. Estos aumentos en la DMO fueron similares a los observados al año en el estudio de 10 mg una vez al día.
En ambos estudios, las respuestas de la DMO fueron similares independientemente de la edad (mayor o igual a 65 años frente a menos de 65 años), la función gonadal (testosterona inicial inferior a 9 ng/dL frente a mayor o igual a 9 ng/dL) , o la DMO inicial (puntuación T del cuello femoral y la columna lumbar inferior o igual a -2,5 frente a superior a -2,5).
Tratamiento de la osteoporosis inducida por glucocorticoides
La eficacia de FOSAMAX 5 y 10 mg una vez al día en hombres y mujeres que reciben glucocorticoides (al menos 7.5 mg/día de prednisona o equivalente) se demostró en dos estudios multicéntricos, de un año, doble ciego, aleatorizados, controlados con placebo de diseño prácticamente idéntico, uno realizado en Estados Unidos y el otro en 15 países diferentes (Multinacional [que también incluía FOSAMAX 2.5 mg/día]). Estos estudios reclutaron a 232 y 328 pacientes, respectivamente, entre las edades de 17 y 83 años con una variedad de enfermedades que requieren glucocorticoides. Los pacientes recibieron suplementos de calcio y vitamina D. La Figura 5 muestra los aumentos medios en relación con el placebo en la DMO de la columna lumbar, el cuello femoral y el trocánter en pacientes que recibieron FOSAMAX 5 mg/día para cada estudio.
Figura 5: Estudios en pacientes tratados con glucocorticoides Aumento de la DMO FOSAMAX 5 mg/día al año
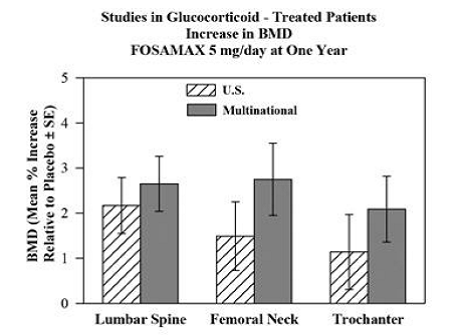
Después de un año, se observaron aumentos significativos en la DMO en relación con el placebo en los estudios combinados en cada uno de estos sitios en pacientes que recibieron FOSAMAX 5 mg/día. En los pacientes tratados con placebo, se produjo una disminución significativa de la DMO en el cuello femoral (-1,2 %) y se observaron disminuciones más pequeñas en la columna lumbar y el trocánter. La DMO corporal total se mantuvo con FOSAMAX 5 mg/día. Los aumentos en la DMO con FOSAMAX 10 mg/día fueron similares a los de FOSAMAX 5 mg/día en todos los pacientes excepto en las mujeres posmenopáusicas que no recibían terapia con estrógenos. En estas mujeres, los aumentos (en relación con el placebo) con FOSAMAX 10 mg/día fueron mayores que con FOSAMAX 5 mg/día en la columna lumbar (4,1 % frente a 1,6 %) y trocánter (2,8 % frente a 1,7 %). pero no en otros sitios. FOSAMAX 35 mg fue eficaz independientemente de la dosis o la duración del uso de glucocorticoides. Además, FOSAMAX fue igualmente eficaz independientemente de la edad (menos de 65 años versus mayor o igual a 65 años), raza (caucásico versus otras razas), género, enfermedad subyacente, DMO inicial, recambio óseo inicial y uso con un variedad de medicamentos comunes.
La histología ósea fue normal en los 49 pacientes biopsiados al cabo de un año que recibieron FOSAMAX en dosis de hasta 10 mg/día.
De los 560 pacientes originales en estos estudios, 208 pacientes que permanecieron con al menos 7,5 mg/día de prednisona o equivalente continuaron con una extensión doble ciego de un año. Después de dos años de tratamiento, la DMO de la columna aumentó un 3,7 % y un 5,0 % en relación con el placebo con FOSAMAX 5 y 10 mg/día, respectivamente. También se observaron aumentos significativos en la DMO (en relación con el placebo) en el cuello femoral, el trocánter y todo el cuerpo.
Después de un año, el 2,3 % de los pacientes tratados con FOSAMAX 5 o 10 mg/día (agrupados) frente al 3,7 % de los tratados con placebo experimentaron una nueva fractura vertebral (no significativa). Sin embargo, en la población estudiada durante dos años, el tratamiento con FOSAMAX (grupos de dosificación combinados: 5 o 10 mg durante dos años o 2,5 mg durante un año seguido de 10 mg durante un año) redujo significativamente la incidencia de pacientes con una nueva fractura vertebral (FOSAMAX 0,7% vs placebo 6,8%).
Tratamiento de la enfermedad ósea de Paget
La eficacia de FOSAMAX 40 mg una vez al día durante seis meses se demostró en dos estudios clínicos doble ciego de pacientes masculinos y femeninos con enfermedad de Paget moderada a grave (fosfatasa alcalina al menos dos veces el límite superior de lo normal): un placebo -estudio multinacional controlado y un estudio comparativo de EE. UU. con etidronato disódico 400 mg/día. La figura 6 muestra los cambios porcentuales medios desde el inicio en la fosfatasa alcalina sérica durante un máximo de seis meses de tratamiento aleatorizado.
Figura 6: Estudios en la enfermedad de Paget del efecto óseo sobre la fosfatasa alcalina sérica de FOSAMAX 40 mg/día versus placebo o etidronato 400 mg/día
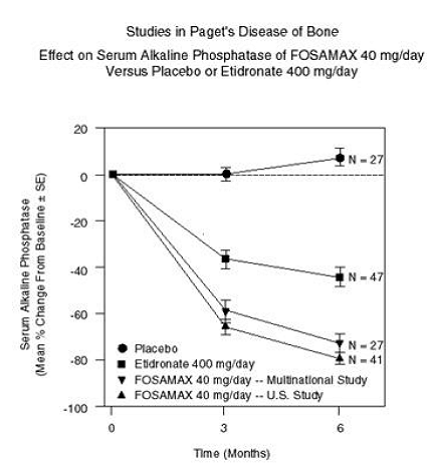
los seis meses la supresión de la fosfatasa alcalina en pacientes tratados con FOSAMAX fue significativamente mayor que la lograda con etidronato y contrastó con la falta total de respuesta en pacientes tratados con placebo. La respuesta (definida como la normalización de la fosfatasa alcalina sérica o una disminución desde el inicio mayor o igual al 60 %) ocurrió en aproximadamente el 85 % de los pacientes tratados con FOSAMAX en los estudios combinados frente al 30 % en el grupo de etidronato y el 0 % en el grupo de placebo grupo. FOSAMAX 70 mg fue igualmente eficaz independientemente de la edad, el sexo, la raza, el uso previo de otros bisfosfonatos o la fosfatasa alcalina basal dentro del rango estudiado (al menos el doble del límite superior normal).
Se evaluó la histología ósea en 33 pacientes con enfermedad de Paget tratados con FOSAMAX 40 mg/día durante 6 meses. Al igual que en los pacientes tratados por osteoporosis [ver Estudios clínicos ], FOSAMAX no perjudicó la mineralización y se observó la disminución esperada en la tasa de recambio óseo. Se produjo hueso lamelar normal durante el tratamiento con FOSAMAX, incluso cuando el hueso preexistente estaba entretejido y desorganizado. En general, los datos de histología ósea respaldan la conclusión de que el hueso formado durante el tratamiento con FOSAMAX 35 mg es de calidad normal.
INFORMACIÓN DEL PACIENTE
FOSAMAX® (FOSS-ah-max)(alendronato de sodio) Tabletas
Lea la Guía del medicamento que viene con FOSAMAX 70 mg antes de comenzar a tomarlo y cada vez que renueve su receta. Es posible que haya nueva información. Esta Guía del medicamento no reemplaza la conversación con su médico sobre su condición médica o tratamiento. Hable con su médico si tiene alguna pregunta sobre FOSAMAX.
¿Cuál es la información más importante que debo saber sobre FOSAMAX 70mg?
FOSAMAX 70 mg puede causar efectos secundarios graves que incluyen:
1. Problemas de esófago.
Algunas personas que toman FOSAMAX 35 mg pueden desarrollar problemas en el esófago (el conducto que conecta la boca y el estómago).
Estos problemas incluyen irritación, inflamación o úlceras del esófago que a veces pueden sangrar.
- Es importante que tome FOSAMAX 70 mg exactamente como se lo recetaron para ayudar a reducir la posibilidad de tener problemas de esófago. (Ver la sección “¿Cómo debo tomar FOSAMAX?”)
- Deje de tomar FOSAMAX y llame a su médico de inmediato si tiene dolor en el pecho, acidez estomacal nueva o que empeora, o si tiene problemas o dolor al tragar.
2. Niveles bajos de calcio en la sangre (hipocalcemia).
FOSAMAX puede disminuir los niveles de calcio en su sangre. Si tiene niveles bajos de calcio en la sangre antes de comenzar a tomar FOSAMAX, es posible que empeoren durante el tratamiento. Su nivel bajo de calcio en la sangre debe tratarse antes de tomar FOSAMAX. La mayoría de las personas con niveles bajos de calcio en la sangre no tienen síntomas, pero algunas personas pueden tener síntomas. Llame a su médico de inmediato si tiene síntomas de niveles bajos de calcio en la sangre, como:
- Espasmos, espasmos o calambres en los músculos
- Entumecimiento u hormigueo en los dedos de las manos y los pies o alrededor de la boca
Su médico puede recetarle calcio y vitamina D para ayudar a prevenir niveles bajos de calcio en su sangre, mientras toma FOSAMAX. Tome calcio y vitamina D como se lo indique su médico.
3. Dolor de huesos, articulaciones o músculos.
Algunas personas que toman FOSAMAX desarrollan dolor severo en los huesos, las articulaciones o los músculos.
4. Problemas graves de los huesos de la mandíbula (osteonecrosis).
Pueden ocurrir problemas severos en los huesos de la mandíbula cuando toma FOSAMAX. Su médico debe examinar su boca antes de comenzar con FOSAMAX. Es posible que su médico le indique que consulte a su dentista antes de comenzar con FOSAMAX. Es importante que practique un buen cuidado bucal durante el tratamiento con FOSAMAX.
5. Fracturas inusuales del hueso del muslo.
Algunas personas han desarrollado fracturas inusuales en el fémur. Los síntomas de una fractura pueden incluir dolor nuevo o inusual en la cadera, la ingle o el muslo.
Llame a su médico de inmediato si tiene alguno de estos efectos secundarios.
¿Qué es FOSAMAX 70mg?
- FOSAMAX 70mg es un medicamento recetado que se utiliza para:
- Tratar o prevenir la osteoporosis en mujeres después de la menopausia. Ayuda a reducir la posibilidad de tener una fractura (rotura) de cadera o de columna.
- Aumentar la masa ósea en hombres con osteoporosis.
- Tratar la osteoporosis en hombres o mujeres que toman corticosteroides.
Trate a ciertos hombres y mujeres que tienen la enfermedad ósea de Paget.
No se sabe cuánto tiempo actúa FOSAMAX 70 mg para el tratamiento y prevención de la osteoporosis. Debe consultar a su médico con regularidad para determinar si FOSAMAX 70 mg sigue siendo adecuado para usted.
FOSAMAX no es para uso en niños.
¿Quién no debe tomar FOSAMAX 70mg?
No tome FOSAMAX si usted:
- Tiene ciertos problemas con su esófago, el tubo que conecta su boca con su estómago
- No puede pararse o sentarse erguido durante al menos 30 minutos
- Tiene bajos niveles de calcio en la sangre
- Es alérgico a FOSAMAX 70mg oa alguno de sus ingredientes. La lista de ingredientes se encuentra al final de este prospecto.
¿Qué debo decirle a mi médico antes de tomar FOSAMAX 35 mg?
Antes de comenzar con FOSAMAX, asegúrese de hablar con su médico si:
- Tiene problemas para tragar
- Tiene problemas estomacales o digestivos.
- Tener bajo el calcio en la sangre
- Plan para someterse a una cirugía dental o extracción de dientes
- Tiene problemas renales
- Le han dicho que tiene problemas para absorber minerales en el estómago o los intestinos (síndrome de malabsorción)
- Está embarazada, intentando quedar embarazada o sospecha que está embarazada. Si queda embarazada mientras toma FOSAMAX, deje de tomarlo y comuníquese con su médico. No se sabe si FOSAMAX puede dañar a su bebé nonato.
- Está amamantando o planea amamantar. No se sabe si FOSAMAX pasa a la leche y puede dañar a su bebé.
Informe especialmente a su médico si toma:
- antiácidos
- aspirina
- Medicamentos antiinflamatorios no esteroideos (AINE)
Informe a su médico sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos herbales. Ciertos medicamentos pueden afectar el funcionamiento de FOSAMAX 70 mg.
Conozca los medicamentos que toma. Mantenga una lista de ellos y muéstresela a su médico y farmacéutico cada vez que obtenga un nuevo medicamento.
¿Cómo debo tomar FOSAMAX 35mg?
- Tome FOSAMAX 35mg exactamente como le indique su médico.
- FOSAMAX funciona solo si se toma con el estómago vacío.
- Tome FOSAMAX 35 mg, después de levantarse y antes de tomar su primera comida, bebida u otro medicamento.
- Tome FOSAMAX mientras está sentado o de pie.
- No mastique ni chupe una tableta de FOSAMAX.
- Trague la tableta de FOSAMAX con un vaso lleno (6-8 oz) de agua corriente únicamente.
- No haga tome FOSAMAX con agua mineral, café, té, gaseosa o jugo.
- Si toma alendronato diario:
- Tome 1 tableta de alendronato una vez al día, todos los días después de levantarse y antes de tomar su primera comida, bebida u otro medicamento.
- Si toma FOSAMAX una vez a la semana:
- Elige el día de la semana que mejor se adapte a tu horario.
- Tome 1 dosis de FOSAMAX cada semana el día que elija después de levantarse y antes de tomar su primera comida, bebida u otro medicamento.
- Si toma alendronato diario:
Después de tragar la tableta de FOSAMAX 35 mg, espere al menos 30 minutos:
- Antes de acostarte. Puede sentarse, pararse o caminar y hacer actividades normales como leer.
- Antes de tomar su primera comida o bebida, excepto agua corriente.
- Antes de tomar otros medicamentos, incluidos los antiácidos, el calcio y otros suplementos y vitaminas.
No se acueste durante al menos 30 minutos después de tomar FOSAMAX y después de comer su primera comida del día.
Si olvida una dosis de FOSAMAX 70 mg, no la tome más tarde en el día. Tome la dosis olvidada a la mañana siguiente después de que se acuerde y luego vuelva a su horario habitual. No tome 2 dosis el mismo día.
Si toma demasiado FOSAMAX 70 mg, llame a su médico. No intente vomitar. No te acuestes.
¿Cuáles son los posibles efectos secundarios de FOSAMAX 70mg?
FOSAMAX puede causar efectos secundarios graves.
- Ver “¿Cuál es la información más importante que debo saber sobre FOSAMAX?”
Los efectos secundarios más comunes de FOSAMAX 70mg son:
- Dolor en el área del estómago (abdominal)
- Acidez
- Estreñimiento
- Diarrea
- Dolor de barriga
- Dolor en sus huesos, articulaciones o músculos
- Náuseas
Puede tener reacciones alérgicas, como urticaria o hinchazón de la cara, los labios, la lengua o la garganta.
Se ha informado empeoramiento del asma.
Informe a su médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de FOSAMAX. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo conservo FOSAMAX?
- Guarde FOSAMAX 35 mg a temperatura ambiente, 59 °F a 86 °F (15 °C a 30 °C).
- Mantener FOSAMAX en un recipiente bien cerrado.
Mantenga FOSAMAX y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de FOSAMAX.
A veces, los medicamentos se recetan para fines distintos a los enumerados en la Guía del medicamento. No use FOSAMAX 35mg para una condición para la cual no fue recetado. No le dé FOSAMAX 35 mg a otras personas, incluso si tienen los mismos síntomas que usted. Puede que les haga daño.
Esta Guía del medicamento resume la información más importante sobre FOSAMAX. Si desea obtener más información, hable con su médico. Puede pedirle a su médico o farmacéutico información sobre FOSAMAX que está escrita para profesionales de la salud. Para más información, ingrese a: www.FOSAMAX.com o llame al 1-800-622-4477 (línea gratuita).
¿Cuáles son los ingredientes de FOSAMAX?
Ingrediente activo: alendronato de sodio
Ingredientes inactivos: celulosa microcristalina, lactosa anhidra, croscarmelosa sódica, estearato de magnesio.
Esta Guía del medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de EE. UU.
