Tratamiento para la Mujer: Clomid 100mg, 25mg, 50mg Clomiphene Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Clomid 50mg y cómo se usa?
Clomid 100mg es un medicamento recetado que se usa para tratar los síntomas de infertilidad en mujeres que tienen insuficiencia ovulatoria. Clomid se puede usar solo o con otros medicamentos.
Clomid pertenece a una clase de medicamentos llamados moduladores selectivos del receptor de estrógeno.
No se sabe si Clomid es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Clomid?
Clomid puede causar efectos secundarios graves que incluyen:
- dolor de estómago,
- hinchazón,
- náuseas,
- vómitos,
- Diarrea,
- rápido aumento de peso (especialmente en la cara y la sección media),
- orinar poco o nada,
- dolor al respirar,
- frecuencia cardíaca rápida, y
- dificultad para respirar
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Clomid incluyen:
- enrojecimiento (calor, enrojecimiento o sensación de hormigueo),
- náuseas,
- vómitos,
- hinchazón,
- dolor o sensibilidad en los senos,
- dolor de cabeza, y
- sangrado intermenstrual o manchado
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Clomid. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
CLOMID (tabletas de citrato de clomifeno USP) es un estimulante ovulatorio no esteroideo administrado por vía oral designado químicamente como citrato de 2-[p-(2-cloro-1,2-difenilvinil)fenoxi]trietilamina (1:1). Tiene la fórmula molecular de C26H28ClNO • C6H8O7 y un peso molecular de 598,09. Se representa estructuralmente como:
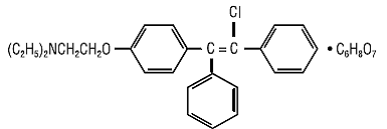
El citrato de clomifeno es un polvo cristalino de color blanco a amarillo pálido, esencialmente inodoro. Es libremente soluble en metanol; soluble en etanol; ligeramente soluble en acetona, agua y cloroformo; e insoluble en éter.
CLOMID 50 mg es una mezcla de dos isómeros geométricos [cis (zuclomifeno) y trans (enclomifeno)] que contiene entre un 30 % y un 50 % del isómero cis.
Cada tableta ranurada blanca contiene 50 mg de citrato de clomifeno USP. La tableta también contiene los siguientes ingredientes inactivos: almidón de maíz, lactosa, estearato de magnesio, almidón de maíz pregelatinizado y sacarosa.
INDICACIONES
CLOMID 100mg está indicado para el tratamiento de la disfunción ovulatoria en mujeres que desean quedarse embarazadas. Los impedimentos para lograr el embarazo deben excluirse o tratarse adecuadamente antes de comenzar la terapia con CLOMID 50 mg. Las pacientes con más probabilidades de lograr el éxito con la terapia con clomifeno incluyen pacientes con síndrome de ovario poliquístico (ver ADVERTENCIAS : Síndrome de Hiperestimulación Ovárica ), síndrome de amenorrea-galactorrea, amenorrea psicógena, amenorrea post-anticonceptivo oral y ciertos casos de amenorrea secundaria de etiología indeterminada.
El coito en el momento adecuado en relación con la ovulación es importante. Un gráfico de temperatura corporal basal u otras pruebas apropiadas pueden ayudar a la paciente y a su médico a determinar si ocurrió la ovulación. Una vez que se ha establecido la ovulación, cada curso de CLOMID 100 mg debe comenzar alrededor del quinto día del ciclo. No se recomienda la terapia cíclica a largo plazo más allá de un total de aproximadamente seis ciclos (incluidos tres ciclos ovulatorios). (Ver DOSIFICACIÓN Y ADMINISTRACIÓN y PRECAUCIONES .)
CLOMID está indicado únicamente en pacientes con disfunción ovulatoria demostrada que cumplan las condiciones descritas a continuación:
Además, los pacientes seleccionados para la terapia con CLOMID deben evaluarse con respecto a lo siguiente:
No existen estudios adecuados o bien controlados que demuestren la eficacia de CLOMID 100mg en el tratamiento de la infertilidad masculina. Además, se han informado tumores testiculares y ginecomastia en hombres que usan clomifeno. Se desconoce la relación de causa y efecto entre los informes de tumores testiculares y la administración de CLOMID 25 mg.
Aunque la literatura médica sugiere varios métodos, no existe un régimen estándar universalmente aceptado para la terapia combinada (es decir, CLOMID junto con otros fármacos inductores de la ovulación). De manera similar, no existe un régimen CLOMID estándar para la inducción de la ovulación en los programas de fertilización in vitro para producir óvulos para la fertilización y la reintroducción. Por lo tanto, CLOMID 50 mg no se recomienda para estos usos.
DOSIFICACIÓN Y ADMINISTRACIÓN
Consideraciones Generales
El estudio y el tratamiento de los candidatos para la terapia con CLOMID 100 mg deben ser supervisados por médicos con experiencia en el manejo de trastornos ginecológicos o endocrinos. Los pacientes deben elegirse para la terapia con CLOMID 50 mg solo después de una cuidadosa evaluación diagnóstica (ver INDICACIONES ). El plan de terapia debe ser esbozado de antemano. Los impedimentos para lograr el objetivo de la terapia deben excluirse o tratarse adecuadamente antes de comenzar con CLOMID. El objetivo terapéutico debe equilibrarse con los riesgos potenciales y discutirse con la paciente y otras personas involucradas en el logro de un embarazo.
La ovulación ocurre con mayor frecuencia de 5 a 10 días después de un curso de CLOMID. El coito debe programarse para que coincida con el momento esperado de la ovulación. Las pruebas apropiadas para determinar la ovulación pueden ser útiles durante este tiempo.
Dósis recomendada
El tratamiento del paciente seleccionado debe comenzar con una dosis baja, 50 mg diarios (1 comprimido) durante 5 días. La dosis debe aumentarse solo en aquellas pacientes que no ovulan en respuesta a CLOMID cíclico de 50 mg. Se recomienda especialmente una dosis baja o una duración del ciclo de tratamiento si se sospecha una sensibilidad inusual a la gonadotropina pituitaria, como en pacientes con síndrome de ovario poliquístico (ver ADVERTENCIAS ; Síndrome de Hiperestimulación Ovárica ).
La paciente debe ser evaluada cuidadosamente para descartar embarazo, agrandamiento ovárico o formación de quistes ováricos entre cada ciclo de tratamiento.
Si se planea un sangrado inducido por progestina, o si ocurre un sangrado uterino espontáneo antes de la terapia, el régimen de 50 mg diarios durante 5 días debe iniciarse alrededor del quinto día del ciclo. La terapia puede iniciarse en cualquier momento en la paciente que no haya tenido sangrado uterino reciente. Cuando se produce la ovulación con esta dosis, no hay ninguna ventaja en aumentar la dosis en ciclos posteriores de tratamiento.
Si la ovulación no parece ocurrir después del primer ciclo de terapia, se debe administrar un segundo ciclo de 100 mg diarios (dos tabletas de 50 mg administradas como dosis única diaria) durante 5 días. Este curso puede iniciarse tan pronto como 30 días después del anterior después de que se tomen precauciones para excluir la presencia de embarazo. No se recomienda aumentar la dosis o la duración del tratamiento más allá de 100 mg/día durante 5 días.
La mayoría de las pacientes que van a ovular lo harán después del primer curso de terapia. Si no ocurre la ovulación después de tres cursos de terapia, no se recomienda un tratamiento adicional con CLOMID 50 mg y se debe reevaluar a la paciente. Si ocurren tres respuestas ovulatorias, pero no se ha logrado el embarazo, no se recomienda un tratamiento adicional. Si la menstruación no ocurre después de una respuesta ovulatoria, la paciente debe ser reevaluada. La terapia cíclica a largo plazo no se recomienda más allá de un total de aproximadamente seis ciclos (ver PRECAUCIONES ).
CÓMO SUMINISTRADO
CDN 0068-0226-30: tabletas de 50 mg en cajas de 30 Las tabletas son redondas, blancas, ranuradas y grabadas con CLOMID 50. Guarde las tabletas a temperatura ambiente controlada de 59 a 86 °F (15 a 30 °C). Proteger del calor, la luz y la humedad excesiva y almacenar en recipientes cerrados.
Fabricado por: A SANOFI COMPANY, sanofi-aventis US LLC, Bridgewater, NJ 08807. Revisado: julio de 2017
EFECTOS SECUNDARIOS
Eventos adversos de ensayos clínicos.
CLOMID, en las dosis recomendadas, generalmente se tolera bien. Las reacciones adversas por lo general han sido leves y transitorias y la mayoría han desaparecido rápidamente después de suspender el tratamiento. Las experiencias adversas notificadas en pacientes tratados con citrato de clomifeno durante los estudios clínicos se muestran en la Tabla 2.
Se informaron los siguientes eventos adversos en menos del 1% de los pacientes en ensayos clínicos: Abdomen agudo, aumento del apetito, estreñimiento, dermatitis o sarpullido, depresión, diarrea, mareos, fatiga, pérdida de cabello/cabello seco, aumento de la frecuencia/volumen urinario, insomnio, mareos, tensión nerviosa, sequedad vaginal, vértigo, aumento/pérdida de peso.
Los pacientes que reciben tratamiento prolongado con CLOMID 25 mg pueden mostrar niveles séricos elevados de desmosterol. Lo más probable es que esto se deba a una interferencia directa con la síntesis de colesterol. Sin embargo, los esteroles séricos en pacientes que reciben la dosis recomendada de CLOMID 50 mg no se alteran significativamente. El cáncer de ovario se ha informado con poca frecuencia en pacientes que han recibido medicamentos para la fertilidad. La infertilidad es un factor de riesgo primario para el cáncer de ovario; sin embargo, los datos epidemiológicos sugieren que el uso prolongado de clomifeno puede aumentar el riesgo de un tumor de ovario borderline o invasivo.
Eventos adversos posteriores a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de Clomid. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Cuerpo como un todo: Fiebre, tinnitus, debilidad
Cardiovascular: Arritmia, dolor torácico, edema, hipertensión, palpitaciones, flebitis, embolia pulmonar, dificultad para respirar, taquicardia, tromboflebitis
Sistema nervioso central: Cefalea migrañosa, parestesia, convulsiones, accidente cerebrovascular, síncope
Dermatológico: Acné, reacción alérgica, eritema, eritema multiforme, eritema nudoso, hipertricosis, prurito, urticaria
Anomalías fetales/neonatales:
- Desarrollo óseo anormal: malformaciones esqueléticas del cráneo, la cara, las fosas nasales, la mandíbula, la mano, las extremidades (ectromelia, que incluye amelia, hemimelia y focomelia), el pie (pie zambo), la columna vertebral y las articulaciones
- Anomalías cardíacas: defectos del tabique cardíaco, comunicación interventricular muscular, conducto arterioso permeable, tetralogía de Fallot y coartación de la aorta
- Trastornos cromosómicos: síndrome de Down
- Anomalías del oído y sordera.
- Anormalidades del tracto gastrointestinal: labio y paladar hendido, ano imperforado, fístula traqueoesofágica, hernia diafragmática, onfalocele
- Anormalidades de los genitales: hipospadias, extrofia cloacal
- Malformaciones del tejido pulmonar
- Malformaciones del ojo y del cristalino (catarata)
- Neoplasias: tumor neuroectodérmico, tumor tiroideo, hepatoblastoma, leucemia linfocítica
- Anomalías del sistema nervioso: defectos del tubo neural (anencefalia, meningomielocele), microcefalia e hidrocefalia
- Alteraciones renales: agenesia renal y disgenesia renal
- Otros: enanismo, retraso mental
Gastrointestinal: pancreatitis
Genitourinario: Endometriosis, quiste ovárico (el agrandamiento o los quistes ováricos podrían, como tales, complicarse con la torsión de los anexos), hemorragia ovárica, embarazo tubárico, hemorragia uterina, espesor endometrial reducido
Hepático: Transaminasas elevadas, hepatitis
Trastornos del metabolismo: Hipertrigliceridemia, en algunos casos con pancreatitis
Musculoesquelético: Artralgia, dolor de espalda, mialgia
Neoplasias: Hígado (hemangiosarcoma hepático, adenoma de células hepáticas, carcinoma hepatocelular); mama (enfermedad fibroquística, carcinoma de mama); endometrio (carcinoma endometrial); sistema nervioso (astrocitoma, tumor pituitario, prolactinoma, neurofibromatosis, glioblastoma multiforme, absceso cerebral); ovario (luteoma del embarazo, quiste dermoide del ovario, carcinoma de ovario); trofoblástica (mola hidatiforme, coriocarcinoma); varios (melanoma, mieloma, quistes perianales, carcinoma de células renales, linfoma de Hodgkin, carcinoma de lengua, carcinoma de vejiga)
Psiquiátrico: Ansiedad, irritabilidad, cambios de humor, psicosis
Trastornos visuales: Acomodación anormal, catarata, dolor ocular, edema macular, neuritis óptica, fotopsia, desprendimiento de vítreo posterior, hemorragia retiniana, trombosis retiniana, espasmo vascular retiniano, pérdida temporal o prolongada de la visión, posiblemente irreversible.
Otro: Leucocitosis, trastorno de la tiroides
INTERACCIONES CON LA DROGAS
No se han documentado interacciones farmacológicas con CLOMID.
Abuso y dependencia de drogas
No se ha informado tolerancia, abuso o dependencia con CLOMID.
ADVERTENCIAS
Síntomas visuales
Se debe advertir a los pacientes que durante el tratamiento con CLOMID pueden presentarse ocasionalmente imágenes borrosas u otros síntomas visuales como manchas o destellos (escotomas centelleantes). Estos síntomas visuales aumentan en incidencia al aumentar la dosis total o la duración de la terapia. Estas alteraciones visuales suelen ser reversibles; sin embargo, se han informado casos de alteración visual prolongada y algunos ocurrieron después de la interrupción de CLOMID 50 mg. Las alteraciones visuales pueden ser irreversibles, especialmente con dosis o duración de la terapia aumentadas. Se debe advertir a los pacientes que estos síntomas visuales pueden hacer que actividades como conducir un automóvil u operar maquinaria sean más peligrosas de lo habitual, particularmente en condiciones de iluminación variable.
Estos síntomas visuales parecen deberse a la intensificación y prolongación de las imágenes secundarias. Los síntomas a menudo aparecen por primera vez o se acentúan con la exposición a un ambiente muy iluminado. Si bien la agudeza visual medida generalmente no se ha visto afectada, un paciente del estudio que tomaba 200 mg de CLOMID al día desarrolló visión borrosa en el séptimo día de tratamiento, que progresó a una disminución severa de la agudeza visual en el décimo día. No se encontró ninguna otra anomalía y la agudeza visual volvió a la normalidad al tercer día después de suspender el tratamiento.
También se han informado escotomas definibles oftalmológicamente y cambios en la función de las células de la retina (electrorretinográficas). Un paciente tratado durante los estudios clínicos desarrolló fosfenos y escotomas durante la administración prolongada de CLOMID 50 mg, que desaparecieron el día 32 después de suspender la terapia.
La vigilancia posterior a la comercialización de eventos adversos también ha revelado otros signos y síntomas visuales durante la terapia con CLOMID (ver REACCIONES ADVERSAS ).
Si bien aún no se comprende la etiología de estos síntomas visuales, los pacientes con cualquier síntoma visual deben suspender el tratamiento y someterse a una evaluación oftalmológica completa de inmediato.
Síndrome de Hiperestimulación Ovárica
Se ha informado que el síndrome de hiperestimulación ovárica (SHEO) ocurre en pacientes que reciben terapia con citrato de clomifeno para inducir la ovulación. El OHSS puede progresar rápidamente (entre 24 horas y varios días) y convertirse en un trastorno médico grave. En algunos casos, el SHO se produjo después del uso cíclico de la terapia con citrato de clomifeno o cuando se usó citrato de clomifeno en combinación con gonadotropinas. Se han informado anomalías transitorias en las pruebas de función hepática que sugieren disfunción hepática, que pueden ir acompañadas de cambios morfológicos en la biopsia hepática, en asociación con el SHO.
El OHSS es un evento médico distinto del agrandamiento ovárico sin complicaciones. Los signos clínicos de este síndrome en casos graves pueden incluir agrandamiento ovárico macroscópico, síntomas gastrointestinales, ascitis, disnea, oliguria y derrame pleural. Además, se han informado los siguientes síntomas en asociación con este síndrome: derrame pericárdico, anasarca, hidrotórax, abdomen agudo, hipotensión, insuficiencia renal, edema pulmonar, hemorragia intraperitoneal y ovárica, trombosis venosa profunda, torsión de ovario y síndrome respiratorio agudo. angustia. Los primeros signos de advertencia del OHSS son dolor y distensión abdominal, náuseas, vómitos, diarrea y aumento de peso. Pueden ocurrir niveles elevados de esteroides urinarios, diversos grados de desequilibrio electrolítico, hipovolemia, hemoconcentración e hipoproteinemia. Se ha producido la muerte por shock hipovolémico, hemoconcentración o tromboembolismo. Debido a la fragilidad de los ovarios agrandados en casos severos, el examen abdominal y pélvico debe realizarse con mucha cautela. Si se produce la concepción, puede ocurrir una progresión rápida a la forma grave del síndrome.
Para minimizar el riesgo asociado con el agrandamiento ovárico anormal ocasional asociado con la terapia con CLOMID de 100 mg, se debe usar la dosis más baja compatible con los resultados clínicos esperados. El agrandamiento máximo del ovario, ya sea fisiológico o anormal, puede no ocurrir hasta varios días después de suspender la dosis recomendada de CLOMID. Algunas pacientes con síndrome de ovario poliquístico que son inusualmente sensibles a la gonadotropina pueden tener una respuesta exagerada a las dosis habituales de CLOMID. Por lo tanto, las pacientes con síndrome de ovario poliquístico deben comenzar con la dosis más baja recomendada y la duración del tratamiento más corta para el primer curso de terapia (ver DOSIFICACIÓN Y ADMINISTRACIÓN ).
Si se produce agrandamiento del ovario, no se debe administrar tratamiento adicional con CLOMID hasta que los ovarios hayan vuelto al tamaño previo al tratamiento, y se debe reducir la dosis o la duración del siguiente ciclo. El agrandamiento de los ovarios y la formación de quistes asociados con el tratamiento con CLOMID 50 mg generalmente remiten espontáneamente en unos pocos días o semanas después de suspender el tratamiento. El beneficio potencial de la terapia posterior con CLOMID 25 mg en estos casos debe exceder el riesgo. A menos que exista una indicación quirúrgica para la laparotomía, dicho agrandamiento quístico siempre debe tratarse de forma conservadora.
No se ha determinado una relación causal entre la hiperestimulación ovárica y el cáncer de ovario. Sin embargo, debido a que se ha sugerido una correlación entre el cáncer de ovario y la nuliparidad, la infertilidad y la edad, si los quistes ováricos no remiten espontáneamente, se debe realizar una evaluación minuciosa para descartar la presencia de neoplasia ovárica.
PRECAUCIONES
General
Se debe prestar especial atención a la selección de candidatos para la terapia con CLOMID. El examen pélvico es necesario antes del tratamiento con CLOMID y antes de cada ciclo subsiguiente (ver CONTRAINDICACIONES y ADVERTENCIAS ).
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
No se han realizado estudios de toxicidad a largo plazo en animales para evaluar el potencial carcinogénico o mutagénico del citrato de clomifeno.
La administración oral de CLOMID 25 mg a ratas macho en dosis de 0,3 o 1 mg/kg/día provocó una disminución de la fertilidad, mientras que dosis más altas provocaron infertilidad temporal. Dosis orales de 0,1 mg/kg/día en ratas hembra interrumpieron temporalmente el patrón de frotis vaginal cíclico normal e impidieron la concepción. Dosis de 0,3 mg/kg/día redujeron ligeramente el número de óvulos y cuerpos lúteos ovulados, mientras que 3 mg/kg/día inhibieron la ovulación.
El embarazo
Resumen de riesgo fetal
El uso de CLOMID 100 mg en mujeres embarazadas está contraindicado, ya que el tratamiento con CLOMID 25 mg no ofrece beneficio en esta población.
Los datos humanos disponibles no sugieren un mayor riesgo de anomalías congénitas por encima del riesgo de la población de fondo. Sin embargo, los estudios de toxicología reproductiva en animales mostraron un aumento de la pérdida embriofetal y malformaciones estructurales en la descendencia. Si este medicamento se usa durante el embarazo, o si la paciente queda embarazada mientras toma este medicamento, se debe informar a la paciente sobre los riesgos potenciales para el feto.
Consideraciones clínicas
Para evitar la administración involuntaria de CLOMID 25 mg durante las primeras etapas del embarazo, se deben utilizar las pruebas adecuadas durante cada ciclo de tratamiento para determinar si se produce la ovulación y/o el embarazo. Las pacientes deben ser evaluadas cuidadosamente para excluir agrandamiento ovárico o formación de quistes ováricos entre cada ciclo de tratamiento. El próximo ciclo de tratamiento con CLOMID debe retrasarse hasta que se hayan excluido estas condiciones.
datos humanos
Los datos humanos disponibles de los estudios epidemiológicos no muestran ninguna relación aparente de causa y efecto entre la exposición periconcepcional al citrato de clomifeno y un mayor riesgo de defectos congénitos generales o cualquier anomalía específica. Sin embargo, debido al pequeño número de casos de anomalías congénitas que se produjeron en mujeres tratadas con citrato de clomifeno, estos estudios epidemiológicos solo pudieron descartar grandes diferencias en el riesgo. Los estudios no consideraron los factores asociados con la subfertilidad femenina y no pudieron ajustar otros factores de confusión importantes. Además, los datos disponibles no respaldan un aumento en la tasa de aborto espontáneo entre las mujeres subfértiles tratadas con citrato de clomifeno para la inducción de la ovulación.
Datos de animales
La administración oral de citrato de clomifeno a ratas preñadas durante la organogénesis en dosis de 1 a 2 mg/kg/día produjo hidramnion y fetos débiles y edematosos con costillas onduladas y otros cambios óseos temporales. Las dosis de 8 mg/kg/día o más también causaron un aumento de la reabsorción y fetos muertos, distocia y parto retrasado, y 40 mg/kg/día resultaron en un aumento de la mortalidad materna. Dosis únicas de 50 mg/kg causaron cataratas fetales, mientras que 200 mg/kg causaron paladar hendido. Después de la inyección de 2 mg/kg de citrato de clomifeno a ratones y ratas durante el embarazo, la descendencia mostró cambios metaplásicos en el tracto reproductivo. Los ratones y ratas recién nacidos inyectados durante los primeros días de vida también desarrollaron cambios metaplásicos en la mucosa uterina y vaginal, así como apertura vaginal prematura y ovarios anovulatorios. Estos hallazgos son similares al comportamiento reproductivo anormal y la esterilidad descritos con otros estrógenos y antiestrógenos.
En conejos, se observaron algunas alteraciones óseas temporales en fetos de madres que recibieron dosis orales de 20 o 40 mg/kg/día durante el embarazo, pero no después de 8 mg/kg/día. No se observaron malformaciones permanentes en esos estudios. Además, los monos rhesus que recibieron dosis orales de 1,5 a 4,5 mg/kg/día durante varios períodos durante el embarazo no tuvieron crías anormales.
Madres lactantes
No se sabe si CLOMID se excreta en la leche humana. Debido a que muchos medicamentos se excretan en la leche humana, se debe tener precaución si se administra CLOMID a mujeres lactantes. En algunas pacientes, CLOMID puede reducir la lactancia.
Cáncer de ovarios
El uso prolongado de tabletas de citrato de clomifeno USP puede aumentar el riesgo de un tumor de ovario borderline o invasivo (ver REACCIONES ADVERSAS ).
SOBREDOSIS
Signos y síntomas
No se han informado efectos tóxicos que acompañan a la sobredosis aguda de CLOMID 50 mg. Los signos y síntomas de sobredosis como resultado del uso de una dosis superior a la recomendada durante el tratamiento con CLOMID 100 mg incluyen náuseas, vómitos, sofocos vasomotores, visión borrosa, manchas o destellos, escotomas, agrandamiento de los ovarios con dolor pélvico o abdominal. (Ver CONTRAINDICACIONES : Quiste de ovario .)
Oral LD50
La LD50 oral aguda de CLOMID 25 mg es de 1700 mg/kg en ratones y de 5750 mg/kg en ratas. Se desconoce la dosis tóxica en humanos.
Diálisis
No se sabe si CLOMID es dializable.
Tratamiento
En caso de sobredosis, se deben emplear las medidas de apoyo adecuadas además de la descontaminación gastrointestinal.
CONTRAINDICACIONES
Hipersensibilidad
CLOMID 100mg está contraindicado en pacientes con hipersensibilidad conocida o alergia al citrato de clomifeno oa cualquiera de sus componentes.
El embarazo
El uso de CLOMID en mujeres embarazadas está contraindicado, ya que CLOMID no ofrece beneficio en esta población.
Los datos humanos disponibles no sugieren un aumento del riesgo de anomalías congénitas por encima del riesgo de la población de fondo cuando se usa según lo indicado. Sin embargo, los estudios de toxicología reproductiva en animales mostraron un aumento de la pérdida embriofetal y malformaciones estructurales en la descendencia. Si este medicamento se usa durante el embarazo, o si la paciente queda embarazada mientras toma este medicamento, se debe informar a la paciente sobre los riesgos potenciales para el feto. (Ver PRECAUCIONES : El embarazo .)
Enfermedad del higado
El tratamiento con CLOMID 25 mg está contraindicado en pacientes con enfermedad hepática o antecedentes de disfunción hepática (ver también INDICACIONES y REACCIONES ADVERSAS ).
Sangrado uterino anormal
CLOMID 25 mg está contraindicado en pacientes con sangrado uterino anormal de origen indeterminado (ver INDICACIONES ).
Quistes en los ovarios
CLOMID está contraindicado en pacientes con quistes ováricos o agrandamiento no debido al síndrome de ovario poliquístico (ver INDICACIONES y ADVERTENCIAS ).
Otro
CLOMID está contraindicado en pacientes con disfunción tiroidea o suprarrenal no controlada o en presencia de una lesión intracraneal orgánica como un tumor hipofisario (ver INDICACIONES ).
FARMACOLOGÍA CLÍNICA
Acción
CLOMID 25 mg es un fármaco de considerable potencia farmacológica. Con una selección cuidadosa y un manejo adecuado de la paciente, se ha demostrado que CLOMID 100 mg es una terapia útil para la paciente anovulatoria que desea un embarazo.
El citrato de clomifeno es capaz de interactuar con los tejidos que contienen receptores de estrógeno, incluidos el hipotálamo, la hipófisis, los ovarios, el endometrio, la vagina y el cuello uterino. Puede competir con los estrógenos por los sitios de unión a los receptores de estrógenos y puede retrasar la reposición de los receptores de estrógenos intracelulares. El citrato de clomifeno inicia una serie de eventos endocrinos que culminan en un aumento repentino de gonadotropinas preovulatorias y la ruptura folicular subsiguiente. El primer evento endocrino en respuesta a un curso de terapia con clomifeno es un aumento en la liberación de gonadotropinas hipofisarias. Esto inicia la esteroidogénesis y la foliculogénesis, lo que da como resultado el crecimiento del folículo ovárico y un aumento en el nivel circulante de estradiol. Después de la ovulación, la progesterona y el estradiol plasmáticos aumentan y disminuyen como lo harían en un ciclo ovulatorio normal.
Los datos disponibles sugieren que tanto las propiedades estrogénicas como antiestrogénicas del clomifeno pueden participar en el inicio de la ovulación. Se ha descubierto que los dos isómeros de clomifeno tienen efectos estrogénicos y antiestrogénicos mixtos, que pueden variar de una especie a otra. Algunos datos sugieren que el zuclomifeno tiene mayor actividad estrogénica que el enclomifeno.
El citrato de clomifeno no tiene efectos progestacionales, androgénicos o antiandrogénicos aparentes y no parece interferir con la función pituitaria-suprarrenal o pituitaria-tiroidea. Aunque no hay evidencia de un "efecto de arrastre" de CLOMID, se han observado menstruaciones ovulatorias espontáneas en algunas pacientes después de la terapia con CLOMID 100 mg.
Farmacocinética
Según los primeros estudios con citrato de clomifeno marcado con 14C, se demostró que el fármaco se absorbe fácilmente por vía oral en humanos y se excreta principalmente en las heces. La excreción urinaria y fecal acumulativa del 14C promedió aproximadamente el 50% de la dosis oral y el 37% de una dosis intravenosa después de 5 días. La excreción urinaria media fue de aproximadamente el 8% con una excreción fecal de alrededor del 42%.
Todavía quedaba algo de marcador 14C en las heces 6 semanas después de la administración. Estudios posteriores de dosis única en voluntarios normales demostraron que el zuclomifeno (cis) tiene una vida media más prolongada que el enclomifeno (trans). Los niveles detectables de zuclomifeno persistieron durante más de un mes en estos sujetos. Esto puede ser sugestivo de reciclaje enterohepático estéreo-específico o secuestro del zuclomifeno. Por lo tanto, es posible que algún medicamento activo pueda permanecer en el cuerpo durante el embarazo temprano en mujeres que conciben en el ciclo menstrual durante la terapia con CLOMID.
Estudios clínicos
Durante las investigaciones clínicas, 7578 pacientes recibieron CLOMID, algunas de las cuales tenían impedimentos para la ovulación además de la disfunción ovulatoria (ver INDICACIONES ). En esos ensayos clínicos, la terapia exitosa caracterizada por el embarazo ocurrió en aproximadamente el 30% de estos pacientes.
Hubo un total de 2635 embarazos informados durante el período del ensayo clínico. De esos embarazos, la información sobre el resultado solo estaba disponible para 2369 de los casos. La Tabla 1 resume el resultado de estos casos.
De los embarazos informados, la incidencia de embarazos múltiples fue del 7,98 %: 6,9 % de mellizos, 0,5 % de trillizos, 0,3 % de cuatrillizos y 0,1 % de quintillizos. De los 165 embarazos de gemelos para los que se disponía de suficiente información, la proporción de gemelos monocigóticos a dicigóticos fue de aproximadamente 1:5. La Tabla 1 informa la tasa de supervivencia de los nacimientos múltiples vivos.
Se informó el nacimiento de un sextillizo después de completar los estudios clínicos originales; ninguno de los sextillizos sobrevivió (cada uno pesaba menos de 400 g), aunque todos parecían muy normales.
La supervivencia general de los bebés de embarazos múltiples, incluidos los abortos espontáneos, los mortinatos y las muertes neonatales, es del 73 %.
Anomalías y mortalidad fetal/neonatal
Se informaron las siguientes anomalías fetales después de embarazos posteriores a la terapia de inducción de la ovulación con CLOMID durante los ensayos clínicos. Cada una de las siguientes anomalías fetales se informó a una tasa de
Además, se han recibido informes de anomalías congénitas durante la vigilancia posterior a la comercialización de CLOMID (ver REACCIONES ADVERSAS ).
INFORMACIÓN DEL PACIENTE
El propósito y los riesgos de la terapia con CLOMID deben ser presentados al paciente antes de comenzar el tratamiento. Debe enfatizarse que el objetivo de la terapia con CLOMID es la ovulación para el embarazo posterior. El médico debe aconsejar al paciente con especial atención a los siguientes riesgos potenciales:
Síntomas visuales
Advierta que ocasionalmente pueden aparecer imágenes borrosas u otros síntomas visuales durante o poco tiempo después de la terapia con CLOMID. Debe quedar claro para el paciente que, en algunos casos, los trastornos visuales pueden ser prolongados y posiblemente irreversibles, especialmente con dosis o duración de la terapia aumentadas. Advierta que los síntomas visuales pueden hacer que actividades como conducir un automóvil u operar maquinaria sean más peligrosas de lo habitual, particularmente en condiciones de iluminación variable (ver ADVERTENCIAS ).
Se debe instruir al paciente para que informe al médico cada vez que se produzcan síntomas visuales inusuales. Si el paciente tiene algún síntoma visual, se debe suspender el tratamiento y realizar una evaluación oftalmológica completa.
Dolor o distensión abdominal/pélvico
El agrandamiento de los ovarios puede ocurrir durante o poco tiempo después de la terapia con CLOMID. Para minimizar los riesgos asociados con el agrandamiento de los ovarios, se debe indicar a la paciente que informe al médico sobre cualquier dolor abdominal o pélvico, aumento de peso, malestar o distensión después de tomar CLOMID (ver ADVERTENCIAS ).
Embarazo múltiple
Informe a la paciente que existe una mayor posibilidad de embarazo múltiple, incluido el embarazo tubárico bilateral y el embarazo tubárico e intrauterino coexistentes, cuando se produce la concepción en relación con la terapia con CLOMID. Se deben explicar las posibles complicaciones y peligros del embarazo múltiple.
Aborto Espontáneo y Anomalías Congénitas
Informe a la paciente que los datos disponibles no sugieren un aumento en las tasas de aborto espontáneo (aborto espontáneo) o anomalías congénitas con el uso de CLOMID 50 mg en la madre en comparación con las tasas en la población general.
Durante la investigación clínica, la experiencia de pacientes con resultado de embarazo conocido (Tabla 1) muestra una tasa de aborto espontáneo del 20,4 % y una tasa de muerte fetal del 1,0 %. (Ver Estudios clínicos ). Entre las anomalías congénitas informadas espontáneamente como casos individuales desde la disponibilidad comercial de Clomid, la proporción de defectos del tubo neural ha sido alta entre los embarazos asociados con la ovulación inducida por Clomid, pero esto no ha sido respaldado por datos de estudios basados en la población.
