Imdur 40mg, 20mg, 30mg, 60mg Isosorbide Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Imdur 30 mg y cómo se usa?
Imdur 30 mg es un medicamento recetado que se usa para tratar los síntomas del dolor de pecho (angina de pecho). Imdur 30 mg se puede usar solo o con otros medicamentos.
Imdur 20 mg pertenece a una clase de medicamentos llamados nitratos, angina.
No se sabe si Imdur 60 mg es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Imdur?
Los efectos secundarios de Imdur incluyen:
- desmayo,
- latidos cardíacos rápidos, irregulares o fuertes,
- sarpullido,
- Comezón,
- hinchazón en la cara, lengua y garganta,
- mareos intensos y
- dificultad para respirar
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Imdur 30 mg incluyen:
- dolor de cabeza,
- mareo,
- aturdimiento, y
- náuseas
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Imdur. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
El mononitrato de isosorbida (ISMN), un nitrato orgánico y el principal metabolito biológicamente activo del dinitrato de isosorbida (ISDN), es un vasodilatador con efectos tanto en las arterias como en las venas.
Las tabletas IMDUR®, para administración oral, contienen 30 mg, 60 mg o 120 mg de mononitrato de isosorbida en una formulación de liberación prolongada. Además, cada tableta contiene los siguientes ingredientes inactivos: dióxido de silicio coloidal, aceite de ricino hidrogenado, hipromelosa, lactosa monohidrato, estearato de magnesio, celulosa microcristalina y talco.
La fórmula molecular de ISMN es C6H9NO6 y el peso molecular es 191,14. El nombre químico del ISMN es 1,4:3,6-dianhidro-,D-glucitol 5-nitrato; el compuesto tiene la siguiente fórmula estructural:
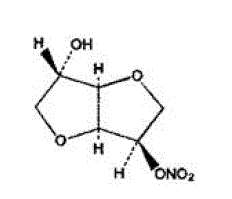
ISMN es un compuesto blanco, cristalino e inodoro que es estable en aire y en solución, tiene un punto de fusión de aproximadamente 90°C y una rotación óptica de +144° (2% en agua, 20°C).
El mononitrato de isosorbida es fácilmente soluble en agua, etanol, metanol, cloroformo, acetato de etilo y diclorometano.
INDICACIONES
IMDUR Comprimidos está indicado para la prevención de la angina de pecho debida a enfermedad de las arterias coronarias. El inicio de acción del mononitrato de isosorbida oral no es lo suficientemente rápido como para que este producto sea útil para abortar un episodio anginoso agudo.
DOSIFICACIÓN Y ADMINISTRACIÓN
La dosis inicial recomendada de tabletas IMDUR es de 30 mg (administrada como una tableta única de 30 mg o como la mitad de una tableta de 60 mg) o 60 mg (administrada como una tableta única) una vez al día. Después de varios días, la dosis puede aumentarse a 120 mg (administrada como una sola tableta de 120 mg o como dos tabletas de 60 mg) una vez al día. En raras ocasiones, se pueden requerir 240 mg. La dosis diaria de IMDUR Tabletas debe tomarse por la mañana al levantarse. Las tabletas de liberación prolongada de IMDUR no deben masticarse ni triturarse y deben tragarse junto con medio vaso de líquido. No rompa la tableta de 30 mg.
CÓMO SUMINISTRADO
IMDUR Comprimidos de Liberación Prolongada 30 mg son comprimidos blancos con forma de cápsula ranurados en una cara y grabados con "IMDUR" en la cara sin ranurar. Se suministran de la siguiente manera:
Botellas de 100 CDN 0085-1374-01
IMDUR Comprimidos de Liberación Prolongada 60 mg son comprimidos blancos con forma de cápsula ranurados en un lado con "60-60" y grabado "IMDUR" en el lado sin ranurar. Se suministran de la siguiente manera:
Botellas de 100 CDN 0085-2028-01
IMDUR 30mg Tabletas de Liberación Prolongada 120 mg son comprimidos blancos con forma de cápsula con la inscripción "IMDUR" en una cara y "120" en la otra cara. Se suministran de la siguiente manera:
Botellas de 100 CDN 0085-0091-01
Almacenar a temperatura ambiente controlada 20°-25°C (68°-77°F) [Ver USP].
Fabricado por: Kremers Urban Pharmaceuticals Inc, Seymour, IN47274, EE. UU. Revisado: diciembre de 2010
EFECTOS SECUNDARIOS
La siguiente tabla muestra las frecuencias de los eventos adversos que ocurrieron en >5 % de los sujetos en tres estudios norteamericanos controlados con placebo en los que los pacientes en el brazo de tratamiento activo recibieron 30 mg, 60 mg, 120 mg o 240 mg de isosorbida mononitrato como comprimidos de 60 mg de IMDUR una vez al día. En paréntesis, la misma tabla muestra las frecuencias con las que estos eventos adversos se asociaron con la suspensión del tratamiento. En general, el 8 % de los pacientes que recibieron 30 mg, 60 mg, 120 mg o 240 mg de mononitrato de isosorbida en los tres estudios norteamericanos controlados con placebo interrumpieron el tratamiento debido a eventos adversos. La mayoría de estos descontinuaron debido al dolor de cabeza. El mareo rara vez se asoció con el retiro de estos estudios. Dado que el dolor de cabeza parece ser un efecto adverso relacionado con la dosis y tiende a desaparecer con la continuación del tratamiento, se recomienda iniciar el tratamiento con IMDUR a dosis bajas durante varios días antes de aumentar a los niveles deseados.
FRECUENCIA Y EVENTOS ADVERSOS (DESCONTINUADO) *
Además, los tres ensayos norteamericanos se combinaron con 11 ensayos controlados realizados en Europa. Entre los 14 ensayos controlados, un total de 711 pacientes fueron asignados aleatoriamente a IMDUR Tablets. Cuando se revisaron los datos agrupados, el dolor de cabeza y los mareos fueron los únicos eventos adversos informados por >5% de los pacientes. Otros eventos adversos, cada uno informado por ≤5% de los pacientes expuestos, y en muchos casos de relación incierta con el tratamiento farmacológico, fueron:
Trastornos del sistema nervioso autónomo : Boca seca, sofocos.
cuerpo como un todo : Astenia, dolor de espalda, dolor de pecho, edema, fatiga, fiebre, síntomas gripales, malestar general, escalofríos.
Trastornos Cardiovasculares Generales : Insuficiencia cardiaca, hipertensión, hipotensión.
Trastornos del sistema nervioso central y periférico : Mareo, cefalea, hipoestesia, migraña, neuritis, paresia, parestesia, ptosis, temblor, vértigo.
Trastornos del sistema gastrointestinal Dolor abdominal, estreñimiento, diarrea, dispepsia, flatulencia, úlcera gástrica, gastritis, glositis, úlcera gástrica hemorrágica, hemorroides, heces blandas, melena, náuseas, vómitos.
Trastornos auditivos y vestibulares : Dolor de oído, tinnitus, perforación de la membrana timpánica.
Trastornos del ritmo y la frecuencia cardíaca : Arritmia, arritmia auricular, fibrilación auricular, bradicardia, bloqueo de rama, extrasístole, palpitaciones, taquicardia, taquicardia ventricular.
Trastornos del sistema hepático y biliar : aumento SGOT, aumento SGPT.
Trastornos metabólicos y nutricionales : Hiperuricemia, hipopotasemia.
Trastornos del sistema musculoesquelético : Artralgia, hombro congelado, debilidad muscular, dolor musculoesquelético, mialgia, miositis, trastorno de los tendones, tortícolis.
Trastornos mio-, endo-, pericárdicos y valvulares : Angina de pecho agravada, soplo cardíaco, ruido cardíaco anormal, infarto de miocardio, anomalía de la onda Q.
Trastornos plaquetarios, hemorrágicos y de la coagulación : Púrpura, trombocitopenia.
Desórdenes psiquiátricos Ansiedad, alteración de la concentración, confusión, disminución de la libido, depresión, impotencia, insomnio, nerviosismo, paroniria, somnolencia.
Trastorno de glóbulos rojos : anemia hipocrómica.
Trastornos Reproductivos Femeninos : Vaginitis atrófica, dolor de mamas.
Trastornos del mecanismo de resistencia : Infección bacteriana, moniliasis, infección viral.
Trastornos del sistema respiratorio : Bronquitis, broncoespasmo, tos, disnea, aumento de expectoración, congestión nasal, faringitis, neumonía, infiltración pulmonar, estertores, rinitis, sinusitis.
Trastornos de la piel y apéndices : Acné, textura anormal del cabello, aumento de la sudoración, prurito, erupción, nódulo en la piel.
Trastornos del sistema urinario : Poliuria, cálculos renales, infección del tracto urinario.
Trastornos vasculares (extracardíacos) : Enrojecimiento, claudicación intermitente, úlcera en la pierna, vena varicosa.
Trastornos de la visión : Conjuntivitis, fotofobia, visión anormal.
Además, se ha notificado el siguiente evento adverso espontáneo durante la comercialización del mononitrato de isosorbida: síncope.
INTERACCIONES CON LA DROGAS
Los efectos vasodilatadores del mononitrato de isosorbida pueden sumarse a los de otros vasodilatadores. Se ha encontrado que el alcohol, en particular, exhibe efectos aditivos de esta variedad.
Se ha informado hipotensión ortostática sintomática marcada cuando se usaron bloqueadores de los canales de calcio y nitratos orgánicos en combinación. Pueden ser necesarios ajustes de dosis de cualquiera de las clases de agentes.
Interacciones entre medicamentos y pruebas de laboratorio
Los nitratos y nitritos pueden interferir con la reacción de color de Zlatkis-Zak, provocando lecturas falsamente bajas en las determinaciones de colesterol sérico.
ADVERTENCIAS
La amplificación de los efectos vasodilatadores de IMDUR por sildenafilo puede provocar hipotensión grave. No se ha estudiado el curso temporal y la dependencia de la dosis de esta interacción. No se ha estudiado el cuidado de apoyo apropiado, pero parece razonable tratar esto como una sobredosis de nitrato, con elevación de las extremidades y con expansión del volumen central.
No se han establecido los beneficios de ISMN en pacientes con infarto agudo de miocardio o insuficiencia cardíaca congestiva; Debido a que los efectos del mononitrato de isosorbida son difíciles de eliminar rápidamente, este medicamento no se recomienda en estos entornos.
Si se usa mononitrato de isosorbida en estas condiciones, se debe usar un control clínico o hemodinámico cuidadoso para evitar los riesgos de hipotensión y taquicardia.
PRECAUCIONES
General
Puede ocurrir hipotensión severa, particularmente con la postura erguida, incluso con dosis pequeñas de mononitrato de isosorbida. Por lo tanto, este fármaco debe usarse con precaución en pacientes que pueden tener depleción de volumen o que, por cualquier motivo, ya están hipotensos. La hipotensión inducida por mononitrato de isosorbida puede ir acompañada de bradicardia paradójica y aumento de la angina de pecho.
La terapia con nitratos puede agravar la angina causada por la miocardiopatía hipertrófica.
En trabajadores industriales que han estado expuestos a largo plazo a dosis desconocidas (presuntamente altas) de nitratos orgánicos, se presenta claramente tolerancia. Dolor torácico, infarto agudo de miocardio e incluso muerte súbita se han producido durante la retirada temporal de nitratos a estos trabajadores, demostrando la existencia de una verdadera dependencia física. Se desconoce la importancia de estas observaciones para el uso clínico de rutina del mononitrato de isosorbida oral.
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
No se observó evidencia de carcinogenicidad en ratas expuestas a mononitrato de isosorbida en sus dietas a dosis de hasta 900 mg/kg/día durante los primeros 6 meses y 500 mg/kg/día durante el resto de la duración de un estudio en el que se dosificó a los machos. hasta 121 semanas y las hembras recibieron dosis hasta 137 semanas. No se observó evidencia de carcinogenicidad en ratones expuestos al mononitrato de isosorbida en sus dietas hasta por 104 semanas a dosis de hasta 900 mg/kg/día.
El mononitrato de isosorbida no produjo mutaciones genéticas (prueba de Ames, prueba de linfoma de ratón) o aberraciones cromosómicas (pruebas de linfocitos humanos y micronúcleos de ratón) en concentraciones biológicamente relevantes.
No se observaron efectos sobre la fertilidad en un estudio en el que se administraron dosis de hasta 750 mg/kg/día a ratas macho y hembra al principio, en los machos, 9 semanas antes del apareamiento, y en las hembras, 2 semanas antes del apareamiento.
El embarazo
Efectos teratogénicos
Embarazo Categoría B
En estudios diseñados para detectar los efectos del mononitrato de isosorbida en el desarrollo embriofetal, dosis de hasta 240 o 248 mg/kg/día, administradas a ratas y conejas preñadas, no se asociaron con evidencia de tales efectos. Estas dosis en animales son unas 100 veces la dosis máxima recomendada en humanos (120 mg en una mujer de 50 kg) cuando la comparación se basa en el peso corporal; cuando la comparación se basa en el área de superficie corporal, la dosis en ratas es aproximadamente 17 veces la dosis en humanos y la dosis en conejos es aproximadamente 38 veces la dosis en humanos. Sin embargo, no existen estudios adecuados y bien controlados en mujeres embarazadas. Debido a que los estudios de reproducción animal no siempre predicen la respuesta humana, las tabletas IMDUR deben usarse durante el embarazo solo si es claramente necesario.
Efectos no teratogénicos
La supervivencia y el desarrollo neonatal y la incidencia de mortinatos se vieron afectados negativamente cuando se administraron dosis orales de 750 (pero no 300) mg de mononitrato de isosorbida/kg/día a ratas preñadas durante la gestación tardía y la lactancia. Esta dosis (alrededor de 312 veces la dosis humana cuando la comparación se basa en el peso corporal y 54 veces la dosis humana cuando la comparación se basa en el área de superficie corporal) se asoció con disminuciones en el aumento de peso y la actividad motora de la madre y evidencia de lactancia deficiente.
Madres lactantes
No se sabe si este fármaco se excreta en la leche humana. Debido a que muchos fármacos se excretan en la leche humana, se debe tener precaución cuando se administra ISMN a una madre lactante.
Uso pediátrico
No se ha establecido la seguridad y eficacia de ISMN en pacientes pediátricos.
Uso geriátrico
Los estudios clínicos de las tabletas de 60 mg de IMDUR no incluyeron información suficiente sobre pacientes de 65 años o más para determinar si responden de manera diferente a los pacientes más jóvenes. Otra experiencia clínica informada para IMDUR 20 mg no ha identificado diferencias en la respuesta entre pacientes ancianos y jóvenes. La experiencia clínica para los nitratos orgánicos reportada en la literatura identificó un potencial de hipotensión severa y una mayor sensibilidad a los nitratos en los ancianos. En general, la selección de la dosis para un paciente de edad avanzada debe ser cautelosa, generalmente comenzando en el extremo inferior del rango de dosificación, lo que refleja la mayor frecuencia de disminución de la función hepática, renal o cardíaca, y de enfermedades concomitantes u otra terapia con medicamentos.
Los pacientes de edad avanzada pueden tener una función barorreceptora reducida y pueden desarrollar hipotensión ortostática severa cuando se usan vasodilatadores. Por lo tanto, IMDUR 60 mg debe usarse con precaución en pacientes de edad avanzada que pueden tener depleción de volumen, que toman múltiples medicamentos o que, por cualquier motivo, ya están hipotensos. La hipotensión inducida por mononitrato de isosorbida puede ir acompañada de bradicardia paradójica y aumento de la angina de pecho.
Los pacientes de edad avanzada pueden ser más susceptibles a la hipotensión y pueden tener un mayor riesgo de caídas con dosis terapéuticas de nitroglicerina.
La terapia con nitratos puede agravar la angina causada por la miocardiopatía hipertrófica, particularmente en los ancianos.
SOBREDOSIS
Efectos hemodinámicos
Los efectos nocivos de la sobredosis de mononitrato de isosorbida generalmente son el resultado de la capacidad del mononitrato de isosorbida para inducir vasodilatación, acumulación venosa, reducción del gasto cardíaco e hipotensión. Estos cambios hemodinámicos pueden tener múltiples manifestaciones, que incluyen aumento de la presión intracraneal, con dolor de cabeza pulsátil persistente, confusión y fiebre moderada, o todos ellos; vértigo, palpitaciones; alteraciones visuales; náuseas y vómitos (posiblemente con cólicos e incluso diarrea sanguinolenta); síncope (especialmente en la postura erguida); falta de aire y disnea, seguidas más tarde por esfuerzo ventilatorio reducido; diaforesis, con la piel enrojecida o fría y húmeda; bloqueo cardíaco y bradicardia; parálisis; coma; convulsiones y muerte.
Las determinaciones de laboratorio de los niveles séricos de mononitrato de isosorbida y sus metabolitos no están ampliamente disponibles y, en cualquier caso, dichas determinaciones no tienen un papel establecido en el tratamiento de la sobredosis de mononitrato de isosorbida.
No hay datos que sugieran qué dosis de mononitrato de isosorbida es probable que ponga en peligro la vida de los seres humanos. En ratas y ratones, existe una letalidad significativa a dosis de 2000 mg/kg y 3000 mg/kg, respectivamente.
No hay datos disponibles que sugieran maniobras fisiológicas (p. ej., maniobras para cambiar el pH de la orina) que puedan acelerar la eliminación del mononitrato de isosorbida. En particular, se sabe que la diálisis es ineficaz para eliminar el mononitrato de isosorbida del cuerpo.
No se conoce ningún antagonista específico de los efectos vasodilatadores del mononitrato de isosorbida, y no se ha realizado ninguna intervención. No se conoce ningún antagonista específico de los efectos vasodilatadores del mononitrato de isosorbida, y ninguna intervención ha sido objeto de estudios controlados como tratamiento de la sobredosis de mononitrato de isosorbida. Debido a que la hipotensión asociada con la sobredosis de mononitrato de isosorbida es el resultado de la venodilatación y la hipovolemia arterial, la terapia prudente en esta situación debe dirigirse hacia un aumento en el volumen de líquido central. La elevación pasiva de las piernas del paciente puede ser suficiente, pero también puede ser necesaria la infusión intravenosa de solución salina normal o un líquido similar.
Es probable que el uso de epinefrina u otros vasoconstrictores arteriales en este contexto cause más daño que beneficio.
En pacientes con enfermedad renal o insuficiencia cardíaca congestiva, la terapia que resulta en una expansión del volumen central no está exenta de riesgos. El tratamiento de la sobredosis de mononitrato de isosorbida en estos pacientes puede ser sutil y difícil, y puede ser necesaria una monitorización invasiva.
Metahemoglobinemia
Se ha informado metahemoglobinemia en pacientes que reciben otros nitratos orgánicos, y probablemente también podría ocurrir como un efecto secundario del mononitrato de isosorbida. Ciertamente, los iones de nitrato liberados durante el metabolismo del mononitrato de isosorbida pueden oxidar la hemoglobina en metahemoglobina. Sin embargo, incluso en pacientes totalmente sin actividad de la citocromo b reductasa, e incluso asumiendo que la fracción nitrato del mononitrato de isosorbida se aplica cuantitativamente a la oxidación de la hemoglobina, se deben requerir alrededor de 2 mg/kg de mononitrato de isosorbida antes de que cualquiera de estos pacientes manifieste clínicamente significativo. ≥10%) metahemoglobinemia. En pacientes con función normal de la reductasa, la producción significativa de metahemoglobina debería requerir dosis aún mayores de mononitrato de isosorbida. En un estudio en el que 36 pacientes recibieron de 2 a 4 semanas de tratamiento continuo con nitroglicerina a 3,1 a 4,4 mg/h (equivalente, en la dosis total administrada de iones de nitrato, a 7,8 a 11,1 mg de mononitrato de isosorbida por hora), el nivel promedio de metahemoglobina medido fue 0,2%; esto fue comparable a lo observado en pacientes paralelos que recibieron placebo.
pesar de estas observaciones, existen informes de casos de metahemoglobinemia significativa en asociación con sobredosis moderadas de nitratos orgánicos. Se pensó que ninguno de los pacientes afectados era inusualmente susceptible.
Los niveles de metahemoglobina están disponibles en la mayoría de los laboratorios clínicos. El diagnóstico debe sospecharse en pacientes que presentan signos de alteración del suministro de oxígeno a pesar de un gasto cardíaco adecuado y una pO2 arterial adecuada. Clásicamente, la sangre metahemoglobinémica se describe como marrón chocolate sin cambio de color con la exposición al aire. Cuando se diagnostica metahemoglobinemia, el tratamiento de elección es azul de metileno, 1-2 mg/kg por vía intravenosa.
CONTRAINDICACIONES
Las tabletas de 20 mg de IMDUR están contraindicadas en pacientes que han mostrado hipersensibilidad o reacciones idiosincrásicas a otros nitratos o nitritos.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
El producto IMDUR es una formulación oral de liberación prolongada de ISMN, el principal metabolito activo del dinitrato de isosorbida; la mayor parte de la actividad clínica del dinitrato es atribuible al mononitrato.
La principal acción farmacológica del ISMN y de todos los nitratos orgánicos en general es la relajación del músculo liso vascular, produciendo la dilatación de las arterias y venas periféricas, especialmente de estas últimas. La dilatación de las venas promueve la acumulación periférica de sangre, disminuye el retorno venoso al corazón, lo que reduce la presión telediastólica del ventrículo izquierdo y la presión de enclavamiento de los capilares pulmonares (precarga). La relajación arteriolar reduce la resistencia vascular sistémica, la presión arterial sistólica y la presión arterial media (poscarga). También se produce dilatación de las arterias coronarias. La importancia relativa de la reducción de la precarga, la reducción de la poscarga y la dilatación coronaria sigue sin definirse.
Farmacodinámica
Los regímenes de dosificación para la mayoría de los fármacos de uso crónico están diseñados para proporcionar concentraciones plasmáticas que son continuamente superiores a una concentración mínimamente eficaz. Esta estrategia es inapropiada para los nitratos orgánicos. Varios ensayos clínicos bien controlados han utilizado pruebas de ejercicio para evaluar la eficacia antianginosa de los nitratos administrados continuamente. En la gran mayoría de estos ensayos, los agentes activos fueron indistinguibles del placebo después de 24 horas (o menos) de terapia continua. Los intentos de superar la tolerancia aumentando la dosis, incluso a dosis muy superiores a las utilizadas de forma aguda, han fracasado sistemáticamente. Solo después de que los nitratos han estado ausentes del cuerpo durante varias horas, se restablece su eficacia antianginosa. Las tabletas IMDUR, durante el uso a largo plazo durante 42 días en dosis de 120 mg una vez al día, continuaron mejorando el rendimiento del ejercicio a las 4 horas y a las 12 horas después de la dosificación, pero sus efectos (aunque mejores que el placebo) son menores o, en el mejor de los casos, iguales a los efectos de la primera dosis de 60 mg.
Farmacocinética y Metabolismo
Después de la administración oral de ISMN como solución o tabletas de liberación inmediata, las concentraciones plasmáticas máximas de ISMN se alcanzan en 30 a 60 minutos, con una biodisponibilidad absoluta de aproximadamente 100%. Después de la administración intravenosa, ISMN se distribuye en el agua corporal total en unos 9 minutos con un volumen de distribución de aproximadamente 0,6-0,7 l/kg. El mononitrato de isosorbida se une aproximadamente en un 5 % a las proteínas plasmáticas humanas y se distribuye en las células sanguíneas y la saliva. El mononitrato de isosorbida se metaboliza principalmente en el hígado, pero a diferencia del dinitrato de isosorbida oral, no está sujeto a un metabolismo de primer paso. El mononitrato de isosorbida se elimina por desnitrificación a isosorbida y glucuronidación como mononitrato, con el 96% de la dosis administrada excretada en la orina dentro de los 5 días y solo alrededor del 1% eliminado en las heces. Se han detectado al menos seis compuestos diferentes en la orina, con alrededor del 2% de la dosis excretada como fármaco sin cambios y al menos cinco metabolitos. Los metabolitos no son farmacológicamente activos. El aclaramiento renal representa sólo alrededor del 4% del aclaramiento corporal total. La vida media de eliminación plasmática media de ISMN es de aproximadamente 5 horas.
Se evaluó la disposición de ISMN en pacientes con varios grados de insuficiencia renal, cirrosis hepática o disfunción cardíaca y se encontró que era similar a la observada en sujetos sanos. La vida media de eliminación de ISMN no se prolongó y no hubo acumulación del fármaco en pacientes con insuficiencia renal crónica después de múltiples dosis orales.
La farmacocinética y/o biodisponibilidad de IMDUR 40 mg comprimidos se ha estudiado tanto en voluntarios normales como en pacientes después de la administración de dosis únicas y múltiples. Los datos de estos estudios sugieren que la farmacocinética de ISMN administrado como tabletas IMDUR es similar entre voluntarios sanos normales y pacientes con angina de pecho. En estudios de dosis única y múltiple, la farmacocinética de ISMN fue proporcional a la dosis entre 30 mg y 240 mg.
En un estudio de dosis múltiples, se evaluó el efecto de la edad en el perfil farmacocinético de IMDUR 60 mg y 120 mg (2 × 60 mg) en sujetos ≥45 años. Los resultados de ese estudio indican que no hay diferencias significativas en ninguna de las variables farmacocinéticas de ISMN entre ancianos (≥65 años) y personas más jóvenes (45-64 años) para la dosis de 60 mg de IMDUR. La administración de IMDUR Tabletas de 120 mg (2 tabletas de 60 mg cada 24 horas durante 7 días) produjo un aumento proporcional a la dosis en la Cmax y el AUC, sin cambios en la Tmax ni en la vida media terminal. El grupo de mayor edad (65-74 años) mostró un aclaramiento oral aparente (Cl/F) un 30 % más bajo después de la dosis más alta, es decir, 120 mg, en comparación con el grupo más joven (45-64 años); Cl/F no fue diferente entre los dos grupos después del régimen de 60 mg. Si bien la Cl/F fue independiente de la dosis en el grupo más joven, el grupo de mayor edad mostró una Cl/F ligeramente más baja después del régimen de 120 mg en comparación con el régimen de 60 mg. Las diferencias entre los dos grupos de edad, sin embargo, no fueron estadísticamente significativas. En el mismo estudio, las mujeres mostraron una ligera reducción (15 %) en el aclaramiento cuando se aumentó la dosis. Las hembras mostraron mayores AUC y Cmax en comparación con los machos, pero estas diferencias se explican por las diferencias en el peso corporal entre los dos grupos. Cuando los datos se analizaron utilizando la edad como variable, los resultados indicaron que no hubo diferencias significativas en ninguna de las variables farmacocinéticas de ISMN entre los individuos mayores (≥65 años) y los más jóvenes (45-64 años). Sin embargo, los resultados de este estudio deben verse con cautela debido al pequeño número de sujetos en cada subgrupo de edad y, en consecuencia, a la falta de poder estadístico suficiente.
La siguiente tabla resume los parámetros farmacocinéticos clave de ISMN después de la administración de dosis únicas y múltiples de ISMN como solución oral o tabletas IMDUR:
Efectos de los alimentos
La influencia de los alimentos en la biodisponibilidad de ISMN después de la administración de una dosis única de IMDUR Tabletas de 60 mg se evaluó en tres estudios diferentes que involucraron un desayuno "ligero" o un desayuno rico en calorías y grasas. Los resultados de estos estudios indican que la ingesta concomitante de alimentos puede disminuir la tasa (aumento de Tmax) pero no el grado (AUC) de absorción de ISMN.
Ensayos clínicos
Los ensayos controlados con tabletas IMDUR han demostrado actividad antianginal después de la dosificación aguda y crónica. La administración de comprimidos de 40 mg de IMDUR una vez al día, temprano en la mañana al levantarse, proporcionó al menos 12 horas de actividad antianginosa.
En un estudio paralelo controlado con placebo, se administraron 30, 60, 120 y 240 mg de comprimidos de 60 mg de IMDUR una vez al día durante un máximo de 6 semanas. Antes de la aleatorización, todos los pacientes completaron una fase de placebo simple ciego de 1 a 3 semanas para demostrar la capacidad de respuesta a los nitratos y la reproducibilidad del tiempo total de ejercicio en cinta rodante. Se realizaron pruebas de tolerancia al ejercicio utilizando el Protocolo de Bruce antes ya las 4 y 12 horas después de la dosis de la mañana en los días 1, 7, 14, 28 y 42 del período doble ciego. Los comprimidos de 30 y 60 mg de IMDUR 60 mg (solo las dosis evaluadas de forma aguda) demostraron un aumento significativo desde el inicio en el tiempo total en la cinta rodante en relación con el placebo a las 4 y 12 horas después de la administración de la primera dosis. En el día 42, las dosis de 120 y 240 mg de IMDUR 40 mg comprimidos demostraron un aumento significativo en el tiempo total de la cinta rodante a las 4 y 12 horas posteriores a la dosis, pero en el día 42, las dosis de 30 y 60 mg ya no eran diferenciables del placebo. A lo largo de la dosificación crónica, no se observó rebote en ningún grupo de tratamiento IMDUR.
Los datos agrupados de otros dos ensayos, que compararon tabletas de 40 mg de IMDUR, 60 mg una vez al día, 30 mg de ISDN QID y placebo QID en pacientes con angina estable crónica mediante un diseño cruzado de tres vías, aleatorizado, doble ciego, encontraron aumentos estadísticamente significativos en la tolerancia al ejercicio veces para los comprimidos de 20 mg de IMDUR en comparación con el placebo en las horas 4, 8 y 12 y con ISDN en la hora 4. Los aumentos en la tolerancia al ejercicio en el día 14, aunque estadísticamente significativos en comparación con el placebo, fueron aproximadamente la mitad de los observados en el día 1 del ensayo .
INFORMACIÓN DEL PACIENTE
Se debe informar a los pacientes que la eficacia antianginosa de los comprimidos de 60 mg de IMDUR se puede mantener siguiendo cuidadosamente el programa de dosificación prescrito. Para la mayoría de los pacientes, esto se puede lograr tomando la dosis al levantarse.
Al igual que con otros nitratos, los dolores de cabeza diarios a veces acompañan al tratamiento con mononitrato de isosorbida. En los pacientes que tienen estos dolores de cabeza, los dolores de cabeza son un marcador de la actividad del fármaco. Los pacientes deben resistir la tentación de evitar las cefaleas modificando el programa de tratamiento con mononitrato de isosorbida, ya que la desaparición de la cefalea puede estar asociada con la pérdida simultánea de la eficacia antianginosa. La aspirina o el paracetamol a menudo alivian con éxito los dolores de cabeza inducidos por el mononitrato de isosorbida sin efectos nocivos sobre la eficacia antianginosa del mononitrato de isosorbida.
El tratamiento con mononitrato de isosorbida puede estar asociado con mareos al ponerse de pie, especialmente justo después de levantarse de una posición recostada o sentada. Este efecto puede ser más frecuente en pacientes que también han consumido alcohol.
