Imuran 50mg, 25mg Azathioprine Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Imuran y cómo se usa?
Imuran 25 mg es un medicamento recetado que se usa para tratar los síntomas de la artritis reumatoide y como prevención del rechazo del trasplante. Imuran se puede usar solo o con otros medicamentos.
Imuran 25 mg pertenece a una clase de medicamentos llamados DMARD, inmunomoduladores; Inmunosupresores.
¿Cuáles son los posibles efectos secundarios de Imuran?
Imuran 25 mg puede causar efectos secundarios graves, que incluyen:
- fiebre,
- glándulas inflamadas,
- dolor de cuerpo,
- sudores nocturnos,
- no sentirse bien,
- piel pálida,
- sarpullido,
- moretones o sangrado fácil,
- manos y pies fríos,
- aturdimiento,
- dificultad para respirar,
- dolor en la parte superior del estómago que puede extenderse al hombro,
- sentirse lleno después de comer solo una pequeña cantidad,
- pérdida de peso,
- signos de infección (fiebre, escalofríos, debilidad, síntomas de gripe, dolor de garganta, tos, dolor o ardor al orinar),
- náuseas severas,
- vómitos,
- Diarrea,
- latidos rápidos del corazón,
- orina oscura y
- coloración amarillenta de la piel o los ojos (ictericia)
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Imuran 50 mg incluyen:
- náuseas,
- Diarrea,
- dolor de estómago,
- pérdida de cabello, y
- erupción cutanea
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Imuran. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
ADVERTENCIA
MALIGNIDAD
La inmunosupresión crónica con IMURAN, un antimetabolito de purina, aumenta el riesgo de malignidad en humanos. Los informes de malignidad incluyen linfoma postrasplante y linfoma de células T hepatoesplénicas (HSTCL) en pacientes con enfermedad inflamatoria intestinal. Los médicos que usan este medicamento deben estar muy familiarizados con este riesgo, así como con el potencial mutagénico tanto para hombres como para mujeres y con posibles toxicidades hematológicas. Los médicos deben informar a los pacientes sobre el riesgo de malignidad con IMURAN. Ver ADVERTENCIAS .
DESCRIPCIÓN
IMURAN (azatioprina), un antimetabolito inmunosupresor, está disponible en forma de tabletas para administración oral. Cada comprimido ranurado contiene 50 mg de azatioprina y los ingredientes inactivos lactosa, estearato de magnesio, almidón de patata, povidona y ácido esteárico.
La azatioprina es químicamente 6-[(1-metil-4-nitro-1H-imidazol-5-il)tio]-1H-purina. La fórmula estructural de la azatioprina es:
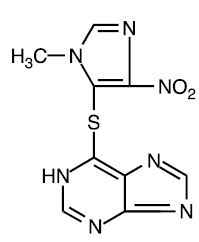
Es un derivado imidazolílico de la 6-mercaptopurina y muchos de sus efectos biológicos son similares a los del compuesto original.
La azatioprina es insoluble en agua, pero puede disolverse con la adición de un equivalente molar de álcali. La azatioprina es estable en solución a pH neutro o ácido, pero la hidrólisis a mercaptopurina se produce en exceso de hidróxido de sodio (0,1 N), especialmente al calentarla. La conversión a mercaptopurina también ocurre en presencia de compuestos de sulfhidrilo como cisteína, glutatión y sulfuro de hidrógeno.
INDICACIONES
IMURAN está indicado como coadyuvante para la prevención del rechazo en el homotrasplante renal. También está indicado para el manejo de la artritis reumatoide activa para reducir los signos y síntomas.
Homotrasplante Renal
IMURAN está indicado como coadyuvante para la prevención del rechazo en el homotrasplante renal. La experiencia con más de 16 000 trasplantes muestra una supervivencia del paciente a 5 años del 35 % al 55 %, pero esto depende del donante, la compatibilidad de los antígenos HLA, el anticuerpo anti-donante o anti-aloantígeno de células B y otras variables. El efecto de IMURAN sobre estas variables no se ha probado en ensayos controlados.
Artritis Reumatoide
IMURAN está indicado para el tratamiento de la artritis reumatoide (AR) activa para reducir los signos y síntomas. La aspirina, los medicamentos antiinflamatorios no esteroideos y/o los glucocorticoides en dosis bajas pueden continuarse durante el tratamiento con IMURAN. No se ha estudiado el uso combinado de IMURAN 25 mg con fármacos antirreumáticos modificadores de la enfermedad (DMARD) para obtener beneficios adicionales o efectos adversos inesperados. No se puede recomendar el uso de IMURAN con estos agentes.
DOSIFICACIÓN Y ADMINISTRACIÓN
LAS PRUEBAS DE TPMT NO PUEDEN SUSTITUIR EL MONITOREO DEL CONTEO SANGRE COMPLETO (CBC) EN PACIENTES QUE RECIBEN IMURAN. El genotipado o fenotipado de TPMT se puede utilizar para identificar pacientes con actividad de TPMT ausente o reducida. Los pacientes con actividad de TPMT baja o nula tienen un mayor riesgo de desarrollar mielotoxicidad grave y potencialmente mortal a causa de IMURAN si se administran dosis convencionales. Los médicos pueden considerar terapias alternativas para pacientes que tienen actividad TPMT baja o nula (homocigóticos para alelos no funcionales). IMURAN 25 mg debe administrarse con precaución a los pacientes que tienen un alelo no funcional (heterocigotos) que corren el riesgo de una actividad reducida de TPMT que puede provocar toxicidad si se administran dosis convencionales. Se recomienda la reducción de la dosis en pacientes con actividad reducida de TPMT. Se puede considerar la interrupción temprana del fármaco en pacientes con resultados anormales de CBC que no responden a la reducción de la dosis.
Homotrasplante Renal
La dosis de IMURAN 50 mg requerida para prevenir el rechazo y minimizar la toxicidad variará con los pacientes individuales; esto requiere una gestión cuidadosa. La dosis inicial suele ser de 3 a 5 mg/kg al día, comenzando en el momento del trasplante. IMURAN generalmente se administra como una dosis única diaria el día del trasplante y, en una minoría de casos, de 1 a 3 días antes. Por lo general, es posible reducir la dosis a niveles de mantenimiento de 1 a 3 mg/kg al día. La dosis de IMURAN 50 mg no debe aumentarse a niveles tóxicos debido a la amenaza de rechazo. La suspensión puede ser necesaria en caso de toxicidad hematológica grave o de otro tipo, incluso si el rechazo del homoinjerto puede ser consecuencia de la suspensión del fármaco.
Artritis Reumatoide
IMURAN 50 mg generalmente se administra diariamente. La dosis inicial debe ser de aproximadamente 1,0 mg/kg (50 a 100 mg) administrada como dosis única o dos veces al día. La dosis puede aumentarse, comenzando a las 6 a 8 semanas y luego gradualmente a intervalos de 4 semanas, si no hay toxicidades graves y si la respuesta inicial no es satisfactoria. Los incrementos de dosis deben ser de 0,5 mg/kg al día, hasta una dosis máxima de 2,5 mg/kg al día. La respuesta terapéutica ocurre después de varias semanas de tratamiento, generalmente de 6 a 8; una prueba adecuada debe ser de un mínimo de 12 semanas. Los pacientes que no mejoran después de 12 semanas pueden considerarse refractarios. IMURAN 50 mg se puede continuar a largo plazo en pacientes con respuesta clínica, pero los pacientes deben ser monitoreados cuidadosamente y se debe intentar una reducción gradual de la dosis para reducir el riesgo de toxicidad.
La terapia de mantenimiento debe ser a la dosis eficaz más baja, y la dosis administrada puede reducirse gradualmente con cambios de 0,5 mg/kg o aproximadamente 25 mg diarios cada 4 semanas mientras que la otra terapia se mantiene constante. No se ha determinado la duración óptima del mantenimiento de IMURAN 50 mg. IMURAN puede interrumpirse abruptamente, pero es posible que se produzcan efectos retardados.
Uso en disfunción renal
Los pacientes relativamente oligúricos, especialmente aquellos con necrosis tubular en el período inmediatamente posterior al trasplante cadavérico, pueden tener un retraso en la eliminación de IMURAN o sus metabolitos, pueden ser particularmente sensibles a este fármaco y, por lo general, reciben dosis más bajas.
Se deben considerar los procedimientos para el manejo y eliminación adecuados de este fármaco antimetabolito inmunosupresor. Se han publicado varias guías sobre este tema.25-31 No existe un acuerdo general de que todos los procedimientos recomendados en las guías sean necesarios o apropiados.
CÓMO SUMINISTRADO
50 miligramos tabletas superpuestas en forma de círculo, de color amarillo a blanquecino, ranuradas, impresas con "IMURAN" y "50" en cada tableta; botella de 100 ( CDN 65483-590-10).
Almacenar de 15° a 25°C (59° a 77°F) en un lugar seco y protegido de la luz.
REFERENCIAS @sesenta y cinco. Recomendaciones para el manejo seguro de fármacos antineoplásicos parenterales. Washington, DC: División de Seguridad; Departamento de Farmacia del Centro Clínico y Servicios de Enfermería Oncológica, Instituto Nacional de Salud; 1992. Departamento de Salud y Servicios Humanos de EE.UU. Publicación del Servicio de Salud Pública NIH 92-2621. @sesenta y cinco. Consejo de Asuntos Científicos de la AMA. Pautas para el manejo de antineoplásicos parenterales. JAMA. 1985; 253:15901592. @sesenta y cinco. Comisión Nacional de Estudios sobre Exposición Citotóxica. Recomendaciones para el manejo de agentes citotóxicos. 1987. Disponible de Louis P. Jeffrey, presidente de la Comisión Nacional de Estudios sobre Exposición a Citotóxicos. Facultad de Farmacia y Ciencias de la Salud Afines de Massachusetts, 179 Longwood Avenue, Boston, MA 02115. @sesenta y cinco. Sociedad Oncológica Clínica de Australia. Pautas y recomendaciones para el manejo seguro de agentes antineoplásicos. Med J Aust. 1983; 1:426-428. @sesenta y cinco. Jones RB, Frank R, Mass T. Manejo seguro de agentes quimioterapéuticos: un informe del Centro Médico Mount Sinai. CA Cancer J para médicos. 1983; 33:258-263. @sesenta y cinco. Sociedad Americana de Farmacéuticos Hospitalarios. Boletín de asistencia técnica de la ASHP en el manejo de medicamentos citotóxicos y peligrosos. Am J Hosp Pharm. 1990; 47:1033-1049. @sesenta y cinco. Yodaiken RE, Bennett D. Pautas de prácticas laborales de OSHA para el personal que maneja medicamentos citotóxicos (antineoplásicos). Am J Hosp Pharm, 1996; 43:1193-1204. Fabricado por Pharmaceutics International, Inc. Hunt Valley, MD 21031 para Prometheus Laboratories Inc. San Diego, CA 92121. Revisado: febrero de 2014EFECTOS SECUNDARIOS
Los efectos tóxicos principales y potencialmente graves de IMURAN son hematológicos y gastrointestinales. Los riesgos de infección secundaria y malignidad también son significativos (ver ADVERTENCIAS ). La frecuencia y la gravedad de las reacciones adversas dependen de la dosis y la duración de IMURAN, así como de la enfermedad subyacente del paciente o de las terapias concomitantes. La incidencia de toxicidades hematológicas y neoplasia encontrada en grupos de receptores de homoinjertos renales es significativamente más alta que la de los estudios que emplean IMURAN 25 mg para la artritis reumatoide. Las incidencias relativas en los estudios clínicos se resumen a continuación:
hematológico
La leucopenia y/o la trombocitopenia dependen de la dosis y pueden ocurrir tarde en el curso de la terapia con IMURAN. La reducción de la dosis o la suspensión temporal pueden dar lugar a la reversión de estas toxicidades. La infección puede ocurrir como una manifestación secundaria de supresión de la médula ósea o leucopenia, pero la incidencia de infección en el homotrasplante renal es de 30 a 60 veces mayor que en la artritis reumatoide. Se han notificado anemias, incluida la anemia macrocítica y/o hemorragia.
El genotipado o fenotipado de TPMT puede ayudar a identificar pacientes con actividad de TPMT baja o ausente (homocigotos para alelos no funcionales) que tienen un mayor riesgo de mielosupresión grave y potencialmente mortal a causa de IMURAN. Ver FARMACOLOGÍA CLÍNICA , ADVERTENCIAS y PRECAUCIONES : Pruebas de laboratorio . Se ha informado muerte asociada con pancitopenia en pacientes con actividad TPMT ausente que reciben azatioprina.6,20
Gastrointestinal
Las náuseas y los vómitos pueden ocurrir dentro de los primeros meses de terapia con IMURAN 50 mg y ocurrieron en aproximadamente el 12 % de 676 pacientes con artritis reumatoide. La frecuencia de los trastornos gástricos a menudo se puede reducir mediante la administración del fármaco en dosis divididas y/o después de las comidas. Sin embargo, en algunos pacientes, las náuseas y los vómitos pueden ser intensos y pueden estar acompañados de síntomas como diarrea, fiebre, malestar general y mialgias (ver PRECAUCIONES ). Los vómitos con dolor abdominal pueden ocurrir raramente con una pancreatitis por hipersensibilidad. Se sabe que ocurre hepatotoxicidad que se manifiesta por elevación de la fosfatasa alcalina sérica, la bilirrubina y/o las transaminasas séricas después del uso de azatioprina, principalmente en receptores de aloinjertos. La hepatotoxicidad ha sido poco común (menos del 1%) en pacientes con artritis reumatoide. La hepatotoxicidad posterior al trasplante ocurre con mayor frecuencia dentro de los 6 meses posteriores al trasplante y generalmente es reversible después de la interrupción de IMURAN. Se ha descrito una enfermedad venooclusiva hepática rara, pero potencialmente mortal, asociada con la administración crónica de azatioprina en pacientes trasplantados y en un paciente que recibió IMURAN por panuveítis.21,22,23 indicado para la detección temprana de hepatotoxicidad. Si se sospecha clínicamente de enfermedad venooclusiva hepática, IMURAN debe retirarse permanentemente.
Otros
Se han informado efectos secundarios adicionales de baja frecuencia. Estos incluyen erupciones cutáneas, alopecia, fiebre, artralgias, diarrea, esteatorrea, balance de nitrógeno negativo, neumonitis intersticial reversible, linfoma de células T hepatoesplénico (ver ADVERTENCIAS – Malignidad ) y síndrome de Sweet (dermatosis neutrofílica febril aguda).
INTERACCIONES CON LA DROGAS
Uso con alopurinol
El alopurinol inhibe una de las vías de inactivación de la azatioprina. Los pacientes que reciben IMURAN 50 mg y alopurinol concomitantemente deben tener una reducción de la dosis de IMURAN 50 mg, a aproximadamente 1/3 a 1/4 de la dosis habitual. Se recomienda considerar una reducción adicional de la dosis o terapias alternativas para los pacientes con actividad de TPMT baja o nula que reciben IMURAN 50 mg y alopurinol porque se ven afectadas las vías de inactivación de TPMT y XO. Ver FARMACOLOGÍA CLÍNICA , ADVERTENCIAS , PRECAUCIONES : Pruebas de laboratorio y REACCIONES ADVERSAS secciones.
Usar con Aminosalicilatos
Existe evidencia in vitro de que los derivados de aminosalicilato (p. ej., sulfasalazina, mesalazina u olsalazina) inhiben la enzima TPMT. El uso concomitante de estos agentes con IMURAN 50 mg debe hacerse con precaución.
Uso con otros agentes que afectan la mielopoyesis
Los medicamentos que pueden afectar la producción de leucocitos, incluido el cotrimoxazol, pueden provocar una leucopenia exagerada, especialmente en los receptores de trasplantes renales.
Uso con inhibidores de la enzima convertidora de angiotensina
Se ha informado que el uso de inhibidores de la enzima convertidora de angiotensina para controlar la hipertensión en pacientes que toman azatioprina induce anemia y leucopenia grave.
Uso con warfarina
IMURAN puede inhibir el efecto anticoagulante de la warfarina.
Usar con ribavirina
Se ha informado que el uso de ribavirina para la hepatitis C en pacientes que reciben azatioprina induce pancitopenia grave y puede aumentar el riesgo de mielotoxicidad relacionada con azatioprina. La inosina monofosfato deshidrogenasa (IMDH) es necesaria para una de las vías metabólicas de la azatioprina. Se sabe que la ribavirina inhibe la IMDH, lo que conduce a la acumulación de un metabolito de azatioprina, el monofosfato de 6-metiltioionosina (6MTITP), que se asocia con mielotoxicidad (neutropenia, trombocitopenia y anemia). Los pacientes que reciben azatioprina con ribavirina deben tener hemogramas completos, incluidos los recuentos de plaquetas, monitoreados semanalmente durante el primer mes, dos veces al mes durante el segundo y tercer mes de tratamiento, luego mensualmente o con mayor frecuencia si es necesario cambiar la dosis u otro tratamiento.
REFERENCIAS @sesenta y cinco. Datos en archivo, Prometheus Laboratories Inc. @sesenta y cinco. Schutz E, Gummert J, Mohr F, Oellerich M. Mielosupresión inducida por azatioprina en pacientes con trasplante de corazón con deficiencia de tiopurina metiltransferasa. Lanceta. 1993; 341:436. @sesenta y cinco. Leer AE, Wiesner RH, LaBrecque DR, et al. Enfermedad venooclusiva hepática asociada a trasplante renal y tratamiento con azatioprina. Ann Intern Med. 1986; 104:651-655. @sesenta y cinco. Katzka DA, Saul SH, Jorkasky D, et al. Azatioprina y enfermedad venooclusiva hepática en pacientes trasplantados renales. Gastroenterología. 1986; 90:446-454. @sesenta y cinco. Weitz H, Gokel JM, Loeshke K, et al. Enfermedad venooclusiva del hígado en pacientes que reciben terapia inmunosupresora. Arco de Virchow A Pathol Anat Histol. mil novecientos ochenta y dos; 395:245-256.ADVERTENCIAS
Malignidad
Los pacientes que reciben inmunosupresores, incluido IMURAN 50 mg, tienen un mayor riesgo de desarrollar linfoma y otras neoplasias malignas, particularmente de la piel. Los médicos deben informar a los pacientes sobre el riesgo de malignidad con IMURAN. Como es habitual en los pacientes con mayor riesgo de cáncer de piel, se debe limitar la exposición a la luz solar y ultravioleta mediante el uso de ropa protectora y el uso de un filtro solar con un factor de protección alto.
Post-trasplante
Se sabe que los pacientes con trasplante renal tienen un mayor riesgo de malignidad, predominantemente cáncer de piel y tumores de células reticulares o linfomatosos. El riesgo de linfomas posteriores al trasplante puede aumentar en pacientes que reciben un tratamiento agresivo con medicamentos inmunosupresores, incluido IMURAN. Por lo tanto, la terapia con medicamentos inmunosupresores debe mantenerse en los niveles efectivos más bajos.
Artritis Reumatoide
Hay información disponible sobre el riesgo de malignidad con el uso de IMURAN 50 mg en la artritis reumatoide (ver REACCIONES ADVERSAS ). No ha sido posible definir el riesgo preciso de malignidad debido a IMURAN. Los datos sugieren que el riesgo puede ser elevado en pacientes con artritis reumatoide, aunque menor que en pacientes con trasplante renal. Sin embargo, se han informado casos de leucemia mielógena aguda y tumores sólidos en pacientes con artritis reumatoide que recibieron IMURAN.
Enfermedad inflamatoria intestinal
Se informaron casos posteriores a la comercialización de linfoma de células T hepatoesplénico (HSTCL), un tipo raro de linfoma de células T, en pacientes tratados con IMURAN. Estos casos han tenido un curso muy agresivo de la enfermedad y han sido fatales. La mayoría de los casos notificados ocurrieron en pacientes con enfermedad de Crohn o colitis ulcerosa y la mayoría fueron varones adolescentes y adultos jóvenes. Algunos de los pacientes fueron tratados con IMURAN como monoterapia y algunos habían recibido tratamiento concomitante con un bloqueador de TNFα en el momento del diagnóstico o antes. No se ha establecido la seguridad y eficacia de IMURAN 25 mg para el tratamiento de la enfermedad de Crohn y la colitis ulcerosa.
citopenias
Se pueden producir leucopenia grave, trombocitopenia, anemias, incluida la anemia macrocítica y/o pancitopenia, en pacientes tratados con IMURAN. También puede ocurrir una supresión severa de la médula ósea. Los pacientes con actividad intermedia de tiopurina S-metil transferasa (TPMT) pueden tener un mayor riesgo de mielotoxicidad si reciben dosis convencionales de IMURAN. Los pacientes con actividad TPMT baja o nula tienen un mayor riesgo de desarrollar mielotoxicidad grave y potencialmente mortal si reciben dosis convencionales de IMURAN. El genotipado o fenotipado de TPMT puede ayudar a identificar a los pacientes que tienen un mayor riesgo de desarrollar toxicidad de 50 mg de IMURAN.2-9 (Ver PRECAUCIONES : Pruebas de laboratorio ). Las toxicidades hematológicas están relacionadas con la dosis y pueden ser más graves en pacientes con trasplante renal cuyo homoinjerto sufre rechazo. Se sugiere que los pacientes que reciben IMURAN se realicen hemogramas completos, incluidos los recuentos de plaquetas, semanalmente durante el primer mes, dos veces al mes durante el segundo y tercer mes de tratamiento, luego mensualmente o con más frecuencia si es necesario modificar la dosis u otros cambios en la terapia. Puede ocurrir supresión hematológica retardada. Puede ser necesaria una pronta reducción de la dosis o la suspensión temporal del fármaco si hay una caída rápida o un recuento de leucocitos persistentemente bajo, u otra evidencia de depresión de la médula ósea. La leucopenia no se correlaciona con el efecto terapéutico; por lo tanto, la dosis no debe aumentarse intencionalmente para disminuir el recuento de glóbulos blancos.
Infecciones graves
Los pacientes que reciben inmunosupresores, incluido Imuran 25 mg, tienen un mayor riesgo de infecciones bacterianas, virales, fúngicas, protozoarias y oportunistas, incluida la reactivación de infecciones latentes. Estas infecciones pueden tener consecuencias graves, incluso mortales.
Leucoencefalopatía Multifocal Progresiva
Se han notificado casos de infección asociada al virus JC que dieron lugar a leucoencefalopatía multifocal progresiva (LMP), en ocasiones mortal, en pacientes tratados con inmunosupresores, incluido Imuran. Los factores de riesgo de la leucoencefalopatía multifocal progresiva incluyen el tratamiento con terapias inmunosupresoras y el deterioro de la función inmunitaria. Considere el diagnóstico de LMP en cualquier paciente que presente manifestaciones neurológicas de inicio reciente y considere la consulta con un neurólogo según esté clínicamente indicado. Considere reducir la cantidad de inmunosupresión en pacientes que desarrollan LMP. En pacientes trasplantados, considerar el riesgo que representa para el injerto la disminución de la inmunosupresión.
Efecto sobre el esperma en animales
Se ha informado que IMURAN causa una depresión temporal en la espermatogénesis y una reducción en la viabilidad y el recuento de espermatozoides en ratones en dosis 10 veces superiores a la dosis terapéutica humana;10 se produjo un porcentaje reducido de apareamientos fértiles cuando los animales recibieron 5 mg/kg.11
El embarazo
Embarazo Categoría D
IMURAN puede causar daño fetal cuando se administra a una mujer embarazada. IMURAN 50 mg no debe administrarse durante el embarazo sin sopesar cuidadosamente el riesgo frente al beneficio. Siempre que sea posible, se debe evitar el uso de IMURAN en pacientes embarazadas. Este medicamento no debe usarse para tratar la artritis reumatoide en mujeres embarazadas.12
IMURAN es teratogénico en conejos y ratones cuando se administra en dosis equivalentes a la dosis humana (5 mg/kg al día). Las anomalías incluyeron malformaciones esqueléticas y anomalías viscerales.11
Se han producido anomalías inmunológicas y de otro tipo limitadas en algunos bebés nacidos de receptores de aloinjertos renales en IMURAN. En un reporte de caso detallado,13 se notificó linfopenia documentada, niveles disminuidos de IgG e IgM, infección por CMV y una sombra tímica disminuida en un bebé nacido de una madre que recibió 150 mg de azatioprina y 30 mg de prednisona diariamente durante el embarazo. A las 10 semanas la mayoría de las características se normalizaron. DeWitte et al informaron pancitopenia y deficiencia inmunológica grave en un bebé prematuro cuya madre recibió 125 mg de azatioprina y 12,5 mg de prednisona al día.14 Ha habido dos informes publicados de hallazgos físicos anormales. Williamson y Karp describieron un bebé que nació con polidactilia preaxial cuya madre recibió azatioprina 200 mg al día y 20 mg de prednisona en días alternos durante el embarazo.15 Tallent et al describieron un bebé con un gran mielomeningocele en la región lumbar superior, caderas dislocadas bilaterales y pie equinovaro. El padre estaba en tratamiento prolongado con azatioprina.16
Se debe sopesar cuidadosamente el beneficio frente al riesgo antes de usar IMURAN en pacientes con potencial reproductivo. No existen estudios adecuados y bien controlados en mujeres embarazadas. Si este medicamento se usa durante el embarazo o si la paciente queda embarazada mientras toma este medicamento, se debe informar a la paciente sobre el peligro potencial para el feto. Se debe advertir a las mujeres en edad fértil que eviten quedarse embarazadas.
PRECAUCIONES
General
Se ha notificado una reacción de hipersensibilidad gastrointestinal caracterizada por náuseas y vómitos intensos. Estos síntomas también pueden ir acompañados de diarrea, erupción cutánea, fiebre, malestar general, mialgias, elevación de las enzimas hepáticas y, en ocasiones, hipotensión. Los síntomas de toxicidad gastrointestinal se desarrollan con mayor frecuencia dentro de las primeras semanas de tratamiento con IMURAN 25 mg y son reversibles al suspender el fármaco. La reacción puede reaparecer dentro de las horas posteriores a la reexposición con una sola dosis de IMURAN.
Pruebas de laboratorio
Monitoreo de conteo sanguíneo completo (CBC)
Los pacientes que toman IMURAN 25 mg deben realizarse hemogramas completos, incluidos los recuentos de plaquetas, semanalmente durante el primer mes, dos veces al mes durante el segundo y tercer mes de tratamiento, luego mensualmente o con más frecuencia si es necesario modificar la dosis u otros cambios en la terapia.
Pruebas de TPMT
Se recomienda considerar a los pacientes con genotipo o fenotipo para TPMT. Los métodos de fenotipado y genotipado están disponibles comercialmente. Los alelos no funcionales más comunes asociados con niveles reducidos de actividad de TPMT son TPMT*2, TPMT*3A y TPMT*3C. Los pacientes con dos alelos no funcionales (homocigotos) tienen una actividad de TPMT baja o nula y aquellos con un alelo no funcional (heterocigotos) tienen una actividad intermedia. No es posible obtener resultados precisos de fenotipado (actividad TPMT de glóbulos rojos) en pacientes que han recibido transfusiones de sangre recientemente. La prueba de TPMT también se puede considerar en pacientes con resultados anormales de CBC que no responden a la reducción de la dosis. Es aconsejable la suspensión precoz del fármaco en estos pacientes. LAS PRUEBAS DE TPMT NO PUEDEN SUSTITUIR EL MONITOREO DEL CONTEO SANGRE COMPLETO (CBC) EN PACIENTES QUE RECIBEN IMURAN. Ver FARMACOLOGÍA CLÍNICA , ADVERTENCIAS , REACCIONES ADVERSAS y DOSIFICACIÓN Y ADMINISTRACIÓN secciones.
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Ver ADVERTENCIAS sección.
El embarazo
Efectos teratogénicos
Embarazo Categoría D. Ver ADVERTENCIAS sección.
Madres lactantes
No se recomienda el uso de IMURAN 25 mg en madres lactantes. La azatioprina o sus metabolitos se transfieren en niveles bajos, tanto a través de la placenta como en la leche materna.17,18,19 Debido al potencial de tumorigenicidad mostrado por la azatioprina, se debe tomar la decisión de suspender la lactancia o suspender el fármaco, teniendo en cuenta la Importancia del fármaco para la madre.
Uso pediátrico
No se ha establecido la seguridad y eficacia de azatioprina en pacientes pediátricos.
REFERENCIAS @sesenta y cinco. Weinshilboum R. Farmacogenética de la tiopurina: estudios clínicos y moleculares de la tiopurina metiltransferasa. Eliminación de metab de drogas. 2001;29:601-605. @sesenta y cinco. McLeod HL, Siva C. El locus del gen de la tiopurina S-metiltransferasa: implicaciones para la farmacogenómica clínica. Farmacogenómica. 2002;3:89-98. @sesenta y cinco. Anstey A, Lennard L, Mayou SC, et al. Pancitopenia relacionada con azatioprina: una deficiencia enzimática causada por un polimorfismo genético común: una revisión. JR Soc Med. 1992; 85:752-756. @sesenta y cinco. Stolk JN, Beorbooms AM, de Abreu RA, et al. Reducción de la actividad de la tiopurina metiltransferasa y desarrollo de efectos secundarios del tratamiento con azatioprina en pacientes con artritis reumatoide. Artritis Rheum. 1998; 41:18581866. @sesenta y cinco. Datos en archivo, Prometheus Laboratories Inc. @sesenta y cinco. Yates CR, Krynetski EY, Loennechen T, et al. Diagnóstico molecular de la deficiencia de tiopurina S-metiltransferasa: base genética para la intolerancia a la azatioprina y la mercaptopurina. Ann Intern Med. 1997; 126:608-614. @sesenta y cinco. Black AJ, McLeod HL, Capell HA, et al. El genotipo de la tiopurina metiltransferasa predice la toxicidad grave de la azatioprina que limita el tratamiento. Ann Intern Med. 1998; 129:716-718. @sesenta y cinco. Clunie GP, Lennard L. Relevancia del estado de tiopurina metiltransferasa en pacientes reumatológicos que reciben azatioprina. Reumatología. 2004; 43:13-18. @sesenta y cinco. Clark JM. La mutagenicidad de la azatioprina en ratones, Drosophila melanogaster y Neurospora crassa. Mutat Res. 1975; 28:87-99. @sesenta y cinco. Datos en archivo, Prometheus Laboratories Inc. @sesenta y cinco. Tagatz GE, Simmons RL. Embarazo después del trasplante renal. Ann Intern Med. 1975; 82:113-114. Notas editoriales. @sesenta y cinco. Cote' CJ, Meuwissen HJ, Pickering RJ. Efectos en el neonato de prednisona y azatioprina administradas a la madre durante el embarazo. J Pediatr. 1974; 85:324-328. @sesenta y cinco. DeWitte DB, Buick MK, Cyran SE, et al. Pancitopenia neonatal e inmunodeficiencia combinada grave asociadas con la administración prenatal de azatioprina y prednisona. J Pediatr. 1984; 105:625-628. @sesenta y cinco. Williamson RA, Karp LE. Teratogenicidad de la azatioprina: revisión de la literatura y reporte de un caso. Obstet Gynecol. 1981; 58:247-250. @sesenta y cinco. Tallent MB, Simmons RL, Najarian JS. Malformaciones congénitas en hijo de varón receptor de trasplante renal. JAMA. 1970; 211: 1854-1855. @sesenta y cinco. Datos en archivo, Prometheus Laboratories Inc. @sesenta y cinco. Saarikoski S, Seppälä M. Inmunosupresión durante el embarazo: transmisión de azatioprina y sus metabolitos de la madre al feto. Soy J Obstet Gynecol. 1973; 115:1100-1106. @sesenta y cinco. Coulam CB, Moyer TP, Jiang NS, et al. Lactancia materna después del trasplante renal. Proceso de trasplante mil novecientos ochenta y dos; 14: 605-609.SOBREDOSIS
Las LD50 orales para dosis únicas de IMURAN 50 mg en ratones y ratas son 2500 mg/kg y 400 mg/kg, respectivamente. Dosis muy altas de este antimetabolito pueden provocar hipoplasia medular, hemorragia, infección y muerte. Alrededor del 30 % de IMURAN se une a las proteínas séricas, pero aproximadamente el 45 % se elimina durante una hemodiálisis de 8 horas.24 Se informó un solo caso de un paciente con trasplante renal que ingirió una dosis única de 7500 mg de IMURAN. Las reacciones tóxicas inmediatas fueron náuseas, vómitos y diarrea, seguidas de leucopenia leve y anomalías leves en la función hepática. El recuento de glóbulos blancos, SGOT y bilirrubina volvieron a la normalidad 6 días después de la sobredosis.
CONTRAINDICACIONES
IMURAN 25 mg no debe administrarse a pacientes que hayan mostrado hipersensibilidad al fármaco. IMURAN no debe usarse para tratar la artritis reumatoide en mujeres embarazadas. Los pacientes con artritis reumatoide tratados previamente con agentes alquilantes (ciclofosfamida, clorambucilo, melfalán u otros) pueden tener un riesgo prohibitivo de malignidad si se tratan con IMURAN.
REFERENCIAS @sesenta y cinco. Schusziarra V, Ziekursch V, Schlamp R, et al. Farmacocinética de la azatioprina en hemodiálisis. Int J Clin Pharmacol Biopharm. 1976; 14:298-302.FARMACOLOGÍA CLÍNICA
La azatioprina se absorbe bien después de la administración oral. La radioactividad sérica máxima ocurre de 1 a 2 horas después de la 35S-azatioprina oral y decae con una vida media de 5 horas. Esta no es una estimación de la vida media de la azatioprina en sí, sino la tasa de descomposición de todos los metabolitos del fármaco que contienen 35S. Debido al extenso metabolismo, solo una fracción de la radiactividad está presente como azatioprina. Las dosis habituales producen niveles sanguíneos de azatioprina y de mercaptopurina derivada de ella, que son bajos ( SOBREDOSIS .
La azatioprina se metaboliza a 6-mercaptopurina (6-MP). Ambos compuestos se eliminan rápidamente de la sangre y se oxidan o metilan en los eritrocitos y el hígado; no se detecta azatioprina o mercaptopurina en la orina después de 8 horas. La activación de la 6-mercaptopurina ocurre a través de la hipoxantina-guanina fosforribosiltransferasa (HGPRT) y una serie de procesos multienzimáticos que involucran quinasas para formar nucleótidos de 6-tioguanina (6-TGN) como metabolitos principales (ver Esquema de metabolismo en la figura 1 ). La citotoxicidad de la azatioprina se debe, en parte, a la incorporación de 6-TGN al ADN.
6-MP sufre dos rutas principales de inactivación (Figura 1). Una es la metilación del tiol, que es catalizada por la enzima tiopurina S-metiltransferasa (TPMT), para formar el metabolito inactivo metil-6-MP (6-MeMP). La actividad de TPMT está controlada por un polimorfismo genético.1,2,3 Para los caucásicos y los afroamericanos, aproximadamente el 10 % de la población hereda un alelo TPMT no funcional (heterocigoto) que confiere una actividad TPMT intermedia, y el 0,3 % hereda dos alelos TPMT no funcionales. alelos (homocigóticos) para actividad de TPMT baja o ausente. Los alelos no funcionales son menos comunes en los asiáticos. La actividad de TPMT se correlaciona inversamente con los niveles de 6-TGN en los eritrocitos y presumiblemente en otros tejidos hematopoyéticos, ya que estas células tienen actividades insignificantes de xantina oxidasa (involucrada en la otra vía de inactivación), dejando la metilación de TPMT como la única vía de inactivación. Los pacientes con actividad TPMT intermedia pueden tener un mayor riesgo de mielotoxicidad si reciben dosis convencionales de IMURAN. Los pacientes con actividad de TPMT baja o ausente tienen un mayor riesgo de desarrollar mielotoxicidad grave y potencialmente mortal si reciben dosis convencionales de IMURAN.4-9 La genotipificación o fenotipificación de TPMT (actividad de TPMT de los glóbulos rojos) puede ayudar a identificar a los pacientes que tienen una mayor riesgo de desarrollar toxicidad de IMURAN 25 mg.2,3,7,8,9 No es posible obtener resultados precisos de fenotipado (actividad TPMT de glóbulos rojos) en pacientes que han recibido transfusiones de sangre recientes. Ver ADVERTENCIAS , PRECAUCIONES : INTERACCIONES CON LA DROGAS , PRECAUCIONES : Pruebas de laboratorio y REACCIONES ADVERSAS secciones.
Figura 1 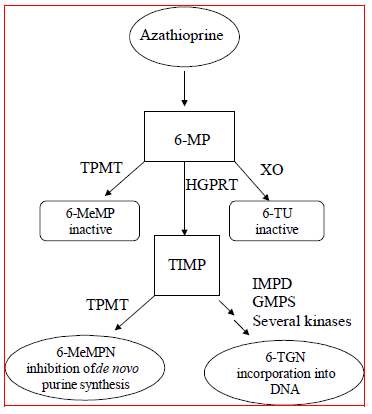 Figura 1. Ruta del metabolismo de la azatioprina: las rutas en competencia dan como resultado la inactivación por TPMT o XO, o la incorporación de nucleótidos citotóxicos en el ADN.
Figura 1. Ruta del metabolismo de la azatioprina: las rutas en competencia dan como resultado la inactivación por TPMT o XO, o la incorporación de nucleótidos citotóxicos en el ADN.
GMPS: guanosina monofosfato sintetasa; HGPRT: hipoxantina-guanina-fosforribosil-transferasa; IMPD: inosina monofosfato deshidrogenasa; MeMP: metilmercaptopurina; MeMPN: nucleótido de metilmercaptopurina; TGN: nucleótidos de tioguanina; TIMP: monofosfato de tioinosina; TPMT: Tiopurina S-metiltransferasa; Ácido tioúrico TU; XO: xantina oxidasa (adaptado de Pharmacogenomics 2002; 3:89-98; y Cancer Res 2001; 61:5810-5816).
Otra vía de inactivación es la oxidación, que es catalizada por la xantina oxidasa (XO) para formar ácido 6-tioúrico. La inhibición de la xantina oxidasa en pacientes que reciben alopurinol (ZYLOPRIM®) es la base para la reducción de la dosis de azatioprina requerida en estos pacientes (ver PRECAUCIONES : INTERACCIONES CON LA DROGAS ). Las proporciones de los metabolitos son diferentes en pacientes individuales y esto presumiblemente explica la variable magnitud y duración de los efectos del fármaco. El aclaramiento renal probablemente no sea importante para predecir la eficacia biológica o las toxicidades, aunque se practica la reducción de la dosis en pacientes con función renal deficiente.
Supervivencia del homoinjerto
El uso de azatioprina para la inhibición del rechazo del homoinjerto renal está bien establecido, los mecanismos para esta acción son algo oscuros. El fármaco suprime las hipersensibilidades de tipo mediado por células y provoca alteraciones variables en la producción de anticuerpos. La supresión de los efectos de las células T, incluida la ablación de la supresión de las células T, depende de la relación temporal con el estímulo antigénico o el injerto. Este agente tiene poco efecto sobre los rechazos de injertos establecidos o las respuestas secundarias.
Las alteraciones en las respuestas inmunitarias específicas o las funciones inmunológicas en los receptores de trasplantes son difíciles de relacionar específicamente con la inmunosupresión por azatioprina. Estos pacientes tienen respuestas subnormales a las vacunas, bajos números de células T y fagocitosis anormal por parte de las células sanguíneas periféricas, pero sus respuestas mitogénicas, inmunoglobulinas séricas y respuestas secundarias de anticuerpos suelen ser normales.
Respuesta inmunoinflamatoria
La azatioprina suprime las manifestaciones de la enfermedad, así como la patología subyacente en modelos animales de enfermedades autoinmunes. Por ejemplo, la azatioprina reduce la gravedad de la artritis adyuvante.
No se conocen los mecanismos por los que la azatioprina afecta a las enfermedades autoinmunes. La azatioprina es inmunosupresora, la hipersensibilidad retardada y las pruebas de citotoxicidad celular se suprimen en mayor grado que las respuestas de anticuerpos. En el modelo de rata de artritis adyuvante, se ha demostrado que la azatioprina inhibe la hiperplasia de los ganglios linfáticos, que precede a la aparición de los signos de la enfermedad. Tanto los efectos inmunosupresores como los terapéuticos en modelos animales están relacionados con la dosis. La azatioprina se considera un fármaco de acción lenta y los efectos pueden persistir después de suspender el fármaco.
REFERENCIAS @sesenta y cinco. Lennard L. La farmacología clínica de 6-mercaptopurina. Eur J Clin Pharmacol. 1992; 43:329-339. @sesenta y cinco. Weinshilboum R. Farmacogenética de la tiopurina: estudios clínicos y moleculares de la tiopurina metiltransferasa. Eliminación de metab de drogas. 2001;29:601-605. @sesenta y cinco. McLeod HL, Siva C. El locus del gen de la tiopurina S-metiltransferasa: implicaciones para la farmacogenómica clínica. Farmacogenómica. 2002;3:89-98. @sesenta y cinco. Anstey A, Lennard L, Mayou SC, et al. Pancitopenia relacionada con azatioprina: una deficiencia enzimática causada por un polimorfismo genético común: una revisión. JR Soc Med. 1992; 85:752-756. @sesenta y cinco. Stolk JN, Beorbooms AM, de Abreu RA, et al. Reducción de la actividad de la tiopurina metiltransferasa y desarrollo de efectos secundarios del tratamiento con azatioprina en pacientes con artritis reumatoide. Artritis Rheum. 1998; 41:18581866. @sesenta y cinco. Datos en archivo, Prometheus Laboratories Inc. @sesenta y cinco. Yates CR, Krynetski EY, Loennechen T, et al. Diagnóstico molecular de la deficiencia de tiopurina S-metiltransferasa: base genética para la intolerancia a la azatioprina y la mercaptopurina. Ann Intern Med. 1997; 126:608-614. @sesenta y cinco. Black AJ, McLeod HL, Capell HA, et al. El genotipo de la tiopurina metiltransferasa predice la toxicidad grave de la azatioprina que limita el tratamiento. Ann Intern Med. 1998; 129:716-718. @sesenta y cinco. Clunie GP, Lennard L. Relevancia del estado de tiopurina metiltransferasa en pacientes reumatológicos que reciben azatioprina. Reumatología. 2004; 43:13-18.INFORMACIÓN DEL PACIENTE
Se debe informar a los pacientes que comienzan con IMURAN de la necesidad de realizar hemogramas periódicos mientras reciben el medicamento y se les debe recomendar que informen a su médico sobre cualquier sangrado o hematoma inusual. Se les debe informar sobre el peligro de infección mientras reciben IMURAN y se les debe pedir que informen los signos y síntomas de infección a su médico. Se deben dar instrucciones detalladas de dosificación al paciente, especialmente cuando se administra IMURAN en presencia de función renal alterada o concomitantemente con alopurinol (ver INTERACCIONES CON LA DROGAS subsección y DOSIFICACIÓN Y ADMINISTRACIÓN ). Se debe advertir a los pacientes sobre los riesgos potenciales del uso de IMURAN 50 mg durante el embarazo y durante el período de lactancia. Se debe explicar al paciente el aumento del riesgo de malignidad después del tratamiento con IMURAN.
