Maxalt 5mg, 10mg Rizatriptan Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Maxalt y cómo se usa?
Maxalt es un medicamento recetado que se usa para tratar los síntomas de la migraña. Maxalt 10 mg se puede usar solo o con otros medicamentos.
Maxalt pertenece a una clase de medicamentos llamados agonistas del receptor de serotonina 5-HT; Agentes Antimigraña.
No se sabe si Maxalt 5 mg es seguro y efectivo en niños menores de 6 años.
¿Cuáles son los posibles efectos secundarios de Maxalt?
Maxalt puede causar efectos secundarios graves que incluyen:
- dolor de estómago repentino y severo,
- diarrea con sangre,
- sensación de frío,
- entumecimiento en los pies y las manos,
- dolor de cabeza intenso,
- visión borrosa,
- latidos en el cuello o las orejas,
- dolor o presión en el pecho,
- dolor que se extiende a la mandíbula o al hombro,
- náuseas,
- transpiración,
- agitación,
- alucinaciones,
- fiebre,
- temblando,
- frecuencia cardíaca rápida,
- rigidez muscular,
- retorciéndose,
- pérdida de coordinación,
- náuseas,
- pérdida de coordinación,
- vómitos,
- Diarrea,
- entumecimiento o debilidad repentinos (especialmente en un lado del cuerpo),
- dolor de cabeza repentino e intenso,
- dificultad para hablar y
- problemas con la visión o el equilibrio
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Maxalt incluyen:
- mareo,
- somnolencia,
- sentirse cansado, y
- dolor o sensación de presión en la garganta o el pecho
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Maxalt. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
MAXALT 10 mg contiene benzoato de rizatriptán, un agonista selectivo del receptor 5-hidroxitriptamina 1B/1D (5-HT1B/1D).
El benzoato de rizatriptán se describe químicamente como: monobenzoato de N,N-dimetil-5-(1H-1,2,4-triazol-1-ilmetil)-1Hindole-3-etanamina y su fórmula estructural es:
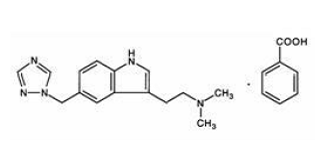
Su fórmula empírica es C15H19N5•C7H6O2, lo que representa un peso molecular de la base libre de 269,4. El benzoato de rizatriptán es un sólido cristalino de color blanco a blanquecino que es soluble en agua a aproximadamente 42 mg por ml (expresado como base libre) a 25 °C.
MAXALT 5mg Tablets y MAXALT-MLT Orally Disintegrating Tablets están disponibles para administración oral en concentraciones de 5 y 10 mg (que corresponden a 7,265 mg o 14,53 mg de la sal de benzoato, respectivamente). Cada tableta comprimida contiene los siguientes ingredientes inactivos: lactosa monohidrato, celulosa microcristalina, almidón pregelatinizado, óxido férrico (rojo) y estearato de magnesio. Cada tableta liofilizada de desintegración oral contiene los siguientes ingredientes inactivos: gelatina, manitol, glicina, aspartamo y sabor a menta.
INDICACIONES
MAXALT® y MAXALT-MLT® están indicados para el tratamiento agudo de la migraña con o sin aura en adultos y en pacientes pediátricos de 6 a 17 años.
Limitaciones de uso
- MAXALT solo debe usarse cuando se haya establecido un diagnóstico claro de migraña. Si un paciente no responde al primer ataque de migraña tratado con MAXALT 10 mg, se debe reconsiderar el diagnóstico de migraña antes de administrar MAXALT 5 mg para tratar cualquier ataque posterior.
- MAXALT 10 mg no está indicado para el tratamiento de la migraña hemipléjica o basilar [ver CONTRAINDICACIONES ].
- MAXALT 10 mg no está indicado para la prevención de los ataques de migraña.
- No se ha establecido la seguridad y eficacia de MAXALT 5 mg para la cefalea en brotes.
DOSIFICACIÓN Y ADMINISTRACIÓN
Información de dosificación en adultos
La dosis inicial recomendada de MAXALT es de 5 mg o 10 mg para el tratamiento agudo de las migrañas en adultos. La dosis de 10 mg puede proporcionar un mayor efecto que la dosis de 5 mg, pero puede tener un mayor riesgo de reacciones adversas [ver Estudios clínicos ].
Redosificación en adultos
Aunque la eficacia de una segunda dosis o dosis posteriores no se ha establecido en ensayos controlados con placebo, si la migraña regresa, se puede administrar una segunda dosis 2 horas después de la primera dosis. La dosis diaria máxima no debe exceder los 30 mg en un período de 24 horas. No se ha establecido la seguridad de tratar, en promedio, más de cuatro dolores de cabeza en un período de 30 días.
Información de dosificación en pacientes pediátricos (de 6 a 17 años de edad)
La dosificación en pacientes pediátricos se basa en el peso corporal del paciente. La dosis recomendada de MAXALT 10 mg es de 5 mg en pacientes que pesan menos de 40 kg (88 lb) y de 10 mg en pacientes que pesan 40 kg (88 lb) o más.
No se ha establecido la eficacia y seguridad del tratamiento con más de una dosis de MAXALT dentro de las 24 horas en pacientes pediátricos de 6 a 17 años de edad.
Administración de tabletas de desintegración oral MAXALT-MLT
Para las tabletas de desintegración oral de MAXALT-MLT, no es necesaria la administración con líquido. Los comprimidos de desintegración oral se envasan en un blíster dentro de una bolsa exterior de aluminio y los pacientes no deben sacar el blíster de la bolsa exterior hasta justo antes de la dosificación. A continuación, se debe abrir el blíster con las manos secas y colocar la tableta de desintegración oral en la lengua, donde se disolverá y se tragará con la saliva.
Ajuste de dosis para pacientes con propranolol
Pacientes adultos
En pacientes adultos que toman propranolol, solo se recomienda la dosis de 5 mg de MAXALT 5 mg, hasta un máximo de 3 dosis en cualquier período de 24 horas (15 mg) [ver INTERACCIONES CON LA DROGAS y FARMACOLOGÍA CLÍNICA ].
Pacientes pediátricos
Para pacientes pediátricos que pesen 40 kg (88 lb) o más y tomen propranolol, se recomienda solo una dosis única de 5 mg de MAXALT (dosis máxima de 5 mg en un período de 24 horas). MAXALT no debe recetarse a pacientes pediátricos tratados con propranolol que pesan menos de 40 kg (88 lb) [ver INTERACCIONES CON LA DROGAS y FARMACOLOGÍA CLÍNICA ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Tabletas MAXALT
- Los comprimidos de 5 mg son comprimidos de color rosa pálido, en forma de cápsula, codificados MRK en un lado y 266 en el otro.
- Los comprimidos de 10 mg son comprimidos de color rosa pálido, en forma de cápsula, codificados MAXALT 5 mg en un lado y MRK 267 en el otro.
MAXALT-MLT Tabletas de desintegración oral
- Los comprimidos de desintegración oral de 5 mg son comprimidos liofilizados redondos de color blanco a blanquecino grabados con un triángulo modificado en un lado.
- Los comprimidos de desintegración oral de 10 mg son comprimidos liofilizados redondos de color blanco a blanquecino grabados con un cuadrado modificado en un lado.
Almacenamiento y manipulación
No. 3732 - MAXALT Comprimidos, 5 mg , son comprimidos comprimidos de color rosa pálido, con forma de cápsula, codificados
MRK por un lado y 266 por el otro:
CDN 0006-0266-18, caja de 18 comprimidos.
No. 3733 - MAXALT 5mg Comprimidos, 10 mg , son comprimidos comprimidos de color rosa pálido, en forma de cápsula, codificados MAXALT 10 mg por un lado y MRK 267 por el otro:
CDN 0006-0267-18, caja de 18 comprimidos.
No. 3800 - MAXALT-MLT Tabletas de desintegración oral, 5 mg son comprimidos de desintegración oral, liofilizados, redondos, de color blanco a blanquecino, grabados con un triángulo modificado en un lado y que miden 10,0-11,5 mm (de lado a lado) con sabor a menta. Cada comprimido de desintegración oral se envasa individualmente en un blíster dentro de una bolsa de aluminio (sobre). Se suministran de la siguiente manera:
CDN 0006-3800-18, 6 x unidad de uso Estuche de transporte de 3 comprimidos de desintegración oral (18 comprimidos en total).
No. 3801 - MAXALT-MLT Tabletas de desintegración oral, 10 mg , son comprimidos de desintegración oral, liofilizados, redondos, de color blanco a blanquecino, grabados con un cuadrado modificado en un lado y que miden 12,0-13,8 mm (de lado a lado) con sabor a menta. Cada comprimido de desintegración oral se envasa individualmente en un blíster dentro de una bolsa de aluminio (sobre). Se suministran de la siguiente manera:
CDN 0006-3801-18, 6 x unidad de uso estuche de transporte de 3 tabletas de desintegración oral (18 tabletas en total).
Almacenamiento
Guarde las tabletas de 5 mg de MAXALT a temperatura ambiente, entre 15 °C y 30 °C (59 °F y 86 °F).
Guarde las tabletas de desintegración oral MAXALT-MLT a temperatura ambiente, entre 15 °C y 30 °C (59 °F y 86 °F).
Distribuido por: Merck Sharp & Dohme Corp., una subsidiaria de MERCK & CO.,INC., Whitehouse Station, NJ 08889, EE. UU. Revisado: octubre de 2019
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas se analizan con más detalle en otras secciones de la etiqueta:
- Isquemia miocárdica, infarto de miocardio y angina de Prinzmetal [ver ADVERTENCIAS Y PRECAUCIONES ].
- Arritmias [ver ADVERTENCIAS Y PRECAUCIONES ].
- Dolor/opresión/presión en el pecho, garganta, cuello y/o mandíbula [ver ADVERTENCIAS Y PRECAUCIONES ].
- Eventos cerebrovasculares [ver ADVERTENCIAS Y PRECAUCIONES ].
- Otras reacciones de vasoespasmo [ver ADVERTENCIAS Y PRECAUCIONES ].
- Dolor de cabeza por uso excesivo de medicamentos [ver ADVERTENCIAS Y PRECAUCIONES ].
- Síndrome serotoninérgico [ver ADVERTENCIAS Y PRECAUCIONES ].
- Aumento de la presión arterial [ver ADVERTENCIAS Y PRECAUCIONES ].
Experiencia en ensayos clínicos
Debido a que los estudios clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los estudios clínicos de un fármaco no pueden compararse directamente con las tasas de los estudios clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Adultos
Incidencia en Ensayos Clínicos Controlados
Las reacciones adversas a MAXALT se evaluaron en ensayos clínicos controlados que incluyeron a más de 3700 pacientes adultos que recibieron dosis únicas o múltiples de MAXALT Tabletas. Las reacciones adversas más comunes durante el tratamiento con MAXALT (≥5 % en cualquiera de los grupos de tratamiento y mayores que el placebo) fueron astenia/fatiga, somnolencia, dolor/sensación de presión y mareos. Estas reacciones adversas parecían estar relacionadas con la dosis.
La Tabla 1 enumera las reacciones adversas (incidencia ≥2% y mayor que el placebo) después de una dosis única de 5 mg de MAXALT en adultos.
Las frecuencias de reacciones adversas en los ensayos clínicos no aumentaron cuando se tomaron hasta tres dosis en 24 horas. Las frecuencias de las reacciones adversas tampoco cambiaron con el uso concomitante de medicamentos comúnmente tomados para la profilaxis de la migraña (incluido el propranolol), anticonceptivos orales o analgésicos. La incidencia de reacciones adversas no se vio afectada por la edad o el género. No hubo datos suficientes para evaluar el impacto de la raza en la incidencia de reacciones adversas.
Otros eventos observados en asociación con la administración de MAXALT en adultos
En la siguiente sección, se presentan las frecuencias de los eventos adversos informados con menos frecuencia que no se informaron en otras secciones de la etiqueta. Debido a que los informes incluyen eventos observados en estudios abiertos, no se puede determinar de manera confiable el papel de MAXALT 5 mg en su causalidad. Además, la variabilidad asociada con la notificación de eventos adversos, la terminología utilizada para describir los eventos adversos, limita el valor de las estimaciones cuantitativas de frecuencia proporcionadas. Las frecuencias de eventos se calculan como el número de pacientes que usaron MAXALT y reportaron un evento dividido por el número total de pacientes expuestos a MAXALT (N=3716). Todos los eventos informados ocurrieron con una incidencia ≥1%, o se cree que están razonablemente asociados con el uso de la droga. Los eventos se clasifican además dentro de categorías de sistemas corporales y se enumeran en orden decreciente de frecuencia utilizando las siguientes definiciones: los eventos adversos frecuentes son aquellos definidos como aquellos que ocurren en al menos (>) 1/100 pacientes; las experiencias adversas poco frecuentes son las que ocurren en 1/100 a 1/1000 pacientes; y las experiencias adversas raras son aquellas que ocurren en menos de 1/1000 pacientes.
General: Infrecuente fue el edema facial. Raros fueron síncope y edema/hinchazón.
Sensaciones atípicas: Eran frecuentes las sensaciones cálidas.
Cardiovascular: Frecuente era la palpitación. Infrecuentes fueron taquicardia, extremidades frías y bradicardia.
Digestivo: Frecuentes fueron diarrea y vómitos. Infrecuentes fueron dispepsia, edema lingual y distensión abdominal.
Musculoesquelético: Infrecuentes fueron debilidad muscular, rigidez, mialgia y calambres/espasmos musculares.
Neurológico/Psiquiátrico: Frecuentes fueron hipoestesia, euforia y temblor. Infrecuentes fueron vértigo, insomnio, confusión/desorientación, anomalías en la marcha, deterioro de la memoria y agitación.
Respiratorio: Frecuente fue la disnea. Infrecuente fue el edema faríngeo.
Sentidos especiales: Infrecuentes fueron visión borrosa y tinnitus. Raro fue la hinchazón de los ojos.
Piel y apéndice de la piel: Frecuente estaba enrojeciendo. Infrecuentes fueron sudoración, prurito, exantema y urticaria. Raro fue el eritema, los sofocos.
El perfil de reacciones adversas observado con MAXALT-MLT en tabletas de desintegración oral fue similar al observado con MAXALT en tabletas de 10 mg.
Pacientes pediátricos de 6 a 17 años de edad
Incidencia en Ensayos Clínicos Controlados en Pacientes Pediátricos
Las reacciones adversas a MAXALT-MLT se evaluaron en un ensayo clínico controlado en el tratamiento agudo de la migraña (Estudio 7) que incluyó un total de 1382 pacientes pediátricos de 6 a 17 años de edad, de los cuales 977 (72%) recibieron al menos una dosis del tratamiento del estudio (MAXALT-MLT y/o placebo) [ver Estudios clínicos ]. La incidencia de reacciones adversas notificadas en pacientes pediátricos en el ensayo clínico agudo fue similar en los pacientes que recibieron MAXALT que en los que recibieron placebo. Se espera que el patrón de reacciones adversas en pacientes pediátricos sea similar al de los adultos.
Otros eventos observados en asociación con la administración de MAXALT-MLT en pacientes pediátricos
En la siguiente sección, se presentan las frecuencias de los eventos adversos informados con menos frecuencia. Debido a que los informes incluyen eventos observados en estudios abiertos, el papel de MAXALT-MLT en su causalidad no se puede determinar de manera confiable. Además, la variabilidad asociada con la notificación de eventos adversos, la terminología utilizada para describir los eventos adversos, limita el valor de las estimaciones cuantitativas de frecuencia proporcionadas.
Las frecuencias de eventos se calculan como el número de pacientes pediátricos de 6 a 17 años de edad que usaron MAXALT-MLT y reportaron un evento dividido por el número total de pacientes expuestos a MAXALT-MLT (N=1068). Todos los eventos informados ocurrieron con una incidencia ≥1%, o se cree que están razonablemente asociados con el uso de la droga. Los eventos se clasifican además dentro de la clasificación de órganos y sistemas y se enumeran en orden de frecuencia decreciente utilizando las siguientes definiciones: los eventos adversos frecuentes son aquellos que ocurren en (>) 1/100 pacientes pediátricos; las experiencias adversas poco frecuentes son las que ocurren en 1/100 a 1/1000 pacientes pediátricos; y las experiencias adversas raras son aquellas que ocurren en menos de 1/1000 pacientes.
General: Frecuente era la fatiga.
Trastornos del oído y del laberinto: Infrecuente fue la hipoacusia.
Desórdenes gastrointestinales: Frecuente fue el malestar abdominal.
Trastornos del sistema nervioso: Fueron poco frecuentes la coordinación anormal, la alteración de la atención y el presíncope.
Desórdenes psiquiátricos: Infrecuente fue la alucinación.
Experiencia posterior a la comercialización
La siguiente sección enumera eventos adversos potencialmente importantes que han ocurrido en la práctica clínica y que han sido informados espontáneamente a varios sistemas de vigilancia. Los eventos enumerados incluyen todos excepto aquellos ya enumerados en otras secciones del etiquetado o aquellos demasiado generales para ser informativos. Debido a que los informes citan eventos informados espontáneamente a partir de la experiencia posterior a la comercialización en todo el mundo, la frecuencia de los eventos y el papel de MAXALT 5 mg en su causalidad no se pueden determinar de manera confiable.
Neurológico/Psiquiátrico: Embargo.
General: Condiciones alérgicas que incluyen anafilaxia/reacción anafilactoide, angioedema, sibilancias y necrólisis epidérmica tóxica [ver CONTRAINDICACIONES ].
Sentidos especiales: Disgeusia.
INTERACCIONES CON LA DROGAS
propranolol
La dosis de MAXALT 5 mg debe ajustarse en pacientes tratados con propranolol, ya que se ha demostrado que propranolol aumenta el AUC plasmático de rizatriptán en un 70 % [ver DOSIFICACIÓN Y ADMINISTRACIÓN y FARMACOLOGÍA CLÍNICA ].
Medicamentos que contienen cornezuelo
Se ha informado que los medicamentos que contienen cornezuelo de centeno causan reacciones vasoespásticas prolongadas. Debido a que estos efectos pueden ser aditivos, está contraindicado el uso de medicamentos que contienen ergotamina o del tipo ergot (como dihidroergotamina o metisergida) y MAXALT 5 mg dentro de las 24 horas [ver CONTRAINDICACIONES ].
Otros agonistas de 5-HT1
Debido a que sus efectos vasoespásticos pueden ser aditivos, está contraindicada la administración conjunta de 10 mg de MAXALT y otros agonistas 5-HT1 dentro de las 24 horas [ver CONTRAINDICACIONES ].
ISRS/IRSN y síndrome serotoninérgico
Se han notificado casos de síndrome serotoninérgico durante la coadministración de triptanos e inhibidores selectivos de la recaptación de serotonina (ISRS) o inhibidores de la recaptación de serotonina y norepinefrina (IRSN) [ver ADVERTENCIAS Y PRECAUCIONES ].
Inhibidores de la monoaminooxidasa
MAXALT está contraindicado en pacientes que toman inhibidores de la MAO-A e inhibidores de la MAO no selectivos. Un inhibidor de la MAO-A específico aumentó la exposición sistémica de rizatriptán y su metabolito [ver CONTRAINDICACIONES y FARMACOLOGÍA CLÍNICA ].
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Isquemia miocárdica, infarto de miocardio y angina de Prinzmetal
MAXALT no debe administrarse a pacientes con enfermedad arterial coronaria isquémica o vasoespástica. Ha habido informes raros de reacciones adversas cardíacas graves, incluido infarto agudo de miocardio, que ocurrieron pocas horas después de la administración de MAXALT. Algunas de estas reacciones ocurrieron en pacientes sin enfermedad de las arterias coronarias (EAC) conocida. Los agonistas de 5-HT1, incluido MAXALT 5 mg, pueden causar vasoespasmo de la arteria coronaria (angina de Prinzmetal), incluso en pacientes sin antecedentes de CAD.
Los pacientes que no han recibido tratamiento previo con triptán que tienen múltiples factores de riesgo cardiovascular (p. ej., edad avanzada, diabetes, hipertensión, tabaquismo, obesidad, antecedentes familiares importantes de CAD) deben someterse a una evaluación cardiovascular antes de recibir MAXALT. Si hay evidencia de CAD o vasoespasmo de la arteria coronaria, no se debe administrar MAXALT [ver CONTRAINDICACIONES ]. Para los pacientes que tienen una evaluación cardiovascular negativa, se debe considerar la administración de la primera dosis de MAXALT en un entorno supervisado por un médico y la realización de un electrocardiograma (ECG) inmediatamente después de la administración de 10 mg de MAXALT. Se debe considerar la evaluación cardiovascular periódica en usuarios intermitentes a largo plazo de MAXALT que tienen factores de riesgo cardiovascular.
Arritmias
Se han notificado alteraciones del ritmo cardíaco potencialmente mortales, incluidas taquicardia ventricular y fibrilación ventricular que conducen a la muerte, pocas horas después de la administración de agonistas 5-HT1. Descontinúe MAXALT 10 mg si ocurren estas alteraciones.
Pecho, garganta, cuello y/o dolor de mandíbula/opresión/presión
Al igual que con otros agonistas de 5-HT1, las sensaciones de tirantez, dolor, presión y pesadez en el precordio, la garganta, el cuello y la mandíbula ocurren comúnmente después del tratamiento con MAXALT 5 mg y generalmente no son de origen cardíaco. Sin embargo, si se sospecha un origen cardíaco, los pacientes deben ser evaluados. Los pacientes que muestran CAD y aquellos con angina variante de Prinzmetal no deben recibir agonistas 5-HT1.
Eventos cerebrovasculares
Se han producido hemorragia cerebral, hemorragia subaracnoidea y accidente cerebrovascular en pacientes tratados con agonistas de 5-HT1, y algunos han resultado en muertes. En varios casos, parece posible que los eventos cerebrovasculares fueran primarios, habiéndose administrado el agonista 5-HT1 con la creencia incorrecta de que los síntomas experimentados eran consecuencia de la migraña, cuando no lo eran. Además, los pacientes con migraña pueden tener un mayor riesgo de ciertos eventos cerebrovasculares (p. ej., accidente cerebrovascular, hemorragia, ataque isquémico transitorio). Suspenda MAXALT si ocurre un evento cerebrovascular.
Al igual que con otras terapias para la migraña aguda, antes de tratar los dolores de cabeza en pacientes que no hayan sido diagnosticados previamente como migrañosos y en los migrañosos que presenten síntomas atípicos, se debe tener cuidado para excluir otras afecciones neurológicas potencialmente graves. MAXALT no debe administrarse a pacientes con antecedentes de accidente cerebrovascular o accidente isquémico transitorio [ver CONTRAINDICACIONES ].
Otras reacciones de vasoespasmo
Los agonistas de 5-HT1, incluido MAXALT, pueden causar reacciones vasoespásticas no coronarias, como isquemia vascular periférica, isquemia vascular gastrointestinal e infarto (que se presenta con dolor abdominal y diarrea sanguinolenta), infarto esplénico y síndrome de Raynaud. En pacientes que experimenten síntomas o signos que sugieran una reacción de vasoespasmo no coronario luego del uso de cualquier agonista 5-HT1, se debe descartar la sospecha de reacción de vasoespasmo antes de recibir dosis adicionales de 10 mg de MAXALT.
Se han informado informes de ceguera transitoria y permanente y pérdida de visión parcial significativa con el uso de agonistas 5-HT1. Dado que los trastornos visuales pueden ser parte de un ataque de migraña, no se ha establecido claramente una relación causal entre estos eventos y el uso de agonistas 5-HT1.
Dolor de cabeza por uso excesivo de medicamentos
El uso excesivo de medicamentos para la migraña aguda (p. ej., ergotamina, triptanos, opioides o una combinación de medicamentos durante 10 o más días al mes) puede provocar la exacerbación del dolor de cabeza (cefalea por uso excesivo de medicamentos). El dolor de cabeza por uso excesivo de medicamentos puede presentarse como dolores de cabeza diarios similares a la migraña, o como un marcado aumento en la frecuencia de los ataques de migraña. Puede ser necesaria la desintoxicación de los pacientes, incluida la retirada de los fármacos usados en exceso, y el tratamiento de los síntomas de abstinencia (que a menudo incluye un empeoramiento transitorio del dolor de cabeza).
Síndrome de serotonina
El síndrome serotoninérgico puede ocurrir con triptanes, incluido MAXALT 10 mg, particularmente durante la administración conjunta con inhibidores selectivos de la recaptación de serotonina (ISRS), inhibidores de la recaptación de serotonina y norepinefrina (IRSN), antidepresivos tricíclicos (TCA) e inhibidores de la MAO [ver INTERACCIONES CON LA DROGAS ]. Los síntomas del síndrome serotoninérgico pueden incluir cambios en el estado mental (p. ej., agitación, alucinaciones, coma), inestabilidad autonómica (p. ej., taquicardia, presión arterial lábil, hipertermia), aberraciones neuromusculares (p. ej., hiperreflexia, falta de coordinación) y/o síntomas gastrointestinales (p. ej., náuseas , vómitos, diarrea). El inicio de los síntomas puede ocurrir de minutos a horas después de recibir una dosis nueva o mayor de un medicamento serotoninérgico. El tratamiento con MAXALT debe interrumpirse si se sospecha síndrome serotoninérgico [ver INTERACCIONES CON LA DROGAS y INFORMACIÓN DEL PACIENTE ].
Aumento de la presión arterial
En raras ocasiones, se ha informado un aumento significativo de la presión arterial, incluida una crisis hipertensiva con deterioro agudo de los sistemas orgánicos, en pacientes con y sin antecedentes de hipertensión que reciben agonistas de 5-HT1, incluido MAXALT. En pacientes adultos jóvenes sanos, hombres y mujeres, que recibieron dosis máximas de MAXALT (10 mg cada 2 horas durante 3 dosis), se observaron ligeros aumentos en la presión arterial (aproximadamente 2-3 mmHg). MAXALT está contraindicado en pacientes con hipertensión no controlada [ver CONTRAINDICACIONES ].
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( INFORMACIÓN DEL PACIENTE ).
Riesgo de isquemia y/o infarto de miocardio, angina de Prinzmetal, otros eventos relacionados con vasoespasmo y eventos cerebrovasculares
Informe a los pacientes que MAXALT puede causar efectos secundarios cardiovasculares graves, como infarto de miocardio o accidente cerebrovascular. Aunque los eventos cardiovasculares graves pueden ocurrir sin síntomas de advertencia, los pacientes deben estar atentos a los signos y síntomas de dolor en el pecho, dificultad para respirar, debilidad, dificultad para hablar, y deben consultar a un médico cuando observen cualquier signo o síntoma indicativo. Los pacientes deben ser informados de la importancia de este seguimiento [ver ADVERTENCIAS Y PRECAUCIONES ].
Síndrome de serotonina
Se debe advertir a los pacientes sobre el riesgo de síndrome serotoninérgico con el uso de MAXALT 10 mg u otros triptanos, particularmente durante el uso combinado con inhibidores selectivos de la recaptación de serotonina (ISRS) o inhibidores de la recaptación de serotonina y norepinefrina (IRSN) [ver ADVERTENCIAS Y PRECAUCIONES , INTERACCIONES CON LA DROGAS , y FARMACOLOGÍA CLÍNICA ].
El embarazo
Informe a las pacientes que MAXALT no debe usarse durante el embarazo a menos que el beneficio potencial justifique el riesgo potencial para el feto [ver Uso en poblaciones específicas ].
Lactancia
Aconseje a los pacientes que notifiquen a su proveedor de atención médica si están amamantando o planean amamantar [ver Uso en poblaciones específicas ].
Capacidad para realizar tareas complejas
Dado que las migrañas o el tratamiento con MAXALT 10 mg pueden causar somnolencia y mareos, indique a los pacientes que evalúen su capacidad para realizar tareas complejas durante los ataques de migraña y después de la administración de MAXALT.
Dolor de cabeza por uso excesivo de medicamentos
Informe a los pacientes que el uso de medicamentos para la migraña aguda durante 10 o más días al mes puede provocar una exacerbación del dolor de cabeza, y anímelos a registrar la frecuencia del dolor de cabeza y el uso de medicamentos (por ejemplo, manteniendo un diario de dolor de cabeza) [ver ADVERTENCIAS Y PRECAUCIONES ].
Manejo de paquetes de tabletas de desintegración oral
Indique a los pacientes que no retiren el blíster de la bolsa exterior de aluminio hasta que estén listos para usar la tableta de desintegración oral que se encuentra en el interior [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Pacientes con Fenilcetonuria
Informe a los pacientes fenilcetonúricos que las tabletas de desintegración oral MAXALT-MLT contienen fenilalanina (un componente del aspartamo). Cada comprimido de desintegración oral de 5 mg contiene 1,1 mg de fenilalanina y cada comprimido de desintegración oral de 10 mg contiene 2,1 mg de fenilalanina [ver Uso en poblaciones específicas ].
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Carcinogénesis
Se realizaron estudios de carcinogenicidad oral de rizatriptán en ratones (100 semanas) y ratas (106 semanas) a dosis de hasta 125 mg/kg/día. No hubo evidencia de un aumento en la incidencia de tumores relacionados con rizatriptán en ninguna de las especies. Las exposiciones plasmáticas (AUC) a la dosis más alta probada fueron aproximadamente 150 (ratones) y 240 veces (ratas) que en humanos con la dosis humana máxima recomendada (MRHD) de 30 mg/día.
mutagénesis
El rizatriptán no fue ni mutagénico ni clastogénico en una serie de estudios de toxicidad genética in vitro e in vivo, que incluyen: el ensayo de mutagénesis microbiana (Ames), ensayos de aberración cromosómica y mutagénesis de células de mamíferos in vitro, y el ensayo de aberración cromosómica in vivo en ratones.
Deterioro de la fertilidad
La administración oral de rizatriptán (0, 2, 10 o 100 mg/kg/día) a ratas hembra antes y durante el apareamiento y durante la gestación y la lactancia no produjo efectos sobre la fertilidad; sin embargo, se observaron cambios en la ciclicidad del estro y retrasos en el tiempo hasta el apareamiento con la dosis más alta probada. La exposición plasmática a la dosis sin efecto (10 mg/kg/día) para la toxicidad reproductiva fue aproximadamente 15 veces mayor que en humanos con la MRHD.
La administración oral de rizatriptán (0, 5, 35 o 250 mg/kg/día) a ratas macho antes y durante el apareamiento no resultó en deterioro de la fertilidad o el rendimiento reproductivo. La exposición plasmática (AUC) a la dosis más alta probada fue aproximadamente 550 veces mayor que en humanos en la MRHD.
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
Los datos humanos disponibles sobre el uso de MAXALT en mujeres embarazadas no son suficientes para sacar conclusiones sobre el riesgo asociado con el fármaco de anomalías congénitas graves y abortos espontáneos.
En estudios con animales, se observó toxicidad en el desarrollo después de la administración oral de rizatriptán durante el embarazo (disminución del peso corporal fetal en ratas) o durante el embarazo y la lactancia (aumento de la mortalidad, disminución del peso corporal y deterioro neuroconductual en las crías de ratas) con exposiciones plasmáticas maternas superiores a las esperado a dosis terapéuticas en humanos [ver Datos de animales ].
En la población general de los EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y de aborto espontáneo en embarazos reconocidos clínicamente es del 2 % al 4 % y del 15 % al 20 %, respectivamente. La tasa informada de defectos congénitos importantes entre los partos de mujeres con migraña oscila entre el 2,2 % y el 2,9 % y la tasa informada de aborto espontáneo fue del 17 %, que son similares a las tasas informadas en mujeres sin migraña.
Consideraciones clínicas
Riesgo materno y/o embrionario/fetal asociado a la enfermedad
En las mujeres con migraña, existe un mayor riesgo de resultados perinatales adversos en la madre, incluidas la preeclampsia y la hipertensión gestacional.
Datos
Datos humanos
El Registro de Embarazo de MAXALT no identificó ningún patrón de anomalías congénitas u otros resultados de nacimiento adversos durante el período de 1998 a 2018. Sin embargo, la falta de identificación de cualquier patrón debe verse con cautela, ya que la cantidad de informes prospectivos con información de resultados fue bajo y no proporcionó suficiente poder para detectar un mayor riesgo de defectos congénitos individuales asociados con el uso de MAXALT. Además, hubo pérdidas significativas durante el seguimiento en los informes de embarazos prospectivos, lo que complicó aún más esta evaluación de una asociación entre MAXALT y cualquier patrón de anomalías congénitas u otros resultados adversos del parto.
En un estudio que utilizó datos del Registro Médico Sueco de Nacimientos, se compararon los nacidos vivos de mujeres que informaron haber usado triptanes o ergot durante el embarazo con los de mujeres que no lo hicieron. De los 157 nacimientos con exposición a rizatriptán en el primer trimestre, 7 bebés nacieron con malformaciones (riesgo relativo 1,01 [IC 95%: 0,40 a 2,08]). Un estudio que utilizó datos vinculados del Registro Médico de Nacimientos de Noruega con la base de datos de prescripciones de Noruega comparó los resultados del embarazo en mujeres que canjearon recetas de triptanes durante el embarazo, así como un grupo de comparación de enfermedades de migraña que canjeó recetas de triptanes antes del embarazo solamente, en comparación con un grupo de control de la población. De las 310 mujeres que canjearon recetas de rizatriptán durante el primer trimestre, 10 tuvieron bebés con malformaciones congénitas importantes (OR 1,03 [IC 95 %: 0,55 a 1,93]), mientras que de las 271 mujeres que canjearon recetas de rizatriptán antes, pero no durante , embarazo, 12 tenían bebés con malformaciones congénitas importantes (OR 1,48 [IC 95 %: 0,83 a 2,64]), cada uno en comparación con el grupo de comparación de la población.
Datos de animales
Cuando se administró rizatriptán (0, 2, 10 ó 100 mg/kg/día) por vía oral a ratas preñadas durante la organogénesis, se observó una disminución en el peso corporal fetal a las dosis más altas probadas. A la dosis media (10 mg/kg/día), que era una dosis sin efecto para los efectos adversos sobre el desarrollo embriofetal, la exposición plasmática (AUC) fue aproximadamente 15 veces mayor que en humanos con la dosis humana máxima recomendada (MRHD) de 30 mg/día. Cuando se administró rizatriptán (0, 5, 10 o 50 mg/kg/día) por vía oral a conejas preñadas durante la organogénesis, no se observaron efectos fetales adversos. La exposición plasmática (AUC) a la dosis más alta probada fue 115 veces mayor que en humanos en la MRHD. En ambas especies se demostró la transferencia placentaria del fármaco al feto.
La administración oral de rizatriptán (0, 2, 10 o 100 mg/kg/día) a ratas hembra antes y durante el apareamiento y continuando durante la gestación y la lactancia resultó en una reducción del peso corporal en las crías desde el nacimiento y durante la lactancia en todos menos el más bajo. dosis ensayada (2 mg/kg/día). La exposición plasmática (AUC) a la dosis sin efecto (2 mg/kg/día) para los efectos adversos sobre el desarrollo posnatal fue similar a la de los humanos con la MRHD.
La administración oral de rizatriptán (0, 5, 100 o 250 mg/kg/día) durante la organogénesis y la lactancia resultó en mortalidad neonatal, reducción del peso corporal (que persistió hasta la edad adulta) y alteración de la función neuroconductual en la descendencia, excepto en la dosis más baja. probado La exposición plasmática (AUC) a la dosis sin efecto para los efectos adversos sobre el desarrollo posnatal (5 mg/kg/día) fue aproximadamente 8 veces mayor que en humanos con la MRHD.
Lactancia
Resumen de riesgos
No hay datos sobre la presencia de rizatriptán o cualquier metabolito activo en la leche humana, o sobre los efectos de rizatriptán en el lactante o en la producción de leche.
Rizatriptán se excretó en la leche de rata, con niveles en la leche de aproximadamente 6 veces los del plasma materno.
Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de MAXALT o MAXALT-MLT y cualquier posible efecto adverso en el lactante a causa de MAXALT o MAXALT-MLT o de la afección materna subyacente.
Datos
Después de la administración oral de rizatriptán a ratas lactantes a una dosis de 100 mg/kg/día, las concentraciones de rizatriptán en muestras de leche excedieron las concentraciones de fármaco en plasma materno en aproximadamente 6 veces.
Uso pediátrico
No se ha establecido la seguridad y eficacia en pacientes pediátricos menores de 6 años. La eficacia y seguridad de MAXALT 5 mg en el tratamiento agudo de la migraña en pacientes de 6 a 17 años se estableció en un estudio adecuado y bien controlado [ver Estudios clínicos ].
La incidencia de reacciones adversas notificadas en pacientes pediátricos en el ensayo clínico agudo fue similar en los pacientes que recibieron 5 mg de MAXALT que en los que recibieron placebo. Se espera que el patrón de reacciones adversas en pacientes pediátricos sea similar al de los adultos.
Uso geriátrico
Los estudios clínicos de MAXALT 5 mg no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes. Otra experiencia clínica informada no ha identificado diferencias en las respuestas entre los ancianos y los pacientes más jóvenes.
Aunque la farmacocinética de rizatriptán fue similar en ancianos (≥65 años) y en adultos más jóvenes (n=17), en general, la selección de dosis para un paciente de edad avanzada debe ser cautelosa, comenzando con el extremo inferior del rango de dosificación. Esto refleja la mayor frecuencia de función hepática, renal o cardíaca disminuida, y de enfermedad concomitante u otra terapia con medicamentos.
Los pacientes geriátricos que tienen otros factores de riesgo cardiovascular (p. ej., diabetes, hipertensión, tabaquismo, obesidad, antecedentes familiares importantes de enfermedad de las arterias coronarias) deben someterse a una evaluación cardiovascular antes de recibir MAXALT [ver ADVERTENCIAS Y PRECAUCIONES ].
Pacientes con Fenilcetonuria
Las tabletas de desintegración oral contienen fenilalanina (un componente del aspartamo). Las tabletas de disolución oral de 5 y 10 mg contienen 1,1 y 2,1 mg de fenilalanina, respectivamente.
SOBREDOSIS
No se informaron sobredosis de MAXALT durante los ensayos clínicos en adultos.
Algunos pacientes adultos que recibieron 40 mg de MAXALT 5 mg ya sea en una sola dosis o en dos dosis con un intervalo de 2 horas entre dosis tuvieron mareos y somnolencia.
En un estudio de farmacología clínica en el que 12 sujetos adultos recibieron MAXALT 5 mg, en dosis acumuladas totales de 80 mg (administradas en un plazo de cuatro horas), dos de los sujetos experimentaron síncope, mareos, bradicardia, incluido bloqueo AV de tercer grado, vómitos y/o incontinencia .
En el estudio abierto a largo plazo, en el que participaron 606 migrañosos pediátricos de 12 a 17 años tratados (de los cuales 432 fueron tratados durante al menos 12 meses), 151 pacientes (25 %) tomaron dos dosis de 10 mg de MAXALT-MLT dentro de un período de 24 horas. Las reacciones adversas para 3 de estos pacientes incluyeron malestar abdominal, fatiga y disnea.
Además, según la farmacología de MAXALT 10 mg, podría ocurrir hipertensión o isquemia miocárdica después de una sobredosis. Se debe considerar la descontaminación gastrointestinal (es decir, lavado gástrico seguido de carbón activado) en pacientes con sospecha de sobredosis de MAXALT. La monitorización clínica y electrocardiográfica debe continuar durante al menos 12 horas, incluso si no se observan síntomas clínicos.
Se desconocen los efectos de la hemodiálisis o la diálisis peritoneal sobre las concentraciones séricas de rizatriptán.
CONTRAINDICACIONES
MAXALT 5 mg está contraindicado en pacientes con:
- Enfermedad arterial coronaria isquémica (angina de pecho, antecedentes de infarto de miocardio o isquemia silenciosa documentada) u otra enfermedad cardiovascular subyacente significativa [ver ADVERTENCIAS Y PRECAUCIONES ].
- Vasoespasmo de la arteria coronaria, incluida la angina de Prinzmetal [ver ADVERTENCIAS Y PRECAUCIONES ].
- Antecedentes de accidente cerebrovascular o ataque isquémico transitorio (AIT) [ver ADVERTENCIAS Y PRECAUCIONES ].
- Enfermedad vascular periférica (EVP) [ver ADVERTENCIAS Y PRECAUCIONES ].
- Enfermedad isquémica intestinal [ver ADVERTENCIAS Y PRECAUCIONES ].
- Hipertensión no controlada [ver ADVERTENCIAS Y PRECAUCIONES ].
- Uso reciente (es decir, dentro de las 24 horas) de otro agonista 5-HT1, medicamento que contiene ergotamina o medicamento de tipo ergotamínico (como dihidroergotamina o metisergida) [ver INTERACCIONES CON LA DROGAS ].
- Migraña hemipléjica o basilar [ver INDICACIONES ].
- Administración concurrente o interrupción reciente (es decir, dentro de las 2 semanas) de un inhibidor de la MAO-A [ver INTERACCIONES CON LA DROGAS y FARMACOLOGÍA CLÍNICA ].
- Hipersensibilidad a rizatriptán o a cualquiera de los excipientes (angioedema y anafilaxia observados) [ver REACCIONES ADVERSAS ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
Rizatriptán se une con gran afinidad a los receptores 5-HT1B/1D clonados humanos. Se presume que MAXALT 10 mg ejerce sus efectos terapéuticos en el tratamiento de la migraña al unirse a los receptores 5-HT1B/1D ubicados en los vasos sanguíneos intracraneales y los nervios sensoriales del sistema trigémino.
Farmacocinética
Absorción
Rizatriptán se absorbe completamente después de la administración oral. La biodisponibilidad absoluta oral media del comprimido de 10 mg de MAXALT es de aproximadamente el 45 %, y las concentraciones plasmáticas máximas medias (Cmax) se alcanzan en aproximadamente 1-1,5 horas (Tmax). La presencia de una migraña no pareció afectar la absorción o la farmacocinética de rizatriptán. Los alimentos no tienen un efecto significativo sobre la biodisponibilidad de rizatriptán, pero retrasan una hora el tiempo para alcanzar la concentración máxima. En ensayos clínicos, MAXALT 10 mg se administró sin tener en cuenta los alimentos.
La biodisponibilidad y Cmax de rizatriptán fueron similares luego de la administración de MAXALT Tablets y MAXALT-MLT Orally Disintegrating Tablets, pero la tasa de absorción es algo más lenta con MAXALT-MLT, con Tmax retrasado hasta 0.7 horas. El AUC de rizatriptán es aproximadamente un 30 % mayor en mujeres que en hombres. No se produjo acumulación en dosis múltiples.
Distribución
El volumen medio de distribución es de aproximadamente 140 litros en sujetos masculinos y 110 litros en sujetos femeninos. Rizatriptán se une mínimamente (14%) a las proteínas plasmáticas.
Metabolismo
La ruta principal del metabolismo de rizatriptán es a través de la desaminación oxidativa por la monoamino oxidasa-A (MAO-A) al metabolito del ácido indol acético, que no es activo en el receptor 5-HT1B/1D. Se forma en menor grado N-monodesmetil-rizatriptán, un metabolito con actividad similar a la del compuesto original en el receptor 5-HT1B/1D. Las concentraciones plasmáticas de N-monodesmetil-rizatriptán son aproximadamente el 14 % de las del compuesto original y se elimina a un ritmo similar. Otros metabolitos menores, el N-óxido, el compuesto 6-hidroxi y el conjugado de sulfato del metabolito 6-hidroxi no son activos en el receptor 5-HT1B/1D.
Eliminación
La radiactividad total de la dosis administrada recuperada durante 120 horas en la orina y las heces fue del 82 % y el 12 %, respectivamente, tras una única administración oral de 10 mg de 14C-rizatriptán. Después de la administración oral de 14C-rizatriptán, el rizatriptán representó alrededor del 17 % de la radiactividad plasmática circulante. Aproximadamente el 14 % de una dosis oral se excreta en la orina como rizatriptán inalterado, mientras que el 51 % se excreta como metabolito del ácido indol acético, lo que indica un importante metabolismo de primer paso.
La vida media plasmática de rizatriptán en hombres y mujeres tiene un promedio de 2 a 3 horas.
Isoformas del citocromo P450
El rizatriptán no es un inhibidor de las actividades de las isoformas 3A4/5, 1A2, 2C9, 2C19 o 2E1 del citocromo P450 hepático humano; rizatriptán es un inhibidor competitivo (Ki = 1400 nM) del citocromo P450 2D6, pero solo en concentraciones altas y clínicamente irrelevantes.
Poblaciones Especiales
geriátrico
La farmacocinética de rizatriptán en voluntarios ancianos sanos sin migraña (edad 65-77 años) fue similar a la de voluntarios más jóvenes sin migraña (edad 18-45 años).
Pediátrico
La farmacocinética de rizatriptán se determinó en migrañosos pediátricos de 6 a 17 años de edad. Las exposiciones luego de la administración de una dosis única de 5 mg de MAXALT-MLT a pacientes pediátricos que pesan 20-39 kg (44-87 lb) o 10 mg de MAXALT-MLT a pacientes pediátricos que pesan ≥40 kg (88 lb) fueron similares a las observadas luego de una dosis única administración de 10 mg de MAXALT-MLT a adultos.
Género
El AUC0-∞ y la Cmax medias de rizatriptán (10 mg por vía oral) fueron aproximadamente un 30 % y un 11 % más altas en las mujeres que en los hombres, respectivamente, mientras que la Tmax se produjo aproximadamente al mismo tiempo.
Deterioro hepático
Después de la administración oral en pacientes con insuficiencia hepática causada por cirrosis hepática alcohólica de leve a moderada, las concentraciones plasmáticas de rizatriptán fueron similares en pacientes con insuficiencia hepática leve en comparación con un grupo de control de sujetos con función hepática normal; las concentraciones plasmáticas de rizatriptán fueron aproximadamente un 30% mayores en pacientes con insuficiencia hepática moderada.
Insuficiencia renal
En pacientes con insuficiencia renal (aclaramiento de creatinina 10-60 ml/min/1,73 m2), el AUC0-∞ de rizatriptán no fue significativamente diferente al de los sujetos con función renal normal. Sin embargo, en pacientes en hemodiálisis (depuración de creatinina
La raza
Los datos farmacocinéticos no revelaron diferencias significativas entre sujetos afroamericanos y caucásicos.
Interacciones con la drogas
[Ver también INTERACCIONES CON LA DROGAS ]
Inhibidores de la monoaminooxidasa
Rizatriptán se metaboliza principalmente a través de la monoaminooxidasa, subtipo 'A' (MAO-A). Las concentraciones plasmáticas de rizatriptán pueden aumentar con fármacos que son inhibidores selectivos de la MAO-A (p. ej., moclobemida) o inhibidores no selectivos de la MAO [tipo A y B] (p. ej., isocarboxazida, fenelzina, tranilcipromina y pargilina). En un estudio de interacción farmacológica, cuando se administró MAXALT 10 mg a sujetos (n=12) que recibían terapia concomitante con el inhibidor de la MAO-A selectivo y reversible, moclobemida 150 mg tres veces al día, hubo aumentos medios en el AUC y la Cmáx de rizatriptán del 119 % y 41% respectivamente; y el AUC del metabolito N-monodesmetil activo de rizatriptán aumentó más del 400 %. Se esperaría que la interacción fuera mayor con los inhibidores de la MAO irreversibles. No se anticipa ninguna interacción farmacocinética en pacientes que reciben inhibidores selectivos de la MAO-B [ver CONTRAINDICACIONES y INTERACCIONES CON LA DROGAS ].
propranolol
En un estudio de la administración simultánea de 240 mg/día de propranolol y una dosis única de 10 mg de rizatriptán en sujetos adultos sanos (n=11), el AUC plasmático medio de rizatriptán aumentó en un 70 % durante la administración de propranolol y se cuadriplicó. se observó en un sujeto. El AUC del metabolito N-monodesmetil activo de rizatriptán no se vio afectado por propranolol [ver DOSIFICACIÓN Y ADMINISTRACIÓN y INTERACCIONES CON LA DROGAS ].
Nadolol/Metoprolol
En un estudio de interacciones farmacológicas, se evaluaron los efectos de dosis múltiples de 80 mg de nadolol o 100 mg de metoprolol cada 12 horas sobre la farmacocinética de una dosis única de 10 mg de rizatriptán en sujetos sanos (n=12). No se observaron interacciones farmacocinéticas.
paroxetina
En un estudio de interacción entre el inhibidor selectivo de la recaptación de serotonina (ISRS) paroxetina 20 mg/día durante dos semanas y una dosis única de MAXALT 10 mg en sujetos sanos (n=12), ni las concentraciones plasmáticas de rizatriptán ni su perfil de seguridad se vieron afectados por la paroxetina [ver ADVERTENCIAS Y PRECAUCIONES , INTERACCIONES CON LA DROGAS , y INFORMACIÓN DEL PACIENTE ].
Anticonceptivos orales
En un estudio de administración simultánea de un anticonceptivo oral durante 6 días de administración de MAXALT (10-30 mg/día) en voluntarias sanas (n=18), rizatriptán no afectó las concentraciones plasmáticas de etinilestradiol o noretindrona.
Estudios clínicos
Adultos
La eficacia de las tabletas de 5 mg de MAXALT se estableció en cuatro ensayos multicéntricos, aleatorizados y controlados con placebo. Los pacientes incluidos en estos estudios eran principalmente mujeres (84 %) y caucásicos (88 %), con una edad media de 40 años (rango de 18 a 71). Se instruyó a los pacientes para que trataran un dolor de cabeza de moderado a intenso. La respuesta al dolor de cabeza, definida como una reducción del dolor de cabeza moderado o intenso a un dolor de cabeza leve o nulo, se evaluó hasta 2 horas (Estudio 1) o hasta 4 horas después de la dosificación (Estudios 2, 3 y 4). Se evaluaron los síntomas asociados de náuseas, fotofobia y fonofobia y el mantenimiento de la respuesta hasta 24 horas después de la dosis. Se permitió una segunda dosis de MAXALT en tabletas de 10 mg de 2 a 24 horas después de la dosificación para el tratamiento del dolor de cabeza recurrente en los Estudios 1 y 2. Se permitieron analgésicos y/o antieméticos adicionales 2 horas después del tratamiento inicial de rescate en los cuatro estudios.
En todos los estudios, el porcentaje de pacientes que lograron una respuesta al dolor de cabeza 2 horas después del tratamiento fue significativamente mayor en los pacientes que recibieron MAXALT 5 o 10 mg en comparación con los que recibieron placebo. En un estudio separado, las dosis de 2,5 mg no fueron diferentes del placebo. Las dosis superiores a 10 mg se asociaron con una mayor incidencia de efectos adversos. Los resultados de los cuatro estudios controlados se resumen en la Tabla 2.
Las comparaciones del rendimiento de los fármacos basadas en los resultados obtenidos en diferentes ensayos clínicos pueden no ser fiables. Debido a que los estudios se realizan en diferentes momentos, con diferentes muestras de pacientes, por diferentes investigadores, empleando diferentes criterios y/o diferentes interpretaciones de los mismos criterios, bajo diferentes condiciones (dosis, régimen de dosificación, etc.), estimaciones cuantitativas de la respuesta al tratamiento y se puede esperar que el momento de la respuesta varíe considerablemente de un estudio a otro.
La probabilidad estimada de lograr una respuesta inicial de dolor de cabeza dentro de las 2 horas posteriores al tratamiento en los estudios combinados 1, 2, 3 y 4 se muestra en la Figura 1.
Figura 1: Probabilidad estimada de lograr una respuesta inicial al dolor de cabeza en 2 horas en los estudios combinados 1, 2, 3 y 4* 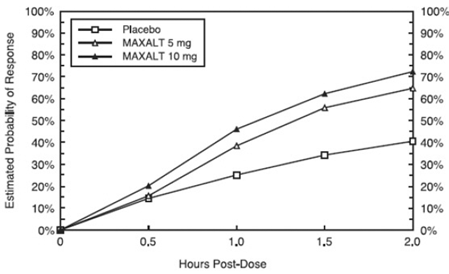
Para los pacientes con fotofobia, fonofobia y náuseas asociadas a la migraña al inicio del estudio, hubo una disminución en la incidencia de estos síntomas después de la administración de MAXALT en comparación con el placebo.
De dos a 24 horas después de la dosis inicial del tratamiento del estudio, se permitió a los pacientes usar un tratamiento adicional para la respuesta al dolor en forma de una segunda dosis del tratamiento del estudio u otro medicamento. La probabilidad estimada de que los pacientes tomen una segunda dosis u otro medicamento para la migraña durante las 24 horas posteriores a la dosis inicial del tratamiento del estudio se resume en la Figura 2.
Figura 2: Probabilidad estimada de los pacientes que toman una segunda dosis de MAXALT en tabletas de 10 mg u otro medicamento para las migrañas durante las 24 horas posteriores a la dosis inicial del tratamiento del estudio en los estudios combinados 1, 2, 3 y 4* 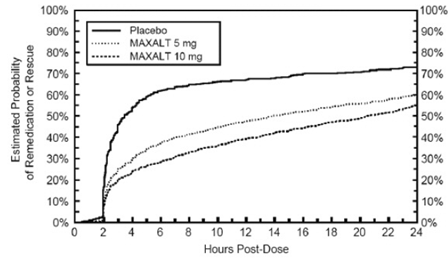
La eficacia no se vio afectada por la presencia de aura; por el sexo o la edad del paciente; o por el uso concomitante de fármacos profilácticos comunes para la migraña (p. ej., bloqueadores beta, bloqueadores de los canales de calcio, antidepresivos tricíclicos) o anticonceptivos orales. En dos estudios similares adicionales, la eficacia no se vio afectada por la relación con la menstruación. No hubo datos suficientes para evaluar el impacto de la raza en la eficacia.
MAXALT-MLT Tabletas de desintegración oral
La eficacia de MAXALT-MLT se estableció en dos ensayos multicéntricos, aleatorizados, controlados con placebo que fueron similares en diseño a los ensayos de MAXALT Tabletas (Estudios 5 y 6). Se instruyó a los pacientes para que trataran un dolor de cabeza de moderado a severo. Los pacientes tratados en estos estudios eran principalmente mujeres (88 %) y caucásicos (95 %), con una edad media de 42 años (rango 18-72).
En ambos estudios, el porcentaje de pacientes que lograron una respuesta del dolor de cabeza 2 horas después del tratamiento fue significativamente mayor en los pacientes que recibieron MAXALT-MLT 5 o 10 mg en comparación con los que recibieron placebo. Los resultados de los Estudios 5 y 6 se resumen en la Tabla 3.
La probabilidad estimada de lograr una respuesta inicial de dolor de cabeza a las 2 horas después del tratamiento con MAXALT-MLT en los estudios combinados 5 y 6 se muestra en la Figura 3.
Figura 3: Probabilidad estimada de lograr una respuesta inicial al dolor de cabeza con MAXALT-MLT en 2 horas en los estudios combinados 5 y 6* 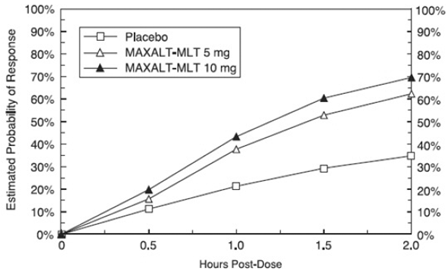
Para los pacientes con fotofobia y fonofobia asociadas a la migraña al inicio del estudio, hubo una disminución en la incidencia de estos síntomas luego de la administración de MAXALT-MLT en comparación con el placebo.
De dos a 24 horas después de la dosis inicial del tratamiento del estudio, se permitió a los pacientes usar un tratamiento adicional para la respuesta al dolor en forma de una segunda dosis del tratamiento del estudio u otro medicamento. La probabilidad estimada de que los pacientes tomen una segunda dosis u otro medicamento para la migraña durante las 24 horas posteriores a la dosis inicial del tratamiento del estudio se resume en la Figura 4.
Figura 4: Probabilidad estimada de pacientes que toman una segunda dosis de MAXALT-MLT u otro medicamento para las migrañas durante las 24 horas posteriores a la dosis inicial del tratamiento del estudio en estudios combinados 5 y 6* 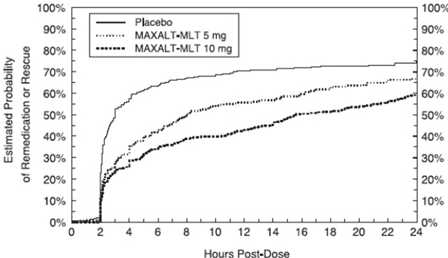
Pacientes pediátricos de 6 a 17 años de edad
La eficacia de MAXALT-MLT en pacientes pediátricos de 6 a 17 años se evaluó en un ensayo clínico multicéntrico, aleatorizado, doble ciego, controlado con placebo y de grupos paralelos (Estudio 7). Los pacientes debían tener al menos un historial de 6 meses de ataques de migraña (con o sin aura) que generalmente duraban 3 horas o más (cuando no se trataba). Históricamente, la población de pacientes no respondía a los AINE ni a la terapia con paracetamol.
Se instruyó a los pacientes para que trataran un solo ataque de migraña con dolor de cabeza de intensidad moderada a severa. La fase de tratamiento del estudio tuvo dos etapas. La Etapa 1 se usó para identificar a los pacientes que no respondieron al placebo, quienes luego entraron en la Etapa 2, en la que los pacientes fueron asignados al azar a MAXALT-MLT o al placebo. Usando una estrategia de dosificación basada en el peso, los pacientes de 20 kg a
La edad media de la población de pacientes estudiada fue de 13 años. El sesenta y uno por ciento de los pacientes eran caucásicos y el cincuenta y seis por ciento de los pacientes eran mujeres. El porcentaje de pacientes que lograron la variable principal de eficacia de ausencia de dolor de cabeza 2 horas después del tratamiento fue significativamente mayor en los pacientes que recibieron MAXALT-MLT, en comparación con los que recibieron placebo (33 % frente a 24 %). Los resultados del Estudio 7 se resumen en la Tabla 4.
El porcentaje observado de pacientes pediátricos que no lograron dolor de cabeza dentro de las 2 horas posteriores al tratamiento inicial con MAXALT-MLT se muestra en la Figura 5.
Figura 5: Porcentaje observado de pacientes que informaron que no tenían dolor de cabeza 2 horas después de la dosis en el estudio 7 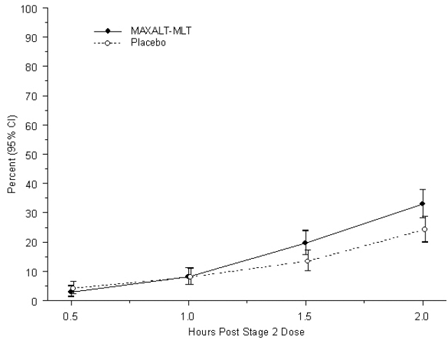
La prevalencia de los criterios de valoración exploratorios de ausencia de síntomas asociados con la migraña (náuseas, fotofobia y fonofobia) a las 2 horas de tomar la dosis no fue estadísticamente significativa entre los pacientes que recibieron MAXALT-MLT y los que recibieron placebo.
INFORMACIÓN DEL PACIENTE
MAXALT® (max-awlt)
MAXALT-MLT® (benzoato de rizatriptán) tabletas y tabletas de desintegración oral
Lea esta información para el paciente antes de comenzar a tomar MAXALT® y cada vez que renueve su receta. Es posible que haya nueva información. Esta información no reemplaza la conversación con su médico sobre su condición médica o su tratamiento.
A menos que se indique lo contrario, la información de este folleto de información para el paciente se aplica tanto a las tabletas de 10 mg de MAXALT como a las tabletas de desintegración oral MAXALT-MLT®.
¿Qué es MAXALT?
MAXALT es un medicamento recetado que pertenece a una clase de medicamentos llamados triptanos. MAXALT está disponible como tableta tradicional (MAXALT) y como tableta de desintegración oral (MAXALT-MLT).
MAXALT 5 mg y MAXALT-MLT se utilizan para tratar los ataques de migraña con o sin aura en adultos y en niños de 6 a 17 años.
MAXALT 5 mg no debe usarse para prevenir los ataques de migraña.
MAXALT no es para el tratamiento de migrañas hemipléjicas o basilares.
No se sabe si MAXALT es seguro y eficaz para el tratamiento de las cefaleas en brotes.
No se sabe si tomar más de 1 dosis de MAXALT en 24 horas es seguro y efectivo en niños de 6 a 17 años de edad.
Se desconoce si MAXALT es seguro y efectivo en niños menores de 6 años.
¿Quién no debe tomar MAXALT?
No tome MAXALT si usted:
- tiene o ha tenido problemas del corazón
- tiene o ha tenido un accidente cerebrovascular o un ataque isquémico transitorio (AIT)
- tiene o ha tenido problemas en los vasos sanguíneos, incluida la enfermedad intestinal isquémica
- tiene presión arterial alta no controlada
- ha tomado otros medicamentos Triptan en las últimas 24 horas
- han tomado medicamentos que contienen ergot en las últimas 24 horas
- tiene migrañas hemipléjicas o basilares
- toma un inhibidor de la monoaminooxidasa (MAO) o ha tomado un inhibidor de la MAO en las últimas 2 semanas
- es alérgico al benzoato de rizatriptán o a cualquiera de los ingredientes de MAXALT. Consulte el final de este folleto para obtener una lista completa de los ingredientes de MAXALT.
Hable con su médico antes de tomar este medicamento si tiene alguna de las condiciones mencionadas anteriormente o si no está seguro si está tomando alguno de estos medicamentos.
¿Qué debo decirle a mi médico antes de tomar MAXALT?
Antes de tomar MAXALT, informe a su médico si usted:
- tiene o ha tenido problemas cardíacos, presión arterial alta, dolor en el pecho o dificultad para respirar
- tiene algún factor de riesgo de problemas cardíacos o problemas de los vasos sanguíneos, como:
- Alta presión sanguínea
- colesterol alto
- de fumar
- obesidad
- diabetes
- antecedentes familiares de problemas cardíacos
- eres posmenopáusica
- eres un hombre mayor de 40
- tiene fenilcetonuria (PKU). Las tabletas de desintegración oral MAXALT-MLT contienen fenilalanina.
- tiene problemas renales o hepáticos
- tiene cualquier otra condición médica
- está embarazada o planea quedar embarazada. No se sabe si MAXALT dañará a su bebé por nacer. Si queda embarazada mientras toma MAXALT 5 mg, hable con su proveedor de atención médica.
- están amamantando o planean amamantar. No se sabe si MAXALT 10 mg pasa a la leche materna. Hable con su médico sobre la mejor manera de alimentar a su bebé si toma MAXALT.
Informe a su médico sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos a base de hierbas.
MAXALT 10 mg y otros medicamentos pueden afectarse entre sí y causar efectos secundarios. MAXALT puede afectar la forma en que funcionan otros medicamentos y otros medicamentos pueden afectar la forma en que funciona MAXALT 5 mg.
Informe especialmente a su médico si toma:
- medicamentos que contienen propranolol como Inderal®, Inderal® LA o Innopran® XL
- medicamentos utilizados para tratar los trastornos del estado de ánimo, incluidos los inhibidores selectivos de la recaptación de serotonina (ISRS) o los inhibidores de la recaptación de serotonina y norepinefrina (IRSN).
Pídale a su médico o farmacéutico una lista de estos medicamentos, si no está seguro.
Conozca los medicamentos que toma. Mantenga una lista de ellos para mostrársela a su médico y farmacéutico cuando obtenga un medicamento nuevo.
¿Cómo debo tomar MAXALT?
- Tome MAXALT exactamente como su médico le indique que lo tome.
- Su médico le dirá cuánto MAXALT 5 mg debe tomar y cuándo tomarlo.
- Para tomar MAXALT-MLT:
- Deje las tabletas de desintegración oral de MAXALT-MLT en el paquete en el que viene hasta que esté listo para tomarlas. Cuando esté listo para tomarlo:
- Retire el blíster de la bolsa de aluminio. No empuje la tableta de desintegración oral MAXALT-MLT a través del blíster.
- Abra el blister con las manos secas y coloque la tableta de desintegración oral MAXALT-MLT en su lengua. La tableta se disolverá y se tragará con su saliva. No se necesita líquido para tomar la tableta de desintegración oral.
- Deje las tabletas de desintegración oral de MAXALT-MLT en el paquete en el que viene hasta que esté listo para tomarlas. Cuando esté listo para tomarlo:
- Si su dolor de cabeza regresa después de su primera dosis de 10 mg de MAXALT:
- Para adultos: se puede tomar una segunda dosis 2 horas después de la primera dosis. No tome más de 30 mg de MAXALT en un período de 24 horas (por ejemplo, no tome más de 3 tabletas de 10 mg en un período de 24 horas).
- Para niños de 6 a 17 años de edad: No se sabe si tomar más de 1 dosis de MAXALT 5 mg en 24 horas es seguro y efectivo. Hable con su médico sobre qué hacer si su dolor de cabeza no desaparece o regresa.
- Si toma demasiado MAXALT 5 mg, llame a su médico o acuda de inmediato a la sala de emergencias del hospital más cercano.
¿Qué debo evitar mientras tomo MAXALT?
MAXALT 5 mg puede causar mareos, debilidad o desmayos. Si tiene estos síntomas, no conduzca un automóvil, no use maquinaria ni haga nada que requiera que esté alerta.
¿Cuáles son los posibles efectos secundarios de MAXALT 5 mg?
MAXALT 5 mg puede provocar efectos secundarios graves. Llame a su médico o vaya a la sala de emergencias del hospital más cercano de inmediato si cree que está teniendo alguno de los efectos secundarios graves de MAXALT, incluidos:
- ataque al corazón. Los síntomas de un ataque al corazón pueden incluir:
- malestar en el pecho en el centro del pecho que dura más de unos pocos minutos o que desaparece y regresa
- malestar en el pecho que se siente como una presión incómoda, opresión, plenitud o dolor
- dolor o malestar en los brazos, la espalda, el cuello, la mandíbula o el estómago
- dificultad para respirar con o sin malestar en el pecho
- estallando en un sudor frío
- náuseas o vómitos
- sentirse mareado
- carrera. Los síntomas de un accidente cerebrovascular pueden incluir los siguientes síntomas repentinos:
- entumecimiento o debilidad en la cara, el brazo o la pierna, especialmente en un lado del cuerpo
- confusión, problemas para hablar o entender
- problemas para ver en 1 o ambos ojos
- problemas para caminar, mareos, pérdida de equilibrio o coordinación
- dolor de cabeza severo sin causa conocida
- problemas de los vasos sanguíneos. Los síntomas de los problemas de los vasos sanguíneos pueden incluir:
- dolor de estómago
- diarrea con sangre
- problemas de la vista
- frialdad y entumecimiento de manos y pies
- síndrome serotoninérgico. Una afección llamada síndrome serotoninérgico puede ocurrir cuando los medicamentos Triptan como MAXALT se toman con otros medicamentos. Los síntomas del síndrome serotoninérgico pueden incluir:
- agitación
- alucinaciones
- coma
- latidos cardíacos acelerados
- cambios rápidos en la presión arterial
- aumento de la temperatura corporal
- espasmo muscular
- pérdida de coordinación
- náuseas, vómitos o diarrea
- aumento de la presión arterial.
Los efectos secundarios más comunes de MAXALT en adultos incluyen:
- sentirse somnoliento o cansado
- dolor o presión en el pecho o la garganta
- mareo
Informe a su médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Si toma MAXALT 10 mg con demasiada frecuencia, es posible que tenga dolores de cabeza crónicos. En tales casos, debe comunicarse con su médico, ya que es posible que deba dejar de tomar MAXALT.
Estos no son todos los posibles efectos secundarios de MAXALT. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA1088.
¿Cómo debo almacenar MAXALT?
- Guarde MAXALT a temperatura ambiente entre 59 °F y 86 °F (15 °C y 30 °C).
- Deseche de forma segura los medicamentos vencidos o que ya no necesite.
Mantenga MAXALT 10 mg y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de MAXALT.
veces, los medicamentos se recetan para fines distintos a los enumerados en el folleto de información para el paciente. No use MAXALT para una condición para la cual no fue recetado. No le dé MAXALT a otras personas, incluso si tienen los mismos síntomas que usted tiene. Puede que les haga daño.
Este folleto de información para el paciente resume la información más importante sobre MAXALT. Si desea obtener más información, hable con su médico. Puede pedirle a su farmacéutico o médico información sobre MAXALT escrita para profesionales de la salud.
Para obtener más información, vaya a www.maxalt.com.
¿Cuáles son los ingredientes de MAXALT?
Ingrediente activo en MAXALT 10 mg y MAXALT-MLT tabletas de desintegración oral:
benzoato de rizatriptán.
Ingredientes inactivos en MAXALT: lactosa monohidrato, celulosa microcristalina, almidón pregelatinizado, óxido férrico (rojo) y estearato de magnesio.
Ingredientes inactivos en las tabletas de desintegración oral MAXALT-MLT: gelatina, manitol, glicina, aspartamo y sabor a menta.
Las tabletas de desintegración oral MAXALT-MLT contienen aspartamo, una fuente de fenilalanina.
Fenilcetonúricos:
Las tabletas de desintegración oral MAXALT-MLT de 5 mg contienen 1,1 mg de fenilalanina. Las tabletas de desintegración oral MAXALT-MLT de 10 mg contienen 2,1 mg de fenilalanina.
Esta información para el paciente ha sido aprobada por la Administración de Drogas y Alimentos de los Estados Unidos.
