Imitrex 100mg, 25mg, 50mg Sumatriptan Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Imitrex 25 mg y cómo se usa?
Imitrex 100 mg es un medicamento recetado que se usa para tratar los síntomas de la migraña y la cefalea en brotes. Imitrex se puede usar solo o con otros medicamentos.
Imitrex 50 mg es un agente antimigrañoso, agonista del receptor de serotonina 5-HT.
No se sabe si Imitrex 50 mg es seguro y eficaz en niños menores de 18 años y no se recomienda su uso en pacientes geriátricos.
¿Cuáles son los posibles efectos secundarios de Imitrex 50mg?
Imitrex 25 mg puede causar efectos secundarios graves, que incluyen:
- dolor de estómago intenso y repentino,
- diarrea con o sin presencia de sangre,
- dolor de pecho severo,
- dolor en la mandíbula o el hombro,
- dificultad para respirar,
- latidos irregulares del corazón,
- convulsiones (convulsiones),
- calambres en las piernas,
- entumecimiento u hormigueo en las piernas o los pies,
- dolor ardiente en las piernas o los pies,
- sensación de frío en las piernas o los pies,
- cambios de color en las piernas o los pies,
- dolor de cadera,
- náuseas,
- vómitos,
- sudoración o escalofríos,
- agitación,
- alucinaciones,
- fiebre,
- rigidez muscular,
- pérdida de coordinación,
- entumecimiento repentino o debilidad en un lado del cuerpo,
- dificultad para hablar,
- dificultad para ver,
- mal equilibrio y
- dolor de cabeza intenso y repentino
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Imitrex incluyen:
- dolor u opresión en el pecho, la garganta o la mandíbula,
- presión en cualquier parte de su cuerpo,
- entumecimiento u hormigueo ,
- sentir calor o frío,
- mareo,
- somnolencia,
- debilidad,
- sabor desagradable después de usar la medicina nasal,
- dolor, ardor, entumecimiento u hormigueo en la nariz o la garganta después de usar el medicamento nasal, y
- secreción nasal o congestión nasal después de usar el medicamento nasal
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Imitrex. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
IMITREX 50 mg inyectable contiene succinato de sumatriptán, un agonista selectivo del receptor 5-HT1B/1D. El succinato de sumatriptán se designa químicamente como succinato de 3-[2-(dimetilamino)etil]-N-metil-indol5-metanosulfonamida (1:1), y tiene la siguiente estructura:
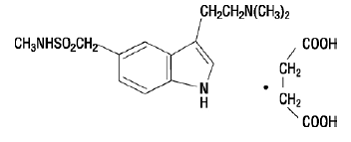
La fórmula empírica es C14H21N3O2S•C4H6O4, que representa un peso molecular de 413,5. El succinato de sumatriptán es un polvo de color blanco a blanquecino que se disuelve fácilmente en agua y solución salina.
La inyección de IMITREX es una solución transparente, incolora a amarillo pálido, estéril y apirógena para inyección subcutánea. Cada 0,5 ml de solución inyectable de IMITREX de 8 mg/ml contiene 4 mg de sumatriptán (base) como sal de succinato y 3,8 mg de cloruro de sodio, USP en agua para inyección, USP. Cada 0,5 ml de solución inyectable de IMITREX de 12 mg/ml contiene 6 mg de sumatriptán (base) como sal de succinato y 3,5 mg de cloruro de sodio, USP en agua para inyección, USP. El rango de pH de ambas soluciones es de aproximadamente 4,2 a 5,3. La osmolalidad de ambas inyecciones es de 291 mOsmol.
INDICACIONES
La inyección de IMITREX® está indicada en adultos para (1) el tratamiento agudo de la migraña, con o sin aura, y (2) el tratamiento agudo de la cefalea en brotes.
Limitaciones de uso
- Usar solo si se ha establecido un diagnóstico claro de migraña o cefalea en racimos. Si un paciente no responde al primer ataque de migraña o dolor de cabeza en brotes tratado con IMITREX 50 mg inyectable, reconsidere el diagnóstico antes de administrar IMITREX inyectable para tratar cualquier ataque posterior.
- IMITREX Inyectable no está indicado para la prevención de ataques de migraña o cefalea en brotes.
DOSIFICACIÓN Y ADMINISTRACIÓN
Información de dosificación
La dosis única máxima recomendada para adultos de IMITREX 25 mg inyectable para el tratamiento agudo de la migraña o la cefalea en brotes es de 6 mg inyectados por vía subcutánea. Para el tratamiento de la migraña, si los efectos secundarios limitan la dosis, se pueden usar dosis más bajas (1 mg a 5 mg) [ver Estudios clínicos ]. Para el tratamiento de la cefalea en brotes, no se ha establecido la eficacia de dosis más bajas.
La dosis acumulada máxima que se puede administrar en 24 horas es de 12 mg, dos inyecciones de 6 mg separadas por al menos 1 hora. Solo se debe considerar una segunda dosis de 6 mg si se observó alguna respuesta a la primera inyección.
Administración con el IMITREX STATdose Pen®
Se encuentra disponible un dispositivo de autoinyección (IMITREX 25 mg STATdose Pen) para usar con cartuchos de jeringa precargados de 4 mg y 6 mg. Con este dispositivo, la aguja penetra aproximadamente 1/4 de pulgada (5 a 6 mm). La inyección está diseñada para administrarse por vía subcutánea y debe evitarse la administración intramuscular o intravascular. Instruya a los pacientes sobre el uso adecuado de IMITREX 100 mg STATdose Pen y pídales que usen sitios de inyección con una piel y un grosor subcutáneo adecuados para acomodar la longitud de la aguja.
Administración de dosis de IMITREX distintas de 4 o 6 mg
En pacientes que reciben dosis distintas de 4 mg o 6 mg, use el vial de dosis única de 6 mg; no utilice la pluma STATdose de 50 mg de IMITREX. Inspeccione visualmente el vial en busca de partículas y decoloración antes de la administración. No lo use si se observan partículas y decoloraciones.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
- Inyección: cartuchos de jeringa precargada de dosis única de 4 mg y 6 mg para usar con la pluma IMITREX STATdose.
- Inyección: vial monodosis de 6 mg.
Almacenamiento y manipulación
Inyección de 100 mg de IMITREX contiene sumatriptán (base) como la sal de succinato y se suministra como una solución transparente, incolora a amarillo pálido, estéril y no pirogénica de la siguiente manera:
Jeringa precargada y/o pluma autoinyectora
Cada paquete contiene un prospecto de Información para el paciente e Instrucciones de uso para el paciente.
IMITREX 100 mg STATdosis System®, 4 mg , que contiene 1 IMITREX 25 mg STATdose Pen, 2 cartuchos de jeringa precargados de dosis única y 1 estuche de transporte ( CDN 0173-0739-00).
IMITREX 100mg Sistema STATdosis, 6 mg que contiene 1 pluma IMITREX STATdose, 2 cartuchos de jeringa precargados de dosis única y 1 estuche de transporte ( CDN 0173-0479-00).
Dos jeringas precargadas de dosis única de 4 mg cartuchos para usar con el sistema IMITREX STATdose ( CDN 0173-0739-02).
Dos jeringas precargadas de dosis única de 6 mg cartuchos para uso con IMITREX 25mg STATdose System ( CDN 0173-0478-00).
Vial de dosis única
IMITREX 25mg Vial de dosis única inyectable (6 mg/0,5 ml) en cajas que contienen 5 viales ( CDN 01730449-02).
Almacenar entre 2° y 30°C (36° y 86°F). Proteger de la luz.
GlaxoSmithKline, Research Triangle Park, NC 27709EFECTOS SECUNDARIOS
Las siguientes reacciones adversas graves se describen a continuación y en otras partes de la etiqueta:
- Isquemia miocárdica, infarto de miocardio y angina de Prinzmetal [ver ADVERTENCIAS Y PRECAUCIONES ]
- Arritmias [ver ADVERTENCIAS Y PRECAUCIONES ]
- Dolor/opresión/opresión en el pecho, la garganta, el cuello y/o la mandíbula [ver ADVERTENCIAS Y PRECAUCIONES ]
- Eventos cerebrovasculares [ver ADVERTENCIAS Y PRECAUCIONES ]
- Otras reacciones de vasoespasmo [ver ADVERTENCIAS Y PRECAUCIONES ]
- Dolor de cabeza por uso excesivo de medicamentos [ver ADVERTENCIAS Y PRECAUCIONES ]
- Síndrome serotoninérgico [ver ADVERTENCIAS Y PRECAUCIONES ]
- Aumento de la presión arterial [ver ADVERTENCIAS Y PRECAUCIONES ]
- Reacciones de hipersensibilidad [ver CONTRAINDICACIONES , ADVERTENCIAS Y PRECAUCIONES ]
- Convulsiones [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Migraña
La Tabla 1 enumera las reacciones adversas que ocurrieron en 2 ensayos clínicos controlados con placebo en EE. UU. en pacientes con migraña (estudios 2 y 3) después de una dosis única de 6 mg de IMITREX 100 mg inyectable o placebo. Solo las reacciones que ocurrieron con una frecuencia del 2 % o más en los grupos tratados con IMITREX Inyectable de 6 mg y que ocurrieron con una frecuencia mayor que en el grupo de placebo se incluyen en la Tabla 1.
La incidencia de reacciones adversas en ensayos clínicos controlados no se vio afectada por el sexo o la edad de los pacientes. No hubo datos suficientes para evaluar el impacto de la raza en la incidencia de reacciones adversas.
Terrible dolor de cabeza
En los ensayos clínicos controlados que evaluaron la eficacia de IMITREX 50 mg inyectable como tratamiento para la cefalea en brotes (Estudios 4 y 5), no se detectaron nuevas reacciones adversas significativas que no se hubieran identificado en los ensayos de IMITREX 100 mg en pacientes con migraña.
En general, la frecuencia de las reacciones adversas notificadas en los ensayos de cefalea en racimos fue generalmente menor que en los ensayos de migraña. Las excepciones incluyen informes de parestesia (5 % IMITREX, 0 % placebo), náuseas y vómitos (4 % IMITREX, 0 % placebo) y broncoespasmo (1 % IMITREX 50 mg, 0 % placebo).
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de IMITREX 50 mg comprimidos, IMITREX aerosol nasal e IMITREX 50 mg inyección. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Cardiovascular
Hipotensión, palpitaciones.
Neurológico
Distonía, temblor.
INTERACCIONES CON LA DROGAS
Medicamentos que contienen cornezuelo
Se ha informado que los medicamentos que contienen cornezuelo de centeno causan reacciones vasoespásticas prolongadas. Debido a que estos efectos pueden ser aditivos, está contraindicado el uso de medicamentos que contienen ergotamina o de tipo ergotamínico (como dihidroergotamina o metisergida) e IMITREX 25 mg inyectable dentro de las 24 horas de diferencia.
Inhibidores de la monoaminooxidasa-A
Los inhibidores de la MAO-A aumentan la exposición sistémica al doble. Por lo tanto, el uso de IMITREX Inyectable en pacientes que reciben inhibidores de la MAO-A está contraindicado [ver FARMACOLOGÍA CLÍNICA ].
Otros agonistas de 5-HT1
Debido a que sus efectos vasoespásticos pueden ser aditivos, está contraindicada la administración conjunta de IMITREX Inyectable y otros agonistas de 5-HT1 (p. ej., triptanos) dentro de las 24 horas de diferencia.
Inhibidores selectivos de la recaptación de serotonina/inhibidores de la recaptación de serotonina y noradrenalina y síndrome serotoninérgico
Se han notificado casos de síndrome serotoninérgico durante la coadministración de triptanos e ISRS, IRSN, ATC e inhibidores de la MAO [ver ADVERTENCIAS Y PRECAUCIONES ].
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Isquemia miocárdica, infarto de miocardio y angina de Prinzmetal
El uso de IMITREX Inyectable está contraindicado en pacientes con CAD isquémica o vasoespástica. Ha habido informes raros de reacciones adversas cardíacas graves, incluido el infarto agudo de miocardio, que ocurrieron dentro de unas pocas horas después de la administración de IMITREX Inyectable. Algunas de estas reacciones ocurrieron en pacientes sin CAD conocida. IMITREX 100 mg inyectable puede causar vasoespasmo de la arteria coronaria (angina de Prinzmetal), incluso en pacientes sin antecedentes de CAD.
Realice una evaluación cardiovascular en pacientes sin tratamiento previo con triptanes que tengan múltiples factores de riesgo cardiovascular (p. ej., edad avanzada, diabetes, hipertensión, tabaquismo, obesidad, antecedentes familiares importantes de CAD) antes de recibir la inyección de IMITREX. Si hay evidencia de CAD o vasoespasmo de la arteria coronaria, la inyección de IMITREX 100 mg está contraindicada. Para pacientes con múltiples factores de riesgo cardiovascular que tienen una evaluación cardiovascular negativa, considere administrar la primera dosis de IMITREX Inyectable en un entorno supervisado médicamente y realizar un electrocardiograma (ECG) inmediatamente después de la administración de IMITREX Inyectable. Para tales pacientes, considere la evaluación cardiovascular periódica en usuarios intermitentes a largo plazo de IMITREX 100mg Inyectable.
Arritmias
Se han notificado alteraciones del ritmo cardíaco potencialmente mortales, incluidas taquicardia ventricular y fibrilación ventricular que conducen a la muerte, pocas horas después de la administración de agonistas 5-HT1. Interrumpa la inyección de IMITREX si ocurren estas alteraciones. La inyección de IMITREX está contraindicada en pacientes con síndrome de Wolff-Parkinson-White o arritmias asociadas con otros trastornos de la vía de conducción accesoria cardíaca.
Pecho, garganta, cuello y/o dolor de mandíbula/opresión/presión
Las sensaciones de opresión, dolor, presión y pesadez en el precordio, la garganta, el cuello y la mandíbula ocurren comúnmente después del tratamiento con IMITREX Inyectable y generalmente no son de origen cardíaco. Sin embargo, realice una evaluación cardíaca si estos pacientes tienen un alto riesgo cardíaco. El uso de IMITREX Inyectable está contraindicado en pacientes con CAD y aquellos con angina variante de Prinzmetal.
Eventos cerebrovasculares
Se han producido hemorragia cerebral, hemorragia subaracnoidea y accidente cerebrovascular en pacientes tratados con agonistas de 5-HT1, y algunos han resultado en muertes. En varios casos, parece posible que los eventos cerebrovasculares fueran primarios, habiéndose administrado el agonista 5-HT1 con la creencia incorrecta de que los síntomas experimentados eran consecuencia de la migraña cuando no lo eran. Además, los pacientes con migraña pueden tener un mayor riesgo de ciertos eventos cerebrovasculares (p. ej., accidente cerebrovascular, hemorragia, AIT). Interrumpa la inyección de IMITREX si ocurre un evento cerebrovascular.
Antes de tratar dolores de cabeza en pacientes que no hayan sido diagnosticados previamente con migraña o cefalea en racimos o en pacientes que presenten síntomas atípicos, excluya otras afecciones neurológicas potencialmente graves. IMITREX Inyectable está contraindicado en pacientes con antecedentes de accidente cerebrovascular o AIT.
Otras reacciones de vasoespasmo
IMITREX 25 mg inyectable puede causar reacciones vasoespásticas no coronarias, como isquemia vascular periférica, isquemia vascular gastrointestinal e infarto (que se presenta con dolor abdominal y diarrea sanguinolenta), infarto esplénico y síndrome de Raynaud. En pacientes que experimenten síntomas o signos que sugieran una reacción de vasoespasmo no coronario luego del uso de cualquier agonista 5-HT1, descarte una reacción vasoespástica antes de recibir inyecciones adicionales de IMITREX.
Se han informado informes de ceguera transitoria y permanente y pérdida de visión parcial significativa con el uso de agonistas 5-HT1. Dado que los trastornos visuales pueden ser parte de un ataque de migraña, no se ha establecido claramente una relación causal entre estos eventos y el uso de agonistas 5-HT1.
Dolor de cabeza por uso excesivo de medicamentos
El uso excesivo de medicamentos para la migraña aguda (p. ej., ergotamina, triptanes, opioides o una combinación de estos medicamentos durante 10 o más días al mes) puede provocar una exacerbación del dolor de cabeza (cefalea por uso excesivo de medicamentos). El dolor de cabeza por uso excesivo de medicamentos puede presentarse como dolores de cabeza diarios similares a la migraña, o como un marcado aumento en la frecuencia de los ataques de migraña. Puede ser necesaria la desintoxicación de los pacientes, incluida la retirada de los fármacos usados en exceso, y el tratamiento de los síntomas de abstinencia (que a menudo incluye un empeoramiento transitorio del dolor de cabeza).
Síndrome de serotonina
El síndrome de serotonina puede ocurrir con la inyección de IMITREX, particularmente durante la administración conjunta con inhibidores selectivos de la recaptación de serotonina (ISRS), inhibidores de la recaptación de serotonina y norepinefrina (IRSN), antidepresivos tricíclicos (TCA) e inhibidores de la MAO [ver INTERACCIONES CON LA DROGAS ]. Los síntomas del síndrome serotoninérgico pueden incluir cambios en el estado mental (p. ej., agitación, alucinaciones, coma), inestabilidad autonómica (p. ej., taquicardia, presión arterial lábil, hipertermia), aberraciones neuromusculares (p. ej., hiperreflexia, falta de coordinación) y/o síntomas gastrointestinales (p. ej., náuseas, vómitos, diarrea). El inicio de los síntomas generalmente ocurre de minutos a horas después de recibir una dosis nueva o mayor de un medicamento serotoninérgico. Interrumpa la inyección de IMITREX si se sospecha síndrome serotoninérgico.
Aumento de la presión arterial
En raras ocasiones se ha notificado un aumento significativo de la presión arterial, incluida una crisis hipertensiva con deterioro agudo de los sistemas orgánicos, en pacientes tratados con agonistas 5-HT1, incluidos pacientes sin antecedentes de hipertensión. Monitorear la presión arterial en pacientes tratados con IMITREX. IMITREX Inyectable está contraindicado en pacientes con hipertensión no controlada.
Reacciones anafilácticas/anafilactoides
Se han producido reacciones anafilácticas/anafilactoides en pacientes que reciben IMITREX. Tales reacciones pueden ser potencialmente mortales o fatales. En general, es más probable que ocurran reacciones anafilácticas a los medicamentos en individuos con antecedentes de sensibilidad a múltiples alérgenos. IMITREX 50 mg inyectable está contraindicado en pacientes con antecedentes de reacción de hipersensibilidad a IMITREX.
convulsiones
Se han informado convulsiones después de la administración de IMITREX. Algunos han ocurrido en pacientes con antecedentes de convulsiones o condiciones concurrentes que predisponen a las convulsiones. También hay informes en pacientes en los que tales factores predisponentes no son aparentes. IMITREX Inyectable debe usarse con precaución en pacientes con antecedentes de epilepsia o afecciones asociadas con un umbral convulsivo reducido.
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( INFORMACIÓN DEL PACIENTE e Instrucciones de uso ).
Riesgo de isquemia y/o infarto de miocardio, angina de Prinzmetal, otros eventos relacionados con vasoespasmo, arritmias y eventos cerebrovasculares
Informe a los pacientes que la inyección de 50 mg de IMITREX puede causar efectos secundarios cardiovasculares graves, como infarto de miocardio o accidente cerebrovascular. Aunque pueden ocurrir eventos cardiovasculares graves sin síntomas de advertencia, los pacientes deben estar alertas a los signos y síntomas de dolor torácico, dificultad para respirar, latidos cardíacos irregulares, aumento significativo de la presión arterial, debilidad y dificultad para hablar, y deben consultar a un médico si se observa cualquier signo o síntoma indicativo. Informar a los pacientes de la importancia de este seguimiento [ver ADVERTENCIAS Y PRECAUCIONES ].
Reacciones anafilácticas/anafilactoides
Informe a los pacientes que se han producido reacciones anafilácticas/anafilactoides en pacientes que recibieron IMITREX 100 mg inyectables. Tales reacciones pueden ser potencialmente mortales o fatales. En general, es más probable que ocurran reacciones anafilácticas a los medicamentos en personas con antecedentes de sensibilidad a múltiples alérgenos [ver CONTRAINDICACIONES , ADVERTENCIAS Y PRECAUCIONES ].
Uso concomitante con otros triptanos o medicamentos ergotamínicos
Informe a los pacientes que está contraindicado el uso de IMITREX 50 mg inyectable dentro de las 24 horas de otro triptán o un medicamento de tipo ergotamínico (incluyendo dihidroergotamina o metisergida) [ver CONTRAINDICACIONES , INTERACCIONES CON LA DROGAS ].
Síndrome de serotonina
Advierta a los pacientes sobre el riesgo de síndrome serotoninérgico con el uso de IMITREX Inyectable u otros triptanos, particularmente durante el uso combinado con ISRS, IRSN, TCA e inhibidores de la MAO [ver ADVERTENCIAS Y PRECAUCIONES , INTERACCIONES CON LA DROGAS ].
Dolor de cabeza por uso excesivo de medicamentos
Informe a los pacientes que el uso de medicamentos para la migraña aguda durante 10 o más días al mes puede provocar una exacerbación del dolor de cabeza y anime a los pacientes a registrar la frecuencia del dolor de cabeza y el uso de medicamentos (por ejemplo, manteniendo un diario de dolor de cabeza) [ver ADVERTENCIAS Y PRECAUCIONES ].
El embarazo
Informe a los pacientes que la inyección de IMITREX de 25 mg no debe usarse durante el embarazo a menos que el beneficio potencial justifique el riesgo potencial para el feto [ver Uso en poblaciones específicas ].
Madres lactantes
Aconseje a los pacientes que notifiquen a su proveedor de atención médica si están amamantando o planean amamantar [ver Uso en poblaciones específicas ].
Capacidad para realizar tareas complejas
El tratamiento con IMITREX 25 mg inyectable puede causar somnolencia y mareos; instruir a los pacientes para que evalúen su capacidad para realizar tareas complejas después de la administración de IMITREX 25 mg inyectable.
Cómo usar la inyección de IMITREX de 100 mg
Proporcionar instrucciones a los pacientes sobre el uso adecuado de la inyección de IMITREX de 100 mg si pueden autoadministrarse la inyección de IMITREX de 50 mg en situaciones sin supervisión médica.
Informe a los pacientes que la aguja de la pluma IMITREX STATdose penetra aproximadamente 1/4 de pulgada (5 a 6 mm). Informe a los pacientes que la inyección debe administrarse por vía subcutánea y que debe evitarse la administración intramuscular o intravascular. Indique a los pacientes que usen sitios de inyección con una piel y un grosor subcutáneo adecuados para acomodar la longitud de la aguja.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Carcinogénesis
En estudios de carcinogenicidad en ratones y ratas en los que se administró sumatriptán por vía oral durante 78 semanas y 104 semanas, respectivamente, a dosis de hasta 160 mg/kg/día (la dosis más alta en ratas se redujo de 360 mg/kg/día durante la semana 21 ). La dosis más alta para ratones y ratas fue de aproximadamente 130 y 260 veces la MRHD única de 6 mg administrada por vía subcutánea sobre una base de mg/m². No hubo evidencia en ninguna de las especies de un aumento en los tumores relacionados con la administración de sumatriptán.
mutagénesis
Sumatriptán fue negativo en ensayos in vitro (mutación bacteriana inversa [Ames], mutación de células genéticas en hámster chino V79/HGPRT, aberración cromosómica en linfocitos humanos) e in vivo (micronúcleo de rata).
Deterioro de la fertilidad
Cuando se administró sumatriptán por inyección subcutánea a ratas macho y hembra antes y durante el período de apareamiento, no hubo evidencia de alteración de la fertilidad en dosis de hasta 60 mg/kg/día o aproximadamente 100 veces la dosis humana única de 6 mg en un base mg/m². Cuando se administró sumatriptán (5, 50, 500 mg/kg/día) por vía oral a ratas macho y hembra antes y durante el período de apareamiento, hubo una disminución de la fertilidad relacionada con el tratamiento secundaria a una disminución del apareamiento en animales tratados con dosis superior a 5 mg/kg/día. No está claro si este hallazgo se debió a un efecto en los hombres, las mujeres o ambos.
Uso en poblaciones específicas
El embarazo
Embarazo Categoría C
No existen ensayos adecuados y bien controlados de IMITREX 50 mg inyectable en mujeres embarazadas. En estudios de toxicidad del desarrollo en ratas y conejos, la administración oral de sumatriptán a animales preñados se asoció con embrioletalidad, anomalías fetales y mortalidad de crías. Cuando se administró por vía intravenosa a conejas preñadas, sumatriptán fue embrioletal. La inyección de IMITREX de 100 mg debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto.
La administración oral de sumatriptán a ratas preñadas durante el período de organogénesis resultó en una mayor incidencia de anomalías en los vasos sanguíneos fetales (cervicotorácicos y umbilicales). La dosis más alta sin efecto para la toxicidad del desarrollo embriofetal en tasas fue de 60 mg/kg/día, o aproximadamente 100 veces la dosis única máxima recomendada en humanos (MRHD) de 6 mg administrada por vía subcutánea sobre una base de mg/m². La administración oral de sumatriptán a conejas preñadas durante el período de organogénesis resultó en un aumento de la incidencia de embrioletalidad y anomalías esqueléticas y vasculares cervicotorácicas fetales. La administración intravenosa de sumatriptán a conejas preñadas durante el período de organogénesis resultó en una mayor incidencia de embrioletalidad. Las dosis orales e intravenosas más altas sin efecto para la toxicidad del desarrollo en conejos fueron 15 y 0,75 mg/kg/día, o aproximadamente 50 y 2 veces, respectivamente, la DMRH única de 6 mg administrada por vía subcutánea sobre una base de mg/m².
La administración oral de sumatriptán a ratas antes y durante la gestación resultó en toxicidad embriofetal (disminución del peso corporal, disminución de la osificación, aumento de la incidencia de anomalías esqueléticas). La dosis más alta sin efecto fue de 50 mg/kg/día, o aproximadamente 80 veces la MRHD única de 6 mg administrada por vía subcutánea sobre una base de mg/m². En las crías de ratas preñadas tratadas por vía oral con sumatriptán durante la organogénesis, hubo una disminución en la supervivencia de las crías. La dosis más alta sin efecto para este efecto fue de 60 mg/kg/día, o aproximadamente 100 veces la MRHD única de 6 mg administrada por vía subcutánea sobre una base de mg/m². El tratamiento oral de ratas preñadas con sumatriptán durante la última parte de la gestación y durante la lactancia resultó en una disminución en la supervivencia de las crías. La dosis más alta sin efecto para este hallazgo fue de 100 mg/kg/día, o aproximadamente 160 veces la MRHD única de 6 mg administrada por vía subcutánea sobre una base de mg/m².
Madres lactantes
Sumatriptán se excreta en la leche humana después de la administración subcutánea. La exposición infantil a sumatriptán se puede minimizar evitando amamantar durante 12 horas después del tratamiento con IMITREX 50 mg inyectable.
Uso pediátrico
No se ha establecido la seguridad y eficacia en pacientes pediátricos. No se recomienda el uso de IMITREX 100 mg inyectable en pacientes menores de 18 años.
Dos ensayos clínicos controlados evaluaron el aerosol nasal IMITREX (5 a 20 mg) en 1248 migrañosos pediátricos de 12 a 17 años de edad que trataron un solo ataque. Los ensayos no establecieron la eficacia de IMITREX en aerosol nasal en comparación con el placebo en el tratamiento de la migraña en pacientes pediátricos. Las reacciones adversas observadas en estos ensayos clínicos fueron de naturaleza similar a las notificadas en los ensayos clínicos en adultos.
Cinco ensayos clínicos controlados (2 ensayos de ataque único, 3 ensayos de ataque múltiple) que evaluaron IMITREX oral (25 a 100 mg) en pacientes pediátricos de 12 a 17 años reclutaron un total de 701 migrañosos pediátricos. Estos ensayos no establecieron la eficacia de IMITREX 25 mg por vía oral en comparación con el placebo en el tratamiento de la migraña en pacientes pediátricos. Las reacciones adversas observadas en estos ensayos clínicos fueron de naturaleza similar a las notificadas en los ensayos clínicos en adultos. La frecuencia de todas las reacciones adversas en estos pacientes pareció depender tanto de la dosis como de la edad, y los pacientes más jóvenes notificaron reacciones con mayor frecuencia que los pacientes pediátricos de mayor edad.
La experiencia posterior a la comercialización documenta que se han producido reacciones adversas graves en la población pediátrica después del uso de IMITREX por vía subcutánea, oral y/o intranasal. Estos informes incluyen reacciones de naturaleza similar a las que rara vez se informan en adultos, como accidente cerebrovascular, pérdida visual y muerte. Se informó un infarto de miocardio en un hombre de 14 años de edad luego del uso de IMITREX oral; los signos clínicos ocurrieron dentro de 1 día de la administración del fármaco. Actualmente no se dispone de datos clínicos para determinar la frecuencia de reacciones adversas graves en pacientes pediátricos que podrían recibir IMITREX por vía subcutánea, oral o intranasal.
Uso geriátrico
Los ensayos clínicos de la inyección de IMITREX de 100 mg no incluyeron un número suficiente de pacientes de 65 años de edad y mayores para determinar si responden de manera diferente a los pacientes más jóvenes. Otra experiencia clínica informada no ha identificado diferencias en las respuestas entre los ancianos y los pacientes más jóvenes. En general, la selección de la dosis para un paciente de edad avanzada debe ser cautelosa, generalmente comenzando en el extremo inferior del rango de dosificación, lo que refleja la mayor frecuencia de disminución de la función hepática, renal o cardíaca y de enfermedad concomitante u otra terapia con medicamentos.
Se recomienda una evaluación cardiovascular para los pacientes geriátricos que tienen otros factores de riesgo cardiovascular (p. ej., diabetes, hipertensión, tabaquismo, obesidad, antecedentes familiares importantes de CAD) antes de recibir la inyección de IMITREX [ver ADVERTENCIAS Y PRECAUCIONES ].
SOBREDOSIS
Se observó vasoespasmo coronario después de la administración intravenosa de IMITREX 50 mg inyectable [ver CONTRAINDICACIONES ]. Según los datos en animales (perros a 0,1 g/kg, ratas a 2 g/kg), se esperaría que las sobredosis causaran posiblemente convulsiones, temblor, inactividad, eritema de las extremidades, frecuencia respiratoria reducida, cianosis, ataxia, midriasis, reacciones en el lugar de la inyección ( descamación, pérdida de cabello y formación de costras) y parálisis.
La vida media de eliminación de sumatriptán es de aproximadamente 2 horas [ver FARMACOLOGÍA CLÍNICA ]; por lo tanto, el seguimiento de los pacientes después de una sobredosis con IMITREX Inyectable debe continuar durante al menos 10 horas o mientras persistan los síntomas o signos.
Se desconoce qué efecto tiene la hemodiálisis o la diálisis peritoneal sobre las concentraciones séricas de sumatriptán.
CONTRAINDICACIONES
IMITREX Inyectable está contraindicado en pacientes con:
- Enfermedad isquémica de las arterias coronarias (EAC) (angina de pecho, antecedentes de infarto de miocardio o isquemia silenciosa documentada) o vasoespasmo de las arterias coronarias, incluida la angina de Prinzmetal [ver ADVERTENCIAS Y PRECAUCIONES ].
- Síndrome de Wolff-Parkinson-White o arritmias asociadas con otros trastornos de la vía de conducción accesoria cardiaca [ver ADVERTENCIAS Y PRECAUCIONES ].
- Antecedentes de accidente cerebrovascular o accidente isquémico transitorio (AIT) o antecedentes de migraña hemipléjica o basilar porque estos pacientes tienen un mayor riesgo de accidente cerebrovascular [ver ADVERTENCIAS Y PRECAUCIONES ].
- Enfermedad vascular periférica [ver ADVERTENCIAS Y PRECAUCIONES ].
- Enfermedad isquémica intestinal [ver ADVERTENCIAS Y PRECAUCIONES ].
- Hipertensión no controlada [ver ADVERTENCIAS Y PRECAUCIONES ].
- Uso reciente (es decir, dentro de las 24 horas) de medicamentos que contienen ergotamina, medicamentos de tipo ergotamínico (como dihidroergotamina o metisergida) u otro agonista de 5-hidroxitriptamina1 (5-HT1) [ver INTERACCIONES CON LA DROGAS ].
- La administración simultánea de un inhibidor de la monoaminooxidasa (MAO)-A o el uso reciente (dentro de las 2 semanas) de un inhibidor de la MAO-A [ver INTERACCIONES CON LA DROGAS , FARMACOLOGÍA CLÍNICA ].
- Hipersensibilidad a IMITREX (angioedema y anafilaxia observados) [ver ADVERTENCIAS Y PRECAUCIONES ].
- Insuficiencia hepática grave [ver FARMACOLOGÍA CLÍNICA ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
Sumatriptán se une con gran afinidad a los receptores 5-HT1B/1D clonados humanos. Presuntamente, el sumatriptán ejerce sus efectos terapéuticos en el tratamiento de la migraña y las cefaleas en brotes a través de efectos agonistas en los receptores 5-HT1B/1D en los vasos sanguíneos intracraneales y los nervios sensoriales del sistema trigémino, lo que provoca la constricción de los vasos craneales y la inhibición del neuropéptido proinflamatorio. liberar.
Farmacodinámica
Presión arterial
Se ha informado una elevación significativa de la presión arterial, incluida una crisis hipertensiva, en pacientes con y sin antecedentes de hipertensión [ver ADVERTENCIAS Y PRECAUCIONES ].
Arterias periféricas (pequeñas)
En voluntarios sanos (N = 18), un ensayo que evaluó los efectos de sumatriptán en la reactividad arterial periférica (pequeños vasos) no logró detectar un aumento clínicamente significativo en la resistencia periférica.
Ritmo cardiaco
Los aumentos transitorios de la presión arterial observados en algunos pacientes en los ensayos clínicos llevados a cabo durante el desarrollo de sumatriptán como tratamiento para la migraña no estuvieron acompañados de cambios clínicamente significativos en la frecuencia cardíaca.
Farmacocinética
Absorción y Biodisponibilidad
La biodisponibilidad de sumatriptán mediante inyección subcutánea en 18 sujetos masculinos sanos fue del 97 % ± 16 % de la obtenida después de la inyección intravenosa.
Después de una única inyección manual subcutánea de 6 mg en el área del deltoides del brazo en 18 hombres sanos (edad: 24 ± 6 años, peso: 70 kg), la concentración sérica máxima (Cmax) de sumatriptán fue (media ± desviación estándar) 74 ± 15 ng/mL y el tiempo hasta la concentración máxima (Tmax) fue de 12 minutos después de la inyección (rango: 5 a 20 minutos). En este ensayo, la misma dosis inyectada por vía subcutánea en el muslo dio una Cmáx de 61 ± 15 ng/ml mediante inyección manual frente a 52 ± 15 ng/ml mediante técnicas de autoinyección. La Tmax o cantidad absorbida no se alteró significativamente ni por el sitio ni por la técnica de inyección.
Distribución
La unión a proteínas, determinada por diálisis de equilibrio en el rango de concentración de 10 a 1000 ng/ml, es baja, aproximadamente del 14 % al 21 %. No se ha evaluado el efecto de sumatriptán sobre la unión a proteínas de otros fármacos.
Después de una inyección subcutánea de 6 mg en el área del deltoides del brazo en 9 hombres (edad media: 33 años, peso medio: 77 kg), el volumen de distribución del compartimento central de sumatriptán fue de 50 ± 8 litros y la vida media de distribución fue 15 ± 2 minutos.
Metabolismo
Los estudios in vitro con microsomas humanos sugieren que sumatriptán es metabolizado por la MAO, predominantemente la isoenzima A. La mayor parte de una dosis radiomarcada de sumatriptán excretada en la orina es el principal metabolito ácido indolacético (IAA) o el glucurónido IAA, ambos inactivos.
Eliminación
Después de una dosis subcutánea única de 6 mg, el 22 % ± 4 % se excretó en la orina como sumatriptán sin cambios y el 38 % ± 7 % como metabolito IAA.
Luego de una inyección subcutánea de 6 mg en el área del deltoides del brazo, el aclaramiento sistémico de sumatriptán fue de 1194 ± 149 ml/min y la vida media terminal fue de 115 ± 19 minutos.
Poblaciones Específicas
Años
La farmacocinética de sumatriptán en ancianos (edad media: 72 años, 2 hombres y 4 mujeres) y en sujetos con migraña (edad media: 38 años, 25 hombres y 155 mujeres) fue similar a la de los hombres sanos (edad media: 30 años).
Deterioro hepático
Se ha evaluado el efecto de la enfermedad hepática de leve a moderada sobre la farmacocinética de sumatriptán administrado por vía subcutánea. No hubo diferencias significativas en la farmacocinética de sumatriptán administrado por vía subcutánea en sujetos con insuficiencia hepática moderada en comparación con controles sanos. No se ha estudiado la farmacocinética de sumatriptán administrado por vía subcutánea en pacientes con insuficiencia hepática grave. El uso de IMITREX Inyectable en esta población está contraindicado [ver CONTRAINDICACIONES ].
La raza
El aclaramiento sistémico y la Cmax de sumatriptán subcutáneo fueron similares en hombres sanos de raza negra (n = 34) y caucásicos (n = 38).
Estudios de interacción farmacológica
Inhibidores de la monoaminooxidasa-A
En un ensayo de 14 mujeres sanas, el pretratamiento con un inhibidor de la MAO-A disminuyó la eliminación de sumatriptán subcutáneo, lo que resultó en un aumento del doble en el área bajo la curva de concentración plasmática-tiempo (AUC) de sumatriptán, lo que corresponde a un aumento del 40 %. en la vida media de eliminación.
Toxicología Animal Y/o Farmacología
Opacidades Corneales
Los perros que recibieron sumatriptán oral desarrollaron opacidades corneales y defectos en el epitelio corneal. Se observaron opacidades corneales con la dosis más baja probada, 2 mg/kg/día, y estuvieron presentes después de 1 mes de tratamiento. Se observaron defectos en el epitelio corneal en un estudio de 60 semanas. No se realizaron exámenes anteriores para estas toxicidades y no se establecieron dosis sin efecto; sin embargo, la exposición plasmática relativa a la dosis más baja probada fue aproximadamente 3 veces la exposición humana después de una dosis subcutánea de 6 mg.
Estudios clínicos
Migraña
En ensayos clínicos controlados que inscribieron a más de 1000 pacientes durante los ataques de migraña que experimentaban dolor moderado o intenso y uno o más de los síntomas enumerados en la Tabla 3, el alivio comenzó tan pronto como 10 minutos después de una inyección de 50 mg de IMITREX de 6 mg. Las dosis más bajas de IMITREX 100 mg inyectables también pueden resultar efectivas, aunque la proporción de pacientes que obtuvieron un alivio adecuado disminuyó y la latencia de ese alivio es mayor con dosis más bajas.
En el Estudio 1, se compararon 6 dosis diferentes de IMITREX de 100 mg inyectables (n = 30 de cada grupo) con placebo (n = 62), en un diseño de grupo paralelo de ataque único, se encontró que la relación dosis-respuesta es la que se muestra en la Tabla 2.
En 2 ensayos clínicos aleatorizados, controlados con placebo de IMITREX 25 mg Inyectable 6 mg en 1104 pacientes con dolor de migraña moderado o severo (Estudios 2 y 3), el inicio del alivio fue de menos de 10 minutos. El alivio del dolor de cabeza, definido por una reducción del dolor de severo o moderadamente severo a leve o sin dolor de cabeza, se logró en el 70% de los pacientes dentro de 1 hora de una sola dosis subcutánea de 6 mg de IMITREX Inyectable. Aproximadamente el 82 % y el 65 % de los pacientes tratados con IMITREX 6 mg tuvieron alivio del dolor de cabeza y estuvieron libres de dolor en 2 horas, respectivamente.
La Tabla 3 muestra los resultados de eficacia a 1 y 2 horas para IMITREX Inyectable de 6 mg en los Estudios 2 y 3.
La inyección de IMITREX de 100 mg también alivió la fotofobia, la fonofobia (sensibilidad al sonido), las náuseas y los vómitos asociados con los ataques de migraña. Se observó una eficacia similar cuando los pacientes se autoadministraron la inyección de 50 mg de IMITREX usando la pluma STATdose de 100 mg de IMITREX.
La eficacia de IMITREX Inyectable no se vio afectada por si la migraña se asoció o no con aura, la duración del ataque, el sexo o la edad del paciente, o el uso concomitante de medicamentos profilácticos comunes para la migraña (p. ej., betabloqueantes).
Terrible dolor de cabeza
La eficacia de IMITREX Inyectable en el tratamiento agudo de la cefalea en brotes se demostró en 2 ensayos cruzados de 2 períodos, aleatorizados, doble ciego, controlados con placebo (Estudios 4 y 5). Se inscribieron pacientes de 21 a 65 años de edad y se les indicó que trataran un dolor de cabeza de moderado a muy intenso dentro de los 10 minutos posteriores al inicio. El alivio de la cefalea se definió como una reducción de la intensidad de la cefalea a leve o sin dolor. En ambos ensayos, la proporción de individuos que obtuvieron alivio a los 10 o 15 minutos fue significativamente mayor entre los pacientes que recibieron 6 mg de IMITREX Inyectable en comparación con los que recibieron placebo (consulte la Tabla 4).
En la Figura 1 se presenta una estimación de la probabilidad acumulada de que un paciente con cefalea en brotes obtenga alivio después de ser tratado con IMITREX 25 mg inyectable o con placebo.
Figura 1: Tiempo hasta el alivio de la cefalea en racimo desde el momento de la inyeccióna 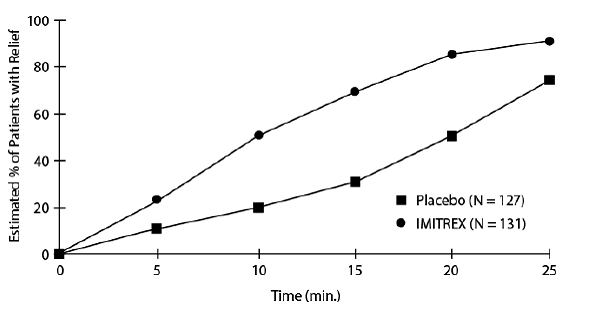
aLa figura utiliza la Gráfica de Supervivencia de Kaplan-Meier (límite de producto). Los pacientes que tomaban medicación de rescate fueron censurados a los 15 minutos.
El gráfico se construyó con datos de pacientes que experimentaron alivio o no requirieron (solicitaron) medicación de rescate dentro de un período de 2 horas después del tratamiento. Como consecuencia, los datos del gráfico se derivan solo de un subconjunto de los 258 dolores de cabeza tratados (se requirió medicación de rescate en 52 de los 127 dolores de cabeza tratados con placebo y en 18 de los 131 dolores de cabeza tratados con IMITREX 50 mg inyectable).
Otros datos sugieren que el tratamiento con IMITREX 25 mg inyectable no está asociado con un aumento en la recurrencia temprana del dolor de cabeza y tiene poco efecto sobre la incidencia de dolores de cabeza posteriores (es decir, los que ocurren después de 2, pero antes de las 18 o 24 horas).
INFORMACIÓN DEL PACIENTE
IMITREX® (IM-i-trex) (succinato de sumatriptán) Inyección
Lea esta información para el paciente antes de comenzar a tomar IMITREX y cada vez que renueve su receta. Es posible que haya nueva información. Esta información no reemplaza la conversación con su proveedor de atención médica sobre su condición médica o tratamiento.
¿Cuál es la información más importante que debo saber sobre IMITREX?
IMITREX puede causar efectos secundarios graves, que incluyen:
Ataque cardíaco y otros problemas cardíacos. Los problemas cardíacos pueden conducir a la muerte.
Deje de tomar IMITREX 25 mg y obtenga ayuda médica de emergencia de inmediato si tiene alguno de los siguientes síntomas de un ataque al corazón:
- malestar en el centro del pecho que dura más de unos pocos minutos, o que desaparece y regresa
- opresión, dolor, presión o pesadez intensos en el pecho, la garganta, el cuello o la mandíbula
- dolor o malestar en los brazos, la espalda, el cuello, la mandíbula o el estómago
- dificultad para respirar con o sin malestar en el pecho
- estallando en un sudor frío
- náuseas o vómitos
- sentirse mareado
IMITREX no es para personas con factores de riesgo de enfermedad cardíaca a menos que se realice un examen cardíaco y no muestre ningún problema. Usted tiene un mayor riesgo de enfermedad cardíaca si:
- tiene presión arterial alta
- tener niveles altos de colesterol
- fumar
- tienen sobrepeso
- tener diabetes
- tiene antecedentes familiares de enfermedades del corazón
¿Qué es IMITREX®?
IMITREX Inyectable es un medicamento recetado que se usa para tratar las migrañas agudas con o sin aura y las cefaleas en racimos agudas en adultos a quienes se les ha diagnosticado migraña o cefaleas en racimos.
IMITREX 50 mg no se usa para tratar otros tipos de dolores de cabeza, como las migrañas hemipléjica (que le impiden moverse de un lado del cuerpo) o basilar (forma rara de migraña con aura).
IMITREX 100 mg no se usa para prevenir o disminuir la cantidad de migrañas o dolores de cabeza en brotes que tiene.
No se sabe si IMITREX 100 mg es seguro y efectivo en niños menores de 18 años.
¿Quién no debe tomar IMITREX 100mg?
No tome IMITREX 50 mg si tiene:
- problemas cardíacos o antecedentes de problemas cardíacos
- estrechamiento de los vasos sanguíneos de las piernas, los brazos, el estómago o los riñones (enfermedad vascular periférica)
- presión arterial alta no controlada
- problemas hepáticos severos
- Migrañas hemipléjicas o migrañas basilares. Si no está seguro de tener este tipo de migrañas, consulte a su proveedor de atención médica.
- tuvo un accidente cerebrovascular, ataques isquémicos transitorios (AIT) o problemas con la circulación sanguínea
- tomado alguno de los siguientes medicamentos en las últimas 24 horas:
- almotriptán (AXERT®)
- eletriptán (RELPAX®)
- frovatriptán (FROVA®)
- naratriptán (AMERGE®)
- rizatriptán (MAXALT®, MAXALT-MLT®)
- sumatriptán y naproxeno (TREXIMET®)
- ergotaminas (CAFERGOT®, ERGOMAR®, MIGERGOT®)
- dihidroergotamina (DHE 45®, MIGRANAL®) Pregúntele a su proveedor de atención médica si no está seguro si su medicamento se encuentra en la lista anterior.
- una alergia al sumatriptán o a cualquiera de los ingredientes de IMITREX. Consulte el final de este prospecto para obtener una lista completa de los ingredientes de IMITREX.
¿Qué debo decirle a mi proveedor de atención médica antes de tomar IMITREX?
Antes de tomar IMITREX, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si:
- tiene presión arterial alta
- tener colesterol alto
- tener diabetes
- fumar
- tienen sobrepeso
- tiene problemas cardíacos o antecedentes familiares de problemas cardíacos o accidente cerebrovascular
- tiene problemas renales
- tiene problemas hepáticos
- ha tenido epilepsia o convulsiones
- no están usando métodos anticonceptivos efectivos
- quedar embarazada mientras toma IMITREX
- están amamantando o planean amamantar. IMITREX 25 mg pasa a la leche materna y puede dañar a su bebé. Hable con su proveedor de atención médica sobre la mejor manera de alimentar a su bebé si toma IMITREX.
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos a base de hierbas.
IMITREX y ciertos otros medicamentos pueden afectarse entre sí, causando efectos secundarios graves.
Dígale especialmente a su proveedor de atención médica si toma medicamentos antidepresivos llamados:
- inhibidores selectivos de la recaptación de serotonina (ISRS)
- inhibidores de la recaptación de serotonina y norepinefrina (IRSN)
- antidepresivos tricíclicos (ATC)
- inhibidores de la monoaminooxidasa (IMAO)
Pídale a su proveedor de atención médica o farmacéutico una lista de estos medicamentos si no está seguro.
Conozca los medicamentos que toma. Mantenga una lista de ellos para mostrársela a su proveedor de atención médica o farmacéutico cuando obtenga un medicamento nuevo.
¿Cómo debo tomar IMITREX 100 mg?
- Ciertas personas deben tomar su primera dosis de IMITREX 25 mg en el consultorio de su proveedor de atención médica o en otro entorno médico. Pregúntele a su proveedor de atención médica si debe tomar su primera dosis en un entorno médico.
- Use IMITREX 50 mg exactamente como su proveedor de atención médica le indique que lo use.
- Su proveedor de atención médica puede cambiar su dosis. No cambie su dosis sin hablar primero con su proveedor de atención médica.
- Para adultos, la dosis habitual es una inyección única administrada justo debajo de la piel.
- Debe administrar una inyección tan pronto como comiencen los síntomas de su dolor de cabeza, pero puede administrarse en cualquier momento durante un ataque de migraña o dolor de cabeza en racimos.
- Si no obtuvo ningún alivio después de la primera inyección, no aplique una segunda inyección sin hablar primero con su proveedor de atención médica.
- Si su dolor de cabeza regresa o solo obtiene algo de alivio después de su primera inyección, puede recibir una segunda inyección 1 hora después de la primera inyección, pero no antes.
- No tome más de 12 mg en un período de 24 horas.
- Si usa demasiado IMITREX 25 mg, llame a su proveedor de atención médica o vaya a la sala de emergencias del hospital más cercano de inmediato.
- Debe anotar cuándo tiene dolores de cabeza y cuándo toma IMITREX para que pueda hablar con su proveedor de atención médica sobre cómo le está funcionando IMITREX 25 mg.
¿Qué debo evitar mientras tomo imitrex?
IMITREX puede causar mareos, debilidad o somnolencia. Si tiene estos síntomas, no conduzca un automóvil, no use maquinaria ni haga nada en lo que necesite estar alerta.
¿Cuáles son los posibles efectos secundarios de IMITREX 25mg?
IMITREX puede causar efectos secundarios graves. Consulte "¿Cuál es la información más importante que debo saber sobre IMITREX?"
Estos efectos secundarios graves incluyen:
- cambios en el color o la sensación en los dedos de las manos y los pies (síndrome de Raynaud)
- problemas estomacales e intestinales (eventos isquémicos gastrointestinales y colónicos). Los síntomas de eventos isquémicos gastrointestinales y colónicos incluyen:
- dolor de estómago repentino o severo
- dolor de estomago despues de las comidas
- pérdida de peso
- náuseas o vómitos
- estreñimiento o diarrea
- diarrea con sangre
- fiebre
- problemas con la circulación sanguínea en las piernas y los pies (isquemia vascular periférica). Los síntomas de la isquemia vascular periférica incluyen:
- calambres y dolor en las piernas o las caderas
- sensación de pesadez o tensión en los músculos de las piernas
- ardor o dolor en los pies o los dedos de los pies mientras descansa
- entumecimiento, hormigueo o debilidad en las piernas
- sensación de frío o cambios de color en una o ambas piernas o pies
- urticaria (protuberancias que pican); hinchazón de la lengua, la boca o la garganta
- Dolores de cabeza por uso excesivo de medicamentos. Algunas personas que usan demasiadas inyecciones de IMITREX de 100 mg pueden tener peores dolores de cabeza (dolor de cabeza por uso excesivo de medicamentos). Si sus dolores de cabeza empeoran, su proveedor de atención médica puede decidir interrumpir su tratamiento con IMITREX.
- síndrome serotoninérgico. El síndrome serotoninérgico es un problema raro pero grave que puede ocurrir en personas que usan IMITREX, especialmente si IMITREX 50 mg se usa con medicamentos antidepresivos llamados ISRS o IRSN. Llame a su proveedor de atención médica de inmediato si tiene alguno de los siguientes síntomas del síndrome serotoninérgico:
- cambios mentales como ver cosas que no existen (alucinaciones), agitación o coma
- latidos cardíacos acelerados
- cambios en la presión arterial
- temperatura corporal alta
- músculos tensos
- problemas para caminar
- convulsiones Se han producido convulsiones en personas que toman IMITREX que nunca antes han tenido convulsiones. Hable con su proveedor de atención médica sobre la posibilidad de tener convulsiones mientras toma IMITREX.
Los efectos secundarios más comunes de la inyección de IMITREX de 50 mg incluyen:
- dolor o enrojecimiento en el lugar de la inyección
- hormigueo o entumecimiento en los dedos de las manos o de los pies
- mareo
- sensación de calor, calor y ardor en la cara (rubefacción)
- malestar o rigidez en el cuello
- sentirse débil, somnoliento o cansado
Informe a su proveedor de atención médica si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de IMITREX. Para obtener más información, consulte a su proveedor de atención médica o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar la inyección de IMITREX?
- Almacene IMITREX entre 36 °F y 86 °F (2 °C y 30 °C).
- Guarde su medicamento lejos de la luz.
- Guarde su medicamento en el empaque o estuche de transporte provisto con él.
Mantenga IMITREX y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de IMITREX
veces, los medicamentos se prescriben para fines distintos a los que se enumeran en los folletos de información para el paciente. No use IMITREX para una condición para la cual no fue recetado. No le dé IMITREX 25 mg a otras personas, incluso si tienen los mismos síntomas que usted. Puede que les haga daño.
Este folleto de información para el paciente resume la información más importante sobre IMITREX. Si desea obtener más información, hable con su proveedor de atención médica. Puede pedirle a su proveedor de atención médica o farmacéutico información sobre IMITREX escrita para profesionales de atención médica.
Para obtener más información, visite www.gsk.com o llame al 1-888-825-5249.
¿Cuáles son los ingredientes de IMITREX Inyectable?
Principio activo: succinato de sumatriptán
Ingredientes inactivos: cloruro de sodio, agua para inyección
Esta información para el paciente e instrucciones de uso ha sido aprobada por la Administración de Drogas y Alimentos de EE. UU.Instrucciones de uso para el paciente
Sistema de dosificación IMITREX STAT
Lea estas Instrucciones de uso para el paciente antes de comenzar a utilizar el sistema IMITREX STATdose. Es posible que haya nueva información. Esta información no reemplaza la conversación con su proveedor de atención médica sobre su condición médica o tratamiento. Usted y su proveedor de atención médica deben hablar sobre la inyección de IMITREX de 25 mg cuando comience a tomarla y en los controles regulares.
Mantenga el sistema IMITREX STATdose fuera del alcance de los niños.
Antes de usar el sistema IMITREX STATdose
Cuando abre por primera vez la caja del sistema IMITREX 25mg STATdose, el paquete del cartucho y el IMITREX STATdose Pen® ya están en el estuche de transporte para su comodidad.
El gris y azul Estuche de transporte se utiliza para almacenar la pluma descargada y el paquete de cartuchos cuando no se utilizan.
los Paquete de cartucho Capacidad para 2 sellados individualmente. Cartuchos de jeringa Cada cartucho de jeringa contiene 1 dosis de IMITREX® (succinato de sumatriptán) inyectable. El Cartucho de la concentración de 4 mg de este medicamento es amarillo y el Cartucho de la concentración de 6 mg es azul (como se muestra). Los paquetes de cartuchos de recarga están disponibles.
El gris y azul Lápiz se utiliza para inyectar automáticamente 1 dosis de medicamento de un cartucho de jeringa. no toques el Botón azul hasta que haya presionado la pluma contra su piel para administrar una dosis. Si lo presiona en cualquier otro momento, podría perder una dosis. los Atrapada segura evita que el Pen se dispare accidentalmente hasta que esté listo. El bolígrafo solo funcionará cuando deslices la parte gris del cilindro hacia la parte azul. Siempre asegúrese de que la varilla de cebado blanca no sobresalga del extremo de la pluma (como se muestra en la Figura B) antes de cargar un cartucho de jeringa nuevo. Si sobresale, perderá esa dosis.
Cómo cargar la pluma IMITREX STATdose
No cargue la pluma hasta que esté listo para administrarse una inyección. No toque el botón azul en la parte superior del bolígrafo (consulte la figura A) mientras carga el bolígrafo.
Figura A 
Figura B 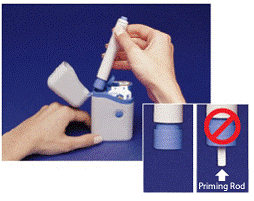
1. Abra la tapa del estuche de transporte. Los sellos de seguridad sobre los 2 cartuchos de jeringa están etiquetados como "A" y "B" (ver Figura A recuadro ).
Siempre use el cartucho de jeringa marcado con una "A" antes del marcado con una "B" para ayudarlo a llevar un registro de sus dosis. No lo use si alguno de los sellos está roto o falta cuando abre el estuche de transporte por primera vez.
2. Quite uno de los sellos de seguridad (ver Figura A ). Deseche el sello. Abra la tapa sobre el cartucho de jeringa.
3. Sostenga el Pen por los surcos de la parte superior. Saque la pluma del estuche de transporte (consulte Figura B ).
Asegúrese de que la varilla de cebado blanca no sobresalga del extremo inferior de la pluma (consulte Recuadro de la figura B ). Si sobresale, vuelva a colocar el lápiz en el estuche de transporte y presione hacia abajo con firmeza hasta que sienta que hace clic. Saque el bolígrafo del estuche de transporte.
Figura C 
4. Ponga la Pluma en el Cartucho. Gírelo hacia la derecha (en el sentido de las agujas del reloj) hasta que no gire más (media vuelta aproximadamente) (ver Figura C ).
5. Sujete el Pen cargado por los bordes y tire de él hacia afuera (consulte Figura D ). Es posible que deba tirar con fuerza del Pen, pero esto es normal. No presione el botón azul todavía.
Figura D 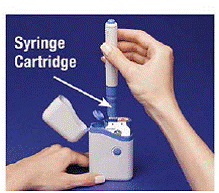
El Pen ahora está listo para usar. No haga vuelva a colocar la pluma cargada en el estuche de transporte porque eso dañará la aguja.
Cómo usar la pluma de dosificación IMITREX STAT para tomar su medicamento
Antes de inyectar su medicamento, elija un área con una capa de tejido adiposo (vea la Figura E o la Figura F). Pregúntele a su proveedor de atención médica si tiene alguna duda sobre dónde inyectar su medicamento.
Para preparar el área de la piel donde se inyectará IMITREX, limpie el lugar de la inyección con una toallita con alcohol. No vuelva a tocar esta área antes de aplicar la inyección.
Figura E o Figura F Figura G 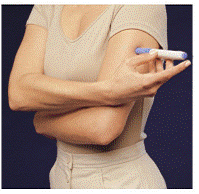
6. Sin presionar el botón azul, presione la pluma cargada firmemente contra la piel para que el cilindro gris se deslice hacia la sección azul que sostiene el cartucho de la jeringa (ver Figura D ). (Esto libera el cierre de seguridad que evita que el lápiz se dispare por error hasta que esté listo).
7. Pulse el botón azul. Sostenga el lápiz quieto durante al menos 5 segundos . Si retira la pluma de la piel demasiado pronto, no saldrá todo el medicamento.
8 Después de 5 segundos , retire con cuidado la pluma de su piel. La aguja estará mostrando (ver Figura G ). No toque la aguja.
Cómo descargar la pluma de dosis IMITREX STAT después de tomar su medicamento
Inmediatamente después de tomar una dosis con la pluma, debe devolver el cartucho de jeringa usado al paquete de cartuchos.
Figura H Figura I y Figura J 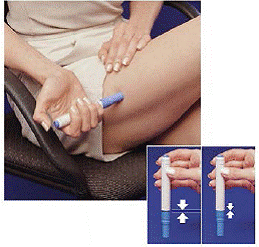
9. Empuje la Pluma hacia abajo en el lado vacío del Cartucho hasta el tope (ver Figura H ).
10. Gire la pluma hacia la izquierda (en sentido contrario a las agujas del reloj) aproximadamente media vuelta hasta que se suelte del cartucho de la jeringa (consulte figura yo ).
11. Saque la pluma vacía del paquete del cartucho (consulte Figura J ).
Debido a que ya se ha utilizado la pluma, la varilla de cebado blanca sobresaldrá del extremo inferior de la pluma (ver Figura J ).
12. Cierre la tapa del paquete de cartuchos sobre el cartucho de jeringa usado. Cuando los cartuchos de jeringa usados se insertan correctamente, el paquete de cartuchos es un estuche protector desechable para ayudarlo a evitar pinchazos con agujas y usar las jeringas correctamente.
13. Vuelva a colocar el lápiz en el estuche de transporte y presiónelo con firmeza hasta que sienta que hace clic. Cierre la tapa del estuche de transporte. Esto prepara el Pen para el próximo uso.
Si la tapa no se cierra, empuje el lápiz hacia abajo hasta que sienta que hace clic. Luego cierre la tapa.
Cómo sacar un paquete de cartuchos usado
Después de que se hayan usado ambos cartuchos de jeringa, saque el paquete de cartuchos del estuche de transporte. Nunca reutilice ni recicle un cartucho de jeringa.
Figura K Figura L 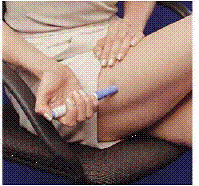
14. Abra la tapa del estuche de transporte.
15. Sostenga el estuche de transporte con una mano y presione los 2 botones a cada lado del estuche de transporte (ver Figura K ).
16. Extraiga con cuidado el paquete de cartuchos con la otra mano (consulte Figura L ).
17. Deseche el paquete de cartuchos o deséchelo según las instrucciones de su proveedor de atención médica. Puede haber leyes estatales y locales especiales para desechar agujas y jeringas usadas. Mantener siempre fuera del alcance de los niños.
Cómo insertar un paquete de cartuchos nuevo
Figura M Figura N y Figura O 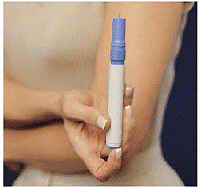
18. Saque el paquete de cartuchos nuevo de su caja. No quite los sellos de seguridad (vea la Figura M).
19. Coloque el paquete de cartuchos en el estuche de transporte. Deslícelo suavemente hacia abajo (consulte Figura N ).
20. El paquete de cartuchos encajará en su lugar cuando los 2 botones se vean a través de los orificios en el estuche de transporte (ver Figura O ). Cerrar la tapa.
Esta información para el paciente e instrucciones de uso ha sido aprobada por la Administración de Drogas y Alimentos de EE. UU.