Cymbalta 20mg, 30mg, 40mg, 60mg Duloxetine Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Cymbalta y cómo se usa?
Cymbalta es un medicamento recetado que se usa para tratar los síntomas del trastorno depresivo mayor, el dolor neuropático periférico diabético, el trastorno de ansiedad generalizada, la fibromialgia y el dolor muscular crónico. Cymbalta se puede usar solo o con otros medicamentos.
- Cymbalta pertenece a una clase de medicamentos llamados antidepresivos, IRSN, agentes de fibromialgia.
- No se sabe si Cymbalta es seguro y efectivo en niños menores de 7 años.
¿Cuáles son los posibles efectos secundarios de Cymbalta 20 mg?
Cymbalta puede causar efectos secundarios graves que incluyen:
- latidos cardíacos fuertes o aleteo en el pecho,
- aturdimiento,
- moretones con facilidad,
- sangrado inusual,
- cambios de visión,
- micción dolorosa o difícil,
- impotencia,
- problemas sexuales,
- dolor de estómago superior derecho,
- Comezón,
- orina oscura,
- coloración amarillenta de la piel o los ojos (ictericia),
- dolor de cabeza,
- confusión,
- dificultad para hablar,
- severa debilidad,
- vómitos,
- pérdida de coordinación,
- sintiéndose inestable,
- pensamientos acelerados,
- mayor energía,
- comportamiento temerario,
- sentirse extremadamente feliz o irritable,
- hablando más de lo habitual, y
- problemas severos con el sueño
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Cymbalta incluyen:
- somnolencia,
- náuseas,
- estreñimiento,
- pérdida de apetito,
- boca seca, y
- aumento de la sudoración
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Cymbalta. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
ADVERTENCIA
PENSAMIENTOS Y CONDUCTAS SUICIDAS
Los antidepresivos aumentaron el riesgo de pensamientos y conductas suicidas en niños, adolescentes y adultos jóvenes en estudios a corto plazo. Estos estudios no mostraron un aumento en el riesgo de pensamientos y conductas suicidas con el uso de antidepresivos en pacientes mayores de 24 años; hubo una reducción en el riesgo con el uso de antidepresivos en pacientes de 65 años o más [ver ADVERTENCIAS Y PRECAUCIONES ].
En pacientes de todas las edades que comienzan con la terapia antidepresiva, controle de cerca el empeoramiento y la aparición de pensamientos y comportamientos suicidas. Aconseje a las familias y cuidadores sobre la necesidad de una estrecha observación y comunicación con el prescriptor [ver ADVERTENCIAS Y PRECAUCIONES ].
DESCRIPCIÓN
CYMBALTA® (cápsulas de liberación retardada de duloxetina) es un inhibidor selectivo de la recaptación de serotonina y norepinefrina (SSNRI) para administración oral. Su designación química es clorhidrato de (+)-(S)-N-metil-γ-(1-naftiloxi)-2-tiofenopropilamina. La fórmula empírica es C18H19NOS•HCl, que corresponde a un peso molecular de 333,88. La fórmula estructural es:
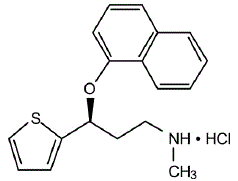
El clorhidrato de duloxetina es un sólido de color blanco a blanco ligeramente parduzco, que es ligeramente soluble en agua.
Cada cápsula contiene gránulos con recubrimiento entérico de 22,4, 33,7 o 67,3 mg de clorhidrato de duloxetina equivalente a 20, 30 o 60 mg de duloxetina, respectivamente. Estos gránulos con cubierta entérica están diseñados para evitar la degradación del fármaco en el ambiente ácido del estómago. Los ingredientes inactivos incluyen FD&C Blue No. 2, gelatina, hipromelosa, succinato de acetato de hidroxipropilmetilcelulosa, laurilsulfato de sodio, sacarosa, esferas de azúcar, talco, dióxido de titanio y citrato de trietilo. Las cápsulas de 20 y 60 mg también contienen óxido de hierro amarillo.
INDICACIONES
CYMBALTA® está indicado para el tratamiento de:
- Trastorno depresivo mayor en adultos
- Trastorno de ansiedad generalizada en adultos y pacientes pediátricos mayores de 7 años
- Dolor neuropático periférico diabético en adultos
- Fibromialgia en adultos y pacientes pediátricos mayores de 13 años
- dolor musculoesquelético crónico en adultos
DOSIFICACIÓN Y ADMINISTRACIÓN
Instrucciones de administración importantes
Administre CYMBALTA por vía oral (con o sin comidas) y trague entero. No mastique ni triture, y no abra la cápsula de liberación retardada y espolvoree su contenido sobre alimentos o mezcle con líquidos porque estas acciones podrían afectar el recubrimiento entérico. Si se olvida una dosis de CYMBALTA 20 mg, tome la dosis olvidada tan pronto como se acuerde. Si es casi la hora de la próxima dosis, omita la dosis olvidada y tome la siguiente dosis a la hora habitual. No tome dos dosis de CYMBALTA 60 mg al mismo tiempo.
Dosis para el tratamiento del trastorno depresivo mayor en adultos
La dosis inicial recomendada en adultos con MDD es de 40 mg/día (administrados como 20 mg dos veces al día) a 60 mg/día (administrados una vez al día o como 30 mg dos veces al día). Para algunos pacientes, puede ser deseable comenzar con 30 mg una vez al día durante 1 semana, para permitir que los pacientes se ajusten a 30 mg de CYMBALTA antes de aumentar a 60 mg una vez al día. Si bien se demostró que una dosis de 120 mg/día es eficaz, no hay evidencia de que dosis superiores a 60 mg/día proporcionen beneficios adicionales. Reevaluar periódicamente para determinar la necesidad de un tratamiento de mantenimiento y la posología adecuada para dicho tratamiento.
Dosis para el tratamiento del trastorno de ansiedad generalizada
Dosis recomendada en adultos menores de 65 años
Para la mayoría de los adultos menores de 65 años con GAD, inicie CYMBALTA 60 mg una vez al día. Para algunos pacientes, puede ser deseable comenzar con 30 mg una vez al día durante 1 semana, para permitir que los pacientes se ajusten a 40 mg de CYMBALTA antes de aumentar a 60 mg una vez al día. Si bien se demostró que una dosis de 120 mg una vez al día es eficaz, no hay evidencia de que las dosis superiores a 60 mg/día proporcionen un beneficio adicional. Sin embargo, si se toma la decisión de aumentar la dosis más allá de 60 mg una vez al día, aumente la dosis en incrementos de 30 mg una vez al día. Reevaluar periódicamente para determinar la necesidad continua de tratamiento de mantenimiento y la dosis adecuada para dicho tratamiento.
Dosis recomendada en pacientes geriátricos
En pacientes geriátricos con GAD, inicie CYMBALTA a una dosis de 30 mg una vez al día durante 2 semanas antes de considerar un aumento a la dosis objetivo de 60 mg/día. Posteriormente, los pacientes pueden beneficiarse de dosis superiores a 60 mg una vez al día. Si se toma la decisión de aumentar la dosis más allá de 60 mg una vez al día, aumente la dosis en incrementos de 30 mg una vez al día. La dosis máxima estudiada fue de 120 mg por día.
Dosis recomendada en pacientes pediátricos de 7 a 17 años de edad
Inicie CYMBALTA 30 mg en pacientes pediátricos de 7 a 17 años de edad con GAD a una dosis de 30 mg una vez al día durante 2 semanas antes de considerar un aumento a 60 mg una vez al día. El rango de dosis recomendado es de 30 a 60 mg una vez al día. Algunos pacientes pueden beneficiarse de dosis superiores a 60 mg una vez al día. Si se toma la decisión de aumentar la dosis más allá de 60 mg una vez al día, aumente la dosis en incrementos de 30 mg una vez al día. La dosis máxima estudiada fue de 120 mg por día.
Dosis para el tratamiento del dolor neuropático periférico diabético en adultos
Administrar 60 mg una vez al día en adultos con dolor neuropático periférico diabético. No hay evidencia de que las dosis superiores a 60 mg una vez al día proporcionen un beneficio significativo adicional y la dosis más alta es claramente menos tolerada. Para los pacientes para quienes la tolerabilidad es una preocupación, se puede considerar una dosis inicial más baja.
Dado que la diabetes se complica con frecuencia por la enfermedad renal, considere una dosis inicial más baja y un aumento gradual de la dosis para pacientes con insuficiencia renal [ver Posología en pacientes con insuficiencia hepática o insuficiencia renal grave y Uso en poblaciones específicas ].
Dosis para el tratamiento de la fibromialgia
Dosis recomendada en adultos
La dosis recomendada de CYMBALTA es de 60 mg una vez al día en adultos con fibromialgia. Comience el tratamiento con 30 mg una vez al día durante 1 semana, para permitir que los pacientes se ajusten a 20 mg de CYMBALTA antes de aumentar a 60 mg una vez al día. Algunos pacientes pueden responder a la dosis inicial. No hay evidencia de que las dosis superiores a 60 mg/día otorguen un beneficio adicional, incluso en pacientes que no responden a una dosis de 60 mg/día, y las dosis más altas se asociaron con una mayor tasa de reacciones adversas.
Dosis recomendada en pacientes pediátricos de 13 a 17 años de edad
La dosis inicial recomendada de CYMBALTA de 60 mg en pacientes pediátricos de 13 a 17 años con fibromialgia es de 30 mg una vez al día. La dosis puede aumentarse a 60 mg una vez al día según la respuesta y la tolerabilidad.
Dosis para el tratamiento del dolor musculoesquelético crónico en adultos
La dosis recomendada de CYMBALTA es de 60 mg una vez al día en adultos con dolor musculoesquelético crónico. Comience el tratamiento con 30 mg una vez al día durante una semana, para permitir que los pacientes se adapten a CYMBALTA antes de aumentar a 60 mg una vez al día. No hay evidencia de que las dosis más altas confieran un beneficio adicional, incluso en pacientes que no responden a una dosis de 60 mg una vez al día, y las dosis más altas se asocian con una tasa más alta de reacciones adversas [ver Estudios clínicos ].
Posología en pacientes con insuficiencia hepática o insuficiencia renal grave
Evite el uso en pacientes con enfermedad hepática crónica o cirrosis [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
Evite el uso en pacientes con insuficiencia renal grave, TFG ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
Suspensión de CYMBALTA
Las reacciones adversas después de la interrupción de CYMBALTA, después de la interrupción abrupta o gradual, incluyen: mareos, dolor de cabeza, náuseas, diarrea, parestesia, irritabilidad, vómitos, insomnio, ansiedad, hiperhidrosis y fatiga. Siempre que sea posible, se recomienda una reducción gradual de la dosis en lugar de un cese abrupto [ver ADVERTENCIAS Y PRECAUCIONES ].
Cambio de un paciente a o desde un inhibidor de la monoaminooxidasa (IMAO) destinado a tratar trastornos psiquiátricos
Deben transcurrir al menos 14 días entre la interrupción de un IMAO destinado a tratar trastornos psiquiátricos y el inicio de la terapia con CYMBALTA. Por el contrario, se deben permitir al menos 5 días después de suspender CYMBALTA 60 mg antes de comenzar un IMAO destinado a tratar trastornos psiquiátricos [ver CONTRAINDICACIONES ].
Uso de CYMBALTA con otros IMAO como linezolid o azul de metileno
No comience con CYMBALTA en un paciente que está siendo tratado con linezolid o azul de metileno por vía intravenosa porque existe un mayor riesgo de síndrome serotoninérgico. En un paciente que requiere un tratamiento más urgente de una condición psiquiátrica, se deben considerar otras intervenciones, incluida la hospitalización [ver CONTRAINDICACIONES ].
En algunos casos, un paciente que ya recibe terapia con CYMBALTA puede requerir tratamiento urgente con linezolid o azul de metileno por vía intravenosa. Si no se dispone de alternativas aceptables al tratamiento con linezolid o azul de metileno intravenoso y se considera que los beneficios potenciales del tratamiento con linezolid o azul de metileno intravenoso superan los riesgos del síndrome serotoninérgico en un paciente en particular, se debe suspender inmediatamente CYMBALTA y linezolid o azul de metileno intravenoso. se puede administrar Se debe monitorear al paciente para detectar síntomas del síndrome serotoninérgico durante 5 días o hasta 24 horas después de la última dosis de linezolid o azul de metileno intravenoso, lo que ocurra primero. La terapia con CYMBALTA se puede reanudar 24 horas después de la última dosis de linezolid o azul de metileno intravenoso [ver ADVERTENCIAS Y PRECAUCIONES ].
No está claro el riesgo de administrar azul de metileno por vías no intravenosas (como tabletas orales o inyección local) o en dosis intravenosas mucho más bajas que 1 mg/kg con CYMBALTA. No obstante, el médico debe ser consciente de la posibilidad de síntomas emergentes del síndrome serotoninérgico con dicho uso [ver ADVERTENCIAS Y PRECAUCIONES ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
CYMBALTA está disponible en cápsulas de liberación retardada:
- Cápsulas verdes opacas de 20 mg impresas con “Lilly 3235 20mg”
- Cápsulas opacas de color blanco y azul de 30 mg impresas con “Lilly 3240 30mg”
- Cápsulas verdes y azules opacas de 60 mg impresas con “Lilly 3270 60mg”
CYMBALTA (cápsulas de liberación retardada de duloxetina) está disponible en las siguientes potencias, colores, estampados y presentaciones:
Almacenamiento y manipulación
Almacenar a 25°C (77°F); excursiones permitidas a 15-30°C (59-86°F) [consulte Temperatura ambiente controlada por USP].
Comercializado por: Lilly USA, LLC Indianapolis, IN 46285, EE. UU. Revisado: julio de 2021
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas graves se describen a continuación y en otras partes de la etiqueta:
- Pensamientos y conductas suicidas en niños, adolescentes y adultos jóvenes [ver CUADRO DE ADVERTENCIA y ADVERTENCIAS Y PRECAUCIONES ]
- Hepatotoxicidad [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hipotensión ortostática, caídas y síncope [ver ADVERTENCIAS Y PRECAUCIONES ]
- Síndrome serotoninérgico [ver ADVERTENCIAS Y PRECAUCIONES ]
- Mayor riesgo de sangrado [ver ADVERTENCIAS Y PRECAUCIONES ]
- Reacciones cutáneas graves [ver ADVERTENCIAS Y PRECAUCIONES ]
- Síndrome de discontinuación [ver ADVERTENCIAS Y PRECAUCIONES ]
- Activación de manía/hipomanía [ver ADVERTENCIAS Y PRECAUCIONES ]
- Glaucoma de ángulo cerrado [ver ADVERTENCIAS Y PRECAUCIONES ]
- Convulsiones [ver ADVERTENCIAS Y PRECAUCIONES ]
- Aumentos en la presión arterial [ver ADVERTENCIAS Y PRECAUCIONES ]
- Interacciones farmacológicas clínicamente importantes [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hiponatremia [ver ADVERTENCIAS Y PRECAUCIONES ]
- Vacilación y retención urinaria [ver ADVERTENCIAS Y PRECAUCIONES ]
- Disfunción sexual [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Las frecuencias indicadas de reacciones adversas representan la proporción de pacientes que experimentaron, al menos una vez, una reacción adversa emergente del tratamiento del tipo enumerado. Una reacción se consideró emergente del tratamiento si ocurría por primera vez o empeoraba mientras recibía la terapia después de la evaluación inicial.
Reacciones adversas en adultos
Base de datos de ensayos clínicos para adultos
Los datos que se describen a continuación reflejan la exposición a CYMBALTA en ensayos en adultos controlados con placebo para MDD (N=3779), GAD (N=1018), OA (N=503), CLBP (N=600), DPNP (N=906), y FM (N=1294). El rango de edad en esta población agrupada fue de 17 a 89 años de edad. En esta población agrupada, el 66 %, 61 %, 61 %, 43 % y 94 % de los pacientes adultos eran mujeres; y el 82 %, 73 %, 85 %, 74 % y 86 % de los pacientes adultos eran caucásicos en las poblaciones MDD, GAD, OA y CLBP, DPNP y FM, respectivamente. La mayoría de los pacientes recibieron dosis de CYMBALTA de un total de 60 a 120 mg por día [ver Estudios clínicos ]. Los datos a continuación no incluyen los resultados del ensayo que evaluó la eficacia de CYMBALTA 30 mg para el tratamiento del TAG en pacientes ≥65 años (Estudio GAD-5) [ver Estudios clínicos ]; sin embargo, las reacciones adversas observadas en esta población geriátrica fueron generalmente similares a las reacciones adversas en la población adulta en general.
Reacciones adversas que llevaron a la interrupción del tratamiento en ensayos controlados con placebo en adultos
Trastorno depresivo mayor
Aproximadamente el 8,4 % (319/3779) de los pacientes tratados con CYMBALTA en ensayos en adultos controlados con placebo para MDD interrumpieron el tratamiento debido a una reacción adversa, en comparación con el 4,6 % (117/2536) de los pacientes tratados con placebo. Las náuseas (1,1 % de CYMBALTA, 0,4 % de placebo) fueron la única reacción adversa notificada como motivo de interrupción y que se consideró relacionada con el fármaco (es decir, la interrupción ocurrió en al menos el 1 % de los pacientes tratados con CYMBALTA y a una tasa de al menos menos el doble que los pacientes tratados con placebo).
Trastorno de ansiedad generalizada
Aproximadamente el 13,7 % (139/1018) de los pacientes tratados con CYMBALTA en ensayos en adultos controlados con placebo para el TAG interrumpieron el tratamiento debido a una reacción adversa, en comparación con el 5 % (38/767) de los pacientes tratados con placebo. Las reacciones adversas frecuentes notificadas como motivo de la suspensión y que se consideraron relacionadas con el fármaco (como se definió anteriormente) incluyeron náuseas (CYMBALTA 3,3 %, placebo 0,4 %) y mareos (CYMBALTA 1,3 %, placebo 0,4 %).
Dolor neuropático periférico diabético
Aproximadamente el 12,9 % (117/906) de los pacientes tratados con CYMBALTA en ensayos en adultos controlados con placebo para DPNP interrumpieron el tratamiento debido a una reacción adversa, en comparación con el 5,1 % (23/448) de los pacientes tratados con placebo. Las reacciones adversas frecuentes notificadas como motivo de la suspensión y que se consideraron relacionadas con el fármaco (como se definió anteriormente) incluyeron náuseas (CYMBALTA 3,5 %, placebo 0,7 %), mareos (CYMBALTA 1,2 %, placebo 0,4 %) y somnolencia (CYMBALTA 1,1 % , placebo 0%).
fibromialgia
Aproximadamente el 17,5 % (227/1294) de los pacientes tratados con CYMBALTA en ensayos en adultos controlados con placebo de 3 a 6 meses para la FM interrumpieron el tratamiento debido a una reacción adversa, en comparación con el 10,1 % (96/955) de los pacientes tratados con placebo . Las reacciones adversas notificadas como motivo de la suspensión y que se consideraron relacionadas con el fármaco (como se definió anteriormente) incluyeron náuseas (CYMBALTA 2,0 %, placebo 0,5 %), dolor de cabeza (CYMBALTA 1,2 %, placebo 0,3 %), somnolencia (CYMBALTA 1,1 %, placebo 0 %) y fatiga (CYMBALTA 1,1 %, placebo 0,1 %).
Dolor crónico debido a la osteoartritis
Aproximadamente el 15,7 % (79/503) de los pacientes tratados con CYMBALTA en ensayos en adultos controlados con placebo de 13 semanas para el dolor crónico debido a la OA interrumpieron el tratamiento debido a una reacción adversa, en comparación con el 7,3 % (37/508) de los tratados con placebo. pacientes tratados. Las reacciones adversas notificadas como motivo de interrupción y que se consideraron relacionadas con el fármaco (según se definió anteriormente) incluyeron náuseas (CYMBALTA 2,2 %, placebo 1 %).
Dolor lumbar crónico
Aproximadamente el 16,5 % (99/600) de los pacientes tratados con CYMBALTA en ensayos en adultos controlados con placebo de 13 semanas para CLBP interrumpieron el tratamiento debido a una reacción adversa, en comparación con el 6,3 % (28/441) de los pacientes tratados con placebo. Las reacciones adversas notificadas como motivo de interrupción y que se consideraron relacionadas con el fármaco (como se definió anteriormente) incluyeron náuseas (CYMBALTA 3 %, placebo 0,7 %) y somnolencia (CYMBALTA 1 %, placebo 0 %).
Reacciones adversas más comunes en ensayos con adultos
Las reacciones adversas observadas con mayor frecuencia en pacientes tratados con CYMBALTA (como se definió anteriormente) fueron:
- Dolor neuropático periférico diabético: náuseas, somnolencia, disminución del apetito, estreñimiento, hiperhidrosis y boca seca.
- Fibromialgia: náuseas, sequedad de boca, estreñimiento, somnolencia, disminución del apetito, hiperhidrosis y agitación.
- Dolor crónico debido a la osteoartritis: náuseas, fatiga, estreñimiento, boca seca, insomnio, somnolencia y mareos.
- Dolor lumbar crónico: náuseas, boca seca, insomnio, somnolencia, estreñimiento, mareos y fatiga.
Las reacciones adversas observadas con mayor frecuencia en pacientes tratados con CYMBALTA en todas las poblaciones de adultos agrupadas (es decir, MDD, GAD, DPNP, FM, OA y CLBP) (incidencia de al menos el 5 % y al menos el doble de la incidencia en pacientes tratados con placebo) pacientes) fueron náuseas, boca seca, somnolencia, estreñimiento, disminución del apetito e hiperhidrosis.
La Tabla 2 muestra la incidencia de reacciones adversas en ensayos controlados con placebo para poblaciones adultas aprobadas (es decir, MDD, GAD, DPNP, FM, OA y CLBP) que ocurrieron en el 5 % o más de los pacientes tratados con CYMBALTA y con una incidencia mayor que los pacientes tratados con placebo.
Reacciones adversas en ensayos combinados de MDD y GAD en adultos
La Tabla 3 muestra la incidencia de reacciones adversas en ensayos en adultos controlados con placebo de MDD y GAD que ocurrieron en el 2 % o más de los pacientes tratados con CYMBALTA y con una incidencia mayor que la de los pacientes tratados con placebo.
Reacciones adversas en los ensayos en adultos de DPNP, FM, OA y CLBP
La Tabla 4 muestra la incidencia de reacciones adversas que ocurrieron en el 2 % o más de los pacientes tratados con CYMBALTA (determinada antes del redondeo) en la fase aguda previa a la comercialización de los ensayos en adultos controlados con placebo de DPNP, FM, OA y CLBP y con una incidencia mayor que los pacientes tratados con placebo.
Efectos sobre la función sexual masculina y femenina en adultos con MDD
Los cambios en el deseo sexual, el desempeño sexual y la satisfacción sexual a menudo ocurren como manifestaciones de trastornos psiquiátricos o diabetes, pero también pueden ser consecuencia del tratamiento farmacológico. Debido a que se supone que las reacciones sexuales adversas no se notifican voluntariamente, la Escala de experiencia sexual de Arizona (ASEX), una medida validada diseñada para identificar las reacciones adversas sexuales, se usó prospectivamente en 4 ensayos en adultos controlados con placebo de MDD (Estudios MDD-1, MDD-2 , MDD-3 y MDD-4) [ver Estudios clínicos ]. La escala ASEX incluye cinco preguntas que pertenecen a los siguientes aspectos de la función sexual: 1) impulso sexual, 2) facilidad de excitación, 3) capacidad para lograr la erección (hombres) o lubricación (mujeres), 4) facilidad para alcanzar el orgasmo y 5) satisfacción del orgasmo. Los números positivos significan un empeoramiento de la función sexual desde el inicio. Los números negativos significan una mejora desde un nivel de disfunción inicial, que se observa comúnmente en pacientes deprimidos.
En estos ensayos, los pacientes masculinos tratados con CYMBALTA experimentaron significativamente más disfunción sexual, medida por la puntuación total en ASEX y la capacidad de alcanzar el orgasmo, que los pacientes masculinos tratados con placebo (ver ). Las pacientes tratadas con CYMBALTA no experimentaron más disfunción sexual que las pacientes tratadas con placebo según lo medido por la puntuación total de ASEX. Los proveedores de atención médica deben preguntar de forma rutinaria sobre posibles reacciones adversas sexuales en pacientes tratados con CYMBALTA.
Cambios en los signos vitales en adultos
En ensayos clínicos controlados con placebo en poblaciones adultas aprobadas para el cambio desde el inicio hasta el final, los pacientes tratados con CYMBALTA tuvieron aumentos medios de 0,23 mm Hg en la presión arterial sistólica (PAS) y 0,73 mm Hg en la presión arterial diastólica (PAD) en comparación con las disminuciones medias de 1,09 mm Hg en PAS y 0,55 mm Hg en PAD en pacientes tratados con placebo. No hubo una diferencia significativa en la frecuencia de presión arterial elevada sostenida (3 visitas consecutivas) [ver ADVERTENCIAS Y PRECAUCIONES ].
El tratamiento con 20 mg de CYMBALTA, durante hasta 26 semanas en ensayos controlados con placebo en poblaciones adultas aprobadas, generalmente provocó un pequeño aumento en la frecuencia cardíaca para el cambio desde el inicio hasta el final en comparación con el placebo de hasta 1,37 latidos por minuto (aumento de 1,20 latidos por minuto en pacientes tratados con CYMBALTA, disminución de 0,17 latidos por minuto en pacientes tratados con placebo).
Cambios de laboratorio en adultos
El tratamiento con CYMBALTA en ensayos clínicos controlados con placebo en poblaciones adultas aprobadas se asoció con pequeños aumentos medios desde el inicio hasta el final en ALT, AST, CPK y fosfatasa alcalina; Se observaron valores anormales transitorios, moderados y poco frecuentes para estos analitos en pacientes tratados con CYMBALTA en comparación con pacientes tratados con placebo [ver ADVERTENCIAS Y PRECAUCIONES ]. Los niveles altos de bicarbonato, colesterol y potasio anormal (alto o bajo) se observaron con más frecuencia en los pacientes tratados con CYMBALTA en comparación con los pacientes tratados con placebo.
Otras reacciones adversas observadas durante la evaluación del ensayo clínico de CYMBALTA en adultos
La siguiente es una lista de reacciones adversas informadas por pacientes tratados con CYMBALTA 40 mg en ensayos clínicos en adultos. En ensayos clínicos de todas las poblaciones adultas aprobadas, 34 756 pacientes fueron tratados con CYMBALTA. De estos, el 27 % (9337) tomó CYMBALTA 60 mg durante al menos 6 meses y el 12 % (4317) tomó CYMBALTA durante al menos un año. La siguiente lista no pretende incluir reacciones (1) ya enumeradas en tablas anteriores o en otra parte del etiquetado, (2) para las cuales la causa de un fármaco era remota, (3) que eran tan generales como para no ser informativas, (4) que eran no se considera que tenga implicaciones clínicas significativas, o (5) que ocurrió a una tasa igual o menor que el placebo.
Las reacciones se clasifican por sistema corporal de acuerdo con las siguientes definiciones: reacciones adversas frecuentes son aquellas que ocurren en al menos 1/100 pacientes; las reacciones adversas poco frecuentes son las que ocurren en 1/100 a 1/1000 pacientes; reacciones raras son aquellas que ocurren en menos de 1/1000 pacientes.
- Trastornos cardíacos - Frecuentes: palpitaciones; Infrecuentes: infarto de miocardio, taquicardia y miocardiopatía de Takotsubo.
- Trastornos del oído y del laberinto - Frecuentes: vértigo; Infrecuentes: dolor de oído y tinnitus.
- Desordenes endocrinos - Poco frecuentes: hipotiroidismo.
- Trastornos oculares - Frecuente: visión borrosa; Infrecuentes: diplopía, ojo seco y discapacidad visual.
- Desórdenes gastrointestinales - Frecuentes: flatulencia; Infrecuentes: disfagia, eructos, gastritis, hemorragia gastrointestinal, halitosis y estomatitis; Raros: úlcera gástrica.
- Desordenes generales y condiciones administrativas del sitio - Frecuentes: escalofríos/rigores; Infrecuentes: caídas, sensación anormal, sensación de calor y/o frío, malestar general y sed; Raros: alteración de la marcha.
- Infecciones e Infestaciones - Infrecuentes: gastroenteritis y laringitis.
- Investigaciones Frecuente: aumento de peso, disminución de peso; Infrecuentes: aumento del colesterol en sangre.
- Trastornos del metabolismo y la nutrición - Infrecuentes: deshidratación e hiperlipidemia; Raros: dislipidemia.
- Trastornos musculoesqueléticos y del tejido conectivo - Frecuentes: dolor musculoesquelético; Infrecuentes: tensión muscular y espasmos musculares.
- Trastornos del sistema nervioso - Frecuentes: disgeusia, letargia y parestesia/hipoestesia; Infrecuentes: alteración de la atención, discinesia, mioclonías y mala calidad del sueño; Raros: disartria.
- Desórdenes psiquiátricos - Frecuentes: sueños anormales y trastornos del sueño; Infrecuentes: apatía, bruxismo, desorientación/estado de confusión, irritabilidad, cambios de humor e intento de suicidio; Raros: suicidio consumado.
- Trastornos renales y urinarios - Frecuente: polaquiuria; Infrecuentes: disuria, urgencia miccional, nicturia, poliuria y olor anormal de la orina.
- Trastornos del sistema reproductivo y de la mama - Frecuentes: anorgasmia/orgasmo anormal; Poco frecuentes: síntomas menopáusicos, disfunción sexual y dolor testicular; Raros: trastorno menstrual.
- Trastornos respiratorios, torácicos y mediastínicos Frecuentes: bostezos, dolor orofaríngeo; Infrecuentes: opresión en la garganta.
- Trastornos de la piel y del tejido subcutáneo - Frecuentes: prurito; Infrecuentes: sudor frío, dermatitis de contacto, eritema, aumento de la tendencia a los hematomas, sudores nocturnos y reacción de fotosensibilidad; Raros: equimosis.
- Trastornos vasculares - Frecuentes: sofocos; Infrecuentes: sofocos, hipotensión ortostática y frialdad periférica.
Reacciones adversas observadas en ensayos clínicos controlados con placebo en pacientes pediátricos
Base de datos de ensayos clínicos pediátricos
Los datos que se describen a continuación reflejan la exposición a CYMBALTA (N=567) en pacientes pediátricos de 7 a 18 años de edad de dos ensayos controlados con placebo de 10 semanas en pacientes con MDD (N=341) (Estudios MDD-6 y MDD- 7), un ensayo controlado con placebo de 10 semanas en TAG (N=135) (Estudio GAD-6) y un ensayo de 13 semanas en fibromialgia (N=91). CYMBALTA 60 mg no está aprobado para el tratamiento de MDD en pacientes pediátricos [ver Uso en poblaciones específicas ]. De los pacientes tratados con CYMBALTA en estos estudios, el 36 % tenía entre 7 y 11 años (el 64 % tenía entre 12 y 18 años), el 55 % eran mujeres y el 69 % eran caucásicos. Los pacientes recibieron de 30 a 120 mg de CYMBALTA por día durante los estudios de tratamiento agudo controlados con placebo. En los ensayos pediátricos de MDD, GAD y fibromialgia de hasta 40 semanas de duración, hubo 988 pacientes pediátricos tratados con CYMBALTA de 7 a 17 años de edad (la mayoría de los pacientes recibieron 30-120 mg por día): el 35 % tenía entre 7 y 11 años de edad (el 65% tenía entre 12 y 17 años) y el 56% eran mujeres.
Reacciones adversas más comunes en ensayos pediátricos
Las reacciones adversas más comunes (≥5 % en pacientes tratados con CYMBALTA y al menos el doble de la incidencia de los pacientes tratados con placebo) en todas las poblaciones pediátricas agrupadas (MDD, GAD y fibromialgia) fueron disminución de peso, disminución del apetito, náuseas, vómitos, fatiga y diarrea.
Reacciones adversas en pacientes pediátricos de 7 a 17 años con MDD y GAD
El perfil de reacciones adversas observado en ensayos clínicos en pacientes pediátricos de 7 a 18 años con MDD y GAD fue consistente con el perfil de reacciones adversas observado en ensayos clínicos en adultos. Las reacciones adversas más comunes (≥5 % y el doble del placebo) observadas en estos ensayos clínicos pediátricos incluyeron: náuseas, diarrea, disminución de peso y mareos.
La Tabla 6 proporciona la incidencia de reacciones adversas en ensayos pediátricos controlados con placebo de MDD y GAD que ocurrieron en más del 2% de los pacientes tratados con CYMBALTA y con una incidencia mayor que los pacientes tratados con placebo. CYMBALTA no está aprobado para el tratamiento de MDD en pacientes pediátricos [ver Uso en poblaciones específicas ].
Otras reacciones adversas que ocurrieron con una incidencia de menos del 2 % y que informaron más pacientes tratados con CYMBALTA que pacientes tratados con placebo en ensayos clínicos pediátricos de MDD y GAD incluyeron: sueños anormales (incluyendo pesadillas), ansiedad, sofocos (incluyendo sofocos ), hiperhidrosis, palpitaciones, aumento del pulso y temblores (CYMBALTA 20 mg no está aprobado para tratar pacientes pediátricos con MDD).
Los síntomas informados con mayor frecuencia después de la interrupción de CYMBALTA 30 mg en ensayos clínicos pediátricos de MDD y GAD incluyeron dolor de cabeza, mareos, insomnio y dolor abdominal [ver ADVERTENCIAS Y PRECAUCIONES ].
Crecimiento (altura y peso) en pacientes pediátricos de 7 a 17 años con GAD y MDD
Se ha observado disminución del apetito y pérdida de peso en asociación con el uso de ISRS e IRSN. Los pacientes pediátricos tratados con CYMBALTA en ensayos clínicos experimentaron una disminución media de peso de 0,1 kg a las 10 semanas, en comparación con un aumento de peso medio de aproximadamente 0,9 kg en los pacientes pediátricos tratados con placebo. La proporción de pacientes que experimentaron una disminución de peso clínicamente significativa (≥3,5 %) fue mayor en el grupo de CYMBALTA que en el grupo de placebo (16 % y 6 %, respectivamente). Posteriormente, durante los períodos de extensión no controlados de 4 a 6 meses, los pacientes tratados con CYMBALTA en promedio tendieron a recuperar su percentil de peso inicial esperado según los datos de población de pares de la misma edad y sexo.
En estudios de hasta 9 meses, los pacientes pediátricos tratados con CYMBALTA experimentaron un aumento de estatura de 1,7 cm en promedio (aumento de 2,2 cm en pacientes de 7 a 11 años de edad y aumento de 1,3 cm en pacientes de 12 a 17 años de edad). Si bien se observó un aumento de estatura durante estos estudios, se observó una disminución promedio del 1 % en el percentil de estatura (disminución del 2 % en pacientes de 7 a 11 años de edad y aumento del 0,3 % en pacientes de 12 a 17 años de edad). El peso y la altura deben controlarse regularmente en pacientes pediátricos tratados con CYMBALTA [ver Uso en poblaciones específicas ].
Reacciones adversas en pacientes pediátricos de 13 a 17 años con fibromialgia
La Tabla 7 proporciona la incidencia de reacciones adversas en un ensayo pediátrico controlado con placebo de fibromialgia (Estudio FM-4) que ocurrió en más del 5 % de los pacientes tratados con CYMBALTA 30 mg y con una incidencia mayor que los pacientes tratados con placebo [ver Estudios clínicos ].
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de CYMBALTA. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Las reacciones adversas informadas desde la introducción al mercado que se relacionaron temporalmente con la terapia con CYMBALTA 40 mg y que no se mencionan en ninguna otra parte de la etiqueta incluyen: pancreatitis aguda, reacción anafiláctica, agresión e ira (particularmente al principio del tratamiento o después de la interrupción del tratamiento), edema angioneurótico, glaucoma de ángulo cerrado, colitis (microscópica o no especificada), vasculitis cutánea (a veces asociada con afectación sistémica), trastorno extrapiramidal, galactorrea, sangrado ginecológico, alucinaciones, hiperglucemia, hiperprolactinemia, hipersensibilidad, crisis hipertensiva, espasmo muscular, erupción cutánea, síndrome de piernas inquietas, convulsiones al suspender el tratamiento, arritmia supraventricular, tinnitus (al suspender el tratamiento), trismo y urticaria.
INTERACCIONES CON LA DROGAS
Tanto CYP1A2 como CYP2D6 son responsables del metabolismo de la duloxetina.
Inhibidores de CYP1A2
Cuando se coadministró CYMBALTA 60 mg con fluvoxamina 100 mg, un potente inhibidor de CYP1A2, a sujetos masculinos (n = 14), el AUC de duloxetina aumentó aproximadamente 6 veces, la Cmax aumentó aproximadamente 2,5 veces y la t1/2 de duloxetina se redujo. aumentó aproximadamente 3 veces. Otros medicamentos que inhiben el metabolismo de CYP1A2 incluyen cimetidina y antimicrobianos de quinolona como ciprofloxacina y enoxacina [ver ADVERTENCIAS Y PRECAUCIONES ].
Inhibidores de CYP2D6
El uso concomitante de CYMBALTA (40 mg una vez al día) con paroxetina (20 mg una vez al día) aumentó la concentración del AUC de duloxetina en aproximadamente un 60 % y se esperan mayores grados de inhibición con dosis más altas de paroxetina. Se esperarían efectos similares con otros inhibidores potentes de CYP2D6 (p. ej., fluoxetina, quinidina) [ver ADVERTENCIAS Y PRECAUCIONES ].
Inhibición dual de CYP1A2 y CYP2D6
La administración concomitante de CYMBALTA 40 mg dos veces al día con fluvoxamina 100 mg, un potente inhibidor de CYP1A2, a sujetos metabolizadores lentos de CYP2D6 (n=14) resultó en un aumento de 6 veces en el AUC y la Cmax de duloxetina.
Fármacos que interfieren con la hemostasia (p. ej., AINE, aspirina y warfarina)
La liberación de serotonina por las plaquetas juega un papel importante en la hemostasia. Los estudios epidemiológicos del diseño de casos y controles y de cohortes que han demostrado una asociación entre el uso de fármacos psicotrópicos que interfieren con la recaptación de serotonina y la aparición de hemorragia digestiva alta también han demostrado que el uso concomitante de un AINE o aspirina puede potenciar este riesgo de hemorragia. Se han informado efectos anticoagulantes alterados, incluido un aumento del sangrado, cuando se coadministran ISRS o IRSN con warfarina. La administración concomitante de warfarina (2-9 mg una vez al día) en condiciones de estado estacionario con CYMBALTA 60 o 120 mg una vez al día durante un máximo de 14 días en sujetos sanos (n=15) no modificó significativamente el INR desde el inicio (los cambios medios del INR oscilaron entre 0,05 a +0,07). La farmacocinética (AUCτ,ss, Cmax,ss o tmax,ss) de la warfarina total (unida a proteínas más el fármaco libre) para la warfarina R y S no se vio alterada por la duloxetina. Debido al efecto potencial de la duloxetina sobre las plaquetas, los pacientes que reciben terapia con warfarina deben ser monitoreados cuidadosamente cuando se inicia o interrumpe CYMBALTA [ver ADVERTENCIAS Y PRECAUCIONES ].
Lorazepam
En condiciones de estado estacionario para CYMBALTA (60 mg cada 12 horas) y lorazepam (2 mg cada 12 horas), la farmacocinética de la duloxetina no se vio afectada por la administración conjunta.
Temazepam
En condiciones de estado estacionario para CYMBALTA (20 mg qhs) y temazepam (30 mg qhs), la farmacocinética de duloxetina no se vio afectada por la administración conjunta.
Medicamentos que afectan la acidez gástrica
CYMBALTA tiene un recubrimiento entérico que resiste la disolución hasta llegar a un segmento del tracto gastrointestinal donde el pH excede 5.5. En condiciones extremadamente ácidas, CYMBALTA 20 mg, sin la protección del recubrimiento entérico, puede sufrir hidrólisis para formar naftol. Se recomienda precaución al usar CYMBALTA 30 mg en pacientes con condiciones que pueden retardar el vaciamiento gástrico (p. ej., algunos diabéticos). Los fármacos que elevan el pH gastrointestinal pueden conducir a una liberación más temprana de duloxetina. Sin embargo, la coadministración de CYMBALTA 60 mg con antiácidos que contienen aluminio y magnesio (51 mEq) o CYMBALTA con famotidina, no tuvo un efecto significativo sobre la tasa o el grado de absorción de duloxetina después de la administración de 40 mg por vía oral.
Fármacos metabolizados por CYP1A2
Los estudios de interacción farmacológica in vitro demuestran que la duloxetina no induce la actividad de CYP1A2. Por lo tanto, no se anticipa un aumento en el metabolismo de los sustratos de CYP1A2 (p. ej., teofilina, cafeína) como resultado de la inducción, aunque no se han realizado estudios clínicos de inducción. La duloxetina es un inhibidor de la isoforma CYP1A2 en estudios in vitro, y en dos estudios clínicos el aumento promedio (intervalo de confianza del 90 %) en el AUC de la teofilina fue del 7 % (1 %-15 %) y del 20 % (13 %-27 %). cuando se coadministra con CYMBALTA (60 mg dos veces al día).
Fármacos metabolizados por CYP2D6
La duloxetina es un inhibidor moderado de CYP2D6. Cuando se administró CYMBALTA (a una dosis de 60 mg dos veces al día) junto con una dosis única de 50 mg de desipramina, un sustrato de CYP2D6, el AUC de desipramina aumentó 3 veces [ver ADVERTENCIAS Y PRECAUCIONES ].
Fármacos metabolizados por CYP2C9
Los resultados de los estudios in vitro demuestran que la duloxetina no inhibe la actividad. En un estudio clínico, la farmacocinética de la S-warfarina, un sustrato de CYP2C9, no se vio significativamente afectada por la duloxetina [ver Fármacos que interfieren con la hemostasia (p. ej., AINE, aspirina y warfarina) ].
Fármacos metabolizados por CYP3A
Los resultados de los estudios in vitro demuestran que la duloxetina no inhibe ni induce la actividad de CYP3A. Por lo tanto, no se anticipa un aumento o disminución en el metabolismo de los sustratos de CYP3A (p. ej., anticonceptivos orales y otros agentes esteroideos) como resultado de la inducción o inhibición, aunque no se han realizado estudios clínicos.
Fármacos metabolizados por CYP2C19
Los resultados de los estudios in vitro demuestran que la duloxetina no inhibe la actividad de CYP2C19 a concentraciones terapéuticas. Por lo tanto, no se prevé la inhibición del metabolismo de los sustratos de CYP2C19, aunque no se han realizado estudios clínicos.
Inhibidores de la monoaminooxidasa (IMAO)
[Ver DOSIFICACIÓN Y ADMINISTRACIÓN , CONTRAINDICACIONES , y ADVERTENCIAS Y PRECAUCIONES ].
Fármacos serotoninérgicos
[Ver DOSIFICACIÓN Y ADMINISTRACIÓN , CONTRAINDICACIONES , y ADVERTENCIAS Y PRECAUCIONES ].
Alcohol
Cuando se administraron CYMBALTA 40 mg y etanol con varias horas de diferencia para que coincidieran las concentraciones máximas de cada uno, CYMBALTA no aumentó el deterioro de las habilidades mentales y motoras causado por el alcohol.
En la base de datos de ensayos clínicos de CYMBALTA, tres pacientes tratados con CYMBALTA tenían daño hepático manifestado por elevaciones de ALT y bilirrubina total, con evidencia de obstrucción. En cada uno de estos casos hubo un uso intercurrente sustancial de etanol, y esto puede haber contribuido a las anormalidades observadas [ver ADVERTENCIAS Y PRECAUCIONES ].
Fármacos del SNC
[Ver ADVERTENCIAS Y PRECAUCIONES ].
Fármacos altamente unidos a proteínas plasmáticas
Debido a que la duloxetina se une en gran medida a las proteínas plasmáticas, la administración de 30 mg de CYMBALTA a un paciente que toma otro fármaco que se une en gran medida a las proteínas puede provocar un aumento de las concentraciones libres del otro fármaco, lo que podría provocar reacciones adversas. Sin embargo, la coadministración de CYMBALTA (60 o 120 mg) con warfarina (2-9 mg), un fármaco altamente ligado a proteínas, no produjo cambios significativos en el INR ni en la farmacocinética de S total o R total. warfarina (unión a proteínas más fármaco libre) [ver Fármacos que interfieren con la hemostasia (p. ej., AINE, aspirina y warfarina) ].
Abuso y dependencia de drogas
Abuso
En estudios con animales, la duloxetina no demostró potencial de abuso similar a los barbitúricos (depresores).
Si bien CYMBALTA no se ha estudiado sistemáticamente en humanos por su potencial de abuso, no hubo indicios de comportamiento de búsqueda de drogas en los ensayos clínicos. Sin embargo, no es posible predecir, sobre la base de la experiencia previa a la comercialización, el grado en que un fármaco activo sobre el SNC será mal utilizado, desviado y/o abusado una vez comercializado. En consecuencia, los médicos deben evaluar cuidadosamente a los pacientes en busca de antecedentes de abuso de drogas y seguirlos de cerca, observándolos en busca de signos de uso indebido o abuso de CYMBALTA (p. ej., desarrollo de tolerancia, aumento de la dosis, comportamiento de búsqueda de drogas).
Dependencia
En estudios de dependencia de drogas, la duloxetina no demostró potencial de producción de dependencia en ratas.
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Pensamientos y conductas suicidas en niños, adolescentes y adultos jóvenes
Los pacientes con trastorno depresivo mayor (MDD), tanto adultos como pediátricos, pueden experimentar un empeoramiento de su depresión y/o la aparición de ideación y comportamiento suicida (suicidalidad) o cambios inusuales en el comportamiento, estén o no tomando medicamentos antidepresivos, y esto el riesgo puede persistir hasta que ocurra una remisión significativa. El suicidio es un riesgo conocido de depresión y ciertos otros trastornos psiquiátricos, y estos trastornos en sí mismos son los predictores más fuertes de suicidio. Sin embargo, desde hace mucho tiempo existe la preocupación de que los antidepresivos puedan tener un papel en la inducción del empeoramiento de la depresión y la aparición de tendencias suicidas en ciertos pacientes durante las primeras fases del tratamiento.
Los análisis combinados de ensayos controlados con placebo a corto plazo de medicamentos antidepresivos (ISRS y otros) mostraron que estos medicamentos aumentan el riesgo de pensamientos y conductas suicidas (tendencia al suicidio) en niños, adolescentes y adultos jóvenes (de 18 a 24 años) con trastorno depresivo mayor ( MDD) y otros trastornos psiquiátricos. Los estudios a corto plazo no mostraron un aumento en el riesgo de tendencias suicidas con antidepresivos en comparación con placebo en adultos mayores de 24 años; hubo una reducción con los antidepresivos en comparación con el placebo en adultos de 65 años o más.
Los análisis agrupados de ensayos controlados con placebo en niños y adolescentes con TDM, trastorno obsesivo compulsivo (TOC) u otros trastornos psiquiátricos incluyeron un total de 24 ensayos a corto plazo de 9 fármacos antidepresivos en más de 4400 pacientes. Los análisis agrupados de ensayos controlados con placebo en adultos con MDD u otros trastornos psiquiátricos incluyeron un total de 295 ensayos a corto plazo (duración media de 2 meses) de 11 fármacos antidepresivos en más de 77 000 pacientes. Hubo una variación considerable en el riesgo de suicidio entre los fármacos, pero una tendencia hacia un aumento en los pacientes más jóvenes para casi todos los fármacos estudiados. Hubo diferencias en el riesgo absoluto de suicidio entre las diferentes indicaciones, con la mayor incidencia en MDD. Sin embargo, el riesgo de diferencias (fármaco frente a placebo) fue relativamente estable dentro de los estratos de edad y entre las indicaciones. Estas diferencias de riesgo (diferencia fármaco-placebo en el número de casos de tendencias suicidas por cada 1000 pacientes tratados) se proporcionan en la Tabla 1.
No se produjeron suicidios en ninguno de los ensayos pediátricos de CYMBALTA. Hubo suicidios en los ensayos de 20 mg de CYMBALTA en adultos, pero el número no fue suficiente para llegar a ninguna conclusión sobre el efecto de CYMBALTA en el suicidio.
Se desconoce si el riesgo de suicidio se extiende al uso a largo plazo, es decir, más allá de varios meses. Sin embargo, existe evidencia sustancial de ensayos de mantenimiento controlados con placebo en adultos con depresión de que el uso de antidepresivos puede retrasar la recurrencia de la depresión.
Todos los pacientes que reciben tratamiento con antidepresivos por cualquier indicación deben ser monitoreados adecuadamente y observados de cerca por si empeoran clínicamente, tienen tendencias suicidas y cambios inusuales en el comportamiento, especialmente durante los meses iniciales de un ciclo de terapia con medicamentos, o en momentos de cambios de dosis, ya sea aumentos o disminuye.
Los siguientes síntomas, ansiedad, agitación, ataques de pánico, insomnio, irritabilidad, hostilidad, agresividad, impulsividad, acatisia (inquietud psicomotora), hipomanía y manía, se han informado en pacientes adultos y pediátricos que también reciben tratamiento con antidepresivos para el trastorno depresivo mayor como para otras indicaciones, tanto psiquiátricas como no psiquiátricas. Aunque no se ha establecido un vínculo causal entre la aparición de tales síntomas y el empeoramiento de la depresión y/o la aparición de impulsos suicidas, existe la preocupación de que tales síntomas puedan representar precursores de tendencias suicidas emergentes.
Se debe considerar cambiar el régimen terapéutico, incluida la posibilidad de suspender el medicamento, en pacientes cuya depresión empeora persistentemente, o que están experimentando tendencias suicidas emergentes o síntomas que podrían ser precursores de un empeoramiento de la depresión o tendencias suicidas, especialmente si estos síntomas son severos, abruptos. en el inicio, o no formaban parte de los síntomas de presentación del paciente.
Si se ha tomado la decisión de interrumpir el tratamiento, se debe disminuir la medicación tan pronto como sea posible, pero reconociendo que la interrupción puede estar asociada con ciertos síntomas [ver DOSIFICACIÓN Y ADMINISTRACIÓN y Síndrome de discontinuación ] para obtener descripciones de los riesgos de la interrupción de CYMBALTA.
Se debe alertar a las familias y cuidadores de pacientes que reciben tratamiento con antidepresivos por trastorno depresivo mayor u otras indicaciones, tanto psiquiátricas como no psiquiátricas, sobre la necesidad de monitorear a los pacientes para detectar la aparición de agitación, irritabilidad, cambios inusuales en el comportamiento y los demás síntomas descritos anteriormente. , así como el surgimiento de tendencias suicidas, y reportar dichos síntomas inmediatamente a los proveedores de atención médica. Dicho seguimiento debe incluir la observación diaria por parte de las familias y los cuidadores. Las recetas de CYMBALTA deben hacerse para la cantidad más pequeña de cápsulas compatible con un buen manejo del paciente, a fin de reducir el riesgo de sobredosis.
Detección de pacientes para el trastorno bipolar
Un episodio depresivo mayor puede ser la presentación inicial del trastorno bipolar. En general, se cree (aunque no se ha establecido en ensayos controlados) que tratar un episodio de este tipo con un antidepresivo solo puede aumentar la probabilidad de precipitación de un episodio mixto/maníaco en pacientes con riesgo de trastorno bipolar. Se desconoce si alguno de los síntomas descritos anteriormente representa tal conversión. Sin embargo, antes de iniciar el tratamiento con un antidepresivo, los pacientes con síntomas depresivos deben someterse a un cribado adecuado para determinar si tienen riesgo de trastorno bipolar; dicha evaluación debe incluir un historial psiquiátrico detallado, incluidos antecedentes familiares de suicidio, trastorno bipolar y depresión. Cabe señalar que CYMBALTA no está aprobado para su uso en el tratamiento de la depresión bipolar.
hepatotoxicidad
Ha habido informes de insuficiencia hepática, a veces fatal, en pacientes tratados con CYMBALTA. Estos casos se han presentado como hepatitis con dolor abdominal, hepatomegalia y elevación de los niveles de transaminasas a más de veinte veces el límite superior normal (ULN) con o sin ictericia, lo que refleja un patrón mixto o hepatocelular de lesión hepática. CYMBALTA 30 mg debe suspenderse en pacientes que desarrollan ictericia u otra evidencia de disfunción hepática clínicamente significativa y no debe reanudarse a menos que se pueda establecer otra causa.
También se han informado casos de ictericia colestásica con elevación mínima de los niveles de transaminasas. Otros informes posteriores a la comercialización indican que se han producido niveles elevados de transaminasas, bilirrubina y fosfatasa alcalina en pacientes con enfermedad hepática crónica o cirrosis.
CYMBALTA aumentó el riesgo de elevación de los niveles de transaminasas séricas en los ensayos clínicos del programa de desarrollo. Las elevaciones de las transaminasas hepáticas dieron lugar a la suspensión del 0,3% (92/34.756) de los pacientes tratados con CYMBALTA. En la mayoría de los pacientes, la mediana de tiempo hasta la detección de la elevación de transaminasas fue de aproximadamente dos meses. En ensayos controlados con placebo en adultos, para pacientes con valores de ALT basales normales y anormales, se produjo una elevación de ALT >3 veces el LSN en el 1,25 % (144/11 496) de los pacientes tratados con CYMBALTA en comparación con el 0,45 % (39/8716) de los que recibieron placebo -pacientes tratados. En estudios controlados con placebo en adultos que utilizaron un diseño de dosis fija, hubo evidencia de una relación dosis-respuesta de CYMBALTA para la elevación de ALT y AST de >3 veces el ULN y >5 veces el ULN, respectivamente.
Debido a que es posible que CYMBALTA y el alcohol puedan interactuar para causar daño hepático o que CYMBALTA 20 mg pueda agravar una enfermedad hepática preexistente, CYMBALTA no se debe recetar a pacientes con consumo considerable de alcohol o evidencia de enfermedad hepática crónica.
Hipotensión ortostática, caídas y síncope
Se han informado casos de hipotensión ortostática, caídas y síncope en pacientes tratados con las dosis recomendadas de CYMBALTA. El síncope y la hipotensión ortostática tienden a ocurrir dentro de la primera semana de tratamiento, pero pueden ocurrir en cualquier momento durante el tratamiento con CYMBALTA, particularmente después de aumentar la dosis. El riesgo de caídas parece estar relacionado con el grado de disminución ortostática de la presión arterial (PA), así como con otros factores que pueden aumentar el riesgo subyacente de caídas.
En un análisis de pacientes de todos los ensayos controlados con placebo, los pacientes tratados con CYMBALTA 20 mg informaron una mayor tasa de caídas en comparación con los pacientes tratados con placebo. El riesgo parece estar relacionado con la presencia de disminución ortostática de la PA. El riesgo de disminución de la PA puede ser mayor en pacientes que toman medicamentos concomitantes que inducen hipotensión ortostática (como antihipertensivos) o son inhibidores potentes de CYP1A2 [ver ADVERTENCIAS Y PRECAUCIONES y Interacciones farmacológicas clínicamente importantes ] y en pacientes que toman CYMBALTA 20 mg en dosis superiores a 60 mg al día. Se debe considerar la reducción de la dosis o la suspensión de CYMBALTA en pacientes que experimenten hipotensión ortostática sintomática, caídas y/o síncope durante la terapia con CYMBALTA 40 mg.
El riesgo de caídas también pareció ser proporcional al riesgo subyacente de caídas del paciente y pareció aumentar constantemente con la edad. Dado que los pacientes geriátricos tienden a tener un mayor riesgo subyacente de caídas debido a una mayor prevalencia de factores de riesgo como el uso de múltiples medicamentos, comorbilidades médicas y trastornos de la marcha, el impacto del aumento de la edad en sí mismo no está claro. Se han informado caídas con consecuencias graves que incluyen fracturas y hospitalizaciones con el uso de CYMBALTA 30 mg [ver REACCIONES ADVERSAS ].
Síndrome de serotonina
Se ha informado el desarrollo de un síndrome serotoninérgico potencialmente mortal con IRSN e ISRS, incluido CYMBALTA 60 mg, solo, pero particularmente con el uso concomitante de otros medicamentos serotoninérgicos (incluidos triptanos, antidepresivos tricíclicos, fentanilo, litio, tramadol, triptófano, buspirona, anfetaminas). , y la hierba de San Juan) y con fármacos que alteran el metabolismo de la serotonina (en particular, los IMAO, tanto los destinados a tratar trastornos psiquiátricos como también otros, como linezolid y azul de metileno intravenoso).
Los síntomas del síndrome serotoninérgico pueden incluir cambios en el estado mental (p. ej., agitación, alucinaciones, delirio y coma), inestabilidad autonómica (p. ej., taquicardia, presión arterial lábil, mareos, diaforesis, sofocos, hipertermia), síntomas neuromusculares (p. ej., temblor, rigidez, mioclonías, hiperreflexia, falta de coordinación), convulsiones y/o síntomas gastrointestinales (p. ej., náuseas, vómitos, diarrea). Los pacientes deben ser monitoreados por la aparición del síndrome serotoninérgico.
Está contraindicado el uso concomitante de CYMBALTA 30 mg con antidepresivos IMAO. CYMBALTA 60 mg tampoco debe iniciarse en un paciente que está siendo tratado con IMAO como linezolid o azul de metileno intravenoso. Todos los informes con azul de metileno que proporcionaron información sobre la vía de administración involucraron la administración intravenosa en el rango de dosis de 1 mg/kg a 8 mg/kg. Ningún informe involucró la administración de azul de metileno por otras vías (como tabletas orales o inyección local en tejido) o en dosis más bajas. Puede haber circunstancias en las que sea necesario iniciar el tratamiento con un IMAO como linezolid o azul de metileno intravenoso en un paciente que toma CYMBALTA. Se debe suspender CYMBALTA antes de iniciar el tratamiento con el IMAO [ver DOSIFICACIÓN Y ADMINISTRACIÓN y CONTRAINDICACIONES ].
Si se justifica clínicamente el uso concomitante de CYMBALTA 20 mg con otros medicamentos serotoninérgicos, incluidos triptanos, antidepresivos tricíclicos, fentanilo, litio, tramadol, buspirona, triptófano, anfetaminas y hierba de San Juan, se debe informar a los pacientes sobre un posible aumento del riesgo de síndrome serotoninérgico. , particularmente durante el inicio del tratamiento y los aumentos de dosis. El tratamiento con CYMBALTA 60 mg y cualquier agente serotoninérgico concomitante debe suspenderse de inmediato si ocurren los eventos anteriores y debe iniciarse un tratamiento sintomático de apoyo.
Mayor riesgo de sangrado
Los medicamentos que interfieren con la inhibición de la recaptación de serotonina, incluido CYMBALTA, pueden aumentar el riesgo de eventos hemorrágicos. Informes de casos y estudios epidemiológicos (casos y controles y diseño de cohortes) han demostrado una asociación entre el uso de fármacos que interfieren con la recaptación de serotonina y la aparición de hemorragia gastrointestinal. Un estudio posterior a la comercialización mostró una mayor incidencia de hemorragia posparto en madres que tomaban CYMBALTA. Otros eventos hemorrágicos relacionados con el uso de ISRS e IRSN van desde equimosis, hematomas, epistaxis y petequias hasta hemorragias potencialmente mortales. El uso concomitante de aspirina, medicamentos antiinflamatorios no esteroideos (AINE), warfarina y otros anticoagulantes puede aumentar este riesgo.
Informar a los pacientes sobre el riesgo de sangrado asociado con el uso concomitante de CYMBALTA y AINE, aspirina u otros medicamentos que afectan la coagulación [ver INTERACCIONES CON LA DROGAS ].
Reacciones cutáneas graves
Se pueden producir reacciones cutáneas graves, como eritema multiforme y síndrome de Stevens-Johnson (SJS), con CYMBALTA. La tasa de notificación de SJS asociado con el uso de CYMBALTA supera la tasa de incidencia de fondo de la población general para esta reacción cutánea grave (1 a 2 casos por millón de personas por año). En general, se acepta que la tasa de notificación es una subestimación debido a la falta de notificación.
CYMBALTA debe interrumpirse ante la primera aparición de ampollas, erupción cutánea, erosiones de la mucosa o cualquier otro signo de hipersensibilidad si no se puede identificar otra etiología.
Síndrome de discontinuación
Los síntomas de discontinuación han sido evaluados sistemáticamente en pacientes que toman CYMBALTA. Después de la interrupción abrupta o gradual en ensayos clínicos controlados con placebo en adultos, los siguientes síntomas ocurrieron en un 1 % o más y en una tasa significativamente mayor en pacientes tratados con CYMBALTA en comparación con los que interrumpieron el tratamiento con placebo: mareos, dolor de cabeza, náuseas, diarrea, parestesia, irritabilidad, vómitos, insomnio, ansiedad, hiperhidrosis y fatiga.
Durante la comercialización de otros ISRS e IRSN (inhibidores de la recaptación de serotonina y norepinefrina), ha habido informes espontáneos de eventos adversos que ocurren tras la interrupción de estos medicamentos, particularmente cuando es abrupto, incluidos los siguientes: estado de ánimo disfórico, irritabilidad, agitación, mareos, alteraciones sensoriales ( ej., parestesias tales como sensaciones de choque eléctrico), ansiedad, confusión, dolor de cabeza, letargo, labilidad emocional, insomnio, hipomanía, tinnitus y convulsiones. Aunque estos eventos son generalmente autolimitados, se ha informado que algunos son graves.
Los pacientes deben ser monitoreados por estos síntomas cuando suspendan el tratamiento con CYMBALTA. Siempre que sea posible, se recomienda una reducción gradual de la dosis en lugar de una interrupción brusca. Si aparecen síntomas intolerables tras una disminución de la dosis o tras la interrupción del tratamiento, se puede considerar la reanudación de la dosis prescrita anteriormente. Posteriormente, el proveedor de atención médica puede continuar disminuyendo la dosis, pero a un ritmo más gradual [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Activación de manía/hipomanía
En ensayos controlados con placebo en adultos en pacientes con TDM, se informó la activación de manía o hipomanía en el 0,1 % (4/3779) de los pacientes tratados con CYMBALTA y en el 0,04 % (1/2536) de los pacientes tratados con placebo. No se informó activación de manía o hipomanía en ensayos controlados con placebo de DPNP, GAD, fibromialgia o dolor musculoesquelético crónico. Se ha notificado activación de manía o hipomanía en una pequeña proporción de pacientes con trastornos del estado de ánimo que fueron tratados con otros fármacos comercializados eficaces en el tratamiento del trastorno depresivo mayor. Al igual que con estos otros agentes, CYMBALTA 60 mg debe usarse con precaución en pacientes con antecedentes de manía.
Glaucoma de ángulo cerrado
La dilatación pupilar que ocurre después del uso de muchos medicamentos antidepresivos, incluido CYMBALTA, puede desencadenar un ataque de ángulo cerrado en un paciente con ángulos anatómicamente estrechos que no tienen una iridectomía permeable.
convulsiones
CYMBALTA no ha sido evaluado sistemáticamente en pacientes con un trastorno convulsivo y dichos pacientes fueron excluidos de los estudios clínicos. En ensayos clínicos controlados con placebo en adultos, se produjeron convulsiones en el 0,02 % (3/12 722) de los pacientes tratados con CYMBALTA 60 mg y en el 0,01 % (1/9513) de los pacientes tratados con placebo. CYMBALTA se debe prescribir con cuidado en pacientes con antecedentes de un trastorno convulsivo.
Aumentos en la presión arterial
En ensayos clínicos controlados con placebo en adultos en las poblaciones adultas aprobadas desde el inicio hasta el final, el tratamiento con CYMBALTA se asoció con aumentos medios de 0,5 mm Hg en la presión arterial sistólica y 0,8 mm Hg en la presión arterial diastólica en comparación con disminuciones medias de 0,6 mm Hg en la presión arterial sistólica y diastólica. diastólica de 0,3 mm Hg en pacientes tratados con placebo. No hubo diferencias significativas en la frecuencia de presión arterial elevada sostenida (3 visitas consecutivas). En un estudio de farmacología clínica diseñado para evaluar los efectos de CYMBALTA 60 mg en varios parámetros, incluida la presión arterial a dosis supraterapéuticas con una titulación de dosis acelerada, hubo evidencia de aumentos en la presión arterial en decúbito supino a dosis de hasta 200 mg dos veces al día (aproximadamente 3,3 veces la dosis máxima recomendada). Con la dosis más alta de 200 mg dos veces al día, el aumento en la frecuencia del pulso promedio fue de 5,0 a 6,8 latidos y los aumentos en la presión arterial promedio fueron de 4,7 a 6,8 mm Hg (sistólica) y de 4,5 a 7 mm Hg (diastólica) hasta 12 horas después de la administración de la dosis .
La presión arterial debe medirse antes de iniciar el tratamiento y medirse periódicamente durante el tratamiento [ver REACCIONES ADVERSAS ].
Interacciones farmacológicas clínicamente importantes
Tanto CYP1A2 como CYP2D6 son responsables del metabolismo de CYMBALTA.
Posibilidad de que otros medicamentos afecten a CYMBALTA
Inhibidores de CYP1A2
Se debe evitar la coadministración de CYMBALTA 40 mg con inhibidores potentes de CYP1A2 [ver INTERACCIONES CON LA DROGAS ].
Inhibidores de CYP2D6
Debido a que CYP2D6 está involucrado en el metabolismo de CYMBALTA, se esperaría que el uso concomitante de CYMBALTA con inhibidores potentes de CYP2D6 dé como resultado concentraciones más altas (en promedio del 60 %) de CYMBALTA [ver INTERACCIONES CON LA DROGAS ].
Potencial de CYMBALTA 30 mg para afectar a otras drogas
Fármacos metabolizados por CYP2D6
La coadministración de CYMBALTA 20 mg con medicamentos que son metabolizados extensamente por CYP2D6 y que tienen un índice terapéutico estrecho, incluidos ciertos antidepresivos (antidepresivos tricíclicos [ATC], como nortriptilina, amitriptilina e imipramina), fenotiazinas y antiarrítmicos tipo 1C (p. ej., propafenona, flecainida), debe abordarse con precaución. Es posible que sea necesario controlar las concentraciones plasmáticas de TCA y que se deba reducir la dosis de TCA si se coadministra un TCA con CYMBALTA. Debido al riesgo de arritmias ventriculares graves y muerte súbita potencialmente asociadas con niveles plasmáticos elevados de tioridazina, no se deben administrar conjuntamente CYMBALTA 30 mg y tioridazina [ver INTERACCIONES CON LA DROGAS ].
Otras interacciones farmacológicas clínicamente importantes
Alcohol
El uso concomitante de CYMBALTA 40 mg con una ingesta excesiva de alcohol puede estar asociado con una lesión hepática grave. Por esta razón, CYMBALTA 60 mg no debe recetarse a pacientes con un consumo considerable de alcohol [ver Hepatotoxicidad e INTERACCIONES MEDICAMENTOSAS ].
Fármacos que actúan sobre el SNC
Dados los efectos primarios de CNS en el SNC, CYMBALTA debe usarse con precaución cuando se toma en combinación con otros medicamentos de acción central o en sustitución de estos, incluidos aquellos con un mecanismo de acción similar [ver Interacciones farmacológicas clínicamente importantes y INTERACCIONES CON LA DROGAS ].
hiponatremia
Puede ocurrir hiponatremia como resultado del tratamiento con ISRS e IRSN, incluido CYMBALTA. En muchos casos, esta hiponatremia parece ser el resultado del síndrome de secreción inadecuada de hormona antidiurética (SIADH). Se informaron casos con sodio sérico inferior a 110 mmol/L con el uso de 40 mg de CYMBALTA y parecieron ser reversibles cuando se suspendió CYMBALTA. Los pacientes geriátricos pueden tener un mayor riesgo de desarrollar hiponatremia con los ISRS y los IRSN. Además, los pacientes que toman diuréticos o que tienen depleción de volumen pueden tener un mayor riesgo [ver Uso en poblaciones específicas ]. Se debe considerar la interrupción de CYMBALTA en pacientes con hiponatremia sintomática y se debe instituir la intervención médica adecuada.
Los signos y síntomas de la hiponatremia incluyen dolor de cabeza, dificultad para concentrarse, deterioro de la memoria, confusión, debilidad e inestabilidad, lo que puede provocar caídas. Los casos más graves y/o agudos se han asociado con alucinaciones, síncope, convulsiones, coma, paro respiratorio y muerte.
Uso en pacientes con enfermedades concomitantes
La experiencia clínica con CYMBALTA en pacientes con enfermedades sistémicas concomitantes es limitada. No hay información sobre el efecto que las alteraciones en la motilidad gástrica pueden tener sobre la estabilidad del recubrimiento entérico de CYMBALTA. En condiciones extremadamente ácidas, CYMBALTA, sin la protección del recubrimiento entérico, puede sufrir hidrólisis para formar naftol. Se recomienda precaución al usar CYMBALTA en pacientes con condiciones que pueden retrasar el vaciamiento gástrico (p. ej., algunos diabéticos).
CYMBALTA 30 mg no se ha evaluado sistemáticamente en pacientes con antecedentes recientes de infarto de miocardio o enfermedad arterial coronaria inestable. Los pacientes con estos diagnósticos generalmente fueron excluidos de los estudios clínicos durante las pruebas previas a la comercialización del producto.
Deterioro hepático
Evite el uso en pacientes con enfermedad hepática crónica o cirrosis [ver DOSIFICACIÓN Y ADMINISTRACIÓN , hepatotoxicidad , y Uso en poblaciones específicas ].
Insuficiencia Renal Severa
Evitar su uso en pacientes con insuficiencia renal grave, TFG DOSIFICACIÓN Y ADMINISTRACIÓN y Uso en poblaciones específicas ].
Control glucémico en pacientes con diabetes
Como se observó en los ensayos de DPNP, el tratamiento con CYMBALTA 30 mg empeoró el control glucémico en algunos pacientes con diabetes. En tres ensayos clínicos de CYMBALTA para el tratamiento del dolor neuropático asociado con la neuropatía periférica diabética [ver Estudios clínicos ], la duración media de la diabetes fue de aproximadamente 12 años, la glucemia en ayunas inicial media fue de 176 mg/dl y la hemoglobina A1c (HbA1c) inicial media fue del 7,8 %. En la fase de tratamiento agudo de 12 semanas de estos estudios, CYMBALTA se asoció con un pequeño aumento en la media de glucosa en sangre en ayunas en comparación con el placebo. En la fase de extensión de estos estudios, que duró hasta 52 semanas, la glucosa sanguínea promedio en ayunas aumentó 12 mg/dl en el grupo de 40 mg de CYMBALTA y disminuyó 11,5 mg/dl en el grupo de atención de rutina. La HbA1c aumentó un 0,5 % en el grupo de 40 mg de CYMBALTA y un 0,2 % en el grupo de atención de rutina.
Vacilación y retención urinaria
CYMBALTA 60 mg pertenece a una clase de medicamentos que se sabe que afectan la resistencia uretral. Si se desarrollan síntomas de vacilación urinaria durante el tratamiento con CYMBALTA 20 mg, se debe considerar la posibilidad de que puedan estar relacionados con el medicamento.
En la experiencia posterior a la comercialización se han observado casos de retención urinaria. En algunos casos de retención urinaria asociada con el uso de CYMBALTA 60 mg, se ha necesitado hospitalización y/o cateterismo.
Disfunción sexual
El uso de IRSN, incluido CYMBALTA 60 mg, puede causar síntomas de disfunción sexual [ver REACCIONES ADVERSAS ]. En pacientes masculinos, el uso de SNRI puede provocar retraso o falla en la eyaculación, disminución de la libido y disfunción eréctil. En pacientes femeninas, el uso de SNRI puede provocar una disminución de la libido y un orgasmo retrasado o ausente.
Es importante que los prescriptores pregunten sobre la función sexual antes de iniciar el tratamiento con CYMBALTA 40 mg y que pregunten específicamente sobre los cambios en la función sexual durante el tratamiento, ya que es posible que la función sexual no se informe espontáneamente. Cuando se evalúan los cambios en la función sexual, es importante obtener una historia clínica detallada (que incluya el momento del inicio de los síntomas) porque los síntomas sexuales pueden tener otras causas, incluido el trastorno psiquiátrico subyacente. Discutir posibles estrategias de manejo para ayudar a los pacientes a tomar decisiones informadas sobre el tratamiento.
Información de consejería para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( Guía de medicamentos ).
Pensamientos y comportamientos suicidas
Aconseje a los pacientes, sus familias y sus cuidadores que estén atentos a la aparición de ideas y conductas suicidas, especialmente durante el tratamiento y cuando la dosis se ajuste hacia arriba o hacia abajo, e indíqueles que informen dichos síntomas a su proveedor de atención médica [ver CUADRO DE ADVERTENCIA y ADVERTENCIAS Y PRECAUCIONES ].
Administración
Aconseje a los pacientes que traguen CYMBALTA 20 mg enteros y que no mastiquen, trituren o abran la cápsula (no rocíen el contenido sobre los alimentos ni lo mezclen con líquidos) porque estas acciones pueden afectar el recubrimiento entérico.
hepatotoxicidad
Informe a los pacientes que se han informado problemas hepáticos graves, a veces fatales, en pacientes tratados con CYMBALTA. Indique a los pacientes que hablen con su proveedor de atención médica si desarrollan picazón, dolor en la parte superior derecha del abdomen, orina oscura o piel/ojos amarillos mientras toman CYMBALTA, que pueden ser signos de problemas hepáticos. Indique a los pacientes que hablen con su proveedor de atención médica sobre su consumo de alcohol. El uso de CYMBALTA con una ingesta excesiva de alcohol puede estar asociado con una lesión hepática grave [ver ADVERTENCIAS Y PRECAUCIONES ].
Alcohol
Aunque CYMBALTA no aumenta el deterioro de las habilidades mentales y motoras causado por el alcohol, el uso concomitante de CYMBALTA con una ingesta excesiva de alcohol puede estar asociado con una lesión hepática grave [ver ADVERTENCIAS Y PRECAUCIONES y INTERACCIONES CON LA DROGAS ].
Hipotensión ortostática, caídas y síncope
Advierta a los pacientes sobre el riesgo de hipotensión ortostática, caídas y síncope, especialmente durante el período de uso inicial y el posterior aumento de la dosis, y en asociación con el uso de medicamentos concomitantes que podrían potenciar el efecto ortostático de CYMBALTA [ver ADVERTENCIAS Y PRECAUCIONES ].
Síndrome de serotonina
Advierta a los pacientes sobre el riesgo de síndrome serotoninérgico con el uso concomitante de CYMBALTA 30 mg y otros agentes serotoninérgicos, incluidos triptanos, antidepresivos tricíclicos, fentanilo, litio, tramadol, buspirona, triptófano, anfetaminas y hierba de San Juan [ver CONTRAINDICACIONES , ADVERTENCIAS Y PRECAUCIONES , y INTERACCIONES CON LA DROGAS ]. Informar a los pacientes sobre los signos y síntomas asociados con el síndrome serotoninérgico que pueden incluir cambios en el estado mental (p. ej., agitación, alucinaciones, delirio y coma), inestabilidad autonómica (p. ej., taquicardia, presión arterial lábil, mareos, diaforesis, sofocos, hipertermia), cambios neuromusculares (p. ej., temblor, rigidez, mioclonía, hiperreflexia, falta de coordinación), convulsiones y/o síntomas gastrointestinales (p. ej., náuseas, vómitos, diarrea). Advierta a los pacientes que busquen atención médica de inmediato si experimentan estos síntomas.
Mayor riesgo de sangrado
Advierta a los pacientes sobre el uso concomitante de CYMBALTA 30 mg y AINE, aspirina, warfarina u otros medicamentos que afectan la coagulación, ya que el uso combinado de medicamentos psicotrópicos que interfieren con la recaptación de serotonina y estos agentes se ha asociado con un mayor riesgo de hemorragia [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
Reacciones cutáneas graves
Advierta a los pacientes que CYMBALTA puede causar reacciones cutáneas graves. Esto puede necesitar ser tratado en un hospital y puede poner en peligro la vida. Aconseje a los pacientes que llamen a su médico de inmediato o busquen ayuda de emergencia si tienen ampollas en la piel, sarpullido, llagas en la boca, urticaria o cualquier otra reacción alérgica [ver ADVERTENCIAS Y PRECAUCIONES ].
Interrupción del tratamiento
Indique a los pacientes que la interrupción de CYMBALTA 30 mg puede estar asociada con síntomas como mareos, dolor de cabeza, náuseas, diarrea, parestesia, irritabilidad, vómitos, insomnio, ansiedad, hiperhidrosis y fatiga, y se les debe recomendar que no modifiquen su régimen de dosificación o suspendan. tomando CYMBALTA sin consultar a su proveedor de atención médica [ver ADVERTENCIAS Y PRECAUCIONES ].
Activación de manía o hipomanía
Evalúe adecuadamente a los pacientes con síntomas depresivos en busca de riesgo de trastorno bipolar (p. ej., antecedentes familiares de suicidio, trastorno bipolar y depresión) antes de iniciar el tratamiento con CYMBALTA. Aconseje a los pacientes que informen cualquier signo o síntoma de una reacción maníaca, como un gran aumento de la energía, problemas graves para dormir, pensamientos acelerados, comportamiento imprudente, hablar más o más rápido de lo habitual, ideas inusualmente grandiosas y felicidad o irritabilidad excesiva [ver ADVERTENCIAS Y PRECAUCIONES ].
Glaucoma de ángulo cerrado
Advierta a los pacientes que tomar CYMBALTA 40 mg puede causar una dilatación pupilar leve que, en personas susceptibles, puede provocar un episodio de glaucoma de ángulo cerrado. El glaucoma preexistente casi siempre es un glaucoma de ángulo abierto porque el glaucoma de ángulo cerrado, cuando se diagnostica, se puede tratar definitivamente con iridectomía. El glaucoma de ángulo abierto no es un factor de riesgo para el glaucoma de ángulo cerrado. Es posible que los pacientes deseen ser examinados para determinar si son susceptibles al ángulo cerrado y someterse a un procedimiento profiláctico (p. ej., iridectomía), si son susceptibles [ver ADVERTENCIAS Y PRECAUCIONES ].
convulsiones
Aconseje a los pacientes que informen a su proveedor de atención médica si tienen antecedentes de trastorno convulsivo [ver ADVERTENCIAS Y PRECAUCIONES ].
Efectos sobre la presión arterial
Advierta a los pacientes que CYMBALTA 60 mg puede causar un aumento de la presión arterial [ver ADVERTENCIAS Y PRECAUCIONES ].
Medicaciones concomitantes
Aconseje a los pacientes que informen a su proveedor de atención médica si están tomando o planean tomar algún medicamento recetado o de venta libre, ya que existe la posibilidad de interacciones [ver DOSIFICACIÓN Y ADMINISTRACIÓN , CONTRAINDICACIONES , ADVERTENCIAS Y PRECAUCIONES , y INTERACCIONES CON LA DROGAS ].
hiponatremia
Informe a los pacientes que se ha notificado hiponatremia como resultado del tratamiento con IRSN e ISRS, incluido CYMBALTA. Informar a los pacientes sobre los signos y síntomas de la hiponatremia [ver ADVERTENCIAS Y PRECAUCIONES ].

Enfermedades concomitantes
Aconseje a los pacientes que informen a su proveedor de atención médica sobre todas sus afecciones médicas [ver ADVERTENCIAS Y PRECAUCIONES ].
Vacilación y retención urinaria
CYMBALTA pertenece a una clase de medicamentos que pueden afectar la micción. Indique a los pacientes que consulten con su proveedor de atención médica si desarrollan algún problema con el flujo de orina [ver ADVERTENCIAS Y PRECAUCIONES ].
Disfunción sexual
Advierta a los pacientes que el uso de CYMBALTA 40 mg puede causar síntomas de disfunción sexual tanto en pacientes masculinos como femeninos. Informe a los pacientes que deben discutir cualquier cambio en la función sexual y las posibles estrategias de manejo con su proveedor de atención médica [ver ADVERTENCIAS Y PRECAUCIONES ].
El embarazo
- Aconseje a las mujeres que notifiquen a su proveedor de atención médica si quedan embarazadas o tienen la intención de quedar embarazadas durante el tratamiento con CYMBALTA.
- Aconseje a las mujeres embarazadas o pacientes que tienen la intención de quedar embarazadas que el uso de 40 mg de CYMBALTA durante el mes anterior al parto puede aumentar el riesgo de hemorragia posparto y puede aumentar el riesgo de complicaciones neonatales que requieran hospitalización prolongada, soporte respiratorio y alimentación por sonda.
- Informar a las mujeres embarazadas que existe el riesgo de recaída con la interrupción de los antidepresivos.
- Informe a los pacientes que existe un registro de exposición durante el embarazo que monitorea los resultados del embarazo en mujeres expuestas a la duloxetina durante el embarazo [ver Uso en poblaciones específicas ].
Lactancia
Aconseje a las mujeres que amamantan que usan CYMBALTA 30 mg que vigilen a los bebés en busca de sedación, mala alimentación y poco aumento de peso y que busquen atención médica si notan estos signos [ver Uso en poblaciones específicas ].
Interferencia con el rendimiento psicomotor
CYMBALTA 30 mg puede estar asociado con sedación y mareos. Por lo tanto, advierta a los pacientes sobre el manejo de maquinaria peligrosa, incluidos los automóviles, hasta que estén razonablemente seguros de que la terapia con CYMBALTA no afecta su capacidad para realizar dichas actividades.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Carcinogénesis
Se administró duloxetina en la dieta a ratones y ratas durante 2 años.
En ratones hembra que recibieron duloxetina a 140 mg/kg/día (3 veces la dosis humana máxima recomendada (MRHD) de 120 mg/día administrada a niños sobre una base de mg/m2), hubo una mayor incidencia de adenomas y carcinomas hepatocelulares. La dosis sin efecto fue de 50 mg/kg/día (1 vez la MRHD administrada a los niños). La incidencia de tumores no aumentó en ratones macho que recibieron duloxetina en dosis de hasta 100 mg/kg/día (2 veces la MRHD administrada a niños).
En ratas, las dosis dietéticas de duloxetina de hasta 27 mg/kg/día en hembras (1 vez la MRHD administrada a niños) y hasta 36 mg/kg/día en machos (1,4 veces la MRHD administrada a niños) no aumentaron la incidencia de tumores.
mutagénesis
La duloxetina no fue mutagénica en el ensayo de mutación inversa bacteriana in vitro (prueba de Ames) y no fue clastogénica en una prueba de aberración cromosómica in vivo en células de médula ósea de ratón. Además, la duloxetina no fue genotóxica en un ensayo in vitro de mutación de genes directos en mamíferos en células de linfoma de ratón o en un ensayo in vitro de síntesis de ADN no programada (UDS) en hepatocitos primarios de rata, y no indujo el intercambio de cromátidas hermanas en la médula ósea de hámster chino in vivo. .
Deterioro de la fertilidad
La duloxetina administrada por vía oral a ratas macho o hembra antes y durante el apareamiento en dosis de hasta 45 mg/kg/día (3 veces la MRHD administrada a adolescentes en mg/m2) no alteró el apareamiento ni la fertilidad.
Uso en poblaciones específicas
El embarazo
Registro de exposición durante el embarazo
Existe un registro de exposición durante el embarazo que monitorea los resultados del embarazo en mujeres expuestas a CYMBALTA durante el embarazo. Para inscribirse, comuníquese con el Registro de embarazos de CYMBALTA al 1-866-814-6975 o visite www.cymbalta 20mgpregnancyregistry.com.
Resumen de riesgos
Los datos de un estudio de cohorte retrospectivo posterior a la comercialización indican que el uso de duloxetina en el mes anterior al parto puede estar asociado con un mayor riesgo de hemorragia posparto. Los datos de la literatura publicada y de un estudio de cohorte retrospectivo posterior a la comercialización no han identificado un riesgo claro asociado con el fármaco de defectos congénitos importantes u otros resultados adversos del desarrollo (ver Datos ). Existen riesgos asociados con la depresión y la fibromialgia no tratadas durante el embarazo, y con la exposición a los IRSN e ISRS, incluido CYMBALTA, durante el embarazo (ver Consideraciones clínicas ).
En ratas y conejos tratados con duloxetina durante el período de organogénesis, los pesos fetales disminuyeron pero no hubo evidencia de efectos en el desarrollo a dosis de hasta 3 y 6 veces, respectivamente, la dosis máxima recomendada en humanos (DMRH) de 120 mg/día administrada a los adolescentes sobre una base de mg/m2. Cuando se administró duloxetina por vía oral a ratas preñadas durante la gestación y la lactancia, el peso de las crías al nacer y la supervivencia de las crías hasta 1 día después del parto se redujeron en una dosis 2 veces superior a la MRHD administrada a las adolescentes sobre una base de mg/m2. A esta dosis, se observaron comportamientos de los cachorros consistentes con una mayor reactividad, como una mayor respuesta de sobresalto al ruido y una menor habituación a la actividad locomotora. El crecimiento posterior al destete no se vio afectado negativamente.
Se desconoce el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo para la población indicada. Todos los embarazos tienen un riesgo de fondo de defecto congénito, pérdida u otros resultados adversos. En la población general de los EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 al 4 % y del 15 al 20 %, respectivamente.
Consideraciones clínicas
Riesgo materno y/o embrionario/fetal asociado a la enfermedad
Las mujeres que suspenden los antidepresivos durante el embarazo tienen más probabilidades de experimentar una recaída de depresión mayor que las mujeres que continúan con los antidepresivos. Este hallazgo proviene de un estudio longitudinal prospectivo que siguió a 201 mujeres embarazadas con antecedentes de trastorno depresivo mayor que eran eutímicas y tomaban antidepresivos al comienzo del embarazo. Considere el riesgo de depresión no tratada al suspender o cambiar el tratamiento con medicamentos antidepresivos durante el embarazo y el posparto.
Las mujeres embarazadas con fibromialgia tienen un mayor riesgo de resultados maternos e infantiles adversos, incluida la ruptura prematura de membranas prematura, parto prematuro, pequeño para la edad gestacional, restricción del crecimiento intrauterino, interrupción de la placenta y trombosis venosa. No se sabe si estos resultados maternos y fetales adversos son un resultado directo de la fibromialgia u otros factores comórbidos.
Reacciones adversas maternas
El uso de duloxetina en el mes anterior al parto puede estar asociado con un mayor riesgo de hemorragia posparto [ver ADVERTENCIAS Y PRECAUCIONES ].
Reacción adversa fetal/neonatal
Los recién nacidos expuestos a CYMBALTA y otros SNRI o ISRS al final del tercer trimestre han desarrollado complicaciones que requieren hospitalización prolongada, soporte respiratorio y alimentación por sonda. Tales complicaciones pueden surgir inmediatamente después del parto. Los hallazgos clínicos informados incluyen dificultad respiratoria, cianosis, apnea, convulsiones, inestabilidad de la temperatura, dificultad para alimentarse, vómitos, hipoglucemia, hipotonía, hipertonía, hiperreflexia, temblor, nerviosismo, irritabilidad y llanto constante. Estos hallazgos son consistentes con un efecto tóxico directo de los SNRI o ISRS, o posiblemente, con un síndrome de interrupción del fármaco. Cabe señalar que, en algunos casos, el cuadro clínico es compatible con el síndrome serotoninérgico [ver ADVERTENCIAS Y PRECAUCIONES ].
Datos
Datos humanos
Los datos de un estudio de cohortes retrospectivo posterior a la comercialización basado en reclamaciones encontraron un mayor riesgo de hemorragia posparto entre 955 mujeres embarazadas expuestas a duloxetina en el último mes de embarazo en comparación con 4 128 460 mujeres embarazadas no expuestas (riesgo relativo ajustado: 1,53; IC del 95 %: 1,08-2,18). ). El mismo estudio no encontró un aumento clínicamente significativo en el riesgo de defectos congénitos importantes en la comparación de 2532 mujeres expuestas a la duloxetina en el primer trimestre del embarazo con 1 284 827 mujeres no expuestas después de ajustar varios factores de confusión. Las limitaciones metodológicas incluyen posibles factores de confusión residuales, clasificación errónea de la exposición y los resultados, falta de medidas directas de la gravedad de la enfermedad y falta de información sobre el consumo de alcohol, la nutrición y la exposición a medicamentos de venta libre.
Datos de animales
En estudios de reproducción animal, se ha demostrado que la duloxetina tiene efectos adversos sobre el desarrollo embrionario/fetal y posnatal.
Cuando se administró duloxetina por vía oral a ratas y conejas preñadas durante el período de organogénesis, no hubo evidencia de malformaciones o variaciones del desarrollo en dosis de hasta 45 mg/kg/día [3 y 6 veces, respectivamente, la MRHD de 120 mg/día administrada a adolescentes sobre una base de mg/m2]. Sin embargo, el peso fetal disminuyó con esta dosis, con una dosis sin efecto de 10 mg/kg/día (aproximadamente igual a la MRHD en ratas y 2 veces la MRHD en conejos).
Cuando se administró duloxetina por vía oral a ratas preñadas durante la gestación y la lactancia, la supervivencia de las crías hasta 1 día después del parto y el peso corporal de las crías al nacer y durante el período de lactancia se redujeron a una dosis de 30 mg/kg/día (2 veces la MRHD administrada). a los adolescentes sobre la base de mg/m2); la dosis sin efecto fue de 10 mg/kg/día. Además, se observaron comportamientos consistentes con una mayor reactividad, como una mayor respuesta de sobresalto al ruido y una menor habituación a la actividad locomotora, en las crías después de la exposición materna a 30 mg/kg/día. El crecimiento posterior al destete y el rendimiento reproductivo de la progenie no se vieron afectados negativamente por el tratamiento materno con duloxetina.
Lactancia
Resumen de riesgos
Los datos de la literatura publicada informan la presencia de duloxetina en la leche humana (ver Datos ). Hay informes de sedación, mala alimentación y escaso aumento de peso en lactantes expuestos a la duloxetina a través de la leche materna (ver Consideraciones clínicas ). No hay datos sobre el efecto de la duloxetina en la producción de leche.
Los beneficios para el desarrollo y la salud de la lactancia materna se deben considerar junto con la necesidad clínica de CYMBALTA de la madre y cualquier posible efecto adverso sobre el niño amamantado debido a CYMBALTA oa la afección materna subyacente.
Consideraciones clínicas
Los bebés expuestos a CYMBALTA deben ser monitoreados por sedación, mala alimentación y poco aumento de peso.
Datos
Se estudió la disposición de CYMBALTA 60 mg en 6 mujeres lactantes que tenían al menos 12 semanas posparto y habían optado por destetar a sus bebés. Las mujeres recibieron 40 mg de CYMBALTA 60 mg dos veces al día durante 3,5 días. La concentración máxima medida en la leche materna se produjo en una mediana de 3 horas después de la dosis. La cantidad de CYMBALTA en la leche materna fue de aproximadamente 7 mcg/día mientras tomaba esa dosis; la dosis diaria estimada para lactantes fue de aproximadamente 2 mcg/kg/día, que es menos del 1 % de la dosis materna. No se examinó la presencia de metabolitos de CYMBALTA 40 mg en la leche materna.
Uso pediátrico
Se ha establecido la seguridad y eficacia de CYMBALTA 60 mg para el tratamiento del trastorno de ansiedad generalizada (TAG) en pacientes de 7 a 17 años y para el tratamiento del síndrome de fibromialgia juvenil en pacientes de 13 a 17 años. No se ha establecido la seguridad y eficacia de CYMBALTA 20 mg en pacientes pediátricos con trastorno depresivo mayor (MDD), dolor neuropático periférico diabético o dolor musculoesquelético crónico.
Los antidepresivos aumentaron el riesgo de pensamientos y conductas suicidas en pacientes pediátricos. Supervise a todos los pacientes pediátricos que reciben tratamiento con antidepresivos para detectar un empeoramiento clínico y la aparición de pensamientos y comportamientos suicidas, especialmente durante los primeros meses de tratamiento o en momentos de cambios de dosis [ver ADVERTENCIAS Y PRECAUCIONES ]. Realice un control regular del peso y el crecimiento en pacientes pediátricos tratados con CYMBALTA [ver REACCIONES ADVERSAS ].
Trastorno de ansiedad generalizada
El uso de CYMBALTA para el tratamiento del GAD en pacientes de 7 a 17 años de edad está respaldado por un ensayo controlado con placebo de 10 semanas (GAD-6). El estudio incluyó a 272 pacientes pediátricos con TAG de los cuales el 47% tenía entre 7 y 11 años (53% tenía entre 12 y 17 años). CYMBALTA demostró superioridad sobre el placebo según lo medido por una mayor mejora en la escala de calificación de ansiedad pediátrica (PARS) para la puntuación de gravedad del TAG [ver Estudios clínicos ].
No se ha establecido la seguridad y eficacia de CYMBALTA 20 mg para el tratamiento del TAG en pacientes pediátricos menores de 7 años.
fibromialgia
El uso de CYMBALTA para el tratamiento de la fibromialgia en pacientes de 13 a 17 años de edad está respaldado por un ensayo controlado con placebo de 13 semanas en 184 pacientes con síndrome de fibromialgia juvenil (estudio FM-4). CYMBALTA mostró una mejora con respecto al placebo en el criterio principal de valoración, el cambio desde el inicio hasta el final del tratamiento en el Inventario Breve del Dolor (BPI, por sus siglas en inglés) - Versión abreviada modificada: Calificación promedio de la gravedad del dolor de 24 horas de la versión para adolescentes [ver Estudios clínicos ].
No se ha establecido la seguridad y eficacia de CYMBALTA para el tratamiento de la fibromialgia en pacientes menores de 13 años.
Trastorno depresivo mayor
No se ha establecido la seguridad y eficacia de CYMBALTA en pacientes pediátricos para el tratamiento de MDD.
No se demostró la eficacia de CYMBALTA en dos ensayos controlados con placebo de 10 semanas con 800 pacientes pediátricos de 7 a 17 años con MDD (MDD-6 y MDD-7). Ni CYMBALTA ni un control activo (aprobado para el tratamiento del TDM pediátrico) fue superior al placebo.
Las reacciones adversas observadas con mayor frecuencia en los ensayos clínicos pediátricos de MDD incluyeron náuseas, dolor de cabeza, disminución de peso y dolor abdominal. Se ha observado disminución del apetito y pérdida de peso en asociación con el uso de ISRS e IRSN.
Datos toxicológicos de animales juveniles
La administración de duloxetina a ratas jóvenes desde el día 21 postnatal (destete) hasta el día 90 postnatal (adulto) resultó en una disminución del peso corporal que persistió hasta la edad adulta, pero se recuperó cuando se interrumpió el tratamiento farmacológico; maduración sexual ligeramente retrasada (~1,5 días) en las hembras, sin ningún efecto sobre la fertilidad; y un retraso en el aprendizaje de una tarea compleja en la edad adulta, que no se observó después de suspender el tratamiento farmacológico. Estos efectos se observaron con la dosis alta de 45 mg/kg/día (2 veces la MRHD, para un niño); el nivel sin efecto fue de 20 mg/kg/día (≈1 veces la MRHD, para un niño).
Uso geriátrico
Exposición geriátrica en ensayos clínicos previos a la comercialización de CYMBALTA
- De los 2418 pacientes en los ensayos de TDM, el 6 % (143) tenía 65 años o más.
- De los 1041 pacientes en los ensayos CLBP, el 21% (221) tenían 65 años o más.
- De los 487 pacientes en los ensayos de OA, el 41 % (197) tenía 65 años o más.
- De los 1074 pacientes en los ensayos de DPNP, el 33 % (357) tenían 65 años o más.
- De los 1.761 pacientes en los ensayos de FM, el 8 % (140) tenían 65 años o más.
En los estudios MDD, GAD, DPNP, FM, OA y CLBP, generalmente no se observaron diferencias generales en la seguridad o la eficacia entre estos pacientes y los pacientes adultos más jóvenes, y otra experiencia clínica informada no ha identificado diferencias en las respuestas entre estos pacientes geriátricos y más jóvenes. pacientes adultos, pero no se puede descartar una mayor sensibilidad de algunos pacientes mayores.
Los ISRS y los IRSN, incluido CYMBALTA, se han asociado con hiponatremia clínicamente significativa en pacientes geriátricos, que pueden tener un mayor riesgo de sufrir esta reacción adversa [ver ADVERTENCIAS Y PRECAUCIONES ].
En un análisis de datos de todos los ensayos controlados con placebo, los pacientes tratados con CYMBALTA informaron una mayor tasa de caídas en comparación con los pacientes tratados con placebo. El aumento del riesgo parece ser proporcional al riesgo subyacente de caídas del paciente. El riesgo subyacente parece aumentar constantemente con la edad. Dado que los pacientes geriátricos tienden a tener una mayor prevalencia de factores de riesgo de caídas, como medicamentos, comorbilidades médicas y trastornos de la marcha, no está claro el impacto del aumento de la edad en las caídas durante el tratamiento con CYMBALTA 30 mg. Se han informado caídas con consecuencias graves, incluidas fracturas óseas y hospitalizaciones, con el uso de CYMBALTA [ver ADVERTENCIAS Y PRECAUCIONES y REACCIONES ADVERSAS ].
Se comparó la farmacocinética de duloxetina después de una dosis única de 40 mg en mujeres sanas de edad avanzada (65 a 77 años) y mujeres sanas de mediana edad (32 a 50 años). No hubo diferencia en la Cmax, pero el AUC de la duloxetina fue un poco más alto (alrededor del 25 %) y la vida media fue unas 4 horas más larga en las mujeres de edad avanzada. Los análisis farmacocinéticos poblacionales sugieren que los valores típicos de aclaramiento disminuyen aproximadamente un 1 % por cada año de edad entre los 25 y los 75 años; pero la edad como factor predictivo solo representa un pequeño porcentaje de la variabilidad entre pacientes. No es necesario ajustar la dosis en función de la edad del paciente adulto.
Género
La vida media de la duloxetina es similar en hombres y mujeres. No es necesario ajustar la dosis según el sexo.
Estado de tabaquismo
La biodisponibilidad de duloxetina (AUC) parece reducirse en aproximadamente un tercio en los fumadores. No se recomiendan modificaciones de dosis para fumadores.
La raza
No se realizó ningún estudio farmacocinético específico para investigar los efectos de la raza.
Deterioro hepático
Los pacientes con insuficiencia hepática clínicamente evidente han disminuido el metabolismo y la eliminación de la duloxetina. Después de una dosis única de 20 mg de CYMBALTA 20 mg, 6 pacientes cirróticos con insuficiencia hepática moderada (Child-Pugh Clase B) tuvieron un aclaramiento plasmático medio de duloxetina de aproximadamente el 15 % del de los sujetos sanos de la misma edad y sexo, con un aumento de 5 veces en la exposición media (AUC). Aunque la Cmax fue similar a los valores normales en los pacientes cirróticos, la vida media fue unas 3 veces más larga [ver DOSIFICACIÓN Y ADMINISTRACIÓN y ADVERTENCIAS Y PRECAUCIONES ].
Insuficiencia Renal Severa
Hay datos limitados disponibles sobre los efectos de CYMBALTA 40 mg en pacientes con enfermedad renal en etapa terminal (ESRD). Después de una dosis única de 60 mg de CYMBALTA 20 mg, los valores de Cmax y AUC fueron aproximadamente un 100 % mayores en pacientes con ESRD que recibían hemodiálisis intermitente crónica que en sujetos con función renal normal. Sin embargo, la vida media de eliminación fue similar en ambos grupos. Las AUC de los principales metabolitos circulantes, glucurónido de 4-hidroxi duloxetina y sulfato de 5-hidroxi, 6 metoxi duloxetina, excretados en gran medida en la orina, fueron aproximadamente de 7 a 9 veces más altas y se espera que aumenten aún más con dosis múltiples. Los análisis farmacocinéticos de la población sugieren que los grados leves a moderados de insuficiencia renal (CrCl estimado de 30-80 ml/min) no tienen un efecto significativo sobre el aclaramiento aparente de duloxetina [ver DOSIFICACIÓN Y ADMINISTRACIÓN y ADVERTENCIAS Y PRECAUCIONES ].
SOBREDOSIS
Signos y síntomas
En la experiencia posterior a la comercialización, se informaron resultados fatales para sobredosis agudas de CYMBALTA 60 mg, principalmente con sobredosis mixtas, pero también con CYMBALTA 20 mg solo, incluidos 1000 mg de CYMBALTA (aproximadamente 8.3 veces la dosis máxima recomendada). Los signos y síntomas de sobredosis (CYMBALTA solo o con medicamentos combinados) incluyeron somnolencia, coma, síndrome serotoninérgico, convulsiones, síncope, taquicardia, hipotensión, hipertensión y vómitos.
Manejo de sobredosis
No existe un antídoto específico para una sobredosis de CYMBALTA 60 mg, pero si se presenta el síndrome serotoninérgico, se puede considerar un tratamiento específico (como con ciproheptadina y/o control de la temperatura).
En caso de sobredosis aguda con CYMBALTA 30 mg, el tratamiento debe consistir en las medidas generales empleadas en el manejo de la sobredosis con cualquier fármaco, como asegurar una vía aérea, oxigenación y ventilación adecuadas y monitorear el ritmo cardíaco y los signos vitales. El lavado gástrico con una sonda orogástrica de gran calibre con protección adecuada de las vías respiratorias, si es necesario, puede estar indicado si se realiza poco después de la ingestión o en pacientes sintomáticos. No se recomienda la inducción de emesis.
El carbón activado puede ser útil para limitar la absorción de duloxetina en el tracto gastrointestinal. Se ha demostrado que la administración de carbón activado disminuye el AUC y la Cmax de duloxetina en un promedio de un tercio, aunque algunos pacientes tuvieron un efecto limitado del carbón activado. Debido al gran volumen de distribución de la duloxetina, es poco probable que la diuresis forzada, la diálisis, la hemoperfusión y la exanguinotransfusión sean beneficiosas.
En el manejo de la sobredosis, se debe considerar la posibilidad de que participen múltiples fármacos. Una precaución específica involucra a los pacientes con sobredosis de CYMBALTA 60 mg y antidepresivos tricíclicos. En tal caso, la eliminación reducida del tricíclico original y/o su metabolito activo puede aumentar la posibilidad de secuelas clínicamente significativas y extender el tiempo necesario para una estrecha observación médica [ver ADVERTENCIAS Y PRECAUCIONES y INTERACCIONES CON LA DROGAS ].
Considere comunicarse con un centro de control de intoxicaciones (1-800-222-1222 o www.poison.org) para obtener información adicional sobre el tratamiento de la sobredosis.
CONTRAINDICACIONES
El uso de IMAO destinados a tratar trastornos psiquiátricos con CYMBALTA 40 mg o dentro de los 5 días posteriores a la interrupción del tratamiento con CYMBALTA está contraindicado debido a un mayor riesgo de síndrome serotoninérgico. Está contraindicado el uso de CYMBALTA dentro de los 14 días posteriores a la suspensión de un IMAO destinado a tratar trastornos psiquiátricos [ver DOSIFICACIÓN Y ADMINISTRACIÓN y ADVERTENCIAS Y PRECAUCIONES ].
También está contraindicado comenzar con CYMBALTA 30 mg en un paciente que está siendo tratado con IMAO como linezolid o azul de metileno intravenoso debido a un mayor riesgo de síndrome serotoninérgico [ver DOSIFICACIÓN Y ADMINISTRACIÓN y ADVERTENCIAS Y PRECAUCIONES ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
Aunque se desconocen los mecanismos exactos de las acciones antidepresiva, inhibidora del dolor central y ansiolítica de la duloxetina en humanos, se cree que estas acciones están relacionadas con la potenciación de la actividad serotoninérgica y noradrenérgica en el SNC.
Farmacodinámica
Los estudios preclínicos han demostrado que la duloxetina es un potente inhibidor de la recaptación neuronal de serotonina y norepinefrina y un inhibidor menos potente de la recaptación de dopamina. La duloxetina no tiene afinidad significativa por los receptores dopaminérgicos, adrenérgicos, colinérgicos, histaminérgicos, opioides, glutamato y GABA in vitro. La duloxetina no inhibe la monoaminooxidasa (MAO).
CYMBALTA pertenece a una clase de medicamentos que se sabe que afectan la resistencia uretral [ver ADVERTENCIAS Y PRECAUCIONES ].
Electrofisiología cardíaca
El efecto de CYMBALTA 160 mg y 200 mg administrados dos veces al día (2,7 y 3,3 veces la dosis máxima recomendada, respectivamente) en el estado estacionario se evaluó en un estudio aleatorio, doble ciego, cruzado de dos vías en 117 mujeres adultas sanas. No se detectó prolongación del intervalo QT. CYMBALTA 40 mg parece estar asociado con un acortamiento del intervalo QT dependiente de la concentración pero no clínicamente significativo.
Farmacocinética
La duloxetina tiene una vida media de eliminación de aproximadamente 12 horas (rango de 8 a 17 horas) y su farmacocinética es proporcional a la dosis en el rango terapéutico. Las concentraciones plasmáticas en estado estacionario generalmente se alcanzan después de 3 días de dosificación. La eliminación de la duloxetina se produce principalmente a través del metabolismo hepático en el que participan dos isoenzimas P450, CYP1A2 y CYP2D6.
Absorción
Después de la administración oral de CYMBALTA 30 mg, el clorhidrato de duloxetina se absorbe bien. Hay un retraso medio de 2 horas hasta que comienza la absorción (Tlag), con concentraciones plasmáticas máximas (Cmax) de duloxetina que ocurren 6 horas después de la dosis. Hay un retraso de 3 horas en la absorción y un aumento de un tercio en el aclaramiento aparente de duloxetina después de una dosis vespertina en comparación con una dosis matutina.
Efecto de la comida
Los alimentos no afectan la Cmax de duloxetina, pero retrasan el tiempo para alcanzar la concentración máxima de 6 a 10 horas y disminuyen marginalmente el grado de absorción (AUC) en aproximadamente un 10 %.
Distribución
El volumen aparente de distribución promedia alrededor de 1640 L. La duloxetina se une en gran medida (>90 %) a las proteínas del plasma humano, y se une principalmente a la albúmina y la glicoproteína ácida α1. La interacción entre la duloxetina y otros fármacos altamente ligados a proteínas no se ha evaluado completamente. La unión a proteínas plasmáticas de la duloxetina no se ve afectada por insuficiencia renal o hepática.
Eliminación
Metabolismo
Se ha determinado la biotransformación y disposición de duloxetina en humanos luego de la administración oral de duloxetina marcada con 14C. La duloxetina comprende alrededor del 3 % del material radiomarcado total en el plasma, lo que indica que sufre un extenso metabolismo a numerosos metabolitos. Las principales vías de biotransformación de la duloxetina implican la oxidación del anillo de naftilo seguida de la conjugación y posterior oxidación. Tanto CYP1A2 como CYP2D6 catalizan la oxidación del anillo de naftilo in vitro. Los metabolitos que se encuentran en el plasma incluyen glucurónido de 4-hidroxi duloxetina y sulfato de 5-hidroxi, 6-metoxi duloxetina.
Excreción
Se han identificado muchos metabolitos adicionales en la orina, algunos de los cuales representan solo vías menores de eliminación. Solo cantidades mínimas (
Poblaciones Específicas
Pacientes pediátricos
La concentración plasmática en estado estacionario de duloxetina fue comparable en pacientes pediátricos de 7 a 17 años de edad y en pacientes adultos. La concentración promedio de duloxetina en estado estacionario fue aproximadamente un 30 % más baja en esta población pediátrica en relación con los pacientes adultos. Las concentraciones plasmáticas de duloxetina en estado estacionario predichas por el modelo en pacientes pediátricos de 7 a 17 años de edad estuvieron en su mayoría dentro del rango de concentración observado en pacientes adultos y no excedieron el rango de concentración en adultos.
Estudios clínicos
Descripción general de los ensayos clínicos
La eficacia de CYMBALTA 60 mg se ha establecido en las siguientes poblaciones en ensayos adecuados y bien controlados:
Trastorno Depresivo Mayor (TDM)
4 ensayos a corto plazo (Estudios MDD-1, MDD-2, MDD-3 y MDD-4) y 1 ensayo de mantenimiento (Estudio MDD-5) en adultos [ver Trastorno depresivo mayor en adultos ].
Trastorno de ansiedad generalizada (TAG)
3 ensayos a corto plazo en adultos (Estudios GAD-1, GAD-2 y GAD-3), 1 ensayo de mantenimiento en adultos (Estudio GAD-4), 1 ensayo a corto plazo en pacientes geriátricos (Estudio GAD-5), y 1 ensayo a corto plazo en pacientes pediátricos de 7 a 17 años de edad (Estudio GAD-6) [ver Trastorno de ansiedad generalizada ].
Dolor neuropático periférico diabético (DPNP)
Dos ensayos de 12 semanas en adultos (Estudios DPNP-1 y DPNP-2) [ver Dolor neuropático periférico diabético en adultos ].
Fibromialgia (FM)
Dos ensayos en adultos (uno de 3 meses de duración y otro de 6 meses de duración) (Estudios FM-1 y FM-2) y un ensayo de 13 semanas en pacientes pediátricos de 13 a 17 años de edad (Estudio FM-4) [ver fibromialgia ].
Dolor musculoesquelético crónico
Dos ensayos de 12 a 13 semanas en pacientes adultos con dolor lumbar crónico (CLBP) (Estudios CLBP-1 y CLBP-3) y un ensayo de 13 semanas en pacientes adultos con dolor crónico debido a la osteoartritis (OA) (Estudio OA -1) [ver Dolor musculoesquelético crónico en adultos ].
Además, a continuación se presenta un resumen de los siguientes ensayos que no demostraron eficacia: Estudio FM-3 (un ensayo de 16 semanas en pacientes adultos con fibromialgia), Estudio CLBP-2 (un ensayo de 13 semanas en pacientes adultos con CLBP) y Estudio OA-2 (un ensayo de 13 semanas en pacientes adultos con dolor crónico debido a la OA).
Trastorno depresivo mayor en adultos
La eficacia de CYMBALTA como tratamiento para MDD en adultos se estableció en 4 ensayos aleatorizados, doble ciego, controlados con placebo, de dosis fija en pacientes adultos ambulatorios (18 a 83 años) que cumplieron con los criterios DSM-IV para MDD:
- En los estudios MDD-1 y MDD-2, los pacientes fueron aleatorizados para recibir 60 mg de CYMBALTA una vez al día (N=123 y N=128, respectivamente) o placebo (N=122 y N=139, respectivamente) durante 9 semanas.
- En el estudio MDD-3, los pacientes fueron aleatorizados para recibir 20 o 40 mg de CYMBALTA dos veces al día (N=86 y N=91, respectivamente) o placebo (N=89) durante 8 semanas.
- En el estudio MDD-4, los pacientes fueron aleatorizados para recibir 40 o 60 mg de CYMBALTA dos veces al día (N=95 y N=93, respectivamente) o placebo (N=93) durante 8 semanas.
En los cuatro ensayos, CYMBALTA 40 mg demostró superioridad sobre el placebo según lo medido por la mejora en la puntuación total de la escala de calificación de depresión de Hamilton (HAMD-17) de 17 ítems (ver ). No hay evidencia de que dosis superiores a 60 mg/día confieran beneficios adicionales.
En todos estos ensayos clínicos, los análisis de la relación entre el resultado del tratamiento y la edad, el sexo y la raza no sugirieron ninguna respuesta diferencial sobre la base de estas características de los pacientes.
Estudio MDD-1 CYMBALTA (60 mg/día)b Placebo 21,5 (4,10) 21,1 (3,71) -10,9 (0,70) -6,1 (0,69) -4,9 (-6,8, -2,9) --
En el estudio MDD-5, 533 pacientes adultos que cumplían con los criterios DSM-IV para MDD recibieron CYMBALTA 60 mg una vez al día durante una fase inicial de tratamiento abierto de 12 semanas. Doscientos setenta y ocho pacientes que respondieron al tratamiento abierto [definido como el cumplimiento de los siguientes criterios en las semanas 10 y 12: una puntuación total de HAMD-17 ≤9, impresiones clínicas globales de gravedad (CGI-S) ≤2, y no que cumplían los criterios del DSM-IV para MDD] fueron asignados al azar a la continuación de CYMBALTA a la misma dosis (N=136) o al placebo (N=142) durante 6 meses.
En el estudio MDD-5, los pacientes tratados con CYMBALTA experimentaron un tiempo estadísticamente significativo más prolongado hasta la recaída de la depresión que los pacientes tratados con placebo (ver Figura 1 ). La recaída se definió como un aumento en la puntuación CGI-S de ≥2 puntos en comparación con la obtenida en la semana 12, así como el cumplimiento de los criterios del DSM-IV para MDD en 2 visitas consecutivas con al menos 2 semanas de diferencia, donde la semana 2 el criterio temporal tuvo que ser satisfecho sólo en la segunda visita.
Figura 1: Proporción acumuladaa de pacientes adultos con recaída de MDD (estudio MDD-5)
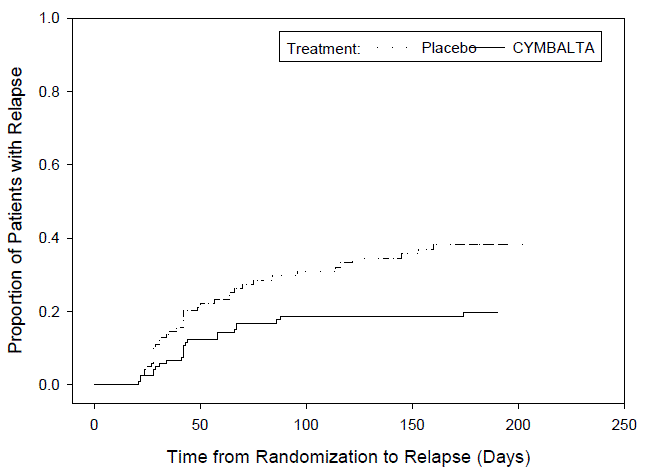
Trastorno de ansiedad generalizada
Ensayos GAD en adultos (incluidos pacientes geriátricos)
La eficacia de CYMBALTA 20 mg en el tratamiento del trastorno de ansiedad generalizada (TAG) se estableció en 1 ensayo aleatorizado, doble ciego, controlado con placebo, de dosis fija y 2 ensayos aleatorizados, doble ciego, controlados con placebo, de dosis flexible en pacientes adultos ambulatorios. entre 18 y 83 años de edad que cumplan con los criterios del DSM-IV para GAD (Estudios GAD-1, GAD-2 y GAD-3, respectivamente).
En los estudios GAD-1 y GAD-2, la dosis inicial fue de 60 mg una vez al día (se permitió una reducción de la dosis a 30 mg una vez al día por razones de tolerabilidad; la dosis podría aumentarse a 60 mg una vez al día). El quince por ciento de los pacientes fueron titulados a la baja. El estudio GAD-3 tenía una dosis inicial de 30 mg una vez al día durante 1 semana antes de aumentarla a 60 mg una vez al día.
Los estudios GAD-2 y GAD-3 incluyeron la titulación de la dosis con dosis de CYMBALTA que oscilaron entre 60 mg una vez al día y 120 mg una vez al día (N=168 y N=162) en comparación con el placebo (N=159 y N=161) durante un periodo de 10 años. período de tratamiento de la semana. La dosis media para los que completaron el tratamiento al final de estos ensayos fue de 104,8 mg/día. El estudio GAD-1 evaluó dosis de 60 mg de CYMBALTA de 60 mg una vez al día (N=168) y 120 mg una vez al día (N=170) en comparación con el placebo (N=175) durante un período de tratamiento de 9 semanas. Si bien se demostró que una dosis de 120 mg/día es efectiva, no hay evidencia de que dosis superiores a 60 mg/día proporcionen un beneficio adicional.
En los 3 ensayos, CYMBALTA demostró superioridad sobre el placebo según lo medido por una mayor mejora en la puntuación total de la escala de ansiedad de Hamilton (HAM-A) (ver ) y por la puntuación de deterioro funcional global de la escala de discapacidad de Sheehan (SDS). El SDS es una medida compuesta de la medida en que los síntomas emocionales interrumpen el funcionamiento del paciente en 3 dominios de la vida: trabajo/escuela, vida social/actividades de ocio y vida familiar/responsabilidades del hogar.
En el estudio GAD-4, 887 pacientes que cumplieron con los criterios DSM-IV-TR para GAD recibieron CYMBALTA de 60 mg a 120 mg una vez al día durante una fase inicial de tratamiento abierto de 26 semanas. Cuatrocientos veintinueve pacientes que respondieron al tratamiento abierto [definido como el cumplimiento de los siguientes criterios en las semanas 24 y 26: una disminución de la puntuación total inicial de HAM-A en al menos un 50 % hasta una puntuación no superior a 11, y una puntuación de 1 o 2 en las impresiones clínicas globales de mejora (CGI-Improvement)] se asignaron al azar a la continuación de CYMBALTA 30 mg a la misma dosis (N=216) o al placebo (N=213) y se observaron las recaídas. De los pacientes aleatorizados, el 73 % había tenido un estado de respuesta durante al menos 10 semanas. La recaída se definió como un aumento en la puntuación CGI-Severity de al menos 2 puntos hasta una puntuación ≥4 y un diagnóstico MINI (Mini-International Neuropsychiatric Interview) de TAG (excluyendo la duración), o interrupción debido a la falta de eficacia. Los pacientes que tomaron CYMBALTA experimentaron un tiempo estadísticamente significativo más largo hasta la recaída del TAG que los pacientes que tomaron placebo (ver Figura 2 ).
Los análisis de subgrupos no indicaron que hubiera diferencias en los resultados del tratamiento en función de la edad o el sexo.
Ensayo GAD en pacientes geriátricos
La eficacia de CYMBALTA en el tratamiento de pacientes ≥65 años de edad con TAG se estableció en un ensayo de 10 semanas de dosis flexible, aleatorizado, doble ciego, controlado con placebo en adultos ≥65 años de edad que cumplían con los criterios del DSM-IV para GAD (Estudio GAD-5). En el estudio GAD-5, la dosis inicial fue de 30 mg una vez al día durante 2 semanas antes de que se permitieran aumentos adicionales de la dosis en incrementos de 30 mg en las semanas de tratamiento 2, 4 y 7 hasta 120 mg una vez al día según el juicio del investigador sobre la respuesta clínica y tolerabilidad La dosis media para los pacientes que completaron la fase de tratamiento agudo de 10 semanas fue de 51 mg. Los pacientes tratados con CYMBALTA (N=151) demostraron una mejoría significativamente mayor en comparación con el placebo (N=140) en el cambio medio desde el inicio hasta el punto final, medido por la puntuación total de HAM-A (ver ).
Ensayo GAD en pacientes pediátricos de 7 a 17 años
La eficacia de CYMBALTA en el tratamiento de pacientes pediátricos de 7 a 17 años de edad con TAG se estableció en 1 ensayo aleatorizado, doble ciego, controlado con placebo de dosis flexible en pacientes pediátricos ambulatorios con TAG (según los criterios del DSM-IV) (Estudio GAD-6).
En el Estudio GAD-6, la dosis inicial fue de 30 mg una vez al día durante 2 semanas. Se permitieron aumentos de dosis adicionales en incrementos de 30 mg hasta 120 mg una vez al día según el juicio del investigador sobre la respuesta clínica y la tolerabilidad. La dosis media para los pacientes que completaron la fase de tratamiento de 10 semanas fue de 57,6 mg/día. En este estudio, CYMBALTA (N=135) demostró superioridad sobre el placebo (N=137) desde el inicio hasta el final, según lo medido por una mayor mejora en la escala de calificación de ansiedad pediátrica (PARS) para la puntuación de gravedad del TAG (ver ).
Figura 2: Proporción acumuladaa de pacientes adultos con recaída de GAD (estudio GAD-4)
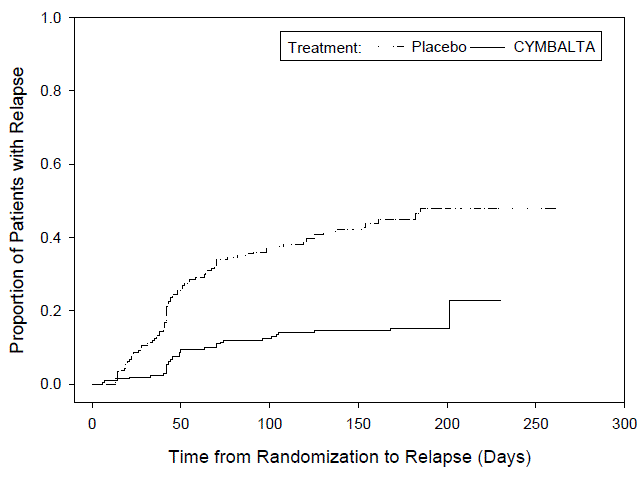
Dolor neuropático periférico diabético en adultos
La eficacia de CYMBALTA 30 mg para el tratamiento del dolor neuropático asociado con la neuropatía periférica diabética en adultos se estableció en 2 ensayos aleatorizados, de 12 semanas, doble ciego, controlados con placebo, de dosis fija en pacientes adultos con dolor neuropático periférico diabético (DPNP ) durante al menos 6 meses (Estudio DPNP-1 y Estudio DPNP-2). Estos ensayos incluyeron un total de 791 pacientes, de los cuales 592 (75 %) completaron los ensayos. Los pacientes inscritos tenían diabetes mellitus tipo I o II con un diagnóstico de polineuropatía sensoriomotora simétrica distal dolorosa durante al menos 6 meses. Los pacientes tenían una puntuación inicial de dolor de ≥4 en una escala de 11 puntos que iba de 0 (sin dolor) a 10 (el peor dolor posible). A los pacientes se les permitió hasta 4 gramos de acetaminofén por día según fuera necesario para el dolor, además de CYMBALTA. Los pacientes registraron su dolor diariamente en un diario.
Ambos ensayos compararon CYMBALTA 60 mg una vez al día o 60 mg dos veces al día con placebo. El estudio DPNP-1 también comparó CYMBALTA 20 mg con placebo. Un total de 457 pacientes (342 CYMBALTA, 115 placebo) se inscribieron en el Estudio DPNP-1 y un total de 334 pacientes (226 CYMBALTA, 108 placebo) se inscribieron en el Estudio DPNP-2.
El tratamiento con CYMBALTA 60 mg una o dos veces al día mejoró significativamente desde el punto de vista estadístico las puntuaciones medias de dolor desde el inicio y aumentó la proporción de pacientes con al menos una reducción del 50 % en las puntuaciones de dolor desde el inicio. Para varios grados de mejoría en el dolor desde el inicio hasta el final del estudio, las Figuras 3 y 4 muestran la fracción de pacientes que lograron ese grado de mejoría en los Estudios DPNP-1 y DPNP-2, respectivamente. Las cifras son acumulativas, por lo que los pacientes cuyo cambio desde el inicio es, por ejemplo, del 50 %, también se incluyen en todos los niveles de mejora por debajo del 50 %. A los pacientes que no completaron el ensayo se les asignó una mejora del 0 %. Algunos pacientes experimentaron una disminución del dolor desde la semana 1, que persistió durante todo el ensayo.
Figura 3: Porcentaje de pacientes adultos del DPNP que lograron varios niveles de alivio del dolor medidos por la intensidad del dolor promedio de 24 horas (estudio DPNP-1)
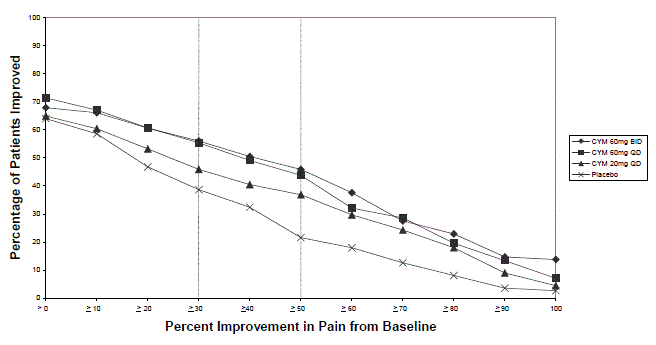
Figura 4: Porcentaje de pacientes adultos de DPNP que lograron varios niveles de alivio del dolor medidos por la gravedad promedio del dolor de 24 horas (estudio DPNP-2)
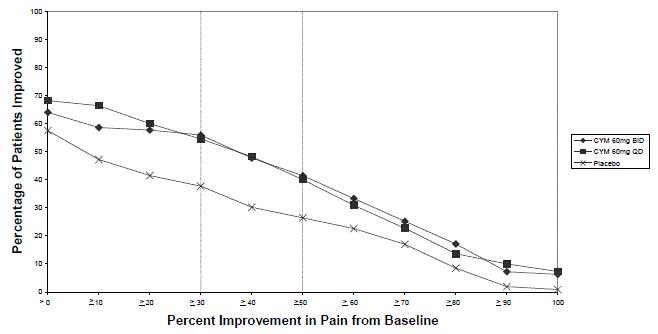
fibromialgia
Ensayos en adultos en fibromialgia
La eficacia de CYMBALTA para el tratamiento de la fibromialgia en adultos se estableció en dos ensayos aleatorizados, doble ciego, controlados con placebo, de dosis fija en pacientes adultos que cumplían con los criterios del American College of Rheumatology para la fibromialgia (antecedentes de dolor generalizado durante 3 meses). , y dolor presente en 11 o más de los 18 sitios de puntos sensibles específicos). El estudio FM-1 tuvo una duración de tres meses y solo inscribió a pacientes mujeres. El estudio FM-2 tuvo una duración de seis meses e inscribió a pacientes masculinos y femeninos. Aproximadamente el 25% de los participantes tenían un diagnóstico comórbido de TDM. Los estudios FM1 y FM-2 incluyeron un total de 874 pacientes, de los cuales 541 (62 %) completaron los ensayos. Un total de 354 pacientes (234 CYMBALTA 40 mg, 120 placebo) se inscribieron en el Estudio FM-1 y un total de 520 pacientes (376 CYMBALTA, 144 placebo) se inscribieron en el Estudio FM-2 (5 % hombres, 95 % mujeres). Los pacientes tenían una puntuación inicial de dolor de 6,5 en una escala de 11 puntos que iba de 0 (sin dolor) a 10 (peor dolor posible).
Los estudios FM-1 y FM-2 compararon CYMBALTA 60 mg una vez al día o 120 mg al día (administrados en dosis divididas en el Estudio FM-1 y como dosis única diaria en el Estudio FM-2) con placebo. El estudio FM-2 comparó además CYMBALTA 20 mg con un placebo durante los primeros tres meses de un ensayo de seis meses.
El tratamiento con CYMBALTA 60 mg o 120 mg diarios mejoró significativamente desde el punto de vista estadístico las puntuaciones medias de dolor desde el inicio y aumentó la proporción de pacientes con al menos una reducción del 50 % en la puntuación de dolor desde el inicio. Se observó reducción del dolor en pacientes con y sin TDM comórbido. Sin embargo, el grado de reducción del dolor puede ser mayor en pacientes con TDM comórbido. Para varios grados de mejoría en el dolor desde el inicio hasta el final del estudio, las Figuras 5 y 6 muestran la fracción de pacientes que lograron ese grado de mejoría en los Estudios FM-1 y FM-2, respectivamente. Las cifras son acumulativas, por lo que los pacientes cuyo cambio desde el inicio es, por ejemplo, del 50 %, también se incluyen en todos los niveles de mejora por debajo del 50 %. A los pacientes que no completaron el ensayo se les asignó una mejora del 0 %. Algunos pacientes experimentaron una disminución del dolor desde la semana 1, que persistió durante todo el ensayo. También se demostró una mejoría en las medidas de función (Fibromyalgia Impact Questionnaires) y la impresión global de cambio del paciente (PGI). Ninguno de los ensayos demostró un beneficio de 120 mg en comparación con 60 mg, y una dosis más alta se asoció con más reacciones adversas e interrupciones prematuras del tratamiento.
Figura 5: Porcentaje de pacientes adultos con fibromialgia que lograron varios niveles de alivio del dolor al final del estudio medido por la intensidad del dolor promedio de 24 horas (Estudio FM-1)
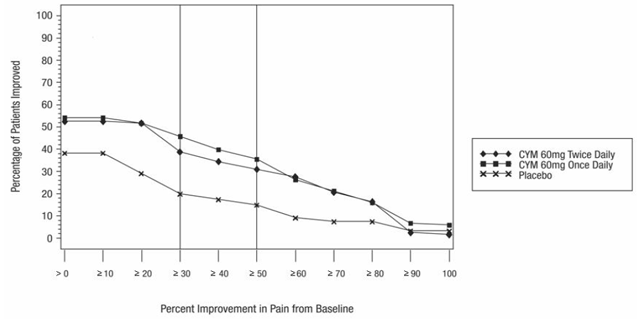
Figura 6: Porcentaje de pacientes adultos con fibromialgia que lograron varios niveles de alivio del dolor al final del estudio medido por la intensidad del dolor promedio de 24 horas (Estudio FM-2)
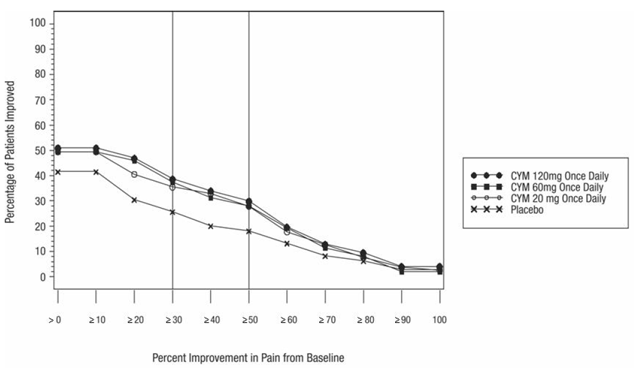
Además, el beneficio de la titulación ascendente en los que no respondieron a CYMBALTA a 60 mg/día se evaluó en un ensayo separado (Estudio FM-3). Los pacientes adultos fueron tratados inicialmente con CYMBALTA 60 mg una vez al día durante ocho semanas de forma abierta. Posteriormente, los que completaron esta fase fueron aleatorizados para recibir un tratamiento doble ciego con CYMBALTA a 60 mg una vez al día o 120 mg una vez al día. Los respondedores se definieron como pacientes que tenían al menos una reducción del 30 % en la puntuación del dolor desde el inicio al final del tratamiento de 8 semanas. Los pacientes que no respondieron a las 8 semanas no tenían más probabilidades de cumplir con los criterios de respuesta al final de las 60 semanas de tratamiento si se titulaba a ciegas a CYMBALTA 120 mg en comparación con aquellos que continuaron a ciegas con CYMBALTA 60 mg.
Ensayo pediátrico en fibromialgia
CYMBALTA se estudió en 184 pacientes pediátricos de 13 a 17 años con síndrome de fibromialgia juvenil en un ensayo controlado con placebo de 13 semanas (Estudio FM-4). En el estudio FM-4, 149 (81 %) pacientes completaron el ensayo. CYMBALTA (N=91) se inició con una dosis de 30 mg una vez al día durante una semana y se ajustó a 60 mg una vez al día durante 12 semanas, según la tolerancia. La dosis media para los pacientes que completaron la fase de tratamiento de 12 semanas fue de 49 mg/día. CYMBALTA mostró una mejoría sobre el placebo en el criterio principal de valoración [cambio desde el inicio hasta el final del tratamiento en el Inventario Breve del Dolor (BPI) - Forma Corta Modificada: Calificación promedio de la gravedad del dolor de 24 horas de la versión para adolescentes] con un valor p de 0.052 de el análisis primario preespecificado y los valores de p que oscilan entre 0,011 y 0,020 de los análisis de sensibilidad que asignaron valores iniciales a las evaluaciones faltantes de algunos pacientes que no completaron el ensayo por diversas razones. Los pacientes tenían un BPI basal de 5,7. Para varios grados de mejoría en el dolor desde el inicio hasta el final del estudio, la Figura 7 muestra la fracción de pacientes que lograron ese grado de mejoría en el Estudio FM-4.
Figura 7: Porcentaje de pacientes pediátricos de 13 a 17 años con síndrome de fibromialgia juvenil que lograron varios niveles de alivio del dolor en la semana 12 (estudio FM-4)a
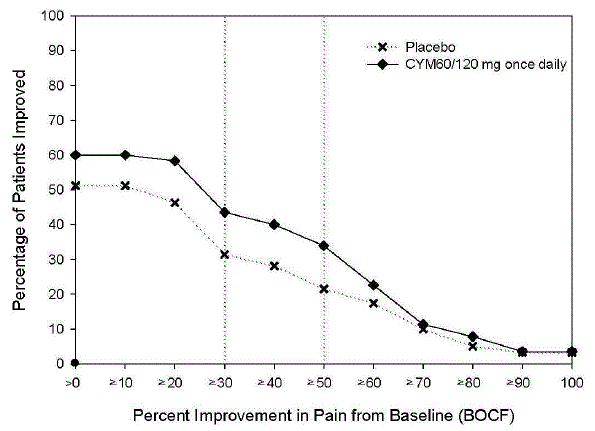
Dolor musculoesquelético crónico en adultos
CYMBALTA está indicado para el tratamiento del dolor musculoesquelético crónico en adultos. Esto se ha establecido en ensayos en pacientes adultos con dolor lumbar crónico y dolor crónico debido a la osteoartritis.
Ensayos en dolor lumbar crónico en adultos
La eficacia de CYMBALTA 60 mg en el dolor lumbar crónico (CLBP) en adultos se evaluó en dos ensayos clínicos aleatorizados, doble ciego, controlados con placebo de 13 semanas de duración (Estudios CLBP-1 y CLBP-2), y uno de 12 -semanas de duración (CLBP-3). Los estudios CLBP-1 y CLBP-3 demostraron la eficacia de CYMBALTA en el tratamiento de CLBP. Los pacientes en todos los ensayos no tenían signos de radiculopatía o estenosis espinal.
Estudio CLBP-1
Se inscribieron 236 pacientes adultos (N=115 con CYMBALTA 40 mg, N=121 con placebo) y 182 (77 %) completaron la fase de tratamiento de 13 semanas. Después de 7 semanas de tratamiento, los pacientes tratados con CYMBALTA con una reducción de menos del 30 % en el dolor diario promedio y que podían tolerar 60 mg una vez al día aumentaron su dosis de CYMBALTA, de manera doble ciego, a 120 mg una vez al día para el resto del juicio. Los pacientes tenían una calificación de dolor inicial promedio de 6 en una escala de calificación numérica que va desde 0 (sin dolor) a 10 (el peor dolor posible). Después de 13 semanas de tratamiento, los pacientes que tomaron CYMBALTA 60-120 mg al día tuvieron una reducción del dolor significativamente mayor en comparación con los pacientes que tomaron placebo. La aleatorización se estratificó según el estado de uso inicial de los AINE de los pacientes. Los análisis de subgrupos no indicaron que hubiera diferencias en los resultados del tratamiento en función del uso de AINE.
Estudio CLBP-2
Cuatrocientos cuatro pacientes fueron aleatorizados para recibir dosis fijas de CYMBALTA 60 mg al día o un placebo equivalente (N=59 con CYMBALTA 20 mg, N=116 con CYMBALTA 60 mg, N=112 con CYMBALTA 120 mg, N=117 con placebo) y 267 (66%) completaron todo el ensayo de 13 semanas. Después de 13 semanas de tratamiento, ninguna de las tres dosis de CYMBALTA de 30 mg mostró una diferencia estadísticamente significativa en la reducción del dolor en comparación con el placebo.
Estudio CLBP-3
Cuatrocientos un pacientes fueron aleatorizados para recibir dosis fijas de CYMBALTA 60 mg al día o placebo (N=198 con CYMBALTA 20 mg, N=203 con placebo), y 303 (76 %) completaron el ensayo. Los pacientes tenían una calificación de dolor inicial promedio de 6 en una escala de calificación numérica que va desde 0 (sin dolor) a 10 (el peor dolor posible). Después de 12 semanas de tratamiento, los pacientes que tomaron CYMBALTA 60 mg al día tuvieron una reducción del dolor significativamente mayor en comparación con los pacientes que tomaron placebo.
Para varios grados de mejoría en el dolor desde el inicio hasta el final del estudio, las Figuras 8 y 9 muestran la fracción de pacientes en los Estudios CLBP-1 y CLBP-3 que lograron ese grado de mejoría, respectivamente. Las cifras son acumulativas, por lo que los pacientes cuyo cambio desde el inicio es, por ejemplo, del 50 %, también se incluyen en todos los niveles de mejora por debajo del 50 %. A los pacientes que no completaron el ensayo se les asignó el valor de 0% de mejoría.
Figura 8: Porcentaje de pacientes adultos con CLBP que lograron varios niveles de alivio del dolor medidos por la intensidad del dolor promedio de 24 horas (estudio CLBP-1)
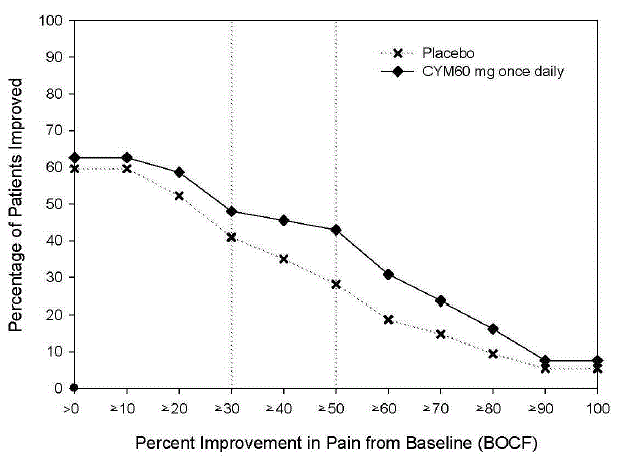
Figura 9: Porcentaje de pacientes adultos con CLBP que lograron varios niveles de alivio del dolor medidos por la intensidad del dolor promedio de 24 horas (estudio CLBP-3)
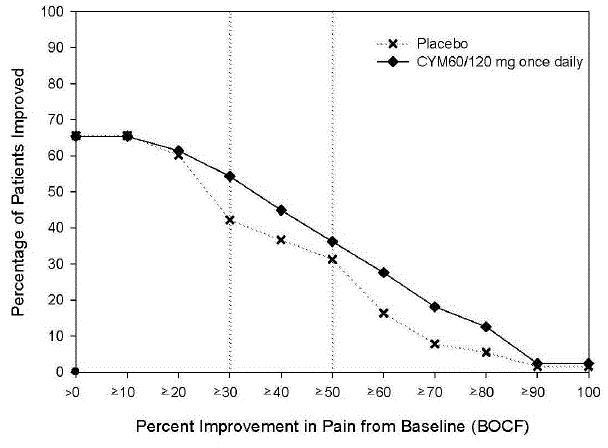
Ensayos en dolor crónico por artrosis en adultos
La eficacia de CYMBALTA en el dolor crónico debido a la osteoartritis (OA) en adultos se evaluó en 2 ensayos clínicos aleatorizados, doble ciego, controlados con placebo de 13 semanas de duración (Estudio OA-1 y Estudio OA-2). Todos los pacientes en ambos ensayos cumplieron con los criterios clínicos y radiográficos del ACR para la clasificación de OA idiopática de rodilla. La aleatorización se estratificó según el estado inicial de uso de AINE de los pacientes.
Los pacientes asignados a CYMBALTA comenzaron el tratamiento en ambos ensayos con una dosis de 30 mg una vez al día durante una semana. Después de la primera semana, la dosis de CYMBALTA se aumentó a 60 mg una vez al día. Después de 7 semanas de tratamiento con CYMBALTA 60 mg una vez al día, en los pacientes del Estudio OA-1 con una respuesta subóptima al tratamiento (
Estudio OA-1
Se inscribieron 256 pacientes (N=128 con CYMBALTA 30 mg, N=128 con placebo) y 204 (80 %) completaron el ensayo. Los pacientes tenían una calificación de dolor inicial promedio de 6 en una escala de calificación numérica que va desde 0 (sin dolor) a 10 (el peor dolor posible). Después de 13 semanas de tratamiento, los pacientes que tomaron CYMBALTA 20 mg tuvieron una reducción del dolor significativamente mayor que los pacientes que tomaron placebo. Los análisis de subgrupos no indicaron que hubiera diferencias en los resultados del tratamiento en función del uso de AINE.
Estudio OA-2
Se inscribieron 231 pacientes (N=111 con CYMBALTA 30 mg, N=120 con placebo) y 173 (75 %) completaron el ensayo. Los pacientes tenían un dolor inicial medio de 6 en una escala de calificación numérica que iba de 0 (sin dolor) a 10 (el peor dolor posible). Después de 13 semanas de tratamiento, los pacientes que tomaron CYMBALTA 20 mg no mostraron una reducción del dolor significativamente mayor que los pacientes que tomaron placebo.
En el Estudio OA-1, para varios grados de mejoría en el dolor desde el inicio hasta el final del estudio, la Figura 10 muestra la fracción de pacientes que lograron ese grado de mejoría. La cifra es acumulativa, por lo que los pacientes cuyo cambio desde el inicio es, por ejemplo, del 50 %, también se incluyen en todos los niveles de mejora por debajo del 50 %. A los pacientes que no completaron el ensayo se les asignó el valor de 0% de mejoría.
Figura 10: Porcentaje de pacientes adultos con OA que lograron varios niveles de alivio del dolor medidos por la gravedad del dolor promedio de 24 horas (estudio OA-1)
INFORMACIÓN DEL PACIENTE
Cymbalta® [sim-BALL-tah] (cápsulas de liberación retardada de duloxetina)
Lea esta Guía del medicamento antes de comenzar a tomar Cymbalta® y cada vez que renueve su receta. Es posible que haya nueva información. Esta información no reemplaza la conversación con su proveedor de atención médica sobre su condición médica o tratamiento.
Hable con su proveedor de atención médica sobre:
- todos los riesgos y beneficios del tratamiento con medicamentos antidepresivos
- todas las opciones de tratamiento para la depresión u otra enfermedad mental grave
¿Cuál es la información más importante que debo saber sobre los medicamentos antidepresivos, la depresión, otras enfermedades mentales graves y los pensamientos o acciones suicidas?
- Preste mucha atención a cualquier cambio en el estado de ánimo, el comportamiento, las acciones, los pensamientos o los sentimientos, especialmente los cambios repentinos. Esto es muy importante cuando se inicia un medicamento antidepresivo o cuando se cambia la dosis.
- Llame a su proveedor de atención médica de inmediato para informar cambios nuevos o repentinos en el estado de ánimo, el comportamiento, los pensamientos o los sentimientos.
- Mantenga todas las visitas de seguimiento con su proveedor de atención médica según lo programado. Llame a su proveedor de atención médica entre visitas según sea necesario, especialmente si le preocupan los síntomas.
Llame a su proveedor de atención médica de inmediato si tiene alguno de los siguientes síntomas o sentimientos, especialmente si son nuevos, empeoran o le preocupan. En caso de emergencia, llame al 911.
- intentos de suicidio
- actuando sobre impulsos peligrosos
- Actuar agresivo, estar enojado o violento.
- pensamientos sobre el suicidio o la muerte
- depresión nueva o peor
- ansiedad nueva o peor
- ataques de pánico
- sentirse muy agitado o inquieto
- irritabilidad nueva o peor
- problemas para dormir
- un aumento extremo en la actividad o hablar (manía)
- otros cambios inusuales en el comportamiento o el estado de ánimo
¿Qué más necesito saber sobre los medicamentos antidepresivos?
- Nunca deje de tomar un medicamento antidepresivo sin hablar primero con un proveedor de atención médica. Detener un medicamento antidepresivo repentinamente puede causar otros síntomas.
- Los antidepresivos son medicamentos que se usan para tratar la depresión y otras enfermedades. Es importante discutir todos los riesgos de tratar la depresión y también los riesgos de no tratarla. Los pacientes deben discutir todas las opciones de tratamiento con su proveedor de atención médica, no solo el uso de antidepresivos.
- Las medicinas antidepresivas tienen otros efectos secundarios. Hable con su proveedor de atención médica sobre los efectos secundarios del medicamento recetado para usted o su familiar.
- Los medicamentos antidepresivos pueden interactuar con otros medicamentos. Conozca todos los medicamentos que toma usted o su familiar. Mantenga una lista de todos los medicamentos para mostrársela a su proveedor de atención médica. No empiece a tomar nuevos medicamentos sin antes consultar con su proveedor de atención médica.
¿Qué es Cymbalta 60 mg?
Cymbalta es un medicamento recetado que se usa para tratar cierto tipo de depresión llamado trastorno depresivo mayor (MDD, por sus siglas en inglés). Cymbalta 20 mg pertenece a una clase de medicamentos conocidos como IRSN (inhibidores de la recaptación de orserotonina-norepinefrina).
Cymbalta 60 mg también se usa para tratar o controlar:
- Trastorno de ansiedad generalizada (TAG)
- Dolor neuropático periférico diabético (DPNP)
- Fibromialgia (FM)
- Dolor musculoesquelético crónico
¿Quién no debe tomar Cymbalta?
No tome Cymbalta 20 mg si usted:
- tomar un inhibidor de la monoaminooxidasa (IMAO). Pregúntele a su proveedor de atención médica oa su farmacéutico si no está seguro si está tomando un IMAO, incluido el antibiótico linezolid o el azul de metileno intravenoso.
- No tome un IMAO dentro de los 5 días posteriores a la suspensión de Cymbalta a menos que su proveedor de atención médica se lo indique.
- No comience Cymbalta si dejó de tomar un IMAO en los últimos 14 días, a menos que su proveedor de atención médica se lo indique.
Las personas que toman Cymbalta 60 mg casi al mismo tiempo que un IMAO pueden tener un problema grave llamado Síndrome serotoninérgico (consulte "¿Cuáles son los posibles efectos secundarios de Cymbalta 60 mg?").
¿Qué debo decirle a mi proveedor de atención médica antes de tomar Cymbalta?
Antes de comenzar con Cymbalta, informe a su proveedor de atención médica si usted:
- tiene problemas cardíacos o presión arterial alta
- tiene diabetes (el tratamiento con Cymbalta 40 mg hace que a algunas personas con diabetes les resulte más difícil controlar el azúcar en la sangre)
- tiene problemas hepáticos
- tiene problemas renales
- tener glaucoma
- tiene o ha tenido ataques o convulsiones
- tiene trastorno bipolar o manía
- tiene niveles bajos de sodio en la sangre
- han retrasado el vaciado del estómago
- tiene o ha tenido problemas de sangrado
- está embarazada o planea quedar embarazada. Cymbalta puede dañar a su bebé por nacer. Hable con su proveedor de atención médica sobre el riesgo para su bebé por nacer si toma Cymbalta durante el embarazo.
- Informe a su proveedor de atención médica de inmediato si queda embarazada o cree que está embarazada durante el tratamiento con Cymbalta.
- Si queda embarazada mientras toma Cymbalta 30 mg, hable con su proveedor de atención médica sobre cómo registrarse en el Registro de Embarazo de Cymbalta. Puede registrarse llamando al 1-866-8146975 o visitando www.cymbalta 40mgpregnancyregistry.com. El propósito de este registro es monitorear los resultados del embarazo en mujeres que han sido tratadas con Cymbalta en cualquier momento durante el embarazo.
- están amamantando o planean amamantar. Cymbalta pasa a la leche materna y puede dañar a su bebé. Hable con su proveedor de atención médica sobre la mejor manera de alimentar a su bebé mientras toma Cymbalta.
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos a base de hierbas. Cymbalta y algunos medicamentos pueden interactuar entre sí, pueden no funcionar tan bien o pueden causar efectos secundarios graves.
Informe especialmente a su proveedor de atención médica si toma:
- triptanos utilizados para tratar la migraña
- medicamentos utilizados para tratar trastornos del estado de ánimo, de ansiedad, psicóticos o del pensamiento, incluidos tricíclicos, litio, buspirona, ISRS, IRSN o IMAO
- tramadol y fentanilo
- anfetaminas
- cimetidina
- los antibióticos ciprofloxacina, enoxacina
- medicamento para tratar la frecuencia cardíaca irregular (como propafenona, flecainida, quinidina)
- teofilina
- el anticoagulante warfarina (Coumadin, Jantoven)
- medicamento antiinflamatorio no esteroideo (AINE) (como ibuprofeno, naproxeno o aspirina).
- suplementos de venta libre como triptófano o hierba de San Juan
- tioridazina (Mellaril). Mellaril junto con Cymbalta puede causar problemas graves de ritmo cardíaco o muerte súbita.
Pídale a su proveedor de atención médica una lista de estos medicamentos si no está seguro.
No tome Cymbalta con ningún otro medicamento que contenga duloxetina.
¿Cómo debo tomar Cymbalta 60 mg?
- Tome Cymbalta exactamente como se lo indique su proveedor de atención médica. Es posible que su proveedor de atención médica deba cambiar la dosis de Cymbalta de 20 mg hasta que sea la dosis adecuada para usted.
- Trague Cymbalta entero. No mastique ni triture Cymbalta.
- No abra la cápsula ni la espolvoree sobre alimentos ni la mezcle con líquidos. Abrir la cápsula puede afectar el funcionamiento de Cymbalta.
- Cymbalta se puede tomar con o sin alimentos.
- Si olvida una dosis de Cymbalta 30 mg, tome la dosis olvidada tan pronto como lo recuerde. Si es casi la hora de la siguiente dosis, omita la dosis olvidada y tome la siguiente dosis a la hora habitual. No tome dos dosis de Cymbalta 30 mg al mismo tiempo.
- Si toma demasiado Cymbalta, llame a su proveedor de atención médica o centro de control de envenenamiento al 1800-222-1222 de inmediato, o busque tratamiento de emergencia.
- Cuando cambie de otro antidepresivo a Cymbalta, es posible que su proveedor de atención médica desee reducir primero la dosis del antidepresivo inicial para evitar posibles efectos secundarios.
¿Qué debo evitar mientras tomo Cymbalta?
- Cymbalta puede causar somnolencia o puede afectar su capacidad para tomar decisiones, pensar con claridad o reaccionar rápidamente. No debe conducir, operar maquinaria pesada ni realizar otras actividades peligrosas hasta que sepa cómo le afecta Cymbalta.
- El uso concomitante de Cymbalta con una ingesta excesiva de alcohol puede estar asociado con daño hepático grave. Evite el consumo excesivo de alcohol mientras toma Cymbalta.
¿Cuáles son los posibles efectos secundarios de Cymbalta?
Cymbalta 30 mg puede causar efectos secundarios graves, que incluyen: Consulte "¿Cuál es la información más importante que debo saber sobre Cymbalta?"
Los posibles efectos secundarios comunes en personas que toman Cymbalta 20 mg incluyen:
Los síntomas en los hombres pueden incluir:
Los síntomas en las mujeres pueden incluir:
Hable con su proveedor de atención médica si desarrolla algún cambio en su función sexual o si tiene alguna pregunta o inquietud acerca de los problemas sexuales durante el tratamiento con CYMBALTA. Puede haber tratamientos que su proveedor de atención médica pueda sugerir.
- Comezón
- dolor abdominal superior derecho
- orina oscura
- piel u ojos amarillos
- hígado agrandado
- aumento de las enzimas hepáticas
- aumentar su presión arterial.
- disminuir su presión arterial cuando está de pie y causar mareos o desmayos, principalmente cuando comienza Cymbalta por primera vez o cuando aumenta la dosis.
- aumentar el riesgo de caídas, especialmente en ancianos.
- agitación, alucinaciones, coma u otros cambios en el estado mental
- problemas de coordinación o espasmos musculares (reflejos hiperactivos)
- latidos cardíacos acelerados, presión arterial alta o baja
- sudoración o fiebre
- náuseas, vómitos o diarrea
- rigidez muscular
- mareo
- enrojecimiento
- temblor
- convulsiones
- ansiedad
- irritabilidad
- sentirse cansado o tener problemas para dormir
- dolor de cabeza
- transpiración
- mareo
- sensaciones similares a descargas eléctricas
- vómitos o náuseas
- Diarrea
- gran aumento de energía
- problemas severos para dormir
- pensamientos acelerados
- comportamiento temerario
- ideas inusualmente grandiosas
- felicidad excesiva o irritabilidad
- hablando más o más rápido de lo habitual
Solo algunas personas corren el riesgo de tener estos problemas. Es posible que desee someterse a un examen de la vista para ver si está en riesgo y recibir tratamiento preventivo si lo está.
- dolor de ojo
- cambios en la visión
- hinchazón o enrojecimiento en o alrededor del ojo
- dolor de cabeza
- debilidad o sensación de inestabilidad
- confusión, problemas para concentrarse o pensar o problemas de memoria
- disminución del flujo de orina
- incapaz de orinar
- eyaculación retardada o incapacidad para tener una eyaculación
- disminución del deseo sexual
- problemas para conseguir o mantener una erección
- disminución del deseo sexual
- orgasmo retrasado o incapacidad para tener un orgasmo
Los efectos secundarios más comunes de Cymbalta 20 mg incluyen:
- náuseas
- boca seca
- somnolencia
- fatiga
- estreñimiento
- pérdida de apetito
- aumento de la sudoración
- mareo
Los posibles efectos secundarios comunes en niños y adolescentes que toman Cymbalta 20 mg incluyen:
- náuseas
- disminución de peso
- mareo
Los efectos secundarios en adultos también pueden ocurrir en niños y adolescentes que toman Cymbalta. A los niños y adolescentes se les debe controlar la altura y el peso durante el tratamiento.
Informe a su proveedor de atención médica si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Cymbalta. Para obtener más información, consulte a su proveedor de atención médica o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios al 1800-FDA-1088.
¿Cómo debo almacenar Cymbalta 40mg?
Guarde Cymbalta a temperatura ambiente, entre 68 °F y 77 °F (20 °C y 25 °C).
Mantenga Cymbalta y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de Cymbalta.
A veces, los medicamentos se recetan para fines distintos a los enumerados en la Guía del medicamento. No use Cymbalta para una afección para la cual no se lo recetaron. No le dé Cymbalta 20 mg a otras personas, incluso si tienen los mismos síntomas que usted. Puede que les haga daño.
Esta Guía del medicamento resume la información más importante sobre Cymbalta. Si desea obtener más información, hable con su proveedor de atención médica. Puede pedirle a su proveedor de atención médica o farmacéutico información sobre Cymbalta escrita para profesionales de la salud.
Para obtener más información, llame al 1-800-545-5979.
¿Cuáles son los ingredientes de Cymbalta 30 mg?
Principio activo: clorhidrato de duloxetina
Ingredientes inactivos:
FD&C Blue No. 2, gelatina, hipromelosa, succinato de acetato de hidroxipropilmetilcelulosa, laurilsulfato de sodio, sacarosa, esferas de azúcar, talco, dióxido de titanio y citrato de trietilo. Las cápsulas de 20 y 60 mg también contienen óxido de hierro amarillo.
Esta Guía del medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de EE. UU.
