Tofranil 25mg, 50mg, 75mg Imipramine Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Tofranil y cómo se usa?
Tofranil 50 mg es un medicamento recetado que se usa para tratar los síntomas de la depresión. Tofranil 25 mg se puede usar solo o con otros medicamentos.
Tofranil pertenece a una clase de medicamentos llamados antidepresivos, TCA.
No se sabe si Tofranil es seguro y efectivo en niños menores de 6 años.
¿Cuáles son los posibles efectos secundarios de Tofranil 50mg?
Tofranil puede causar efectos secundarios graves, que incluyen:
- cambios de humor o comportamiento,
- ansiedad,
- ataques de pánico,
- problemas para dormir,
- comportamiento impulsivo,
- irritabilidad,
- agitación,
- hostilidad,
- agresión,
- inquietud,
- Hiperactividad (mental o física),
- más depresión,
- pensamientos suicidas,
- visión borrosa,
- visión de túnel,
- dolor o hinchazón de los ojos,
- viendo halos alrededor de las luces,
- aturdimiento,
- dolor de pecho nuevo o que empeora,
- latidos del corazón palpitantes,
- revoloteando en tu pecho,
- entumecimiento o debilidad repentina,
- problemas con la visión, el habla o el equilibrio,
- fiebre,
- dolor de garganta,
- confusión,
- alucinaciones,
- pensamientos o comportamientos inusuales,
- micción dolorosa o difícil,
- convulsiones, y
- coloración amarillenta de la piel o los ojos (ictericia)
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Tofranil incluyen:
- sensación de hormigueo,
- debilidad,
- falta de cordinacion,
- boca seca,
- náuseas,
- vómitos,
- estreñimiento,
- Diarrea,
- cambios de visión,
- zumbando en tus oídos,
- bienestar de los senos (tanto hombres como mujeres),
- disminución del deseo sexual,
- impotencia, y
- dificultad para tener un orgasmo
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Tofranil. Para obtener más información, consulte a su médico o farmacéutico.
Medicamentos suicidas y antidepresivos
Los antidepresivos aumentaron el riesgo de pensamientos y conductas suicidas (tendencia suicida) en comparación con placebo en niños, adolescentes y adultos jóvenes en estudios a corto plazo de trastorno depresivo mayor (TDM) y otros trastornos psiquiátricos. Cualquiera que esté considerando el uso de clorhidrato de imipramina o cualquier otro antidepresivo en un niño, adolescente o adulto joven debe sopesar este riesgo con la necesidad clínica. Los estudios a corto plazo no mostraron un aumento en el riesgo de tendencias suicidas con antidepresivos en comparación con placebo en adultos mayores de 24 años; hubo una reducción del riesgo con los antidepresivos en comparación con el placebo en adultos de 65 años o más. La depresión y ciertos otros trastornos psiquiátricos están asociados con aumentos en el riesgo de suicidio. Los pacientes de todas las edades que comienzan con la terapia antidepresiva deben ser monitoreados apropiadamente y observados de cerca para detectar empeoramiento clínico, tendencias suicidas o cambios inusuales en el comportamiento. Se debe advertir a las familias y cuidadores de la necesidad de una estrecha observación y comunicación con el prescriptor. El clorhidrato de imipramina no está aprobado para su uso en pacientes pediátricos (ver ADVERTENCIAS Empeoramiento Clínico y Riesgo de Suicidio; PRECAUCIONES Información para Pacientes; y PRECAUCIONES , Uso pediátrico).
DESCRIPCIÓN
Tofranil™ se suministra en forma de comprimidos para administración oral.
Tofranil 75 mg, clorhidrato de imipramina USP, el antidepresivo tricíclico original, es miembro del grupo de compuestos de dibenzazepina. Se denomina monoclorhidrato de 5-3-(dimetilamino)propil-10,11-dihidro-5Hdibenz[b,f]-azepina. Su fórmula estructural es:
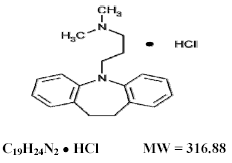
El clorhidrato de imipramina USP es un polvo cristalino de color blanco a blanquecino, inodoro o prácticamente inodoro. Es libremente soluble en agua y en alcohol, soluble en acetona e insoluble en éter y en benceno.
ingredientes inactivos
Fosfato de calcio, compuestos de celulosa, docusato de sodio, óxidos de hierro, estearato de magnesio, polietilenglicol, povidona, glicolato de almidón de sodio, sacarosa, talco y dióxido de titanio.
INDICACIONES
Depresión
Para el alivio de los síntomas de la depresión. Es más probable que se alivie la depresión endógena que otros estados depresivos. Pueden ser necesarias de una a tres semanas de tratamiento antes de que sean evidentes los efectos terapéuticos óptimos.
Enuresis infantil
Puede ser útil como terapia adyuvante temporal para reducir la enuresis en niños de 6 años o más, después de que se hayan excluido las posibles causas orgánicas mediante pruebas apropiadas. En pacientes con síntomas diurnos de polaquiuria y urgencia, el examen debe incluir cistouretrografía miccional y cistoscopia, según sea necesario. La efectividad del tratamiento puede disminuir con la administración continua del fármaco.
DOSIFICACIÓN Y ADMINISTRACIÓN
Depresión
Se recomiendan dosis más bajas para pacientes de edad avanzada y adolescentes. También se recomiendan dosis más bajas para pacientes ambulatorios en comparación con pacientes hospitalizados que estarán bajo estrecha supervisión. La dosis debe iniciarse a un nivel bajo y aumentarse gradualmente, observando cuidadosamente la respuesta clínica y cualquier evidencia de intolerancia. Después de la remisión, es posible que se requiera medicación de mantenimiento durante un período de tiempo más largo, en la dosis más baja que mantenga la remisión.
Dosis habitual para adultos
Pacientes hospitalizados
Inicialmente, 100 mg/día en dosis divididas aumentaron gradualmente a 200 mg/día según se requería. Si no hay respuesta después de dos semanas, aumente a 250 a 300 mg/día.
Pacientes ambulatorios
Inicialmente, 75 mg/día aumentó a 150 mg/día. No se recomiendan dosis superiores a 200 mg/día. Mantenimiento, 50 a 150 mg/día.
Pacientes Adolescentes Y Geriátricos
Inicialmente, 30 a 40 mg/día; generalmente no es necesario exceder los 100 mg/día.
Enuresis infantil
Inicialmente, se debe probar una dosis oral de 25 mg/día en niños mayores de 6 años. La medicación debe administrarse una hora antes de acostarse. Si no se produce una respuesta satisfactoria dentro de una semana, aumente la dosis a 50 mg todas las noches en niños menores de 12 años; los niños mayores de 12 años pueden recibir hasta 75 mg por noche. Una dosis diaria superior a 75 mg no mejora la eficacia y tiende a aumentar los efectos secundarios. La evidencia sugiere que en los que mojan la cama temprano en la noche, el fármaco es más eficaz administrado antes y en cantidades divididas, es decir, 25 mg a media tarde, repetidos a la hora de acostarse. Se debe considerar la posibilidad de instituir un período libre de drogas después de un ensayo terapéutico adecuado con una respuesta favorable. La dosis debe reducirse gradualmente en lugar de suspenderse abruptamente; esto puede reducir la tendencia a la recaída. Los niños que recaen cuando se interrumpe el fármaco no siempre responden a un ciclo de tratamiento posterior.
No se debe exceder una dosis de 2,5 mg/kg/día. Se han informado cambios en el ECG de significado desconocido en pacientes pediátricos con dosis del doble de esta cantidad.
No se ha establecido la seguridad y eficacia de Tofranil como terapia adyuvante temporal para la enuresis nocturna en niños menores de 6 años.
CÓMO SUMINISTRADO
Las tres concentraciones de Tofranil™ (clorhidrato de imipramina USP) están disponibles de la siguiente manera:
– Comprimido recubierto de azúcar, triangular, biconvexo, de color marrón rojizo coral, con la impresión en una cara y “10” en la otra cara en negro.
Botellas de 30 CDN 0406-9920-03 Botellas de 100 CDN 0406-9920-01
– Comprimido recubierto de azúcar, redondo, biconvexo, de color marrón rojizo coral, grabado en negro con “25” en una cara y en la otra cara.
Botellas de 30 CDN 0406-9921-03 Botellas de 100 CDN 0406-9921-01
– Comprimido recubierto de azúcar, redondo, biconvexo, de color marrón rojizo coral, con la impresión en un lado y “50” en el otro lado en negro.
Botellas de 30 CDN 0406-9922-03 Botellas de 100 CDN 0406-9922-01
Almacene a una temperatura de 20° a 25°C (68° a 77°F) [consulte Temperatura ambiente controlada por la USP].
Dispense en un recipiente hermético (USP) con cierre a prueba de niños.
Fabricado por: Patheon Inc. Whitby, Ontario, Canadá, L1N 5Z5. Revisado: abril de 2017
EFECTOS SECUNDARIOS
Nota – Aunque la lista que sigue incluye algunas reacciones adversas que no han sido reportadas con este medicamento específico, las similitudes farmacológicas entre los medicamentos antidepresivos tricíclicos requieren que se considere cada una de las reacciones cuando se administra Tofranil 25 mg.
Cardiovascular: Hipotensión ortostática, hipertensión, taquicardia, palpitaciones, infarto de miocardio, arritmias, bloqueo cardíaco, cambios en el ECG, precipitación de insuficiencia cardíaca congestiva, accidente cerebrovascular.
Psiquiátrico: Estados confusionales (especialmente en ancianos) con alucinaciones, desorientación, delirios; ansiedad, inquietud, agitación; insomnio y pesadillas; hipomanía; exacerbación de la psicosis.
Neurológico: Entumecimiento, hormigueo, parestesias de las extremidades; falta de coordinación, ataxia, temblores; neuropatía periférica; síntomas extrapiramidales; convulsiones, alteraciones en los patrones de EEG; tinnitus.
Anticolinérgico: Sequedad de boca y, en raras ocasiones, adenitis sublingual asociada; visión borrosa, alteraciones de la acomodación, midriasis; estreñimiento, íleo paralítico; retención urinaria, micción retardada, dilatación del tracto urinario.
Alérgico: Erupción cutánea, petequias, urticaria, prurito, fotosensibilización; edema (general o de cara y lengua); fiebre por drogas; sensibilidad cruzada con desipramina.
hematológico: depresión de la médula ósea, incluida la agranulocitosis; eosinofilia; púrpura; trombocitopenia.
Gastrointestinal: Náuseas y vómitos, anorexia, malestar epigástrico, diarrea; gusto peculiar, estomatitis, calambres abdominales, lengua negra.
Endocrino: Ginecomastia en el varón; agrandamiento de los senos y galactorrea en la mujer; aumento o disminución de la libido, impotencia; hinchazón testicular; elevación o depresión de los niveles de azúcar en la sangre; Síndrome de secreción inadecuada de hormona antidiurética (ADH).
Otro: Ictericia (simulando obstructiva); función hepática alterada; ganancia o pérdida de peso; transpiración; enrojecimiento; frecuencia urinaria; somnolencia, mareos, debilidad y fatiga; dolor de cabeza; hinchazón de la parótida; alopecia; propensión a caer.
Síntomas de abstinencia: Aunque no es indicativo de adicción, la interrupción abrupta del tratamiento después de una terapia prolongada puede producir náuseas, dolor de cabeza y malestar general.
Nota – En niños enuréticos tratados con Tofranil 75 mg las reacciones adversas más frecuentes han sido nerviosismo, trastornos del sueño, cansancio y molestias gastrointestinales leves. Estos generalmente desaparecen durante la administración continua del fármaco o cuando se reduce la dosis. Otras reacciones que se han informado incluyen estreñimiento, convulsiones, ansiedad, inestabilidad emocional, síncope y colapso. Se deben considerar todos los efectos adversos informados con el uso en adultos.
INTERACCIONES CON LA DROGAS
Fármacos metabolizados por P450 2D6
La actividad bioquímica del fármaco que metaboliza la isoenzima citocromo P450 2D6 (debrisoquina hidroxilasa) se reduce en un subconjunto de la población caucásica (alrededor del 7% al 10% de los caucásicos son los llamados "metabolizadores lentos"); Aún no se dispone de estimaciones fiables de la prevalencia de la actividad reducida de la isoenzima P450 2D6 entre las poblaciones asiáticas, africanas y otras. Los metabolizadores lentos tienen concentraciones plasmáticas de antidepresivos tricíclicos (TCA) más altas de lo esperado cuando se les administran las dosis habituales. Dependiendo de la fracción de fármaco metabolizado por P450 2D6, el aumento en la concentración plasmática puede ser pequeño o bastante grande (aumento de 8 veces en el AUC plasmático del TCA).
Además, ciertos fármacos inhiben la actividad de esta isoenzima y hacen que los metabolizadores normales parezcan metabolizadores lentos. Un individuo que está estable con una dosis dada de TCA puede volverse tóxico repentinamente cuando se le administra uno de estos fármacos inhibidores como terapia concomitante. Los fármacos que inhiben el citocromo P450 2D6 incluyen algunos que no son metabolizados por la enzima (quinidina, cimetidina) y muchos que son sustratos del P450 2D6 (muchos otros antidepresivos, fenotiazinas y los antiarrítmicos tipo 1C propafenona y flecainida). Si bien todos los inhibidores selectivos de la recaptación de serotonina (ISRS), por ejemplo, fluoxetina, sertralina y paroxetina, inhiben la P450 2D6, pueden variar en el grado de inhibición. La medida en que la interacción ISRS-TCA puede plantear problemas clínicos dependerá del grado de inhibición y la farmacocinética del ISRS involucrado. No obstante, se recomienda precaución en la coadministración de TCA con cualquiera de los ISRS y también en el cambio de una clase a otra. De particular importancia, debe transcurrir suficiente tiempo antes de iniciar el tratamiento con ATC en un paciente al que se le retira la fluoxetina, dada la larga vida media del metabolito original y activo (pueden ser necesarias al menos 5 semanas).
El uso concomitante de antidepresivos tricíclicos con fármacos que pueden inhibir el citocromo P450 2D6 puede requerir dosis más bajas que las prescritas normalmente para el antidepresivo tricíclico o el otro fármaco. Además, cada vez que uno de estos otros medicamentos se retira de la coterapia, puede ser necesario aumentar la dosis de antidepresivos tricíclicos. Es deseable controlar los niveles plasmáticos de TCA cada vez que se coadministre un TCA con otro fármaco conocido por ser un inhibidor de P450 2D6.
La concentración plasmática de imipramina puede aumentar cuando el fármaco se administra junto con inhibidores de las enzimas hepáticas (p. ej., cimetidina, fluoxetina) y disminuir con la administración concomitante con inductores de las enzimas hepáticas (p. ej., barbitúricos, fenitoína), por lo que es necesario ajustar la dosis de imipramina. ser necesario.
En pacientes susceptibles ocasionales o en aquellos que reciben además fármacos anticolinérgicos (incluidos los agentes antiparkinsonianos), los efectos similares a los de la atropina pueden volverse más pronunciados (p. ej., íleo paralítico). Se requiere una estrecha supervisión y un ajuste cuidadoso de la dosis cuando el clorhidrato de imipramina se administra concomitantemente con fármacos anticolinérgicos.
Evite el uso de preparados, como descongestionantes y anestésicos locales, que contengan alguna amina simpaticomimética (p. ej., epinefrina, norepinefrina), ya que se ha informado que los antidepresivos tricíclicos pueden potenciar los efectos de las catecolaminas.
Se debe tener precaución cuando se usa clorhidrato de imipramina con agentes que disminuyen la presión arterial. El clorhidrato de imipramina puede potenciar los efectos de los fármacos depresores del SNC.
Se debe advertir a los pacientes que el clorhidrato de imipramina puede aumentar los efectos depresores del alcohol en el SNC (ver ADVERTENCIAS ).
ADVERTENCIAS
Empeoramiento clínico y riesgo de suicidio
Los pacientes con trastorno depresivo mayor (MDD), tanto adultos como pediátricos, pueden experimentar un empeoramiento de su depresión y/o la aparición de ideación y comportamiento suicida (suicidalidad) o cambios inusuales en el comportamiento, estén o no tomando medicamentos antidepresivos, y esto el riesgo puede persistir hasta que ocurra una remisión significativa. El suicidio es un riesgo conocido de depresión y ciertos otros trastornos psiquiátricos, y estos trastornos en sí mismos son los predictores más fuertes de suicidio. Sin embargo, desde hace mucho tiempo existe la preocupación de que los antidepresivos puedan tener un papel en la inducción del empeoramiento de la depresión y la aparición de tendencias suicidas en ciertos pacientes durante las primeras fases del tratamiento. Los análisis combinados de ensayos controlados con placebo a corto plazo de medicamentos antidepresivos (ISRS y otros) mostraron que estos medicamentos aumentan el riesgo de pensamientos y conductas suicidas (tendencia suicida) en niños, adolescentes y adultos jóvenes (de 18 a 24 años) con depresión mayor. (TDM) y otros trastornos psiquiátricos. Los estudios a corto plazo no mostraron un aumento en el riesgo de tendencias suicidas con antidepresivos en comparación con placebo en adultos mayores de 24 años; hubo una reducción con los antidepresivos en comparación con el placebo en adultos de 65 años o más.
Los análisis agrupados de ensayos controlados con placebo en niños y adolescentes con TDM, trastorno obsesivo compulsivo (TOC) u otros trastornos psiquiátricos incluyeron un total de 24 ensayos a corto plazo de 9 fármacos antidepresivos en más de 4400 pacientes. Los análisis agrupados de ensayos controlados con placebo en adultos con MDD u otros trastornos psiquiátricos incluyeron un total de 295 ensayos a corto plazo (duración media de 2 meses) de 11 fármacos antidepresivos en más de 77 000 pacientes. Hubo una variación considerable en el riesgo de suicidio entre los fármacos, pero una tendencia hacia un aumento en los pacientes más jóvenes para casi todos los fármacos estudiados. Hubo diferencias en el riesgo absoluto de suicidio entre las diferentes indicaciones, con la mayor incidencia en MDD. Sin embargo, las diferencias de riesgo (fármaco frente a placebo) fueron relativamente estables dentro de los estratos de edad y entre las indicaciones. Estas diferencias de riesgo (diferencia fármaco-placebo en el número de casos de tendencias suicidas por cada 1000 pacientes tratados) se proporcionan en la Tabla 1.
No se produjeron suicidios en ninguno de los ensayos pediátricos. Hubo suicidios en los ensayos con adultos, pero el número no fue suficiente para llegar a ninguna conclusión sobre el efecto del fármaco sobre el suicidio.
Se desconoce si el riesgo de suicidio se extiende al uso a largo plazo, es decir, más allá de varios meses. Sin embargo, existe evidencia sustancial de ensayos de mantenimiento controlados con placebo en adultos con depresión de que el uso de antidepresivos puede retrasar la recurrencia de la depresión.
Todos los pacientes que reciben tratamiento con antidepresivos por cualquier indicación deben ser monitoreados adecuadamente y observados de cerca por si empeoran clínicamente, tienen tendencias suicidas y cambios inusuales en el comportamiento, especialmente durante los meses iniciales de un ciclo de terapia con medicamentos, o en momentos de cambios de dosis, ya sea aumentos o disminuye.
Los siguientes síntomas, ansiedad, agitación, ataques de pánico, insomnio, irritabilidad, hostilidad, agresividad, impulsividad, acatisia (inquietud psicomotora), hipomanía y manía, se han informado en pacientes adultos y pediátricos que también reciben tratamiento con antidepresivos para el trastorno depresivo mayor como para otras indicaciones, tanto psiquiátricas como no psiquiátricas. Aunque no se ha establecido un vínculo causal entre la aparición de tales síntomas y el empeoramiento de la depresión y/o la aparición de impulsos suicidas, existe la preocupación de que tales síntomas puedan representar precursores de tendencias suicidas emergentes.
Se debe considerar cambiar el régimen terapéutico, incluida la posibilidad de suspender el medicamento, en pacientes cuya depresión empeora persistentemente, o que están experimentando tendencias suicidas emergentes o síntomas que podrían ser precursores de un empeoramiento de la depresión o tendencias suicidas, especialmente si estos síntomas son severos, abruptos. en el inicio, o no formaban parte de los síntomas de presentación del paciente.
Se debe alertar a las familias y cuidadores de pacientes que reciben tratamiento con antidepresivos por trastorno depresivo mayor u otras indicaciones, tanto psiquiátricas como no psiquiátricas, sobre la necesidad de monitorear a los pacientes para detectar la aparición de agitación, irritabilidad, cambios inusuales en el comportamiento y los demás síntomas descritos anteriormente. , así como el surgimiento de tendencias suicidas, e informar dichos síntomas de inmediato a los proveedores de atención médica. Dicho seguimiento debe incluir la observación diaria por parte de las familias y los cuidadores. Las recetas de clorhidrato de imipramina se deben escribir para la cantidad más pequeña de comprimidos compatible con un buen manejo del paciente, a fin de reducir el riesgo de sobredosis.
Detección de pacientes para el trastorno bipolar
Un episodio depresivo mayor puede ser la presentación inicial del trastorno bipolar. En general, se cree (aunque no se ha establecido en ensayos controlados) que tratar un episodio de este tipo con un antidepresivo solo puede aumentar la probabilidad de precipitación de un episodio mixto/maníaco en pacientes con riesgo de trastorno bipolar. Se desconoce si alguno de los síntomas descritos anteriormente representa tal conversión. Sin embargo, antes de iniciar el tratamiento con un antidepresivo, los pacientes con síntomas depresivos deben someterse a un cribado adecuado para determinar si tienen riesgo de trastorno bipolar; dicha evaluación debe incluir un historial psiquiátrico detallado, incluidos antecedentes familiares de suicidio, trastorno bipolar y depresión. Cabe señalar que el clorhidrato de imipramina no está aprobado para su uso en el tratamiento de la depresión bipolar.
Glaucoma de ángulo cerrado
La dilatación pupilar que se produce después del uso de muchos fármacos antidepresivos, incluido el Tofranil, puede desencadenar un ataque de ángulo cerrado en un paciente con ángulos anatómicamente estrechos que no tienen una iridectomía permeable.
Niños
No se debe superar una dosis de 2,5 mg/kg/día de Tofranil 25 mg en la infancia. Se han informado cambios en el ECG de significado desconocido en pacientes pediátricos con dosis del doble de esta cantidad.
Se debe tener extrema precaución cuando se administra este medicamento a: pacientes con enfermedad cardiovascular debido a la posibilidad de defectos de conducción, arritmias, insuficiencia cardíaca congestiva, infarto de miocardio, accidentes cerebrovasculares y taquicardia. Estos pacientes requieren vigilancia cardíaca en todos los niveles de dosificación del fármaco;
pacientes con antecedentes de retención urinaria o antecedentes de glaucoma de ángulo estrecho debido a las propiedades anticolinérgicas del fármaco; pacientes con hipertiroidismo o con medicamentos para la tiroides debido a la posibilidad de toxicidad cardiovascular;
pacientes con antecedentes de trastorno convulsivo porque se ha demostrado que este medicamento reduce el umbral convulsivo;
pacientes que reciben guanetidina, clonidina o agentes similares, ya que Tofranil puede bloquear los efectos farmacológicos de estos medicamentos;
pacientes que reciben clorhidrato de metilfenidato. Dado que el clorhidrato de metilfenidato puede inhibir el metabolismo de Tofranil 75 mg, puede ser necesario ajustar a la baja la dosis de clorhidrato de imipramina cuando se administre concomitantemente con clorhidrato de metilfenidato.
Tofranil puede potenciar los efectos depresores del alcohol sobre el SNC. Por lo tanto, debe tenerse en cuenta que los peligros inherentes a un intento de suicidio o una sobredosis accidental con la droga pueden aumentar para el paciente que consume cantidades excesivas de alcohol (ver PRECAUCIONES ).
Dado que Tofranil puede afectar las capacidades mentales y/o físicas necesarias para la realización de tareas potencialmente peligrosas, como manejar un automóvil o maquinaria, se debe advertir al paciente en consecuencia.
PRECAUCIONES
General
Se debe realizar un registro de ECG antes del inicio de dosis mayores de lo habitual de Tofranil y posteriormente a intervalos apropiados hasta que se logre el estado de equilibrio. (Los pacientes con cualquier evidencia de enfermedad cardiovascular requieren vigilancia cardíaca en todos los niveles de dosificación del medicamento. Ver ADVERTENCIAS .) Los pacientes de edad avanzada y los pacientes con enfermedades cardíacas o antecedentes de enfermedades cardíacas tienen un riesgo especial de desarrollar anomalías cardíacas asociadas con el uso de Tofranil.
Debe tenerse en cuenta que la posibilidad de suicidio en pacientes gravemente deprimidos es inherente a la enfermedad y puede persistir hasta que se produzca una remisión significativa. Dichos pacientes deben ser cuidadosamente supervisados durante la fase inicial del tratamiento con Tofranil 75 mg y pueden requerir hospitalización. Las recetas deben escribirse por la cantidad más pequeña posible. Pueden ocurrir episodios hipomaníacos o maníacos, particularmente en pacientes con trastornos cíclicos. Tales reacciones pueden requerir la suspensión del fármaco. Si es necesario, Tofranil 75 mg se puede reanudar en dosis más bajas cuando se alivian estos episodios.
La administración de un tranquilizante puede ser útil para controlar tales episodios.
Ocasionalmente se puede observar una activación de la psicosis en pacientes esquizofrénicos y puede requerir una reducción de la dosis y la adición de una fenotiazina.
La administración concomitante de Tofranil 50 mg con terapia de electroshock puede aumentar los riesgos; dicho tratamiento debe limitarse a aquellos pacientes para los que es imprescindible, ya que la experiencia clínica es limitada.
Los pacientes que toman clorhidrato de imipramina deben evitar la exposición excesiva a la luz solar ya que ha habido informes de fotosensibilización.
Tanto la elevación como la disminución de los niveles de azúcar en la sangre se han informado con el uso de clorhidrato de imipramina.
El clorhidrato de imipramina se debe usar con precaución en pacientes con insuficiencia renal o hepática significativa.
A los pacientes que desarrollen fiebre y dolor de garganta durante el tratamiento con clorhidrato de imipramina se les debe realizar un recuento leucocitario y hemograma. El clorhidrato de imipramina debe suspenderse si hay evidencia de depresión patológica de neutrófilos.
Antes de la cirugía electiva, se debe suspender el clorhidrato de imipramina durante el tiempo que lo permita la situación clínica.
Información para pacientes
Los prescriptores u otros profesionales de la salud deben informar a los pacientes, sus familias y sus cuidadores sobre los beneficios y riesgos asociados con el tratamiento con clorhidrato de imipramina y deben asesorarlos sobre su uso apropiado. Un paciente Guía de medicamentos sobre "Medicamentos antidepresivos, depresión y otras enfermedades mentales graves y pensamientos o acciones suicidas" está disponible para el clorhidrato de imipramina. El prescriptor o el profesional de la salud debe instruir a los pacientes, sus familias y sus cuidadores para que lean la Guía del medicamento y debe ayudarlos a comprender su contenido. Los pacientes deben tener la oportunidad de discutir el contenido de la Guía del medicamento y obtener respuestas a cualquier pregunta que puedan tener. El texto completo de la Guía del medicamento se reproduce al final de este documento.
Se debe informar a los pacientes sobre los siguientes problemas y pedirles que alerten a su prescriptor si ocurren mientras toman clorhidrato de imipramina.
Se debe advertir a los pacientes que tomar Tofranil puede causar dilatación pupilar leve, lo que en individuos susceptibles puede conducir a un episodio de glaucoma de ángulo cerrado. El glaucoma preexistente casi siempre es un glaucoma de ángulo abierto porque el glaucoma de ángulo cerrado, cuando se diagnostica, se puede tratar definitivamente con iridectomía. El glaucoma de ángulo abierto no es un factor de riesgo para el glaucoma de ángulo cerrado. Los pacientes pueden desear ser examinados para determinar si son susceptibles al cierre del ángulo y someterse a un procedimiento profiláctico (p. ej., iridectomía), si son susceptibles.
Empeoramiento clínico y riesgo de suicidio
Se debe alentar a los pacientes, sus familias y sus cuidadores a estar alerta ante la aparición de ansiedad, agitación, ataques de pánico, insomnio, irritabilidad, hostilidad, agresividad, impulsividad, acatisia (inquietud psicomotora), hipomanía, manía, otros cambios inusuales en el comportamiento. , empeoramiento de la depresión e ideación suicida, especialmente al principio del tratamiento con antidepresivos y cuando la dosis se ajusta hacia arriba o hacia abajo. Se debe recomendar a las familias y cuidadores de los pacientes que estén atentos a la aparición de dichos síntomas en el día a día, ya que los cambios pueden ser abruptos. Dichos síntomas deben informarse al médico o al profesional de la salud del paciente, especialmente si son graves, de inicio repentino o no formaban parte de los síntomas que presentaba el paciente. Síntomas como estos pueden estar asociados con un mayor riesgo de pensamientos y conductas suicidas e indican la necesidad de un control muy estricto y posiblemente cambios en la medicación.
El embarazo
Los estudios de reproducción animal han arrojado resultados no concluyentes (ver también Farmacología Animal ).
No se han realizado estudios bien controlados con mujeres embarazadas para determinar el efecto de Tofranil en el feto. Sin embargo, ha habido informes clínicos de malformaciones congénitas asociadas con el uso de la droga. Aunque no se pudo establecer una relación causal entre estos efectos y el fármaco, no se puede excluir la posibilidad de riesgo fetal por la ingestión materna de Tofranil. Por lo tanto, Tofranil debe usarse en mujeres que están embarazadas o pueden quedar embarazadas solo si la condición clínica justifica claramente el riesgo potencial para el feto.
Madres lactantes
Los datos limitados sugieren que es probable que Tofranil 75 mg se excrete en la leche materna humana. Como regla general, una mujer que toma un fármaco no debe amamantar, ya que existe la posibilidad de que el fármaco se excrete en la leche materna y sea perjudicial para el niño.
Uso pediátrico
No se ha establecido la seguridad y eficacia en la población pediátrica distinta de los pacientes pediátricos con enuresis nocturna (ver CUADRO DE ADVERTENCIA y ADVERTENCIAS , Empeoramiento clínico y riesgo de suicidio ). Cualquiera que esté considerando el uso de clorhidrato de imipramina en un niño o adolescente debe sopesar los riesgos potenciales con la necesidad clínica.
No se ha establecido la seguridad y eficacia del fármaco como terapia adyuvante temporal para la enuresis nocturna en pacientes pediátricos menores de 6 años.
No se ha establecido la seguridad del fármaco para uso crónico a largo plazo como terapia adyuvante para la enuresis nocturna en pacientes pediátricos de 6 años de edad o mayores; se debe considerar la instauración de un período libre de drogas después de un ensayo terapéutico adecuado con una respuesta favorable.
No se debe exceder una dosis de 2,5 mg/kg/día en la infancia. Se han informado cambios en el ECG de significado desconocido en pacientes pediátricos con dosis del doble de esta cantidad.
Uso geriátrico
En la literatura, había cuatro estudios clínicos de comparación de grupos paralelos, aleatorizados, doble ciego, bien controlados realizados con Tofranil 50 mg en la población de edad avanzada. Hubo un número total de 651 sujetos incluidos en estos estudios. Estos estudios no proporcionaron una comparación con sujetos más jóvenes. No se identificaron experiencias adversas adicionales en los ancianos.
Los estudios clínicos de Tofranil 75 mg en la solicitud original no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes. La experiencia clínica posterior a la comercialización no ha identificado diferencias en las respuestas entre los ancianos y los sujetos más jóvenes. En general, la selección de la dosis para los ancianos debe ser cautelosa, generalmente comenzando en el extremo inferior del rango de dosificación, lo que refleja una mayor frecuencia de disminución de la función hepática, renal o cardíaca, y de enfermedades concomitantes u otra terapia con medicamentos.
(Ver también DOSIFICACIÓN Y ADMINISTRACIÓN , Adolescente y Pacientes geriátricos .)
(Ver también PRECAUCIONES , General. )
SOBREDOSIS
Pueden ocurrir muertes por sobredosis con esta clase de medicamentos. La ingestión de múltiples drogas (incluido el alcohol) es común en la sobredosis deliberada de tricíclicos. Como el manejo es complejo y cambiante, se recomienda que el médico se comunique con un centro de control de intoxicaciones para obtener información actualizada sobre el tratamiento. Los signos y síntomas de toxicidad se desarrollan rápidamente después de una sobredosis de tricíclicos. Por lo tanto, se requiere seguimiento hospitalario lo antes posible.
Se ha informado que los niños son más sensibles que los adultos a una sobredosis aguda de clorhidrato de imipramina. Una sobredosis aguda de cualquier cantidad en bebés o niños pequeños, especialmente, debe considerarse grave y potencialmente mortal.
Manifestaciones
Estos pueden variar en gravedad según factores como la cantidad de fármaco absorbido, la edad del paciente y el intervalo entre la ingestión del fármaco y el inicio del tratamiento. Las manifestaciones críticas de la sobredosis incluyen arritmias cardíacas, hipotensión grave, convulsiones y depresión del SNC, incluido el coma. Los cambios en el electrocardiograma, particularmente en el eje QRS o el ancho, son indicadores clínicamente significativos de toxicidad tricíclica.
Otras manifestaciones del SNC pueden incluir somnolencia, estupor, ataxia, inquietud, agitación, reflejos hiperactivos, rigidez muscular, movimientos atetoideos y coreiformes.
Las anomalías cardíacas pueden incluir taquicardia y signos de insuficiencia congestiva. También pueden presentarse depresión respiratoria, cianosis, shock, vómitos, hiperpirexia, midriasis y diaforesis.
administración
Obtenga un ECG e inicie inmediatamente la monitorización cardíaca. Proteja las vías respiratorias del paciente, establezca una vía intravenosa e inicie la descontaminación gástrica. Es necesario un mínimo de 6 horas de observación con monitorización cardíaca y observación de signos de depresión respiratoria o del SNC, hipotensión, arritmias cardíacas y/o bloqueos de conducción y convulsiones. Si se presentan signos de toxicidad en cualquier momento durante este período, se requiere un seguimiento prolongado. Hay informes de casos de pacientes que sucumbieron a arritmias fatales después de una sobredosis; estos pacientes tenían evidencia clínica de envenenamiento significativo antes de la muerte y la mayoría recibió una descontaminación gastrointestinal inadecuada. La monitorización de los niveles plasmáticos del fármaco no debe guiar el tratamiento del paciente.
Descontaminación Gastrointestinal
Todos los pacientes con sospecha de sobredosis de tricíclicos deben recibir descontaminación gastrointestinal. Esto debe incluir un lavado gástrico de gran volumen seguido de carbón activado. Si la conciencia está alterada, se debe asegurar la vía aérea antes del lavado. La emesis está contraindicada.
Cardiovascular
Una duración máxima de QRS de derivación de extremidad de ≥0,10 segundos puede ser la mejor indicación de la gravedad de la sobredosis. Se debe usar bicarbonato de sodio intravenoso para mantener el pH sérico en el rango de 7,45 a 7,55. Si la respuesta del pH es inadecuada, también se puede utilizar la hiperventilación. El uso concomitante de hiperventilación y bicarbonato de sodio debe hacerse con extrema precaución, con monitoreo frecuente del pH. No es deseable un pH >7,60 o una pCO2
En casos raros, la hemoperfusión puede ser beneficiosa en la inestabilidad cardiovascular refractaria aguda en pacientes con toxicidad aguda. Sin embargo, la hemodiálisis, la diálisis peritoneal, las exanguinotransfusiones y la diuresis forzada por lo general han sido reportadas como ineficaces en el envenenamiento por tricíclicos.
SNC
En pacientes con depresión del SNC, se recomienda la intubación temprana debido al potencial de deterioro abrupto. Las convulsiones deben controlarse con benzodiazepinas o, si no son eficaces, con otros anticonvulsivos (p. ej., fenobarbital, fenitoína). No se recomienda la fisostigmina excepto para tratar síntomas potencialmente mortales que no han respondido a otras terapias, y solo en consulta con un centro de control de envenenamiento.
Seguimiento Psiquiátrico
Dado que la sobredosis suele ser deliberada, los pacientes pueden intentar suicidarse por otros medios durante la fase de recuperación. La derivación psiquiátrica puede ser apropiada.
Manejo pediátrico
Los principios de manejo de las sobredosis de niños y adultos son similares. Se recomienda enfáticamente que el médico se comunique con el centro local de control de envenenamiento para un tratamiento pediátrico específico.
CONTRAINDICACIONES
Está contraindicado el uso concomitante de compuestos inhibidores de la monoaminooxidasa. Pueden ocurrir crisis hiperpiréticas o ataques convulsivos severos en pacientes que reciben tales combinaciones. La potenciación de los efectos adversos puede ser grave o incluso mortal. Cuando se desee sustituir a Tofranil en pacientes que reciben un inhibidor de la monoaminooxidasa, debe transcurrir un intervalo tan largo como lo permita la situación clínica, con un mínimo de 14 días. La dosis inicial debe ser baja y los incrementos deben ser graduales y prescritos con precaución.
El medicamento está contraindicado durante el período de recuperación aguda después de un infarto de miocardio. Los pacientes con hipersensibilidad conocida a este compuesto no deben recibir el medicamento. Debe tenerse en cuenta la posibilidad de sensibilidad cruzada con otros compuestos de dibenzazepina.
FARMACOLOGÍA CLÍNICA
El mecanismo de acción de Tofranil 25 mg no se conoce con certeza. Sin embargo, no actúa principalmente por estimulación del sistema nervioso central. Se supone que el efecto clínico se debe a la potenciación de las sinapsis adrenérgicas mediante el bloqueo de la captación de norepinefrina en las terminaciones nerviosas. Se cree que el modo de acción del fármaco en el control de la enuresis infantil es independiente de su efecto antidepresivo.
Farmacología y Toxicología Animal
A. Agudo
Los rangos orales de LD50 son los siguientes:
Rata 355 a 682 mg/kg Perro 100 a 215 mg/kg
Dependiendo de la dosis en ambas especies, los signos tóxicos evolucionaron progresivamente desde depresión, respiración irregular y ataxia hasta convulsiones y muerte.
B. Reproducción/teratogénico
La evaluación general se puede resumir de la siguiente manera:
Oral: Estudios independientes en tres especies (rata, ratón y conejo) revelaron que cuando Tofranil se administra por vía oral en dosis de hasta aproximadamente 2-1/2 veces la dosis máxima en humanos en las primeras 2 especies y hasta 25 veces la dosis máxima en humanos dosis en la tercera especie, el fármaco está esencialmente libre de potencial teratogénico. En las tres especies estudiadas, solo ocurrió un caso de anormalidad fetal (en el conejo) y en ese estudio también hubo una anormalidad en el grupo de control. Sin embargo, existe evidencia de los estudios con ratas de que es demostrable cierto potencial sistémico y embriotóxico. Esto se manifiesta por la reducción del tamaño de la camada, un ligero aumento en la tasa de mortinatos y una reducción en el peso medio al nacer.
