Remeron 15mg, 30mg Mirtazapine Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué son Remeron y cómo se utilizan?
Remeron es un medicamento recetado que se usa para tratar los síntomas de la depresión. Remeron 30 mg se puede usar solo o con otros medicamentos.
Remeron pertenece a una clase de medicamentos llamados antidepresivos, antagonistas alfa-2; Antidepresivos, Otros.
No se sabe si Remeron 30 mg es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Remeron 30 mg?
Remeron puede causar efectos secundarios graves que incluyen:
- sentirse inquieto,
- pensamientos acelerados,
- disminución de la necesidad de dormir,
- comportamiento inusual de toma de riesgos,
- sentimientos de extrema felicidad o tristeza,
- siendo más hablador que de costumbre,
- visión borrosa,
- visión de túnel,
- dolor o hinchazón de los ojos,
- viendo halos alrededor de las luces,
- aturdimiento,
- fiebre,
- escalofríos,
- dolor de garganta,
- úlceras de boca,
- cambios en el peso o el apetito,
- sarpullido grave, ampollas o hinchazón en las palmas de las manos o en las plantas de los pies,
- convulsiones (ataques),
- dolor de cabeza,
- confusión,
- dificultad para hablar,
- severa debilidad,
- vómitos,
- pérdida de coordinación y
- sentirse inestable
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Remeron incluyen:
- somnolencia,
- mareo,
- sueños extraños,
- boca seca,
- estreñimiento,
- aumento del apetito y
- aumento de peso
Informe a su médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Remeron. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
Medicamentos suicidas y antidepresivos
Los antidepresivos aumentaron el riesgo de pensamientos y conductas suicidas (tendencia suicida) en comparación con placebo en niños, adolescentes y adultos jóvenes en estudios a corto plazo de trastorno depresivo mayor (TDM) y otros trastornos psiquiátricos. Cualquiera que esté considerando el uso de las tabletas de REMERON® (mirtazapina) o cualquier otro antidepresivo en un niño, adolescente o adulto joven debe sopesar este riesgo con la necesidad clínica. Los estudios a corto plazo no mostraron un aumento en el riesgo de tendencias suicidas con antidepresivos en comparación con placebo en adultos mayores de 24 años; hubo una reducción del riesgo con los antidepresivos en comparación con el placebo en adultos de 65 años o más. La depresión y ciertos otros trastornos psiquiátricos están asociados con aumentos en el riesgo de suicidio. Los pacientes de todas las edades que comienzan con la terapia antidepresiva deben ser monitoreados apropiadamente y observados de cerca para detectar empeoramiento clínico, tendencias suicidas o cambios inusuales en el comportamiento. Se debe advertir a las familias y cuidadores de la necesidad de una estrecha observación y comunicación con el prescriptor. REMERON no está aprobado para su uso en pacientes pediátricos. (Ver ADVERTENCIAS: Empeoramiento Clínico y Riesgo de Suicidio, INFORMACIÓN PARA EL PACIENTE y PRECAUCIONES: Uso Pediátrico)
DESCRIPCIÓN
Las tabletas REMERON® (mirtazapina) son un medicamento administrado por vía oral. La mirtazapina tiene una estructura química tetracíclica y pertenece al grupo de compuestos piperazino-azepina. Se denomina 1,2,3,4,10,14b-hexahidro-2-metilpirazino [2,1-a] pirido [2,3-c] benzazepina y tiene la fórmula empírica de C17H19N3. Su peso molecular es 265,36. La fórmula estructural es la siguiente y es la mezcla racémica:
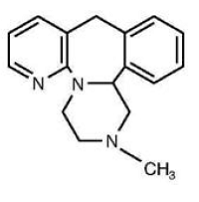
La mirtazapina es un polvo cristalino de color blanco a blanco cremoso que es ligeramente soluble en agua.
REMERON se suministra para administración oral en forma de comprimidos recubiertos con película ranurados que contienen 15 o 30 mg de mirtazapina y comprimidos recubiertos con película sin ranurar que contienen 45 mg de mirtazapina. Cada tableta también contiene almidón de maíz, hidroxipropilcelulosa, estearato de magnesio, dióxido de silicio coloidal, lactosa y otros ingredientes inactivos.
INDICACIONES
Las tabletas REMERON (mirtazapina) están indicadas para el tratamiento del trastorno depresivo mayor.
La eficacia de REMERON en el tratamiento del trastorno depresivo mayor se estableció en ensayos controlados de 6 semanas de duración en pacientes ambulatorios cuyos diagnósticos se correspondían más estrechamente con la categoría de trastorno depresivo mayor del Manual diagnóstico y estadístico de los trastornos mentales, 3.ª edición (DSM-III) (ver FARMACOLOGÍA CLÍNICA ).
Un episodio depresivo mayor (DSM-IV) implica un estado de ánimo deprimido o disfórico prominente y relativamente persistente (casi todos los días durante al menos 2 semanas) que generalmente interfiere con el funcionamiento diario e incluye al menos 5 de los siguientes 9 síntomas: estado de ánimo deprimido, pérdida de interés en las actividades habituales, cambios significativos en el peso y/o el apetito, insomnio o hipersomnia, agitación o retraso psicomotor, aumento de la fatiga, sentimientos de culpa o inutilidad, pensamiento lento o dificultad para concentrarse, intento de suicidio o ideación suicida.
La eficacia de REMERON 15 mg en pacientes deprimidos hospitalizados no ha sido adecuadamente estudiada.
La eficacia de REMERON 15 mg para mantener una respuesta en pacientes con trastorno depresivo mayor hasta 40 semanas después de 8 a 12 semanas de tratamiento abierto inicial se demostró en un ensayo controlado con placebo. No obstante, el médico que opte por usar REMERON 15 mg durante períodos prolongados debe reevaluar periódicamente la utilidad a largo plazo del fármaco para el paciente individual (ver FARMACOLOGÍA CLÍNICA ).
DOSIFICACIÓN Y ADMINISTRACIÓN
Tratamiento inicial
La dosis inicial recomendada para las tabletas de REMERON (mirtazapina) es de 15 mg/día, administrados en una dosis única, preferiblemente por la noche antes de acostarse. En los ensayos clínicos controlados que establecieron la eficacia de REMERON en el tratamiento del trastorno depresivo mayor, el rango de dosis efectiva fue generalmente de 15 a 45 mg/día. Si bien la relación entre la dosis y la respuesta satisfactoria en el tratamiento del trastorno depresivo mayor para REMERON 15 mg no se ha explorado adecuadamente, los pacientes que no respondan a la dosis inicial de 15 mg pueden beneficiarse de aumentos de dosis hasta un máximo de 45 mg/día. REMERON tiene una vida media de eliminación de aproximadamente 20 a 40 horas; por lo tanto, los cambios de dosis no deben realizarse a intervalos de menos de 1 a 2 semanas para permitir tiempo suficiente para la evaluación de la respuesta terapéutica a una dosis dada.
Ancianos Y Pacientes Con Insuficiencia Renal O Hepática
El aclaramiento de mirtazapina se reduce en pacientes de edad avanzada y en pacientes con insuficiencia renal o hepática de moderada a grave. En consecuencia, el prescriptor debe ser consciente de que los niveles plasmáticos de mirtazapina pueden aumentar en estos grupos de pacientes, en comparación con los niveles observados en adultos más jóvenes sin insuficiencia renal o hepática (ver PRECAUCIONES y FARMACOLOGÍA CLÍNICA ).
Mantenimiento/Tratamiento Extendido
En general, se acepta que los episodios agudos de depresión requieren varios meses o más de terapia farmacológica sostenida más allá de la respuesta al episodio agudo. La evaluación sistemática de las tabletas de REMERON (mirtazapina) ha demostrado que su eficacia en el trastorno depresivo mayor se mantiene durante períodos de hasta 40 semanas después de 8 a 12 semanas de tratamiento inicial a una dosis de 15 a 45 mg/día (ver FARMACOLOGÍA CLÍNICA ). Sobre la base de estos datos limitados, se desconoce si la dosis de REMERON de 30 mg necesaria para el tratamiento de mantenimiento es idéntica a la dosis necesaria para lograr una respuesta inicial. Los pacientes deben ser reevaluados periódicamente para determinar la necesidad de un tratamiento de mantenimiento y la dosis adecuada para dicho tratamiento.
Cambio de un paciente a o desde un inhibidor de la monoaminooxidasa (IMAO) destinado a tratar trastornos psiquiátricos
Deben transcurrir al menos 14 días entre la interrupción de un IMAO destinado a tratar trastornos psiquiátricos y el inicio de la terapia con REMERON (mirtazapina) en tabletas. Por el contrario, se deben permitir al menos 14 días después de suspender REMERON 30 mg antes de comenzar un IMAO destinado a tratar trastornos psiquiátricos (ver CONTRAINDICACIONES ).
Uso de REMERON 15 mg con otros IMAO, como linezolid o azul de metileno
No inicie REMERON 15 mg en un paciente que está siendo tratado con linezolid o azul de metileno intravenoso porque existe un mayor riesgo de síndrome serotoninérgico. En un paciente que requiere un tratamiento más urgente de una condición psiquiátrica, se deben considerar otras intervenciones, incluida la hospitalización (ver CONTRAINDICACIONES ).
En algunos casos, un paciente que ya recibe terapia con REMERON 30 mg puede requerir tratamiento urgente con linezolid o azul de metileno intravenoso. Si no hay disponibles alternativas aceptables al tratamiento con linezolid o azul de metileno intravenoso y se considera que los beneficios potenciales del tratamiento con linezolid o azul de metileno intravenoso superan los riesgos del síndrome serotoninérgico en un paciente en particular, REMERON 30 mg debe suspenderse de inmediato y linezolid o metileno intravenoso. Se puede administrar azul. Se debe monitorear al paciente para detectar síntomas del síndrome serotoninérgico durante 2 semanas o hasta 24 horas después de la última dosis de linezolid o azul de metileno intravenoso, lo que ocurra primero. La terapia con REMERON 30 mg puede reanudarse 24 horas después de la última dosis de linezolid o azul de metileno intravenoso (ver ADVERTENCIAS ).
No está claro el riesgo de administrar azul de metileno por vías no intravenosas (como tabletas orales o inyección local) o en dosis intravenosas mucho más bajas que 1 mg/kg con REMERON. No obstante, el médico debe ser consciente de la posibilidad de síntomas emergentes del síndrome serotoninérgico con dicho uso (ver ADVERTENCIAS ).
Interrupción del tratamiento con REMERON
Se han informado síntomas asociados con la interrupción o reducción de la dosis de REMERON en tabletas de 15 mg. Los pacientes deben ser monitoreados por estos y otros síntomas al interrumpir el tratamiento o durante la reducción de la dosis. Siempre que sea posible, se recomienda una reducción gradual de la dosis durante varias semanas, en lugar de un cese abrupto. Si aparecen síntomas intolerables tras una disminución de la dosis o tras la interrupción del tratamiento, el ajuste de la dosis debe controlarse en función de la respuesta clínica del paciente (ver PRECAUCIONES y REACCIONES ADVERSAS ).
Información para pacientes
Se debe advertir a los pacientes que tomar REMERON puede causar dilatación pupilar leve, lo que en personas susceptibles puede provocar un episodio de glaucoma de ángulo cerrado. El glaucoma preexistente casi siempre es un glaucoma de ángulo abierto porque el glaucoma de ángulo cerrado, cuando se diagnostica, se puede tratar definitivamente con iridectomía. El glaucoma de ángulo abierto no es un factor de riesgo para el glaucoma de ángulo cerrado. Es posible que los pacientes deseen ser examinados para determinar si son susceptibles al ángulo cerrado y someterse a un procedimiento profiláctico (p. ej., iridectomía), si son susceptibles.
CÓMO SUMINISTRADO
REMERON (mirtazapina) Tabletas se suministran como:
Comprimidos de 15 mg — ovalado, ranurado, amarillo, recubierto, con "Organon" grabado en un lado y "T3Z" en el otro lado.
Botellas de 30 CDN 0052-0105-30
Comprimidos de 30 mg — ovalado, ranurado, marrón rojizo, recubierto, con "Organon" grabado en un lado y "T5Z" en el otro lado.
Botellas de 30 CDN 0052-0107-30
Comprimidos de 45 mg — ovalado, blanco, estucado, con “Organon” grabado en un lado y “T7Z” en el otro lado.
Botellas de 30 CDN 0052-0109-30
Almacenamiento
Almacenar a una temperatura de 20 °C a 25 °C (68 °F a 77 °F); excursiones permitidas a 15°C a 30°C (59°F a 86°F) [ver Temperatura ambiente controlada por USP ]. Proteger de la luz y la humedad.
Fabricado para: Merck Sharp & Dohme Corp., una subsidiaria de Merck & Co., Inc., Whitehouse Station, NJ 08889, EE. UU. Fabricado por: NV Organon, Oss, Países Bajos, una subsidiaria de Merck & Co., Inc., Whitehouse Station, NJ 08889, EE. UU. Revisado: julio de 2016
EFECTOS SECUNDARIOS
Asociado con la interrupción del tratamiento
Aproximadamente el 16 % de los 453 pacientes que recibieron tabletas de REMERON (mirtazapina) en ensayos clínicos controlados de 6 semanas en EE. UU. interrumpieron el tratamiento debido a una experiencia adversa, en comparación con el 7 % de los 361 pacientes tratados con placebo en esos estudios. Los eventos más comunes (≥ 1 %) asociados con la interrupción y que se consideran relacionados con el fármaco (es decir, aquellos eventos asociados con la tasa de abandono al menos el doble que la del placebo) se incluyen en la Tabla 2.
Eventos adversos comúnmente observados en ensayos clínicos controlados en EE. UU.
Los eventos adversos observados con mayor frecuencia asociados con el uso de las tabletas de REMERON (mirtazapina) (incidencia del 5 % o más) y que no se observaron con una incidencia equivalente entre los pacientes tratados con placebo (incidencia de REMERON al menos el doble que la del placebo) se enumeran en la Tabla 3.
Eventos adversos que ocurren con una incidencia del 1 % o más entre los pacientes tratados con REMERON
La Tabla 4 enumera los eventos adversos que ocurrieron con una incidencia del 1% o más, y que fueron más frecuentes que en el grupo de placebo, entre los pacientes tratados con REMERON (mirtazapina) Tabletas que participaron en ensayos controlados con placebo a corto plazo en los EE. Dosificado en un rango de 5 a 60 mg/día. Esta tabla muestra el porcentaje de pacientes en cada grupo que tuvo al menos 1 episodio de un evento en algún momento durante su tratamiento. Los eventos adversos informados se clasificaron utilizando una terminología de diccionario estándar basada en COSTART.
El prescriptor debe ser consciente de que estas cifras no pueden utilizarse para predecir la incidencia de efectos secundarios en el curso de la práctica médica habitual cuando las características del paciente y otros factores difieren de los que prevalecieron en los ensayos clínicos. Del mismo modo, las frecuencias citadas no pueden compararse con cifras obtenidas de otras investigaciones con diferentes tratamientos, usos e investigadores. Las cifras citadas, sin embargo, proporcionan al médico prescriptor alguna base para estimar la contribución relativa de los factores farmacológicos y no farmacológicos a la tasa de incidencia de efectos secundarios en la población estudiada.
Cambios en el ECG
Se analizaron los electrocardiogramas de 338 pacientes que recibieron tabletas de REMERON (mirtazapina) y 261 pacientes que recibieron placebo en ensayos controlados con placebo de 6 semanas. No se observó prolongación del QTc ≥ 500 ms entre los pacientes tratados con mirtazapina; el cambio medio en QTc fue de +1,6 mseg para mirtazapina y -3,1 mseg para placebo. La mirtazapina se asoció con un aumento medio de la frecuencia cardíaca de 3,4 lpm, en comparación con 0,8 lpm para el placebo. Se desconoce el significado clínico de estos cambios.
El efecto de REMERON (mirtazapina) sobre el intervalo QTc se evaluó en un ensayo clínico aleatorizado con placebo y controles positivos (moxifloxacina) en el que participaron 54 voluntarios sanos utilizando un análisis de respuesta a la exposición. Este ensayo mostró una relación positiva entre las concentraciones de mirtazapina y la prolongación del intervalo QTc. Sin embargo, el grado de prolongación del intervalo QT observado con dosis de mirtazapina de 45 mg (terapéuticas) y 75 mg (supraterapéuticas) no se encontraba en un nivel considerado clínicamente significativo.
Otros eventos adversos observados durante la evaluación previa a la comercialización de REMERON
Durante su evaluación previa a la comercialización, se administraron múltiples dosis de REMERON (mirtazapina) en tabletas a 2796 pacientes en estudios clínicos. Las condiciones y la duración de la exposición a la mirtazapina variaron mucho e incluyeron (en categorías superpuestas) estudios abiertos y doble ciego, estudios controlados y no controlados, estudios con pacientes hospitalizados y ambulatorios, estudios de dosis fija y de titulación. Los eventos adversos asociados con esta exposición fueron registrados por investigadores clínicos utilizando terminología de su propia elección. En consecuencia, no es posible proporcionar una estimación significativa de la proporción de personas que experimentan eventos adversos sin agrupar primero tipos similares de eventos adversos en un número menor de categorías de eventos estandarizados.
En las siguientes tabulaciones, los eventos adversos informados se clasificaron utilizando una terminología de diccionario estándar basada en COSTART. Las frecuencias presentadas, por lo tanto, representan la proporción de los 2796 pacientes expuestos a dosis múltiples de REMERON que experimentaron un evento del tipo citado en al menos 1 ocasión mientras recibían REMERON. Se incluyen todos los eventos informados, excepto los que ya se enumeran en la Tabla 4, aquellas experiencias adversas incluidas en los términos de COSTART que son demasiado generales o demasiado específicas para no ser informativas, y aquellos eventos para los cuales la causa de un fármaco fue muy remota.
Es importante recalcar que, si bien los eventos informados ocurrieron durante el tratamiento con REMERON 30mg, no necesariamente fueron causados por éste.
Los eventos se clasifican además por sistema corporal y se enumeran en orden de frecuencia decreciente de acuerdo con las siguientes definiciones: los eventos adversos frecuentes son aquellos que ocurren en 1 o más ocasiones en al menos 1/100 pacientes; los eventos adversos poco frecuentes son los que ocurren en 1/100 a 1/1000 pacientes; Los eventos raros son aquellos que ocurren en menos de 1/1000 pacientes. En esta lista solo aparecen aquellos eventos que aún no se enumeran en la Tabla 4. Los eventos de mayor importancia clínica también se describen en las secciones de ADVERTENCIAS y PRECAUCIONES.
Cuerpo como un todo: frecuentes: malestar general, dolor abdominal, síndrome abdominal agudo; infrecuentes: escalofríos, fiebre, edema facial, úlcera, reacción de fotosensibilidad, rigidez del cuello, dolor de cuello, abdomen agrandado; Raros: celulitis, dolor torácico subesternal.
Sistema cardiovascular: frecuentes: hipertensión, vasodilatación; infrecuentes: angina de pecho, infarto de miocardio, bradicardia, extrasístoles ventriculares, síncope, migraña, hipotensión; raros: arritmia auricular, bigeminismo, cefalea vascular, embolia pulmonar, isquemia cerebral, cardiomegalia, flebitis, insuficiencia cardíaca izquierda.
Sistema digestivo: frecuentes: vómitos, anorexia; poco frecuentes: eructos, glositis, colecistitis, náuseas y vómitos, hemorragia de las encías, estomatitis, colitis, pruebas de función hepática anormales; raros: decoloración de la lengua, estomatitis ulcerosa, agrandamiento de las glándulas salivales, aumento de la salivación, obstrucción intestinal, pancreatitis, estomatitis aftosa, cirrosis hepática, gastritis, gastroenteritis, moniliasis oral, edema de la lengua.
Sistema endocrino: raros: bocio, hipotiroidismo.
Sistema Hemático y Linfático: Raros: linfadenopatía, leucopenia, petequias, anemia, trombocitopenia, linfocitosis, pancitopenia.
Trastornos metabólicos y nutricionales: frecuentes: sed; poco frecuentes: deshidratación, pérdida de peso; Raros: gota, aumento de SGOT, cicatrización anormal, aumento de fosfatasa ácida, aumento de SGPT, diabetes mellitus, hiponatremia.
Sistema musculoesquelético: frecuente: miastenia, artralgia; poco frecuentes: artritis, tenosinovitis; Raros: fractura patológica, fractura por osteoporosis, dolor óseo, miositis, rotura de tendón, artrosis, bursitis.
Sistema nervioso: frecuentes: hipoestesia, apatía, depresión, hipocinesia, vértigo, espasmos, agitación, ansiedad, amnesia, hipercinesia, parestesia; poco frecuentes: ataxia, delirio, delirios, despersonalización, discinesia, síndrome extrapiramidal, aumento de la libido, coordinación anormal, disartria, alucinaciones, reacción maníaca, neurosis, distonía, hostilidad, aumento de los reflejos, labilidad emocional, euforia, reacción paranoide; Raros: afasia, nistagmo, acatisia (inquietud psicomotora), estupor, demencia, diplopía, drogodependencia, parálisis, convulsiones de gran mal, hipotonía, mioclonía, depresión psicótica, síndrome de abstinencia, síndrome serotoninérgico.
Sistema respiratorio: frecuentes: aumento de la tos, sinusitis; infrecuentes: epistaxis, bronquitis, asma, neumonía; Raros: asfixia, laringitis, neumotórax, hipo.
Piel y apéndices: frecuente: prurito, erupción; poco frecuentes: acné, dermatitis exfoliativa, piel seca, herpes simple, alopecia; Raros: urticaria, herpes zoster, hipertrofia cutánea, seborrea, úlcera cutánea.
Sentidos especiales: infrecuentes: dolor ocular, alteración de la acomodación, conjuntivitis, sordera, queratoconjuntivitis, lagrimeo, glaucoma de ángulo cerrado, hiperacusia, dolor de oído; Raros: blefaritis, sordera transitoria parcial, otitis media, pérdida del gusto, parosmia.
Sistema urogenital: frecuente: infección del tracto urinario; poco frecuentes: cálculos renales, cistitis, disuria, incontinencia urinaria, retención urinaria, vaginitis, hematuria, dolor mamario, amenorrea, dismenorrea, leucorrea, impotencia; Raros: poliuria, uretritis, metrorragia, menorragia, eyaculación anormal, congestión mamaria, aumento de tamaño de las mamas, urgencia urinaria.
Otros eventos adversos observados durante la evaluación posterior a la comercialización de REMERON
Los eventos adversos informados desde la introducción al mercado, que estuvieron temporalmente (pero no necesariamente causalmente) relacionados con la terapia con mirtazapina, incluyen casos de arritmia ventricular Torsades de Pointes. En la mayoría de estos casos, sin embargo, estuvieron implicados fármacos concomitantes. También se han notificado casos de reacciones cutáneas graves, incluido el síndrome de Stevens-Johnson, dermatitis ampollosa, eritema multiforme y necrólisis epidérmica tóxica. También se han informado niveles elevados de creatina quinasa en sangre y rabdomiolisis.
Abuso y dependencia de drogas
Clase de sustancia controlada
Las tabletas REMERON (mirtazapina) no son una sustancia controlada.
Dependencia Física Y Psicológica
Las tabletas de REMERON (mirtazapina) no se han estudiado sistemáticamente en animales o humanos por su potencial de abuso, tolerancia o dependencia física. Si bien los ensayos clínicos no revelaron ninguna tendencia a ningún comportamiento de búsqueda de fármacos, estas observaciones no fueron sistemáticas y, sobre la base de esta experiencia limitada, no es posible predecir hasta qué punto un fármaco activo en el SNC será mal utilizado, desviado y /o abusado una vez comercializado. En consecuencia, los pacientes deben ser evaluados cuidadosamente en busca de antecedentes de abuso de drogas, y dichos pacientes deben ser observados de cerca para detectar signos de uso indebido o abuso de REMERON (p. ej., desarrollo de tolerancia, incrementos de dosis, comportamiento de búsqueda de drogas).
INTERACCIONES CON LA DROGAS
Al igual que con otros medicamentos, existe la posibilidad de interacción por una variedad de mecanismos (p. ej., inhibición o mejora farmacodinámica, farmacocinética, etc.) (ver FARMACOLOGÍA CLÍNICA ).
Inhibidores de la monoaminooxidasa
(Ver CONTRAINDICACIONES , ADVERTENCIAS , y DOSIFICACIÓN Y ADMINISTRACIÓN .)
Fármacos serotoninérgicos
(Ver CONTRAINDICACIONES y ADVERTENCIAS .)
Medicamentos que afectan el metabolismo hepático
El metabolismo y la farmacocinética de las tabletas de REMERON (mirtazapina) pueden verse afectados por la inducción o inhibición de enzimas metabolizadoras de fármacos.
Fármacos que se metabolizan y/o inhiben las enzimas del citocromo P450
Inductores de enzimas CYP
(estos estudios utilizaron ambos fármacos en estado estacionario)
fenitoína
En pacientes masculinos sanos (n=18), la fenitoína (200 mg diarios) aumentó el aclaramiento de mirtazapina (30 mg diarios) alrededor de 2 veces, lo que resultó en una disminución de las concentraciones plasmáticas promedio de mirtazapina del 45 %. La mirtazapina no afectó significativamente la farmacocinética de la fenitoína.
Carbamazepina
En pacientes masculinos sanos (n=24), la carbamazepina (400 mg dos veces al día) aumentó el aclaramiento de mirtazapina (15 mg dos veces al día) aproximadamente al doble, lo que resultó en una disminución de las concentraciones plasmáticas promedio de mirtazapina del 60 %.
Cuando se agrega fenitoína, carbamazepina u otro inductor del metabolismo hepático (como la rifampicina) a la terapia con mirtazapina, es posible que sea necesario aumentar la dosis de mirtazapina. Si se interrumpe el tratamiento con dicho medicamento, puede ser necesario reducir la dosis de mirtazapina.
Inhibidores de enzimas CYP
cimetidina
En pacientes varones sanos (n = 12), cuando se coadministró cimetidina, un inhibidor débil de CYP1A2, CYP2D6 y CYP3A4, administrado dos veces al día en estado estacionario con mirtazapina (30 mg diarios) en estado estacionario, el área bajo la curva (AUC) de mirtazapina aumentó más del 50%. La mirtazapina no provocó cambios relevantes en la farmacocinética de la cimetidina. La dosis de mirtazapina puede tener que reducirse cuando se inicia el tratamiento concomitante con cimetidina, o aumentarse cuando se interrumpe el tratamiento con cimetidina.
ketoconazol
En pacientes caucásicos varones sanos (n=24), la coadministración del potente inhibidor de CYP3A4 ketoconazol (200 mg dos veces al día durante 6,5 días) aumentó los niveles plasmáticos máximos y el AUC de una dosis única de 30 mg de mirtazapina en aproximadamente un 40 % y 50%, respectivamente.
Se debe tener precaución cuando se coadministre mirtazapina con inhibidores potentes de CYP3A4, inhibidores de la proteasa del VIH, antifúngicos azoles, eritromicina o nefazodona.
paroxetina
En un estudio de interacción in vivo en pacientes sanos metabolizadores rápidos de CYP2D6 (n=24), mirtazapina (30 mg/día), en estado estacionario, no provocó cambios relevantes en la farmacocinética de paroxetina en estado estacionario (40 mg/día), un inhibidor de CYP2D6.
Otras interacciones farmacológicas
amitriptilina
En pacientes sanos, metabolizadores rápidos de CYP2D6 (n=32), la amitriptilina (75 mg al día), en estado estacionario, no provocó cambios relevantes en la farmacocinética de la mirtazapina en estado estacionario (30 mg al día); la mirtazapina tampoco provocó cambios relevantes en la farmacocinética de la amitriptilina.
warfarina
En sujetos masculinos sanos (n=16), la mirtazapina (30 mg diarios), en estado estacionario, provocó un aumento pequeño (0,2) pero estadísticamente significativo en el índice internacional normalizado (INR) en sujetos tratados con warfarina. Dado que a dosis más altas de mirtazapina no se puede excluir un efecto más pronunciado, se recomienda controlar el INR en caso de tratamiento concomitante de warfarina con mirtazapina.
Litio
No se han observado efectos clínicos relevantes ni cambios significativos en la farmacocinética en sujetos masculinos sanos en tratamiento concomitante con niveles subterapéuticos de litio (600 mg/día durante 10 días) en estado estacionario y una dosis única de 30 mg de mirtazapina. Se desconocen los efectos de dosis más altas de litio sobre la farmacocinética de mirtazapina.
risperidona
En un estudio de interacción in vivo, no aleatorizado, los sujetos (n = 6) que necesitaban tratamiento con un fármaco antipsicótico y antidepresivo demostraron que la mirtazapina (30 mg al día) en estado estacionario no influía en la farmacocinética de la risperidona (hasta 3 mg licitación).
Alcohol
La administración concomitante de alcohol (equivalente a 60 g) tuvo un efecto mínimo sobre los niveles plasmáticos de mirtazapina (15 mg) en 6 sujetos varones sanos. Sin embargo, se demostró que el deterioro de las habilidades cognitivas y motoras producido por REMERON es aditivo con el producido por el alcohol. En consecuencia, se debe advertir a los pacientes que eviten el alcohol mientras toman REMERON.
diazepam
La administración concomitante de diazepam (15 mg) tuvo un efecto mínimo sobre los niveles plasmáticos de mirtazapina (15 mg) en 12 sujetos sanos. Sin embargo, se ha demostrado que el deterioro de las habilidades motoras producido por REMERON 30 mg se suma a los causados por diazepam. En consecuencia, se debe advertir a los pacientes que eviten el diazepam y otros medicamentos similares mientras toman REMERON.
Fármacos que prolongan el intervalo QTc
El riesgo de prolongación del intervalo QT y/o arritmias ventriculares (p. ej., Torsades de Pointes) puede aumentar con el uso concomitante de medicamentos que prolongan el intervalo QTc (p. ej., algunos antipsicóticos y antibióticos) y en caso de sobredosis de mirtazapina (ver REACCIONES ADVERSAS y SOBREDOSIS secciones).
ADVERTENCIAS
Empeoramiento clínico y riesgo de suicidio
Los pacientes con trastorno depresivo mayor (MDD), tanto adultos como pediátricos, pueden experimentar un empeoramiento de su depresión y/o la aparición de ideación y comportamiento suicida (suicidalidad) o cambios inusuales en el comportamiento, estén o no tomando medicamentos antidepresivos, y esto el riesgo puede persistir hasta que ocurra una remisión significativa. El suicidio es un riesgo conocido de depresión y ciertos otros trastornos psiquiátricos, y estos trastornos en sí mismos son los predictores más fuertes de suicidio. Sin embargo, desde hace mucho tiempo existe la preocupación de que los antidepresivos puedan tener un papel en la inducción del empeoramiento de la depresión y la aparición de tendencias suicidas en ciertos pacientes durante las primeras fases del tratamiento. Los análisis combinados de ensayos controlados con placebo a corto plazo de medicamentos antidepresivos (ISRS y otros) mostraron que estos medicamentos aumentan el riesgo de pensamientos y conductas suicidas (tendencia al suicidio) en niños, adolescentes y adultos jóvenes (de 18 a 24 años de edad) con depresión mayor. (TDM) y otros trastornos psiquiátricos. Los estudios a corto plazo no mostraron un aumento en el riesgo de tendencias suicidas con antidepresivos en comparación con placebo en adultos mayores de 24 años; hubo una reducción del riesgo con los antidepresivos en comparación con el placebo en adultos de 65 años o más.
Los análisis agrupados de ensayos controlados con placebo en niños y adolescentes con TDM, trastorno obsesivo compulsivo (TOC) u otros trastornos psiquiátricos incluyeron un total de 24 ensayos a corto plazo de 9 fármacos antidepresivos en más de 4400 pacientes. Los análisis agrupados de ensayos controlados con placebo en adultos con MDD u otros trastornos psiquiátricos incluyeron un total de 295 ensayos a corto plazo (duración media de 2 meses) de 11 fármacos antidepresivos en más de 77 000 pacientes. Hubo una variación considerable en el riesgo de suicidio entre los fármacos, pero una tendencia hacia un aumento en los pacientes más jóvenes para casi todos los fármacos estudiados. Hubo diferencias en el riesgo absoluto de tendencias suicidas en diferentes indicaciones, con la mayor incidencia en MDD. Sin embargo, las diferencias de riesgo (fármaco frente a placebo) fueron relativamente estables dentro de los estratos de edad y entre las indicaciones. Estas diferencias de riesgo (diferencia fármaco-placebo en el número de casos de tendencias suicidas por cada 1000 pacientes tratados) se proporcionan en la Tabla 1.
No se produjeron suicidios en ninguno de los ensayos pediátricos. Hubo suicidios en los ensayos con adultos, pero el número no fue suficiente para llegar a ninguna conclusión sobre el efecto del fármaco sobre el suicidio.
Se desconoce si el riesgo de suicidio se extiende al uso a largo plazo, es decir, más allá de varios meses. Sin embargo, existe evidencia sustancial de ensayos de mantenimiento controlados con placebo en adultos con depresión de que el uso de antidepresivos puede retrasar la recurrencia de la depresión.
Todos los pacientes que reciben tratamiento con antidepresivos por cualquier indicación deben ser monitoreados adecuadamente y observados de cerca por si empeoran clínicamente, tienen tendencias suicidas y cambios inusuales en el comportamiento, especialmente durante los meses iniciales de un ciclo de terapia con medicamentos, o en momentos de cambios de dosis, ya sea aumentos o disminuye.
Los siguientes síntomas, ansiedad, agitación, ataques de pánico, insomnio, irritabilidad, hostilidad, agresividad, impulsividad, acatisia (inquietud psicomotora), hipomanía y manía, se han informado en pacientes adultos y pediátricos que también reciben tratamiento con antidepresivos para el trastorno depresivo mayor como para otras indicaciones, tanto psiquiátricas como no psiquiátricas. Aunque no se ha establecido un vínculo causal entre la aparición de tales síntomas y el empeoramiento de la depresión y/o la aparición de impulsos suicidas, existe la preocupación de que tales síntomas puedan representar precursores de tendencias suicidas emergentes.
Se debe considerar cambiar el régimen terapéutico, incluida la posibilidad de suspender el medicamento, en pacientes cuya depresión empeora persistentemente, o que están experimentando tendencias suicidas emergentes o síntomas que podrían ser precursores de un empeoramiento de la depresión o tendencias suicidas, especialmente si estos síntomas son severos, abruptos. en el inicio, o no formaban parte de los síntomas de presentación del paciente.
Se debe alertar a las familias y cuidadores de pacientes que reciben tratamiento con antidepresivos por trastorno depresivo mayor u otras indicaciones, tanto psiquiátricas como no psiquiátricas, sobre la necesidad de monitorear a los pacientes para detectar la aparición de agitación, irritabilidad, cambios inusuales en el comportamiento y los demás síntomas descritos anteriormente. , así como el surgimiento de tendencias suicidas, e informar dichos síntomas de inmediato a los proveedores de atención médica. Dicho seguimiento debe incluir la observación diaria por parte de las familias y los cuidadores. Las recetas de comprimidos de REMERON (mirtazapina) deben hacerse para la cantidad más pequeña de comprimidos compatible con un buen manejo del paciente, a fin de reducir el riesgo de sobredosis.
Detección de pacientes para el trastorno bipolar
Un episodio depresivo mayor puede ser la presentación inicial del trastorno bipolar. En general, se cree (aunque no se ha establecido en ensayos controlados) que tratar un episodio de este tipo con un antidepresivo solo puede aumentar la probabilidad de precipitación de un episodio mixto/maníaco en pacientes con riesgo de trastorno bipolar. Se desconoce si alguno de los síntomas descritos anteriormente representa tal conversión. Sin embargo, antes de iniciar el tratamiento con un antidepresivo, los pacientes con síntomas depresivos deben someterse a un cribado adecuado para determinar si tienen riesgo de trastorno bipolar; dicha evaluación debe incluir un historial psiquiátrico detallado, incluidos antecedentes familiares de suicidio, trastorno bipolar y depresión. Cabe señalar que las tabletas REMERON (mirtazapina) no están aprobadas para su uso en el tratamiento de la depresión bipolar.
agranulocitosis
En ensayos clínicos previos a la comercialización, 2 (1 con síndrome de Sjögren) de 2796 pacientes tratados con REMERON (mirtazapina) en tabletas desarrollaron agranulocitosis [recuento absoluto de neutrófilos (RAN)
Síndrome de serotonina
Se ha informado el desarrollo de un síndrome serotoninérgico potencialmente mortal con IRSN e ISRS, incluido REMERON 30 mg, solo, pero particularmente con el uso concomitante de otros fármacos serotoninérgicos (incluidos triptanos, antidepresivos tricíclicos, fentanilo, litio, tramadol, triptófano, buspirona y hierba de San Juan), y con fármacos que alteran el metabolismo de la serotonina (en particular, los IMAO, tanto los destinados a tratar trastornos psiquiátricos como también otros, como linezolid y azul de metileno intravenoso).
Los síntomas del síndrome serotoninérgico pueden incluir cambios en el estado mental (p. ej., agitación, alucinaciones, delirio y coma), inestabilidad autonómica (p. ej., taquicardia, presión arterial lábil, mareos, diaforesis, sofocos, hipertermia), síntomas neuromusculares (p. ej., temblor, rigidez, mioclonías, hiperreflexia, falta de coordinación), convulsiones y/o síntomas gastrointestinales (p. ej., náuseas, vómitos, diarrea). Los pacientes deben ser monitoreados por la aparición del síndrome serotoninérgico.
Está contraindicado el uso concomitante de REMERON 15 mg con IMAO destinados a tratar trastornos psiquiátricos. REMERON tampoco debe iniciarse en un paciente que está siendo tratado con IMAO como linezolid o azul de metileno intravenoso. Todos los informes con azul de metileno que proporcionaron información sobre la vía de administración involucraron la administración intravenosa en el rango de dosis de 1 mg/kg a 8 mg/kg. Ningún informe involucró la administración de azul de metileno por otras vías (como tabletas orales o inyección local en tejido) o en dosis más bajas. Puede haber circunstancias en las que sea necesario iniciar el tratamiento con un IMAO como linezolid o azul de metileno intravenoso en un paciente que toma REMERON. Se debe suspender REMERON 15 mg antes de iniciar el tratamiento con el IMAO (ver CONTRAINDICACIONES y DOSIFICACIÓN Y ADMINISTRACIÓN ).
Si está clínicamente justificado el uso concomitante de REMERON 30 mg con otros medicamentos serotoninérgicos, incluidos triptanos, antidepresivos tricíclicos, fentanilo, litio, tramadol, buspirona, triptófano y hierba de San Juan, tenga en cuenta un posible aumento del riesgo de síndrome serotoninérgico, particularmente durante inicio del tratamiento y aumentos de dosis.
El tratamiento con REMERON 30 mg y cualquier agente serotoninérgico concomitante debe suspenderse de inmediato si ocurren los eventos anteriores y debe iniciarse un tratamiento sintomático de apoyo.
Glaucoma de ángulo cerrado
La dilatación pupilar que ocurre después del uso de muchos medicamentos antidepresivos, incluido REMERON 15 mg, puede desencadenar un ataque de ángulo cerrado en un paciente con ángulos anatómicamente estrechos que no tienen una iridectomía permeable.
Prolongación QT y Torsades de Pointes
El efecto de REMERON (mirtazapina) sobre el intervalo QTc se evaluó en un ensayo clínico aleatorizado con placebo y controles positivos (moxifloxacina) en el que participaron 54 voluntarios sanos utilizando un análisis de respuesta a la exposición. Este ensayo mostró una relación positiva entre las concentraciones de mirtazapina y la prolongación del intervalo QTc. Sin embargo, el grado de prolongación del intervalo QT observado con dosis de mirtazapina de 45 mg (terapéuticas) y 75 mg (supraterapéuticas) no se encontraba en un nivel considerado clínicamente significativo. Durante el uso posterior a la comercialización de mirtazapina, se han notificado casos de prolongación del intervalo QT, Torsades de Pointes, taquicardia ventricular y muerte súbita (ver REACCIONES ADVERSAS ). La mayoría de los informes ocurrieron en asociación con sobredosis o en pacientes con otros factores de riesgo de prolongación del intervalo QT, incluido el uso concomitante de medicamentos que prolongan el intervalo QTc (ver INTERACCIONES CON LA DROGAS y SOBREDOSIS secciones). Se debe tener precaución cuando se prescriba REMERON a pacientes con enfermedad cardiovascular conocida o antecedentes familiares de prolongación del intervalo QT, y en uso concomitante con otros medicamentos que se cree que prolongan el intervalo QTc.
PRECAUCIONES
General
Síntomas de interrupción
Ha habido informes de reacciones adversas tras la interrupción de las tabletas de REMERON (mirtazapina) (particularmente cuando es abrupta), que incluyen, entre otras, las siguientes: mareos, sueños anormales, alteraciones sensoriales (incluidas parestesias y sensaciones de descargas eléctricas), agitación, ansiedad, fatiga, confusión, dolor de cabeza, temblores, náuseas, vómitos y sudoración, u otros síntomas que pueden tener importancia clínica. La mayoría de los casos notificados son leves y autolimitados. Aunque se han notificado como reacciones adversas, debe tenerse en cuenta que estos síntomas pueden estar relacionados con una enfermedad subyacente.
Los pacientes que actualmente toman REMERON NO deben suspender el tratamiento abruptamente, debido al riesgo de síntomas de suspensión. En el momento en que se toma la decisión médica de suspender el tratamiento con REMERON, se recomienda una reducción gradual de la dosis, en lugar de una suspensión abrupta.
Acatisia/inquietud psicomotora
El uso de antidepresivos se ha asociado con el desarrollo de acatisia, caracterizada por una inquietud subjetivamente desagradable o angustiosa y la necesidad de moverse, a menudo acompañada de una incapacidad para sentarse o permanecer quieto. Esto es más probable que ocurra dentro de las primeras semanas de tratamiento. En pacientes que desarrollan estos síntomas, el aumento de la dosis puede ser perjudicial.
hiponatremia
Muy raramente se ha informado hiponatremia con el uso de mirtazapina. Se debe tener precaución en pacientes de riesgo, como pacientes de edad avanzada o pacientes tratados concomitantemente con medicamentos que se sabe que causan hiponatremia.
Somnolencia
En estudios controlados en EE. UU., se notificó somnolencia en el 54 % de los pacientes tratados con REMERON (mirtazapina) en tabletas, en comparación con el 18 % con placebo y el 60 % con amitriptilina. En estos estudios, la somnolencia provocó la interrupción del tratamiento en el 10,4 % de los pacientes tratados con REMERON, en comparación con el 2,2 % de los tratados con placebo. No está claro si se desarrolla o no tolerancia a los efectos somníferos de REMERON. Debido a los efectos potencialmente significativos de REMERON 30 mg sobre el deterioro del rendimiento, se debe advertir a los pacientes que no participen en actividades que requieran estar alerta hasta que hayan podido evaluar el efecto del fármaco en su propio rendimiento psicomotor (ver INFORMACIÓN DEL PACIENTE ).
Mareo
En estudios controlados en EE. UU., se informaron mareos en el 7 % de los pacientes tratados con REMERON, en comparación con el 3 % con placebo y el 14 % con amitriptilina. No está claro si se desarrolla o no tolerancia a los mareos observados en asociación con el uso de REMERON.
Aumento del apetito/ganancia de peso
En estudios controlados en EE. UU., se notificó un aumento del apetito en el 17 % de los pacientes tratados con REMERON 30 mg, en comparación con el 2 % con placebo y el 6 % con amitriptilina. En estos mismos ensayos, se informó un aumento de peso de ≥ 7 % del peso corporal en el 7,5 % de los pacientes tratados con mirtazapina, en comparación con el 0 % para el placebo y el 5,9 % para la amitriptilina. En un grupo de estudios previos a la comercialización en los EE. UU., que incluyeron a muchos pacientes para un tratamiento abierto a largo plazo, el 8 % de los pacientes que recibieron REMERON 30 mg interrumpieron el tratamiento debido al aumento de peso. En un ensayo clínico pediátrico de 8 semanas de duración con dosis de entre 15 y 45 mg/día, el 49 % de los pacientes tratados con REMERON tuvo un aumento de peso de al menos el 7 %, en comparación con el 5,7 % de los pacientes tratados con placebo (ver PRECAUCIONES : Uso pediátrico ).
Colesterol/Triglicéridos
En estudios controlados en EE. UU., se observaron aumentos de colesterol sin ayuno de ≥ 20 % por encima de los límites superiores normales en el 15 % de los pacientes tratados con REMERON 30 mg, en comparación con el 7 % con placebo y el 8 % con amitriptilina. En estos mismos estudios, se observaron aumentos de triglicéridos sin ayuno a ≥ 500 mg/dl en el 6 % de los pacientes tratados con mirtazapina, en comparación con el 3 % para el placebo y el 3 % para la amitriptilina.
Elevaciones de transaminasas
Se observaron elevaciones clínicamente significativas de ALT (SGPT) (≥ 3 veces el límite superior del rango normal) en el 2,0 % (8/424) de los pacientes expuestos a REMERON 30 mg en un grupo de ensayos controlados a corto plazo en EE. UU., en comparación con el 0,3 % (1/328) de pacientes con placebo y 2,0% (3/181) de pacientes con amitriptilina. La mayoría de estos pacientes con aumentos de ALT no desarrollaron signos o síntomas asociados con una función hepática comprometida. Mientras que algunos pacientes descontinuaron el tratamiento debido a los aumentos de ALT, en otros casos, los niveles de enzimas volvieron a la normalidad a pesar de continuar con el tratamiento con REMERON. REMERON debe utilizarse con precaución en pacientes con función hepática alterada (ver FARMACOLOGÍA CLÍNICA y DOSIFICACIÓN Y ADMINISTRACIÓN ).
Activación de manía/hipomanía
Se produjo manía/hipomanía en aproximadamente el 0,2 % (3/1299 pacientes) de los pacientes tratados con REMERON en estudios estadounidenses. Aunque la incidencia de manía/hipomanía fue muy baja durante el tratamiento con mirtazapina, debe usarse con precaución en pacientes con antecedentes de manía/hipomanía.
Embargo
En los ensayos clínicos previos a la comercialización, solo se informó 1 convulsión entre los 2796 pacientes estadounidenses y no estadounidenses tratados con REMERON. Sin embargo, no se han realizado estudios controlados en pacientes con antecedentes de convulsiones. Por lo tanto, se debe tener cuidado cuando se usa mirtazapina en estos pacientes.
Uso en pacientes con enfermedades concomitantes
La experiencia clínica con REMERON en pacientes con enfermedades sistémicas concomitantes es limitada. En consecuencia, se recomienda tener cuidado al prescribir mirtazapina a pacientes con enfermedades o condiciones que afectan el metabolismo o las respuestas hemodinámicas.
REMERON no se ha evaluado sistemáticamente ni se ha utilizado en una medida apreciable en pacientes con antecedentes recientes de infarto de miocardio u otra enfermedad cardíaca significativa. REMERON se asoció con hipotensión ortostática significativa en los primeros ensayos de farmacología clínica con voluntarios normales. La hipotensión ortostática se observó con poca frecuencia en ensayos clínicos con pacientes deprimidos. REMERON 15 mg debe usarse con precaución en pacientes con enfermedad cardiovascular o cerebrovascular conocida que podría exacerbarse por hipotensión (antecedentes de infarto de miocardio, angina o accidente cerebrovascular isquémico) y condiciones que predispondrían a los pacientes a la hipotensión (deshidratación, hipovolemia y tratamiento con antihipertensivos). medicamento).
El aclaramiento de mirtazapina disminuye en pacientes con insuficiencia renal moderada [tasa de filtración glomerular (TFG) = 11 - 39 ml/min/1,73 m²] y grave [TFG FARMACOLOGÍA CLÍNICA y DOSIFICACIÓN Y ADMINISTRACIÓN ).
Información para pacientes
Los prescriptores u otros profesionales de la salud deben informar a los pacientes, sus familias y sus cuidadores sobre los beneficios y riesgos asociados con el tratamiento con REMERON (mirtazapina) Tabletas y deben asesorarlos sobre su uso apropiado. Un paciente Guía de medicamentos sobre “Medicamentos antidepresivos, depresión y otras enfermedades mentales graves y pensamientos o acciones suicidas” está disponible para REMERON. El prescriptor o el profesional de la salud debe instruir a los pacientes, sus familias y sus cuidadores para que lean el Guía de medicamentos y debe ayudarlos a comprender su contenido. Los pacientes deben tener la oportunidad de discutir el contenido de la Guía de medicamentos para obtener respuestas a cualquier pregunta que puedan tener. El texto completo de la Guía de medicamentos se reproduce al final de este documento.
Se debe informar a los pacientes sobre los siguientes problemas y pedirles que alerten a su prescriptor si ocurren mientras toman REMERON.
Empeoramiento clínico y riesgo de suicidio
Se debe alentar a los pacientes, sus familias y sus cuidadores a estar alerta ante la aparición de ansiedad, agitación, ataques de pánico, insomnio, irritabilidad, hostilidad, agresividad, impulsividad, acatisia (inquietud psicomotora), hipomanía, manía, otros cambios inusuales en el comportamiento. , empeoramiento de la depresión e ideación suicida, especialmente al principio del tratamiento con antidepresivos y cuando la dosis se ajusta hacia arriba o hacia abajo. Se debe recomendar a las familias y cuidadores de los pacientes que estén atentos a la aparición de dichos síntomas en el día a día, ya que los cambios pueden ser abruptos. Dichos síntomas deben informarse al médico o al profesional de la salud del paciente, especialmente si son graves, de inicio repentino o no formaban parte de los síntomas que presentaba el paciente. Síntomas como estos pueden estar asociados con un mayor riesgo de pensamientos y conductas suicidas e indican la necesidad de un control muy estricto y posiblemente cambios en la medicación.
agranulocitosis
Se debe advertir a los pacientes que van a recibir REMERON sobre el riesgo de desarrollar agranulocitosis. Se debe advertir a los pacientes que se comuniquen con su médico si experimentan algún indicio de infección, como fiebre, escalofríos, dolor de garganta, ulceración de la membrana mucosa u otros posibles signos de infección. Se debe prestar especial atención a cualquier queja similar a la gripe u otros síntomas que puedan sugerir una infección.
Interferencia con el rendimiento cognitivo y motor
REMERON 15 mg puede afectar el juicio, el pensamiento y, en particular, las habilidades motoras, debido a su prominente efecto sedante. La somnolencia asociada con el uso de mirtazapina puede afectar la capacidad del paciente para conducir, usar máquinas o realizar tareas que requieran estar alerta. Por lo tanto, se debe advertir a los pacientes sobre la participación en actividades peligrosas hasta que estén razonablemente seguros de que la terapia con REMERON no afecta negativamente su capacidad para realizar dichas actividades.
Completar el curso de terapia
Si bien los pacientes pueden notar una mejoría con la terapia de 15 mg de REMERON en 1 a 4 semanas, se les debe recomendar que continúen la terapia según las indicaciones.
Medicación concomitante
Se debe advertir a los pacientes que informen a su médico si están tomando o tienen la intención de tomar algún medicamento recetado o de venta libre, ya que existe la posibilidad de que REMERON interactúe con otros medicamentos.
Se debe informar a los pacientes sobre un posible aumento del riesgo de síndrome serotoninérgico si está clínicamente justificado el uso concomitante de REMERON 15 mg con otros medicamentos serotoninérgicos, incluidos triptanos, antidepresivos tricíclicos, fentanilo, litio, tramadol, buspirona, triptófano y hierba de San Juan. particularmente durante el inicio del tratamiento y los aumentos de dosis.
Alcohol
Se ha demostrado que el deterioro de las habilidades cognitivas y motoras producido por REMERON es aditivo con el producido por el alcohol. En consecuencia, se debe advertir a los pacientes que eviten el alcohol mientras toman mirtazapina.
El embarazo
Se debe advertir a las pacientes que notifiquen a su médico si quedan embarazadas o tienen la intención de quedar embarazadas durante la terapia con REMERON.
Enfermería
Se debe advertir a los pacientes que notifiquen a su médico si están amamantando a un bebé.
Pruebas de laboratorio
No se recomiendan pruebas de laboratorio de rutina.
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Carcinogénesis
Se realizaron estudios de carcinogenicidad con mirtazapina administrada en la dieta en dosis de 2, 20 y 200 mg/kg/día a ratones y 2, 20 y 60 mg/kg/día a ratas. Las dosis más altas utilizadas son aproximadamente 20 y 12 veces la dosis humana máxima recomendada (MRHD) de 45 mg/día sobre una base de mg/m² en ratones y ratas, respectivamente. Hubo una mayor incidencia de adenoma y carcinoma hepatocelular en ratones macho con la dosis alta. En ratas, hubo un aumento de adenoma hepatocelular en las hembras con las dosis medias y altas y de tumores hepatocelulares y adenoma/cistoadenoma y carcinoma folicular tiroideo en los machos con la dosis alta. Los datos sugieren que los efectos anteriores posiblemente podrían estar mediados por mecanismos no genotóxicos, cuya relevancia para los seres humanos se desconoce.
Es posible que las dosis utilizadas en el estudio con ratones no hayan sido lo suficientemente altas para caracterizar completamente el potencial carcinogénico de las tabletas de REMERON (mirtazapina).
mutagénesis
La mirtazapina no fue mutagénica ni clastogénica y no indujo daños generales en el ADN según lo determinado en varias pruebas de genotoxicidad: prueba de Ames, ensayo de mutación genética in vitro en células V 79 de hámster chino, ensayo de intercambio de cromátidas hermanas in vitro en linfocitos de conejo cultivados, médula ósea in vivo prueba de micronúcleos en ratas y ensayo de síntesis de ADN no programado en células HeLa.
Deterioro de la fertilidad
En un estudio de fertilidad en ratas, la mirtazapina se administró en dosis de hasta 100 mg/kg [20 veces la dosis máxima recomendada en humanos (DMRH) en mg/m2]. El fármaco no afectó el apareamiento ni la concepción, pero el ciclo estral se interrumpió con dosis 3 o más veces superiores a la MRHD, y se produjeron pérdidas previas a la implantación con 20 veces la MRHD.
El embarazo
Efectos teratogénicos
Embarazo Categoría C
Los estudios de reproducción en ratas y conejas preñadas en dosis de hasta 100 mg/kg y 40 mg/kg, respectivamente [20 y 17 veces la dosis máxima recomendada en humanos (MRHD) en mg/m², respectivamente], no han revelado evidencia de efectos teratogénicos. Sin embargo, en ratas, hubo un aumento en las pérdidas posteriores a la implantación en las madres tratadas con mirtazapina. Hubo un aumento en las muertes de crías durante los primeros 3 días de lactancia y una disminución en el peso de las crías al nacer. Se desconoce la causa de estas muertes. Los efectos ocurrieron en dosis que eran 20 veces la MRHD, pero no 3 veces la MRHD, sobre una base de mg/m². No existen estudios adecuados y bien controlados en mujeres embarazadas. Debido a que los estudios de reproducción en animales no siempre predicen la respuesta humana, este medicamento debe usarse durante el embarazo solo si es claramente necesario.
Madres lactantes
Debido a que parte de REMERON puede excretarse en la leche materna, se debe tener precaución cuando se administren tabletas de REMERON (mirtazapina) a mujeres lactantes.
Uso pediátrico
No se ha establecido la seguridad y eficacia en la población pediátrica (ver ADVERTENCIA EN CAJA y ADVERTENCIAS : Empeoramiento clínico y riesgo de suicidio ). Se realizaron dos ensayos controlados con placebo en 258 pacientes pediátricos con MDD con las tabletas de REMERON (mirtazapina), y los datos no fueron suficientes para respaldar una declaración de uso en pacientes pediátricos. Cualquiera que esté considerando el uso de REMERON 30 mg en un niño o adolescente debe sopesar los riesgos potenciales con la necesidad clínica.
En un ensayo clínico pediátrico de 8 semanas de duración con dosis de entre 15 y 45 mg/día, el 49 % de los pacientes tratados con REMERON tuvo un aumento de peso de al menos el 7 %, en comparación con el 5,7 % de los pacientes tratados con placebo. El aumento medio de peso fue de 4 kg (2 kg SD) para los pacientes tratados con REMERON versus 1 kg (2 kg SD) para los pacientes tratados con placebo (ver PRECAUCIONES : Aumento del apetito/ganancia de peso ).
Uso geriátrico
Aproximadamente 190 personas de edad avanzada (≥ 65 años de edad) participaron en estudios clínicos con tabletas de REMERON (mirtazapina). Se sabe que este fármaco se excreta sustancialmente por vía renal (75 %), y el riesgo de disminución de la depuración de este fármaco es mayor en pacientes con insuficiencia renal. Debido a que es más probable que los pacientes de edad avanzada tengan una función renal disminuida, se debe tener cuidado al seleccionar la dosis. Los fármacos sedantes pueden causar confusión y exceso de sedación en los ancianos. En este grupo no se identificaron fenómenos adversos inusuales relacionados con la edad. Los estudios farmacocinéticos revelaron una disminución del aclaramiento en los ancianos. Se recomienda precaución al administrar REMERON a pacientes de edad avanzada (ver FARMACOLOGÍA CLÍNICA y DOSIFICACIÓN Y ADMINISTRACIÓN ).
SOBREDOSIS
Experiencia humana
Existe una experiencia muy limitada con la sobredosis de comprimidos de REMERON (mirtazapina). En estudios clínicos previos a la comercialización, hubo 8 informes de sobredosis de REMERON solo o en combinación con otros agentes farmacológicos. La única muerte por sobredosis de drogas informada mientras tomaba REMERON fue en combinación con amitriptilina y clorprotixeno en un estudio clínico fuera de los EE. UU. Según los niveles plasmáticos, la dosis de 15 mg de REMERON tomada fue de 30 a 45 mg, mientras que los niveles plasmáticos de amitriptilina y clorprotixeno se encontraron en niveles tóxicos. Todos los demás casos de sobredosis previos a la comercialización dieron como resultado una recuperación total. Los signos y síntomas informados en relación con la sobredosis incluyeron desorientación, somnolencia, deterioro de la memoria y taquicardia. No hubo informes de anomalías en el ECG, coma o convulsiones después de una sobredosis con REMERON solo.
Sin embargo, según los informes posteriores a la comercialización, existe la posibilidad de resultados más graves (incluidas las muertes) con dosis mucho más altas que la dosis terapéutica, especialmente con sobredosis mixtas. En estos casos, también se han informado prolongación del intervalo QT y Torsades de Pointes (ver INTERACCIONES CON LA DROGAS y REACCIONES ADVERSAS secciones).
Manejo de sobredosis
El tratamiento debe consistir en aquellas medidas generales empleadas en el manejo de la sobredosis con cualquier fármaco eficaz en el tratamiento del trastorno depresivo mayor. Asegurar una adecuada vía aérea, oxigenación y ventilación. Controle los parámetros de ECG (incluido el ritmo cardíaco) y los signos vitales. También se recomiendan medidas generales de apoyo y sintomáticas. No se recomienda la inducción de emesis. El lavado gástrico con una sonda orogástrica de gran calibre con protección adecuada de las vías respiratorias, si es necesario, puede estar indicado si se realiza poco después de la ingestión o en pacientes sintomáticos. Se debe administrar carbón activado. No hay experiencia con el uso de diuresis forzada, diálisis, hemoperfusión o exanguinotransfusión en el tratamiento de la sobredosis de mirtazapina. No se conocen antídotos específicos para la mirtazapina.
En el manejo de la sobredosis, considere la posibilidad de que participen múltiples fármacos. El médico debe considerar comunicarse con un centro de control de intoxicaciones para obtener información adicional sobre el tratamiento de cualquier sobredosis. Los números de teléfono de los centros de control de envenenamiento certificados se encuentran en la Referencia del escritorio de los médicos (PDR).
CONTRAINDICACIONES
Hipersensibilidad
Las tabletas de REMERON (mirtazapina) están contraindicadas en pacientes con hipersensibilidad conocida a la mirtazapina oa cualquiera de los excipientes.
Inhibidores de la monoaminooxidasa
El uso de inhibidores de la monoaminooxidasa (IMAO) destinados a tratar trastornos psiquiátricos con REMERON 15 mg comprimidos o dentro de los 14 días posteriores a la interrupción del tratamiento con REMERON 15 mg está contraindicado debido a un mayor riesgo de síndrome serotoninérgico. También está contraindicado el uso de REMERON 15 mg dentro de los 14 días posteriores a la interrupción de un IMAO destinado a tratar trastornos psiquiátricos (ver ADVERTENCIAS y DOSIFICACIÓN Y ADMINISTRACIÓN ).
También está contraindicado iniciar REMERON en un paciente que está siendo tratado con IMAO como linezolid o azul de metileno intravenoso debido a un mayor riesgo de síndrome serotoninérgico (ver ADVERTENCIAS y DOSIFICACIÓN Y ADMINISTRACIÓN ).
FARMACOLOGÍA CLÍNICA
Farmacodinámica
Se desconoce el mecanismo de acción de las tabletas de REMERON (mirtazapina), al igual que con otros medicamentos efectivos en el tratamiento del trastorno depresivo mayor.
La evidencia recopilada en estudios preclínicos sugiere que la mirtazapina aumenta la actividad noradrenérgica y serotoninérgica central. Estos estudios han demostrado que la mirtazapina actúa como un antagonista de los autorreceptores y heterorreceptores inhibidores adrenérgicos α2 presinápticos centrales, una acción que se postula que resulta en un aumento de la actividad noradrenérgica y serotoninérgica central.
La mirtazapina es un potente antagonista de los receptores 5-HT2 y 5-HT3. La mirtazapina no tiene afinidad significativa por los receptores 5-HT1A y 5-HT1B.
La mirtazapina es un potente antagonista de los receptores de histamina (H1), una propiedad que puede explicar sus prominentes efectos sedantes.
La mirtazapina es un antagonista adrenérgico α periférico moderado, una propiedad que puede explicar la hipotensión ortostática ocasional reportada en asociación con su uso.
La mirtazapina es un antagonista moderado de los receptores muscarínicos, una propiedad que puede explicar la incidencia relativamente baja de efectos secundarios anticolinérgicos asociados con su uso.
Farmacocinética
Las tabletas de REMERON (mirtazapina) se absorben rápida y completamente después de la administración oral y tienen una vida media de aproximadamente 20 a 40 horas. Las concentraciones plasmáticas máximas se alcanzan en aproximadamente 2 horas después de una dosis oral. La presencia de alimentos en el estómago tiene un efecto mínimo tanto en la velocidad como en el grado de absorción y no requiere un ajuste de dosis.
La mirtazapina se metaboliza ampliamente después de la administración oral. Las principales vías de biotransformación son la desmetilación y la hidroxilación, seguidas de la conjugación con glucurónido. Los datos in vitro de microsomas hepáticos humanos indican que los citocromos 2D6 y 1A2 están implicados en la formación del metabolito 8-hidroxi de la mirtazapina, mientras que se considera que el citocromo 3A es responsable de la formación de los metabolitos N-desmetil y N-óxido. La mirtazapina tiene una biodisponibilidad absoluta de alrededor del 50%. Se elimina predominantemente por la orina (75%) con un 15% en las heces. Varios metabolitos no conjugados poseen actividad farmacológica pero están presentes en el plasma a niveles muy bajos. El enantiómero (-) tiene una vida media de eliminación que es aproximadamente el doble que el enantiómero (+) y, por lo tanto, alcanza niveles plasmáticos que son aproximadamente 3 veces más altos que los del enantiómero (+).
Los niveles plasmáticos están linealmente relacionados con la dosis en un rango de dosis de 15 a 80 mg. La vida media de eliminación media de la mirtazapina después de la administración oral varía de aproximadamente 20 a 40 horas en todos los subgrupos de edad y sexo, y las mujeres de todas las edades muestran vidas medias de eliminación significativamente más largas que los hombres (vida media media de 37 horas para mujeres frente a 26 horas). para hombres). Los niveles plasmáticos de mirtazapina en estado estacionario se alcanzan en 5 días, con una acumulación de alrededor del 50 % (proporción de acumulación = 1,5).
La mirtazapina se une aproximadamente en un 85 % a las proteínas plasmáticas en un rango de concentración de 0,01 a 10 mcg/ml.
Poblaciones Especiales
geriátrico
Después de la administración oral de tabletas de REMERON (mirtazapina) de 20 mg/día durante 7 días a sujetos de diferentes edades (rango, 25 - 74), la depuración oral de mirtazapina se redujo en los ancianos en comparación con los sujetos más jóvenes. Las diferencias fueron más notables en los hombres, con un aclaramiento un 40 % menor en los hombres de edad avanzada en comparación con los hombres más jóvenes, mientras que el aclaramiento en las mujeres de edad avanzada fue solo un 10 % menor en comparación con las mujeres más jóvenes. Se recomienda precaución al administrar REMERON 30 mg a pacientes de edad avanzada (ver PRECAUCIONES y DOSIFICACIÓN Y ADMINISTRACIÓN ).
Pediatría
No se ha establecido la seguridad y eficacia de mirtazapina en la población pediátrica (ver PRECAUCIONES ).
Género
La vida media de eliminación media de la mirtazapina después de la administración oral oscila entre aproximadamente 20 y 40 horas en todos los subgrupos de edad y sexo, y las mujeres de todas las edades muestran vidas medias de eliminación significativamente más largas que los hombres (vida media media de 37 horas para mujeres vs. 26 horas para hombres) (ver Farmacocinética ).
La raza
No se han realizado estudios clínicos para evaluar el efecto de la raza en la farmacocinética de REMERON.
Insuficiencia renal
Se estudió la disposición de mirtazapina en pacientes con diversos grados de función renal. La eliminación de mirtazapina se correlaciona con el aclaramiento de creatinina. El aclaramiento corporal total de mirtazapina se redujo aproximadamente un 30 % en pacientes con insuficiencia renal moderada (Clcr=11 - 39 ml/min/1,73 m²) y aproximadamente un 50 % en pacientes con insuficiencia renal grave (Clcr= PRECAUCIONES y DOSIFICACIÓN Y ADMINISTRACIÓN ).
insuficiencia hepática
Después de una dosis oral única de 15 mg de REMERON, el aclaramiento oral de mirtazapina disminuyó aproximadamente un 30 % en pacientes con insuficiencia hepática en comparación con sujetos con función hepática normal. Se recomienda precaución al administrar REMERON a pacientes con función hepática comprometida (ver PRECAUCIONES y DOSIFICACIÓN Y ADMINISTRACIÓN ).
Ensayos clínicos que muestran eficacia
La eficacia de las tabletas de REMERON (mirtazapina) como tratamiento para el trastorno depresivo mayor se estableció en 4 ensayos controlados con placebo de 6 semanas en pacientes adultos ambulatorios que cumplían con los criterios del DSM-III para el trastorno depresivo mayor. Los pacientes fueron titulados con mirtazapina desde un rango de dosis de 5 mg hasta 35 mg/día. En general, estos estudios demostraron que la mirtazapina es superior al placebo en al menos 3 de las siguientes 4 medidas: puntaje total de la escala de calificación de depresión de Hamilton (HDRS) de 21 ítems; Elemento de estado de ánimo depresivo HDRS; puntuación de gravedad CGI; y Montgomery and Asberg Depression Rating Scale (MADRS). También se encontró superioridad de la mirtazapina sobre el placebo para ciertos factores de la HDRS, incluido el factor de ansiedad/somatización y el factor de alteración del sueño. La dosis media de mirtazapina para los pacientes que completaron estos 4 estudios osciló entre 21 y 32 mg/día. Un quinto estudio de diseño similar utilizó una dosis más alta (hasta 50 mg) por día y también mostró efectividad.
El examen de los subconjuntos de edad y género de la población no reveló ninguna sensibilidad diferencial sobre la base de estos subgrupos.
En un estudio a más largo plazo, los pacientes que cumplían con los criterios (DSM-IV) para el trastorno depresivo mayor que habían respondido durante un período inicial de 8 a 12 semanas de tratamiento agudo con REMERON 30 mg fueron asignados al azar para continuar con REMERON 15 mg o placebo durante un máximo de 40 semanas. observación de recaídas. La respuesta durante la fase abierta se definió como haber logrado una puntuación total de HAM-D 17 de ≤ 8 y una puntuación de mejora CGI de 1 o 2 en 2 visitas consecutivas a partir de la semana 6 de las 8 a 12 semanas en la fase abierta de El estudio. Los investigadores individuales determinaron la recaída durante la fase doble ciego. Los pacientes que recibieron tratamiento continuo con REMERON de 30 mg experimentaron tasas de recaída significativamente más bajas durante las siguientes 40 semanas en comparación con los que recibieron placebo. Este patrón se demostró tanto en pacientes masculinos como femeninos.
INFORMACIÓN DEL PACIENTE
REMERON® (rem' - e - ron) (mirtazapina) Comprimidos
¿Cuál es la información más importante que debo saber sobre REMERON®?
REMERON 15 mg y otros medicamentos antidepresivos pueden causar efectos secundarios graves, que incluyen:
1. Pensamientos o acciones suicidas:
- REMERON 30 mg y otros medicamentos antidepresivos pueden aumentar los pensamientos o acciones suicidas en algunos niños, adolescentes o adultos jóvenes durante los primeros meses de tratamiento o cuando se cambia la dosis.
- La depresión u otras enfermedades mentales graves son las causas más importantes de pensamientos o acciones suicidas.
- Esté atento a estos cambios y llame a su proveedor de atención médica de inmediato si nota:
- Cambios nuevos o repentinos en el estado de ánimo, el comportamiento, las acciones, los pensamientos o los sentimientos, especialmente si son graves.
- Preste especial atención a tales cambios cuando se inicia REMERON o cuando se cambia la dosis.
Mantenga todas las visitas de seguimiento con su proveedor de atención médica y llame entre visitas si le preocupan los síntomas.
Llame a su proveedor de atención médica de inmediato si tiene alguno de los siguientes síntomas, o llame al 911 en caso de emergencia, especialmente si son nuevos, empeoran o le preocupan:
- intentos de suicidio
- actuando sobre impulsos peligrosos
- actuando agresivo o violento
- pensamientos sobre el suicidio o la muerte
- depresión nueva o peor
- nuevos o peores ataques de ansiedad o pánico
- sentirse agitado, inquieto, enojado o irritable
- problemas para dormir
- un aumento en la actividad o hablar más de lo normal para usted
- otros cambios inusuales en el comportamiento o el estado de ánimo
Llame a su proveedor de atención médica de inmediato si tiene alguno de los siguientes síntomas, o llame al 911 si es una emergencia. REMERON puede estar asociado con estos efectos secundarios graves:
2. Episodios maníacos:
- gran aumento de energía
- comportamiento temerario
- hablando más o más rápido de lo habitual
- problemas severos para dormir
- ideas inusualmente grandiosas
- pensamientos acelerados
- felicidad excesiva o irritabilidad
3. Disminución de glóbulos blancos llamados neutrófilos, que son necesarios para combatir las infecciones. Informe a su médico si tiene algún indicio de infección, como fiebre, escalofríos, dolor de garganta o llagas en la boca o la nariz, especialmente síntomas similares a los de la gripe.
4. Síndrome serotoninérgico. Esta condición puede poner en peligro la vida y puede incluir:
- agitación, alucinaciones, coma u otros cambios en el estado mental
- latidos cardíacos acelerados, presión arterial alta o baja
- náuseas, vómitos o diarrea
- problemas de coordinación o espasmos musculares (reflejos hiperactivos)
- sudoración o fiebre
- rigidez muscular
5. Problemas visuales
- dolor de ojo
- cambios en la visión
- hinchazón o enrojecimiento en o alrededor del ojo
Solo algunas personas corren el riesgo de tener estos problemas. Es posible que desee someterse a un examen de la vista para ver si está en riesgo y recibir tratamiento preventivo si lo está.
6. Convulsiones
7. Niveles bajos de sal (sodio) en la sangre.
Las personas mayores pueden estar en mayor riesgo de esto. Los síntomas pueden incluir:
- dolor de cabeza
- confusión, problemas para concentrarse o pensar o problemas de memoria
- debilidad o sensación de inestabilidad
8. Somnolencia. lo mejor es tomar REMERÓN cerca de la hora de acostarse.
9. Reacciones cutáneas graves: Llame a su médico de inmediato si tiene alguno o todos los siguientes síntomas:
- erupción cutánea grave con hinchazón de la piel (incluso en las palmas de las manos y las plantas de los pies)
- enrojecimiento doloroso de la piel, ampollas o úlceras en el cuerpo o en la boca
10. Reacciones alérgicas graves: dificultad para respirar, hinchazón de la cara, lengua, ojos o boca
- sarpullido, ronchas que pican (urticaria) o ampollas, solo o con fiebre o dolor en las articulaciones
11. Aumentos en el apetito o el peso. A los niños y adolescentes se les debe controlar la altura y el peso durante el tratamiento.
12. Aumento de los niveles de colesterol y triglicéridos en sangre
No deje de tomar REMERON 15 mg sin antes hablar con su proveedor de atención médica. Dejar de tomar REMERON 15 mg demasiado rápido puede causar síntomas potencialmente graves que incluyen:
- mareo
- fatiga
- sensación de hormigueo
- sueños anormales
- confusión
- náuseas vómitos
- agitación
- dolor de cabeza
- transpiración
- ansiedad
- sacudida
¿Qué es REMERON 15mg?
REMERON 15 mg es un medicamento recetado que se usa para tratar la depresión. Es importante hablar con su proveedor de atención médica sobre los riesgos de tratar la depresión y también los riesgos de no tratarla. Debe analizar todas las opciones de tratamiento con su proveedor de atención médica.
Hable con su proveedor de atención médica si no cree que su condición esté mejorando con el tratamiento con REMERON.
¿Quién no debe tomar REMERON 15mg?
No tome REMERON:
- si es alérgico a la mirtazapina o a cualquiera de los componentes de REMERON. Consulte el final de esta Guía del medicamento para obtener una lista completa de los ingredientes de REMERON.
- si toma un inhibidor de la monoaminooxidasa (IMAO). Pregúntele a su proveedor de atención médica o farmacéutico si no está seguro si está tomando un IMAO, incluido el antibiótico linezolid.
- No tome un IMAO dentro de las 2 semanas posteriores a la suspensión de REMERON, a menos que su proveedor de atención médica se lo indique.
- No comience con REMERON si dejó de tomar un IMAO en las últimas 2 semanas, a menos que su proveedor de atención médica se lo indique.
Las personas que toman REMERON 15 mg casi al mismo tiempo que un IMAO pueden tener efectos secundarios graves o incluso potencialmente mortales. Obtenga ayuda médica de inmediato si tiene alguno de estos síntomas:
- fiebre alta
- cambios rápidos en la frecuencia cardíaca o la presión arterial
- espasmos musculares incontrolables
- confusión
- músculos rígidos
- pérdida del conocimiento (desmayo)
¿Qué debo decirle a mi proveedor de atención médica antes de tomar REMERON?
Antes de tomar REMERON, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si usted:
- están tomando ciertos medicamentos como:
- Triptanos utilizados para tratar la migraña
- Medicamentos utilizados para tratar el estado de ánimo, la ansiedad, los trastornos psicóticos o del pensamiento, incluidos los tricíclicos, el litio, los ISRS, los IRSN o los antipsicóticos
- Tramadol utilizado para tratar el dolor.
- Suplementos de venta libre como triptófano o hierba de San Juan
- Fenitoína, carbamazepina o rifampicina (estos medicamentos pueden disminuir su nivel sanguíneo de REMERON)
- Cimetidina o ketoconazol (estos medicamentos pueden aumentar su nivel sanguíneo de REMERON)
- Medicamentos que pueden afectar el ritmo cardíaco (como ciertos antibióticos y algunos antipsicóticos)
- tener o tener:
- problemas hepáticos
- problemas de riñon
- problemas cardíacos o ciertas condiciones que pueden cambiar su ritmo cardíaco
- ataques o convulsiones
- trastorno bipolar o manía
- una tendencia a marearse o desmayarse
- está embarazada o planea quedar embarazada. No se sabe si REMERON dañará a su bebé por nacer. Hable con su proveedor de atención médica sobre los beneficios y riesgos de tratar la depresión durante el embarazo
- están amamantando o planean amamantar. Parte de REMERON puede pasar a la leche materna. Hable con su proveedor de atención médica sobre la mejor manera de alimentar a su bebé mientras toma REMERON
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos a base de hierbas. REMERON y algunos medicamentos pueden interactuar entre sí, pueden no funcionar tan bien o pueden causar efectos secundarios graves.
Su proveedor de atención médica o farmacéutico puede decirle si es seguro tomar REMERON 15 mg con sus otros medicamentos. No comience ni suspenda ningún medicamento mientras toma REMERON sin hablar primero con su proveedor de atención médica. Si toma REMERON 30 mg, no debe tomar ningún otro medicamento que contenga mirtazapina, incluido REMERON 30 mg SolTab®.
¿Cómo debo tomar REMERON?
- Tome REMERON exactamente como se lo recetaron. Es posible que su proveedor de atención médica deba cambiar la dosis de REMERON 15 mg hasta que sea la dosis adecuada para usted.
- Tome REMERON a la misma hora todos los días, preferiblemente por la noche antes de acostarse.
- Trague REMERON 15 mg según las indicaciones.
- Es común que los medicamentos antidepresivos como REMERON tarden unas pocas semanas antes de que comience a sentirse mejor. No deje de tomar REMERON 15 mg si no siente los resultados de inmediato.
- No deje de tomar ni cambie la dosis de REMERON 15 mg sin antes consultar con su médico, incluso si se siente mejor.
- REMERON puede tomarse con o sin alimentos.
- Si olvida una dosis de REMERON 30 mg, tome la dosis olvidada tan pronto como lo recuerde. Si es casi la hora de la próxima dosis, omita la dosis olvidada y tome la siguiente dosis a la hora habitual. No tome dos dosis de REMERON 15 mg al mismo tiempo.
- Si toma demasiado REMERON 15 mg, llame a su proveedor de atención médica o al centro de control de envenenamiento de inmediato, u obtenga tratamiento de emergencia. Los signos de una sobredosis de REMERON (sin otros medicamentos ni alcohol) incluyen:
- confusión,
- problemas de memoria
- somnolencia
- aumento del ritmo cardíaco.
Los síntomas de una posible sobredosis pueden incluir cambios en el ritmo cardíaco (latidos cardíacos rápidos e irregulares) o desmayos, que podrían ser síntomas de una afección potencialmente mortal conocida como Torsades de Pointes.
¿Qué debo evitar mientras tomo REMERON 15mg?
- REMERON puede causar somnolencia o puede afectar su capacidad para tomar decisiones, pensar con claridad o reaccionar rápidamente. No debe conducir, operar maquinaria pesada ni realizar otras actividades peligrosas hasta que sepa cómo le afecta REMERON.
- Evite beber alcohol o tomar diazepam (un medicamento que se usa para la ansiedad, el insomnio y las convulsiones, por ejemplo) o medicamentos similares mientras toma REMERON. Si no está seguro de si ciertos medicamentos se pueden tomar con REMERON 30 mg, hable con su médico.
¿Cuáles son los posibles efectos secundarios de REMERON?
REMERON puede causar efectos secundarios graves:
- Consulte "¿Cuál es la información más importante que debo saber sobre REMERON?"
Los efectos secundarios más comunes de REMERON incluyen:
- somnolencia
- estreñimiento
- Apetito incrementado
- mareo
- aumento de peso
- boca seca sueños anormales
Estos no son todos los posibles efectos secundarios de REMERON.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar REMERON?
- Guarde REMERON 15 mg a temperatura ambiente, entre 20 °C y 25 °C (68 °F y 77 °F).
- Mantenga REMERON 15 mg alejado de la luz.
- Mantenga el frasco de REMERON de 30 mg bien cerrado.
Mantenga REMERON 30 mg y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de REMERON.
veces, los medicamentos se recetan para fines distintos a los enumerados en la Guía del medicamento. No use REMERON 15 mg para una condición para la cual no fue recetado. No le dé REMERON a otras personas, incluso si tienen los mismos síntomas que usted tiene. Puede que les haga daño. Puede pedirle a su farmacéutico o proveedor de atención médica información sobre REMERON 30 mg que está escrita para profesionales de la salud.
¿Cuáles son los ingredientes de REMERON 15mg?
Ingrediente activo: mirtazapina
Ingredientes inactivos :
- Comprimidos de 15 mg: Almidón (maíz), hidroxipropilcelulosa, estearato de magnesio, dióxido de silicio coloidal, lactosa, hipromelosa, polietilenglicol 8000, dióxido de titanio, óxido férrico (amarillo).
- Comprimidos de 30 mg: Almidón (maíz), hidroxipropilcelulosa, estearato de magnesio, dióxido de silicio coloidal, lactosa, hipromelosa, polietilenglicol 8000, dióxido de titanio, óxido férrico (amarillo), óxido férrico (rojo).
- Comprimidos de 45 mg: Almidón (maíz), hidroxipropilcelulosa, estearato de magnesio, dióxido de silicio coloidal, lactosa, hipromelosa, polietilenglicol 8000, dióxido de titanio.
