Augmentin 250/125mg, 500/125mg, 750/250mg, 875/125mg Clavulanate Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Augmentin 875 mg y cómo se usa?
Augmentin 250 mg es un medicamento recetado que se usa para tratar los síntomas de muchas infecciones diferentes causadas por bacterias, como infecciones del tracto respiratorio inferior, enfermedad pulmonar obstructiva crónica, sinusitis bacteriana, heridas por mordeduras de animales/humanos e infecciones de la piel. Augmentin 125 mg se puede usar solo o con otros medicamentos.
- Augmentin es una penicilina, Amino.
¿Cuáles son los posibles efectos secundarios de Augmentin?
Augmentin 750 mg puede causar efectos secundarios graves, que incluyen:
- dolor de estómago severo,
- diarrea acuosa o con sangre,
- piel pálida o amarillenta,
- orina de color oscuro,
- fiebre,
- confusión,
- debilidad,
- pérdida de apetito,
- dolor de estómago superior,
- coloración amarillenta de la piel o los ojos (ictericia),
- moretones o sangrado fácil,
- orinar poco o nada,
- dolor de garganta,
- hinchazón en la cara o la lengua,
- ardiendo en tus ojos,
- dolor en la piel seguido de una erupción roja o morada que se extiende (en la cara o la parte superior del cuerpo) con ampollas y descamación
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Augmentin incluyen:
- náuseas,
- Diarrea,
- picazón o secreción vaginal,
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Augmentin. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
AUGMENTIN 500 mg es una combinación antibacteriana oral que consiste en amoxicilina y el inhibidor de betalactamasas, clavulanato de potasio (la sal de potasio del ácido clavulánico).
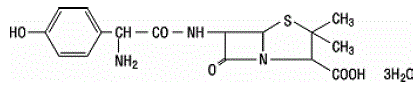
La amoxicilina es un análogo de la ampicilina, derivado del núcleo básico de la penicilina, el ácido 6 aminopenicilánico. La fórmula molecular de la amoxicilina es C16H19N3O5S•3H2O y el peso molecular es 419,46. Químicamente, la amoxicilina es (2S,5R,6R)-6-[(R)-(-)-2-Amino-2-(p-hidroxifenil)acetamido]-3,3-dimetil-7-oxo-4-tia -1-azabiciclo[3.2.0]heptano-2-ácido carboxílico trihidrato y puede representarse estructuralmente como:
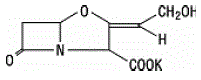
El ácido clavulánico se produce por la fermentación de Streptomyces clavuligerus. Es un betalactámico estructuralmente relacionado con las penicilinas y posee la capacidad de inactivar algunas betalactamasas al bloquear los sitios activos de estas enzimas. La fórmula molecular del clavulanato de potasio es C8H8KNO5 y el peso molecular es 237,25. Químicamente, el clavulanato de potasio es (Z)(2R,5R)-3-(2-hidroxietilideno)-7-oxo-4-oxa-1-azabiciclo[3.2.0]-heptano-2-carboxilato de potasio y puede representarse estructuralmente como:
ingredientes inactivos
- Tabletas: dióxido de silicio coloidal, hipromelosa, estearato de magnesio, celulosa microcristalina, polietilenglicol, glicolato de almidón de sodio y dióxido de titanio. Cada comprimido de AUGMENTIN contiene 0,63 mEq de potasio.
- Polvo para suspensión oral: dióxido de silicio coloidal, saborizantes, goma xantana y uno o más de los siguientes: hipromelosa, manitol, gel de sílice, dióxido de silicio, ácido succínico, sacarina sódica y aspartamo. [ver ADVERTENCIAS Y PRECAUCIONES ]
- Tabletas masticables: dióxido de silicio coloidal, saborizantes, estearato de magnesio, manitol y uno o más de los siguientes: D&C Yellow No. 10, FD&C Red No. 40, glicina, sacarina de sodio y aspartamo. [ver ADVERTENCIAS Y PRECAUCIONES]
- Cada comprimido masticable de 125 mg y cada 5 ml de suspensión oral reconstituida de 125/5 ml de AUGMENTIN 750 mg contiene 0,16 mEq de potasio
- Cada comprimido masticable de 250 mg y cada 5 ml de suspensión oral reconstituida de 250/5 ml de AUGMENTIN contiene 0,32 mEq de potasio
- Cada comprimido masticable de 200 mg y cada 5 ml de suspensión oral reconstituida de 200/5 ml de AUGMENTIN contiene 0,14 mEq de potasio
- Cada comprimido masticable de 400 mg y cada 5 ml de suspensión oral reconstituida de 400/5 ml de AUGMENTIN 500 mg contiene 0,29 mEq de potasio
INDICACIONES
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de AUGMENTIN (amoxicilina/clavulanato de potasio) y otros medicamentos antibacterianos, AUGMENTIN 500 mg debe usarse solo para tratar infecciones que se compruebe o se sospeche que son causadas por bacterias susceptibles. Cuando la información de cultivo y susceptibilidad esté disponible, se debe considerar al seleccionar o modificar la terapia antibacteriana. En ausencia de tales datos, la epidemiología local y los patrones de susceptibilidad pueden contribuir a la selección empírica de la terapia.
AUGMENTIN® es una combinación de antibacteriano de tipo penicilina e inhibidor de betalactamasa indicado en el tratamiento de infecciones debidas a aislados susceptibles de las bacterias designadas en las condiciones que se enumeran a continuación*:
Infecciones del tracto respiratorio inferior
Causada por aislamientos productores de betalactamasa de Haemophilus influenzae y Moraxella catarrhalis.
Otitis media bacteriana aguda
Provocada por aislamientos productores de betalactamasa de H. influenzae y M. catarrhalis.
Sinusitis
Provocada por aislamientos productores de betalactamasa de H. influenzae y M. catarrhalis.
Infecciones De La Piel Y De La Estructura De La Piel
Causada por aislamientos productores de betalactamasa de Staphylococcus aureus, Escherichia coli y especies de Klebsiella.
Infecciones del tracto urinario
Provocada por aislamientos productores de betalactamasa de E. coli, especies de Klebsiella y especies de Enterobacter.
Limitaciones de uso
Cuando los resultados de las pruebas de susceptibilidad muestren susceptibilidad a la amoxicilina, lo que indica que no hay producción de betalactamasas, no se debe usar AUGMENTIN.
DOSIFICACIÓN Y ADMINISTRACIÓN
AUGMENTIN 875 mg puede tomarse sin tener en cuenta las comidas; sin embargo, la absorción de clavulanato de potasio mejora cuando se administra AUGMENTIN 250 mg al comienzo de una comida. Para minimizar el potencial de intolerancia gastrointestinal, AUGMENTIN 125 mg debe tomarse al comienzo de una comida.
Adultos
La dosis habitual para adultos es un comprimido de 500 mg de AUGMENTIN cada 12 horas o un comprimido de 250 mg de AUGMENTIN 125 mg cada 8 horas. Para infecciones más graves e infecciones de las vías respiratorias, la dosis debe ser un comprimido de 875 mg de AUGMENTIN 875 mg cada 12 horas o un comprimido de 500 mg de AUGMENTIN cada 8 horas. Los adultos que tienen dificultad para tragar pueden recibir la suspensión de 125 mg/5 ml o 250 mg/5 ml en lugar de la tableta de 500 mg. Se puede usar la suspensión de 200 mg/5 ml o la suspensión de 400 mg/5 ml en lugar de la tableta de 875 mg.
Dos comprimidos de 250 mg de AUGMENTIN no deben sustituirse por un comprimido de 500 mg de AUGMENTIN. Dado que tanto las tabletas de 250 mg como las de 500 mg de AUGMENTIN contienen la misma cantidad de ácido clavulánico (125 mg, que la sal de potasio), dos tabletas de 250 mg no equivalen a una tableta de 500 mg de AUGMENTIN.
El comprimido de 250 mg de AUGMENTIN y el comprimido masticable de 250 mg no deben sustituirse entre sí, ya que no son intercambiables. El comprimido de 250 mg de AUGMENTIN 250 mg y el comprimido masticable de 250 mg no contienen la misma cantidad de ácido clavulánico (que la sal de potasio). El comprimido de 250 mg de AUGMENTIN contiene 125 mg de ácido clavulánico, mientras que el comprimido masticable de 250 mg contiene 62,5 mg de ácido clavulánico.
Pacientes pediátricos
Basado en el componente amoxicilina, AUGMENTIN debe dosificarse de la siguiente manera:
Recién nacidos y lactantes de
La dosis recomendada de AUGMENTIN es de 30 mg/kg/día divididos cada 12 horas, en base al componente amoxicilina. La experiencia con la formulación de 200 mg/5 ml en este grupo de edad es limitada y, por lo tanto, se recomienda el uso de la suspensión oral de 125 mg/5 ml.
Pacientes de 12 semanas (3 meses) y mayores
Consulte los regímenes de dosificación proporcionados en la Tabla 1. Se recomienda el régimen de cada 12 horas, ya que se asocia con una cantidad significativamente menor de diarrea [consulte Estudios clínicos ]. Sin embargo, la suspensión cada 12 horas (200 mg/5 ml y 400 mg/5 ml) y las tabletas masticables (200 mg y 400 mg) contienen aspartamo y no deben ser utilizadas por fenilcetonúricos. [ver ADVERTENCIAS Y PRECAUCIONES ]
Pacientes que pesan 40 kg o más
Los pacientes pediátricos que pesan 40 kg o más deben recibir la dosis de acuerdo con las recomendaciones para adultos.
El comprimido de 250 mg de AUGMENTIN no debe utilizarse hasta que el niño pese al menos 40 kg, debido a las diferentes proporciones de amoxicilina a ácido clavulánico en el comprimido de 250 mg de AUGMENTIN (250/125) frente al comprimido masticable de 250 mg de AUMENTO (250/62,5).
Pacientes con insuficiencia renal
Los pacientes con insuficiencia renal generalmente no requieren una reducción de la dosis a menos que la insuficiencia sea grave. Los pacientes con insuficiencia renal con una tasa de filtración glomerular
Los pacientes en hemodiálisis deben recibir 500 mg o 250 mg cada 24 horas, según la gravedad de la infección. Deben recibir una dosis adicional tanto durante como al final de la diálisis.
Instrucciones para mezclar la suspensión oral
Prepare una suspensión en el momento de la dispensación de la siguiente manera: golpee la botella hasta que todo el polvo fluya libremente. Agregue aproximadamente 2/3 de la cantidad total de agua para la reconstitución (consulte la Tabla 2 a continuación) y agite enérgicamente para suspender el polvo. Agregue el resto del agua y vuelva a agitar vigorosamente.
Nota: Agite bien la suspensión oral antes de usar. La suspensión reconstituida debe almacenarse en refrigeración y desecharse después de 10 días.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
tabletas
- Comprimidos de 250 mg/125 mg: Cada comprimido recubierto con película ovalado blanco, grabado con AUGMENTIN 750 mg en un lado y 250/125 en el otro lado, contiene 250 mg de amoxicilina y 125 mg de ácido clavulánico como sal de potasio.
- Comprimidos de 500 mg/125 mg: Cada comprimido recubierto con película ovalado blanco, grabado con AUGMENTIN 125 mg en un lado y 500/125 en el otro lado, contiene 500 mg de amoxicilina y 125 mg de ácido clavulánico como sal de potasio.
- Comprimidos de 875 mg/125 mg: Cada comprimido ranurado en forma de cápsula blanca, grabado con AUGMENTIN 875 en un lado y ranurado en el otro lado, contiene 875 mg de amoxicilina y 125 mg de ácido clavulánico como sal de potasio.
Polvo para suspensión oral
- 125 mg/31,25 mg por 5 ml: Polvo para suspensión oral con sabor a plátano (cada 5 ml de suspensión reconstituida contiene 125 mg de amoxicilina y 31,25 mg de ácido clavulánico como sal de potasio).
- 200 mg/28,5 mg por 5 ml: Polvo de color naranja para suspensión oral (cada 5 ml de suspensión reconstituida contiene 200 mg de amoxicilina y 28,5 mg de ácido clavulánico como sal de potasio).
- 250 mg/62,5 mg por 5 ml: Polvo con sabor a naranja para suspensión oral (cada 5 ml de suspensión reconstituida contiene 250 mg de amoxicilina y 62,5 mg de ácido clavulánico como sal de potasio).
- 400 mg/57 mg por 5 ml Polvo con sabor a naranja para suspensión oral (cada 5 ml de suspensión reconstituida contiene 400 mg de amoxicilina y 57,0 mg de ácido clavulánico como sal de potasio).
Tabletas masticables
- Comprimidos masticables de 125 mg/31,25 mg: Cada comprimido amarillo moteado, redondo, con sabor a lima-limón, grabado con BMP 189, contiene 125 mg de amoxicilina y 31,25 mg de ácido clavulánico como sal de potasio.
- Tabletas masticables de 200 mg/28,5 mg: Cada comprimido rosa moteado, redondo, biconvexo con sabor a cereza y plátano, grabado con AUGMENTIN 200 contiene 200 mg de amoxicilina y 28,5 mg de ácido clavulánico como sal de potasio.
- Comprimidos masticables de 250 mg/62,5 mg: Cada comprimido amarillo moteado, redondo, con sabor a lima-limón, grabado con BMP 190, contiene 250 mg de amoxicilina y 62,5 mg de ácido clavulánico como sal de potasio.
- Tabletas masticables de 400 mg/57 mg: Cada comprimido rosa moteado, redondo, biconvexo con sabor a cereza y plátano, grabado con AUGMENTIN 400 contiene 400 mg de amoxicilina y 57,0 mg de ácido clavulánico como sal de potasio.
El comprimido de 250 mg de AUGMENTIN 750 mg y el comprimido masticable de 250 mg NO deben sustituirse entre sí, ya que no son intercambiables y el comprimido de 250 mg no debe utilizarse en niños que pesen menos de 40 kg. El comprimido de 250 mg de AUGMENTIN y el comprimido masticable de 250 mg no contienen la misma cantidad de ácido clavulánico. El comprimido de 250 mg de AUGMENTIN contiene 125 mg de ácido clavulánico mientras que el comprimido masticable de 250 mg contiene 62,5 mg de ácido clavulánico.
Dos tabletas de 250 mg de AUGMENTIN 750 mg NO deben sustituirse por una tableta de 500 mg de AUGMENTIN. Dado que tanto los comprimidos de 250 mg como los de 500 mg de AUGMENTIN contienen la misma cantidad de ácido clavulánico (125 mg que la sal de potasio), dos comprimidos de 250 mg de AUGMENTIN 750 mg no equivalen a un comprimido de 500 mg de AUGMENTIN.
Almacenamiento y manipulación
tabletas
Comprimidos de 250 mg/125 mg: Cada comprimido recubierto con película ovalado blanco, grabado con AUGMENTIN 750 mg en un lado y 250/125 en el otro lado, contiene 250 mg de amoxicilina como trihidrato y 125 mg de ácido clavulánico como sal de potasio.
CDN 43598-018-30 botellas de 30 CDN 43598-018-78 Dosis Unitaria (10x10) 100 comprimidos
Comprimidos de 500 mg/125 mg: Cada comprimido recubierto con película ovalado blanco, grabado con AUGMENTIN en un lado y 500/125 en el otro lado, contiene 500 mg de amoxicilina como trihidrato y 125 mg de ácido clavulánico como sal de potasio.
CDN 43598-006-14 botellas de 20 CDN 43598-006-78 Dosis Unitaria (10x10) 100 comprimidos
Comprimidos de 875 mg/125 mg: Cada comprimido ranurado en forma de cápsula blanca, grabado con AUGMENTIN 875 en un lado y ranurado en el otro lado, contiene 875 mg de amoxicilina como trihidrato y 125 mg de ácido clavulánico como sal de potasio.
CDN 43598-021-14 botellas de 20 CDN 43598-021-78 Dosis Unitaria (10x10) 100 comprimidos
Polvo para suspensión oral: 125 mg/31,25 mg por 5 ml: Polvo para suspensión oral con sabor a plátano (cada 5 ml de suspensión reconstituida contiene 125 mg de amoxicilina y 31,25 mg de ácido clavulánico como sal de potasio).
CDN 43598-012-51 Botella de 75 ml CDN 43598-012-52 Botella de 100ml CDN 43598-012-53 Botella de 150 mL
200 mg/28,5 mg por 5 ml: Polvo de color naranja para suspensión oral (cada 5 ml de suspensión reconstituida contiene 200 mg de amoxicilina y 28,5 mg de ácido clavulánico como sal de potasio).
CDN 43598-013-50 Botella de 50ml CDN 43598-013-51 Botella de 75 ml CDN 43598-013-52 Botella de 100ml
250 mg/62,5 mg por 5 ml: Polvo con sabor a naranja para suspensión oral (cada 5 ml de suspensión reconstituida contiene 250 mg de amoxicilina y 62,5 mg de ácido clavulánico como sal de potasio).
CDN 43598-004-51 Botella de 75 ml CDN 43598-004-52 Botella de 100ml CDN 43598-004-53 Botella de 150 mL
400 mg/57 mg por 5 ml Polvo con sabor a naranja para suspensión oral (cada 5 ml de suspensión reconstituida contiene 400 mg de amoxicilina y 57,0 mg de ácido clavulánico como sal de potasio).
CDN 43598-008-50 Botella de 50ml CDN 43598-008-51 Botella de 75 ml CDN 43598-008-52 Botella de 100ml
Tabletas masticables: 125 mg/31,25 mg Tabletas masticables: Cada comprimido amarillo moteado, redondo, con sabor a lima-limón, grabado con BMP 189, contiene 125 mg de amoxicilina y 31,25 mg de ácido clavulánico como sal de potasio.
CDN 43598-014-31 caja de 30 (5x6) tabletas
Tabletas masticables de 200 mg/28,5 mg: Cada comprimido de color rosa moteado, redondo, biconvexo, con sabor a cereza y plátano, grabado con AUGMENTIN 200, contiene 200 mg de amoxicilina y 28,5 mg de ácido clavulánico como sal de potasio.
CDN 43598-015-14 caja de 20 comprimidos
Comprimidos masticables de 250 mg/62,5 mg: Cada comprimido amarillo moteado, redondo, con sabor a lima-limón, grabado con BMP 190, contiene 250 mg de amoxicilina y 62,5 mg de ácido clavulánico como sal de potasio.
CDN 43598-016-31 caja de 30 (5x6) tabletas
Tabletas masticables de 400 mg/57 mg: Cada comprimido de color rosa moteado, redondo, biconvexo, con sabor a cereza y plátano, grabado con AUGMENTIN 400, contiene 400 mg de amoxicilina y 57,0 mg de ácido clavulánico como sal de potasio.
CDN 43598-017-14 caja de 20 comprimidos
Dispensar en envase original.
Guarde las tabletas y el polvo seco a una temperatura igual o inferior a 25 °C (77 °F).
Guarde la suspensión reconstituida en refrigeración. Deseche la suspensión no utilizada después de 10 días. Mantener fuera del alcance de los niños.
REFERENCIAS
1. Swanson-Biearman B, Dean BS, López G, Krenzelok EP. Los efectos de la ingestión de penicilina y cefalosporina en niños menores de seis años. Vet Hum Toxicol. 1988; 30: 66 67.
2. Instituto de Normas Clínicas y de Laboratorio (CLSI). Métodos para pruebas de susceptibilidad antimicrobiana por dilución para bacterias que crecen aeróbicamente; Norma Aprobada – 8vo. CLSI Documento M7-A9. CLSI, 940 West Valley Road, Suite 1400, Wayne, PA, 19087, 2012.
3. Instituto de Normas Clínicas y de Laboratorio (CLSI). Estándar de rendimiento para pruebas de susceptibilidad de disco antimicrobiano; Estándar aprobado - 11thed. CLSI Documento M2-A11. CLSI, 940 West Valley Road, Suite 1400, Wayne, PA, 19087, 2012.
4. CLSI. Normas de rendimiento para las pruebas de susceptibilidad a los antimicrobianos: 22.º suplemento informativo. Documento CLSI M100-S22. CLSI, Wayne, Pensilvania, 2012.
Distribuido por: Dr. Reddy's Laboratories Inc. Bridgewater, NJ 08807. Revisado: marzo de 2013
EFECTOS SECUNDARIOS
Lo siguiente se discute con más detalle en otras secciones del etiquetado:
- Reacciones anafilácticas [ver ADVERTENCIAS Y PRECAUCIONES ]
- Disfunción hepática [ver ADVERTENCIAS Y PRECAUCIONES ]
- CDAD [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Las reacciones adversas notificadas con mayor frecuencia fueron diarrea/heces blandas (9 %), náuseas (3 %), erupciones cutáneas y urticaria (3 %), vómitos (1 %) y vaginitis (1 %). Menos del 3 % de los pacientes interrumpieron el tratamiento debido a reacciones adversas relacionadas con el fármaco. La incidencia global de reacciones adversas, y en particular de diarrea, aumentó con la dosis más alta recomendada. Otras reacciones adversas notificadas con menos frecuencia (
En pacientes pediátricos (de 2 meses a 12 años), se realizó 1 ensayo clínico en EE. UU./Canadá que comparó 45/6,4 mg/kg/día (divididos cada 12 horas) de AUGMENTIN durante 10 días versus 40/10 mg/kg/día (dividido cada 8 horas) de AUGMENTIN 125mg durante 10 días en el tratamiento de la otitis media aguda. Se inscribió un total de 575 pacientes y en este ensayo solo se usaron las formulaciones de suspensión. En general, las reacciones adversas observadas fueron comparables a las mencionadas anteriormente; sin embargo, hubo diferencias en las tasas de diarrea, erupciones cutáneas/urticaria y erupciones en el área del pañal. [Ver Estudios clínicos ]
Experiencia posterior a la comercialización
Además de las reacciones adversas informadas en los ensayos clínicos, se identificaron las siguientes durante el uso posterior a la comercialización de AUGMENTIN. Debido a que son reportados voluntariamente por una población de tamaño desconocido, no se pueden hacer estimaciones de frecuencia. Estos eventos han sido elegidos para su inclusión debido a una combinación de su gravedad, frecuencia de notificación o posible conexión causal con AUGMENTIN.
Gastrointestinal
Indigestión, gastritis, estomatitis, glositis, lengua negra “vellosa”, candidiasis mucocutánea, enterocolitis y colitis hemorrágica/pseudomembranosa. La aparición de los síntomas de la colitis pseudomembranosa puede ocurrir durante o después del tratamiento con antibióticos. [ver ADVERTENCIAS Y PRECAUCIONES ]
Reacciones hipersensibles
Prurito, angioedema, reacciones similares a la enfermedad del suero (urticaria o erupción cutánea acompañada de artritis, artralgia, mialgia y, con frecuencia, fiebre), eritema multiforme, síndrome de Stevens Johnson, pustulosis exantemática generalizada aguda, vasculitis por hipersensibilidad y casos de dermatitis exfoliativa (incluida la epidermis tóxica). necrólisis) han sido reportados. [ver ADVERTENCIAS Y PRECAUCIONES ]
Hígado
Se ha informado con AUGMENTIN disfunción hepática, que incluye hepatitis e ictericia colestática, aumentos en las transaminasas séricas (AST y/o ALT), bilirrubina sérica y/o fosfatasa alcalina. Se ha notificado con más frecuencia en ancianos, en varones o en pacientes en tratamiento prolongado. Los hallazgos histológicos en la biopsia hepática han consistido en un tratamiento predominantemente colestásico. Los hallazgos histológicos en la biopsia hepática han consistido en cambios predominantemente colestásicos, hepatocelulares o mixtos colestásicos hepatocelulares. La aparición de signos/síntomas de disfunción hepática puede ocurrir durante o varias semanas después de haber interrumpido el tratamiento. La disfunción hepática, que puede ser grave, suele ser reversible. Se han reportado muertes. [ver CONTRAINDICACIONES , ADVERTENCIAS Y PRECAUCIONES ]
Renal
Se han informado nefritis intersticial, hematuria y cristaluria. [ver SOBREDOSIS ]

Sistemas hemático y linfático
Se ha informado anemia, que incluye anemia hemolítica, trombocitopenia, púrpura trombocitopénica, eosinofilia, leucopenia y agranulocitosis. Estas reacciones suelen ser reversibles al interrumpir el tratamiento y se cree que son fenómenos de hipersensibilidad. Se observó trombocitosis en menos del 1 % de los pacientes tratados con AUGMENTIN. Ha habido informes de aumento del tiempo de protrombina en pacientes que reciben AUGMENTIN 125 mg y terapia anticoagulante concomitantemente. [ver INTERACCIONES CON LA DROGAS ]
Sistema nervioso central
Se han informado agitación, ansiedad, cambios de comportamiento, confusión, convulsiones, mareos, insomnio e hiperactividad reversible.
Misceláneas
Se ha informado decoloración de los dientes (tinción marrón, amarilla o gris). La mayoría de los informes ocurrieron en pacientes pediátricos. La decoloración se redujo o eliminó con cepillado o limpieza dental en la mayoría de los casos.
INTERACCIONES CON LA DROGAS
probenecid
El probenecid disminuye la secreción tubular renal de amoxicilina pero no retrasa la excreción renal de ácido clavulánico. El uso simultáneo con AUGMENTIN 875 mg puede resultar en un aumento y prolongación de las concentraciones sanguíneas de amoxicilina. No se recomienda la administración conjunta de probenecid.
Anticoagulantes orales
Se ha notificado una prolongación anormal del tiempo de protrombina (aumento del índice internacional normalizado [INR]) en pacientes que reciben amoxicilina y anticoagulantes orales. Se debe realizar un control adecuado cuando se prescriben anticoagulantes junto con AUGMENTIN. Pueden ser necesarios ajustes en la dosis de anticoagulantes orales para mantener el nivel deseado de anticoagulación.
alopurinol
La administración concomitante de alopurinol y amoxicilina aumenta la incidencia de erupciones cutáneas en pacientes que reciben ambos fármacos en comparación con pacientes que reciben amoxicilina sola. No se sabe si esta potenciación de las erupciones por amoxicilina se debe al alopurinol oa la hiperuricemia presente en estos pacientes.
Anticonceptivos orales
AUGMENTIN 750 mg puede afectar la flora intestinal, lo que lleva a una menor reabsorción de estrógenos y reduce la eficacia de los anticonceptivos orales combinados de estrógeno/progesterona.
Efectos en las pruebas de laboratorio
Las concentraciones altas de amoxicilina en la orina pueden dar lugar a reacciones falsas positivas cuando se analiza la presencia de glucosa en la orina con CLINITEST®, la solución de Benedict o la solución de Fehling. Dado que este efecto también puede ocurrir con AUGMENTIN, se recomienda utilizar pruebas de glucosa basadas en reacciones enzimáticas de glucosa oxidasa.
Después de la administración de amoxicilina a mujeres embarazadas, se ha observado una disminución transitoria de la concentración plasmática de estriol conjugado total, estriol-glucurónido, estrona conjugada y estradiol.
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Reacciones hipersensibles
Se han informado reacciones de hipersensibilidad (anafilácticas) graves y ocasionalmente fatales en pacientes que reciben antibacterianos betalactámicos, incluido AUGMENTIN. Es más probable que estas reacciones ocurran en personas con antecedentes de hipersensibilidad a la penicilina y/o antecedentes de sensibilidad a múltiples alérgenos. Antes de iniciar la terapia con AUGMENTIN 250 mg, se debe realizar una investigación cuidadosa sobre las reacciones previas de hipersensibilidad a las penicilinas, cefalosporinas u otros alérgenos. Si ocurre una reacción alérgica, se debe suspender AUGMENTIN e instituir la terapia adecuada.
disfunción hepática
La disfunción hepática, incluida la hepatitis y la ictericia colestática, se ha asociado con el uso de AUGMENTIN. La toxicidad hepática suele ser reversible; sin embargo, se han reportado muertes. La función hepática debe controlarse a intervalos regulares en pacientes con insuficiencia hepática.
Diarrea asociada a Clostridium difficile (CDAD)
Se ha informado diarrea asociada a Clostridium difficile (CDAD) con el uso de casi todos los agentes antibacterianos, incluido AUGMENTIN 250 mg, y puede variar en gravedad desde diarrea leve hasta colitis fatal. El tratamiento con agentes antibacterianos altera la flora normal del colon y conduce al crecimiento excesivo de C. difficile.
C. difficile produce toxinas A y B que contribuyen al desarrollo de CDAD. Las cepas de C. difficile productoras de hipertoxina causan una mayor morbilidad y mortalidad, ya que estas infecciones pueden ser refractarias a la terapia antimicrobiana y pueden requerir colectomía. Se debe considerar CDAD en todos los pacientes que presenten diarrea después del uso de antibacterianos. Es necesaria una cuidadosa historia clínica ya que se ha informado que la CDAD ocurre más de 2 meses después de la administración de agentes antibacterianos.
Si se sospecha o se confirma CDAD, es posible que se deba suspender el uso continuo de antibacterianos no dirigidos contra C. difficile. Se debe instituir el manejo apropiado de líquidos y electrolitos, suplementos de proteínas, tratamiento antibacteriano de C. difficile y evaluación quirúrgica según esté clínicamente indicado.
Erupción cutánea en pacientes con mononucleosis
Un alto porcentaje de pacientes con mononucleosis que reciben amoxicilina desarrollan una erupción cutánea eritematosa. Por lo tanto, AUGMENTIN no debe administrarse a pacientes con mononucleosis.
Potencial de sobrecrecimiento microbiano
Se debe considerar la posibilidad de sobreinfecciones con patógenos fúngicos o bacterianos durante la terapia. Si se produce una superinfección, se debe interrumpir el tratamiento con amoxicilina/ácido clavulánico e instaurar el tratamiento adecuado.
fenilcetonúricos
Las tabletas masticables AUGMENTIN de 500 mg y el polvo AUGMENTIN para solución oral contienen aspartamo que contiene fenilalanina. Cada comprimido masticable de 200 mg de AUGMENTIN 750 mg contiene 2,1 mg de fenilalanina; cada comprimido masticable de 400 mg contiene 4,2 mg de fenilalanina; cada 5 ml de la suspensión oral de 200 mg/5 ml o de 400 mg/5 ml contiene 7 mg de fenilalanina. Las otras formulaciones de AUGMENTIN 875mg no contienen fenilalanina.
Desarrollo de bacterias resistentes a los medicamentos
Prescribir AUGMENTIN 250 mg en ausencia de una infección bacteriana comprobada o fuertemente sospechada es poco probable que brinde beneficios al paciente y aumenta el riesgo de desarrollo de bacterias resistentes a los medicamentos.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
No se han realizado estudios a largo plazo en animales para evaluar el potencial carcinogénico.
AUGMENTIN (formulación de amoxicilina:clavulanato en proporción 4:1) no fue mutagénico en el ensayo de mutación bacteriana de Ames y en el ensayo de conversión de genes de levadura. AUGMENTIN fue débilmente positivo en el ensayo de linfoma de ratón, pero la tendencia hacia el aumento de las frecuencias de mutación en este ensayo se produjo en dosis que también se asociaron con una disminución de la supervivencia celular. AUGMENTIN fue negativo en la prueba de micronúcleos de ratón y en el ensayo letal dominante en ratones. El clavulanato de potasio solo se probó en el ensayo de mutación bacteriana de Ames y en la prueba de micronúcleo de ratón, y dio negativo en cada uno de estos ensayos.
Se encontró que AUGMENTIN (formulación de amoxicilina:clavulanato en proporción 2:1) en dosis orales de hasta 1,200 mg/kg/día no tiene efecto sobre la fertilidad y el desempeño reproductivo en ratas. Con base en el área de superficie corporal, esta dosis de amoxicilina es aproximadamente 4 veces la dosis oral máxima recomendada en humanos para adultos (875 mg cada 12 horas). Para el clavulanato, el múltiplo de dosis es aproximadamente 9 veces mayor que la dosis oral máxima recomendada en humanos para adultos (125 mg cada 8 horas), también según el área de superficie corporal.
Uso en poblaciones específicas
El embarazo
Efectos teratogénicos
Embarazo Categoría B. Los estudios de reproducción realizados en ratas y ratones preñados que recibieron AUGMENTIN (formulación de amoxicilina:clavulanato en proporción 2:1) en dosis orales de hasta 1200 mg/kg/día no revelaron evidencia de daño al feto debido a AUGMENTIN. Las dosis de amoxicilina en ratas y ratones (basadas en el área de superficie corporal) fueron aproximadamente 4 y 2 veces la dosis oral máxima recomendada en humanos para adultos (875 mg cada 12 horas). Para el clavulanato, estos múltiplos de dosis fueron aproximadamente 9 y 4 veces la dosis oral máxima recomendada en humanos para adultos (125 mg cada 8 horas). Sin embargo, no existen estudios adecuados y bien controlados en mujeres embarazadas. Debido a que los estudios de reproducción en animales no siempre predicen la respuesta humana, este medicamento debe usarse durante el embarazo solo si es claramente necesario.
Trabajo y entrega
Los antibióticos orales de la clase de la ampicilina se absorben mal durante el trabajo de parto. No se sabe si el uso de amoxicilina/clavulánico potásico en humanos durante el parto tiene efectos adversos inmediatos o retardados en el feto, prolonga la duración del trabajo de parto o aumenta la probabilidad de necesidad de una intervención obstétrica.
Madres lactantes
Se ha demostrado que la amoxicilina se excreta en la leche humana. El uso de amoxicilina/clavulánico potásico por parte de madres lactantes puede provocar sensibilización de los lactantes. Se debe tener precaución cuando se administra amoxicilina/ácido clavulánico a una mujer lactante.
Uso pediátrico
Se ha establecido la seguridad y eficacia de AUGMENTIN en polvo para suspensión oral y tabletas masticables en pacientes pediátricos. El uso de AUGMENTIN 125 mg en pacientes pediátricos está respaldado por evidencia de estudios de AUGMENTIN Tabletas en adultos con datos adicionales de un estudio de AUGMENTIN Polvo para suspensión oral en pacientes pediátricos de 2 meses a 12 años con otitis media aguda. [ver Estudios clínicos ]
Debido al desarrollo incompleto de la función renal en recién nacidos y niños pequeños, la eliminación de amoxicilina puede retrasarse; la eliminación del clavulanato no se altera en este grupo de edad. La dosificación de AUGMENTIN 500 mg debe modificarse en pacientes pediátricos de DOSIFICACIÓN Y ADMINISTRACIÓN ]
Uso geriátrico
De los 3119 pacientes en un análisis de estudios clínicos de AUGMENTIN, el 32 % tenía ≥65 años y el 14 % tenía ≥75 años. No se observaron diferencias generales en la seguridad o la eficacia entre estos sujetos y los sujetos más jóvenes, y otra experiencia clínica notificada no ha identificado diferencias en las respuestas entre los ancianos y los pacientes más jóvenes, pero no se puede descartar una mayor sensibilidad de algunos individuos mayores.
Se sabe que este fármaco se excreta sustancialmente por vía renal, y el riesgo de reacciones adversas a este fármaco puede ser mayor en pacientes con insuficiencia renal. Debido a que es más probable que los pacientes de edad avanzada tengan una función renal disminuida, se debe tener cuidado en la selección de la dosis y puede ser útil monitorear la función renal.
Dosificación en insuficiencia renal
La amoxicilina se elimina principalmente por vía renal y suele ser necesario ajustar la dosis en pacientes con insuficiencia renal grave (TFG Pacientes con Insuficiencia Renal para recomendaciones específicas en pacientes con insuficiencia renal.
SOBREDOSIS
En caso de sobredosis, suspenda la medicación, trate sintomáticamente e instituya medidas de apoyo según sea necesario. Un estudio prospectivo de 51 pacientes pediátricos en un centro de toxicología sugirió que las sobredosis de menos de 250 mg/kg de amoxicilina no están asociadas con síntomas clínicos significativos1.
Se ha informado nefritis intersticial que resultó en insuficiencia renal oligúrica en pacientes después de una sobredosis de amoxicilina/clavulanato de potasio.
También se ha notificado cristaluria, que en algunos casos conduce a insuficiencia renal, después de una sobredosis de amoxicilina/ácido clavulánico potásico en pacientes adultos y pediátricos. En caso de sobredosis, se debe mantener una ingesta adecuada de líquidos y diuresis para reducir el riesgo de cristaluria de amoxicilina/clavulanato de potasio. La insuficiencia renal parece ser reversible con el cese de la administración del fármaco. Los niveles sanguíneos elevados pueden ocurrir más fácilmente en pacientes con función renal alterada debido a la disminución del aclaramiento renal de amoxicilina/ácido clavulánico. La amoxicilina/clavulanato de potasio puede eliminarse de la circulación mediante hemodiálisis. [ver DOSIFICACIÓN Y ADMINISTRACIÓN ]
CONTRAINDICACIONES
Reacciones de hipersensibilidad graves
AUGMENTIN está contraindicado en pacientes con antecedentes de reacciones de hipersensibilidad graves (p. ej., anafilaxia o síndrome de Stevens-Johnson) a la amoxicilina, el clavulanato oa otros fármacos antibacterianos betalactámicos (p. ej., penicilinas y cefalosporinas).
Ictericia colestática/disfunción hepática
AUGMENTIN 250 mg está contraindicado en pacientes con antecedentes de ictericia colestásica/disfunción hepática asociada con AUGMENTIN.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
AUGMENTIN es un fármaco antibacteriano. [ver Microbiología ]
Farmacocinética
Los parámetros farmacocinéticos medios de amoxicilina y clavulanato de potasio en adultos normales después de la administración de AUGMENTIN en tabletas de 250 mg se muestran en la Tabla 3 y luego de la administración de AUGMENTIN en polvo para suspensión oral y tabletas masticables de 250 mg en la Tabla 4.
La administración oral de 5 ml de suspensión de 250 mg/5 ml de AUGMENTIN o la dosis equivalente de 10 ml de suspensión de 125 mg/5 ml de AUGMENTIN proporciona concentraciones séricas máximas promedio aproximadamente 1 hora después de la dosificación de 6,9 mcg/ml para amoxicilina y 1,6 mcg /mL para ácido clavulánico. Las áreas bajo las curvas de concentración sérica obtenidas durante las primeras 4 horas después de la dosificación fueron 12,6 mcg*h/mL para amoxicilina y 2,9 mcg*h/mL para ácido clavulánico cuando se administraron 5 mL de suspensión de 250 mg/5 mL de AUGMENTIN o dosis equivalente de Se administraron 10 mL de suspensión de 125 mg/5 mL de AUGMENTIN a adultos normales. Una tableta masticable de 250 mg de AUGMENTIN o dos tabletas masticables de 125 mg de AUGMENTIN equivalen a 5 ml de suspensión de 250 mg/5 ml de AUGMENTIN y brindan concentraciones séricas similares de amoxicilina y ácido clavulánico.
Las concentraciones séricas de amoxicilina alcanzadas con AUGMENTIN 250 mg son similares a las producidas por la administración oral de dosis equivalentes de amoxicilina sola. Se ha demostrado que el tiempo por encima de la concentración inhibitoria mínima de 1 mcg/mL para la amoxicilina es similar después de los regímenes de dosificación correspondientes cada 12 horas y cada 8 horas de AUGMENTIN 250 mg en adultos y niños.
Absorción
La dosificación en ayunas o con alimentos tiene un efecto mínimo sobre la farmacocinética de la amoxicilina. Si bien AUGMENTIN se puede administrar sin tener en cuenta las comidas, la absorción de clavulanato de potasio cuando se toma con alimentos es mayor en relación con el estado en ayunas. En un estudio, la biodisponibilidad relativa del clavulanato se redujo cuando se administró AUGMENTIN a los 30 y 150 minutos después del inicio de un desayuno rico en grasas.
Distribución
Ninguno de los componentes de AUGMENTIN se une en gran medida a las proteínas; El ácido clavulánico se une aproximadamente en un 25 % al suero humano y la amoxicilina se une en aproximadamente un 18 %. La amoxicilina se difunde fácilmente en la mayoría de los tejidos y fluidos corporales con la excepción del cerebro y el líquido cefalorraquídeo.
Dos horas después de la administración oral de una dosis única de 35 mg/kg de suspensión de AUGMENTIN 500 mg a niños en ayunas, se detectaron concentraciones promedio de 3 mcg/mL de amoxicilina y 0.5 mcg/mL de ácido clavulánico en derrames del oído medio.
Metabolismo y excreción
La vida media de la amoxicilina tras la administración oral de AUGMENTIN 125 mg es de 1,3 horas y la del ácido clavulánico es de 1 hora.
Aproximadamente del 50% al 70% de la amoxicilina y aproximadamente del 25% al 40% del ácido clavulánico se excretan sin cambios en la orina durante las primeras 6 horas después de la administración de una sola tableta de 250 mg o 500 mg de AUGMENTIN.
Microbiología
La amoxicilina es un antibiótico semisintético con actividad bactericida in vitro contra bacterias Gram-positivas y Gram-negativas. Sin embargo, la amoxicilina es susceptible de degradación por las betalactamasas y, por lo tanto, el espectro de actividad no incluye los organismos que producen estas enzimas. El ácido clavulánico es un beta-lactámico, relacionado estructuralmente con las penicilinas, que posee la capacidad de inactivar algunas enzimas beta-lactamasas que se encuentran comúnmente en microorganismos resistentes a penicilinas y cefalosporinas. En particular, tiene buena actividad contra las betalactamasas clínicamente importantes mediadas por plásmidos, frecuentemente responsables de la resistencia a los medicamentos transferida.
La formulación de amoxicilina y ácido clavulánico en AUGMENTIN protege a la amoxicilina de la degradación por parte de algunas enzimas betalactamasas y amplía el espectro antibiótico de la amoxicilina para incluir muchas bacterias normalmente resistentes a la amoxicilina.
Se ha demostrado que la amoxicilina/ácido clavulánico es activa contra la mayoría de los aislados de las siguientes bacterias, tanto in vitro como en infecciones clínicas, como se describe en la sección INDICACIONES Y USO.
bacterias grampositivas
estafilococo aureus
Bacterias Gram-negativo
Especies de Enterobacter Escherichia coli Haemophilus influenzae Especies de Klebsiella Moraxella catarrhalis
Los siguientes datos in vitro están disponibles, pero se desconoce su significado clínico . Al menos el 90 por ciento de las siguientes bacterias exhiben una concentración inhibitoria mínima (MIC) in vitro menor o igual al punto de corte susceptible para amoxicilina/ácido clavulánico. Sin embargo, la eficacia de amoxicilina/ácido clavulánico en el tratamiento de infecciones clínicas debidas a estas bacterias no ha sido establecido en ensayos clínicos adecuados y bien controlados.
bacterias grampositivas
Enterococcus faecalis Staphylococcus epidermidis Staphylococcus saprophyticus Streptococcus pneumoniae Streptococcus pyogenes Grupo Viridans Streptococcus
Bacterias Gram-negativo
Eikenellacorrodens Proteus mirabilis
Bacteria anaerobica
Especies de Bacteroides incluyendo Bacteroides fragilis Especies de Fusobacterium Especies de Peptostreptococcus
Métodos de prueba de susceptibilidad
Cuando esté disponible, el laboratorio de microbiología clínica debe proporcionar al médico los resultados de las pruebas de susceptibilidad in vitro de los medicamentos antimicrobianos utilizados en los hospitales residentes como informes periódicos que describen el perfil de susceptibilidad de los patógenos nosocomiales y adquiridos en la comunidad. Estos informes deberían ayudar al médico a seleccionar un medicamento antibacteriano para el tratamiento.
Técnicas de dilución
Los métodos cuantitativos se utilizan para determinar las concentraciones inhibitorias mínimas (CIM) antimicrobianas. Estos MIC proporcionan estimaciones de la susceptibilidad de las bacterias a los compuestos antimicrobianos. Las CIM deben determinarse utilizando un método de prueba estandarizado2,3 (caldo y/o agar). Los valores de MIC deben interpretarse de acuerdo con los criterios proporcionados en la Tabla 5.
Técnicas de difusión
Los métodos cuantitativos que requieren la medición de los diámetros de las zonas también pueden proporcionar estimaciones reproducibles de la susceptibilidad de las bacterias a los compuestos antimicrobianos. El tamaño de la zona proporciona una estimación de la susceptibilidad de las bacterias a los compuestos antimicrobianos. El tamaño de la zona debe determinarse utilizando un método de prueba estandarizado3,4. Este procedimiento utiliza discos de papel impregnados con 30 mcg de amoxicilina/ácido clavulánico (20 mcg de amoxicilina más 10 mcg de ácido clavulánico) para evaluar la susceptibilidad de las bacterias a la amoxicilina/ácido clavulánico. Los criterios de interpretación de la difusión por disco se proporcionan en la Tabla 5.
Control de calidad
Los procedimientos de prueba de susceptibilidad estandarizados requieren el uso de controles de laboratorio para monitorear y garantizar la exactitud y precisión de los suministros y reactivos utilizados en el ensayo, y las técnicas de las personas que realizan la prueba2,3,4. El polvo estándar de amoxicilina/ácido clavulánico debe proporcionar el siguiente rango de valores de CMI indicados en la Tabla 6 para la técnica de difusión usando el disco de 30 mcg de amoxicilina/ácido clavulánico (20 mcg de amoxicilina más 10 mcg de ácido clavulánico), se deben cumplir los criterios de la Tabla 6 .
Estudios clínicos
Infecciones del tracto respiratorio inferior y del tracto urinario complicadas
Los datos de 2 ensayos fundamentales en 1191 pacientes tratados por infecciones de las vías respiratorias inferiores o infecciones urinarias complicadas compararon un régimen de comprimidos de 875 mg de AUGMENTIN cada 12 horas con comprimidos de 500 mg de AUGMENTIN de 125 mg administrados cada 8 horas (584 y 607 pacientes, respectivamente). ). Se demostró una eficacia comparable entre los regímenes de dosificación cada 12 horas y cada 8 horas. No hubo diferencia significativa en el porcentaje de eventos adversos en cada grupo. El evento adverso informado con mayor frecuencia fue la diarrea; las tasas de incidencia fueron similares para los regímenes de dosificación de 875 mg cada 12 horas y 500 mg cada 8 horas (15 % y 14 %, respectivamente); sin embargo, hubo una diferencia estadísticamente significativa (p
En uno de estos ensayos fundamentales, los pacientes con pielonefritis (n = 361) o una infección urinaria complicada (es decir, pacientes con anomalías del tracto urinario que predisponen a la recaída de la bacteriuria después de la erradicación, n = 268) fueron aleatorizados (1: 1) para recibir tabletas de 875 mg de AUGMENTIN de 125 mg cada 12 horas (n=308) o tabletas de 500 mg de AUGMENTIN cada 8 horas (n=321).
El número de pacientes evaluables bacteriológicamente fue comparable entre los dos regímenes de dosificación. AUGMENTIN 250 mg produjo tasas de éxito bacteriológico comparables en pacientes evaluados de 2 a 4 días inmediatamente después del final de la terapia. Las tasas de eficacia bacteriológica fueron comparables en una de las visitas de seguimiento (5 a 9 días después de la terapia) y en una visita tardía después de la terapia (en la mayoría de los casos, esto fue de 2 a 4 semanas después de la terapia), como se ve en la Tabla 7.
Como se señaló anteriormente, aunque no hubo una diferencia significativa en el porcentaje de eventos adversos en cada grupo, hubo una diferencia estadísticamente significativa en las tasas de diarrea grave o retiros con diarrea entre los regímenes.
Otitis media bacteriana aguda y diarrea en pacientes pediátricos
Se realizó un ensayo clínico en EE. UU./Canadá que comparó 45/6,4 mg/kg/día (divididos cada 12 horas) de AUGMENTIN durante 10 días versus 40/10 mg/kg/día (divididos cada 8 horas) de AUGMENTIN durante 10 días en el tratamiento de la otitis media aguda. En este ensayo solo se usaron las formulaciones en suspensión. Se inscribió un total de 575 pacientes pediátricos (de 2 meses a 12 años de edad), con una distribución uniforme entre los 2 grupos de tratamiento y se pudo evaluar un número comparable de pacientes (es decir, ³ 84 %) por grupo de tratamiento. Se requirieron criterios específicos de otitis media para la elegibilidad y se encontró una fuerte correlación al final de la terapia y el seguimiento entre estos criterios y la evaluación médica de la respuesta clínica. Las tasas de eficacia clínica al final de la visita de terapia (definida como 2 4 días después de la finalización de la terapia) y en la visita de seguimiento (definida como 22 28 días después de la finalización de la terapia) fueron comparables para los 2 grupos de tratamiento, con lo siguiente tasas de curación obtenidas para los pacientes evaluables: al final de la terapia, 87% (n = 265) y 82% (n = 260) para 45 mg/kg/día cada 12 horas y 40 mg/kg/día cada 8 horas, respectivamente . En el seguimiento, 67% (n = 249) y 69% (n = 243) para 45 mg/kg/día cada 12 horas y 40 mg/kg/día cada 8 horas, respectivamente.
La diarrea se definió como: (a) 3 o más deposiciones acuosas o 4 o más deposiciones blandas/acuosas en 1 día; O (b) 2 deposiciones acuosas por día o 3 deposiciones blandas/acuosas por día durante 2 días consecutivos. La incidencia de diarrea fue significativamente menor en los pacientes que recibieron el régimen cada 12 horas en comparación con los pacientes que recibieron el régimen cada 8 horas (14 % y 34 %, respectivamente). Además, el número de pacientes con diarrea severa o que fueron retirados por diarrea fue significativamente menor en el grupo de tratamiento cada 12 horas (3 % y 8 % para el tratamiento cada 12 horas/10 días y cada 8 horas/10 días, respectivamente). ). En el grupo de tratamiento cada 12 horas, 3 pacientes (1%) fueron retirados por una reacción alérgica, mientras que 1 paciente en el grupo cada 8 horas fue retirado por este motivo. El número de pacientes con candidiasis en el área del pañal fue de 4% y 6% para los grupos cada 12 horas y cada 8 horas, respectivamente.
No se sabe si el hallazgo de una reducción estadísticamente significativa de la diarrea con las suspensiones orales dosificadas cada 12 horas, frente a las suspensiones dosificadas cada 8 horas, puede extrapolarse a los comprimidos masticables. La presencia de manitol en las tabletas masticables puede contribuir a un perfil de diarrea diferente. Las suspensiones orales cada 12 horas (200 mg/5 mL y 400 mg/5 mL) se endulzan con aspartamo.
INFORMACIÓN DEL PACIENTE
Se debe informar a los pacientes que AUGMENTIN puede tomarse cada 8 horas o cada 12 horas, según la dosis prescrita. Cada dosis debe tomarse con una comida o refrigerio para reducir la posibilidad de molestias gastrointestinales.
Se debe advertir a los pacientes que los medicamentos antibacterianos, incluido AUGMENTIN 125 mg, solo deben usarse para tratar infecciones bacterianas. No tratan infecciones virales (p. ej., el resfriado común). Cuando se prescribe AUGMENTIN para tratar una infección bacteriana, se debe informar a los pacientes que, aunque es común que se sientan mejor al principio del tratamiento, el medicamento debe tomarse exactamente como se indica. Omitir dosis o no completar el curso completo de la terapia puede: (1) disminuir la eficacia del tratamiento inmediato y (2) aumentar la probabilidad de que las bacterias desarrollen resistencia y no se puedan tratar con AUGMENTIN 250 mg u otros medicamentos antibacterianos en el futuro .
Aconseje a los pacientes que la diarrea es un problema común causado por los antibacterianos y que, por lo general, desaparece cuando se suspende el antibacteriano. A veces, después de comenzar el tratamiento con antibacterianos, los pacientes pueden desarrollar heces acuosas y sanguinolentas (con o sin calambres estomacales y fiebre) incluso 2 o más meses después de haber tomado la última dosis del antibacteriano. Si la diarrea es severa o dura más de 2 o 3 días, los pacientes deben comunicarse con su médico.
Se debe recomendar a los pacientes que mantengan la suspensión refrigerada. Agitar bien antes de usar. Cuando dosifique a un niño con la suspensión (líquido) de AUGMENTIN 125 mg, use una cuchara dosificadora o un cuentagotas. Asegúrese de enjuagar la cuchara o el gotero después de cada uso. Los frascos de suspensión de AUGMENTIN pueden contener más líquido del requerido. Siga las instrucciones de su médico sobre la cantidad a usar y los días de tratamiento que requiere su hijo. Deseche cualquier medicamento no utilizado.
Los pacientes deben saber que AUGMENTIN 125 mg contiene un medicamento del tipo de la penicilina que puede causar reacciones alérgicas en algunas personas.
