Zyvox 600mg Linezolid Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Zyvox 600 mg y cómo se usa?
Zyvox es un medicamento recetado que se usa para tratar los síntomas de infecciones bacterianas como neumonía, infecciones de la piel e infecciones resistentes a otros antibióticos. Zyvox 600 mg se puede usar solo o con otros medicamentos.
Zyvox pertenece a una clase de medicamentos llamados antibióticos, otros; Oxazolidinonas.
No se sabe si Zyvox es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Zyvox?
Zyvox puede causar efectos secundarios graves que incluyen:
- urticaria,
- respiración dificultosa,
- hinchazón en la cara o la garganta,
- reacción cutánea severa,
- fiebre,
- dolor de garganta,
- ojos irritados,
- dolor de piel,
- erupción cutánea roja o morada con ampollas y descamación,
- problemas de la vista,
- cambios en su visión,
- dolor de estómago severo,
- diarrea acuosa o con sangre,
- convulsiones,
- transpiración,
- sintiéndose ansioso o temblando,
- agitación,
- alucinaciones,
- fiebre,
- temblando,
- frecuencia cardíaca rápida,
- rigidez muscular,
- retorciéndose,
- pérdida de coordinación,
- náuseas,
- vómitos,
- Diarrea,
- dolor muscular inusual,
- dificultad para respirar,
- dolor de estómago,
- frecuencia cardíaca irregular,
- mareo,
- siento frio,
- sentirse muy débil o cansado,
- confusión,
- úlceras de boca,
- llagas en la piel,
- moretones con facilidad,
- sangrado inusual,
- piel pálida,
- manos y pies fríos,
- aturdimiento, y
- dificultad para respirar
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Zyvox incluyen:
- náuseas,
- vómitos,
- Diarrea,
- erupción cutánea leve,
- anemia (bajos glóbulos rojos),
- dolor de cabeza, y
- mareo
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Zyvox. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
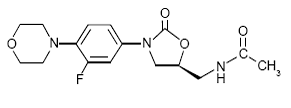
La inyección IV de ZYVOX de 600 mg, las tabletas de ZYVOX y la suspensión oral de ZYVOX contienen linezolida, que es un agente antibacteriano sintético de la clase de las oxazolidinona. El nombre químico de linezolida es (S)-N-[[3-[3-Fluoro-4-(4morfolinil)fenil]-2-oxo-5-oxazolidinil]metil]-acetamida.
La fórmula empírica es C16H20FN3O4. Su peso molecular es 337,35, y su estructura química se representa a continuación:
La inyección IV de ZYVOX de 600 mg se suministra como una solución isotónica estéril lista para usar para infusión intravenosa. Cada mL contiene 2 mg de linezolid. Los ingredientes inactivos son citrato de sodio, ácido cítrico y dextrosa en un vehículo acuoso para administración intravenosa. El contenido de sodio (Na+) es de 0,38 mg/ml (5 mEq/bolsa de 300 ml y 1,7 mEq/bolsa de 100 ml).
ZYVOX Tablet para administración oral contiene 600 mg de linezolid como comprimido recubierto con película. Los ingredientes inactivos son almidón de maíz, celulosa microcristalina, hidroxipropilcelulosa, glicolato de almidón de sodio, estearato de magnesio, hipromelosa, polietilenglicol, dióxido de titanio y cera de carnauba. El contenido de sodio (Na+) es de 2,92 mg por tableta de 600 mg (0,1 mEq/tableta).
ZYVOX 600 mg para suspensión oral se presenta como un gránulo/polvo con sabor a naranja para convertirlo en una suspensión para administración oral. Tras la reconstitución, cada 5 ml contiene 100 mg de linezolid. Los ingredientes inactivos son sacarosa, ácido cítrico, citrato de sodio, celulosa microcristalina y carboximetilcelulosa de sodio, aspartamo, goma de xantano, manitol, benzoato de sodio, dióxido de silicio coloidal, cloruro de sodio y sabores [ver INFORMACIÓN DEL PACIENTE ]. El contenido de sodio (Na+) es de 8,52 mg/5 mL (0,4 mEq/5 mL).
INDICACIONES
Neumonía nosocomial
ZYVOX está indicado para el tratamiento de la neumonía nosocomial causada por Staphylococcus aureus (aislados sensibles y resistentes a la meticilina) o Streptococcus pneumoniae [ver Estudios clínicos ].
La comunidad adquirió neumonía
ZYVOX 600 mg está indicado para el tratamiento de la neumonía adquirida en la comunidad causada por Streptococcus pneumoniae, incluidos los casos con bacteriemia concurrente o Staphylococcus aureus (solo aislados sensibles a la meticilina) [ver Estudios clínicos ].
Infecciones Complicadas De La Piel Y De La Estructura De La Piel
ZYVOX 600 mg está indicado para el tratamiento de infecciones complicadas de la piel y la estructura de la piel, incluidas las infecciones del pie diabético, sin osteomielitis concomitante, causadas por Staphylococcus aureus (aislados sensibles y resistentes a la meticilina), Streptococcus pyogenes o Streptococcus agalactiae. ZYVOX no se ha estudiado en el tratamiento de las úlceras de decúbito [ver Estudios clínicos ].
Infecciones no complicadas de la piel y de la estructura de la piel
ZYVOX 600 mg está indicado para el tratamiento de infecciones no complicadas de la piel y de la estructura de la piel causadas por Staphylococcus aureus (solo aislados sensibles a la meticilina) o Streptococcus pyogenes [ver Estudios clínicos ].
Infecciones por Enterococcus faecium resistente a la vancomicina
ZYVOX 600 mg está indicado para el tratamiento de infecciones por Enterococcus faecium resistentes a la vancomicina, incluidos los casos con bacteriemia concurrente [ver Estudios clínicos ].
Limitaciones de uso
- ZYVOX 600 mg no está indicado para el tratamiento de infecciones por gramnegativos. Es fundamental que la terapia específica contra Gram-negativos se inicie de inmediato si se documenta o sospecha un patógeno Gram-negativo concomitante [ver ADVERTENCIAS Y PRECAUCIONES ].
- La seguridad y eficacia de las formulaciones de 600 mg de ZYVOX administradas durante más de 28 días no se han evaluado en ensayos clínicos controlados [ver Estudios clínicos ].
Uso
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de ZYVOX 600 mg y otros medicamentos antibacterianos, ZYVOX debe usarse solo para tratar o prevenir infecciones que se compruebe o se sospeche que son causadas por bacterias susceptibles. Cuando la información de cultivo y susceptibilidad esté disponible, se debe considerar al seleccionar o modificar la terapia antibacteriana. En ausencia de tales datos, la epidemiología local y los patrones de susceptibilidad pueden contribuir a la selección empírica de la terapia.
DOSIFICACIÓN Y ADMINISTRACIÓN
Dosis general y administración
La dosis recomendada para las formulaciones de ZYVOX de 600 mg para el tratamiento de infecciones se describe en la Tabla 1.
No es necesario ajustar la dosis cuando se cambia de administración intravenosa a oral.
Administracion intravenosa
La inyección IV de ZYVOX de 600 mg se suministra en bolsas de infusión de dosis única listas para usar. Los productos farmacéuticos parenterales deben inspeccionarse visualmente en busca de partículas antes de la administración. Compruebe si hay fugas diminutas apretando firmemente la bolsa. Si se detectan fugas, deseche la solución, ya que la esterilidad puede verse afectada. Mantenga las bolsas de infusión en el envoltorio hasta que esté listo para usar. Almacenar a temperatura ambiente. Proteger de la congelación. La inyección IV de ZYVOX de 600 mg puede exhibir un color amarillo que puede intensificarse con el tiempo sin afectar negativamente la potencia.
La inyección de ZYVOX IV debe administrarse mediante infusión intravenosa durante un período de 30 a 120 minutos. No utilice esta bolsa de perfusión intravenosa en conexiones en serie. No se deben introducir aditivos en esta solución. Si la inyección IV de ZYVOX de 600 mg se va a administrar concomitantemente con otro medicamento, cada medicamento debe administrarse por separado de acuerdo con la dosis y la vía de administración recomendadas para cada producto. Deseche la porción no utilizada.
Si se usa la misma línea intravenosa para la infusión secuencial de varios medicamentos, la línea debe enjuagarse antes y después de la infusión de ZYVOX IV Inyectable con una solución de infusión compatible con ZYVOX 600 mg IV Inyectable y con cualquier otro fármaco administrado a través de esta vía común. .
Compatibilidades
Las soluciones intravenosas compatibles incluyen inyección de cloruro de sodio al 0,9 %, USP, inyección de dextrosa al 5 %, USP e inyección de Ringer lactato, USP.
incompatibilidades
Se produjeron incompatibilidades físicas cuando la inyección IV de ZYVOX de 600 mg se combinó con los siguientes medicamentos durante la administración simulada en el sitio Y: anfotericina B, clorpromazina HCl, diazepam, isotionato de pentamidina, lactobionato de eritromicina, fenitoína sódica y trimetoprima-sulfametoxazol. Además, se produjo una incompatibilidad química cuando se combinó la inyección de ZYVOX IV con ceftriaxona sódica.
Constitución De Suspensión Oral
ZYVOX para suspensión oral se suministra como polvo/gránulos para reconstitución. Golpee suavemente la botella para aflojar el polvo. Agregar un total de 123 mL de agua destilada en dos porciones. Después de agregar la primera mitad, agite vigorosamente para humedecer todo el polvo. Luego agregue la segunda mitad del agua y agite vigorosamente para obtener una suspensión uniforme. Después de la reconstitución, cada 5 mL de la suspensión contiene 100 mg de linezolid. Antes de usar, mezcle suavemente invirtiendo la botella de 3 a 5 veces. No sacudir. Almacene la suspensión constituida a temperatura ambiente. Usar dentro de los 21 días posteriores a la constitución.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Inyección IV de ZYVOX de 600 mg: 200 mg/100 ml (2 mg/ml) y 600 mg/300 ml (2 mg/ml) de dosis única de linezolida, bolsas de infusión de plástico flexible listas para usar en un envoltorio laminado de aluminio.
Tableta de 600 mg de ZYVOX:
Comprimido recubierto con película, blanco, en forma de cápsula, grabado con “ZYV” en un lado y “600” en el otro ZYVOX 600 mg para suspensión oral: gránulo/polvo seco, de color blanco a blanquecino, con sabor a naranja. Cuando se prepara según las indicaciones, cada frasco contendrá 150 ml de una suspensión que proporciona el equivalente a 100 mg de linezolid por cada 5 ml.
Almacenamiento y manipulación
Inyección
ZYVOX® 600 mg IV La inyección está disponible en bolsas de infusión de plástico flexible, listas para usar, de dosis única, en un envoltorio laminado de aluminio. Las bolsas de infusión y los puertos no están fabricados con látex de caucho natural. Las bolsas de infusión están disponibles en los siguientes tamaños de envase:
200 mg/100 mL (2 mg/mL) linezolid x 10 - CDN 0009-5137-04 600 mg/300 mL (2 mg/mL) linezolid x 10 - CDN 0009-5140-04
tabletas
Comprimidos de 600 mg de ZYVOX están disponibles de la siguiente manera:
600 mg (comprimidos recubiertos con película, blancos, en forma de cápsula, grabados con “ZYV” en un lado y “600” en el otro)
20 tabletas en botella de HDPE - CDN 0009-5138-02 Envases monodosis de 30 comprimidos - CDN 0009-5138-03
Suspensión oral
ZYVOX para suspensión oral está disponible como gránulo/polvo seco, de color blanco a blanquecino, con sabor a naranja. Cuando se prepara según las indicaciones, cada frasco contendrá 150 ml de una suspensión que proporciona el equivalente a 100 mg de linezolid por cada 5 ml. ZYVOX para suspensión oral se suministra de la siguiente manera:
100 mg/5 mL en frascos de vidrio de 240 mL - CDN 0009-5136-01
Almacenamiento y manipulación
Almacenar a 25°C (77°F). Proteger de la luz. Mantenga las botellas bien cerradas para protegerlas de la humedad. Se recomienda que las bolsas de perfusión se mantengan en el envoltorio hasta que estén listas para usar. Proteja las bolsas de infusión de la congelación.
Distribuido por Pharmacia & Upjohn Co Division of Pfizer Inc, NY, NY 10017. Revisado: noviembre de 2021.
EFECTOS SECUNDARIOS
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Adultos
La seguridad de las formulaciones de 600 mg de ZYVOX se evaluó en 2046 pacientes adultos inscritos en siete ensayos clínicos controlados con un comparador de fase 3, que recibieron tratamiento durante un máximo de 28 días.
De los pacientes tratados por infecciones de la piel y de la estructura de la piel no complicadas (SSSI), el 25,4 % de los pacientes tratados con ZYVOX y el 19,6 % de los pacientes tratados con el comparador experimentaron al menos un evento adverso relacionado con el fármaco. Para todas las demás indicaciones, el 20,4 % de los pacientes tratados con ZYVOX y el 14,3 % de los pacientes tratados con el comparador experimentaron al menos un evento adverso relacionado con el fármaco.
La Tabla 2 muestra la incidencia de reacciones adversas emergentes del tratamiento de todas las causales informadas en al menos el 1 % de los pacientes adultos en estos ensayos por dosis de ZYVOX.
De los pacientes tratados por uSSSI, el 3,5 % de los pacientes tratados con ZYVOX y el 2,4 % de los pacientes tratados con el comparador interrumpieron el tratamiento debido a eventos adversos relacionados con el fármaco. Para todas las demás indicaciones, las interrupciones debido a eventos adversos relacionados con el medicamento ocurrieron en el 2,1 % de los pacientes tratados con ZYVOX y en el 1,7 % de los pacientes tratados con el comparador. Los eventos adversos relacionados con el fármaco notificados con mayor frecuencia que dieron lugar a la interrupción del tratamiento fueron náuseas, dolor de cabeza, diarrea y vómitos.
Pacientes pediátricos
La seguridad de las formulaciones de ZYVOX se evaluó en 215 pacientes pediátricos con edades comprendidas entre el nacimiento y los 11 años, y en 248 pacientes pediátricos de 5 a 17 años (146 de estos, 248 tenían entre 5 y 11 años y 102 tenían entre 12 y 17 años). Estos pacientes se inscribieron en dos ensayos clínicos controlados con un comparador de fase 3 y recibieron tratamiento durante un máximo de 28 días. En el estudio de pacientes pediátricos hospitalizados (desde el nacimiento hasta los 11 años) con infecciones por Grampositivos, que se aleatorizaron 2 a 1 (linezolid: vancomicina), la mortalidad fue del 6,0 % (13/215) en el brazo de linezolid y del 3,0 % (3/101) en el brazo de vancomicina. Sin embargo, dada la grave enfermedad subyacente en la población de pacientes, no se pudo establecer una causalidad.
De los pacientes pediátricos tratados por uSSSI, el 19,2 % de los pacientes tratados con ZYVOX y el 14,1 % de los pacientes tratados con el comparador experimentaron al menos un evento adverso relacionado con el fármaco. Para todas las demás indicaciones, el 18,8 % de los pacientes tratados con ZYVOX y el 34,3 % de los pacientes tratados con el comparador experimentaron al menos un evento adverso relacionado con el fármaco.
La Tabla 3 muestra la incidencia de reacciones adversas emergentes del tratamiento de todas las causales notificadas en más del 1 % de los pacientes pediátricos (y más de 1 paciente) en cualquiera de los grupos de tratamiento en los ensayos de fase 3 controlados con el comparador.
De los pacientes pediátricos tratados por uSSSI, el 1,6 % de los pacientes tratados con ZYVOX y el 2,4 % de los pacientes tratados con el comparador interrumpieron el tratamiento debido a eventos adversos relacionados con el fármaco. Para todas las demás indicaciones, las interrupciones debido a eventos adversos relacionados con el medicamento ocurrieron en el 0,9 % de los pacientes tratados con ZYVOX y en el 6,1 % de los pacientes tratados con el comparador.
Anomalías de laboratorio
ZYVOX se ha asociado con trombocitopenia cuando se usa en dosis de hasta 600 mg cada 12 horas durante un máximo de 28 días. En los ensayos controlados con un comparador de fase 3, el porcentaje de pacientes adultos que desarrollaron un recuento de plaquetas sustancialmente bajo (definido como menos del 75 % del límite inferior normal y/o inicial) fue del 2,4 % (rango entre estudios: 0,3 a 10,0 %) con ZYVOX 600 mg y 1,5 % (rango entre estudios: 0,4 a 7,0 %) con un comparador. En un estudio de pacientes pediátricos hospitalizados con edades comprendidas entre el nacimiento y los 11 años, el porcentaje de pacientes que desarrollaron un recuento de plaquetas sustancialmente bajo (definido como menos del 75 % del límite inferior normal y/o inicial) fue del 12,9 % con ZYVOX 600 mg y 13,4% con vancomicina. En un estudio ambulatorio de pacientes pediátricos de 5 a 17 años, el porcentaje de pacientes que desarrollaron un recuento de plaquetas sustancialmente bajo fue del 0 % con ZYVOX y del 0,4 % con cefadroxilo. La trombocitopenia asociada con el uso de ZYVOX parece depender de la duración de la terapia (generalmente más de 2 semanas de tratamiento). Los recuentos de plaquetas de la mayoría de los pacientes volvieron al rango normal/línea de base durante el período de seguimiento. No se identificaron eventos adversos clínicos relacionados en los ensayos clínicos de fase 3 en pacientes que desarrollaron trombocitopenia. Se identificaron eventos de sangrado en pacientes trombocitopénicos en un programa de uso compasivo de ZYVOX; no se puede determinar el papel de linezolid en estos eventos [ver ADVERTENCIAS Y PRECAUCIONES ].
Los cambios observados en otros parámetros de laboratorio, sin tener en cuenta la relación con el fármaco, no revelaron diferencias sustanciales entre ZYVOX 600 mg y los comparadores. En general, estos cambios no fueron clínicamente significativos, no dieron lugar a la suspensión del tratamiento y fueron reversibles. La incidencia de pacientes adultos y pediátricos con al menos un valor hematológico o químico sérico sustancialmente anormal se presenta en las tablas 4, 5, 6 y 7.
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de ZYVOX. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco:
- Mielosupresión (incluyendo anemia, leucopenia, pancitopenia y trombocitopenia) [ver ADVERTENCIAS Y PRECAUCIONES ]; anemia sideroblástica.
- Neuropatía periférica y neuropatía óptica que a veces progresa hasta la pérdida de la visión [ver ADVERTENCIAS Y PRECAUCIONES ].
- Acidosis láctica [ver ADVERTENCIAS Y PRECAUCIONES ]. Aunque estos informes se han producido principalmente en pacientes tratados durante más tiempo que la duración máxima recomendada de 28 días, estos eventos también se han informado en pacientes que recibieron ciclos de tratamiento más breves.
- Se ha informado síndrome serotoninérgico en pacientes que reciben agentes serotoninérgicos concomitantes, incluidos antidepresivos como los inhibidores selectivos de la recaptación de serotonina (ISRS) y opioides, y ZYVOX [ver ADVERTENCIAS Y PRECAUCIONES ].
- Convulsiones [ver ADVERTENCIAS Y PRECAUCIONES ].
- Anafilaxia, angioedema, trastornos cutáneos ampollosos que incluyen reacciones adversas cutáneas graves (SCAR) como la necrólisis epidérmica tóxica y el síndrome de Stevens-Johnson, y vasculitis por hipersensibilidad.
- Se ha informado decoloración superficial de los dientes y de la lengua con el uso de linezolid. La decoloración de los dientes se eliminó con una limpieza dental profesional (desincrustación manual) en los casos con resultado conocido.
- Hipoglucemia, incluidos los episodios sintomáticos [ver ADVERTENCIAS Y PRECAUCIONES ].
- Hiponatremia y/o Síndrome de Secreción Inapropiada de Hormona Antidiurética (SIADH) [ver ADVERTENCIAS Y PRECAUCIONES ].
INTERACCIONES CON LA DROGAS
Inhibidores de la monoaminooxidasa
Linezolid es un inhibidor reversible no selectivo de la monoaminooxidasa [ver CONTRAINDICACIONES y FARMACOLOGÍA CLÍNICA ].
Agentes adrenérgicos y serotoninérgicos
Linezolid tiene el potencial de interactuar con agentes adrenérgicos y serotoninérgicos [ver ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ].
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
mielosupresión
Se ha informado mielosupresión (que incluye anemia, leucopenia, pancitopenia y trombocitopenia) en pacientes que reciben linezolid. En los casos en los que se conoce el resultado, cuando se interrumpió la linezolida, los parámetros hematológicos afectados aumentaron hacia los niveles previos al tratamiento. Los hemogramas completos deben controlarse semanalmente en pacientes que reciben linezolid, particularmente en aquellos que reciben linezolid durante más de dos semanas, aquellos con mielosupresión preexistente, aquellos que reciben medicamentos concomitantes que producen supresión de la médula ósea o aquellos con una infección crónica que tienen recibido tratamiento farmacológico antibacteriano previo o concomitante. Se debe considerar la interrupción del tratamiento con linezolida en pacientes que desarrollen o tengan un empeoramiento de la mielosupresión.
Neuropatía periférica y óptica
Se han informado neuropatías ópticas y periféricas en pacientes tratados con ZYVOX 600 mg, principalmente en aquellos pacientes tratados durante más tiempo que la duración máxima recomendada de 28 días. En los casos de neuropatía óptica que progresó a la pérdida de la visión, los pacientes fueron tratados durante períodos prolongados más allá de la duración máxima recomendada. Se ha informado visión borrosa en algunos pacientes tratados con ZYVOX durante menos de 28 días. También se ha informado neuropatía periférica y óptica en niños.
Si los pacientes experimentan síntomas de discapacidad visual, como cambios en la agudeza visual, cambios en la visión del color, visión borrosa o defecto del campo visual, se recomienda una evaluación oftálmica inmediata. La función visual debe controlarse en todos los pacientes que toman ZYVOX durante períodos prolongados (≥ 3 meses) y en todos los pacientes que informan nuevos síntomas visuales, independientemente de la duración del tratamiento con ZYVOX. Si ocurre neuropatía periférica u óptica, se debe sopesar el uso continuado de ZYVOX 600 mg en estos pacientes frente a los riesgos potenciales.
Síndrome de serotonina
Se han notificado informes espontáneos de síndrome serotoninérgico, incluidos casos fatales asociados con la administración conjunta de ZYVOX y agentes serotoninérgicos, incluidos antidepresivos como los inhibidores selectivos de la recaptación de serotonina (ISRS).
menos que sea clínicamente apropiado y los pacientes sean cuidadosamente observados en busca de signos y/o síntomas del síndrome serotoninérgico o reacciones similares al síndrome neuroléptico maligno (similares al SNM), linezolid no debe administrarse a pacientes con síndrome carcinoide y/o pacientes que toman cualquiera de los siguientes medicamentos : inhibidores de la recaptación de serotonina, antidepresivos tricíclicos, bupropión, buspirona, agonistas del receptor de serotonina 5-HT1 (triptanos) y opioides, incluida la meperidina [ver INTERACCIONES CON LA DROGAS y FARMACOLOGÍA CLÍNICA ].
En algunos casos, un paciente que ya esté recibiendo un antidepresivo serotoninérgico o buspirona puede requerir tratamiento urgente con linezolid. Si no hay alternativas disponibles a linezolid y los beneficios potenciales de linezolid superan los riesgos del síndrome serotoninérgico o reacciones similares al SNM, el antidepresivo serotoninérgico debe suspenderse de inmediato y administrarse linezolid. El paciente debe ser monitoreado durante dos semanas (cinco semanas si tomó fluoxetina) o hasta 24 horas después de la última dosis de linezolid, lo que ocurra primero. Los síntomas del síndrome serotoninérgico o reacciones similares al SNM incluyen hipertermia, rigidez, mioclono, inestabilidad autonómica y cambios en el estado mental que incluyen agitación extrema que progresa a delirio y coma. El paciente también debe ser monitoreado en busca de síntomas de interrupción del antidepresivo (consulte el prospecto del agente o agentes especificados para obtener una descripción de los síntomas de interrupción asociados).
Desequilibrio de mortalidad en un estudio de investigación en pacientes con infecciones del torrente sanguíneo relacionadas con el catéter, incluidos aquellos con infecciones en el sitio del catéter
Se observó un desequilibrio en la mortalidad en pacientes tratados con linezolid en comparación con vancomicina/dicloxacilina/oxacilina en un estudio abierto en pacientes gravemente enfermos con infecciones relacionadas con catéteres intravasculares [78/363 (21,5 %) frente a 58/363 (16,0 % ); odds ratio 1,426, IC 95% 0,970, 2,098]. Si bien no se ha establecido la causalidad, este desequilibrio observado ocurrió principalmente en pacientes tratados con linezolid en los que se identificaron patógenos gramnegativos, patógenos mixtos gramnegativos y grampositivos, o ningún patógeno al inicio del estudio, pero no se observó en pacientes con Solo infecciones por grampositivos.
Linezolid no está aprobado y no debe usarse para el tratamiento de pacientes con infecciones del torrente sanguíneo relacionadas con el catéter o infecciones en el sitio del catéter.
Linezolid no tiene actividad clínica contra patógenos Gram-negativos y no está indicado para el tratamiento de infecciones Gram-negativas. Es fundamental que la terapia específica contra Gram-negativos se inicie de inmediato si se documenta o sospecha un patógeno Gram-negativo concomitante [ver INDICACIONES ].
Diarrea asociada a Clostridioides difficile
Se ha informado diarrea asociada a Clostridioides difficile (CDAD) con el uso de casi todos los agentes antibacterianos, incluido ZYVOX 600 mg, y puede variar en gravedad desde diarrea leve hasta colitis fatal. El tratamiento con agentes antibacterianos altera la flora normal del colon y conduce al crecimiento excesivo de C. difficile.
C. difficile produce toxinas A y B que contribuyen al desarrollo de CDAD. Las cepas de C. difficile productoras de hipertoxina causan mayor morbilidad y mortalidad, ya que estas infecciones pueden ser refractarias a la terapia antimicrobiana y pueden requerir colectomía. Se debe considerar CDAD en todos los pacientes que presentan diarrea después del uso de medicamentos antibacterianos.
Es necesaria una cuidadosa historia clínica ya que se ha informado que la CDAD ocurre más de dos meses después de la administración de agentes antibacterianos.
Si se sospecha o se confirma CDAD, es posible que se deba suspender el uso continuo de medicamentos antibacterianos no dirigidos contra C. difficile. Se debe instituir el manejo adecuado de líquidos y electrolitos, la suplementación con proteínas, el tratamiento farmacológico antibacteriano de C. difficile y la evaluación quirúrgica según esté clínicamente indicado.
Interacciones potenciales que producen elevación de la presión arterial
A menos que se controle a los pacientes por posibles aumentos de la presión arterial, linezolid no debe administrarse a pacientes con hipertensión no controlada, feocromocitoma, tirotoxicosis y/o pacientes que toman cualquiera de los siguientes tipos de medicamentos: agentes simpaticomiméticos de acción directa o indirecta (p. ej., pseudoefedrina), agentes vasopresores (p. ej., epinefrina, norepinefrina), agentes dopaminérgicos (p. ej., dopamina, dobutamina) [ver INTERACCIONES CON LA DROGAS y FARMACOLOGÍA CLÍNICA ].
Acidosis láctica
Se ha informado acidosis láctica con el uso de ZYVOX. En los casos informados, los pacientes experimentaron episodios repetidos de náuseas y vómitos. Los pacientes que desarrollan náuseas o vómitos recurrentes, acidosis inexplicable o un nivel bajo de bicarbonato mientras reciben ZYVOX deben recibir una evaluación médica inmediata.
convulsiones
Se han notificado convulsiones en pacientes tratados con linezolid. En algunos de estos casos, se informó un historial de convulsiones o factores de riesgo de convulsiones.
Hipoglucemia
Se informaron casos posteriores a la comercialización de hipoglucemia sintomática en pacientes con diabetes mellitus que recibieron insulina o agentes hipoglucemiantes orales cuando se trataron con linezolid, un inhibidor de la MAO no selectivo y reversible. Algunos inhibidores de la MAO se han asociado con episodios de hipoglucemia en pacientes diabéticos que reciben insulina o agentes hipoglucemiantes. Si bien no se ha establecido una relación causal entre linezolid y la hipoglucemia, se debe advertir a los pacientes diabéticos de posibles reacciones hipoglucémicas cuando se les trata con linezolid.
Si ocurre hipoglucemia, se puede requerir una disminución en la dosis de insulina o agente hipoglucemiante oral, o la suspensión del agente hipoglucemiante oral, insulina o linezolida.
Hiponatremia y/o Síndrome de Secreción Inapropiada de Hormona Antidiurética (SIADH)
Se han observado casos posteriores a la comercialización de hiponatremia y/o síndrome de secreción inadecuada de hormona antidiurética (SIADH) en pacientes tratados con linezolid. En los casos informados, los signos y síntomas incluyeron confusión, somnolencia, debilidad generalizada y, en casos graves, provocaron insuficiencia respiratoria e incluso la muerte. Monitoree los niveles de sodio sérico regularmente en ancianos, en pacientes que toman diuréticos y en otros pacientes con riesgo de hiponatremia y/o SIADH mientras toman ZYVOX. Si se presentan signos y síntomas de hiponatremia y/o SIADH, suspenda ZYVOX 600 mg e instituya las medidas de apoyo adecuadas.
Riesgos en pacientes con fenilcetonuria
La fenilalanina puede ser dañina para los pacientes con fenilcetonuria (PKU). ZYVOX para suspensión oral contiene fenilalanina, un componente del aspartamo. Cada 5 ml de la suspensión oral de 100 mg/5 ml contiene 20 mg de fenilalanina. Antes de recetar ZYVOX 600 mg para suspensión oral a un paciente con PKU, considere la cantidad diaria combinada de fenilalanina de todas las fuentes, incluido ZYVOX para suspensión oral.
Las otras formulaciones de ZYVOX no contienen fenilalanina.
Desarrollo de bacterias resistentes a los medicamentos
Prescribir ZYVOX en ausencia de una infección bacteriana comprobada o fuertemente sospechada o una indicación profiláctica es poco probable que brinde beneficios al paciente y aumenta el riesgo de desarrollo de bacterias resistentes a los medicamentos.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
No se han realizado estudios de por vida en animales para evaluar el potencial carcinogénico de linezolid. No se encontró potencial mutagénico ni clastogénico en una serie de pruebas que incluyen: ensayos de mutagenicidad (reversión bacteriana de Ames y mutación de células CHO), un ensayo de síntesis de ADN no programada (UDS) in vitro, un ensayo de aberración cromosómica in vitro en linfocitos humanos y un Ensayo de micronúcleos de ratón in vivo.
Linezolid no afectó la fertilidad ni el rendimiento reproductivo de ratas hembra adultas que recibieron dosis orales de hasta 100 mg/kg/día durante 14 días antes del apareamiento hasta el día 7 de gestación. Disminuyó reversiblemente la fertilidad y el rendimiento reproductivo en ratas macho adultas cuando se administró en dosis ≥ 50 mg/kg/día, con exposiciones aproximadamente iguales o mayores que el nivel de exposición humano esperado (las comparaciones de exposición se basan en las AUC). Los efectos reversibles sobre la fertilidad estuvieron mediados por una espermatogénesis alterada. Las espermátides afectadas contenían mitocondrias anormalmente formadas y orientadas y no eran viables. Se observó hipertrofia de células epiteliales e hiperplasia en el epidídimo junto con disminución de la fertilidad. No se observaron cambios similares en el epidídimo en perros.
En ratas macho sexualmente maduras expuestas al fármaco cuando eran jóvenes, se observó una disminución leve de la fertilidad después del tratamiento con linezolid durante la mayor parte de su período de desarrollo sexual (50 mg/kg/día desde los días 7 a 36 de edad y 100 mg/kg/día desde los días 37 a 55 de edad), con exposiciones hasta 1,7 veces mayores que las AUC medias observadas en pacientes pediátricos de 3 meses a 11 años. No se observó disminución de la fertilidad con períodos de tratamiento más cortos, correspondientes a la exposición en el útero durante el período neonatal temprano (día 6 de gestación hasta el día 5 posnatal), exposición neonatal (días 5 a 21 posnatales) o exposición juvenil (días 22 a 35 posnatales). ). Se observaron reducciones reversibles en la motilidad de los espermatozoides y una morfología alterada de los espermatozoides en ratas tratadas desde el día 22 al 35 después del nacimiento.
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
Los datos disponibles de los informes de casos publicados y posteriores a la comercialización con el uso de linezolid en mujeres embarazadas no han identificado un riesgo asociado con el fármaco de defectos congénitos importantes, aborto espontáneo o resultados maternos o fetales adversos. Cuando se administró durante la organogénesis, linezolid no causó malformaciones en ratones, ratas o conejos a niveles de exposición materna de aproximadamente 6,5 veces (ratones), equivalentes a (ratas) o 0,06 veces (conejos) la exposición terapéutica clínica, según las AUC. Sin embargo, se observó letalidad embriofetal en ratones a 6,5 veces la exposición humana estimada. Cuando se administraron dosis a ratas hembra durante la organogénesis hasta la lactancia, la supervivencia posnatal de las crías disminuyó a dosis aproximadamente equivalentes a la exposición humana estimada en base a las AUC (ver Datos ).
Se desconoce el riesgo de fondo de defectos congénitos importantes y abortos espontáneos para las poblaciones indicadas. Todos los embarazos tienen un riesgo de fondo de defecto congénito, pérdida u otros resultados adversos. En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 al 4 % y del 15 al 20 %, respectivamente.
Datos
Datos de animales
En ratones, se observaron toxicidades embriofetales solo a dosis que causaron toxicidad materna (signos clínicos y reducción del aumento de peso corporal). Una dosis oral de 450 mg/kg/día administrada desde el día de gestación (GD) 6-16 (6,5 veces la exposición humana estimada en función de las AUC) se correlacionó con un aumento de la muerte embrionaria posterior a la implantación, incluida la pérdida total de la camada, la disminución del peso corporal fetal y una mayor incidencia de fusión del cartílago costal. No se observaron toxicidades maternas ni embriofetales con dosis de hasta 150 mg/kg/día. No se observaron malformaciones fetales.
En ratas, se observó toxicidad fetal con 15 y 50 mg/kg/día administrados por vía oral desde GD 6-17 (exposiciones de 0,22 veces a aproximadamente el equivalente a la exposición humana estimada, respectivamente, según las AUC). Los efectos consistieron en una disminución del peso corporal fetal y una reducción de la osificación de las esternebras, un hallazgo que a menudo se observa en asociación con una disminución del peso corporal fetal. No se observaron malformaciones fetales. Se observó toxicidad materna, en forma de reducción del aumento de peso corporal, con 50 mg/kg/día.
En conejos, la reducción del peso corporal fetal ocurrió solo en presencia de toxicidad materna (signos clínicos, reducción del aumento de peso corporal y consumo de alimentos) cuando se administró una dosis oral de 15 mg/kg/día administrada desde GD 6-20 (0,06 veces la exposición humana estimada basada en las AUC). No se observaron malformaciones fetales.
Cuando se trató a ratas hembra con 50 mg/kg/día (aproximadamente equivalente a la exposición humana estimada basada en las AUC) de linezolid durante el embarazo y la lactancia (GD 6 hasta el día 20 de lactancia), la supervivencia de las crías disminuyó en los días 1 a 4 posnatales. Las crías macho y hembra a las que se les permitió madurar hasta la edad reproductiva, cuando se aparearon, mostraron un aumento en la pérdida previa a la implantación.
Lactancia
Resumen de riesgos
Linezolid está presente en la leche materna. Según los datos de los informes de casos publicados disponibles, la dosis diaria de linezolid que el lactante recibiría de la leche materna sería aproximadamente del 6 % al 9 % de la dosis terapéutica recomendada para lactantes (10 mg/kg cada 8 horas). No hay información sobre los efectos de linezolid en el lactante; sin embargo, la diarrea y los vómitos fueron las reacciones adversas más frecuentes notificadas en ensayos clínicos en lactantes que recibieron linezolid terapéuticamente [ver REACCIONES ADVERSAS y (ver Consideraciones clínicas). No hay información sobre los efectos de linezolid en la producción de leche. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de linezolid de la madre y cualquier posible efecto adverso en el niño amamantado debido a linezolid o a la afección materna subyacente.
Consideraciones clínicas
Aconseje a las mujeres lactantes que vigilen a un bebé amamantado en busca de diarrea y vómitos.
Hembras y machos con potencial reproductivo
Esterilidad
machos
Según los hallazgos de estudios en ratas, ZYVOX puede afectar de forma reversible la fertilidad en pacientes masculinos [ver Toxicología no clínica )].
Uso pediátrico
La seguridad y la eficacia de ZYVOX 600 mg para el tratamiento de pacientes pediátricos con las siguientes infecciones están respaldadas por la evidencia de estudios adecuados y bien controlados en adultos, datos farmacocinéticos en pacientes pediátricos y datos adicionales de un estudio controlado con un comparador de bacterias grampositivas infecciones en pacientes pediátricos con edades comprendidas entre el nacimiento y los 11 años [ver INDICACIONES , FARMACOLOGÍA CLÍNICA y Estudios clínicos ]:
- neumonía nosocomial
- infecciones complicadas de la piel y de la estructura de la piel
- neumonía adquirida en la comunidad (también respaldada por evidencia de un estudio no controlado en pacientes con edades comprendidas entre los 8 meses y los 12 años)
- Infecciones por Enterococcus faecium resistentes a la vancomicina
La seguridad y la eficacia de ZYVOX 600 mg para el tratamiento de pacientes pediátricos con la siguiente infección se establecieron en un estudio controlado con un comparador en pacientes pediátricos con edades comprendidas entre los 5 y los 17 años [ver Estudios clínicos ]:
- infecciones no complicadas de la piel y de la estructura de la piel causadas por Staphylococcus aureus (cepas sensibles a la meticilina solamente) o Streptococcus pyogenes
La información farmacocinética generada en pacientes pediátricos con derivaciones ventriculoperitoneales mostró concentraciones variables de linezolida en el líquido cefalorraquídeo (LCR) después de dosis únicas y múltiples de linezolida; las concentraciones terapéuticas no se alcanzaron ni mantuvieron de forma consistente en el LCR. Por lo tanto, no se recomienda el uso de linezolid para el tratamiento empírico de pacientes pediátricos con infecciones del sistema nervioso central.
La farmacocinética de linezolid ha sido evaluada en pacientes pediátricos desde el nacimiento hasta los 17 años de edad. En general, el aclaramiento de linezolid basado en el peso disminuye gradualmente con el aumento de la edad de los pacientes pediátricos. Sin embargo, en los recién nacidos prematuros (edad gestacional DOSIFICACIÓN Y ADMINISTRACIÓN y FARMACOLOGÍA CLÍNICA ].
En experiencia clínica limitada, 5 de 6 (83 %) pacientes pediátricos con infecciones debidas a patógenos grampositivos con concentraciones inhibitorias mínimas (MIC) de 4 mcg/mL tratados con ZYVOX 600 mg tuvieron curas clínicas. Sin embargo, los pacientes pediátricos presentan una variabilidad más amplia en el aclaramiento de linezolid y la exposición sistémica (AUC) en comparación con los adultos. En pacientes pediátricos con una respuesta clínica subóptima, particularmente aquellos con patógenos con MIC de 4 mcg/mL, se debe considerar una exposición sistémica más baja, el sitio y la gravedad de la infección, y la afección médica subyacente al evaluar la respuesta clínica [ver FARMACOLOGÍA CLÍNICA y DOSIFICACIÓN Y ADMINISTRACIÓN ].
Uso geriátrico
De los 2046 pacientes tratados con ZYVOX 600 mg en los ensayos clínicos controlados con un comparador de fase 3, 589 (29 %) tenían 65 años o más y 253 (12 %) tenían 75 años o más. No se observaron diferencias generales en la seguridad o la eficacia entre estos pacientes y los pacientes más jóvenes, y otra experiencia clínica informada no ha identificado diferencias en las respuestas entre los ancianos y los pacientes más jóvenes, pero no se puede descartar una mayor sensibilidad de algunas personas mayores.
SOBREDOSIS
En caso de sobredosis, se aconseja tratamiento de soporte, con mantenimiento de la filtración glomerular. La hemodiálisis puede facilitar una eliminación más rápida de linezolid. En un ensayo clínico de fase 1, se eliminó aproximadamente el 30 % de una dosis de linezolid durante una sesión de hemodiálisis de 3 horas que comenzó 3 horas después de administrar la dosis de linezolid. No hay datos disponibles para la eliminación de linezolid con diálisis peritoneal o hemoperfusión. Los signos clínicos de toxicidad aguda en animales fueron disminución de la actividad y ataxia en ratas y vómitos y temblores en perros tratados con 3000 mg/kg/día y 2000 mg/kg/día, respectivamente.
CONTRAINDICACIONES
Hipersensibilidad
Las formulaciones de ZYVOX están contraindicadas para su uso en pacientes con hipersensibilidad conocida a linezolid o cualquiera de los otros componentes del producto.
Inhibidores de la monoaminooxidasa
Linezolid no debe usarse en pacientes que toman cualquier medicamento que inhiba las monoaminooxidasas A o B (por ejemplo, fenelzina, isocarboxazida) o dentro de las dos semanas posteriores a la toma de dicho medicamento.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
ZYVOX es un fármaco antibacteriano [ver Microbiología ].
Farmacodinámica
En un estudio aleatorizado, cruzado y controlado con placebo, QT completo, a 40 sujetos sanos se les administró una dosis única de 600 mg de ZYVOX a través de una infusión IV de 1 hora, una dosis única de 1200 mg de ZYVOX a través de una infusión IV de 1 hora, placebo y un dosis oral única de control positivo. En las dosis de 600 mg y 1200 mg de ZYVOX 600 mg, no se detectó ningún efecto significativo sobre el intervalo QTc en la concentración plasmática máxima ni en ningún otro momento.
Farmacocinética
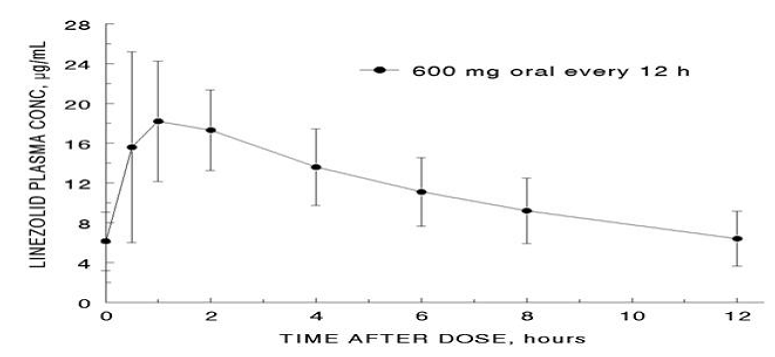
Los parámetros farmacocinéticos medios de linezolid en adultos después de dosis orales e intravenosas únicas y múltiples se resumen en la Tabla 8. Las concentraciones plasmáticas de linezolid en el estado estacionario después de dosis orales de 600 mg administradas cada 12 horas se muestran en la Figura 1.
Figura 1. Concentraciones plasmáticas de linezolida en adultos en estado estacionario después de la administración oral cada 12 horas (media ± desviación estándar, n=16)
Absorción
Linezolid se absorbe ampliamente después de la dosificación oral. Las concentraciones plasmáticas máximas se alcanzan aproximadamente de 1 a 2 horas después de la administración de la dosis y la biodisponibilidad absoluta es de aproximadamente el 100 %. Por lo tanto, linezolid se puede administrar por vía oral o intravenosa sin ajustar la dosis.
Linezolid puede administrarse independientemente del horario de las comidas. El tiempo para alcanzar la concentración máxima se retrasa de 1,5 horas a 2,2 horas y la Cmax se reduce en aproximadamente un 17 % cuando se administran alimentos ricos en grasas con linezolida. Sin embargo, la exposición total medida como AUC0-∞ es similar en ambas condiciones.
Distribución
Los estudios farmacocinéticos en animales y humanos han demostrado que la linezolida se distribuye fácilmente a los tejidos bien perfundidos. La unión a proteínas plasmáticas de linezolid es de aproximadamente un 31 % y es independiente de la concentración. El volumen de distribución de linezolid en estado estacionario promedió 40 a 50 litros en voluntarios adultos sanos.
Las concentraciones de linezolid se han determinado en varios fluidos de un número limitado de sujetos en estudios de voluntarios de Fase 1 luego de dosis múltiples de linezolid. La proporción de linezolid en la saliva en relación con el plasma fue de 1,2 a 1 y la proporción de linezolid en el sudor en relación con el plasma fue de 0,55 a 1.
Metabolismo
Linezolid se metaboliza principalmente por oxidación del anillo de morfolina, lo que da como resultado dos metabolitos de ácido carboxílico con anillo abierto inactivo: el metabolito de ácido aminoetoxiacético (A) y el metabolito de hidroxietilglicina (B). Se supone que la formación del metabolito A se forma a través de una vía enzimática, mientras que el metabolito B está mediado por un mecanismo de oxidación química no enzimática in vitro. Los estudios in vitro han demostrado que linezolid se metaboliza mínimamente y puede estar mediado por el citocromo P450 humano. Sin embargo, la ruta metabólica de linezolid no se comprende completamente.
Excreción
El aclaramiento no renal representa aproximadamente el 65% del aclaramiento total de linezolid. En condiciones de estado estacionario, aproximadamente el 30 % de la dosis aparece en la orina como linezolida, el 40 % como metabolito B y el 10 % como metabolito A. El aclaramiento renal medio de linezolida es de 40 ml/min, lo que sugiere una reabsorción tubular neta. Prácticamente no aparece linezolid en las heces, mientras que aproximadamente el 6 % de la dosis aparece en las heces como metabolito B y el 3 % como metabolito A.
Se observó un pequeño grado de no linealidad en la depuración con dosis crecientes de linezolid, lo que parece deberse a una menor depuración renal y no renal de linezolid a concentraciones más altas. Sin embargo, la diferencia en el aclaramiento fue pequeña y no se reflejó en la semivida de eliminación aparente.
Poblaciones Específicas
Pacientes geriátricos
La farmacocinética de linezolid no se altera significativamente en pacientes de edad avanzada (65 años o más). Por lo tanto, no es necesario ajustar la dosis para pacientes geriátricos.
Pacientes pediátricos
La farmacocinética de linezolid después de una dosis intravenosa única se investigó en pacientes pediátricos con edades comprendidas entre el nacimiento y los 17 años (incluidos los recién nacidos prematuros y nacidos a término), en sujetos adolescentes sanos con edades comprendidas entre los 12 y los 17 años y en pacientes pediátricos con edades comprendidas entre los 12 y los 17 años. en la edad de 1 semana a 12 años. Los parámetros farmacocinéticos de linezolid se resumen en la Tabla 9 para las poblaciones pediátricas estudiadas y sujetos adultos sanos después de la administración de dosis únicas por vía intravenosa.
La Cmax y el volumen de distribución (Vss) de linezolid son similares independientemente de la edad en pacientes pediátricos. Sin embargo, el aclaramiento plasmático de linezolid varía en función de la edad. Con la exclusión de los recién nacidos prematuros de menos de una semana de edad, la depuración basada en el peso es más rápida en los grupos de edad más jóvenes que van desde
Se observaron valores medios diarios de AUC similares en pacientes pediátricos desde el nacimiento hasta los 11 años de edad que recibieron dosis cada 8 horas en relación con adolescentes o adultos que recibieron dosis cada 12 horas. Por lo tanto, la dosis para pacientes pediátricos de hasta 11 años de edad debe ser de 10 mg/kg cada 8 horas. Los pacientes pediátricos de 12 años y mayores deben recibir 600 mg cada 12 horas [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Género
Las mujeres tienen un volumen de distribución de linezolid ligeramente menor que los hombres. Las concentraciones plasmáticas son más altas en las mujeres que en los hombres, lo que se debe en parte a las diferencias de peso corporal. Después de una dosis de 600 mg, el aclaramiento oral medio es aproximadamente un 38 % más bajo en mujeres que en hombres. Sin embargo, no hay diferencias significativas de género en la constante de tasa de eliminación aparente media o la vida media. Por lo tanto, no se espera que la exposición al fármaco en mujeres aumente sustancialmente más allá de los niveles que se sabe que son bien tolerados. Por lo tanto, no parece necesario un ajuste de dosis por género.
Insuficiencia renal
La farmacocinética del fármaco original, linezolid, no se altera en pacientes con algún grado de insuficiencia renal; sin embargo, los dos metabolitos principales de linezolid se acumulan en pacientes con insuficiencia renal, y la cantidad de acumulación aumenta con la gravedad de la disfunción renal (consulte la Tabla 10). La farmacocinética de linezolid y sus dos metabolitos también se ha estudiado en pacientes con enfermedad renal en etapa terminal (ESRD) que reciben hemodiálisis. En el estudio ESRD, 14 pacientes recibieron una dosis de linezolid de 600 mg cada 12 horas durante 14,5 días (consulte la Tabla 11). Dado que se alcanzan concentraciones plasmáticas similares de linezolida independientemente de la función renal, no se recomienda ajustar la dosis en pacientes con insuficiencia renal. Sin embargo, dada la ausencia de información sobre la importancia clínica de la acumulación de los metabolitos primarios, se debe sopesar el uso de linezolid en pacientes con insuficiencia renal frente a los riesgos potenciales de acumulación de estos metabolitos. Tanto linezolid como los dos metabolitos se eliminan por hemodiálisis. No hay información disponible sobre el efecto de la diálisis peritoneal en la farmacocinética de linezolid. Aproximadamente el 30% de una dosis se eliminó en una sesión de hemodiálisis de 3 horas que comenzó 3 horas después de que se administró la dosis de linezolid; por lo tanto, linezolid debe administrarse después de la hemodiálisis.
Deterioro hepático
La farmacocinética de linezolid no se altera en pacientes (n=7) con insuficiencia hepática de leve a moderada (clase A o B de Child-Pugh). Según la información disponible, no se recomienda ajustar la dosis en pacientes con insuficiencia hepática de leve a moderada. No se ha evaluado la farmacocinética de linezolid en pacientes con insuficiencia hepática grave.
Interacciones con la drogas
Fármacos metabolizados por el citocromo P450
Linezolid no es un inductor del citocromo P450 (CYP450) en ratas. Además, linezolid no inhibe las actividades de las isoformas CYP humanas clínicamente significativas (p. ej., 1A2, 2C9, 2C19, 2D6, 2E1, 3A4). Por lo tanto, no se espera que linezolid afecte la farmacocinética de otros fármacos metabolizados por estas enzimas principales. La administración concomitante de linezolid no altera sustancialmente las características farmacocinéticas de la (S)-warfarina, que se metaboliza ampliamente por CYP2C9. Fármacos como la warfarina y la fenitoína, que son sustratos de CYP2C9, se pueden administrar con linezolid sin cambios en el régimen de dosificación.
Medicamentos antibacterianos
Aztreonam: La farmacocinética de linezolid o aztreonam no se altera cuando se administran juntos.
Gentamicina: La farmacocinética de linezolid o gentamicina no se altera cuando se administran juntas.
Antioxidantes
El potencial de interacciones farmacológicas con linezolid y los antioxidantes vitamina C y vitamina E se estudió en voluntarios sanos. A los sujetos se les administró una dosis oral de 600 mg de linezolid el día 1 y otra dosis de 600 mg de linezolid el día 8. Los días 2 a 9, los sujetos recibieron vitamina C (1000 mg/día) o vitamina E (800 UI/día). día). El AUC0-∞ de linezolid aumentó un 2,3 % cuando se coadministró con vitamina C y un 10,9 % cuando se coadministró con vitamina E. No se recomienda ajustar la dosis de linezolid durante la coadministración con vitamina C o vitamina E.
Fuertes inductores CYP 3A4
rifampicina
El efecto de la rifampicina sobre la farmacocinética de linezolid se evaluó en un estudio de 16 hombres adultos sanos. A los voluntarios se les administró linezolid oral 600 mg dos veces al día durante 5 dosis con y sin rifampicina 600 mg una vez al día durante 8 días. La coadministración de rifampicina con linezolid resultó en una disminución del 21 % en la Cmax de linezolid [90 % IC, 15 % - 27 %] y una disminución del 32 % en el AUC0-12 de linezolid [90 % IC, 27 % - 37 %]. Se desconoce el significado clínico de esta interacción. El mecanismo de esta interacción no se comprende completamente y puede estar relacionado con la inducción de enzimas hepáticas. Otros inductores potentes de las enzimas hepáticas (p. ej., carbamazepina, fenitoína, fenobarbital) podrían causar una disminución similar o menor en la exposición a linezolid.
Inhibición de la monoaminooxidasa
Linezolid es un inhibidor reversible no selectivo de la monoaminooxidasa. Por lo tanto, linezolid tiene el potencial de interacción con agentes adrenérgicos y serotoninérgicos.
Agentes adrenérgicos
Algunas personas que reciben ZYVOX 600 mg pueden experimentar un aumento reversible de la respuesta presora a los agentes simpaticomiméticos de acción indirecta, vasopresores o dopaminérgicos. Se han estudiado específicamente fármacos de uso común como la fenilpropanolamina y la pseudoefedrina. Las dosis iniciales de agentes adrenérgicos, como dopamina o epinefrina, deben reducirse y titularse para lograr la respuesta deseada.
tiramina
Se ha observado una respuesta presora significativa en sujetos adultos normales que reciben dosis de linezolid y tiramina de más de 100 mg. Por lo tanto, los pacientes que reciben linezolid deben evitar consumir grandes cantidades de alimentos o bebidas con alto contenido de tiramina [ver INFORMACIÓN DEL PACIENTE ].
Pseudoefedrina HCl o fenilpropanolamina HCl
Se observa un aumento reversible de la respuesta presora de pseudoefedrina HCl (PSE) o fenilpropanolamina HCl (PPA) cuando se administra linezolid a sujetos sanos normotensos [ver ADVERTENCIAS Y PRECAUCIONES y INTERACCIONES CON LA DROGAS ]. No se ha realizado un estudio similar en pacientes hipertensos. Los estudios de interacción realizados en sujetos normotensos evaluaron los efectos en la presión arterial y la frecuencia cardíaca del placebo, PPA o PSE solos, linezolid solo y la combinación de linezolid en estado estacionario (600 mg cada 12 horas durante 3 días) con dos dosis de PPA ( 25 mg) o PSE (60 mg) administrados con 4 horas de diferencia. La frecuencia cardíaca no se vio afectada por ninguno de los tratamientos. La presión arterial aumentó con ambos tratamientos combinados. Los niveles máximos de presión arterial se observaron de 2 a 3 horas después de la segunda dosis de PPA o PSE, y regresaron a la línea base de 2 a 3 horas después del pico. A continuación se muestran los resultados del estudio PPA, que muestran la presión arterial sistólica máxima media (y rango) en mm Hg: placebo = 121 (103 a 158); linezolid solo = 120 (107 a 135); PPA solo = 125 (106 a 139); PPA con linezolid = 147 (129 a 176). Los resultados del estudio PSE fueron similares a los del estudio PPA. El aumento medio máximo de la presión arterial sistólica con respecto al valor inicial fue de 32 mm Hg (rango: 20-52 mm Hg) y 38 mm Hg (rango: 18-79 mm Hg) durante la coadministración de linezolid con pseudoefedrina o fenilpropanolamina, respectivamente.
Agentes serotoninérgicos
dextrometorfano
La posible interacción farmacológica con dextrometorfano se estudió en voluntarios sanos. A los sujetos se les administró dextrometorfano (dos dosis de 20 mg administradas con 4 horas de diferencia) con o sin linezolid. No se han observado efectos del síndrome serotoninérgico (confusión, delirio, inquietud, temblores, rubor, diaforesis, hiperpirexia) en sujetos normales que reciben linezolid y dextrometorfano.
Microbiología
Mecanismo de acción
Linezolid es un agente antibacteriano sintético de la clase de las oxazolidinona, que tiene utilidad clínica en el tratamiento de infecciones causadas por bacterias aerobias Gram-positivas. El espectro de actividad in vitro de linezolid también incluye ciertas bacterias Gram-negativas y bacterias anaerobias. Linezolid se une a un sitio en el ARN ribosómico 23S bacteriano de la subunidad 50S e impide la formación de un complejo de iniciación 70S funcional, que es esencial para la reproducción bacteriana. Los resultados de los estudios de muerte por tiempo han demostrado que linezolid es bacteriostático contra enterococos y estafilococos. Para los estreptococos, se encontró que linezolid era bactericida para la mayoría de los aislamientos.
Resistencia
Los estudios in vitro han demostrado que las mutaciones puntuales en el ARNr 23S están asociadas con la resistencia a la linezolida. Se han publicado informes de Enterococcus faecium resistentes a vancomicina que se vuelven resistentes a linezolid durante su uso clínico. Hay informes de Staphylococcus aureus (resistente a la meticilina) que desarrollan resistencia a linezolid durante el uso clínico. La resistencia a linezolid en estos organismos está asociada con una mutación puntual en el ARNr 23S (sustitución de timina por guanina en la posición 2576) del organismo. Los organismos resistentes a las oxazolidinonas a través de mutaciones en los genes cromosómicos que codifican el ARNr 23S o las proteínas ribosómicas (L3 y L4) generalmente tienen resistencia cruzada a la linezolida. También se ha informado resistencia a linezolid en estafilococos mediada por la enzima metiltransferasa. Esta resistencia está mediada por el gen cfr (cloranfenicol-florfenicol) ubicado en un plásmido que es transferible entre estafilococos.
Interacción con otros fármacos antimicrobianos
Estudios in vitro han demostrado aditividad o indiferencia entre linezolid y vancomicina, gentamicina, rifampicina, imipenem-cilastatina, aztreonam, ampicilina o estreptomicina.
Se ha demostrado que linezolid es activo contra la mayoría de los aislados de los siguientes microorganismos, tanto in vitro como en infecciones clínicas [ver INDICACIONES ].
bacterias grampositivas
Enterococcus faecium (solo aislados resistentes a la vancomicina) Staphylococcus aureus (incluidos los aislados resistentes a la meticilina) Streptococcus agalactiae Streptococcus pneumoniae Streptococcus pyogenes
Los siguientes datos in vitro están disponibles, pero se desconoce su importancia clínica. Más del 90 % de las siguientes bacterias exhiben una CIM in vitro menor o igual al punto de corte sensible a linezolid para organismos de género similar. La seguridad y eficacia de linezolid en el tratamiento de infecciones clínicas debidas a estas bacterias no se han establecido en ensayos clínicos adecuados y bien controlados.
bacterias grampositivas
Enterococcus faecalis (incluidos los aislados resistentes a la vancomicina) Enterococcus faecium (aislados sensibles a la vancomicina) Staphylococcus epidermidis (incluidos los aislados resistentes a la meticilina) Staphylococcus haemolyticus Estreptococos del grupo viridans
Bacterias Gram-negativo
Pasteurella multicida
Pruebas de susceptibilidad
Para obtener información específica sobre los criterios interpretativos de las pruebas de susceptibilidad y los métodos de prueba asociados y los estándares de control de calidad reconocidos por la FDA para este medicamento, consulte: https://www.fda.gov/STIC.
Toxicología Animal Y/o Farmacología
Los órganos diana de la toxicidad de linezolid fueron similares en ratas y perros jóvenes y adultos. En estudios con animales se ha observado mielosupresión dependiente de la dosis y el tiempo, como se evidencia por hipocelularidad de la médula ósea/disminución de la hematopoyesis, disminución de la hematopoyesis extramedular en el bazo y el hígado, y disminución de los niveles de eritrocitos, leucocitos y plaquetas circulantes. El agotamiento linfoide se produjo en el timo, los ganglios linfáticos y el bazo. En general, los hallazgos linfoides se asociaron con anorexia, pérdida de peso y supresión del aumento de peso corporal, lo que puede haber contribuido a los efectos observados.
En ratas a las que se les administró linezolid por vía oral durante 6 meses, se observó una degeneración axonal irreversible, de mínima a leve, de los nervios ciáticos a 80 mg/kg/día; También se observó una degeneración mínima del nervio ciático en 1 macho con este nivel de dosis en una necropsia intermedia de 3 meses. Se realizó una evaluación morfológica sensible de los tejidos fijados por perfusión para investigar la evidencia de degeneración del nervio óptico. La degeneración mínima a moderada del nervio óptico fue evidente en 2 ratas macho después de 6 meses de administración de la dosis, pero la relación directa con el fármaco fue equívoca debido a la naturaleza aguda del hallazgo y su distribución asimétrica. La degeneración nerviosa observada fue microscópicamente comparable a la degeneración unilateral espontánea del nervio óptico notificada en ratas de edad avanzada y puede ser una exacerbación del cambio de fondo común.
Estos efectos se observaron a niveles de exposición comparables a los observados en algunos sujetos humanos. Los efectos hematopoyéticos y linfoides fueron reversibles, aunque en algunos estudios, la reversión fue incompleta durante el período de recuperación.
Estudios clínicos
Adultos
Neumonía nosocomial
Se incluyeron pacientes adultos con neumonía nosocomial documentada clínica y radiológicamente en un ensayo aleatorizado, multicéntrico y doble ciego. Los pacientes fueron tratados durante 7 a 21 días. Un grupo recibió 600 mg de inyección IV de ZYVOX cada 12 horas y el otro grupo recibió 1 g de vancomicina cada 12 horas por vía intravenosa. Ambos grupos recibieron aztreonam de forma concomitante (1 a 2 g cada 8 horas por vía intravenosa), que podía continuarse si estaba clínicamente indicado. Hubo 203 pacientes tratados con linezolid y 193 tratados con vancomicina inscritos en el estudio. Ciento veintidós (60%) pacientes tratados con linezolid y 103 (53%) pacientes tratados con vancomicina fueron evaluables clínicamente. Las tasas de curación en pacientes clínicamente evaluables fueron del 57 % para los pacientes tratados con linezolid y del 60 % para los pacientes tratados con vancomicina. Las tasas de curación en pacientes clínicamente evaluables con neumonía asociada al ventilador fueron del 47 % para los pacientes tratados con linezolid y del 40 % para los pacientes tratados con vancomicina. Un análisis modificado por intención de tratar (MITT) de 94 pacientes tratados con linezolid y 83 pacientes tratados con vancomicina incluyó sujetos a los que se les aisló un patógeno antes del tratamiento. Las tasas de curación en el análisis MITT fueron del 57 % en los pacientes tratados con linezolid y del 46 % en los pacientes tratados con vancomicina. Las tasas de curación por patógeno para pacientes microbiológicamente evaluables se presentan en la Tabla 12.
Infecciones Complicadas De La Piel Y De La Estructura De La Piel
Los pacientes adultos con infecciones complicadas de la piel y de la estructura de la piel clínicamente documentadas se inscribieron en un ensayo aleatorizado, multicéntrico, doble ciego y con doble simulación que comparó los medicamentos del estudio administrados por vía intravenosa seguidos de medicamentos administrados por vía oral durante un total de 10 a 21 días de tratamiento. Un grupo de pacientes recibió ZYVOX IV Inyección de 600 mg cada 12 horas seguido de ZYVOX 600 mg Tabletas de 600 mg cada 12 horas; el otro grupo recibió oxacilina 2 g cada 6 horas por vía intravenosa seguido de dicloxacilina 500 mg cada 6 horas por vía oral. Los pacientes podrían recibir aztreonam concomitante si está clínicamente indicado. Hubo 400 pacientes tratados con linezolid y 419 tratados con oxacilina inscritos en el estudio. Doscientos cuarenta y cinco (61%) pacientes tratados con linezolid y 242 (58%) pacientes tratados con oxacilina fueron clínicamente evaluables. Las tasas de curación en pacientes clínicamente evaluables fueron del 90 % en pacientes tratados con linezolid y del 85 % en pacientes tratados con oxacilina. Un análisis modificado por intención de tratar (MITT) de 316 pacientes tratados con linezolid y 313 pacientes tratados con oxacilina incluyó sujetos que cumplieron con todos los criterios para ingresar al estudio. Las tasas de curación en el análisis MITT fueron del 86 % en los pacientes tratados con linezolid y del 82 % en los pacientes tratados con oxacilina. Las tasas de curación por patógeno para pacientes microbiológicamente evaluables se presentan en la Tabla 13.
Un estudio separado proporcionó experiencia adicional con el uso de ZYVOX en el tratamiento de infecciones por Staphylococcus aureus resistente a la meticilina (MRSA). Este fue un ensayo aleatorizado y abierto en pacientes adultos hospitalizados con infección documentada o sospechada de MRSA.
Un grupo de pacientes recibió ZYVOX IV Inyección de 600 mg cada 12 horas seguido de ZYVOX Tabletas de 600 mg cada 12 horas. El otro grupo de pacientes recibió vancomicina 1 g cada 12 horas por vía intravenosa. Ambos grupos fueron tratados durante 7 a 28 días y podían recibir concomitantemente aztreonam o gentamicina si estaba clínicamente indicado. Las tasas de curación en pacientes microbiológicamente evaluables con infección de la piel y la estructura de la piel por SARM fueron 26/33 (79 %) para los pacientes tratados con linezolid y 24/33 (73 %) para los pacientes tratados con vancomicina.
Infecciones del pie diabético
Los pacientes diabéticos adultos con infecciones complicadas de la piel y de la estructura de la piel clínicamente documentadas ("infecciones del pie diabético") se inscribieron en un ensayo aleatorizado (proporción 2:1), multicéntrico y abierto que comparó los medicamentos del estudio administrados por vía intravenosa u oral durante un total de 14 a 28 días de tratamiento. Un grupo de pacientes recibió ZYVOX 600 mg cada 12 horas por vía intravenosa u oral; el otro grupo recibió de 1,5 a 3 g de ampicilina/sulbactam por vía intravenosa o de 500 a 875 mg de amoxicilina/clavulanato cada 8 a 12 horas por vía oral. En los países donde no se comercializa ampicilina/sulbactam, se utilizó amoxicilina/clavulanato de 500 mg a 2 g cada 6 horas para el régimen intravenoso. Los pacientes del grupo de comparación también podrían ser tratados con 1 g de vancomicina cada 12 horas por vía intravenosa si se aislara SARM de la infección del pie. Los pacientes en cualquiera de los grupos de tratamiento que tenían bacilos Gram-negativos aislados del sitio de la infección también podían recibir 1 a 2 g de aztreonam cada 8 a 12 horas por vía intravenosa. Todos los pacientes fueron elegibles para recibir métodos de tratamiento complementarios apropiados, como desbridamiento y descarga, como se requiere típicamente en el tratamiento de infecciones del pie diabético, y la mayoría de los pacientes recibieron estos tratamientos. Hubo 241 pacientes tratados con linezolid y 120 pacientes tratados con comparador en la población del estudio por intención de tratar (ITT). Doscientos doce (86%) pacientes tratados con linezolid y 105 (85%) pacientes tratados con comparador fueron evaluables clínicamente. En la población ITT, las tasas de curación fueron del 68,5 % (165/241) en pacientes tratados con linezolid y del 64 % (77/120) en pacientes tratados con el comparador, donde aquellos con resultados indeterminados y faltantes se consideraron fracasos. Las tasas de curación en los pacientes clínicamente evaluables (excluyendo aquellos con resultados indeterminados y faltantes) fueron del 83 % (159/192) y del 73 % (74/101) en los pacientes tratados con linezolid y comparador, respectivamente. Un análisis post-hoc crítico se centró en 121 pacientes tratados con linezolid y 60 pacientes tratados con un comparador a los que se les aisló un patógeno grampositivo del sitio de infección o de la sangre, que tenían menos evidencia de osteomielitis subyacente que la población general del estudio y que no recibió antimicrobianos prohibidos. Según ese análisis, las tasas de curación fueron del 71 % (86/121) en los pacientes tratados con linezolid y del 63 % (38/60) en los pacientes tratados con el comparador. Ninguno de los análisis anteriores se ajustó para el uso de terapias complementarias. Las tasas de curación por patógeno para pacientes microbiológicamente evaluables se presentan en la Tabla 14.
Infecciones por enterococos resistentes a la vancomicina
Los pacientes adultos con infección por enterococos resistente a la vancomicina documentada o sospechada se inscribieron en un ensayo aleatorizado, multicéntrico, doble ciego que comparó una dosis alta de ZYVOX (600 mg) con una dosis baja de ZYVOX (200 mg) administrada cada 12 horas ya sea por vía intravenosa (IV) u oral durante 7 a 28 días. Los pacientes podrían recibir concomitantemente aztreonam o aminoglucósidos. Hubo 79 pacientes asignados al azar a linezolid en dosis alta y 66 a linezolid en dosis baja. La población por intención de tratar (ITT) con infección por enterococos resistente a la vancomicina documentada al inicio del estudio constaba de 65 pacientes en el brazo de dosis alta y 52 en el brazo de dosis baja.
Las tasas de curación para la población ITT con infección por enterococos resistente a la vancomicina documentada al inicio del estudio se presentan en la Tabla 15 por fuente de infección. Estas tasas de curación no incluyen pacientes con resultados faltantes o indeterminados. La tasa de curación fue mayor en el brazo de dosis alta que en el brazo de dosis baja, aunque la diferencia no fue estadísticamente significativa al nivel de 0,05.
Pacientes pediátricos
Infecciones por bacterias Gram-positivas
Un estudio de seguridad y eficacia proporcionó experiencia sobre el uso de ZYVOX 600 mg en pacientes pediátricos para el tratamiento de neumonía nosocomial, infecciones complicadas de la piel y de la estructura de la piel y otras infecciones debidas a patógenos bacterianos grampositivos, incluido el Staphylococcus aureus sensible y resistente a la meticilina. y Enterococcus faecium resistente a la vancomicina. Los pacientes pediátricos con edades comprendidas entre el nacimiento y los 11 años con infecciones causadas por bacterias grampositivas sospechadas o documentadas se inscribieron en un ensayo aleatorizado, de etiqueta abierta y controlado por un comparador. Un grupo de pacientes recibió ZYVOX 600 mg por inyección IV, 10 mg/kg cada 8 horas, seguido de ZYVOX 600 mg en suspensión oral, 10 mg/kg cada 8 horas. Un segundo grupo recibió 10 a 15 mg/kg de vancomicina por vía intravenosa cada 6 a 24 horas, según la edad y la depuración renal. Los pacientes que tenían infecciones VRE confirmadas se colocaron en un tercer grupo del estudio y recibieron ZYVOX 10 mg/kg cada 8 horas por vía intravenosa y/u oral. Todos los pacientes fueron tratados durante un total de 10 a 28 días y podían recibir fármacos antibacterianos gramnegativos concomitantes si estaban clínicamente indicados. En la población por intención de tratar (ITT), hubo 206 pacientes asignados al azar a linezolid y 102 pacientes asignados al azar a vancomicina. Las tasas de curación para pacientes ITT, MITT y clínicamente evaluables se presentan en la Tabla 16. Después de que se completó el estudio, 13 pacientes adicionales con edades comprendidas entre los 4 días y los 16 años se inscribieron en una extensión abierta del brazo VRE del estudiar. La Tabla 17 proporciona tasas de curación clínica por patógeno para pacientes microbiológicamente evaluables, incluidos pacientes microbiológicamente evaluables con Enterococcus faecium resistente a la vancomicina de la extensión de este estudio.
INFORMACIÓN DEL PACIENTE
Instrucciones de administración importantes
Informe a los pacientes que ZYVOX puede tomarse con o sin alimentos.
Neuropatía periférica y óptica
Aconseje a los pacientes que informen a su médico si experimentan cambios en la visión mientras toman ZYVOX [ver ADVERTENCIAS Y PRECAUCIONES ].
Síndrome de serotonina
Aconseje a los pacientes que informen a su médico si toman agentes serotoninérgicos, incluidos los inhibidores de la recaptación de serotonina u otros antidepresivos y opioides [ver ADVERTENCIAS Y PRECAUCIONES ].
Interacciones potenciales que producen elevación de la presión arterial
- Aconseje a los pacientes que informen a su médico si tienen antecedentes de hipertensión.
- Aconseje a los pacientes que eviten grandes cantidades de alimentos o bebidas con alto contenido de tiramina mientras toman ZYVOX. Los alimentos con alto contenido de tiramina incluyen aquellos que pueden haber sufrido cambios de proteínas por el envejecimiento, la fermentación, el encurtido o el ahumado para mejorar el sabor, como los quesos añejos, las carnes fermentadas o secadas al aire, el chucrut, la salsa de soya, las cervezas de barril y los vinos tintos. El contenido de tiramina de cualquier alimento rico en proteínas puede aumentar si se almacena durante períodos prolongados o se refrigera incorrectamente.
- Aconseje a los pacientes que informen a su médico si toman medicamentos que contengan clorhidrato de pseudoefedrina o clorhidrato de fenilpropanolamina, como remedios para el resfriado y descongestionantes [ver ADVERTENCIAS Y PRECAUCIONES ].
Acidosis láctica
Aconseje a los pacientes que informen a su médico si experimentan episodios repetidos de náuseas o vómitos mientras reciben ZYVOX [ver ADVERTENCIAS Y PRECAUCIONES ].
convulsiones
Aconseje a los pacientes que informen a su médico si tienen antecedentes de ataques o convulsiones [ver ADVERTENCIAS Y PRECAUCIONES ].
Hipoglucemia
Aconseje a los pacientes que informen a su médico si tienen diabetes mellitus. Cuando se trata con linezolid, pueden ocurrir reacciones hipoglucémicas, como diaforesis y temblores, junto con niveles bajos de glucosa en sangre. Si ocurren tales reacciones, los pacientes deben contactar a un médico u otro profesional de la salud para recibir el tratamiento adecuado [ver ADVERTENCIAS Y PRECAUCIONES ].
Hiponatremia y/o SIADH
Aconseje a los pacientes con riesgo de hiponatremia que informen a su médico si experimentan signos y síntomas de hiponatremia y/o SIADH, incluidos confusión, somnolencia, debilidad generalizada y dificultad respiratoria [ver ADVERTENCIAS Y PRECAUCIONES ].
Fenilcetonuria
Indique a los pacientes con fenilcetonuria (PKU) que cada 5 ml de ZYVOX de 100 mg/5 ml para suspensión oral contiene 20 mg de fenilalanina. Las otras formulaciones de ZYVOX de 600 mg no contienen fenilalanina. La fenilalanina puede ser dañina para los pacientes con fenilcetonuria. Comuníquese con su médico o farmacéutico cuando le receten ZYVOX 600 mg para suspensión oral [ver ADVERTENCIAS Y PRECAUCIONES ].
Resistencia antibacteriana
Se debe advertir a los pacientes que los medicamentos antibacterianos, incluido ZYVOX, solo deben usarse para tratar infecciones bacterianas. No tratan infecciones virales (p. ej., el resfriado común). Cuando se receta ZYVOX de 600 mg para tratar una infección bacteriana, se debe informar a los pacientes que, aunque es común sentirse mejor al comienzo de la terapia, el medicamento debe tomarse exactamente como se indica. Omitir dosis o no completar el curso completo de la terapia puede disminuir la eficacia del tratamiento inmediato y aumentar la probabilidad de que las bacterias desarrollen resistencia y no sean tratables con ZYVOX u otros medicamentos antibacterianos en el futuro.
Diarrea
La diarrea es un problema común causado por los medicamentos antibacterianos, que generalmente desaparece cuando se suspende el medicamento antibacteriano. A veces, después de comenzar el tratamiento con medicamentos antibacterianos, los pacientes pueden desarrollar heces acuosas y sanguinolentas (con o sin calambres estomacales y fiebre) incluso dos o más meses después de haber tomado la última dosis del medicamento antibacteriano. Si esto ocurre, los pacientes deben comunicarse con su médico lo antes posible [ver ADVERTENCIAS Y PRECAUCIONES ].
Esterilidad
Advierta a los pacientes masculinos que ZYVOX puede afectar la fertilidad de manera reversible [ver Uso en poblaciones específicas ].
El etiquetado de este producto puede haber sido actualizado. Para obtener la información de prescripción más reciente, visite www.pfizer.com.
