Cleocin 150mg, 300mg Clindamycin Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué son las cápsulas de clorhidrato de Cleocin 300 mg?
Las Cápsulas de Clorhidrato de Cleocin contienen un antibiótico indicado en el tratamiento de infecciones graves causadas por bacterias anaerobias susceptibles. Clorhidrato de Cleocin 150 mg también está indicado en el tratamiento de infecciones graves debidas a cepas susceptibles de estreptococos, neumococos y estafilococos. Su uso debe reservarse para pacientes alérgicos a la penicilina u otros pacientes para quienes, a juicio del médico, una penicilina es inapropiada. Clorhidrato de Cleocin está disponible en forma genérica.
¿Cuáles son los efectos secundarios de las cápsulas de clorhidrato de Cleocin 300 mg?
Los efectos secundarios comunes del clorhidrato de Cleocin incluyen:
- Colitis por Clostridium difficile,
- dolor abdominal,
- colitis pseudomembranosa,
- esofagitis,
- náuseas,
- vómitos,
- Diarrea,
- erupción cutanea,
- urticaria,
- reacciones alérgicas graves (anafilaxia),
- reacciones hipersensibles,
- Comezón,
- flujo vaginal y molestias,
- hinchazón de la piel,
- piel y ojos amarillentos (ictericia),
- pruebas de función hepática anormales, y
- dolor en las articulaciones.
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de CLEOCIN 300 mg HCl y otros medicamentos antibacterianos, CLEOCIN 300 mg HCl debe usarse solo para tratar o prevenir infecciones que se compruebe o se sospeche que son causadas por bacterias.
ADVERTENCIA
Se ha informado diarrea asociada a Clostridium difficile (CDAD) con el uso de casi todos los agentes antibacterianos, incluido CLEOCIN HCl, y puede variar en gravedad desde diarrea leve hasta colitis fatal. El tratamiento con agentes antibacterianos altera la flora normal del colon, lo que lleva al crecimiento excesivo de C. difficile.
Debido a que la terapia con HCl de 150 mg de CLEOCIN se ha asociado con colitis severa que puede terminar fatalmente, debe reservarse para infecciones graves donde los agentes antimicrobianos menos tóxicos son inapropiados, como se describe en la INDICACIONES Y USO sección. No debe usarse en pacientes con infecciones no bacterianas, como la mayoría de las infecciones de las vías respiratorias superiores.
C. difficile produce toxinas A y B, que contribuyen al desarrollo de CDAD. Las cepas de C. difficile productoras de hipertoxina causan mayor morbilidad y mortalidad, ya que estas infecciones pueden ser refractarias a la terapia antimicrobiana y pueden requerir colectomía. Se debe considerar CDAD en todos los pacientes que presenten diarrea después del uso de antibióticos. Es necesaria una cuidadosa historia clínica ya que se ha informado que la CDAD ocurre más de dos meses después de la administración de agentes antibacterianos.
Si se sospecha o se confirma CDAD, es posible que se deba suspender el uso continuo de antibióticos no dirigidos contra C. difficile. Se debe instituir el manejo adecuado de líquidos y electrolitos, la suplementación con proteínas, el tratamiento con antibióticos de C. difficile y la evaluación quirúrgica según esté clínicamente indicado.
DESCRIPCIÓN
El clorhidrato de clindamicina es la sal de clorhidrato hidratada de clindamicina. La clindamicina es un antibiótico semisintético producido por una sustitución 7(S)-cloro del grupo 7(R)-hidroxilo del compuesto original lincomicina.
CLEOCIN HCl Capsules contiene clorhidrato de clindamicina equivalente a 75 mg, 150 mg o 300 mg de clindamicina.
Ingredientes inactivos: 75 mg - almidón de maíz, FD&C azul no. 1, FD&C amarillo no. 5, gelatina, lactosa, estearato de magnesio y talco; 150 mg - almidón de maíz, FD&C azul no. 1, FD&C amarillo no. 5, gelatina, lactosa, estearato de magnesio, talco y dióxido de titanio; 300 mg - almidón de maíz, FD&C azul no. 1, gelatina, lactosa, estearato de magnesio, talco y dióxido de titanio.
La fórmula estructural se representa a continuación:
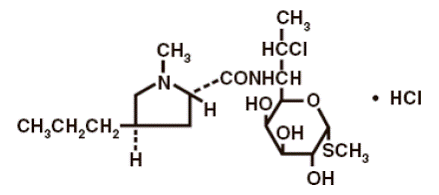
El nombre químico del clorhidrato de clindamicina es Metil 7-cloro-6,7,8-trideoxi-6-(1-metil-trans-4-propil-L-2-pirrolidincarboxamido)-1-tio-L-treo-α- Monoclorhidrato de D-galacto-octopiranósido.
INDICACIONES
La clindamicina está indicada en el tratamiento de infecciones graves causadas por bacterias anaerobias susceptibles.
La clindamicina también está indicada en el tratamiento de infecciones graves debidas a cepas susceptibles de estreptococos, neumococos y estafilococos. Su uso debe reservarse para pacientes alérgicos a la penicilina u otros pacientes para quienes, a juicio del médico, una penicilina es inapropiada. Debido al riesgo de colitis, como se describe en el RECUADRO DE ADVERTENCIA, antes de seleccionar clindamicina, el médico debe considerar la naturaleza de la infección y la idoneidad de alternativas menos tóxicas (p. ej., eritromicina).
Anaerobios: Infecciones graves del tracto respiratorio como empiema, neumonitis anaerobia y absceso pulmonar; infecciones graves de la piel y los tejidos blandos; septicemia; infecciones intraabdominales tales como peritonitis y abscesos intraabdominales (típicamente resultantes de organismos anaerobios residentes en el tracto gastrointestinal normal); Infecciones de la pelvis femenina y del tracto genital, como endometritis, absceso tuboovárico no gonocócico, celulitis pélvica e infección posquirúrgica del manguito vaginal.
Estreptococos: Infecciones graves del tracto respiratorio; Infecciones graves de piel y tejidos blandos.
estafilococos: Infecciones graves del tracto respiratorio; Infecciones graves de piel y tejidos blandos.
Neumococos: Infecciones graves del tracto respiratorio.
Se deben realizar estudios bacteriológicos para determinar los organismos causales y su susceptibilidad a la clindamicina.
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de CLEOCIN HCl y otros medicamentos antibacterianos, CLEOCIN HCl debe usarse solo para tratar o prevenir infecciones que se compruebe o se sospeche que son causadas por bacterias susceptibles. Cuando la información de cultivo y susceptibilidad esté disponible, se debe considerar al seleccionar o modificar la terapia antibacteriana. En ausencia de tales datos, la epidemiología local y los patrones de susceptibilidad pueden contribuir a la selección empírica de la terapia.
DOSIFICACIÓN Y ADMINISTRACIÓN
Si se produce una diarrea significativa durante el tratamiento, se debe suspender este antibiótico (ver ADVERTENCIA EN CAJA ).
Adultos
Infecciones graves - 150 a 300 mg cada 6 horas. Infecciones más graves: 300 a 450 mg cada 6 horas.
Pacientes pediátricos (para niños que pueden tragar cápsulas):
Infecciones graves 8 a 16 mg/kg/día (4 a 8 mg/lb/día) repartidos en tres o cuatro dosis iguales. Infecciones más graves: 16 a 20 mg/kg/día (8 a 10 mg/lb/día) divididos en tres o cuatro dosis iguales.
Para evitar la posibilidad de irritación esofágica, las Cápsulas de HCl de 300 mg de CLEOCIN deben tomarse con un vaso lleno de agua.
CLEOCIN HCl Capsules no es adecuado para niños que no pueden tragarlas enteras. Las cápsulas no proporcionan dosis exactas en mg/kg, por lo que puede ser necesario utilizar la solución oral de palmitato de clindamicina en algunos casos.
Las infecciones graves debidas a bacterias anaeróbicas generalmente se tratan con la solución estéril CLEOCIN PHOSPHATE®. Sin embargo, en circunstancias clínicamente apropiadas, el médico puede optar por iniciar o continuar el tratamiento con CLEOCIN 150 mg HCl Cápsulas.
En casos de infecciones por estreptococos β-hemolíticos, el tratamiento debe continuar durante al menos 10 días.
CÓMO SUMINISTRADO
Cápsulas de clorhidrato de Cleocin están disponibles en las siguientes fortalezas, colores y tamaños:
75 miligramos Botellas Verdes de 100 CDN 0009-0331-02
150 miligramos Celeste y Verde Botellas de 100 CDN 0009-0225-02
300 miligramos Azul Claro Botellas de 100 CDN 0009-0395-14
Almacenar a temperatura ambiente controlada de 20° a 25° C (68° a 77° F) [ver USP ].
Distribuido por: Pharmacia & Upjohn Co, Division of Pfizer Inc, NY, NY 10017. Revisado en 2017
EFECTOS SECUNDARIOS
Se han notificado las siguientes reacciones con el uso de clindamicina.
Infecciones e infestaciones: Colitis por Clostridium difficile
Gastrointestinal: Dolor abdominal, colitis pseudomembranosa, esofagitis, náuseas, vómitos y diarrea (ver ADVERTENCIA EN CAJA ). La aparición de los síntomas de la colitis pseudomembranosa puede ocurrir durante o después del tratamiento antibacteriano (ver ADVERTENCIAS ). Se han notificado úlceras esofágicas. Se ha informado un sabor desagradable o metálico después de la administración oral.
Reacciones hipersensibles: Las reacciones adversas notificadas con mayor frecuencia son erupciones cutáneas generalizadas leves a moderadas de tipo morbiliforme (maculopapular). Se han observado erupciones vesiculoampollosas, así como urticaria, durante la terapia con medicamentos. Se han notificado reacciones cutáneas graves como la necrólisis epidérmica tóxica, algunas con desenlace mortal (ver ADVERTENCIAS ). También se han notificado casos de pustulosis exantemática generalizada aguda (PEAG), eritema multiforme, algunos parecidos al síndrome de Stevens-Johnson, shock anafiláctico, reacción anafiláctica e hipersensibilidad.
Piel y Mucosas: Se han informado prurito, vaginitis, angioedema y casos raros de dermatitis exfoliativa. (Ver Reacciones hipersensibles .)
Hígado: Se han observado ictericia y anomalías en las pruebas de función hepática durante el tratamiento con clindamicina.
Renal: Aunque no se ha establecido una relación directa de clindamicina con el daño renal, se ha observado disfunción renal evidenciada por azotemia, oliguria y/o proteinuria.
hematopoyético: Se han notificado neutropenia transitoria (leucopenia) y eosinofilia. Se han realizado informes de agranulocitosis y trombocitopenia. No se pudo establecer una relación etiológica directa con la terapia con clindamicina concurrente en ninguno de los anteriores.
Sistema inmunitario: Se han notificado casos de reacción al fármaco con eosinofilia y síntomas sistémicos (DRESS).
Musculoesquelético: Se han notificado casos de poliartritis.
INTERACCIONES CON LA DROGAS
Se ha demostrado que la clindamicina tiene propiedades bloqueantes neuromusculares que pueden potenciar la acción de otros agentes bloqueadores neuromusculares. Por lo tanto, debe usarse con precaución en pacientes que reciben dichos agentes.
La clindamicina se metaboliza predominantemente por CYP3A4 y, en menor medida, por CYP3A5, al principal metabolito sulfóxido de clindamicina y al metabolito menor N-desmetilclindamicina. Por lo tanto, los inhibidores de CYP3A4 y CYP3A5 pueden aumentar las concentraciones plasmáticas de clindamicina y los inductores de estas isoenzimas pueden reducir las concentraciones plasmáticas de clindamicina. En presencia de inhibidores fuertes de CYP3A4, controle las reacciones adversas. En presencia de inductores potentes de CYP3A4, como la rifampicina, controle la pérdida de eficacia.
Los estudios in vitro indican que la clindamicina no inhibe CYP1A2, CYP2C9, CYP2C19, CYP2E1 o CYP2D6 y solo inhibe moderadamente CYP3A4.
Se ha demostrado antagonismo entre clindamicina y eritromicina in vitro. Debido a su posible importancia clínica, estos dos medicamentos no deben administrarse al mismo tiempo.
ADVERTENCIAS
Ver ADVERTENCIA EN CAJA
Diarrea asociada a Clostridium difficile
Se ha informado diarrea asociada a Clostridium difficile (CDAD) con el uso de casi todos los agentes antibacterianos, incluido CLEOCIN 300 mg HCl, y puede variar en gravedad desde diarrea leve hasta colitis fatal. El tratamiento con agentes antibacterianos altera la flora normal del colon, lo que lleva al crecimiento excesivo de C. difficile.
C. difficile produce toxinas A y B, que contribuyen al desarrollo de CDAD. Las cepas de C. difficile productoras de hipertoxina causan mayor morbilidad y mortalidad, ya que estas infecciones pueden ser refractarias a la terapia antimicrobiana y pueden requerir colectomía. Se debe considerar CDAD en todos los pacientes que presenten diarrea después del uso de antibióticos. Es necesaria una cuidadosa historia clínica ya que se ha informado que la CDAD ocurre más de dos meses después de la administración de agentes antibacterianos.
Si se sospecha o se confirma CDAD, es posible que se deba suspender el uso continuo de antibióticos no dirigidos contra C. difficile. Se debe instituir el manejo adecuado de líquidos y electrolitos, la suplementación con proteínas, el tratamiento con antibióticos de C. difficile y la evaluación quirúrgica según esté clínicamente indicado.
Reacciones anafilácticas y de hipersensibilidad severa
Se han notificado shock anafiláctico y reacciones anafilácticas (ver REACCIONES ADVERSAS ).
Se han notificado reacciones de hipersensibilidad graves, incluidas reacciones cutáneas graves como necrólisis epidérmica tóxica (TEN), reacción al fármaco con eosinofilia y síntomas sistémicos (DRESS) y síndrome de Stevens-Johnson (SJS), algunas con desenlace mortal (ver REACCIONES ADVERSAS ).
En caso de una reacción anafiláctica o de hipersensibilidad grave, suspenda el tratamiento de forma permanente e instituya la terapia adecuada.
Se debe realizar una investigación cuidadosa sobre sensibilidades previas a fármacos y otros alérgenos.
Uso en meningitis
Dado que la clindamicina no se difunde adecuadamente en el líquido cefalorraquídeo, el fármaco no debe utilizarse en el tratamiento de la meningitis.
PRECAUCIONES
General
La revisión de la experiencia hasta la fecha sugiere que un subgrupo de pacientes mayores con enfermedad grave asociada puede tolerar menos la diarrea. Cuando se indica clindamicina en estos pacientes, deben ser monitoreados cuidadosamente para detectar cambios en la frecuencia intestinal.
CLEOCIN 300 mg HCl se debe prescribir con precaución en personas con antecedentes de enfermedad gastrointestinal, particularmente colitis.
CLEOCIN 300 mg HCl debe prescribirse con precaución en personas atópicas.
Los procedimientos quirúrgicos indicados deben realizarse junto con la terapia con antibióticos.
El uso de CLEOCIN 150 mg HCl ocasionalmente produce un crecimiento excesivo de organismos no sensibles, en particular levaduras. En caso de sobreinfecciones, se deben tomar las medidas apropiadas según lo indique la situación clínica.
La modificación de la dosis de clindamicina puede no ser necesaria en pacientes con enfermedad renal. En pacientes con enfermedad hepática de moderada a grave, se ha observado una prolongación de la vida media de la clindamicina. Sin embargo, se postuló a partir de estudios que cuando se administra cada ocho horas, la acumulación rara vez debería ocurrir. Por lo tanto, puede que no sea necesario modificar la dosis en pacientes con enfermedad hepática. Sin embargo, se deben realizar determinaciones periódicas de enzimas hepáticas cuando se trate a pacientes con enfermedad hepática grave.
Las cápsulas de 75 mg y 150 mg contienen FD&C amarillo no. 5 (tartrazina), que puede causar reacciones de tipo alérgico (incluyendo asma bronquial) en ciertas personas susceptibles. Aunque la incidencia general de FD&C amarilla no. 5 (tartrazina) en la población general es baja, se observa con frecuencia en pacientes que también tienen hipersensibilidad a la aspirina.
Prescribir CLEOCIN 150 mg HCl en ausencia de una infección bacteriana comprobada o fuertemente sospechada o una indicación profiláctica es poco probable que brinde beneficios al paciente y aumenta el riesgo de desarrollo de bacterias resistentes a los medicamentos.
Pruebas de laboratorio
Durante la terapia prolongada, se deben realizar pruebas periódicas de función hepática y renal y hemogramas.
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
No se han realizado estudios a largo plazo en animales con clindamicina para evaluar el potencial carcinogénico. Las pruebas de genotoxicidad realizadas incluyeron una prueba de micronúcleo en rata y una prueba de reversión de Ames Salmonella. Ambas pruebas dieron negativo.
Los estudios de fertilidad en ratas tratadas por vía oral con hasta 300 mg/kg/día (aproximadamente 1,6 veces la dosis humana adulta más alta recomendada en mg/m²) no revelaron efectos sobre la fertilidad o la capacidad de apareamiento.
El embarazo
Efectos teratogénicos
En ensayos clínicos con mujeres embarazadas, la administración sistémica de clindamicina durante el segundo y tercer trimestre, no se ha asociado con una mayor frecuencia de anomalías congénitas.
La clindamicina debe usarse durante el primer trimestre del embarazo solo si es claramente necesario. No existen estudios adecuados y bien controlados en mujeres embarazadas durante el primer trimestre del embarazo. Debido a que los estudios de reproducción en animales no siempre predicen la respuesta humana, este medicamento debe usarse durante el embarazo solo si es claramente necesario.
Estudios de reproducción realizados en ratas y ratones utilizando dosis orales de clindamicina de hasta 600 mg/kg/día (3,2 y 1,6 veces la dosis máxima recomendada en humanos para adultos en mg/m², respectivamente) o dosis subcutáneas de clindamicina de hasta 250 mg/kg /día (1,3 y 0,7 veces la dosis humana adulta más alta recomendada en mg/m², respectivamente) no reveló evidencia de teratogenicidad.
Madres lactantes
Se ha informado que la clindamicina aparece en la leche materna en el rango de 0,7 a 3,8 mcg/mL. La clindamicina tiene el potencial de causar efectos adversos en la flora gastrointestinal del lactante. Si una madre lactante requiere clindamicina oral o intravenosa, no es una razón para interrumpir la lactancia, pero se puede preferir un fármaco alternativo. Vigile al bebé por posibles efectos adversos en la flora gastrointestinal, como diarrea, candidiasis (candidiasis bucal, dermatitis del pañal) o, en raras ocasiones, sangre en las heces que indique una posible colitis asociada a antibióticos.
Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de clindamicina de la madre y cualquier posible efecto adverso sobre el niño amamantado debido a la clindamicina o a la afección materna subyacente.
Uso pediátrico
Cuando se administra CLEOCIN 300 mg HCl a la población pediátrica (desde el nacimiento hasta los 16 años), es deseable un control adecuado de las funciones del sistema orgánico.
Uso geriátrico
Los estudios clínicos de clindamicina no incluyeron un número suficiente de pacientes de 65 años o más para determinar si responden de manera diferente a los pacientes más jóvenes. Sin embargo, otra experiencia clínica informada indica que la colitis y la diarrea asociadas a los antibióticos (debido a Clostridium difficile) que se observan en asociación con la mayoría de los antibióticos ocurren con mayor frecuencia en los ancianos (> 60 años) y pueden ser más graves. Estos pacientes deben ser monitoreados cuidadosamente para el desarrollo de diarrea.
Los estudios farmacocinéticos con clindamicina no han mostrado diferencias clínicamente importantes entre sujetos jóvenes y ancianos con función hepática normal y función renal normal (ajustada a la edad) después de la administración oral o intravenosa.
SOBREDOSIS
Se observó una mortalidad significativa en ratones con una dosis intravenosa de 855 mg/kg y en ratas con una dosis oral o subcutánea de aproximadamente 2618 mg/kg. En los ratones se observaron convulsiones y depresión.
La hemodiálisis y la diálisis peritoneal no son eficaces para eliminar la clindamicina del suero.
CONTRAINDICACIONES
CLEOCIN 150 mg HCl está contraindicado en personas con antecedentes de hipersensibilidad a los preparados que contienen clindamicina o lincomicina.
FARMACOLOGÍA CLÍNICA
Farmacología Humana
Absorción
Los estudios de niveles séricos con una dosis oral de 150 mg de clorhidrato de clindamicina en 24 voluntarios adultos normales mostraron que la clindamicina se absorbía rápidamente después de la administración oral. Se alcanzó un nivel sérico máximo promedio de 2,50 mcg/mL en 45 minutos; los niveles séricos promediaron 1,51 mcg/mL a las 3 horas y 0,70 mcg/mL a las 6 horas. La absorción de una dosis oral es virtualmente completa (90%) y la administración concomitante de alimentos no modifica apreciablemente las concentraciones séricas; los niveles séricos han sido uniformes y predecibles de persona a persona y de dosis a dosis. Los estudios de niveles séricos después de múltiples dosis de CLEOCIN 150 mg HCl durante un máximo de 14 días no muestran evidencia de acumulación o metabolismo alterado del fármaco. Dosis de hasta 2 gramos de clindamicina por día durante 14 días han sido bien toleradas por voluntarios sanos, excepto que la incidencia de efectos secundarios gastrointestinales es mayor con las dosis más altas.
Distribución
Las concentraciones de clindamicina en el suero aumentaron linealmente con el aumento de la dosis. Los niveles séricos superan la MIC (concentración inhibitoria mínima) para la mayoría de los organismos indicados durante al menos seis horas después de la administración de las dosis normalmente recomendadas. La clindamicina se distribuye ampliamente en los fluidos y tejidos corporales (incluidos los huesos). No se alcanzan niveles significativos de clindamicina en el líquido cefalorraquídeo, incluso en presencia de meninges inflamadas.
Metabolismo
Los estudios in vitro en microsomas hepáticos e intestinales humanos indicaron que la clindamicina se metaboliza predominantemente por el citocromo P450 3A4 (CYP3A4), con una contribución menor de CYP3A5, para formar sulfóxido de clindamicina y un metabolito menor, N-desmetilclindamicina.
Excreción
La vida media biológica promedio es de 2,4 horas. Aproximadamente el 10% de la bioactividad se excreta en la orina y el 3,6% en las heces; el resto se excreta como metabolitos bioinactivos.
Poblaciones Especiales
Insuficiencia renal
La vida media sérica de la clindamicina aumenta ligeramente en pacientes con función renal marcadamente reducida. La hemodiálisis y la diálisis peritoneal no son eficaces para eliminar la clindamicina del suero.
Uso en ancianos
Los estudios farmacocinéticos en voluntarios de edad avanzada (61-79 años) y adultos más jóvenes (18-39 años) indican que la edad por sí sola no altera la farmacocinética de clindamicina (aclaramiento, vida media de eliminación, volumen de distribución y área bajo la curva de concentración sérica-tiempo). ) después de la administración IV de fosfato de clindamicina. Después de la administración oral de clorhidrato de clindamicina, la vida media de eliminación aumenta a aproximadamente 4,0 horas (rango 3,4-5,1 h) en los ancianos en comparación con 3,2 horas (rango 2,1-4,2 h) en adultos más jóvenes. Sin embargo, el grado de absorción no es diferente entre los grupos de edad y no es necesario modificar la dosis para los ancianos con función hepática normal y función renal normal (ajustada a la edad)1.
Microbiología
Mecanismo de acción
La clindamicina inhibe la síntesis de proteínas bacterianas al unirse al ARN 23S de la subunidad 50S del ribosoma. La clindamicina es bacteriostática.
Resistencia
La resistencia a la clindamicina suele deberse a la modificación de bases específicas del ARN ribosómico 23S. La resistencia cruzada entre clindamicina y lincomicina es completa. Debido a que los sitios de unión de estos medicamentos antibacterianos se superponen, a veces se observa resistencia cruzada entre lincosamidas, macrólidos y estreptogramina B. La resistencia a la clindamicina inducible por macrólidos ocurre en algunos aislados de bacterias resistentes a macrólidos. Los aislamientos de estafilococos y estreptococos beta-hemolíticos resistentes a los macrólidos deben examinarse para detectar la inducción de resistencia a la clindamicina mediante la prueba de la zona D.
Actividad antimicrobiana
Se ha demostrado que la clindamicina es activa contra la mayoría de los aislados de los siguientes microorganismos, tanto in vitro como en infecciones clínicas, como se describe en el INDICACIONES Y USO sección.
bacterias grampositivas
Staphylococcus aureus (cepas sensibles a la meticilina) Streptococcus pneumoniae (cepas sensibles a la penicilina) Streptococcus pyogenes
Bacteria anaerobica
Clostridium perfringens Fusobacterium necrophorum Fusobacterium nucleatum Peptostreptococcus anaerobius Prevotella melaninogenica
Al menos el 90 % de los microorganismos enumerados a continuación presentan concentraciones inhibitorias mínimas (MIC) in vitro inferiores o iguales al punto de corte de la MIC sensible a la clindamicina para organismos de un tipo similar a los que se muestran en la Tabla 1. Sin embargo, la eficacia de la clindamicina en el tratamiento de infecciones debidas a estos microorganismos no se ha establecido en ensayos clínicos adecuados y bien controlados.
bacterias grampositivas
Staphylococcus epidermidis (cepas sensibles a la meticilina) Streptococcus agalactiae Streptococcus anginosus Streptococcus mitis Streptococcus oralis
Bacteria anaerobica
Actinomyces israelii Clostridium clostridioforme Eggerthella lenta Finegoldia (Peptostreptococcus) magna Micromonas (Peptostreptococcus) micros Prevotella bivia Prevotella intermedia Propionibacterium acnes
Métodos de prueba de susceptibilidad
Cuando esté disponible, el laboratorio de microbiología clínica debe proporcionar al médico los resultados acumulados de las pruebas de susceptibilidad in vitro para los medicamentos antimicrobianos utilizados en hospitales locales y áreas de práctica como informes periódicos que describen el perfil de susceptibilidad de los patógenos nosocomiales y adquiridos en la comunidad. Estos informes deberían ayudar al médico a seleccionar un fármaco antibacteriano para el tratamiento.
Técnicas de dilución
Los métodos cuantitativos se utilizan para determinar las concentraciones inhibitorias mínimas (CIM) antimicrobianas. Estos MIC proporcionan estimaciones de la susceptibilidad de las bacterias a los compuestos antimicrobianos. Las CIM deben determinarse utilizando un método de prueba estandarizado2,3 (caldo y/o agar). Los valores de MIC deben interpretarse de acuerdo con los criterios proporcionados en la Tabla 1.
Técnicas de difusión
Los métodos cuantitativos que requieren la medición de los diámetros de las zonas también pueden proporcionar estimaciones reproducibles de la susceptibilidad de las bacterias a los compuestos antimicrobianos. El tamaño de la zona debe determinarse utilizando un método estandarizado2,5. Este procedimiento utiliza discos de papel impregnados con 2 mcg de clindamicina para probar la susceptibilidad de las bacterias a la clindamicina. Los puntos de corte de difusión del disco se proporcionan en la Tabla 1.
Técnicas anaeróbicas
Para las bacterias anaerobias, la susceptibilidad a la clindamicina se puede determinar mediante un método de prueba estandarizado2,4. Los valores de MIC obtenidos deben interpretarse de acuerdo con los criterios proporcionados en la Tabla 1.
Un informe de Susceptible (S ) indica que es probable que el fármaco antimicrobiano inhiba el crecimiento del patógeno si el fármaco antimicrobiano alcanza la concentración que normalmente se alcanza en el sitio de la infección. Un informe de Intermedio (I) indica que el resultado debe considerarse equívoco y, si el microorganismo no es completamente susceptible a fármacos alternativos clínicamente factibles, la prueba debe repetirse. Esta categoría implica una posible aplicabilidad clínica en sitios del cuerpo donde el fármaco se concentra fisiológicamente o en situaciones en las que se pueden utilizar dosis altas del fármaco. Esta categoría también proporciona una zona de amortiguamiento que evita que pequeños factores técnicos no controlados causen discrepancias importantes en la interpretación. Un informe de resistente (R) indica que no es probable que el fármaco antimicrobiano inhiba el crecimiento del patógeno si el fármaco antimicrobiano alcanza la concentración que normalmente se alcanza en el sitio de la infección; debe seleccionarse otra terapia.
Control de calidad
Los procedimientos de prueba de susceptibilidad estandarizados requieren el uso de controles de laboratorio para monitorear y garantizar la exactitud y precisión de los suministros y reactivos utilizados en el ensayo, y las técnicas de las personas que realizan la prueba.2,3,4,5 El polvo estándar de clindamicina debe proporcionar los rangos de MIC en la Tabla 2. Para la técnica de difusión en disco que utiliza el disco de clindamicina de 2 mcg, se deben cumplir los criterios proporcionados en la Tabla 2.
los anaerobios pueden analizarse mediante métodos de microdilución en caldo o dilución en agar. NA=No aplicable ATCC® es una marca registrada de American Type Culture Collection
REFERENCIAS
1. Smith RB, Phillips JP: Evaluación de CLEOCIN HCl y CLEOCIN Phosphate en una población anciana. Upjohn TR 8147-82-9122-021, diciembre de 1982.
2. CLSI. Normas de desempeño para pruebas de susceptibilidad a los antimicrobianos: 26.ª ed. Suplemento CLSI M100S. Wayne, PA: Instituto de Estándares Clínicos y de Laboratorio; 2016.
3. CLSI. Métodos para pruebas de susceptibilidad antimicrobiana por dilución para bacterias que crecen aeróbicamente; Norma Aprobada - Décima Edición. Documento CLSI M07-A10. Wayne, PA: Instituto de Estándares Clínicos y de Laboratorio; 2015.
4. CLSI. Métodos para las pruebas de susceptibilidad antimicrobiana de bacterias anaerobias; Aprobado Standard-Octava Edición. Documento CLSI M11-A8. Wayne, PA: Instituto de Estándares Clínicos y de Laboratorio; 2012.
5. CLSI. Estándares de rendimiento para pruebas de susceptibilidad de disco antimicrobiano; Norma Aprobada - Duodécima Edición. CLSI documento M02-A12. Wayne, PA: Instituto de Estándares Clínicos y de Laboratorio; 2015.
INFORMACIÓN DEL PACIENTE
Se debe advertir a los pacientes que los medicamentos antibacterianos, incluido CLEOCIN HCl, solo deben usarse para tratar infecciones bacterianas. No tratan infecciones virales (p. ej., el resfriado común). Cuando se prescribe CLEOCIN HCl para tratar una infección bacteriana, se debe informar a los pacientes que, aunque es común que se sientan mejor al comienzo de la terapia, el medicamento debe tomarse exactamente como se indica. Omitir dosis o no completar el curso completo de la terapia puede (1) disminuir la eficacia del tratamiento inmediato y (2) aumentar la probabilidad de que las bacterias desarrollen resistencia y no sean tratables con CLEOCIN 150 mg HCl u otros medicamentos antibacterianos en el futuro.
La diarrea es un problema común causado por los antibióticos que generalmente termina cuando se suspende el antibiótico. A veces, después de comenzar el tratamiento con antibióticos, los pacientes pueden desarrollar heces acuosas y sanguinolentas (con o sin calambres estomacales y fiebre) incluso dos o más meses después de haber tomado la última dosis del antibiótico. Si esto ocurre, los pacientes deben comunicarse con su médico lo antes posible.
