Vantin 200mg, 100mg Cefpodoxime Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Vantin 100 mg y cómo se usa?
Vantin 100 mg es un medicamento recetado que se usa para tratar los síntomas de diversas infecciones bacterianas, como bronquitis, neumonía, sinusitis, faringitis, amigdalitis, infecciones del tracto urinario, infecciones de la piel y gonorrea. Vantin 200 mg se puede usar solo o con otros medicamentos.
Vantin pertenece a una clase de medicamentos llamados Caphalosporins, 3rd Generation.
No se sabe si Vantin es seguro y efectivo en niños menores de 2 meses de edad.
¿Cuáles son los posibles efectos secundarios de Vantin 200 mg?
Vantin puede causar efectos secundarios graves que incluyen:
- urticaria,
- respiración dificultosa,
- hinchazón de la cara, los labios, la lengua o la garganta,
- fiebre,
- dolor de garganta,
- ardiendo en tus ojos,
- dolor de piel,
- erupción cutánea roja o morada que se extiende y causa ampollas y descamación,
- dolor de estómago severo,
- diarrea acuosa o con sangre,
- glándulas inflamadas,
- dolor en las articulaciones,
- malestar general,
- latidos del corazón palpitantes,
- revoloteando en tu pecho,
- dificultad para respirar, y
- embargo
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Vantin incluyen:
- picazón o secreción vaginal,
- dermatitis del pañal en un bebé que usa este medicamento,
- náuseas,
- vómitos,
- Diarrea,
- dolor de estómago, y
- dolor de cabeza
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Vantin. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de VANTIN 100 mg y otros medicamentos antibacterianos, VANTIN 100 mg debe usarse solo para tratar o prevenir infecciones que se compruebe o se sospeche que son causadas por bacterias.
DESCRIPCIÓN
La cefpodoxima proxetil es un antibiótico semisintético de espectro extendido de administración oral de la clase de las cefalosporinas. El nombre químico es (RS)-1(isopropoxicarboniloxi) etilo (+)-(6R,7R)-7-[2-(2-amino-4-tiazolil)-2-{(Z)metoxiimino}acetamido]-3 -metoximetil-8-oxo-5-tia-1-azabiciclo [4.2.0]oct-2-eno-2-carboxilato. Su fórmula empírica es C21H27N5O9S2 y su fórmula estructural se representa a continuación:
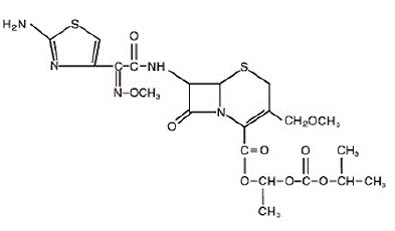
El peso molecular de cefpodoxima proxetil es 557,6.
Cefpodoxime proxetil es un profármaco; su metabolito activo es la cefpodoxima. Todas las dosis de cefpodoxima proxetilo en este prospecto se expresan en términos de la fracción activa de cefpodoxima. El fármaco se suministra en forma de comprimidos recubiertos con película y gránulos aromatizados para suspensión oral.
Las tabletas VANTIN contienen cefpodoxima proxetil equivalente a 100 mg o 200 mg de actividad de cefpodoxima y los siguientes ingredientes inactivos: carboximetilcelulosa de calcio, cera de carnauba, FD&C Yellow No. 6, hidroxipropilcelulosa, hipromelosa, lactosa hidratada, estearato de magnesio, propilenglicol, lauril sulfato de sodio y dióxido de titanio. Además, las tabletas recubiertas con película de 100 mg contienen D&C Yellow No. 10 y las tabletas recubiertas con película de 200 mg contienen FD&C Red No. 40.
Cada 5 ml de suspensión oral de VANTIN contiene cefpodoxima proxetil equivalente a 50 mg o 100 mg de actividad de cefpodoxima después de la constitución y los siguientes ingredientes inactivos: saborizantes artificiales, hidroxianisol butilado (BHA), carboximetilcelulosa sódica, celulosa microcristalina, carragenina, ácido cítrico, coloidal dióxido de silicio, croscarmelosa de sodio, hidroxipropilcelulosa, lactosa, maltodextrina, saborizantes naturales, alginato de propilenglicol, citrato de sodio, benzoato de sodio, almidón, sacarosa y aceite vegetal.
INDICACIONES
Cefpodoxima proxetil está indicado para el tratamiento de pacientes con infecciones leves a moderadas causadas por cepas sensibles de los microorganismos designados en las condiciones que se enumeran a continuación.
Las dosis recomendadas, la duración de la terapia y las poblaciones de pacientes aplicables varían entre estas infecciones. Consulte DOSIS Y ADMINISTRACIÓN para recomendaciones específicas. Otitis media aguda causada por Streptococcus pneumoniae (excluyendo las cepas resistentes a la penicilina), Streptococcus pyogenes, Haemophilus influenzae (incluidas las cepas productoras de betalactamasas) o Moraxella (Branhamella) catarrhalis (incluidas las cepas productoras de betalactamasas).
Faringitis Y/o Amigdalitis causada por Streptococcus pyogenes.
NOTA: Sólo la penicilina por vía intramuscular ha demostrado ser eficaz en la profilaxis de la fiebre reumática. Cefpodoxima proxetilo es generalmente eficaz en la erradicación de estreptococos de la orofaringe. Sin embargo, no se dispone de datos que establezcan la eficacia de cefpodoxima proxetilo para la profilaxis de la fiebre reumática subsiguiente.
La comunidad adquirió neumonía causada por S. pneumoniae o H. Influenzae (incluidas las cepas productoras de betalactamasas).
Exacerbación bacteriana aguda de la bronquitis crónica causada por S. pneumoniae, H. influenzae (cepas no productoras de betalactamasa únicamente) o M. catarrhalis. Los datos son insuficientes en este momento para establecer la eficacia en pacientes con exacerbaciones bacterianas agudas de bronquitis crónica causadas por cepas de H. influenzae productoras de betalactamasas.
Gonorrea uretral y cervical aguda, no complicada causada por Neisseria gonorrhoeae (incluidas las cepas productoras de penicilinasa).
Infecciones anorrectales agudas no complicadas en mujeres debido a Neisseria gonorrhoeae (incluidas las cepas productoras de penicilinasa).
NOTA: No se ha establecido la eficacia de cefpodoxima en el tratamiento de pacientes masculinos con infecciones rectales causadas por N. gonorrhoeae. Los datos no respaldan el uso de cefpodoxima proxetilo en el tratamiento de infecciones faríngeas por N. gonorrhoeae en hombres o mujeres.
Infecciones no complicadas de la piel y de la estructura de la piel causada por Staphylococcus aureus (incluidas las cepas productoras de penicilinasa) o Streptococcus pyogenes. Los abscesos deben drenarse quirúrgicamente según esté clínicamente indicado.
NOTA: En los ensayos clínicos, el tratamiento exitoso de las infecciones de la piel y de la estructura de la piel sin complicaciones estuvo relacionado con la dosis. La dosis terapéutica efectiva para las infecciones cutáneas fue superior a las utilizadas en otras indicaciones recomendadas. (Ver DOSIFICACIÓN Y ADMINISTRACIÓN .)
Sinusitis maxilar aguda causada por Haemophilus influenzae (incluidas las cepas productoras de betalactamasas), Streptococcus pneumoniae y Moraxella catarrhalis.
Infecciones del tracto urinario no complicadas (cistitis) causada por Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis o Staphylococcus saprophyticus.
NOTA: Al considerar el uso de cefpodoxima proxetil en el tratamiento de la cistitis, las tasas más bajas de erradicación bacteriana de cefpodoxima proxetil deben sopesarse frente a las mayores tasas de erradicación y los diferentes perfiles de seguridad de algunas otras clases de agentes aprobados. (Ver Estudios clínicos sección.)
Deben obtenerse muestras adecuadas para el examen bacteriológico con el fin de aislar e identificar los organismos causales y determinar su susceptibilidad a la cefpodoxima. La terapia puede instituirse mientras se esperan los resultados de estos estudios. Una vez que estos resultados estén disponibles, la terapia antimicrobiana debe ajustarse en consecuencia.
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de VANTIN 100 mg y otros medicamentos antibacterianos, VANTIN 200 mg debe usarse solo para tratar o prevenir infecciones que se compruebe o se sospeche que son causadas por bacterias susceptibles. Cuando la información de cultivo y susceptibilidad esté disponible, se debe considerar al seleccionar o modificar la terapia antibacteriana. En ausencia de tales datos, la epidemiología local y los patrones de susceptibilidad pueden contribuir a la selección empírica de la terapia.
DOSIFICACIÓN Y ADMINISTRACIÓN
(Ver INDICACIONES Y USO para los patógenos indicados.)
Comprimidos recubiertos con película
Los comprimidos de VANTIN deben administrarse por vía oral con alimentos para mejorar la absorción. (Ver FARMACOLOGÍA CLÍNICA .)
Las dosis recomendadas, la duración del tratamiento y la población de pacientes aplicable se describen en el siguiente cuadro:
Adultos y Adolescentes (mayores de 12 años)
Gránulos para suspensión oral
La suspensión oral de VANTIN puede administrarse independientemente de los alimentos. Las dosis recomendadas, la duración del tratamiento y las poblaciones de pacientes aplicables se describen en el siguiente cuadro:
Adultos y Adolescentes (mayores de 12 años)
Bebés y pacientes pediátricos (de 2 meses a 12 años)
Pacientes con disfunción renal
Para pacientes con insuficiencia renal grave (aclaramiento de creatinina
Cuando solo se dispone del nivel de creatinina sérica, se puede utilizar la siguiente fórmula (basada en el sexo, el peso y la edad del paciente) para estimar el aclaramiento de creatinina (ml/min). Para que esta estimación sea válida, el nivel de creatinina sérica debe representar un estado estable de la función renal.
Hombres (mL/min): Peso (kg) x (140 - edad)/ 72 x creatinina sérica (mg/100 mL)
Hembras (mL/min) : 0,85 x valor anterior
Pacientes con cirrosis
La farmacocinética de cefpodoxima en pacientes cirróticos (con o sin ascitis) es similar a la de sujetos sanos. No es necesario ajustar la dosis en esta población.
Preparación de la suspensión
Instrucciones constitucionales para la suspensión oral
Después de mezclar, la suspensión debe almacenarse en un refrigerador, de 2° a 8°C (36° a 46°F). Agitar bien antes de usar. Mantener el contenedor bien cerrado. La mezcla se puede utilizar durante 14 días. Deseche la porción no utilizada después de 14 días.
CÓMO SUMINISTRADO
VANTIN Tabletas están disponibles en las siguientes concentraciones (equivalente a cefpodoxima), colores y tamaños:
100 mg (naranja claro, elíptico, grabado con U3617)
Botellas de 20 CDN 0009-3617-01 Botellas de 100 CDN 0009-3617-02 Envases monodosis de 100 CDN 0009-3617-03
200 mg (rojo coral, elíptico, grabado con U3618)
Botellas de 20 CDN 0009-3618-01 Botellas de 100 CDN 0009-3618-02
200 mg (rojo coral, elíptico, grabado con U3618)
Envases monodosis de 100 CDN 0009-3618-03
Guarde las tabletas a temperatura ambiente controlada de 20° a 25°C (68° a 77°F) [ver USP ].
Vuelva a colocar la tapa de forma segura después de cada apertura. Proteja los paquetes de dosis unitarias de la humedad excesiva.
VANTIN 200 mg suspensión oral proporciona el equivalente a 50 mg o 100 mg de cefpodoxima por 5 ml de suspensión (cuando se prepara según las indicaciones) y está disponible con sabor a crema de limón en los siguientes tamaños:
50 mg/5 ml
Suspensión de 100 ml CDN 0009-3531-01 Suspensión de 75 ml CDN 0009-3531-02 Suspensión de 50 ml CDN 0009-3531-03
100 mg/5 ml
Suspensión de 100 ml CDN 0009-3615-01 Suspensión de 75 ml CDN 0009-3615-02 Suspensión de 50 ml CDN 0009-3615-03
Almacene los gránulos sin suspender a temperatura ambiente controlada de 20° a 25°C (68° a 77°F) [ver USP ].
Las instrucciones para mezclar están incluidas en la etiqueta. Después de mezclar, la suspensión debe almacenarse en un refrigerador, entre 2 °C y 8 °C (36 °F y 46 °F). Agitar bien antes de usar. Mantener el contenedor bien cerrado. La mezcla se puede utilizar durante 14 días. Deseche la porción no utilizada después de 14 días.
Distribuido por: Pharmacia & Upjohn Company, Division of Pfizer Inc., NY, NY 10017. Revisado: agosto de 2016
EFECTOS SECUNDARIOS
Ensayos clínicos
Comprimidos recubiertos con película (dosis múltiple)
En ensayos clínicos utilizando múltiples dosis de cefpodoxima proxetil comprimidos recubiertos con película, 4696 pacientes fueron tratados con las dosis recomendadas de cefpodoxima (100 a 400 mg cada 12 horas). No hubo muertes o discapacidades permanentes que se pensaran relacionadas con la toxicidad de las drogas. Ciento veintinueve (2,7%) pacientes suspendieron la medicación debido a eventos adversos que se pensaron posible o probablemente relacionados con la toxicidad del fármaco. Noventa y tres (52%) de los 178 pacientes que interrumpieron el tratamiento (ya sea que se pensara que estaba relacionado con el tratamiento farmacológico o no) lo hicieron debido a trastornos gastrointestinales, náuseas, vómitos o diarrea. El porcentaje de pacientes tratados con cefpodoxima proxetilo que interrumpieron el fármaco del estudio debido a eventos adversos fue significativamente mayor con una dosis de 800 mg diarios que con una dosis de 400 mg diarios o con una dosis de 200 mg diarios. Los eventos adversos que se pensaron posible o probablemente relacionados con la cefpodoxima en los ensayos clínicos de dosis múltiples (N=4696 pacientes tratados con cefpodoxima) fueron:
Incidencia mayor al 1%
Diarrea 7,0%
La diarrea o las heces blandas estuvieron relacionadas con la dosis: disminuyeron del 10,4 % de los pacientes que recibieron 800 mg al día al 5,7 % de los que recibieron 200 mg al día. De los pacientes con diarrea, el 10% tenía el organismo C. difficile o la toxina en las heces. (Ver ADVERTENCIAS .)
Náuseas 3,3 % Infecciones fúngicas vaginales 1,0 % Infecciones vulvovaginales 1,3 % Dolor abdominal 1,2 % Dolor de cabeza 1,0 %
Incidencia Menos del 1%
Por sistema corporal en orden decreciente
Estudios clínicos
Eventos adversos que se cree posible o probablemente relacionados con cefpodoxima proxetil que ocurrieron en menos del 1 % de los pacientes (N=4696)
Cuerpo - infecciones fúngicas, distensión abdominal, malestar general, fatiga, astenia, fiebre, dolor de pecho, dolor de espalda, escalofríos, dolor generalizado, pruebas microbiológicas anormales, moniliasis, absceso, reacción alérgica, edema facial, infecciones bacterianas, infecciones parasitarias, edema localizado, dolor localizado .
Cardiovasculares - insuficiencia cardíaca congestiva, migraña, palpitaciones, vasodilatación, hematoma, hipertensión, hipotensión.
Digestivo - vómitos, dispepsia, sequedad de boca, flatulencia, disminución del apetito, estreñimiento, moniliasis oral, anorexia, eructos, gastritis, úlceras bucales, trastornos gastrointestinales, trastornos rectales, trastornos de la lengua, trastornos dentales, aumento de la sed, lesiones orales, tenesmo, sequedad de garganta, dolor de muelas .
hemico y linfatico - anemia.
Metabólico y Nutricional - deshidratación, gota, edema periférico, aumento de peso.
Musculo-esquelético - mialgia.
Nervioso - mareos, insomnio, somnolencia, ansiedad, temblores, nerviosismo, infarto cerebral, cambios en los sueños, problemas de concentración, confusión, pesadillas, parestesia, vértigo.
Respiratorio - asma, tos, epistaxis, rinitis, sibilancias, bronquitis, disnea, derrame pleural, neumonía, sinusitis.
Piel - urticaria, erupción cutánea, prurito en el lugar no aplicado, diaforesis, erupción maculopapular, dermatitis fúngica, descamación, piel seca en el lugar no aplicado, pérdida de cabello, erupción vesiculoampollosa, quemadura solar.
Sentidos especiales - alteraciones del gusto, irritación ocular, pérdida del gusto, tinnitus.
Urogenital - hematuria, infecciones del tracto urinario, metrorragia, disuria, polaquiuria, nicturia, infección del pene, proteinuria, dolor vaginal.
Gránulos para suspensión oral (dosis múltiple)
En ensayos clínicos que utilizaron dosis múltiples de gránulos de cefpodoxima proxetilo para suspensión oral, 2128 pacientes pediátricos (93% de los cuales tenían menos de 12 años) fueron tratados con las dosis recomendadas de cefpodoxima (10 mg/kg/día Q 24 horas o divididas Q 12 horas hasta una dosis máxima equivalente para adultos). No hubo muertes ni discapacidades permanentes en ninguno de los pacientes de estos estudios. Veinticuatro pacientes (1,1 %) interrumpieron la medicación debido a eventos adversos que se consideraron posible o probablemente relacionados con el fármaco del estudio. Principalmente, estas interrupciones se debieron a trastornos gastrointestinales, generalmente diarrea, vómitos o erupciones cutáneas.
Los eventos adversos que se pensaron posible o probablemente relacionados, o de relación desconocida con cefpodoxima proxetil para suspensión oral en ensayos clínicos de dosis múltiples (N = 2128 pacientes tratados con cefpodoxima) fueron:
Incidencia mayor al 1%
Diarrea 6,0% La incidencia de diarrea en lactantes y niños pequeños (de 1 mes a 2 años) fue del 12,8%. Erupción del pañal/Erupción cutánea fúngica 2,0 % (incluye moniliasis) La incidencia de la dermatitis del pañal en bebés y niños pequeños fue del 8,5 %. Otras erupciones cutáneas 1,8 % Vómitos 2,3 %
Incidencia Menos del 1%
Cuerpo: Dolor abdominal localizado, cólico abdominal, dolor de cabeza, monilia, dolor abdominal generalizado, astenia, fiebre, infección fúngica.
Digestivo: Náuseas, monilia, anorexia, boca seca, estomatitis, colitis pseudomembranosa.
Hemático y Linfático: Trombocitemia, prueba de Coombs directa positiva, eosinofilia, leucocitosis, leucopenia, tiempo de tromboplastina parcial prolongado, púrpura trombocitopénica.
Metabólico y Nutricional: SGPT aumentado.
Musculo-esquelético: Mialgia.
Nervioso: Alucinaciones, hipercinesia, nerviosismo, somnolencia.
Respiratorio: Epistaxis, rinitis.

Piel: Moniliasis cutánea, urticaria, dermatitis fúngica, acné, dermatitis exfoliativa, erupción maculopapular.
Sentidos especiales: Perversión del gusto.
Comprimidos recubiertos con película (dosis única)
En ensayos clínicos utilizando un dosís única de cefpodoxima proxetil comprimidos recubiertos con película, 509 pacientes fueron tratados con la dosis recomendada de cefpodoxima (200 mg). En estos estudios no hubo muertes ni discapacidades permanentes relacionadas con la toxicidad del fármaco.
Los eventos adversos que se pensaron posible o probablemente relacionados con la cefpodoxima en los ensayos clínicos de dosis única realizados en los Estados Unidos fueron:
Incidencia mayor al 1%
Náuseas 1,4% Diarrea 1,2%
Incidencia Menos del 1%
Sistema Nervioso Central: Mareos, dolor de cabeza, síncope. Dermatológico: Erupción. Genitales: Vaginitis. Gastrointestinales: Dolor abdominal. Psiquiátrico: Ansiedad.
Cambios de laboratorio
Los cambios de laboratorio significativos que se informaron en pacientes adultos y pediátricos en ensayos clínicos de cefpodoxima proxetilo, sin tener en cuenta la relación con el fármaco, fueron:
Hepático: Aumentos transitorios de AST (SGOT), ALT (SGPT), GGT, fosfatasa alcalina, bilirrubina y LDH.
hematológico: Eosinofilia, leucocitosis, linfocitosis, granulocitosis, basofilia, monocitosis, trombocitosis, hemoglobina disminuida, hematocrito disminuido, leucopenia, neutropenia, linfocitopenia, trombocitopenia, trombocitemia, prueba de Coombs positiva y PT y PTT prolongados.
Química del suero: Hiperglucemia, hipoglucemia, hipoalbuminemia, hipoproteinemia, hiperpotasemia e hiponatremia.
Renal: Aumentos en BUN y creatinina.
La mayoría de estas anomalías fueron transitorias y no clínicamente significativas.
Experiencia posterior a la comercialización
Se han notificado las siguientes experiencias adversas graves: reacciones alérgicas, incluido el síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, eritema multiforme y reacciones similares a la enfermedad del suero, colitis seudomembranosa, diarrea sanguinolenta con dolor abdominal, colitis ulcerosa, rectorragia con hipotensión, shock anafiláctico, lesión hepática, exposición intrauterina con aborto espontáneo, nefritis purpúrica, infiltrado pulmonar con eosinofilia y dermatitis palpebral.
Una muerte se atribuyó a colitis pseudomembranosa y coagulación intravascular diseminada.
Etiquetado de clase de cefalosporina
Además de las reacciones adversas enumeradas anteriormente que se han observado en pacientes tratados con cefpodoxima proxetilo, se han notificado las siguientes reacciones adversas y pruebas de laboratorio alteradas para los antibióticos de la clase de las cefalosporinas:
Reacciones adversas y pruebas de laboratorio anormales: Disfunción renal, nefropatía tóxica, disfunción hepática incluyendo colestasis, anemia aplásica, anemia hemolítica, reacción similar a la enfermedad del suero, hemorragia, agranulocitosis y pancitopenia.
Se ha implicado a varias cefalosporinas en el desencadenamiento de convulsiones, particularmente en pacientes con insuficiencia renal cuando no se redujo la dosis. (Ver DOSIFICACIÓN Y ADMINISTRACIÓN y SOBREDOSIS .) Si se presentan convulsiones asociadas con la terapia con medicamentos, se debe suspender el medicamento. La terapia anticonvulsiva puede ser dada si está clínicamente indicada.
INTERACCIONES CON LA DROGAS
antiácidos
La administración concomitante de dosis altas de antiácidos (bicarbonato de sodio e hidróxido de aluminio) o bloqueadores H2 reduce los niveles plasmáticos máximos entre un 24 % y un 42 % y el grado de absorción entre un 27 % y un 32 %, respectivamente. La velocidad de absorción no se ve alterada por estos medicamentos concomitantes. Los anticolinérgicos orales (p. ej., propantelina) retrasan los niveles plasmáticos máximos (aumento del 47 % en Tmax), pero no afectan el grado de absorción (AUC).
probenecid
Al igual que con otros antibióticos betalactámicos, la excreción renal de cefpodoxima fue inhibida por probenecid y dio como resultado un aumento de aproximadamente el 31 % en el AUC y un aumento del 20 % en los niveles plasmáticos máximos de cefpodoxima.
Fármacos nefrotóxicos
Aunque no se ha observado nefrotoxicidad cuando se administra cefpodoxima proxetilo solo, se recomienda una estrecha vigilancia de la función renal cuando se administra cefpodoxima proxetilo junto con compuestos de potencial nefrotóxico conocido.
Interacciones entre medicamentos y pruebas de laboratorio
Se sabe que las cefalosporinas, incluida la cefpodoxima proxetilo, inducen ocasionalmente una prueba de Coombs directa positiva.
ADVERTENCIAS
ANTES DE INSTALAR LA TERAPIA CON CEFPODOXIMA PROXETIL, SE DEBE REALIZAR UNA INVESTIGACIÓN CUIDADOSA PARA DETERMINAR SI EL PACIENTE HA TENIDO REACCIONES PREVIAS DE HIPERSENSIBILIDAD A CEFPODOXIMA, OTRAS CEFALOSPORINAS, PENICILINAS U OTROS MEDICAMENTOS. SI SE VA A ADMINISTRAR CEFPODOXIMA A PACIENTES SENSIBLES A LA PENICILINA, SE DEBE TENER PRECAUCIÓN PORQUE LA HIPERSENSIBILIDAD CRUZADA ENTRE ANTIBIÓTICOS BETA-LACTAMICOS SE HA DOCUMENTADO CLARAMENTE Y PUEDE OCURRIR HASTA EN EL 10% DE LOS PACIENTES CON ANTECEDENTES DE ALERGIA A LA PENICILINA. SI OCURRE UNA REACCIÓN ALÉRGICA A CEFPODOXIMA PROXETIL, SUSPENDA EL MEDICAMENTO. LAS REACCIONES DE HIPERSENSIBILIDAD AGUDA SERIAS PUEDEN REQUERIR TRATAMIENTO CON EPINEFRINA Y OTRAS MEDIDAS DE EMERGENCIA, INCLUYENDO OXÍGENO, LÍQUIDOS INTRAVENOSOS, ANTIHISTAMÍNICOS INTRAVENOSOS Y MANEJO DE LAS VÍAS AÉREAS, SEGÚN SE INDIQUE CLÍNICAMENTE.
Se ha informado diarrea asociada a Clostridium difficile (CDAD) con el uso de casi todos los agentes antibacterianos, incluido VANTIN, y puede variar en gravedad desde diarrea leve hasta colitis fatal. El tratamiento con agentes antibacterianos altera la flora normal del colon y conduce al crecimiento excesivo de C. difficile.
C. difficile produce toxinas A y B que contribuyen al desarrollo de CDAD. Las cepas de C. difficile productoras de hipertoxina causan mayor morbilidad y mortalidad, ya que estas infecciones pueden ser refractarias a la terapia antimicrobiana y pueden requerir colectomía. Se debe considerar CDAD en todos los pacientes que presenten diarrea después del uso de antibióticos. Es necesaria una cuidadosa historia clínica ya que se ha informado que la CDAD ocurre más de dos meses después de la administración de agentes antibacterianos.
Si se sospecha o se confirma CDAD, es posible que deba suspenderse el uso continuo de antibióticos no dirigidos contra C. difficile. Se debe instituir el manejo adecuado de líquidos y electrolitos, la suplementación con proteínas, el tratamiento con antibióticos de C. difficile y la evaluación quirúrgica según esté clínicamente indicado.
Se realizó un esfuerzo concertado para controlar la presencia de C. difficile en pacientes con diarrea tratados con cefpodoxima debido a una mayor incidencia de diarrea asociada con C. difficile en los primeros ensayos en sujetos normales. Se informaron organismos o toxinas de C. difficile en el 10 % de los pacientes adultos con diarrea tratados con cefpodoxima; sin embargo, no se hizo un diagnóstico específico de colitis pseudomembranosa en estos pacientes.
En la experiencia posterior a la comercialización fuera de los Estados Unidos, se recibieron informes de colitis pseudomembranosa asociada con el uso de cefpodoxima proxetilo.
PRECAUCIONES
General
En pacientes con reducción transitoria o persistente de la producción de orina debido a insuficiencia renal, se debe reducir la dosis diaria total de cefpodoxima proxetilo porque pueden ocurrir concentraciones séricas altas y prolongadas de antibiótico en tales individuos después de las dosis habituales. La cefpodoxima, al igual que otras cefalosporinas, debe administrarse con precaución a los pacientes que reciben tratamiento concomitante con diuréticos potentes. (Ver DOSIFICACIÓN Y ADMINISTRACIÓN .)
Al igual que con otros antibióticos, el uso prolongado de cefpodoxima proxetilo puede provocar un crecimiento excesivo de organismos no sensibles. La evaluación repetida de la condición del paciente es esencial. Si se produce una superinfección durante el tratamiento, se deben tomar las medidas adecuadas.
Es poco probable que la prescripción de VANTIN en ausencia de una infección bacteriana comprobada o fuertemente sospechada o una indicación profiláctica brinde beneficios al paciente y aumente el riesgo de desarrollo de bacterias resistentes a los medicamentos.
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
No se han realizado estudios de carcinogénesis en animales a largo plazo con cefpodoxima proxetilo. Los estudios de mutagénesis de cefpodoxima, incluida la prueba de Ames con y sin activación metabólica, la prueba de aberración cromosómica, el ensayo de síntesis de ADN no programada, la recombinación mitótica y la conversión génica, el ensayo de mutación genética directa y la prueba de micronúcleos in vivo, fueron todos negativos. No se observaron efectos adversos sobre la fertilidad o la reproducción cuando se administraron por vía oral a ratas 100 mg/kg/día o menos (2 veces la dosis humana basada en mg/m²).
El embarazo
Efectos teratogénicos
Cefpodoxima proxetilo no fue teratogénico ni embriocida cuando se administró a ratas durante la organogénesis en dosis de hasta 100 mg/kg/día (2 veces la dosis humana basada en mg/m²) o a conejos en dosis de hasta 30 mg/kg/día (1 -2 veces la dosis humana basada en mg/m²).
Sin embargo, no existen estudios adecuados y bien controlados sobre el uso de cefpodoxima proxetilo en mujeres embarazadas. Debido a que los estudios de reproducción en animales no siempre predicen la respuesta humana, este medicamento debe usarse durante el embarazo solo si es claramente necesario.
Trabajo y entrega
No se ha estudiado el uso de cefpodoxima proxetilo durante el trabajo de parto y el parto. El tratamiento solo debe administrarse si es claramente necesario.
Madres lactantes
La cefpodoxima se excreta en la leche humana. En un estudio de 3 mujeres lactantes, los niveles de cefpodoxima en la leche humana fueron 0 %, 2 % y 6 % de los niveles séricos concomitantes a las 4 horas después de una dosis oral de 200 mg de cefpodoxima proxetilo. A las 6 horas posteriores a la dosificación, los niveles eran del 0 %, 9 % y 16 % de los niveles séricos concomitantes. Debido al potencial de reacciones graves en los lactantes, se debe tomar la decisión de suspender la lactancia o suspender el fármaco, teniendo en cuenta la importancia del fármaco para la madre.
Uso pediátrico
No se ha establecido la seguridad y eficacia en lactantes menores de 2 meses de edad.
Uso geriátrico
De los 3338 pacientes en estudios clínicos de dosis múltiples de comprimidos recubiertos con película de cefpodoxima proxetilo, 521 (16%) tenían 65 años o más, mientras que 214 (6%) tenían 75 años o más. No se observaron diferencias generales en la eficacia o la seguridad entre los pacientes de edad avanzada y los más jóvenes. En sujetos geriátricos sanos con función renal normal, la vida media de cefpodoxima en plasma promedió 4,2 horas y la recuperación urinaria promedió 21 % después de administrar una dosis de 400 mg cada 12 horas durante 15 días. Otros parámetros farmacocinéticos no cambiaron en relación con los observados en sujetos sanos más jóvenes.
No es necesario ajustar la dosis en pacientes de edad avanzada con función renal normal.
SOBREDOSIS
En estudios de toxicidad aguda en roedores, una dosis oral única de 5 g/kg no produjo efectos adversos.
En el caso de una reacción tóxica grave por sobredosis, la hemodiálisis o la diálisis peritoneal pueden ayudar a eliminar la cefpodoxima del cuerpo, especialmente si la función renal está comprometida.
Los síntomas tóxicos que siguen a una sobredosis de antibióticos betalactámicos pueden incluir náuseas, vómitos, malestar epigástrico y diarrea.
CONTRAINDICACIONES
Cefpodoxima proxetilo está contraindicado en pacientes con alergia conocida a la cefpodoxima o al grupo de antibióticos de las cefalosporinas.
FARMACOLOGÍA CLÍNICA
Absorción y excreción
La cefpodoxima proxetilo es un profármaco que se absorbe en el tracto gastrointestinal y se desesterifica a su metabolito activo, la cefpodoxima. Luego de la administración oral de 100 mg de cefpodoxima proxetilo a sujetos en ayunas, aproximadamente el 50 % de la dosis de cefpodoxima administrada se absorbió sistémicamente. Sobre el rango de dosificación recomendado (100 a 400 mg), aproximadamente 29 a 33% de la dosis de cefpodoxima administrada se excretó sin cambios en la orina en 12 horas. Hay un metabolismo mínimo de cefpodoxima in vivo.
Efectos de la comida
El grado de absorción (AUC media) y la concentración plasmática máxima media aumentaron cuando los comprimidos recubiertos con película se administraron con alimentos. Luego de una dosis de tableta de 200 mg tomada con alimentos, el AUC fue de 21 a 33 % mayor que en ayunas, y la concentración plasmática máxima promedió 3,1 mcg/mL en sujetos alimentados versus 2,6 mcg/mL en sujetos en ayunas. El tiempo hasta la concentración máxima no fue significativamente diferente entre los sujetos alimentados y en ayunas.
Cuando se tomó una dosis de 200 mg de la suspensión con alimentos, el grado de absorción (AUC promedio) y la concentración plasmática máxima promedio en sujetos alimentados no fueron significativamente diferentes de los sujetos en ayunas, pero la tasa de absorción fue más lenta con alimentos (aumento del 48 %). en Tmáx).
Farmacocinética de los comprimidos recubiertos con película de cefpodoxima proxetil
Sobre el rango de dosificación recomendado (100 a 400 mg), la velocidad y el grado de absorción de cefpodoxima mostraron dependencia de la dosis; La Cmax y el AUC normalizados por dosis disminuyeron hasta un 32 % con el aumento de la dosis. Sobre el rango de dosificación recomendado, el Tmax fue de aproximadamente 2 a 3 horas y el T½ varió de 2,09 a 2,84 horas. La Cmáx media fue de 1,4 mcg/ml para la dosis de 100 mg, 2,3 mcg/ml para la dosis de 200 mg y 3,9 mcg/ml para la dosis de 400 mg. En pacientes con función renal normal, no se observaron acumulaciones ni cambios significativos en otros parámetros farmacocinéticos luego de múltiples dosis orales de hasta 400 mg cada 12 horas.
NIVELES EN PLASMA DE CEFPODOXIMA (mcg/mL) EN ADULTOS EN AYUNA DESPUÉS DE LA ADMINISTRACIÓN DE COMPRIMIDOS RECUBIERTOS CON PELÍCULA (Dosis única)
Farmacocinética de la suspensión de cefpodoxima proxetil
En sujetos adultos, una dosis de 100 mg de suspensión oral produjo una concentración máxima promedio de cefpodoxima de aproximadamente 1,5 mcg/mL (rango: 1,1 a 2,1 mcg/mL), que es equivalente a la notificada luego de la administración de la tableta de 100 mg. El tiempo hasta la concentración plasmática máxima y el área bajo la curva de concentración plasmática-tiempo (AUC) de la suspensión oral también fueron equivalentes a los producidos con comprimidos recubiertos con película en adultos después de una dosis oral de 100 mg.
La farmacocinética de cefpodoxima se investigó en 29 pacientes de 1 a 17 años. Cada paciente recibió una dosis oral única de 5 mg/kg de suspensión oral de cefpodoxima. Se recogieron muestras de plasma y orina durante 12 horas después de la dosificación. Los niveles plasmáticos informados de este estudio son los siguientes:
NIVELES PLASMÁTICOS DE CEFPODOXIMA (mcg/mL) EN PACIENTES EN AYUNA (1 A 17 AÑOS DE EDAD) DESPUÉS DE LA ADMINISTRACIÓN DE LA SUSPENSIÓN
Distribución
La unión a proteínas de la cefpodoxima oscila entre el 22 y el 33 % en suero y entre el 21 y el 29 % en plasma.
ampolla de la piel
Después de la administración de dosis múltiples cada 12 horas durante 5 días de 200 mg o 400 mg de cefpodoxima proxetilo, la concentración media máxima de cefpodoxima en el líquido de las ampollas cutáneas promedió 1,6 y 2,8 mcg/ml, respectivamente. Los niveles de cefpodoxima en el líquido de las ampollas cutáneas 12 horas después de la administración promediaron 0,2 y 0,4 mcg/ml para los regímenes de dosis múltiples de 200 mg y 400 mg, respectivamente.
Tejido de amígdalas
Después de una sola tableta oral de 100 mg de cefpodoxima proxetilo recubierta con película, la concentración media máxima de cefpodoxima en el tejido de las amígdalas promedió 0,24 mcg/g a las 4 horas posteriores a la administración y 0,09 mcg/g a las 7 horas posteriores a la administración. Se logró el equilibrio entre el plasma y el tejido de las amígdalas dentro de las 4 horas posteriores a la dosificación. No se informó la detección de cefpodoxima en el tejido amigdalino 12 horas después de la dosificación. Estos resultados demostraron que las concentraciones de cefpodoxima excedieron la MIC90 de S. pyogenes durante al menos 7 horas después de la administración de 100 mg de cefpodoxima proxetilo.
Tejido pulmonar
Después de una sola tableta oral de 200 mg de cefpodoxima proxetil recubierta con película, la concentración máxima media de cefpodoxima en el tejido pulmonar promedió 0,63 mcg/g a las 3 horas posteriores a la dosificación, 0,52 mcg/g a las 6 horas posteriores a la dosificación y 0,19 mcg/g a las 12 horas después de la dosificación. Los resultados de este estudio indicaron que la cefpodoxima penetró en el tejido pulmonar y produjo concentraciones sostenidas del fármaco durante al menos 12 horas después de la dosificación a niveles que excedieron la MIC90 para S. pneumoniae y H. influenzae.
LCR
No se dispone de datos adecuados sobre los niveles de cefpodoxima en LCR.
Efectos de la función renal disminuida
La eliminación de cefpodoxima se reduce en pacientes con insuficiencia renal de moderada a grave (aclaramiento de creatinina PRECAUCIONES y DOSIFICACIÓN Y ADMINISTRACIÓN .) En sujetos con deterioro leve de la función renal (depuración de creatinina de 50 a 80 ml/min), la vida media plasmática promedio de la cefpodoxima fue de 3,5 horas. En sujetos con insuficiencia renal moderada (aclaramiento de creatinina de 30 a 49 ml/min) o grave (aclaramiento de creatinina de 5 a 29 ml/min), la vida media aumentó a 5,9 y 9,8 horas, respectivamente. Aproximadamente el 23 % de la dosis administrada se eliminó del cuerpo durante un procedimiento estándar de hemodiálisis de 3 horas.
Efecto de la insuficiencia hepática (cirrosis)
La absorción fue algo disminuida y la eliminación no cambió en pacientes con cirrosis. El T½ medio de cefpodoxima y el aclaramiento renal en pacientes cirróticos fueron similares a los obtenidos en estudios de sujetos sanos. La ascitis no pareció afectar los valores en sujetos cirróticos. No se recomienda ajustar la dosis en esta población de pacientes.
Farmacocinética en sujetos de edad avanzada
Los sujetos de edad avanzada no requieren ajustes de dosis a menos que tengan una función renal disminuida. (Ver PRECAUCIONES .) En sujetos geriátricos sanos, la vida media de cefpodoxima en plasma promedió 4,2 horas (frente a 3,3 en sujetos más jóvenes) y la recuperación urinaria promedió 21 % después de administrar una dosis de 400 mg cada 12 horas. Otros parámetros farmacocinéticos (Cmax, AUC y Tmax) no cambiaron en relación con los observados en sujetos jóvenes sanos.
Microbiología
Mecanismo de acción
La cefpodoxima es un agente bactericida que actúa inhibiendo la síntesis de la pared celular bacteriana. Cefpodoxima tiene actividad en presencia de algunas betalactamasas, tanto penicilinasas como cefalosporinasas, de bacterias Gram negativas y Gram positivas.
mecanismo de resistencia
La resistencia a la cefpodoxima se debe principalmente a la hidrólisis por la betalactamasa, la alteración de las proteínas de unión a penicilina (PBP) y la disminución de la permeabilidad.
Se ha demostrado que la cefpodoxima es activa contra la mayoría de los aislados de las siguientes bacterias, tanto in vitro como en infecciones clínicas, como se describe en la sección Indicaciones y uso (1):
bacterias grampositivas
Staphylococcus aureus (cepas sensibles a la meticilina, incluidas las que producen penicilinasas) Staphylococcus saprophyticus Streptococcus pneumoniae (excluidos los aislados resistentes a la penicilina) Streptococcus pyogenes
Bacterias Gram-negativo
Escherichia coli Klebsiella pneumoniae Proteus mirabilis Haemophilus influenzae (incluidos los aislados productores de betalactamasa) Moraxella catarrhalis Neisseria gonorrhoeae (incluidos los aislados productores de penicilinasa)
Los siguientes datos in vitro están disponibles, pero se desconoce su importancia clínica. Al menos el 90 por ciento de los siguientes microorganismos exhiben una concentración inhibitoria mínima (MIC) in vitro menor o igual al punto de corte Susceptible para cefpodoxima. Sin embargo, la eficacia de cefpodoxima en el tratamiento de infecciones clínicas debidas a estos microorganismos no se ha establecido en ensayos clínicos adecuados y bien controlados.
bacterias grampositivas
Streptococcus agalactiae Streptococcus spp. (Grupos C, F, G)
Bacterias Gram-negativo
Citrobacter diversus Klebsiella oxytoca Proteus vulgaris Providencia rettgeri Haemophilus parainfluenzae
Bacterias Gram-positivas Anaerobias
peptostreptococcus magnus
Métodos de prueba de susceptibilidad
Cuando esté disponible, el laboratorio de microbiología clínica debe proporcionar al médico los resultados de las pruebas de susceptibilidad in vitro de los medicamentos antimicrobianos utilizados en los hospitales residentes como informes periódicos que describen el perfil de susceptibilidad de los patógenos nosocomiales y adquiridos en la comunidad. Estos informes deberían ayudar al médico a seleccionar un medicamento antibacteriano para el tratamiento.
Técnicas de dilución
Los métodos cuantitativos se utilizan para determinar las concentraciones inhibitorias mínimas (CIM) antimicrobianas. Estos MIC proporcionan estimaciones de la susceptibilidad de las bacterias a los compuestos antimicrobianos. Las CIM deben determinarse utilizando un método de prueba estandarizado. Los valores de MIC deben interpretarse de acuerdo con los criterios proporcionados en la Tabla 1.
Técnicas de difusión
Los métodos cuantitativos que requieren la medición de los diámetros de las zonas también proporcionan estimaciones reproducibles de la susceptibilidad de las bacterias a los compuestos antimicrobianos. El tamaño de la zona proporciona una estimación de la susceptibilidad de las bacterias a los compuestos antimicrobianos. El tamaño de la zona debe determinarse usando un método de prueba estandarizado. Este procedimiento utiliza discos de papel impregnados con 10 mcg de Cefpodoxima para probar la susceptibilidad de los microorganismos a la Cefpodoxima. Los criterios de interpretación de la difusión por disco se proporcionan en la Tabla 1.
Un informe de Susceptible indica que es probable que el antimicrobiano inhiba el crecimiento del patógeno si el compuesto antimicrobiano alcanza la concentración en el sitio de infección necesaria para inhibir el crecimiento del patógeno. Un informe de Intermedio indica que el resultado debe considerarse equívoco, y si el microorganismo no es completamente sensible a los medicamentos alternativos clínicamente factibles, la prueba debe repetirse. Esta categoría implica una posible aplicabilidad clínica en sitios del cuerpo donde el fármaco se concentra fisiológicamente o en situaciones en las que se puede utilizar una dosis alta del fármaco. Esta categoría también proporciona una zona de amortiguamiento que evita que pequeños factores técnicos no controlados causen grandes discrepancias en la interpretación. Un informe de Resistente indica que no es probable que el antimicrobiano inhiba el crecimiento del patógeno si el compuesto antimicrobiano alcanza las concentraciones que normalmente se alcanzan en el sitio de la infección; debe seleccionarse otra terapia.
Control de calidad
Los procedimientos de prueba de susceptibilidad estandarizados requieren el uso de controles de laboratorio para monitorear y garantizar la exactitud y precisión de los suministros y reactivos utilizados en el ensayo, y las técnicas de la persona que realiza la prueba1,2,3. El polvo de cefpodoxima estándar debe proporcionar el siguiente rango de valores de MIC que se indican en la Tabla 2. Para la técnica de difusión que usa el disco de 10 mcg, se deben cumplir los criterios de la Tabla 2.
Ensayos clínicos
Cistitis
En dos ensayos comparativos aleatorios 2:1, doble ciego, realizados en adultos en los Estados Unidos, se comparó cefpodoxima proxetilo con otros antibióticos betalactámicos. En estos estudios, se obtuvieron las siguientes tasas de erradicación bacteriana entre 5 y 9 días después de la terapia:
En estos estudios, las tasas de curación clínica y las tasas de erradicación bacteriana para cefpodoxima proxetilo fueron comparables a las de los agentes de comparación; sin embargo, las tasas de curación clínica y las tasas de erradicación bacteriológica fueron más bajas que las observadas con algunas otras clases de agentes aprobados para la cistitis.
Estudios de otitis media aguda
En estudios controlados de otitis media aguda realizados en los Estados Unidos, donde se encontraron tasas significativas de organismos productores de betalactamasas, se comparó cefpodoxima proxetilo con cefixima. En estos estudios, utilizando criterios de evaluabilidad muy estrictos y criterios microbiológicos y de respuesta clínica en el seguimiento de 4 a 21 días después de la terapia, se obtuvieron los siguientes resultados presuntivos de erradicación bacteriana/éxito clínico (curación y mejoría).
REFERENCIAS
1. Instituto de Normas Clínicas y de Laboratorio (CLSI). Métodos para pruebas de susceptibilidad antimicrobiana por dilución para bacterias que crecen aeróbicamente; Norma Aprobada - Novena Edición. Documento CLSI M07-A9, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, EE. UU., 2012.
2. Instituto de Normas Clínicas y de Laboratorio (CLSI). Estándares de Desempeño para Pruebas de Susceptibilidad Antimicrobiana; Vigésimo Tercer Suplemento Informativo, CLSI documento M100-S23. Documento CLSI M100-S23, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, EE. UU., 2013.
3. Instituto de Normas Clínicas y de Laboratorio (CLSI). Normas de rendimiento para las pruebas de susceptibilidad a la difusión por disco de antimicrobianos; Estándar aprobado: undécima edición del documento CLSI M02-A11, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, EE. UU., 2012.
INFORMACIÓN DEL PACIENTE
Se debe advertir a los pacientes que los medicamentos antibacterianos, incluido VANTIN, solo deben usarse para tratar infecciones bacterianas. No tratan infecciones virales (p. ej., el resfriado común). Cuando se prescribe VANTIN para tratar una infección bacteriana, se debe informar a los pacientes que, aunque es común que se sientan mejor al comienzo de la terapia, el medicamento debe tomarse exactamente como se indica. Omitir dosis o no completar el curso completo de la terapia puede (1) disminuir la eficacia del tratamiento inmediato y (2) aumentar la probabilidad de que las bacterias desarrollen resistencia y no sean tratables con VANTIN u otros medicamentos antibacterianos en el futuro.
La diarrea es un problema común causado por los antibióticos que generalmente termina cuando se suspende el antibiótico. A veces, después de comenzar el tratamiento con antibióticos, los pacientes pueden desarrollar heces acuosas y sanguinolentas (con o sin calambres estomacales y fiebre) incluso dos o más meses después de haber tomado la última dosis del antibiótico. Si esto ocurre, los pacientes deben comunicarse con su médico lo antes posible.
