Cipro 1000mg, 250mg, 500mg, 750mg Ciprofloxacin Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Cipro 750mg y cómo se usa?
Cipro 500mg es un medicamento recetado que se usa para tratar los síntomas de infecciones bacterianas. Cipro puede usarse solo o con otros medicamentos.
Cipro pertenece a una clase de medicamentos llamados fluoroquinolonas.
No se sabe si Cipro 750 mg es seguro y efectivo en niños menores de 1 año.
¿Cuáles son los posibles efectos secundarios de Cipro?
Cipro puede causar efectos secundarios graves que incluyen:
- baja azúcar en la sangre,
- dolor de cabeza,
- hambre,
- transpiración,
- irritabilidad,
- mareo,
- náuseas,
- frecuencia cardíaca rápida,
- sentirse ansioso o tembloroso,
- entumecimiento en sus manos, brazos, piernas o pies,
- debilidad,
- hormigueo o dolor ardiente,
- nerviosismo,
- confusión,
- agitación,
- paranoia,
- alucinaciones,
- problemas de memoria,
- problemas para concentrarse,
- pensamientos de suicidio,
- dolor súbito,
- hinchazón,
- hematomas,
- sensibilidad,
- rigidez,
- problemas de movimiento,
- chasquido o estallido en cualquier articulación,
- dolor intenso o constante en el pecho, el estómago o la espalda,
- diarrea acuosa o con sangre,
- revoloteando en tu pecho,
- dificultad para respirar,
- aturdimiento,
- sarpullido,
- problemas respiratorios,
- orinar poco o nada,
- coloración amarillenta de la piel o los ojos,
- dolor de cabeza intenso,
- zumbando en tus oídos,
- problemas de visión y
- dolor detrás de tus ojos
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Cipro 1000mg incluyen:
- náuseas,
- vómitos,
- Diarrea,
- dolor de estómago,
- picazón o secreción vaginal,
- dolor de cabeza, y
- pruebas de función hepática anormales
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Cipro. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
ADVERTENCIA
REACCIONES ADVERSAS GRAVES INCLUYENDO TENDINITIS, RUPTURA DE TENDONES, NEUROPATÍA PERIFÉRICA, EFECTOS EN EL SISTEMA NERVIOSO CENTRAL Y EXACERBACIÓN DE MIASTENIA GRAVIS
- Las fluoroquinolonas, incluido Cipro 250 mg, se han asociado con reacciones adversas graves incapacitantes y potencialmente irreversibles que han ocurrido juntas [ver ADVERTENCIAS Y PRECAUCIONES], que incluyen:
- Tendinitis y rotura de tendón [ver ADVERTENCIAS Y PRECAUCIONES]
- Neuropatía periférica [ver ADVERTENCIAS Y PRECAUCIONES]
- Efectos sobre el sistema nervioso central [ver ADVERTENCIAS Y PRECAUCIONES]
Suspender Cipro 750 mg inmediatamente y evitar el uso de fluoroquinolonas, incluido Cipro, en pacientes que experimentan cualquiera de estas reacciones adversas graves [ver ADVERTENCIAS Y PRECAUCIONES ]
- Las fluoroquinolonas, incluido Cipro 750 mg, pueden exacerbar la debilidad muscular en pacientes con miastenia grave. Evite Cipro en pacientes con antecedentes conocidos de miastenia grave. [ver ADVERTENCIAS Y PRECAUCIONES]
- Debido a que las fluoroquinolonas, incluido CIPRO 500 mg, se han asociado con reacciones adversas graves [ver ADVERTENCIAS Y PRECAUCIONES], reserve CIPRO para uso en pacientes que no tienen opciones de tratamiento alternativas para infecciones del tracto urinario no complicadas [ver INDICACIONES]
DESCRIPCIÓN
Las tabletas de liberación prolongada Cipro (cipro 750 mgfloxacino*) contienen cipro 500 mgfloxacino, un agente antimicrobiano sintético para administración oral. Los comprimidos de Cipro de 1000 mg son comprimidos recubiertos de dos capas que constan de una capa de liberación inmediata y una capa de liberación controlada tipo matriz de erosión. Los comprimidos contienen una combinación de dos tipos de principio activo de ciprofloxacina, clorhidrato de ciprofloxacina y ciprofloxacina betaína (base). El clorhidrato de floxacina de 750 mg de Cipro es clorhidrato de ácido 1-ciclopropil-6-fluoro-1,4dihidro-4-oxo-7-(1-piperazinil)-3-quinolinacarboxílico. Se proporciona como una mezcla del monohidrato y el sesquihidrato. La fórmula empírica del monohidrato es C17H18FN3O3. HCl. H2O y su peso molecular es 385,8. La fórmula empírica del sesquihidrato es C17H18FN3O3. HCl. 1.5 H2O y su peso molecular es 394.8. El principio activo es una sustancia cristalina ligeramente amarillenta a amarilla clara. La estructura química del monohidrato es la siguiente:
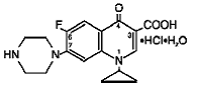
Cipro 1000 mg de floxacina betaína es ácido 1-ciclopropil-6-fluoro-1, 4-dihidro-4-oxo-7-(1-piperazinil)-3-quinolinacarboxílico. Como hidrato, su fórmula empírica es C17H18FN3O3. 3,5 H2O y su peso molecular es 394,3. Es una sustancia cristalina de color amarillento pálido a amarillo claro y su estructura química es la siguiente:
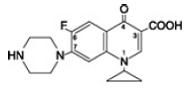
Cipro está disponible en tabletas de 500 mg y 1000 mg (cipro 500 mg equivalente a floxacina). Los comprimidos de Cipro son comprimidos oblongos, recubiertos con película, casi blancos o ligeramente amarillentos. Cada tableta de Cipro 500 mg contiene 500 mg de ciprofloxacina como ciprofloxacina HCl (287,5 mg, calculados como ciprofloxacina en base seca) y cipro 1000 mgfloxacina† (212,6 mg, calculados en base seca). Cada tableta de Cipro 1000 mg contiene 1000 mg de ciprofloxacina como ciprofloxacina HCl (574,9 mg, calculados como ciprofloxacina en base seca) y cipro 750 mgfloxacina† (425,2 mg, calculados en base seca). Los ingredientes inactivos son crospovidona, hipromelosa, estearato de magnesio, polietilenglicol, sílice coloidal anhidra, ácido succínico y dióxido de titanio.
* como cipro 500 mg de floxacina† y cipro 250 mg de clorhidrato de floxacina † no cumple con la prueba de pérdida por secado y la prueba de residuos por ignición de la monografía de la USP.
INDICACIONES
Infecciones De La Piel Y De La Estructura De La Piel
CIPRO 1000 mg está indicado en pacientes adultos para el tratamiento de infecciones de la piel y la estructura de la piel causadas por Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Proteus mirabilis, Proteus vulgaris, Providencia stuartii, Morganella morganii, Citrobacter freundii, Pseudomonas aeruginosa, Staphylococcus aureus sensible a la meticilina, Staphylococcus epidermidis sensible a la meticilina o Streptococcus pyogenes.
Infecciones de huesos y articulaciones
CIPRO 750 mg está indicado en pacientes adultos para el tratamiento de infecciones óseas y articulares causadas por Enterobacter cloacae, Serratia marcescens o Pseudomonas aeruginosa.
Infecciones intraabdominales complicadas
CIPRO 250 mg está indicado en pacientes adultos para el tratamiento de infecciones intraabdominales complicadas (utilizadas en combinación con metronidazol) causadas por Escherichia coli, Pseudomonas aeruginosa, Proteus mirabilis, Klebsiella pneumoniae o Bacteroides fragilis.
Diarrea Infecciosa
CIPRO 500 mg está indicado en pacientes adultos para el tratamiento de la diarrea infecciosa causada por Escherichia coli (aislados enterotoxigénicos), Campylobacter jejuni, Shigella boydii †, Shigella dysenteriae, Shigella flexneri o Shigella sonnei † cuando esté indicada la terapia antibacteriana.
†Aunque el tratamiento de infecciones debidas a este organismo en este sistema de órganos demostró un resultado clínicamente significativo, la eficacia se estudió en menos de 10 pacientes.
Fiebre tifoidea (fiebre entérica)
CIPRO 1000 mg está indicado en pacientes adultos para el tratamiento de la fiebre tifoidea (fiebre entérica) causada por Salmonella typhi. No se ha demostrado la eficacia de ciprofloxacino en la erradicación del estado de portador crónico de fiebre tifoidea.
Gonorrea cervical y uretral sin complicaciones
CIPRO está indicado en pacientes adultos para el tratamiento de la gonorrea cervical y uretral no complicada debida a Neisseria gonorrhoeae [ver ADVERTENCIAS Y PRECAUCIONES ].
Ántrax por inhalación (posterior a la exposición)
CIPRO 250 mg está indicado en adultos y pacientes pediátricos desde el nacimiento hasta los 17 años de edad para el ántrax por inhalación (post-exposición) para reducir la incidencia o progresión de la enfermedad después de la exposición al Bacillus anthracis en aerosol.
Las concentraciones séricas de 500 mg de floxacina de Cipro alcanzadas en humanos sirvieron como criterio de valoración sustituto con una probabilidad razonable de predecir el beneficio clínico y proporcionaron la base inicial para la aprobación de esta indicación.1 Se obtuvo información clínica de apoyo para la ciprofloxacina para la profilaxis posterior a la exposición al ántrax durante los ataques bioterroristas de ántrax de octubre. 2001 [ver Estudios clínicos ].
Plaga
CIPRO 1000 mg está indicado para el tratamiento de la peste, incluida la peste neumónica y septicémica, debida a Yersinia pestis (Y. pestis) y la profilaxis de la peste en adultos y pacientes pediátricos desde el nacimiento hasta los 17 años de edad. No se pudieron realizar estudios de eficacia de cipro 250 mgfloxacino en humanos con peste por razones de factibilidad. Por lo tanto, esta indicación se basa en un estudio de eficacia realizado únicamente en animales [ver Estudios clínicos ].
Prostatitis bacteriana crónica
CIPRO está indicado en pacientes adultos para el tratamiento de la prostatitis bacteriana crónica causada por Escherichia coli o Proteus mirabilis.
Infecciones del tracto respiratorio inferior
CIPRO 750 mg está indicado en pacientes adultos para el tratamiento de infecciones del tracto respiratorio inferior causadas por Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Proteus mirabilis, Pseudomonas aeruginosa, Haemophilus influenzae, Haemophilus parainfluenzae o Streptococcus pneumoniae.
CIPRO no es un fármaco de primera elección en el tratamiento de neumonía presunta o confirmada secundaria a Streptococcus pneumoniae.
CIPRO está indicado para el tratamiento de las exacerbaciones agudas de la bronquitis crónica (AECB) causadas por Moraxella catarrhalis.
Debido a que las fluoroquinolonas, incluido CIPRO, se han asociado con reacciones adversas graves [ver ADVERTENCIAS Y PRECAUCIONES ] y para algunos pacientes AECB es autolimitado, reserve CIPRO 750 mg para el tratamiento de AECB en pacientes que no tienen opciones de tratamiento alternativas.
Infecciones del tracto urinario
Infecciones del tracto urinario en adultos
CIPRO 500 mg está indicado en pacientes adultos para el tratamiento de infecciones del tracto urinario causadas por Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Serratia marcescens, Proteus mirabilis, Providencia rettgeri, Morganella morganii, Citrobacter koseri, Citrobacter freundii, Pseudomonas aeruginosa, Staphylococcus epidermidis sensible a la meticilina , Staphylococcus saprophyticus o Enterococcus faecalis.
Cistitis aguda no complicada
CIPRO 750 mg está indicado en mujeres adultas para el tratamiento de la cistitis aguda no complicada causada por Escherichia coli o Staphylococcus saprophyticus.
Debido a que las fluoroquinolonas, incluido CIPRO, se han asociado con reacciones adversas graves [ver ADVERTENCIAS Y PRECAUCIONES ] y para algunos pacientes la cistitis aguda no complicada es autolimitada, reserve CIPRO para el tratamiento de la cistitis aguda no complicada en pacientes que no tienen opciones de tratamiento alternativas.
Infección complicada del tracto urinario y pielonefritis en pacientes pediátricos
CIPRO está indicado en pacientes pediátricos de uno a 17 años de edad para el tratamiento de infecciones complicadas del tracto urinario (cUTI) y pielonefritis debidas a Escherichia coli [ver Uso en poblaciones específicas ].
Aunque es eficaz en los ensayos clínicos, CIPRO no es un fármaco de primera elección en la población pediátrica debido a una mayor incidencia de reacciones adversas en comparación con los controles, incluidas las reacciones relacionadas con las articulaciones y/o los tejidos circundantes. CIPRO 250 mg, al igual que otras fluoroquinolonas, se asocia con artropatía y cambios histopatológicos en las articulaciones que soportan peso de animales jóvenes [ver ADVERTENCIAS Y PRECAUCIONES , REACCIONES ADVERSAS , Uso en poblaciones específicas y Toxicología no clínica ].
Sinusitis aguda
CIPRO está indicado en pacientes adultos para el tratamiento de la sinusitis aguda causada por Haemophilus influenzae, Streptococcus pneumoniae o Moraxella catarrhalis.
Debido a que las fluoroquinolonas, incluido CIPRO, se han asociado con reacciones adversas graves [ver ADVERTENCIAS Y PRECAUCIONES ] y para algunos pacientes la sinusitis aguda es autolimitada, reserve CIPRO para el tratamiento de la sinusitis aguda en pacientes que no tienen opciones de tratamiento alternativas.
Uso
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de CIPRO 1000 mg y otros medicamentos antibacterianos, CIPRO 500 mg debe usarse solo para tratar o prevenir infecciones que se compruebe o se sospeche que son causadas por bacterias susceptibles. Cuando la información de cultivo y susceptibilidad esté disponible, se debe considerar al seleccionar o modificar la terapia antibacteriana. En ausencia de tales datos, la epidemiología local y los patrones de susceptibilidad pueden contribuir a la selección empírica de la terapia.
Si se sospecha que los organismos anaerobios contribuyen a la infección, se debe administrar la terapia adecuada. Se deben realizar cultivos y pruebas de susceptibilidad apropiados antes del tratamiento para aislar e identificar los organismos que causan la infección y determinar su susceptibilidad a la ciprofloxacina. La terapia con CIPRO puede iniciarse antes de que se conozcan los resultados de estas pruebas; una vez que los resultados estén disponibles, se debe continuar con la terapia adecuada.
Al igual que con otros medicamentos, algunos aislados de Pseudomonas aeruginosa pueden desarrollar resistencia con bastante rapidez durante el tratamiento con cipro 1000 mg de floxacina. Los cultivos y las pruebas de susceptibilidad realizadas periódicamente durante la terapia proporcionarán información no solo sobre el efecto terapéutico del agente antimicrobiano sino también sobre la posible aparición de resistencia bacteriana.
DOSIFICACIÓN Y ADMINISTRACIÓN
Las tabletas y la suspensión oral de CIPRO de 1000 mg deben administrarse por vía oral como se describe en las tablas de Pautas de dosificación correspondientes.
Dosis en adultos
La determinación de la dosis y la duración para cualquier paciente en particular debe tener en cuenta la gravedad y la naturaleza de la infección, la susceptibilidad del microorganismo causante, la integridad de los mecanismos de defensa del huésped del paciente y el estado de la función hepática y renal. . Los comprimidos de CIPRO o la suspensión oral de CIPRO se pueden administrar a pacientes adultos cuando esté clínicamente indicado a discreción del médico. Administre CIPRO para suspensión oral usando la cuchara graduada empaquetada conjuntamente [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Conversión de dosificación IV a oral en adultos
Los pacientes cuyo tratamiento se inicia con CIPRO IV pueden cambiarse a CIPRO 750 mg comprimidos o suspensión oral cuando esté clínicamente indicado a discreción del médico (Tabla 2) [ver FARMACOLOGÍA CLÍNICA ].
Dosis en pacientes pediátricos
La dosificación y la vía inicial de tratamiento (es decir, IV u oral) para la cUTI o la pielonefritis deben determinarse según la gravedad de la infección. CIPRO debe administrarse como se describe en la Tabla 3. Administre CIPRO para suspensión oral usando la cuchara graduada empaquetada conjuntamente [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Modificaciones de dosis en pacientes con insuficiencia renal
Cipro 250 mgfloxacino se elimina principalmente por excreción renal; sin embargo, el fármaco también se metaboliza y elimina parcialmente a través del sistema biliar del hígado y del intestino. Estas vías alternativas de eliminación del fármaco parecen compensar la excreción renal reducida en pacientes con insuficiencia renal. No obstante, se recomienda alguna modificación de la dosis, particularmente para pacientes con disfunción renal grave. Las pautas de dosificación para uso en pacientes con insuficiencia renal se muestran en la Tabla 4.
Cuando solo se conoce la concentración de creatinina sérica, se pueden usar las siguientes fórmulas para estimar el aclaramiento de creatinina:
La creatinina sérica debe representar un estado estable de la función renal.
En pacientes con infecciones graves e insuficiencia renal grave, se puede administrar una dosis unitaria de 750 mg en los intervalos indicados anteriormente. Los pacientes deben ser monitoreados cuidadosamente.
Los pacientes pediátricos con insuficiencia renal de moderada a grave fueron excluidos del ensayo clínico de ITUc y pielonefritis. No hay información disponible sobre los ajustes de dosis necesarios para pacientes pediátricos con insuficiencia renal de moderada a grave (es decir, aclaramiento de creatinina
Instrucciones de administración importantes
Con Cationes Multivalentes
Administrar CIPRO al menos 2 horas antes o 6 horas después de los antiácidos de magnesio/aluminio; aglutinantes de fosfato poliméricos (por ejemplo, sevelamer, carbonato de lantano) o sucralfato; Videx® (didanosina) tabletas masticables/amortiguadas o polvo pediátrico para solución oral; otras drogas altamente amortiguadas; u otros productos que contengan calcio, hierro o zinc.
Con Productos Lácteos
Se debe evitar la administración concomitante de CIPRO 500 mg solo con productos lácteos (como leche o yogur) o jugos fortificados con calcio, ya que es posible que disminuya la absorción; sin embargo, CIPRO puede tomarse con una comida que contenga estos productos.
Hidratación de pacientes que reciben CIPRO
Asegurar la hidratación adecuada de los pacientes que reciben CIPRO 1000 mg para evitar la formación de orina muy concentrada. Se ha informado cristaluria con quinolonas.
Indique al paciente la administración adecuada de CIPRO 1000 mg [ver Información de asesoramiento para pacientes ].
Dosis olvidadas
Si se olvida una dosis, debe tomarse en cualquier momento, pero a más tardar 6 horas antes de la siguiente dosis programada. Si quedan menos de 6 horas antes de la siguiente dosis, no se debe tomar la dosis olvidada y se debe continuar el tratamiento según lo prescrito con la siguiente dosis programada. No se deben tomar dosis dobles para compensar la dosis olvidada.
Dividir CIPRO 1000mg Tabletas
Los comprimidos CIPRO de 750 mg, 250 mg y 500 mg son comprimidos ranurados funcionalmente que se pueden dividir por la mitad en la línea ranurada para proporcionar una concentración de 125 mg y 250 mg, respectivamente.
Instrucciones para la reconstitución de las microcápsulas de CIPRO 500 mg para suspensión oral
La suspensión oral de 750 mg de CIPRO se suministra en concentraciones del 5 % (5 g de ciprofloxacina en 100 ml) y del 10 % (10 g de 750 mg de ciprofloxacina en 100 ml). La suspensión oral de CIPRO de 250 mg está compuesta por dos componentes (microcápsulas y diluyente) que deben combinarse antes de dispensarse.
Preparación de la suspensión
Paso 1
El frasco pequeño contiene las microcápsulas, el frasco grande contiene el diluyente.

Paso 2
Abre ambas botellas. Tapa a prueba de niños: presione hacia abajo de acuerdo con las instrucciones de la tapa mientras gira hacia la izquierda.

Paso 3
 Vierta las microcápsulas por completo en la botella más grande de diluyente. No agregue agua a la suspensión. .
Paso 4
 Retire la capa superior de la etiqueta de la botella de diluyente (para dejar al descubierto la etiqueta de suspensión oral de CIPRO de 1000 mg). Cierra completamente el frasco grande según las instrucciones de la tapa y agita vigorosamente durante unos 15 segundos. La suspensión está lista para usar.
Paso 5
Escriba la fecha de caducidad de la suspensión oral reconstituida en la etiqueta del frasco.
El producto reconstituido se puede almacenar por debajo de 30 °C (86 °F) durante 14 días. Proteger de la congelación.
No se deben realizar adiciones a la suspensión final mixta de ciprofloxacino. La suspensión oral de CIPRO 1000 mg no debe administrarse a través de sondas de alimentación o nasogástricas debido a sus características físicas.
Instrucciones de administración de CIPRO para suspensión oral después de la reconstitución
- Agite vigorosamente la suspensión oral de CIPRO de 750 mg cada vez que la use durante aproximadamente 15 segundos.
- Administre la suspensión oral de CIPRO usando la cucharadita graduada empaquetada junto con el paciente (consulte la Figura 1)
Figura 1: Cucharadita graduada de 5 ml empaquetada conjuntamente
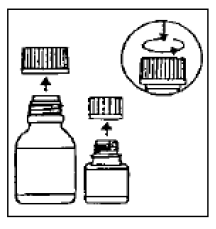
Se proporciona la cucharadita graduada empaquetada conjuntamente (5 ml), con marcas para ½ (2,5 ml) y 1/1 (5 ml)
- Después del uso, limpie la cucharadita graduada con agua corriente con detergente para platos y séquela bien.
- No mastique las microcápsulas de la suspensión oral de CIPRO 250 mg, en su lugar tráguelas enteras.
- Se puede tomar agua después.
- Vuelva a cerrar la botella correctamente después de cada uso de acuerdo con las instrucciones en la tapa.
- Una vez finalizado el tratamiento, la suspensión oral de 1000 mg de CIPRO no debe reutilizarse.
Dosificación de CIPRO para suspensión oral utilizando la cuchara empaquetada conjuntamente en pacientes adultos y pediátricos
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
tabletas
- 250 mg, ligeramente amarillento, recubierto con película, redondo, ranurado funcionalmente, impreso con "BAYER" en un lado y "CIP 250" en el otro.
- 500 mg, ligeramente amarillento, recubierto con película, en forma de cápsula, ranurado funcionalmente, impreso con "BAYER" en un lado y "CIP 500" en el otro.
Suspensión oral
- Suspensión oral al 5 %: 250 mg de cipro 750 mg de floxacina por 5 ml después de la reconstitución
- Suspensión oral al 10 %: 500 mg de cipro 250 mg de floxacina por 5 ml después de la reconstitución
Almacenamiento y manipulación
CIPRO (cipro 750 mg de clorhidrato de floxacina) Las tabletas están disponibles como tabletas recubiertas con película, redondas, ligeramente amarillentas que contienen 250 mg de cipro 500 mg de floxacina. El comprimido de 250 mg está codificado con la palabra "BAYER" en un lado y funcionalmente ranurado y grabado con "CIP 250" en el reverso. CIPRO también está disponible en comprimidos recubiertos con película ligeramente amarillentos en forma de cápsula que contienen 500 mg de ciprofloxacino. La tableta de 500 mg está codificada con la palabra "BAYER" en un lado y funcionalmente ranurada y grabada con "CIP 500" en el reverso. CIPRO 250 mg y 500 mg están disponibles en frascos de 100.
Almacenar a una temperatura de 20° a 25°C (68° a 77°F); excursiones permitidas a 15° a 30°C (59° a 86°F) [ver Temperatura ambiente controlada por USP ].
La suspensión oral de CIPRO se suministra en concentraciones del 5 % y 10 %. El medicamento está compuesto por dos componentes (microcápsulas que contienen el ingrediente activo y el diluyente) que deben ser mezclados por el farmacéutico [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Guarde las microcápsulas y el diluyente por debajo de 25 °C (77 °F); se permiten excursiones de 15°C a 30°C (59°F a 86°F) [ver Temperatura ambiente controlada por USP ]. Proteger de la congelación.
El producto reconstituido se puede almacenar a 25°C (77°F) durante 14 días; se permiten excursiones de 15°C a 30°C (59°F a 86°F) [ver Temperatura ambiente controlada por USP ]. Proteger de la congelación.
Se proporciona una cucharadita graduada (5 ml) con marcas ½ (2,5 ml) y 1/1 (5 ml) para el paciente.
REFERENCIAS
1. 21 CFR 314.510 (Subparte H: Aprobación acelerada de nuevos medicamentos para enfermedades potencialmente mortales).
2. Friedman J, Polifka J. Efectos teratogénicos de las drogas: un recurso para los médicos (TERIS). Baltimore, Maryland: Prensa de la Universidad Johns Hopkins, 2000: 149-195.
3. Loebstein R, Addis A, Ho E, et al. Resultado del embarazo después de la exposición gestacional a las fluoroquinolonas: un estudio controlado prospectivo multicéntrico. Quimioterapia de agentes antimicrobianos. 1998;42(6):1336-1339.
Fabricado para: Bayer HealthCare Pharmaceuticals Inc. Whippany, NJ 07981. Revisado: noviembre de 2021
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas graves y de otro modo importantes se analizan con mayor detalle en otras secciones del etiquetado:
- Reacciones adversas graves incapacitantes y potencialmente irreversibles [ver ADVERTENCIAS Y PRECAUCIONES ]
- Tendinitis y ruptura de tendón [ver ADVERTENCIAS Y PRECAUCIONES ]
- Neuropatía periférica [ver ADVERTENCIAS Y PRECAUCIONES ]
- Efectos sobre el sistema nervioso central [ver ADVERTENCIAS Y PRECAUCIONES ] Exacerbación de la miastenia grave [ver ADVERTENCIAS Y PRECAUCIONES ]
- Otras reacciones adversas graves y, en ocasiones, mortales [ver ADVERTENCIAS Y PRECAUCIONES ]
- Reacciones de hipersensibilidad [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hepatotoxicidad [ver ADVERTENCIAS Y PRECAUCIONES ]
- Riesgo de aneurisma y disección aórticos [ver ADVERTENCIAS Y PRECAUCIONES ]
- Reacciones adversas graves con teofilina concomitante [ver ADVERTENCIAS Y PRECAUCIONES ]
- Diarrea asociada a Clostridioides difficile [ver ADVERTENCIAS Y PRECAUCIONES ]
- Prolongación del intervalo QT [ver ADVERTENCIAS Y PRECAUCIONES ]
- Trastornos musculoesqueléticos en pacientes pediátricos [ver ADVERTENCIAS Y PRECAUCIONES ]
- Fotosensibilidad/Fototoxicidad [ver ADVERTENCIAS Y PRECAUCIONES ]
- Desarrollo de bacterias resistentes a los medicamentos [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Pacientes adultos
Durante las investigaciones clínicas con CIPRO oral y parenteral de 750 mg, 49 038 pacientes recibieron ciclos del fármaco.
Las reacciones adversas notificadas con mayor frecuencia en los ensayos clínicos de todas las formulaciones, todas las dosis, todas las duraciones de la terapia con medicamentos y para todas las indicaciones de la terapia con ciprofloxacino fueron náuseas (2,5 %), diarrea (1,6 %), pruebas de función hepática anormales (1,3 %). ), vómitos (1%) y erupción (1%).
En ensayos clínicos controlados, aleatorizados, doble ciego, que compararon comprimidos de CIPRO [500 mg dos veces al día (BID)] con cefuroxima axetilo (250 mg–500 mg BID) y claritromicina (500 mg BID) en pacientes con infecciones del tracto respiratorio, CIPRO demostró un perfil de reacciones adversas del SNC comparable a los fármacos de control.
Pacientes pediátricos
Se comparó la seguridad musculoesquelética y neurológica a corto (6 semanas) y a largo plazo (1 año) de ciprofloxacino oral/intravenoso con una cefalosporina para el tratamiento de ITUc o pielonefritis en pacientes pediátricos de 1 a 17 años de edad (edad media de 6 ± 4 años). ) en un ensayo multicéntrico internacional. La duración del tratamiento fue de 10 a 21 días (la duración media del tratamiento fue de 11 días con un rango de 1 a 88 días). Se incluyeron un total de 335 pacientes tratados con cipro 250 mg de floxacina y 349 tratados con el comparador.
Un Comité Independiente de Seguridad Pediátrica (IPSC, por sus siglas en inglés) revisó todos los casos de reacciones adversas musculoesqueléticas, incluida la marcha anormal o el examen articular anormal (inicial o emergente del tratamiento). Dentro de las 6 semanas posteriores al inicio del tratamiento, las tasas de reacciones adversas musculoesqueléticas fueron del 9,3 % (31/335) en el grupo tratado con 750 mg de floxacina de cipro frente al 6 % (21/349) en los pacientes tratados con el comparador. Todas las reacciones adversas musculoesqueléticas que ocurrieron a las 6 semanas se resolvieron (resolución clínica de los signos y síntomas), generalmente dentro de los 30 días posteriores al final del tratamiento. Las evaluaciones radiológicas no se utilizaron de forma rutinaria para confirmar la resolución de las reacciones adversas. Los pacientes tratados con Cipro 500 mg de floxacina tenían más probabilidades de informar más de una reacción adversa y en más de una ocasión en comparación con los pacientes de control. La tasa de reacciones adversas musculoesqueléticas fue consistentemente mayor en el grupo de ciprofloxacina en comparación con el grupo de control en todos los subgrupos de edad. Al final de 1 año, la tasa de estas reacciones adversas notificadas en cualquier momento durante ese período fue del 13,7 % (46/335) en el grupo tratado con 250 mg de floxacina de cipro frente al 9,5 % (33/349) en los pacientes tratados con el comparador ( Tabla 9).
Las tasas de incidencia de reacciones adversas neurológicas dentro de las 6 semanas posteriores al inicio del tratamiento fueron del 3 % (9/335) en el grupo CIPRO frente al 2 % (7/349) en el grupo de comparación e incluyeron mareos, nerviosismo, insomnio y somnolencia.
En este ensayo, las tasas generales de incidencia de reacciones adversas dentro de las 6 semanas posteriores al inicio del tratamiento fueron del 41 % (138/335) en el grupo de 250 mg de floxacina de cipro frente al 31 % (109/349) en el grupo de comparación. Las reacciones adversas más frecuentes fueron gastrointestinales: 15 % (50/335) de los pacientes tratados con ciprofloxacino frente al 9 % (31/349) de los pacientes de comparación. Se observaron reacciones adversas graves en el 7,5 % (25/335) de los pacientes tratados con ciprofloxacino en comparación con el 5,7 % (20/349) de los pacientes de control. Se observó interrupción del fármaco debido a una reacción adversa en el 3 % (10/335) de los pacientes tratados con ciprofloxacino frente al 1,4 % (5/349) de los pacientes de comparación. Otras reacciones adversas que ocurrieron en al menos el 1 % de los pacientes con ciprofloxacina fueron diarrea 4,8 %, vómitos 4,8 %, dolor abdominal 3,3 %, dispepsia 2,7 %, náuseas 2,7 %, fiebre 2,1 %, asma 1,8 % y erupción cutánea 1,8 %.
Los datos de seguridad a corto plazo para cipro 1000mgfloxacin también se recopilaron en un ensayo clínico aleatorizado, doble ciego para el tratamiento de exacerbaciones pulmonares agudas en pacientes con fibrosis quística (de 5 a 17 años de edad). Sesenta y siete pacientes recibieron CIPRO IV 10 mg/kg/dosis cada 8 horas durante una semana seguido de CIPRO 250 mg comprimidos 20 mg/kg/dosis cada 12 horas para completar el tratamiento de 10 a 21 días y 62 pacientes recibieron la combinación de ceftazidima intravenosa 50 mg/kg/dosis cada 8 h y tobramicina intravenosa 3 mg/kg/dosis cada 8 h durante un total de 10 a 21 días. Examinadores cegados al tratamiento realizaron evaluaciones musculoesqueléticas periódicas. Los pacientes fueron seguidos durante un promedio de 23 días después de completar el tratamiento (rango 0-93 días). Se informaron reacciones adversas musculoesqueléticas en el 22 % de los pacientes del grupo de ciprofloxacina y en el 21 % del grupo de comparación. Se informó una disminución del rango de movimiento en el 12% de los sujetos en el grupo de ciprofloxacina y en el 16% en el grupo de comparación. Se informó artralgia en el 10 % de los pacientes del grupo de 500 mg de floxacina de cipro y en el 11 % del grupo de comparación. Otras reacciones adversas fueron similares en naturaleza y frecuencia entre los brazos de tratamiento. No se ha establecido la eficacia de CIPRO para el tratamiento de exacerbaciones pulmonares agudas en pacientes pediátricos con fibrosis quística.
Además de las reacciones adversas notificadas en pacientes pediátricos en ensayos clínicos, cabe esperar que las reacciones adversas notificadas en adultos durante los ensayos clínicos o la experiencia posterior a la comercialización también puedan ocurrir en pacientes pediátricos.
Experiencia posterior a la comercialización
Las siguientes reacciones adversas se han informado a partir de la experiencia de comercialización mundial con fluoroquinolonas, incluido CIPRO. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco (Tabla 10).
Cambios adversos de laboratorio
Los cambios en los parámetros de laboratorio durante el tratamiento con CIPRO 250 mg se enumeran a continuación:
Hepático –Elevaciones de ALT (SGPT), AST (SGOT), fosfatasa alcalina, LDH, bilirrubina sérica.
hematológico –Eosinofilia, leucopenia, plaquetas sanguíneas disminuidas, plaquetas sanguíneas elevadas, pancitopenia.
Renal –Se han informado elevaciones de creatinina sérica, BUN, cristaluria, cilindruria y hematuria.
Otros cambios que ocurrieron fueron: elevación de la gammaglutamil transferasa sérica, elevación de la amilasa sérica, reducción de la glucosa en sangre, aumento del ácido úrico, disminución de la hemoglobina, anemia, diátesis hemorrágica, aumento de los monocitos en sangre y leucocitosis.
INTERACCIONES CON LA DROGAS
El ciprofloxacino es un inhibidor del metabolismo mediado por el citocromo humano P450 1A2 (CYP1A2). La administración conjunta de CIPRO con otros medicamentos metabolizados principalmente por CYP1A2 da como resultado un aumento de las concentraciones plasmáticas de estos medicamentos y podría provocar eventos adversos clínicamente significativos del fármaco administrado conjuntamente.
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Reacciones adversas graves incapacitantes y potencialmente irreversibles, incluidas tendinitis y ruptura de tendones, neuropatía periférica y efectos sobre el sistema nervioso central
Las fluoroquinolonas, incluido CIPRO, se han asociado con reacciones adversas graves incapacitantes y potencialmente irreversibles de diferentes sistemas corporales que pueden ocurrir juntas en el mismo paciente. Las reacciones adversas comúnmente observadas incluyen tendinitis, ruptura de tendón, artralgia, mialgia, neuropatía periférica y efectos en el sistema nervioso central (alucinaciones, ansiedad, depresión, insomnio, dolores de cabeza intensos y confusión). Estas reacciones pueden ocurrir dentro de horas o semanas después de iniciar CIPRO. Pacientes de cualquier edad o sin factores de riesgo preexistentes han experimentado estas reacciones adversas [ver ADVERTENCIAS Y PRECAUCIONES ].
Suspender CIPRO 250 mg inmediatamente ante los primeros signos o síntomas de cualquier reacción adversa grave. Además, evite el uso de fluoroquinolonas, incluido CIPRO 500 mg, en pacientes que hayan experimentado alguna de estas reacciones adversas graves asociadas con las fluoroquinolonas.
Tendinitis Y Rotura De Tendón
Las fluoroquinolonas, incluido CIPRO, se han asociado con un mayor riesgo de tendinitis y ruptura del tendón en todas las edades [ver ADVERTENCIAS Y PRECAUCIONES y REACCIONES ADVERSAS ]. Esta reacción adversa afecta con mayor frecuencia al tendón de Aquiles y también se ha informado en el manguito de los rotadores (el hombro), la mano, el bíceps, el pulgar y otros tendones. Puede ocurrir tendinitis o ruptura del tendón, a las pocas horas o días de comenzar con CIPRO 500 mg, o hasta varios meses después de completar la terapia con fluoroquinolonas. La tendinitis y la ruptura del tendón pueden ocurrir bilateralmente.
El riesgo de desarrollar tendinitis asociada con fluoroquinolonas y ruptura de tendones aumenta en pacientes mayores de 60 años, en pacientes que toman corticosteroides y en pacientes con trasplantes de riñón, corazón o pulmón. Otros factores que pueden aumentar de forma independiente el riesgo de ruptura del tendón incluyen la actividad física extenuante, la insuficiencia renal y los trastornos previos de los tendones, como la artritis reumatoide. También se han producido tendinitis y ruptura de tendones en pacientes que toman fluoroquinolonas que no tienen los factores de riesgo anteriores. Suspender CIPRO 250 mg inmediatamente si el paciente experimenta dolor, hinchazón, inflamación o ruptura de un tendón. Evite las fluoroquinolonas, incluido CIPRO 250 mg, en pacientes con antecedentes de trastornos de los tendones o que hayan experimentado tendinitis o ruptura del tendón [ver REACCIONES ADVERSAS ].
Neuropatía periférica
Las fluoroquinolonas, incluido CIPRO, se han asociado con un mayor riesgo de neuropatía periférica. Se han notificado casos de polineuropatía axonal sensitiva o sensitivomotora que afecta axones pequeños y/o grandes que provocan parestesias, hipoestesias, disestesias y debilidad en pacientes que reciben fluoroquinolonas, incluido CIPRO. Los síntomas pueden ocurrir poco después del inicio de CIPRO y pueden ser irreversibles en algunos pacientes [ver ADVERTENCIAS Y PRECAUCIONES y REACCIONES ADVERSAS ].
Interrumpa CIPRO inmediatamente si el paciente experimenta síntomas de neuropatía periférica, incluidos dolor, ardor, hormigueo, entumecimiento y/o debilidad, u otras alteraciones en las sensaciones, incluido el tacto ligero, dolor, temperatura, sentido de posición y sensación vibratoria, y/o fuerza motora en para minimizar el desarrollo de una condición irreversible. Evite las fluoroquinolonas, incluido CIPRO 500 mg, en pacientes que hayan experimentado previamente neuropatía periférica [ver REACCIONES ADVERSAS ].
Efectos del sistema nervioso central
Reacciones adversas psiquiátricas
Las fluoroquinolonas, incluido CIPRO, se han asociado con un mayor riesgo de reacciones adversas psiquiátricas, que incluyen: psicosis tóxica, reacciones psicóticas que progresan a ideas/pensamientos suicidas, alucinaciones o paranoia; depresión o conducta autolesiva, como intento o suicidio consumado; ansiedad, agitación o nerviosismo; confusión, delirio, desorientación o alteraciones de la atención; insomnio o pesadillas; deterioro de la memoria. Estas reacciones pueden ocurrir después de la primera dosis. Aconseje a los pacientes que reciben CIPRO que informen a su proveedor de atención médica de inmediato si ocurren estas reacciones, suspendan el medicamento e instituyan la atención adecuada.
Reacciones adversas del sistema nervioso central
Las fluoroquinolonas, incluido CIPRO 750 mg, se han asociado con un mayor riesgo de ataques (convulsiones), aumento de la presión intracraneal (pscudotumor cerebri), mareos y temblores. Se sabe que CIPRO, al igual que otras fluoroquinolonas, desencadena convulsiones o reduce el umbral de convulsiones. Se han notificado casos de estado epiléptico. Al igual que con todas las fluoroquinolonas, use CIPRO con precaución en pacientes epilépticos y pacientes con trastornos conocidos o sospechados del SNC que puedan predisponer a convulsiones o disminuir el umbral convulsivo (por ejemplo, arteriosclerosis cerebral grave, antecedentes de convulsiones, flujo sanguíneo cerebral reducido, alteración del cerebro). estructura, o accidente cerebrovascular), o en presencia de otros factores de riesgo que pueden predisponer a las convulsiones o disminuir el umbral de convulsiones (por ejemplo, ciertas terapias con medicamentos, disfunción renal). Si ocurren convulsiones, suspenda CIPRO 500 mg e instituya el cuidado adecuado [ver REACCIONES ADVERSAS y INTERACCIONES CON LA DROGAS ].
Exacerbación de la miastenia grave
Las fluoroquinolonas, incluido CIPRO, tienen actividad de bloqueo neuromuscular y pueden exacerbar la debilidad muscular en pacientes con miastenia grave. Las reacciones adversas graves posteriores a la comercialización, incluidas la muerte y la necesidad de soporte ventilatorio, se han asociado con el uso de fluoroquinolonas en pacientes con miastenia grave. Evite CIPRO en pacientes con antecedentes conocidos de miastenia grave [ver REACCIONES ADVERSAS ].
Otras reacciones adversas graves y, en ocasiones, mortales
Se han informado otras reacciones adversas graves ya veces mortales, algunas debidas a hipersensibilidad y otras de etiología incierta, en pacientes que reciben tratamiento con quinolonas, incluido CIPRO. Estos eventos pueden ser graves y generalmente ocurren después de la administración de dosis múltiples. Las manifestaciones clínicas pueden incluir una o más de las siguientes:
- Fiebre, erupción cutánea o reacciones dermatológicas graves (por ejemplo, necrólisis epidérmica tóxica, síndrome de Stevens-Johnson);
- vasculitis; artralgia; mialgia; enfermedad del suero;
- neumonitis alérgica;
- Nefritis intersticial; insuficiencia o falla renal aguda;
- Hepatitis; ictericia; necrosis o insuficiencia hepática aguda;
- Anemia, incluyendo hemolítica y aplásica; trombocitopenia, incluyendo púrpura trombocitopénica trombótica; leucopenia; agranulocitosis; pancitopenia; y/u otras anomalías hematológicas.
Suspender CIPRO 500 mg inmediatamente ante la primera aparición de una erupción cutánea, ictericia o cualquier otro signo de hipersensibilidad y medidas de apoyo instituidas [ver REACCIONES ADVERSAS ].
Reacciones hipersensibles
Se han informado reacciones de hipersensibilidad (anafilácticas) graves y ocasionalmente fatales, algunas después de la primera dosis, en pacientes que reciben terapia con fluoroquinolonas, incluido CIPRO. Algunas reacciones se acompañaron de colapso cardiovascular, pérdida del conocimiento, hormigueo, edema faríngeo o facial, disnea, urticaria y prurito. Sólo unos pocos pacientes tenían antecedentes de reacciones de hipersensibilidad. Las reacciones anafilácticas graves requieren tratamiento de emergencia inmediato con epinefrina y otras medidas de reanimación, que incluyen oxígeno, fluidos intravenosos, antihistamínicos intravenosos, corticosteroides, aminas presoras y manejo de las vías respiratorias, incluida la intubación, según se indique [ver REACCIONES ADVERSAS ].
hepatotoxicidad
Se han informado casos de hepatotoxicidad severa, incluida necrosis hepática, insuficiencia hepática potencialmente mortal y eventos fatales con CIPRO. La lesión hepática aguda tiene un inicio rápido (rango de 1 a 39 días) y a menudo se asocia con hipersensibilidad. El patrón de lesión puede ser hepatocelular, colestásico o mixto. La mayoría de los pacientes con desenlace fatal eran mayores de 55 años. En caso de cualquier signo y síntoma de hepatitis (como anorexia, ictericia, orina oscura, prurito o dolor en el abdomen), interrumpa el tratamiento inmediatamente.
Puede haber un aumento temporal de las transaminasas, fosfatasa alcalina o ictericia colestásica, especialmente en pacientes con daño hepático previo, que son tratados con CIPRO [ver REACCIONES ADVERSAS ].
Riesgo de aneurisma aórtico y disección
Los estudios epidemiológicos informan una mayor tasa de aneurisma aórtico y disección dentro de los dos meses posteriores al uso de fluoroquinolonas, particularmente en pacientes de edad avanzada. No se ha identificado la causa del aumento del riesgo. En pacientes con un aneurisma aórtico conocido o pacientes con mayor riesgo de aneurismas aórticos, reserve CIPRO 750 mg para usar solo cuando no haya tratamientos antibacterianos alternativos disponibles.
Reacciones adversas graves con teofilina concomitante
Se han informado reacciones graves y fatales en pacientes que recibieron la administración simultánea de CIPRO 250 mg y teofilina. Estas reacciones han incluido paro cardíaco, convulsiones, estado epiléptico e insuficiencia respiratoria. También se han producido casos de náuseas, vómitos, temblores, irritabilidad o palpitaciones.
Aunque se informaron reacciones adversas graves similares en pacientes que recibieron teofilina sola, no se puede descartar la posibilidad de que estas reacciones puedan ser potenciadas por CIPRO. Si no se puede evitar el uso concomitante, controle los niveles séricos de teofilina y ajuste la dosis según corresponda [ver INTERACCIONES CON LA DROGAS ].
Diarrea asociada a Clostridioides difficile
Se ha informado diarrea asociada a Clostridioides difficile (C. difficile) (CDAD) con el uso de casi todos los agentes antibacterianos, incluido CIPRO, y puede variar en gravedad desde diarrea leve hasta colitis fatal. El tratamiento con agentes antibacterianos altera la flora normal del colon y conduce al crecimiento excesivo de C. difficile.
C. difficile produce toxinas A y B que contribuyen al desarrollo de CDAD. Los aislamientos de C. difficile que producen hipertoxina causan una mayor morbilidad y mortalidad, ya que estas infecciones pueden ser refractarias a la terapia antimicrobiana y pueden requerir colectomía. Se debe considerar CDAD en todos los pacientes que presenten diarrea después del uso de antibacterianos. Es necesaria una cuidadosa historia clínica ya que se ha informado que la CDAD ocurre más de dos meses después de la administración de agentes antibacterianos.
Si se sospecha o se confirma CDAD, es posible que se deba suspender el uso continuo de antibacterianos no dirigidos contra C. difficile. Manejo adecuado de líquidos y electrolitos, suplementos de proteínas, tratamiento antibacteriano de C. difficile e institución de evaluación quirúrgica según esté clínicamente indicado [ver REACCIONES ADVERSAS ].
Prolongación del intervalo QT
Algunas fluoroquinolonas, incluido CIPRO 750 mg, se han asociado con prolongación del intervalo QT en el electrocardiograma y casos de arritmia. Se informaron casos de torsade de pointes durante la vigilancia posterior a la comercialización en pacientes que recibieron fluoroquinolonas, incluido CIPRO.
Evite CIPRO 1000 mg en pacientes con prolongación conocida del intervalo QT, factores de riesgo de prolongación del intervalo QT o torsade de pointes (por ejemplo, síndrome de QT prolongado congénito, desequilibrio electrolítico no corregido, como hipopotasemia o hipomagnesemia y enfermedad cardíaca, como insuficiencia cardíaca, infarto de miocardio). infarto o bradicardia), y pacientes que reciben agentes antiarrítmicos de Clase IA (quinidina, procainamida) o agentes antiarrítmicos de Clase III (amiodarona, sotalol), antidepresivos tricíclicos, macrólidos y antipsicóticos. Los pacientes de edad avanzada también pueden ser más susceptibles a los efectos asociados con los medicamentos en el intervalo QT [ver REACCIONES ADVERSAS , Uso en poblaciones específicas ].
Trastornos musculoesqueléticos en pacientes pediátricos y efectos artropáticos en animales
CIPRO 250 mg está indicado en pacientes pediátricos (menores de 18 años) solo para ITUc, prevención del ántrax por inhalación (postexposición) y peste [ver INDICACIONES Y USO ]. Se ha observado una mayor incidencia de reacciones adversas en comparación con los controles, incluidas las reacciones relacionadas con las articulaciones y/o los tejidos circundantes [ver REACCIONES ADVERSAS ].
En estudios preclínicos, la administración oral de CIPRO provocó cojera en perros inmaduros. El examen histopatológico de las articulaciones que soportan peso de estos perros reveló lesiones permanentes del cartílago. Los fármacos relacionados de la clase de las quinolonas también producen erosiones del cartílago de las articulaciones que soportan peso y otros signos de artropatía en animales inmaduros de varias especies [ver Uso en poblaciones específicas y Toxicología no clínica ].
Fotosensibilidad/Fototoxicidad
Reacciones de fotosensibilidad/fototoxicidad de moderadas a graves, la última de las cuales puede manifestarse como reacciones exageradas de quemadura solar (por ejemplo, quemazón, eritema, exudación, vesículas, ampollas, edema) que involucran áreas expuestas a la luz (típicamente la cara, el área “V” de la cuello, superficies extensoras de los antebrazos, dorso de las manos), pueden asociarse con el uso de quinolonas, incluido CIPRO, después de la exposición al sol o a la luz ultravioleta. Por lo tanto, evite la exposición excesiva a estas fuentes de luz. Descontinuar CIPRO 250 mg si ocurre fototoxicidad [ver REACCIONES ADVERSAS ].
Desarrollo de bacterias resistentes a los medicamentos
Prescribir tabletas de 250 mg de CIPRO y suspensión oral de CIPRO en ausencia de una infección bacteriana comprobada o fuertemente sospechada o una indicación profiláctica es poco probable que brinde beneficios al paciente y aumente el riesgo de desarrollo de bacterias resistentes a los medicamentos.
Riesgos potenciales con el uso concomitante de fármacos metabolizados por enzimas del citocromo P450 1A2
CIPRO 750 mg es un inhibidor de la vía enzimática hepática CYP1A2. La coadministración de CIPRO y otros fármacos metabolizados principalmente por CYP1A2 (por ejemplo, teofilina, metilxantinas, cafeína, tizanidina, ropinirol, clozapina, olanzapina y zolpidem), provoca un aumento de las concentraciones plasmáticas del fármaco coadministrado y podría provocar efectos clínicamente significativos. reacciones adversas farmacodinámicas del fármaco coadministrado [ver INTERACCIONES CON LA DROGAS y FARMACOLOGÍA CLÍNICA ].
Interferencia con el diagnóstico oportuno de sífilis
No se ha demostrado que CIPRO 1000 mg sea eficaz en el tratamiento de la sífilis. Los agentes antimicrobianos que se usan en dosis altas durante períodos cortos para tratar la gonorrea pueden enmascarar o retrasar los síntomas de la sífilis en incubación. Realizar una prueba serológica para sífilis en todos los pacientes con gonorrea al momento del diagnóstico. Realizar prueba serológica de seguimiento para sífilis tres meses después del tratamiento con CIPRO.
cristaluria
Se han observado cristales de ciprofloxacina en raras ocasiones en la orina de sujetos humanos, pero con más frecuencia en la orina de animales de laboratorio, que suele ser alcalina [ver Toxicología no clínica ]. La cristaluria relacionada con CIPRO se ha informado solo en raras ocasiones en humanos porque la orina humana suele ser ácida. Evite la alcalinidad de la orina en pacientes que reciben CIPRO. Hidratar bien a los pacientes para evitar la formación de orina muy concentrada [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Alteraciones de la glucosa en sangre
Las fluoroquinolonas, incluido CIPRO, se han asociado con alteraciones de la glucosa en sangre, incluidas hiperglucemia e hipoglucemia sintomáticas, generalmente en pacientes diabéticos que reciben tratamiento concomitante con un agente hipoglucemiante oral (por ejemplo, glibenclamida) o con insulina. En estos pacientes, se recomienda un control cuidadoso de la glucosa en sangre. Se han informado casos graves de hipoglucemia que resultaron en coma o muerte. Si ocurre una reacción hipoglucémica en un paciente tratado con CIPRO, suspenda CIPRO 750 mg e inicie la terapia adecuada de inmediato [ver REACCIONES ADVERSAS , INTERACCIONES CON LA DROGAS ].
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( Guía de medicamentos )
Reacciones adversas graves
Aconseje a los pacientes que dejen de tomar CIPRO 250 mg si experimentan una reacción adversa y que llamen a su proveedor de atención médica para recibir asesoramiento sobre cómo completar el tratamiento completo con otro medicamento antibacteriano.
Informe a los pacientes sobre las siguientes reacciones adversas graves que se han asociado con el uso de CIPRO u otras fluoroquinolonas:
- Reacciones adversas graves incapacitantes y potencialmente irreversibles que pueden ocurrir juntas: Informe a los pacientes que las reacciones adversas graves incapacitantes y potencialmente irreversibles, que incluyen tendinitis y ruptura de tendones, neuropatías periféricas y efectos en el sistema nervioso central, se han asociado con el uso de CIPRO 1000 mg y pueden ocurrir juntas en el mismo paciente. Informe a los pacientes que dejen de tomar CIPRO inmediatamente si experimentan una reacción adversa y que llamen a su proveedor de atención médica.
- Tendinitis y rotura de tendones: Indique a los pacientes que se comuniquen con su proveedor de atención médica si experimentan dolor, hinchazón o inflamación de un tendón, o debilidad o incapacidad para usar una de sus articulaciones; descansar y abstenerse de hacer ejercicio; y suspenda el tratamiento con CIPRO 750 mg. Los síntomas pueden ser irreversibles. El riesgo de trastorno grave de los tendones con fluoroquinolonas es mayor en pacientes mayores, generalmente mayores de 60 años, en pacientes que toman corticosteroides y en pacientes con trasplantes de riñón, corazón o pulmón.
- Neuropatías periféricas: Informe a los pacientes que se han asociado neuropatías periféricas con el uso de ciprofloxacina, los síntomas pueden ocurrir poco después del inicio de la terapia y pueden ser irreversibles. Si se desarrollan síntomas de neuropatía periférica que incluyen dolor, ardor, hormigueo, entumecimiento y/o debilidad, interrumpa inmediatamente CIPRO y dígale que se comunique con su médico.
- Efectos del sistema nervioso central (por ejemplo, convulsiones, mareos, aturdimiento, aumento de la presión intracraneal): informe a los pacientes que se han informado convulsiones en pacientes que reciben fluoroquinolonas, incluida la ciprofloxacina. Indique a los pacientes que notifiquen a su médico antes de tomar este medicamento si tienen antecedentes de convulsiones. Informe a los pacientes que deben saber cómo reaccionan a CIPRO antes de operar un automóvil o maquinaria o participar en otras actividades que requieran agilidad mental y coordinación. Indique a los pacientes que notifiquen a su médico si se produce un dolor de cabeza persistente con o sin visión borrosa.
- Exacerbación de la miastenia grave: Indique a los pacientes que informen a su médico sobre cualquier antecedente de miastenia gravis. Indique a los pacientes que notifiquen a su médico si experimentan algún síntoma de debilidad muscular, incluidas las dificultades respiratorias.
- Reacciones hipersensibles: Informe a los pacientes que la ciprofloxacina puede causar reacciones de hipersensibilidad, incluso después de una dosis única, y que suspenda el medicamento ante el primer signo de erupción cutánea, urticaria u otras reacciones cutáneas, latidos cardíacos rápidos, dificultad para tragar o respirar, cualquier hinchazón que sugiera angioedema ( por ejemplo, hinchazón de labios, lengua, cara, opresión en la garganta, ronquera) u otros síntomas de una reacción alérgica.
- Hepatotoxicidad: Informe a los pacientes que se ha informado hepatotoxicidad grave (que incluye hepatitis aguda y eventos fatales) en pacientes que toman CIPRO. Indique a los pacientes que informen a su médico si experimentan signos o síntomas de daño hepático, incluidos: pérdida de apetito, náuseas, vómitos, fiebre, debilidad, cansancio, sensibilidad en el cuadrante superior derecho, picazón, piel y ojos amarillentos, heces de color claro. u orina de color oscuro.
- Aneurisma aórtico y disección: Informe a los pacientes que busquen atención médica de emergencia si experimentan dolor repentino en el pecho, el estómago o la espalda.
- Diarrea: La diarrea es un problema común causado por los antibióticos que generalmente termina cuando se suspende el antibiótico. A veces, después de comenzar el tratamiento con antibióticos, los pacientes pueden desarrollar heces acuosas y sanguinolentas (con o sin calambres estomacales y fiebre) incluso dos o más meses después de haber tomado la última dosis del antibiótico. Si esto ocurre, indique a los pacientes que se comuniquen con su médico lo antes posible.
- Prolongación del Intervalo QT: Indique a los pacientes que informen a su médico sobre cualquier antecedente personal o familiar de prolongación del intervalo QT o condiciones proarrítmicas como hipopotasemia, bradicardia o isquemia miocárdica reciente; si están tomando cualquier agente antiarrítmico de Clase IA (quinidina, procainamida) o Clase III (amiodarona, sotalol). Indique a los pacientes que notifiquen a su médico si tienen algún síntoma de prolongación del intervalo QT, incluidas palpitaciones cardíacas prolongadas o pérdida del conocimiento.
- Trastornos musculoesqueléticos en pacientes pediátricos: Indique a los padres que informen al médico de su hijo si el niño tiene antecedentes de problemas relacionados con las articulaciones antes de tomar este medicamento. Informe a los padres de pacientes pediátricos que notifiquen al médico de su hijo sobre cualquier problema relacionado con las articulaciones que ocurra durante o después de la terapia con cipro 1000 mg de floxacina [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
- Tizanidina: Indique a los pacientes que no usen cipro 250 mg de floxacina si ya están tomando tizanidina. CIPRO aumenta los efectos de la tizanidina (Zanaflex®).
- Teofilina: Informe a los pacientes que cipro 250 mg floxacina CIPRO 1000 mg puede aumentar los efectos de la teofilina. Se pueden producir efectos en el SNC y arritmias que ponen en peligro la vida. Aconseje a los pacientes que busquen ayuda médica de inmediato si experimentan convulsiones, palpitaciones o dificultad para respirar.
- Cafeína: Informe a los pacientes que CIPRO 500 mg puede aumentar los efectos de la cafeína. Existe la posibilidad de acumulación de cafeína cuando se consumen productos que contienen cafeína mientras se toman quinolonas.
- Fotosensibilidad/Fototoxicidad: Informe a los pacientes que se ha notificado fotosensibilidad/fototoxicidad en pacientes que reciben fluoroquinolonas. Informar a los pacientes para minimizar o evitar la exposición a la luz solar natural o artificial (camas de bronceado o tratamiento UVA/B) mientras toman quinolonas. Si los pacientes necesitan estar al aire libre mientras usan quinolonas, indíqueles que usen ropa holgada que proteja la piel de la exposición al sol y hable con su médico sobre otras medidas de protección solar. Si se produce una reacción similar a una quemadura de sol o una erupción en la piel, indique a los pacientes que se comuniquen con su médico.
- Alteraciones de la glucosa en sangre: Informe a los pacientes que si son diabéticos y están siendo tratados con insulina o un agente hipoglucemiante oral y ocurre una reacción hipoglucémica, deben suspender CIPRO 250 mg y consultar a un médico.
- Lactancia: Para indicaciones distintas al ántrax por inhalación (después de la exposición), informe a la mujer que no se recomienda amamantar durante el tratamiento con Cipro y durante 2 días adicionales después de la última dosis. Alternativamente, una mujer puede bombear y desechar durante el tratamiento y durante 2 días adicionales después de la última dosis [ver Uso en poblaciones específicas ].
Resistencia antibacteriana
Informe a los pacientes que los medicamentos antibacterianos, incluidos los comprimidos de 250 mg de CIPRO y la suspensión oral de 1000 mg de CIPRO, solo deben usarse para tratar infecciones bacterianas. No tratan infecciones virales (por ejemplo, el resfriado común). Cuando se recetan tabletas de CIPRO de 500 mg y suspensión oral de CIPRO de 500 mg para tratar una infección bacteriana, se debe informar a los pacientes que, aunque es común sentirse mejor al principio del tratamiento, el medicamento debe tomarse exactamente como se indica. Omitir dosis o no completar el curso completo de la terapia puede (1) disminuir la eficacia del tratamiento inmediato y (2) aumentar la probabilidad de que las bacterias desarrollen resistencia y no sean tratables con CIPRO 500 mg Tabletas y CIPRO 250 mg Suspensión oral u otro antibacteriano. drogas en el futuro.
Instrucciones de administración
Instruir al paciente
- Agitar vigorosamente la Suspensión Oral CIPRO cada vez antes de usar durante aproximadamente 15 segundos.
- Usar siempre la cuchara dosificadora graduada empaquetada con marcas para ½ (2.5 mL) y 1/1 (5 mL), para obtener la dosis exacta.
- Después de su uso, la cuchara medidora graduada debe limpiarse con agua corriente con detergente para platos y secarse completamente.
- No masticar las microcápsulas, sino tragarlas enteras.
- Esa agua se puede tomar después.
- Vuelva a cerrar la botella correctamente después de cada uso de acuerdo con las instrucciones en la tapa.
- Una vez finalizado el tratamiento, la suspensión oral de 1000 mg de CIPRO no debe reutilizarse.
Informe a los pacientes que CIPRO 250 mg puede tomarse con o sin alimentos.
Indique a los pacientes que beban abundantes líquidos mientras toman CIPRO para evitar la formación de orina altamente concentrada y la formación de cristales en la orina.
Informe a los pacientes que los antiácidos que contienen magnesio o aluminio, así como sucralfato, cationes metálicos como el hierro y las preparaciones multivitamínicas con zinc o didanosina deben tomarse al menos dos horas antes o seis horas después de la administración de 1000 mg de CIPRO. CIPRO no debe tomarse solo con productos lácteos (como leche o yogur) o jugos fortificados con calcio, ya que la absorción de ciprofloxacina puede reducirse significativamente; sin embargo, CIPRO 500 mg puede tomarse con una comida que contenga estos productos.
Aconseje a los pacientes que si se olvidan una dosis, deben tomarla en cualquier momento pero a más tardar 6 horas antes de la siguiente dosis programada. Si quedan menos de 6 horas antes de la siguiente dosis, no se debe tomar la dosis olvidada y se debe continuar el tratamiento según lo prescrito con la siguiente dosis programada. No se deben tomar dosis dobles para compensar la dosis olvidada.
Indique a los pacientes que las tabletas de CIPRO de 500 mg (250 mg y 500 mg) están ranuradas y se pueden dividir por la mitad en la línea ranurada para proporcionar una concentración de 125 mg o 250 mg, respectivamente.
Interacciones medicamentosas Agentes antidiabéticos orales
Informar a los pacientes que se ha notificado hipoglucemia cuando se coadministraron 250 mg de floxacina de cipro y agentes antidiabéticos orales; si se produce un nivel bajo de azúcar en la sangre con CIPRO 750 mg, indíqueles que consulten a su médico y que es posible que sea necesario cambiar su medicamento antibacteriano.
Estudios de ántrax y peste
Informe a los pacientes que recibieron CIPRO para estas afecciones que no se pudieron realizar estudios de eficacia en humanos por razones de factibilidad. Por lo tanto, la aprobación de estas condiciones se basó en estudios de eficacia realizados en animales.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Se han realizado ocho pruebas de mutagenicidad in vitro con cipro 500 mg de floxacina, y los resultados de las pruebas se enumeran a continuación:
- Prueba de Salmonella/Microsome (Negativa)
- Ensayo de reparación de ADN de E. coli (negativo)
- Ensayo de mutación directa de células de linfoma de ratón (positivo)
- Prueba HGPRT de células V79 de hámster chino (negativa)
- Ensayo de transformación de células embrionarias de hámster sirio (negativo)
- Ensayo de mutación puntual de Saccharomyces cerevisiae (negativo)
- Saccharomyces cerevisiae Cruce mitótico y ensayo de conversión de genes (negativo)
- Ensayo de reparación de ADN de hepatocitos de rata (positivo)
Por lo tanto, 2 de las 8 pruebas fueron positivas, pero los resultados de los siguientes 3 sistemas de prueba in vivo dieron resultados negativos:
- Ensayo de reparación de ADN de hepatocitos de rata
- Prueba de micronúcleos (ratones)
- Prueba letal dominante (ratones)
Los estudios de carcinogenicidad a largo plazo en ratas y ratones no mostraron efectos carcinogénicos ni tumorigénicos debido a 500 mg de floxacina de cipro a dosis orales diarias de hasta 250 mg/kg y 750 mg/kg en ratas y ratones, respectivamente (aproximadamente 1,7 y 2,5 veces la dosis terapéutica más alta recomendada según el área de superficie corporal, respectivamente).
Los resultados de las pruebas de fotococarcinogenicidad indican que cipro 1000 mg de floxacina no reduce el tiempo de aparición de tumores de piel inducidos por UV en comparación con el control del vehículo. Se expuso a ratones sin pelo (Skh-1) a la luz UVA durante 3,5 horas cinco veces cada dos semanas durante un máximo de 78 semanas mientras se les administraba ciprofloxacina al mismo tiempo. El tiempo hasta el desarrollo de los primeros tumores de piel fue de 50 semanas en ratones tratados concomitantemente con UVA y cipro 1000 mg de floxacina (dosis en ratones aproximadamente igual a la dosis máxima recomendada en humanos según el área de superficie corporal), en comparación con las 34 semanas cuando los animales fueron tratados con ambos rayos UVA. y vehículo Los tiempos de desarrollo de los tumores de piel oscilaron entre 16 semanas y 32 semanas en ratones tratados concomitantemente con UVA y otras quinolonas.5
En este modelo, los ratones tratados con ciprofloxacino solo no desarrollaron tumores cutáneos o sistémicos. No hay datos de modelos similares que utilicen ratones pigmentados y/o ratones con pelo completo. Se desconoce el significado clínico de estos hallazgos para los humanos.
Los estudios de fertilidad realizados en ratas macho y hembra con dosis orales de 250 mg de floxacino de cipro de hasta 100 mg/kg (aproximadamente 0,6 veces la dosis oral terapéutica más alta recomendada según el área de superficie corporal) no revelaron evidencia de deterioro. Las ratas macho recibieron ciprofloxacina oral durante 10 semanas antes del apareamiento y las hembras recibieron dosis durante 3 semanas antes del apareamiento hasta el día 7 de gestación.
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
La experiencia prolongada con cipro 1000 mgfloxacino en mujeres embarazadas durante varias décadas, según la información publicada disponible de informes de casos, estudios de casos y controles y estudios observacionales sobre cipro 1000 mgfloxacino administrado durante el embarazo, no ha identificado ningún riesgo asociado con el fármaco de defectos congénitos importantes, aborto espontáneo o reacciones adversas. resultados maternos o fetales (ver Datos ). La administración oral de cipro 500 mgfloxacino durante la organogénesis en dosis de hasta 100 mg/kg a ratones y ratas preñadas y de hasta 30 mg/kg a conejas preñadas no causó malformaciones fetales (ver Datos ). Estas dosis fueron de hasta 0,3, 0,6 y 0,4 veces la dosis oral clínica máxima recomendada en ratones, ratas y conejos, respectivamente, según el área de superficie corporal. Se desconoce el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo para la población indicada. Todos los embarazos tienen un riesgo de fondo de defecto congénito, pérdida u otros resultados adversos. En la población general de los EE. UU., los riesgos básicos estimados de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos son del 2 al 4 % y del 15 al 20 %, respectivamente.
Datos
Datos humanos
Si bien los estudios disponibles no pueden establecer definitivamente la ausencia de riesgo, los datos publicados de estudios observacionales prospectivos durante varias décadas no han establecido una asociación con el uso de 250 mg de floxacina de cipro durante el embarazo y defectos congénitos importantes, aborto espontáneo o resultados maternos o fetales adversos. Los estudios disponibles tienen limitaciones metodológicas, incluido el pequeño tamaño de la muestra y algunos de ellos no son específicos para la ciprofloxacina. Un estudio observacional prospectivo controlado siguió a 200 mujeres expuestas a fluoroquinolonas (52,5 % expuestas a cipro 250 mg de floxacina y 68 % expuestas en el primer trimestre) durante la gestación. La exposición intrauterina a las fluoroquinolonas durante la embriogénesis no se asoció con un mayor riesgo de malformaciones importantes. Las tasas notificadas de malformaciones congénitas importantes fueron del 2,2 % para el grupo de fluoroquinolonas y del 2,6 % para el grupo de control (la incidencia de antecedentes de malformaciones importantes es del 1 al 5 %). Las tasas de abortos espontáneos, prematuridad y bajo peso al nacer no difirieron entre los grupos y no hubo disfunciones musculoesqueléticas clínicamente significativas hasta el año de edad en los niños expuestos a cipro 500 mg de floxacina.
Otro estudio de seguimiento prospectivo informó sobre 549 embarazos con exposición a fluoroquinolonas (93% exposiciones en el primer trimestre). Hubo 70 exposiciones a cipro 500 mg de floxacina, todas dentro del primer trimestre. Las tasas de malformación entre los bebés nacidos vivos expuestos a cipro 750 mg de floxacina ya las fluoroquinolonas en general estuvieron dentro de los rangos de incidencia de fondo. No se encontraron patrones específicos de anomalías congénitas. El estudio no reveló ninguna reacción adversa clara debido a la exposición intrauterina a la ciprofloxacina.
No se observaron diferencias en las tasas de prematuridad, abortos espontáneos o peso al nacer en mujeres expuestas a ciprofloxacino durante el embarazo. Sin embargo, estos pequeños estudios epidemiológicos posteriores a la comercialización, de los cuales la mayor parte de la experiencia proviene de la exposición a corto plazo en el primer trimestre, son insuficientes para evaluar el riesgo de defectos menos comunes o para permitir conclusiones confiables y definitivas con respecto a la seguridad de la ciprofloxacina en mujeres embarazadas y sus fetos en desarrollo. .
Datos de animales
Se han realizado estudios de toxicología del desarrollo con cipro 500 mg de floxacina en ratas, ratones y conejos. En ratas y ratones, las dosis orales de hasta 100 mg/kg administradas durante la organogénesis (días de gestación, GD, 6-17) no se asociaron con resultados de desarrollo adversos, como toxicidad embriofetal o malformaciones. En ratas y ratones, una dosis de 100 mg/kg es aproximadamente 0,6 y 0,3 veces la dosis oral diaria máxima en humanos (1500 mg/día) según el área de superficie corporal, respectivamente. En una serie de estudios de toxicología del desarrollo en conejos, recibió 250 mg de floxacino por vía oral o intravenosa durante uno de los siguientes períodos de 5 días: GD 6 a 10, GD 10 a 14 o GD 14 a 18, destinados a cubrir el período de organogénesis. Este fue un intento de mitigar la intolerancia gastrointestinal observada en conejos que reciben antibacterianos que se manifiesta por un consumo reducido de alimento materno y pérdida de peso, que puede conducir a la reabsorción embriofetal o al aborto espontáneo. Una dosis oral de cipro 750 mg de floxacina de 100 mg/kg (aproximadamente 1,3 veces la dosis oral clínica más alta recomendada según el área de superficie corporal) provocó una toxicidad materna excesiva que confundió la evaluación de los fetos. Una dosis oral de 30 mg/kg (aproximadamente 0,4 veces la dosis oral clínica más alta recomendada) se asoció con la supresión del aumento de peso corporal materno y fetal, pero no se observaron malformaciones fetales. La administración intravenosa de dosis de hasta 20 mg/kg (aproximadamente 0,3 veces la dosis oral clínica más alta recomendada según el área de superficie corporal) a conejas preñadas no fue tóxica para la madre y no se observó toxicidad embriofetal ni malformaciones fetales.
En estudios perinatales y posnatales, las ratas recibieron dosis de cipro de 1000 mg de floxacina de hasta 200 mg/kg/día (oral) o de hasta 30 mg/kg/día (subcutánea) desde el día 16 hasta el 22 después del parto. La dosis de 200 mg/kg es aproximadamente 1,3 veces la dosis oral clínica máxima recomendada en función del área de superficie corporal. No se observaron toxicidad materna ni efectos adversos sobre el crecimiento y desarrollo de las crías, incluyendo ningún signo de artropatía en las articulaciones de las patas traseras de las crías. Se ha demostrado que la ciprofloxacina y otras quinolonas causan artropatía en animales inmaduros de la mayoría de las especies analizadas cuando se administran directamente [ver ADVERTENCIAS Y PRECAUCIONES y Toxicología no clínica ].
Lactancia
Resumen de riesgos
La literatura publicada informa que cipro 1000mgfloxacin está presente en la leche humana después de la administración intravenosa y oral. No hay información sobre los efectos de CIPRO en la producción de leche o en el lactante. Debido al riesgo potencial de reacciones adversas graves en lactantes, incluida la artropatía mostrada en estudios con animales jóvenes [ver Uso en poblaciones específicas (Consideraciones clínicas)], para la mayoría de las indicaciones, una mujer lactante puede considerar extraer y desechar la leche materna durante el tratamiento con CIPRO 500 mg y dos días adicionales (cinco vidas medias) después de la última dosis. Alternativamente, avise a la mujer que no se recomienda amamantar durante el tratamiento con CIPRO y durante dos días adicionales (cinco vidas medias) después de la última dosis.
Sin embargo, para la inhalación de ántrax (después de la exposición), durante un incidente que resulte en exposición al ántrax, la evaluación de riesgo-beneficio de continuar amamantando mientras la madre (y potencialmente el bebé) está(n) en CIPRO puede ser aceptable [ver DOSIFICACIÓN Y ADMINISTRACIÓN , Uso pediátrico , y Estudios clínicos ]. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de CIPRO de la madre y cualquier posible efecto adverso en el niño amamantado de CIPRO 1000 mg o de la afección materna subyacente.
Consideraciones clínicas
Cipro 1000mgfloxacino puede causar alteración de la flora intestinal del lactante. Aconseje a una mujer que vigile al bebé amamantado en busca de heces sueltas o con sangre y candidiasis (candidiasis bucal, dermatitis del pañal).
Uso pediátrico
Aunque efectivo en ensayos clínicos, CIPRO 750 mg no es un fármaco de primera elección en la población pediátrica debido a una mayor incidencia de reacciones adversas en comparación con los controles. Las quinolonas, incluido CIPRO, causan artropatía (artralgia, artritis) en animales jóvenes [ver ADVERTENCIAS Y PRECAUCIONES y Toxicología no clínica ].
Infección complicada del tracto urinario y pielonefritis
CIPRO 250 mg está indicado para el tratamiento de ITUc y pielonefritis por Escherichia coli en pacientes pediátricos de 1 a 17 años de edad. Aunque es eficaz en los ensayos clínicos, CIPRO 500 mg no es un fármaco de primera elección en la población pediátrica debido a una mayor incidencia de reacciones adversas en comparación con los controles, incluidos los eventos relacionados con las articulaciones y/o los tejidos circundantes [ver REACCIONES ADVERSAS y Estudios clínicos ].
Ántrax por inhalación (posterior a la exposición)
CIPRO 750 mg está indicado en pacientes pediátricos desde el nacimiento hasta los 17 años de edad, para el carbunco por inhalación (post-exposición). La evaluación de riesgo-beneficio indica que la administración de ciprofloxacino a pacientes pediátricos es apropiada [ver DOSIFICACIÓN Y ADMINISTRACIÓN y Estudios clínicos ].
Plaga
CIPRO 500 mg está indicado en pacientes pediátricos desde el nacimiento hasta los 17 años de edad, para el tratamiento de la peste, incluida la peste neumónica y septicémica debida a Yersinia pestis (Y. pestis) y la profilaxis de la peste. No se pudieron realizar estudios de eficacia de CIPRO en humanos con peste neumónica por razones de viabilidad. Por lo tanto, la aprobación de esta indicación se basó en un estudio de eficacia realizado en animales. La evaluación de riesgo-beneficio indica que la administración de CIPRO a pacientes pediátricos es apropiada [ver INDICACIONES Y USO , DOSIFICACIÓN Y ADMINISTRACIÓN y Estudios clínicos ].
Uso geriátrico
Los pacientes geriátricos tienen un mayor riesgo de desarrollar trastornos graves de los tendones, incluida la ruptura del tendón, cuando reciben tratamiento con una fluoroquinolona como CIPRO. Este riesgo aumenta aún más en pacientes que reciben tratamiento concomitante con corticosteroides. La tendinitis o ruptura del tendón puede afectar el tendón de Aquiles, la mano, el hombro u otros sitios del tendón y puede ocurrir durante o después de completar la terapia; Se han informado casos que ocurrieron hasta varios meses después del tratamiento con fluoroquinolonas. Se debe tener precaución al prescribir CIPRO 500 mg a pacientes de edad avanzada, especialmente a aquellos que toman corticosteroides. Se debe informar a los pacientes sobre esta posible reacción adversa y aconsejarles que suspendan CIPRO 500 mg y se comuniquen con su proveedor de atención médica si se presentan síntomas de tendinitis o ruptura del tendón [ver ADVERTENCIA EN CAJA , ADVERTENCIAS Y PRECAUCIONES , y REACCIONES ADVERSAS ].
Los estudios epidemiológicos informan un aumento en la tasa de aneurisma aórtico y disección dentro de los dos meses posteriores al uso de fluoroquinolonas, particularmente en pacientes de edad avanzada [ver ADVERTENCIAS Y PRECAUCIONES ].
En un análisis retrospectivo de 23 ensayos clínicos controlados de dosis múltiples de CIPRO que abarcaron más de 3500 pacientes tratados con ciprofloxacina, el 25 % de los pacientes tenían 65 años o más y el 10 % tenían 75 años o más. No se observaron diferencias generales en la seguridad o la eficacia entre estos sujetos y los sujetos más jóvenes, y otra experiencia clínica notificada no ha identificado diferencias en las respuestas entre los pacientes de edad avanzada y los más jóvenes, pero no se puede descartar una mayor sensibilidad de algunas personas de edad avanzada con cualquier tratamiento farmacológico. Se sabe que el ciprofloxacino se excreta sustancialmente por vía renal, y el riesgo de reacciones adversas puede ser mayor en pacientes con insuficiencia renal. No es necesario modificar la dosis para pacientes mayores de 65 años con función renal normal. Sin embargo, dado que algunas personas mayores experimentan una reducción de la función renal debido a su avanzada edad, se debe tener cuidado al seleccionar la dosis para pacientes de edad avanzada, y la monitorización de la función renal puede ser útil en estos pacientes [ver DOSIFICACIÓN Y ADMINISTRACIÓN y FARMACOLOGÍA CLÍNICA ].
En general, los pacientes de edad avanzada pueden ser más susceptibles a los efectos asociados al fármaco en el intervalo QT. Por lo tanto, se debe tener precaución cuando se usa CIPRO 500 mg con medicamentos concomitantes que pueden resultar en la prolongación del intervalo QT (por ejemplo, antiarrítmicos de clase IA o clase III) o en pacientes con factores de riesgo de torsade de pointes (por ejemplo, prolongación QT conocida). , hipopotasemia no corregida) [ver ADVERTENCIAS Y PRECAUCIONES ].
Insuficiencia renal
Cipro 500 mgfloxacino se elimina principalmente por excreción renal; sin embargo, el fármaco también se metaboliza y elimina parcialmente a través del sistema biliar del hígado y del intestino. Estas vías alternativas de eliminación del fármaco parecen compensar la excreción renal reducida en pacientes con insuficiencia renal. No obstante, se recomienda alguna modificación de la dosis, particularmente para pacientes con disfunción renal severa [ver DOSIFICACIÓN Y ADMINISTRACIÓN y FARMACOLOGÍA CLÍNICA ].
Deterioro hepático
En estudios preliminares en pacientes con cirrosis hepática crónica estable, no se observaron cambios significativos en la farmacocinética de ciprofloxacino. No se ha estudiado la farmacocinética de cipro 500 mg de floxacino en pacientes con insuficiencia hepática aguda.
SOBREDOSIS
En caso de sobredosis aguda, se ha informado toxicidad renal reversible en algunos casos. Vacíe el estómago induciendo el vómito o mediante lavado gástrico. Observe atentamente al paciente y administre un tratamiento de apoyo, incluida la monitorización de la función renal, el pH urinario y la acidificación, si es necesario, para prevenir la cristaluria y la administración de antiácidos que contengan magnesio, aluminio o calcio que pueden reducir la absorción de cipro 750 mgfloxacino. Se debe mantener una hidratación adecuada. Solo una pequeña cantidad de cipro 250mgfloxacin (menos del 10%) se elimina del cuerpo después de la hemodiálisis o la diálisis peritoneal.
CONTRAINDICACIONES
Hipersensibilidad
CIPRO 1000 mg está contraindicado en personas con antecedentes de hipersensibilidad a cipro 750 mg floxacina, cualquier miembro de la clase de antibacterianos de las quinolonas o cualquiera de los componentes del producto [ver ADVERTENCIAS Y PRECAUCIONES ].
tizanidina
Está contraindicada la administración concomitante con tizanidina [ver INTERACCIONES CON LA DROGAS ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
El ciprofloxacino es un miembro de la clase de fluoroquinolonas de agentes antibacterianos [ver Microbiología ].
Farmacocinética
Absorción
La biodisponibilidad absoluta de cipro 500 mg de floxacina cuando se administra como comprimido oral es de aproximadamente el 70 % sin pérdida sustancial por metabolismo de primer paso. Las concentraciones séricas máximas de ciprofloxacino (Cmax) y el área bajo la curva (AUC) se muestran en el gráfico para el rango de dosis de 250 mg a 1000 mg (Tabla 12).
Las concentraciones séricas máximas se alcanzan de 1 a 2 horas después de la administración oral. Las concentraciones medias 12 horas después de la dosificación con 250, 500 o 750 mg son 0,1, 0,2 y 0,4 mcg/mL, respectivamente. La vida media de eliminación sérica en sujetos con función renal normal es de aproximadamente 4 horas. Las concentraciones séricas aumentan proporcionalmente con dosis de hasta 1000 mg.
Se ha demostrado que una dosis oral de 500 mg administrada cada 12 horas produce un AUC equivalente al producido por una infusión intravenosa de 400 mg de CIPRO 1000 mg administrada durante 60 minutos cada 12 horas. Se ha demostrado que una dosis oral de 750 mg administrada cada 12 horas produce un AUC en el estado estacionario equivalente al producido por una infusión intravenosa de 400 mg administrada durante 60 minutos cada 8 horas. Una dosis oral de 750 mg da como resultado una Cmax similar a la observada con una dosis intravenosa de 400 mg (Tabla 13). Una dosis oral de 250 mg administrada cada 12 horas produce un AUC equivalente al producido por una infusión de 200 mg de CIPRO 1000 mg administrada cada 12 horas.
Alimento
Cuando CIPRO Tablet se administra concomitantemente con alimentos, hay un retraso en la absorción del fármaco, lo que resulta en concentraciones máximas que ocurren más cerca de 2 horas después de la dosificación en lugar de 1 hora, mientras que no se observa retraso cuando CIPRO 750 mg Suspensión se administra con alimentos. . Sin embargo, la absorción general de CIPRO 1000 mg Tablet o CIPRO 500 mg Suspensión no se ve sustancialmente afectada. La farmacocinética de cipro 750 mg de floxacina administrada como suspensión tampoco se ve afectada por los alimentos. Evite la administración concomitante de CIPRO con productos lácteos (como leche o yogur) o jugos fortificados con calcio solo, ya que es posible que disminuya la absorción; sin embargo, CIPRO 1000 mg puede tomarse con una comida que contenga estos productos
Con la administración oral, una dosis de 500 mg, administrada como 10 mL de la Suspensión CIPRO al 5 % (que contiene 250 mg de ciprofloxacina/5 mL) es bioequivalente a la tableta de 500 mg. Un volumen de 10 ml de la suspensión de 1000 mg de CIPRO al 5 % (que contiene 250 mg de ciprofloxacina/5 ml) es bioequivalente a un volumen de 5 ml de la suspensión de 750 mg de CIPRO al 10 % (que contiene 500 mg de cipro 1000 mg de floxacina/5 ml).
Distribución
La unión de ciprofloxacino a las proteínas séricas es del 20% al 40%, lo que probablemente no sea lo suficientemente alto como para causar interacciones significativas de unión a proteínas con otros medicamentos.
Después de la administración oral, cipro 250 mgfloxacino se distribuye ampliamente por todo el cuerpo. Las concentraciones tisulares a menudo exceden las concentraciones séricas tanto en hombres como en mujeres, particularmente en el tejido genital, incluida la próstata. El ciprofloxacino está presente en forma activa en la saliva, las secreciones nasales y bronquiales, la mucosa de los senos paranasales, el esputo, el líquido de las ampollas cutáneas, la linfa, el líquido peritoneal, la bilis y las secreciones prostáticas. Cipro 500mgfloxacin también se ha detectado en pulmón, piel, grasa, músculo, cartílago y hueso. El fármaco se difunde en el líquido cefalorraquídeo (LCR); sin embargo, las concentraciones en LCR son generalmente menos del 10% de las concentraciones séricas máximas. Se han detectado niveles bajos de la droga en los humores acuoso y vítreo del ojo.
Metabolismo
Se han identificado cuatro metabolitos en la orina humana que juntos representan aproximadamente el 15% de una dosis oral. Los metabolitos tienen actividad antimicrobiana, pero son menos activos que el cipro 500 mg de floxacina sin modificar. Cipro 500 mg de floxacina es un inhibidor del metabolismo mediado por el citocromo humano P450 1A2 (CYP1A2). La coadministración de ciprofloxacino con otros fármacos metabolizados principalmente por CYP1A2 da como resultado un aumento de las concentraciones plasmáticas de estos fármacos y podría dar lugar a eventos adversos clínicamente significativos del fármaco coadministrado [ver CONTRAINDICACIONES , ADVERTENCIAS Y PRECAUCIONES , y INTERACCIONES CON LA DROGAS ].
Excreción
La vida media de eliminación sérica en sujetos con función renal normal es de aproximadamente 4 horas. Aproximadamente del 40 al 50% de una dosis administrada por vía oral se excreta en la orina como fármaco inalterado. Después de una dosis oral de 250 mg, las concentraciones en orina de 500 mg de floxacina de cipro generalmente superan los 200 mcg/mL durante las primeras dos horas y son de aproximadamente 30 mcg/mL entre 8 y 12 horas después de la dosificación. La excreción urinaria de ciprofloxacino es virtualmente completa dentro de las 24 horas posteriores a la dosificación. El aclaramiento renal de cipro 250 mgfloxacino, que es de aproximadamente 300 ml/minuto, supera la tasa de filtración glomerular normal de 120 ml/minuto. Por lo tanto, la secreción tubular activa parecería desempeñar un papel importante en su eliminación. La coadministración de probenecid con ciprofloxacino da como resultado una reducción de alrededor del 50 % en el aclaramiento renal de ciprofloxacino y un aumento del 50 % en su concentración en la circulación sistémica.
Aunque las concentraciones biliares de cipro 250 mgfloxacina son varias veces más altas que las concentraciones séricas después de la dosificación oral, solo una pequeña cantidad de la dosis administrada se recupera de la bilis como fármaco inalterado. Un 1% a 2% adicional de la dosis se recupera de la bilis en forma de metabolitos. Aproximadamente del 20% al 35% de una dosis oral se recupera de las heces dentro de los 5 días posteriores a la administración. Esto puede surgir del aclaramiento biliar o de la eliminación transintestinal.
Poblaciones Específicas
Anciano
Los estudios farmacocinéticos de las formas oral (dosis única) e intravenosa (dosis única y múltiple) de cipro 250 mgfloxacina indican que las concentraciones plasmáticas de ciprofloxacina son más altas en sujetos de edad avanzada (mayores de 65 años) en comparación con adultos jóvenes. Aunque la Cmax aumenta entre un 16 % y un 40 %, el aumento en el AUC medio es de aproximadamente un 30 % y puede atribuirse, al menos parcialmente, a la disminución del aclaramiento renal en los ancianos. La vida media de eliminación se prolonga solo ligeramente (~20%) en los ancianos. Estas diferencias no se consideran clínicamente significativas [ver Uso en poblaciones específicas ].
Insuficiencia renal
En pacientes con función renal reducida, la vida media de ciprofloxacino se prolonga ligeramente. Es posible que se requieran ajustes de dosis [ver Uso en poblaciones específicas y DOSIFICACIÓN Y ADMINISTRACIÓN ].
Deterioro hepático
En estudios preliminares en pacientes con cirrosis hepática crónica estable, no se observaron cambios significativos en la farmacocinética de ciprofloxacino. La cinética de cipro 750mgfloxacino en pacientes con insuficiencia hepática aguda, no ha sido completamente estudiada.
Pediatría
La Tabla 14 resume los parámetros farmacocinéticos en pacientes pediátricos de menos de 1 a menos de 12 años que reciben tratamiento intravenoso.
Estos valores están dentro del rango informado para adultos en dosis terapéuticas. Según el análisis farmacocinético poblacional de pacientes pediátricos con diversas infecciones, la semivida media prevista en niños es de aproximadamente 4 a 5 horas, y la biodisponibilidad de la suspensión oral es de aproximadamente el 60 %.
Interacciones fármaco-fármaco
antiácidos
La administración concomitante de antiácidos que contienen hidróxido de magnesio o hidróxido de aluminio puede reducir la biodisponibilidad de cipro 500 mgfloxacina hasta en un 90% [ver DOSIFICACIÓN Y ADMINISTRACIÓN y INTERACCIONES CON LA DROGAS ].
Antagonistas del receptor H2 de histamina
Los antagonistas de los receptores H2 de histamina no parecen tener un efecto significativo sobre la biodisponibilidad de 250 mg de cipro floxacina.
metronidazol
Las concentraciones séricas de ciprofloxacina y metronidazol no se alteraron cuando estos dos fármacos se administraron de forma concomitante.
tizanidina
En un estudio farmacocinético, la exposición sistémica de tizanidina (dosis única de 4 mg) aumentó significativamente (Cmax 7 veces, AUC 10 veces) cuando el fármaco se administró concomitantemente con CIPRO (500 mg dos veces al día durante 3 días). La administración concomitante de tizanidina y CIPRO está contraindicada debido a la potenciación de los efectos hipotensores y sedantes de la tizanidina [ver CONTRAINDICACIONES ].
ropinirol
En un estudio realizado en 12 pacientes con enfermedad de Parkinson a los que se les administró 6 mg de ropinirol una vez al día con 500 mg de CIPRO 250 mg dos veces al día, la Cmax media y el AUC medio de ropinirol aumentaron un 60 % y un 84 %, respectivamente. Se recomienda monitorear las reacciones adversas relacionadas con ropinirol y ajustar la dosis apropiada de ropinirol durante y poco después de la coadministración con CIPRO [ver ADVERTENCIAS Y PRECAUCIONES ].
clozapina
Luego de la administración concomitante de 250 mg de CIPRO 500 mg con 304 mg de clozapina durante 7 días, las concentraciones séricas de clozapina y N-desmetilclozapina aumentaron en un 29 % y un 31 %, respectivamente. Se recomienda un control cuidadoso de las reacciones adversas asociadas a la clozapina y un ajuste adecuado de la dosis de clozapina durante y poco tiempo después de la coadministración con CIPRO.
sildenafilo
Luego de la administración concomitante de una dosis oral única de 50 mg de sildenafil con 500 mg de CIPRO 1000 mg a sujetos sanos, la Cmax media y el AUC media de sildenafil aumentaron aproximadamente al doble. Use sildenafilo con precaución cuando se administre conjuntamente con CIPRO 500 mg debido al aumento esperado del doble en la exposición de sildenafilo con la administración conjunta de CIPRO.
Duloxetina
En estudios clínicos se demostró que el uso concomitante de duloxetina con inhibidores potentes de la isoenzima CYP450 1A2, como la fluvoxamina, puede resultar en un aumento de 5 veces en el AUC medio y un aumento de 2,5 veces en la Cmax media de duloxetina.
lidocaína
En un estudio realizado en 9 voluntarios sanos, el uso concomitante de 1,5 mg/kg de lidocaína IV con 500 mg de CIPRO dos veces al día resultó en un aumento de la Cmax y el AUC de la lidocaína en un 12 % y un 26 %, respectivamente. Aunque el tratamiento con lidocaína fue bien tolerado con esta exposición elevada, puede ocurrir una posible interacción con CIPRO y un aumento de las reacciones adversas relacionadas con la lidocaína con la administración concomitante.
metoclopramida
La metoclopramida acelera significativamente la absorción de 750 mg de floxacina de cipro oral, lo que reduce el tiempo para alcanzar las concentraciones plasmáticas máximas. No se observó ningún efecto significativo sobre la biodisponibilidad de ciprofloxacino.
omeprazol
Cuando CIPRO se administró en una dosis única de 1000 mg junto con omeprazol (40 mg una vez al día durante tres días) a 18 voluntarios sanos, el AUC y la Cmax medias de ciprofloxacino se redujeron en un 20 % y un 23 %, respectivamente. No se ha determinado la importancia clínica de esta interacción.
Microbiología
Mecanismo de acción
La acción bactericida de cipro 750mgfloxacino resulta de la inhibición de las enzimas topoisomerasa II (ADN girasa) y topoisomerasa IV (ambas topoisomerasas Tipo II), que son necesarias para la replicación, transcripción, reparación y recombinación del ADN bacteriano.
mecanismo de resistencia
El mecanismo de acción de las fluoroquinolonas, incluida la ciprofloxacina, es diferente al de las penicilinas, cefalosporinas, aminoglucósidos, macrólidos y tetraciclinas; por lo tanto, los microorganismos resistentes a estas clases de fármacos pueden ser susceptibles a la ciprofloxacina. La resistencia a las fluoroquinolonas se produce principalmente por mutaciones en las girasas del ADN, disminución de la permeabilidad de la membrana externa o salida del fármaco. La resistencia in vitro a la ciprofloxacina se desarrolla lentamente por mutaciones en múltiples pasos. La resistencia a ciprofloxacino debido a mutaciones espontáneas ocurre con una frecuencia general de entre
Resistencia cruzada
No se conoce resistencia cruzada entre cipro 1000mgfloxacin y otras clases de antimicrobianos.
Se ha demostrado que la ciprofloxacina es activa contra la mayoría de los aislados de las siguientes bacterias, tanto in vitro como en infecciones clínicas [ver INDICACIONES Y USO ].
bacterias grampositivas
Bacillus anthracis Enterococcus faecalis Staphylococcus aureus (solo aislados sensibles a la meticilina) Staphylococcus epidermidis (solo aislados sensibles a la meticilina) Staphylococcus saprophyticus Streptococcus pneumoniae Streptococcus pyogenes
Bacterias Gram-negativo
Campylobacter jejuni Citrobacter koseri Citrobacter freundii Enterobacter cloacae Escherichia coli Haemophilus influenza Haemophilus parainfluenzae Klebsiella pneumonia Moraxella catarrhalis Morganella morganii Neisseria gonorrhoeae Proteus mirabilis Proteus vulgaris Providencia rettgeri Providencia stuartii Pseudomonas aeruginosa Salmonella typhi Serratia marcescens Shigella boydii Shigella dysenteriae Shigella flexneri Shigella sonnei Yersinia pestis
Los siguientes datos in vitro están disponibles, pero se desconoce su importancia clínica. Al menos el 90 por ciento de las siguientes bacterias exhiben una concentración inhibitoria mínima (MIC) in vitro menor o igual al punto de corte susceptible para cipro 750 mg de floxacina contra aislados de género o grupo de organismos similares. Sin embargo, la eficacia de cipro 500mgfloxacin en el tratamiento de infecciones clínicas causadas por estas bacterias no se ha establecido en ensayos clínicos adecuados y bien controlados.
bacterias grampositivas
Staphylococcus haemolyticus (solo aislados sensibles a la meticilina) Staphylococcus hominis (solo aislados sensibles a la meticilina)
Bacterias Gram-negativo
Acinetobacter lwoffi Aeromonas hydrophila Edwardsiella tarda Enterobacter aerogenes Klebsiella oxytoca Legionella pneumophila Pasteurella multocida Salmonella enteritidis Vibrio cholera Vibrio parahaemolyticus Vibrio vulnificus Yersinia enterocolitica
Pruebas de susceptibilidad
Para obtener información específica sobre los criterios interpretativos de las pruebas de susceptibilidad y los métodos de prueba asociados y los estándares de control de calidad reconocidos por la FDA para este medicamento, consulte: https://www.fda.gov/STIC.
Estudios clínicos
Infección complicada del tracto urinario y pielonefritis: eficacia en pacientes pediátricos
CIPRO administrado por vía intravenosa y/u oral se comparó con una cefalosporina para el tratamiento de ITUc y pielonefritis en pacientes pediátricos de 1 a 17 años de edad (edad media de 6 ± 4 años). El ensayo se llevó a cabo en EE. UU., Canadá, Argentina, Perú, Costa Rica, México, Sudáfrica y Alemania. La duración del tratamiento fue de 10 a 21 días (la duración media del tratamiento fue de 11 días con un rango de 1 a 88 días). El objetivo principal del estudio fue evaluar la seguridad musculoesquelética y neurológica.
Se evaluó a los pacientes en cuanto al éxito clínico y la erradicación bacteriológica de los organismos de referencia sin infección nueva o superinfección entre 5 y 9 días después de la terapia (Prueba de curación o TOC). La población según el protocolo tenía uno o más organismos causales con recuentos de colonias especificados en el protocolo al inicio del estudio, sin violación del protocolo y sin interrupción prematura o pérdida durante el seguimiento (entre otros criterios).
Las tasas de éxito clínico y de erradicación bacteriológica en la población según el protocolo fueron similares entre CIPRO 250 mg y el grupo de comparación, como se muestra a continuación.
Ántrax por inhalación en adultos y niños
Las concentraciones séricas medias de ciprofloxacina asociadas con una mejora estadísticamente significativa en la supervivencia en el modelo de mono rhesus de ántrax por inhalación se alcanzan o superan en pacientes adultos y pediátricos que reciben regímenes orales e intravenosos. La farmacocinética de Cipro 500 mg de floxacina se ha evaluado en varias poblaciones humanas. La concentración sérica máxima media alcanzada en el estado estacionario en adultos humanos que reciben 500 mg por vía oral cada 12 horas es de 2,97 mcg/ml y de 4,56 mcg/ml después de 400 mg por vía intravenosa cada 12 horas. La concentración sérica mínima media en el estado estacionario para ambos regímenes es de 0,2 mcg/mL. En un estudio de 10 pacientes pediátricos de entre 6 y 16 años de edad, la concentración plasmática máxima media alcanzada es de 8,3 mcg/mL y las concentraciones mínimas varían de 0,09 mcg/mL a 0,26 mcg/mL, luego de dos infusiones intravenosas de 30 minutos de 10 mg/kg administrados con 12 horas de diferencia. Después de la segunda infusión intravenosa, los pacientes cambiaron a 15 mg/kg por vía oral cada 12 horas y alcanzaron una concentración máxima media de 3,6 mcg/ml después de la dosis oral inicial. Los datos de seguridad a largo plazo, incluidos los efectos sobre el cartílago, después de la administración de CIPRO a pacientes pediátricos son limitados. Las concentraciones séricas de 1000 mg de floxacina de Cipro alcanzadas en humanos sirven como criterio de valoración sustituto con una probabilidad razonable de predecir el beneficio clínico y proporcionan la base para esta indicación.1
Se realizó un estudio en animales controlado con placebo en monos rhesus expuestos a una dosis media inhalada de 11 LD50 (~5,5 x 105 esporas (rango 5-30 LD50) de B. anthracis. La concentración inhibitoria mínima (MIC) de cipro 250 mg de floxacina para la cepa de ántrax utilizada en este estudio fue de 0,08 mcg/ml En los animales estudiados, las concentraciones séricas medias de cipro 1000 mg de floxacina alcanzadas en el Tmáx esperado (1 hora después de la dosis) después de la dosificación oral hasta el estado estacionario oscilaron entre 0,98 mcg/ml y 1,69 mcg/mL Las concentraciones mínimas medias en estado estacionario a las 12 horas posteriores a la dosis variaron de 0,12 mcg/mL a 0,19 mcg/mL. - la exposición fue significativamente menor (1/9), en comparación con el grupo placebo (9/10) [p= 0,001] El único animal tratado con CIPRO que murió de ántrax lo hizo después del período de administración del fármaco de 30 días.7
Se recomendó a más de 9300 personas que completaran un mínimo de 60 días de profilaxis antibacteriana contra una posible exposición por inhalación a B. anthracis durante 2001. A la mayoría de esas personas se les recomendó 250 mg de CIPRO para todo o parte del régimen de profilaxis. Algunas personas también recibieron la vacuna contra el ántrax o cambiaron a medicamentos antibacterianos alternativos. Ninguno de los que recibieron CIPRO 1000 mg u otras terapias como tratamiento profiláctico posteriormente desarrolló ántrax por inhalación. Se desconoce el número de personas que recibieron CIPRO como todo o parte de su régimen de profilaxis posterior a la exposición.
Plaga
Se realizó un estudio en animales controlado con placebo en monos verdes africanos expuestos a una dosis media inhalada de 110 LD50 (rango de 92 a 127 LD50) de Yersinia pestis (cepa CO92). La concentración inhibitoria mínima (MIC) de ciprofloxacina para la cepa de Y. pestis utilizada en este estudio fue de 0,015 mcg/mL. Las concentraciones séricas máximas medias de ciprofloxacina alcanzadas al final de una única infusión de 60 minutos fueron 3,49 ± mcg/ml, 0,55 mcg/ml, 3,91 mcg/ml ± 0,58 mcg/ml y 4,03 mcg/ml ± 1,22 mcg/ml el día 2. Día 6 y Día 10 de tratamiento en monos verdes africanos, respectivamente Todas las concentraciones mínimas (Día 2, Día 6 y Día 10) fueron
Toxicología Animal Y/o Farmacología
Se ha demostrado que Cipro 250 mg de floxacina y otras quinolonas causan artropatía en animales inmaduros de la mayoría de las especies analizadas [ver ADVERTENCIAS Y PRECAUCIONES ]. Se observaron daños en las articulaciones que soportan peso en perros y ratas jóvenes. En beagles jóvenes, 100 mg/kg de ciprofloxacina, administrados diariamente durante 4 semanas, provocó cambios articulares degenerativos en la articulación de la rodilla. A 30 mg/kg, el efecto sobre la articulación fue mínimo. En un estudio posterior en perros beagle jóvenes, dosis orales de cipro 750 mgfloxacino de 30 mg/kg y 90 mg/kg de cipro 750 mgfloxacino (aproximadamente 1,3 veces y 3,5 veces la dosis pediátrica según las AUC plasmáticas comparativas) administradas diariamente durante 2 semanas causaron dolor articular. cambios que aún se observaban por histopatología después de un período sin tratamiento de 5 meses. A 10 mg/kg (aproximadamente 0,6 veces la dosis pediátrica según las AUC plasmáticas comparativas), no se observaron efectos en las articulaciones. Esta dosis tampoco se asoció con artrotoxicidad después de un período adicional sin tratamiento de 5 meses. En otro estudio, la eliminación de la carga de peso de la articulación redujo las lesiones pero no las evitó por completo.
La cristaluria, a veces asociada con nefropatía secundaria, ocurre en animales de laboratorio que reciben dosis de ciprofloxacina. Esto se relaciona principalmente con la solubilidad reducida de la ciprofloxacina en condiciones alcalinas, que predominan en la orina de los animales de prueba; en el hombre, la cristaluria es rara ya que la orina humana suele ser ácida. En monos rhesus, se observó cristaluria sin nefropatía después de dosis orales únicas tan bajas como 5 mg/kg. (aproximadamente 0,07 veces la dosis terapéutica más alta recomendada según el área de superficie corporal). Después de 6 meses de dosificación intravenosa de 10 mg/kg/día, no se observaron cambios nefropatológicos; sin embargo, se observó nefropatía después de una dosis de 20 mg/kg/día durante la misma duración (aproximadamente 0,2 veces la dosis terapéutica más alta recomendada según el área de superficie corporal).
En perros, la ciprofloxacina a dosis de 3 mg/kg y 10 mg/kg por vía intravenosa rápida (15 segundos) produce efectos hipotensores pronunciados. Se considera que estos efectos están relacionados con la liberación de histamina, ya que son parcialmente antagonizados por la pirilamina, un antihistamínico. En monos rhesus, la inyección intravenosa rápida también produce hipotensión, pero el efecto en esta especie es inconsistente y menos pronunciado.
En ratones, se ha informado que la administración concomitante de fármacos antiinflamatorios no esteroideos como fenilbutazona e indometacina con quinolonas aumenta el efecto estimulador del SNC de las quinolonas.
La toxicidad ocular observada con algunos medicamentos relacionados no se ha observado en animales tratados con ciprofloxacino
REFERENCIAS
1. 21 CFR 314.510 (Subparte H: Aprobación acelerada de nuevos medicamentos para enfermedades potencialmente mortales).
5. Informe presentado en la reunión del Comité asesor de medicamentos antiinfecciosos y medicamentos dermatológicos de la FDA, 31 de marzo de 1993, Silver Spring, MD. Informe disponible de FDA, CDER, Advisors and Consultants Staff, HFD-21, 1901 Chapman Avenue, Room 200, Rockville, MD 20852, EE. UU.
6. Kelly DJ, et al. Concentraciones séricas de penicilina, doxiciclina y ciprofloxacina durante la terapia prolongada en monos rhesus. J Infect Dis 1992; 166:1184-7.
7. Friedlander AM, et al. Profilaxis posterior a la exposición contra el ántrax por inhalación experimental. J Infect Dis 1993; 167:1239-42.
8. Reunión del Comité Asesor de Medicamentos Antiinfecciosos, 3 de abril de 2012: la eficacia de la ciprofloxacina para el tratamiento de la peste neumónica.
INFORMACIÓN DEL PACIENTE
CIPRO® (Sip-row) (clorhidrato de ciprofloxacina) comprimidos, para uso oral
CIPRO® (Sip-row) (cipro 1000mgfloxacin) para suspensión oral
Lea esta Guía del medicamento antes de comenzar a tomar CIPRO 500 mg y cada vez que renueve su receta. Es posible que haya nueva información. Esta información no reemplaza la conversación con su proveedor de atención médica sobre su condición médica o su tratamiento.
¿Cuál es la información más importante que debo saber sobre CIPRO 500mg?
CIPRO, un medicamento antibacteriano de fluoroquinolona, puede causar efectos secundarios graves. Algunos de estos efectos secundarios graves pueden ocurrir al mismo tiempo y provocar la muerte.
Si experimenta alguno de los siguientes efectos secundarios graves mientras toma CIPRO, debe dejar de tomar CIPRO 750 mg de inmediato y obtener ayuda médica de inmediato.
1. Rotura de tendón o hinchazón del tendón (tendinitis).
- Los problemas de los tendones pueden ocurrir en personas de todas las edades que toman CIPRO. Los tendones son cordones resistentes de tejido que conectan los músculos a los huesos. Los síntomas de los problemas de los tendones pueden incluir:
- dolor
- hinchazón
- desgarros e hinchazón de los tendones, incluida la parte posterior del tobillo (Aquiles), el hombro, la mano, el pulgar u otros sitios tendinosos.
- El riesgo de tener problemas en los tendones mientras toma CIPRO es mayor si:
- son mayores de 60 años
- está tomando esteroides (corticosteroides)
- ha tenido un trasplante de riñón, corazón o pulmón.
- Los problemas de los tendones pueden ocurrir en personas que no tienen los factores de riesgo anteriores cuando toman CIPRO.
- Otras razones que pueden aumentar el riesgo de problemas en los tendones pueden incluir:
- actividad física o ejercicio
- insuficiencia renal
- problemas de tendones en el pasado, como en personas con artritis reumatoide (AR).
- Deje de tomar CIPRO inmediatamente y obtenga ayuda médica de inmediato ante el primer signo de dolor, hinchazón o inflamación del tendón. El área más común de dolor e inflamación es el tendón de Aquiles en la parte posterior del tobillo. Esto también puede ocurrir con otros tendones.
- La ruptura del tendón puede ocurrir mientras toma o después de haber terminado de tomar CIPRO. Las rupturas de tendones pueden ocurrir horas o días después de tomar CIPRO y han ocurrido hasta varios meses después de que las personas terminaron de tomar su fluoroquinolona.
- Deje de tomar CIPRO 500 mg inmediatamente y obtenga ayuda médica de inmediato si presenta alguno de los siguientes signos o síntomas de ruptura de un tendón:
- escuchar o sentir un chasquido o estallido en el área de un tendón
- hematomas justo después de una lesión en el área de un tendón
- incapaz de mover el área afectada o soportar peso
Los problemas de los tendones pueden ser permanentes.
2. Cambios en la sensibilidad y posible daño a los nervios (neuropatía periférica). Las personas que toman fluoroquinolonas, incluido CIPRO, pueden sufrir daños en los nervios de los brazos, las manos, las piernas o los pies. Deje de tomar CIPRO 750 mg de inmediato y hable con su proveedor de atención médica de inmediato si presenta alguno de los siguientes síntomas de neuropatía periférica en los brazos, las manos, las piernas o los pies:
- dolor
- entumecimiento
- incendio
- debilidad
- hormigueo
Es posible que deba suspenderse CIPRO 500 mg para evitar daños permanentes en los nervios.
3. Efectos sobre el Sistema Nervioso Central (SNC). Se han informado problemas de salud mental y convulsiones en personas que toman medicamentos antibacterianos con fluoroquinolonas, incluido CIPRO. Informe a su proveedor de atención médica si tiene antecedentes de convulsiones antes de comenzar a tomar CIPRO. Los efectos secundarios del SNC pueden ocurrir tan pronto como después de tomar la primera dosis de CIPRO. Deje de tomar CIPRO de inmediato y hable con su proveedor de atención médica de inmediato si experimenta alguno de estos efectos secundarios u otros cambios en el estado de ánimo o el comportamiento:
- convulsiones
- problemas para dormir
- escuchar voces, ver cosas o sentir cosas que no existen (alucinaciones)
- pesadillas
- sentirse aturdido o mareado
- sentirse agitado
- sentirse más sospechoso (paranoia)
- temblores
- pensamientos o actos suicidas
- sentirse ansioso o nervioso
- dolores de cabeza que no desaparecen, con o sin
- confusión visión borrosa
- depresión
- problemas de memoria
- reducción de la conciencia del entorno
- pensamientos o creencias falsas o extrañas (delirios)
Estos cambios pueden ser permanentes.
4. Empeoramiento de la miastenia gravis (un problema que causa debilidad muscular). Las fluoroquinolonas como CIPRO 500 mg pueden empeorar los síntomas de la miastenia grave, como debilidad muscular y problemas respiratorios. Informe a su proveedor de atención médica si tiene antecedentes de miastenia grave antes de comenzar a tomar CIPRO. Llame a su proveedor de atención médica de inmediato si tiene un empeoramiento de la debilidad muscular o problemas respiratorios.
¿Qué es CIPRO 750 mg?
CIPRO es un medicamento antibacteriano de fluoroquinolona que se usa en adultos mayores de 18 años para tratar ciertas infecciones causadas por ciertos gérmenes llamados bacterias. Estas infecciones bacterianas incluyen:
-
- infección del tracto urinario
- infección de huesos y articulaciones
- gonorrea cervical y uretral, sin complicaciones
- infeccion cronica de prostata
- neumonía nosocomial
- personas con un recuento bajo de glóbulos blancos y fiebre
- infección del tracto respiratorio inferior
- infección intraabdominal complicada
- ántrax por inhalación
- Infección sinusal
- diarrea infecciosa
- Plaga
- infección en la piel
- fiebre tifoidea (entérica)
- Los estudios de CIPRO 1000 mg para su uso en el tratamiento de la peste y el ántrax se realizaron solo en animales, porque la peste y el ántrax no se pudieron estudiar en personas.
- CIPRO 250 mg no debe usarse en personas con exacerbación aguda de bronquitis crónica, cistitis aguda no complicada e infecciones de los senos paranasales, si hay otras opciones de tratamiento disponibles.
- CIPRO 750 mg no debe usarse como primera opción de medicamento antibacteriano para tratar infecciones del tracto respiratorio inferior causadas por cierto tipo de bacteria llamada Streptococcus pneumoniae.
- CIPRO 1000mg también se usa en niños menores de 18 años para tratar infecciones complicadas del tracto urinario y los riñones o que pueden haber inhalado gérmenes de ántrax, tener peste o haber estado expuestos a gérmenes de peste.
- Los niños menores de 18 años tienen una mayor probabilidad de tener problemas en los huesos, las articulaciones o los tendones (musculoesqueléticos), como dolor o hinchazón, mientras toman CIPRO. CIPRO 500 mg no debe usarse como primera opción de medicamento antibacteriano en niños menores de 18 años.
¿Quién no debe tomar CIPRO 1000mg?
No tome CIPRO 500 mg si usted:
- alguna vez ha tenido una reacción alérgica grave a un medicamento antibacteriano conocido como fluoroquinolona, o es alérgico al clorhidrato de 500 mg de floxacina de cipro o a cualquiera de los ingredientes de CIPRO. Consulte el final de esta Guía del medicamento para obtener una lista completa de los ingredientes de CIPRO.
- también tome un medicamento llamado tizanidina (Zanaflex®). Pregúntele a su proveedor de atención médica si no está seguro.
¿Qué debo decirle a mi proveedor de atención médica antes de tomar CIPRO?
Antes de tomar CIPRO, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si:
- tiene problemas en los tendones. CIPRO no debe usarse en personas que tienen antecedentes de problemas en los tendones.
- tiene una enfermedad que causa debilidad muscular (miastenia gravis). CIPRO no debe usarse en personas que tienen un historial conocido de miastenia grave.
- tiene problemas hepáticos.
- tiene problemas del sistema nervioso central (como la epilepsia).
- tiene problemas nerviosos. CIPRO 500 mg no debe usarse en personas que tienen antecedentes de un problema nervioso llamado neuropatía periférica o alguien en su familia tiene latidos cardíacos irregulares o ataques cardíacos, especialmente una condición llamada "prolongación del intervalo QT".
- tiene niveles bajos de potasio en la sangre (hipocalemia) o niveles bajos de magnesio (hipomagnesemia).
- tiene o ha tenido convulsiones.
- tiene problemas renales. Es posible que necesite una dosis más baja de CIPRO 500 mg si sus riñones no funcionan bien.
- tiene diabetes o problemas con niveles bajos de azúcar en la sangre (hipoglucemia).
- tiene problemas en las articulaciones, incluida la artritis reumatoide (AR).
- tiene problemas para tragar pastillas.
- está embarazada o planea quedar embarazada. No se sabe si CIPRO 250mg dañará a su bebé nonato.
- están amamantando o planean amamantar. CIPRO 250 mg pasa a la leche materna.
- No debe amamantar durante el tratamiento con CIPRO 500 mg y durante 2 días después de tomar su última dosis de CIPRO. Puede extraerse la leche materna y desecharla durante el tratamiento con CIPRO y durante 2 días después de tomar su última dosis de CIPRO.
- Si está tomando CIPRO para el ántrax por inhalación, usted y su proveedor de atención médica deben decidir si puede continuar amamantando mientras toma CIPRO.
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos a base de hierbas.
- CIPRO 1000mg y otros medicamentos pueden afectarse entre sí y causar efectos secundarios.
- Informe especialmente a su proveedor de atención médica si toma:
- un medicamento esteroide.
- un medicamento antipsicótico.
- un antidepresivo tricíclico.
- una pastilla de agua (diurético).
- teofilina (como Theo-24®, Elixophyllin®, Theochron®, Uniphyl®, Theolair®).
- un medicamento para controlar la frecuencia o el ritmo cardíaco (antiarrítmicos).
- un medicamento oral contra la diabetes.
- fenitoína (Fosphenytoin Sodium®, Cerebyx®, Dilantin-125®, Dilantin®, Extended Phenytoin Sodium®, Prompt Phenytoin Sodium®, Phenytek®).
- ciclosporina (Gengraf®, Neoral®, Sandimmune®, Sangcya®).
- un anticoagulante (como warfarina, Coumadin®, Jantoven®).
- metotrexato (Trexall®).
- ropinirol (Requip®).
- clozapina (Clozaril®, Fazaclo® ODT®).
- un fármaco antiinflamatorio no esteroideo (AINE). Muchos medicamentos comunes para aliviar el dolor son los AINE. Tomar un AINE mientras toma CIPRO 500 mg u otras fluoroquinolonas puede aumentar su riesgo de sufrir efectos en el sistema nervioso central y convulsiones.
- sildenafilo (Viagra®, Revatio®).
- duloxetina.
- productos que contienen cafeína.
- probenecid (Probalan®, Col-probenecid®).
- Ciertos medicamentos pueden impedir que las tabletas CIPRO y la suspensión oral CIPRO funcionen correctamente. Tome las tabletas y la suspensión oral de CIPRO 2 horas antes o 6 horas después de tomar estos medicamentos, vitaminas o suplementos:
- un antiácido, multivitamínico u otro medicamento o suplemento que contenga magnesio, calcio, aluminio, hierro o zinc.
- sucralfato (Carafate®).
- didanosina (Videx®, Videx EC®).
Pídale a su proveedor de atención médica una lista de estos medicamentos si no está seguro.
Conozca los medicamentos que toma. Mantenga una lista de ellos para mostrársela a su proveedor de atención médica y farmacéutico cuando obtenga un nuevo medicamento.
¿Cómo debo tomar CIPRO 500mg?
- Tome CIPRO exactamente como se lo indique su proveedor de atención médica.
- Su proveedor de atención médica le dirá cuánto CIPRO debe tomar y cuándo tomarlo.
- CIPRO se puede tomar con o sin alimentos.
- CIPRO no debe tomarse solo con productos lácteos (como leche o yogur) o jugos fortificados con calcio, pero puede tomarse con una comida que contenga estos productos.
- Beba muchos líquidos mientras toma CIPRO.
- No omita ninguna dosis de CIPRO ni deje de tomarla, incluso si comienza a sentirse mejor, hasta que termine el tratamiento recetado, a menos que:
- Tienes problemas en los tendones. Ver “¿Cuál es la información más importante que debo saber sobre CIPRO?”
- Tienes problemas de nervios. Ver “¿Cuál es la información más importante que debo saber sobre CIPRO?”
- usted tiene problemas del sistema nervioso central. Ver “¿Cuál es la información más importante que debo saber sobre CIPRO 1000mg?”
- tiene una reacción alérgica grave. Ver “¿Cuáles son los posibles efectos secundarios de CIPRO 750 mg?”
- su proveedor de atención médica le indica que deje de tomar CIPRO.
Tomar todas sus dosis de CIPRO ayudará a asegurarse de que se eliminen todas las bacterias. Tomar todas sus dosis de CIPRO ayudará a reducir la posibilidad de que las bacterias se vuelvan resistentes a CIPRO. Si se vuelve resistente a CIPRO, es posible que CIPRO 1000 mg y otros medicamentos antibacterianos no le funcionen en el futuro.
-
Si toma demasiado CIPRO 750 mg, llame a su proveedor de atención médica u obtenga ayuda médica de inmediato.
-
CIPRO se suministra en forma de comprimido ranurado (CIPRO 1000 mg comprimidos), suspensión oral (CIPRO 750 mg suspensión oral), comprimido de liberación prolongada (CIPRO XR) e inyección para infusión intravenosa (CIPRO IV). Lea y siga las instrucciones a continuación para el tipo de CIPRO de 500 mg que su proveedor de atención médica le recetó.
Tabletas CIPRO:
- Las tabletas CIPRO vienen en tabletas ranuradas de 250 mg y 500 mg que se pueden tomar enteras o se pueden partir por la mitad en la línea ranurada. Su proveedor de atención médica le indicará la cantidad de tabletas de CIPRO de 500 mg que debe tomar y si deberá dividir las tabletas de CIPRO de 1000 mg a la mitad para obtener la dosis recetada.
- Tome las tabletas de CIPRO por la mañana y por la noche aproximadamente a la misma hora todos los días. No triture ni mastique la tableta. Informe a su proveedor de atención médica si no puede tragar la tableta.
- Si olvida una dosis de CIPRO 500 mg comprimidos y es:
- 6 horas o más hasta su próxima dosis programada, tome la dosis que olvidó de inmediato. Luego tome la siguiente dosis a la hora habitual.
- menos de 6 horas hasta su próxima dosis programada, no tome la dosis olvidada. Tome la siguiente dosis a la hora habitual.
- No tome 2 dosis de tabletas de 750 mg de CIPRO a la vez para compensar la dosis olvidada. Si no está seguro de cuándo tomar las tabletas de CIPRO de 500 mg después de olvidar una dosis, consulte a su proveedor de atención médica o farmacéutico.
Suspensión oral CIPRO:
- Tome la suspensión oral de CIPRO de 1000 mg por la mañana y por la noche aproximadamente a la misma hora todos los días. Agite bien el frasco de suspensión oral de CIPRO de 750 mg cada vez que lo use durante unos 15 segundos para asegurarse de que la suspensión se mezcle bien. Cierre la botella completamente después de su uso.
- Si olvida una dosis de CIPRO suspensión oral y es:
- 6 horas o más hasta su próxima dosis programada, tome la dosis que olvidó de inmediato. Luego tome la siguiente dosis a la hora habitual.
- menos de 6 horas hasta su próxima dosis programada, no tome la dosis olvidada. Tome la siguiente dosis a la hora habitual.
- No tome 2 dosis de CIPRO 750 mg suspensión oral a la vez para compensar la dosis olvidada. Si no está seguro de cuándo tomar la suspensión oral de CIPRO después de olvidar una dosis, consulte a su proveedor de atención médica o farmacéutico.
¿Qué debo evitar mientras tomo CIPRO?
- CIPRO 250 mg puede hacer que se sienta mareado y aturdido. No conduzca, opere maquinaria ni realice otras actividades que requieran agilidad mental o coordinación hasta que sepa cómo le afecta CIPRO 250 mg.
- Evite las lámparas solares, las camas de bronceado y trate de limitar el tiempo que pasa bajo el sol. CIPRO 500 mg puede hacer que su piel sea sensible al sol (fotosensibilidad) y a la luz de las lámparas solares y las camas de bronceado. Podría sufrir quemaduras solares graves, ampollas o hinchazón de la piel. Si tiene alguno de estos síntomas mientras toma CIPRO 250 mg, llame a su proveedor de atención médica de inmediato. Debes usar bloqueador solar y usar un sombrero y ropa que cubra tu piel si tienes que estar bajo la luz del sol.
¿Cuáles son los posibles efectos secundarios de CIPRO?
CIPRO puede causar efectos secundarios graves, que incluyen:
- Ver “¿Cuál es la información más importante que debo saber sobre CIPRO?”
- Reacciones alérgicas graves. Se pueden producir reacciones alérgicas graves, incluida la muerte, en personas que toman fluoroquinolonas, incluido CIPRO, incluso después de una sola dosis. Deje de tomar CIPRO y obtenga ayuda médica de emergencia de inmediato si presenta alguno de los siguientes síntomas de una reacción alérgica grave:
- urticaria
- latidos rápidos
- dificultad para respirar o tragar
- tenue
- hinchazón de los labios, lengua, cara
- erupción cutanea
- opresión en la garganta, ronquera
La erupción cutánea puede ocurrir en personas que toman CIPRO 1000 mg incluso después de solo 1 dosis. Deje de tomar CIPRO 500 mg al primer signo de erupción cutánea y llame a su proveedor de atención médica. La erupción cutánea puede ser un signo de una reacción más grave a CIPRO.
- Daño hepático (hepatotoxicidad). La hepatotoxicidad puede ocurrir en personas que toman CIPRO. Llame a su proveedor de atención médica de inmediato si tiene síntomas inexplicables, como:
- náuseas o vómitos
- cansancio inusual
- dolor de estómago
- pérdida de apetito
- fiebre
- evacuaciones intestinales de color claro
- debilidad
- orina de color oscuro
- dolor o sensibilidad abdominal
- coloración amarillenta de la piel y el blanco de los ojos
- Comezón
Deje de tomar CIPRO 750 mg e informe a su proveedor de atención médica de inmediato si tiene coloración amarillenta en la piel o parte blanca de los ojos, o si tiene orina oscura. Estos pueden ser signos de una reacción grave a CIPRO (un problema hepático).
- Aneurisma y disección de aorta. Informe a su proveedor de atención médica si alguna vez le han dicho que tiene un aneurisma aórtico, una inflamación de la arteria grande que lleva la sangre del corazón al resto del cuerpo. Obtenga ayuda médica de emergencia de inmediato si tiene dolor repentino en el pecho, el estómago o la espalda.
- Infección intestinal (Clostridioides difficile – diarrea asociada). La diarrea asociada a Clostridioides difficile (CDAD) puede ocurrir con muchos medicamentos antibacterianos, incluido CIPRO. Llame a su proveedor de atención médica de inmediato si tiene diarrea acuosa, diarrea que no desaparece o heces con sangre. Es posible que tenga calambres estomacales y fiebre. CDAD puede ocurrir 2 o más meses después de haber terminado su medicamento antibacteriano.
- Alteraciones graves del ritmo cardíaco (prolongación del intervalo QT y torsade de pointes). Informe a su proveedor de atención médica de inmediato si tiene un cambio en los latidos de su corazón (latidos cardíacos rápidos o irregulares) o si se desmaya. CIPRO puede causar un problema cardíaco raro conocido como prolongación del intervalo QT. Esta condición puede causar latidos cardíacos anormales y puede ser muy peligrosa. Las posibilidades de este evento son mayores en las personas:
- que son ancianos.
- con antecedentes familiares de prolongación del intervalo QT.
- con niveles bajos de potasio en sangre (hipocalemia) o niveles bajos de magnesio (hipomagnesemia).
- que toman determinados medicamentos para controlar el ritmo cardíaco (antiarrítmicos).
- Problemas articulares. Puede haber una mayor probabilidad de problemas con las articulaciones y los tejidos alrededor de las articulaciones en niños menores de 18 años. Informe al proveedor de atención médica de su hijo si tiene algún problema en las articulaciones durante o después del tratamiento con CIPRO.
- Sensibilidad a la luz solar (fotosensibilidad). Consulte "¿Qué debo evitar mientras tomo CIPRO 250 mg?"
- Cambios en el azúcar en la sangre. Las personas que toman CIPRO y otras fluoroquinolonas con medicamentos orales contra la diabetes o con insulina pueden tener un nivel bajo de azúcar en la sangre (hipoglucemia) y un nivel alto de azúcar en la sangre (hiperglucemia). Siga las instrucciones de su proveedor de atención médica sobre la frecuencia con la que debe controlar su nivel de azúcar en la sangre. Si tiene diabetes y tiene un nivel bajo de azúcar en la sangre mientras toma CIPRO, deje de tomar CIPRO y llame a su proveedor de atención médica de inmediato. Es posible que sea necesario cambiar su medicamento antibiótico.
Los efectos secundarios más comunes de CIPRO 750 mg incluyen:
- náuseas
- Diarrea
- cambios en las pruebas de función hepática
- vómitos
- sarpullido
Informe a su proveedor de atención médica sobre cualquier efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de CIPRO. Para obtener más información, consulte a su proveedor de atención médica o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar CIPRO?
Comprimidos CIPRO 500mg
- Almacene a temperatura ambiente entre 68 °F y 77 °F (20 °C y 25 °C).
Suspensión oral CIPRO 750 mg
- Guarde las microcápsulas y el diluyente a temperatura ambiente hasta 25 °C (77 °F).
- No congelar.
- Una vez finalizado el tratamiento con CIPRO, deseche de forma segura cualquier suspensión oral no utilizada.
Mantenga CIPRO 250 mg y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de CIPRO.
A veces, los medicamentos se recetan para fines distintos a los enumerados en la Guía del medicamento. No use CIPRO para una condición para la cual no está prescrito. No le dé CIPRO a otras personas, incluso si tienen los mismos síntomas que usted tiene. Puede que les haga daño.
Esta Guía del medicamento resume la información más importante sobre CIPRO. Si desea obtener más información sobre CIPRO, hable con su proveedor de atención médica. Puede pedirle a su proveedor de atención médica o farmacéutico información sobre CIPRO 250 mg que está escrita para profesionales de la salud.
¿Cuáles son los ingredientes de CIPRO 500mg?
Comprimidos CIPRO 1000mg:
- Ingrediente activo: cipro 250mg clorhidrato de floxacina
- Ingredientes inactivos: almidón de maíz, crospovidona, hipromelosa, estearato de magnesio, celulosa microcristalina, polietilenglicol, dióxido de silicio y dióxido de titanio.
Suspensión oral CIPRO:
- Ingrediente activo: ciprofloxacina
- Ingredientes inactivos:
- Las microcápsulas contienen: hipromelosa, estearato de magnesio, copolímero de ácido metacrílico y polisorbato 20 y povidona.
- El diluyente contiene: triglicéridos de cadena media, sacarosa, lecitina de soja, agua y sabor a fresa.
Esta Guía del medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de EE. UU.
