Myambutol 200mg, 400mg, 600mg, 800mg Ethambutol Hydrochloride Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Myambutol y cómo se usa?
Myambutol es un medicamento recetado que se usa para tratar los síntomas de la tuberculosis. Myambutol 400 mg se puede usar solo o con otros medicamentos.
Myambutol pertenece a una clase de medicamentos llamados agentes antituberculosos.
No se sabe si Myambutol 800 mg es seguro y efectivo en niños menores de 13 años.
¿Cuáles son los posibles efectos secundarios de Myambutol 800mg?
Myambutol puede causar efectos secundarios graves que incluyen:
- urticaria,
- respiración dificultosa,
- hinchazón de la cara, los labios, la lengua o la garganta,
- problemas de la vista,
- pérdida de la visión que puede ser permanente,
- visión borrosa,
- problemas para enfocar,
- pérdida de la visión en un ojo que dura una hora o más,
- aumento de la sensibilidad de los ojos a la luz,
- pérdida de la visión del color,
- dolor con el movimiento de los ojos,
- dolor detrás de los ojos,
- tos nueva o que empeora con fiebre,
- entumecimiento u hormigueo en las manos o los pies,
- confusión,
- alucinaciones,
- fiebre,
- glándulas inflamadas,
- llagas dolorosas en la boca,
- llagas en la piel,
- síntomas de resfriado o gripe,
- malestar general,
- moretones o sangrado fácil,
- hemorragias nasales,
- sangrado de las encías,
- orinar poco o nada,
- dolor de estómago superior,
- orina oscura,
- heces de color arcilla,
- coloración amarillenta de la piel o los ojos (ictericia),
- dolor de garganta,
- ardiendo en tus ojos,
- dolor de piel,
- erupción cutánea roja o morada que se extiende (especialmente en la cara o la parte superior del cuerpo) y causa ampollas y descamación,
- dolor de pecho, y
- dificultad para respirar
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Myambutol incluyen:
- Comezón,
- sarpullido,
- dolor en las articulaciones,
- dolor de cabeza,
- mareo,
- náuseas,
- vómitos,
- dolor de estómago,
- indigestión, y
- pérdida de apetito
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Myambutol. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
MYAMBUTOL (clorhidrato de etambutol) es un agente quimioterapéutico oral que es específicamente efectivo contra microorganismos del género Mycobacterium en crecimiento activo, incluyendo M. tuberculosis. La fórmula estructural es:
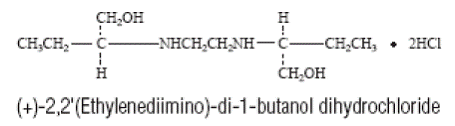
Las tabletas de 100 y 400 mg de MYAMBUTOL (clorhidrato de etambutol) contienen los siguientes ingredientes inactivos: gelatina, hidroxipropilmetilcelulosa, estearato de magnesio, laurilsulfato de sodio, sorbitol, ácido esteárico, sacarosa, dióxido de titanio y otros ingredientes.
INDICACIONES
MYAMBUTOL está indicado para el tratamiento de la tuberculosis pulmonar. No debe utilizarse como único fármaco antituberculoso, sino que debe utilizarse junto con al menos otro fármaco antituberculoso. La selección del fármaco complementario debe basarse en la experiencia clínica, consideraciones de seguridad comparativa y estudios de susceptibilidad in vitro apropiados. En pacientes que no han recibido terapia antituberculosa previa, es decir, tratamiento inicial, las pautas más utilizadas han sido las siguientes:
MYAMBUTOL más isoniazida
MYAMBUTOL 800 mg más isoniazida más estreptomicina.
En pacientes que han recibido tratamiento antituberculoso previo, es frecuente la resistencia de las micobacterias a otros fármacos utilizados en el tratamiento inicial. En consecuencia, en tales pacientes de retratamiento, MYAMBUTOL debe combinarse con al menos uno de los medicamentos de segunda línea que no se haya administrado previamente al paciente y para el cual se haya indicado susceptibilidad bacteriana mediante estudios in vitro apropiados. Los fármacos antituberculosos utilizados con MYAMBUTOL incluyen cicloserina, etionamida, pirazinamida, viomicina y otros fármacos. La isoniazida, el ácido aminosalicílico y la estreptomicina también se han utilizado en múltiples regímenes farmacológicos. También se han utilizado regímenes farmacológicos alternativos.
DOSIFICACIÓN Y ADMINISTRACIÓN
MYAMBUTOL 200 mg no debe usarse solo, en el tratamiento inicial o en el retratamiento. MYAMBUTOL 400 mg debe administrarse solo una vez cada 24 horas. La absorción no se ve significativamente alterada por la administración con alimentos. La terapia, en general, debe continuarse hasta que la conversión bacteriológica sea permanente y se haya producido la mejoría clínica máxima.
No se recomienda el uso de MYAMBUTOL en pacientes pediátricos menores de trece años debido a que no se han establecido las condiciones seguras para su uso.
Tratamiento inicial: En pacientes que no hayan recibido tratamiento antituberculoso previo, administrar MYAMBUTOL 15 mg/kg (7 mg/lb) de peso corporal, en dosis única oral una vez cada 24 horas. En los estudios más recientes, la isoniazida se administró simultáneamente en una sola dosis oral diaria.
Retratamiento: En pacientes que hayan recibido tratamiento antituberculoso previo, administrar MYAMBUTOL 25 mg/kg (11 mg/lb) de peso corporal, en dosis única oral una vez cada 24 horas. Administrar al mismo tiempo al menos otro fármaco antituberculoso al que se haya demostrado que los organismos son susceptibles mediante pruebas in vitro adecuadas. Los fármacos adecuados suelen consistir en aquellos que no se han utilizado previamente en el tratamiento del paciente. Después de 60 días de la administración de 600 mg de MYAMBUTOL, disminuya la dosis a 15 mg/kg (7 mg/lb) de peso corporal y administre como dosis oral única una vez cada 24 horas.
Durante el período en que el paciente recibe una dosis diaria de 25 mg/kg, se recomiendan exámenes oculares mensuales.
Consulte la tabla para seleccionar fácilmente la(s) tableta(s) adecuada(s) según el peso.
Tabla Peso-Dosis
CÓMO SUMINISTRADO
Tabletas de clorhidrato de etambutol USP
100 miligramos – Los comprimidos recubiertos con película redondos, convexos, blancos, grabados con E6 en una cara se suministran de la siguiente manera:
CDN 54879-001-01 - Botella de 100 CDN 54879-001-00 - 10 blisters x 10 comprimidos
400 miligramos – Los comprimidos recubiertos con película, redondos, convexos, blancos, ranurados, grabados con una E a la izquierda y un 7 a la derecha de la ranura en un lado, se suministran de la siguiente manera:
CDN 54879-002-01 - Botella de 100 CDN 54879-002-00 - 10 blisters x 10 comprimidos
Almacenar a temperatura ambiente controlada de 20° a 25°C (68° a 77°F).
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088
Fabricado y distribuido por: STI Pharma, LLC Langhorne, PA 19047. Revisado en marzo de 2013EFECTOS SECUNDARIOS
MYAMBUTOL puede producir disminuciones en la agudeza visual, incluida la ceguera irreversible, que parece deberse a una neuritis óptica. La neuropatía óptica, incluida la neuritis óptica o la neuritis retrobulbar, que ocurre en asociación con la terapia con etambutol puede caracterizarse por uno o más de los siguientes eventos: disminución de la agudeza visual, escotoma, daltonismo y/o defecto visual. Estos eventos también se han informado en ausencia de un diagnóstico de neuritis óptica o retrobulbar.
Se debe advertir a los pacientes que informen de inmediato a su médico cualquier cambio en la agudeza visual.
El cambio en la agudeza visual puede ser unilateral o bilateral y, por lo tanto, cada ojo debe evaluarse por separado y ambos ojos deben evaluarse juntos. Se deben realizar pruebas de agudeza visual antes de comenzar la terapia con MYAMBUTOL y periódicamente durante la administración del fármaco, excepto que se deben realizar mensualmente cuando el paciente recibe una dosis de más de 15 mg por kilogramo por día. Se recomiendan las tablas optométricas de Snellen para evaluar la agudeza visual. Los estudios han demostrado que existen fluctuaciones definidas de una o dos líneas de la tabla de Snellen en la agudeza visual de muchos pacientes tuberculosos que no reciben MYAMBUTOL.

La siguiente tabla puede ser útil para interpretar posibles cambios en la agudeza visual atribuibles a MYAMBUTOL.
En general, los cambios en la agudeza visual inferiores a los indicados en "Número significativo de líneas" y "Número reducido de puntos" pueden deberse a variaciones aleatorias, limitaciones del método de prueba o variabilidad fisiológica. Por el contrario, los cambios en la agudeza visual que igualan o superan los de "Número significativo de líneas" y "Número reducido de puntos" indican la necesidad de volver a realizar la prueba y una evaluación cuidadosa del estado visual del paciente. Si una evaluación cuidadosa confirma la magnitud del cambio visual y no logra revelar otra causa, se debe suspender MYAMBUTOL 400 mg y se debe volver a evaluar al paciente a intervalos frecuentes. Se debe considerar que las disminuciones progresivas de la agudeza visual durante el tratamiento se deben a MYAMBUTOL.
Si se usan anteojos correctivos antes del tratamiento, estos deben usarse durante la prueba de agudeza visual. Durante 1 a 2 años de terapia, se puede desarrollar un error de refracción que debe corregirse para obtener resultados de prueba precisos. Probar la agudeza visual a través de un agujero de alfiler elimina el error de refracción. Los pacientes que desarrollan anomalías visuales durante el tratamiento con MYAMBUTOL 800 mg pueden mostrar síntomas visuales subjetivos antes o simultáneamente con la demostración de disminución de la agudeza visual, y todos los pacientes que reciben MYAMBUTOL deben ser interrogados periódicamente acerca de la visión borrosa y otros síntomas oculares subjetivos.
La recuperación de la agudeza visual generalmente ocurre durante un período de semanas a meses después de que se suspende el medicamento. Algunos pacientes han recibido MYAMBUTOL (clorhidrato de etambutol) nuevamente después de dicha recuperación sin recurrencia de la pérdida de agudeza visual.
Otras reacciones adversas notificadas incluyen: hipersensibilidad, reacción anafiláctica/anafilactoide, dermatitis, eritema multiforme, prurito y dolor articular; anorexia, náuseas, vómitos, malestar gastrointestinal y dolor abdominal; fiebre, malestar general, dolor de cabeza y mareos; confusión mental, desorientación y posibles alucinaciones; trombocitopenia, leucopenia y neutropenia. Se ha informado entumecimiento y hormigueo de las extremidades debido a neuritis periférica.
Se producen niveles elevados de ácido úrico en suero y se ha informado precipitación de gota aguda. También se informaron infiltrados pulmonares, con o sin eosinofilia, durante la terapia con MYAMBUTOL. Se han informado toxicidades hepáticas, incluidas muertes (ver ADVERTENCIAS .) Dado que MYAMBUTOL 400 mg se recomienda para el tratamiento junto con uno o más fármacos antituberculosos, estos cambios pueden estar relacionados con el tratamiento concurrente. Síndrome de hipersensibilidad que consiste en una reacción cutánea (como erupción cutánea o dermatitis exfoliativa), eosinofilia y uno o más de los siguientes: hepatitis, neumonitis, nefritis, miocarditis, pericarditis. Puede haber fiebre y linfadenopatía.
INTERACCIONES CON LA DROGAS
Los resultados de un estudio de coadministración de MYAMBUTOL (50 mg/kg) con un antiácido que contiene hidróxido de aluminio a 13 pacientes con tuberculosis mostró una reducción de las concentraciones séricas medias y la excreción urinaria de etambutol de aproximadamente 20 % y 13 %, respectivamente, lo que sugiere que la estos productos antiácidos pueden reducir la absorción oral de etambutol. Se recomienda evitar la administración simultánea de etambutol con antiácidos que contengan hidróxido de aluminio durante al menos 4 horas después de la administración de etambutol.
ADVERTENCIAS
MYAMBUTOL 600 mg puede producir disminuciones en la agudeza visual que parecen deberse a neuritis óptica. Este efecto puede estar relacionado con la dosis y la duración del tratamiento. Este efecto generalmente es reversible cuando la administración del fármaco se interrumpe rápidamente. Sin embargo, se ha informado ceguera irreversible. (Ver PRECAUCIONES y REACCIONES ADVERSAS ).
Se han informado toxicidades hepáticas, incluidas muertes (ver REACCIONES ADVERSAS ). Se debe realizar una evaluación inicial y periódica de la función hepática.
PRECAUCIONES
No se recomienda el uso de MYAMBUTOL 800 mg de clorhidrato de etambutol en pacientes pediátricos menores de trece años debido a que no se han establecido las condiciones seguras para su uso.
Los pacientes con función renal disminuida necesitan que se reduzca la dosis según lo determinen los niveles séricos de MYAMBUTOL, ya que la vía principal de excreción de este fármaco es por vía renal.
Debido a que este medicamento puede tener efectos adversos en la visión, el examen físico debe incluir oftalmoscopia, perimetría digital y pruebas de discriminación de colores. En pacientes con defectos visuales como cataratas, enfermedades oculares inflamatorias recurrentes, neuritis óptica y retinopatía diabética, la evaluación de los cambios en la agudeza visual es más difícil y se debe tener cuidado para asegurarse de que las variaciones en la visión no se deban a las condiciones subyacentes de la enfermedad. En tales pacientes, se debe considerar la relación entre los beneficios esperados y el posible deterioro visual ya que la evaluación de los cambios visuales es difícil. (Para conocer los procedimientos recomendados, consulte los párrafos siguientes bajo REACCIONES ADVERSAS ).
Al igual que con cualquier fármaco potente, se debe realizar una evaluación inicial y periódica de las funciones de los sistemas de órganos, incluidas las funciones renal, hepática y hematopoyética.
El embarazo
Efectos teratogénicos
Embarazo Categoría C.
No existen estudios adecuados y bien controlados en mujeres embarazadas. Hay informes de anomalías oftálmicas que ocurren en bebés nacidos de mujeres que reciben terapia antituberculosa que incluía MYAMBUTOL. MYAMBUTOL debe usarse durante el embarazo solo si el beneficio justifica el riesgo potencial para el feto.
Se ha demostrado que MYAMBUTOL 200 mg es teratogénico en ratones y conejas preñadas cuando se administra en dosis altas. Cuando ratones o conejas preñadas fueron tratadas con altas dosis de clorhidrato de etambutol, la mortalidad fetal aumentó levemente pero no significativamente (P>0.05). Las ratas hembra tratadas con clorhidrato de etambutol mostraron disminuciones leves pero insignificantes (P>0,05) en la fertilidad y el tamaño de la camada.
En fetos nacidos de ratones tratados con altas dosis de MYAMBUTOL 400 mg durante el embarazo, se observó una baja incidencia de paladar hendido, exencefalia y anomalía de la columna vertebral. Se observaron anomalías menores de la vértebra cervical en los recién nacidos de ratas tratadas con altas dosis de clorhidrato de etambutol durante el embarazo. Las conejas que recibieron altas dosis de MYAMBUTOL durante el embarazo dieron a luz a dos fetos con monoftalmía, uno con el antebrazo derecho acortado acompañado de contractura bilateral de la articulación de la muñeca y otro con labio leporino y paladar hendido.
Madres lactantes
MYAMBUTOL se excreta en la leche materna. El uso de MYAMBUTOL debe considerarse solo si el beneficio esperado para la madre supera el riesgo potencial para el lactante.
Uso pediátrico
No se recomienda el uso de MYAMBUTOL (clorhidrato de etambutol) en pacientes pediátricos menores de trece años debido a que no se han establecido las condiciones seguras para su uso.
Uso geriátrico
Hay datos limitados sobre el uso de etambutol en ancianos. Un estudio de 101 pacientes, de 65 años o más, con regímenes antituberculosos de múltiples fármacos incluyó a 94 pacientes con etambutol. No se observaron diferencias en la seguridad o tolerabilidad en estos pacientes en comparación con lo informado en adultos en general. Otra experiencia clínica informada no ha identificado diferencias en las respuestas entre los ancianos y los pacientes más jóvenes, pero no se puede descartar una mayor sensibilidad de algunas personas mayores.
SOBREDOSIS
No se proporcionó información
CONTRAINDICACIONES
MYAMBUTOL está contraindicado en pacientes con hipersensibilidad conocida a este fármaco. También está contraindicado en pacientes con neuritis óptica conocida a menos que el juicio clínico determine que puede usarse. MYAMBUTOL está contraindicado en pacientes que no pueden apreciar y reportar efectos secundarios visuales o cambios en la visión (p. ej., niños pequeños, pacientes inconscientes).
FARMACOLOGÍA CLÍNICA
MYAMBUTOL 600 mg, luego de una dosis oral única de 25 mg/kg de peso corporal, alcanza un pico de 2 a 5 mg/mL en suero de 2 a 4 horas después de la administración. Cuando el fármaco se administra diariamente durante períodos de tiempo más prolongados a esta dosis, los niveles séricos son similares. El nivel sérico de MYAMBUTOL cae a niveles indetectables 24 horas después de la última dosis, excepto en algunos pacientes con función renal anormal. Las concentraciones intracelulares de eritrocitos alcanzan valores máximos de aproximadamente el doble de los plasmáticos y mantienen esta relación a lo largo de las 24 horas.
Durante el período de 24 horas posterior a la administración oral de MYAMBUTOL, aproximadamente el 50 por ciento de la dosis inicial se excreta sin cambios en la orina, mientras que un 8 a 15 por ciento adicional aparece en forma de metabolitos. La vía principal del metabolismo parece ser una oxidación inicial del alcohol a un intermedio aldehídico, seguida de la conversión a un ácido dicarboxílico. Del 20 al 22 por ciento de la dosis inicial se excreta en las heces como fármaco inalterado. No se ha observado acumulación del fármaco con dosis diarias únicas consecutivas de 25 mg/kg en pacientes con función renal normal, aunque se ha demostrado una marcada acumulación en pacientes con insuficiencia renal.
MYAMBUTOL se difunde en las células de micobacterias en crecimiento activo, como el bacilo tuberculoso. MYAMBUTOL 800 mg parece inhibir la síntesis de uno o más metabolitos, lo que provoca un deterioro del metabolismo celular, la detención de la multiplicación y la muerte celular. No se ha demostrado resistencia cruzada con otros agentes antimicobacterianos disponibles.
Se ha demostrado que MYAMBUTOL 200 mg es eficaz contra cepas de Mycobacterium tuberculosis, pero no parece ser activo contra hongos, virus u otras bacterias. Las cepas de Mycobacterium tuberculosis no expuestas previamente a MYAMBUTOL han sido uniformemente sensibles a concentraciones de 8 mcg/mL o menos, dependiendo de la naturaleza de los medios de cultivo. Cuando MYAMBUTOL se ha utilizado solo para el tratamiento de la tuberculosis, los bacilos tuberculosos de estos pacientes han desarrollado resistencia a MYAMBUTOL (clorhidrato de etambutol) mediante pruebas de susceptibilidad in vitro; el desarrollo de la resistencia ha sido impredecible y parece ocurrir de manera escalonada. No se ha informado resistencia cruzada entre MYAMBUTOL y otros medicamentos antituberculosos. MYAMBUTOL ha reducido la incidencia de la aparición de resistencia micobacteriana a la isoniazida cuando ambos fármacos se han utilizado al mismo tiempo.
Se puede utilizar un ensayo microbiológico de difusión en agar, basado en la inhibición de Mycobacterium smegmatis (ATCC 607) para determinar las concentraciones de MYAMBUTOL en suero y orina.
Farmacología Animal
Los estudios toxicológicos en perros con dosis prolongadas altas produjeron evidencia de daño e insuficiencia miocárdica, y despigmentación del tapetum lucidum de los ojos, cuya importancia se desconoce. También se han observado cambios degenerativos en el sistema nervioso central, aparentemente no relacionados con la dosis, en perros que recibieron clorhidrato de etambutol durante un período prolongado.
En el mono rhesus, aparecieron signos neurológicos después del tratamiento con dosis altas administradas diariamente durante un período de varios meses. Estos se correlacionaron con niveles séricos específicos de etambutol y con cambios neuroanatómicos definidos en el sistema nervioso central. También se observó carditis intersticial focal en monos que recibieron clorhidrato de etambutol en dosis altas durante un período prolongado.
INFORMACIÓN DEL PACIENTE
No se proporcionó información. por favor refiérase a ADVERTENCIAS y PRECAUCIONES secciones.
