Flagyl 200mg, 400mg Metronidazole Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Flagyl y cómo se usa?
Flagyl es un medicamento recetado que se usa para tratar los síntomas de las infecciones bacterianas de la vagina, el estómago, el hígado, la piel, las articulaciones, el cerebro y las vías respiratorias. Flagyl se puede usar solo o con otros medicamentos.
Flagyl es un nitroimidazol, inhibidor de CYP3A4, moderado.
¿Cuáles son los posibles efectos secundarios de Flagyl 200 mg?
Flagyl 400 mg puede causar efectos secundarios graves, que incluyen:
- Diarrea,
- dolor o dificultad para orinar,
- problemas para dormir,
- depresión,
- irritabilidad,
- dolor de cabeza,
- mareo
- debilidad,
- aturdimiento,
- ampollas o úlceras en la boca,
- encías rojas o hinchadas, y
- dificultad al tragar
Informe a su médico si experimenta efectos secundarios graves de Flagyl, incluidos:
- entumecimiento,
- hormigueo,
- dolor ardiente en las manos o los pies,
- problemas de la vista,
- dolor detrás de tus ojos,
- viendo destellos o luz,
- debilidad muscular,
- dificultad de coordinación,
- dificultad para hablar o entender lo que se le dice,
- embargo,
- fiebre,
- rigidez de nuca y
- aumento de la sensibilidad a la luz
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Estos no son todos los posibles efectos secundarios de Flagyl. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de FLAGYL® y otros medicamentos antibacterianos, FLAGYL® debe usarse solo para tratar o prevenir infecciones que se haya comprobado o que se sospeche firmemente que son causadas por bacterias.
ADVERTENCIA
Se ha demostrado que el metronidazol es cancerígeno en ratones y ratas (ver PRECAUCIONES ). Se debe evitar el uso innecesario del medicamento. Su uso debe reservarse para las condiciones descritas en el INDICACIONES Y USO sección a continuación.
DESCRIPCIÓN
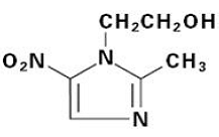
FLAGYL (metronidazol) comprimidos, 250 mg o 500 mg es una formulación oral del antimicrobiano nitroimidazol sintético, 2-metil-5-nitro-1H-imidazol-1-etanol, que tiene la siguiente fórmula estructural:
Las tabletas de FLAGYL (metronidazol) contienen 250 mg o 500 mg de metronidazol. Los ingredientes inactivos incluyen celulosa, FD&C Blue No. 2 Lake, hidroxipropilcelulosa, hipromelosa, polietilenglicol, ácido esteárico y dióxido de titanio.
INDICACIONES
Tricomoniasis sintomática. FLAGYL está indicado para el tratamiento de la infección por T. vaginalis en hembras y machos cuando la presencia de la tricomona ha sido confirmada mediante procedimientos de laboratorio apropiados (frotis húmedos y/o cultivos).
Tricomoniasis asintomática. FLAGYL 400 mg está indicado en el tratamiento de la infección asintomática por T. vaginalis en mujeres cuando el organismo está asociado con endocervicitis, cervicitis o erosión cervical. Dado que existe evidencia de que la presencia de tricomonas puede interferir con la evaluación precisa de frotis citológicos anormales, se deben realizar frotis adicionales después de la erradicación del parásito.
Tratamiento de las parejas sexuales asintomáticas. La infección por T. vaginalis es una enfermedad venérea. Por lo tanto, las parejas sexuales asintomáticas de los pacientes tratados deben tratarse simultáneamente si se ha encontrado la presencia del organismo, para prevenir la reinfección de la pareja. La decisión de tratar a una pareja masculina asintomática que tiene un cultivo negativo oa uno para quien no se ha intentado cultivo es individual. Al tomar esta decisión, se debe tener en cuenta que existe evidencia de que una mujer puede volver a infectarse si su pareja sexual no recibe tratamiento. Además, dado que puede haber una dificultad considerable para aislar el organismo del portador masculino asintomático, no se puede confiar en los frotis y cultivos negativos a este respecto. En cualquier caso, la pareja sexual debe ser tratada con FLAGYL en caso de reinfección.
Amebiasis. FLAGYL está indicado en el tratamiento de la amebiasis intestinal aguda (disentería amebiana) y el absceso hepático amebiano.
En el absceso hepático amebiano, la terapia con FLAGYL no elimina la necesidad de aspiración o drenaje de pus.
Infecciones por bacterias anaerobias. FLAGYL 200mg está indicado en el tratamiento de infecciones graves causadas por bacterias anaerobias sensibles. Los procedimientos quirúrgicos indicados deben realizarse junto con la terapia con FLAGYL. En una infección mixta aeróbica y anaeróbica, además de FLAGYL, se deben utilizar antimicrobianos apropiados para el tratamiento de la infección aeróbica.
INFECCIONES INTRAABDOMINALES, que incluyen peritonitis, absceso intraabdominal y absceso hepático, causadas por especies de Bacteroides, incluido el grupo B. fragilis (B. fragilis, B. distasonis, B. ovatus, B. thetaiotaomicron, B. vulgatus), Clostridium especies, especies de Eubacterium, especies de Peptococcus y especies de Peptostreptococcus.
INFECCIONES DE LA PIEL Y LA ESTRUCTURA DE LA PIEL causadas por especies de Bacteroides, incluido el grupo B. fragilis, especies de Clostridium, especies de Peptococcus, especies de Peptostreptococcus y especies de Fusobacterium.
INFECCIONES GINECOLÓGICAS, que incluyen endometritis, endomiometritis, absceso tuboovárico e infección posquirúrgica del manguito vaginal, causadas por especies de Bacteroides, incluido el grupo B. fragilis, especies de Clostridium, especies de Peptococcus, especies de Peptostreptococcus y especies de Fusobacterium.
SEPTICEMIA BACTERIANA causada por especies de Bacteroides, incluido el grupo B. fragilis y especies de Clostridium.
INFECCIONES DE HUESOS Y ARTICULACIONES, (como terapia adyuvante), causadas por especies de Bacteroides, incluido el grupo B. fragilis.
INFECCIONES DEL SISTEMA NERVIOSO CENTRAL (SNC), incluyendo meningitis y abscesos cerebrales, causadas por especies de Bacteroides, incluido el grupo B. fragilis.
INFECCIONES DEL TRACTO RESPIRATORIO INFERIOR, que incluyen neumonía, empiema y absceso pulmonar, causadas por especies de Bacteroides, incluido el grupo B. fragilis.
ENDOCARDITIS causada por especies de Bacteroides, incluido el grupo B. fragilis.
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de FLAGYL 400 mg y otros medicamentos antibacterianos, FLAGYL debe usarse solo para tratar o prevenir infecciones que se compruebe o se sospeche que son causadas por bacterias susceptibles. Cuando la información de cultivo y susceptibilidad esté disponible, se debe considerar al seleccionar o modificar la terapia antibacteriana. En ausencia de tales datos, la epidemiología local y los patrones de susceptibilidad pueden contribuir a la selección empírica de la terapia.
DOSIFICACIÓN Y ADMINISTRACIÓN
tricomoniasis
en la hembra
Tratamiento de un día: dos gramos de FLAGYL, administrados en una sola dosis o en dos dosis divididas de un gramo cada una, administradas el mismo día.
Curso de tratamiento de siete días: 250 mg tres veces al día durante siete días consecutivos. Hay alguna indicación de estudios comparativos controlados de que las tasas de curación determinadas por frotis vaginales y signos y síntomas pueden ser más altas después de un ciclo de tratamiento de siete días que después de un régimen de tratamiento de un día.
El régimen de dosificación debe ser individualizado. El tratamiento de dosis única puede asegurar el cumplimiento, especialmente si se administra bajo supervisión, en aquellos pacientes en los que no se puede confiar para continuar con el régimen de siete días. Un curso de tratamiento de siete días puede minimizar la reinfección al proteger al paciente el tiempo suficiente para que los contactos sexuales obtengan el tratamiento adecuado. Además, algunos pacientes pueden tolerar un régimen de tratamiento mejor que el otro.
Las pacientes embarazadas no deben ser tratadas durante el primer trimestre (ver CONTRAINDICACIONES ). En pacientes embarazadas para las que el tratamiento alternativo ha sido inadecuado, no se debe utilizar el tratamiento de un día, ya que da como resultado niveles séricos más altos que pueden llegar a la circulación fetal (ver PRECAUCIONES , El embarazo ).
Cuando se requieren cursos repetidos del fármaco, se recomienda que transcurra un intervalo de cuatro a seis semanas entre los cursos y que la presencia de la tricomona se reconfirme mediante medidas de laboratorio apropiadas. Se deben realizar recuentos de leucocitos totales y diferenciales antes y después del nuevo tratamiento.
En el Hombre: El tratamiento debe ser individualizado como lo es para la mujer.
amebiasis
Adultos
Para la amebiasis intestinal aguda (disentería amebiana aguda): 750 mg por vía oral tres veces al día durante 5 a 10 días.
Para el absceso hepático amebiano: 500 mg o 750 mg por vía oral tres veces al día durante 5 a 10 días.
Pacientes pediátricos: 35 a 50 mg/kg/24 horas, repartidos en tres tomas, por vía oral durante 10 días.
Infecciones por bacterias anaerobias
En el tratamiento de las infecciones anaerobias más graves, se suele administrar inicialmente metronidazol intravenoso.
La dosis oral habitual para adultos es de 7,5 mg/kg cada seis horas (aproximadamente 500 mg para un adulto de 70 kg). No se debe exceder un máximo de 4 g durante un período de 24 horas.
La duración habitual de la terapia es de 7 a 10 días; sin embargo, las infecciones de los huesos y las articulaciones, las vías respiratorias inferiores y el endocardio pueden requerir un tratamiento más prolongado.
Ajustes de dosis
Pacientes con insuficiencia hepática grave
Para pacientes con insuficiencia hepática grave (Child-Pugh C), la dosis de FLAGYL debe reducirse en un 50% (ver FARMACOLOGÍA CLÍNICA y PRECAUCIONES ).
Pacientes en hemodiálisis
La hemodiálisis elimina cantidades significativas de metronidazol y sus metabolitos de la circulación sistémica. El aclaramiento de metronidazol dependerá del tipo de membrana de diálisis utilizada, la duración de la sesión de diálisis y otros factores. Si la administración de metronidazol no puede separarse de la sesión de hemodiálisis, se debe considerar la suplementación de la dosis de metronidazol después de la sesión de hemodiálisis, dependiendo de la situación clínica del paciente (ver FARMACOLOGÍA CLÍNICA ).
CÓMO SUMINISTRADO
FLAGYL 250 mg los comprimidos son redondos, azules, recubiertos con película, con SEARLE y 1831 grabados en un lado y FLAGYL y 250 en el otro lado; se suministra en botellas de 50 y 100.
FLAGYL 500 mg los comprimidos son oblongos, azules, recubiertos con película, con FLAGYL grabado en un lado y 500 en el otro lado; botellas de 50 y 100.
Almacenamiento y estabilidad
Almacenar por debajo de 25°C (77°F) y proteger de la luz.
Distribuido por: Pfizer Labs, Division of Pfizre Inc., NY, NY 10017. Revisado: diciembre de 2021
EFECTOS SECUNDARIOS
Se han notificado las siguientes reacciones durante el tratamiento con metronidazol:
Sistema nervioso central
Las reacciones adversas más graves notificadas en pacientes tratados con metronidazol han sido crisis convulsivas, encefalopatía, meningitis aséptica, neuropatía óptica y periférica, esta última caracterizada principalmente por entumecimiento o parestesia de una extremidad. Debido a que se ha informado neuropatía periférica persistente en algunos pacientes que recibieron administración prolongada de metronidazol, se debe advertir específicamente a los pacientes acerca de estas reacciones y se les debe indicar que suspendan el medicamento e informen de inmediato a sus médicos si se presentan síntomas neurológicos. Además, los pacientes informaron dolor de cabeza, síncope, mareos, vértigo, falta de coordinación, ataxia, confusión, disartria, irritabilidad, depresión, debilidad e insomnio (ver ADVERTENCIAS ).
Gastrointestinal
Las reacciones adversas notificadas con mayor frecuencia se relacionan con el tracto gastrointestinal, en particular náuseas, algunas veces acompañadas de dolor de cabeza, anorexia y ocasionalmente vómitos; Diarrea; malestar epigástrico; y calambres abdominales y estreñimiento.
Boca
Un sabor metálico fuerte y desagradable no es inusual. Se han presentado lengua peluda, glositis y estomatitis; estos pueden estar asociados con un crecimiento excesivo repentino de Candida que puede ocurrir durante la terapia.
dermatológico
Erupción eritematosa y prurito.
hematopoyético
neutropenia reversible (leucopenia); raramente, trombocitopenia reversible.
Cardiovascular
Se ha informado prolongación del intervalo QT, particularmente cuando se administró metronidazol con fármacos con el potencial de prolongar el intervalo QT. El aplanamiento de la onda T puede verse en los trazados electrocardiográficos.
Hipersensibilidad
Urticaria, erupción eritematosa, síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, enrojecimiento, congestión nasal, sequedad de boca (o vagina o vulva) y fiebre.
Renal
Disuria, cistitis, poliuria, incontinencia y sensación de presión pélvica. Aproximadamente uno de cada 100.000 pacientes ha informado casos de orina oscurecida. Aunque el pigmento que probablemente es responsable de este fenómeno no ha sido identificado positivamente, es casi seguro que es un metabolito del metronidazol y parece no tener importancia clínica.
Hepático
Se han notificado casos de hepatotoxicidad grave irreversible/insuficiencia hepática aguda, incluidos casos con desenlaces mortales de aparición muy rápida tras el inicio del uso sistémico de metronidazol, en pacientes con síndrome de Cockayne (latencia desde el inicio del fármaco hasta los signos de insuficiencia hepática de tan solo 2 días). ) (ver CONTRAINDICACIONES ).
Otro
Proliferación de Candida en la vagina, dispareunia, disminución de la libido, proctitis y dolores articulares pasajeros que a veces se asemejan a la "enfermedad del suero". Se han informado casos raros de pancreatitis, que generalmente disminuyeron con la suspensión del fármaco.
Se sabe que los pacientes con enfermedad de Crohn tienen una mayor incidencia de cánceres gastrointestinales y ciertos cánceres extraintestinales. Ha habido algunos informes en la literatura médica de cáncer de mama y de colon en pacientes con enfermedad de Crohn que han sido tratados con metronidazol en dosis altas durante períodos prolongados. No se ha establecido una relación de causa y efecto. La enfermedad de Crohn no es una indicación aprobada para las tabletas de FLAGYL de 200 mg.
INTERACCIONES CON LA DROGAS
disulfiram
Se han informado reacciones psicóticas en pacientes alcohólicos que están usando metronidazol y disulfiram al mismo tiempo. No se debe administrar metronidazol a pacientes que hayan tomado disulfiram en las últimas dos semanas (ver CONTRAINDICACIONES ).
Bebidas alcohólicas
Pueden ocurrir calambres abdominales, náuseas, vómitos, dolores de cabeza y sofocos si se consumen bebidas alcohólicas o productos que contienen propilenglicol durante o después de la terapia con metronidazol (ver CONTRAINDICACIONES ).
Warfarina y otros anticoagulantes orales
Se ha informado que el metronidazol potencia el efecto anticoagulante de la warfarina y otros anticoagulantes cumarínicos orales, lo que resulta en una prolongación del tiempo de protrombina. Cuando se prescribe FLAGYL a pacientes que reciben este tipo de terapia anticoagulante, se debe controlar cuidadosamente el tiempo de protrombina y el INR.

Litio
En pacientes estabilizados con dosis relativamente altas de litio, la terapia con metronidazol a corto plazo se ha asociado con elevación del litio sérico y, en algunos casos, signos de toxicidad por litio. Los niveles séricos de litio y creatinina sérica deben obtenerse varios días después de comenzar con metronidazol para detectar cualquier aumento que pueda preceder a los síntomas clínicos de intoxicación por litio.
busulfán
Se ha informado que el metronidazol aumenta las concentraciones plasmáticas de busulfán, lo que puede resultar en un mayor riesgo de toxicidad grave por busulfán. El metronidazol no debe administrarse concomitantemente con busulfán a menos que el beneficio supere el riesgo. Si no hay alternativas terapéuticas disponibles para el metronidazol, y la administración concomitante con busulfano es médicamente necesaria, se debe realizar un control frecuente de la concentración plasmática de busulfano y la dosis de busulfano se debe ajustar en consecuencia.
Fármacos que inhiben las enzimas CYP450
La administración simultánea de medicamentos que disminuyen la actividad de las enzimas hepáticas microsomales, como la cimetidina, puede prolongar la vida media y disminuir el aclaramiento plasmático de metronidazol.
Fármacos que inducen las enzimas CYP450
La administración simultánea de fármacos que inducen enzimas hepáticas microsomales, como la fenitoína o el fenobarbital, puede acelerar la eliminación de metronidazol, lo que reduce los niveles plasmáticos; También se ha notificado una eliminación alterada de la fenitoína.
Fármacos que prolongan el intervalo QT
Se ha informado prolongación del intervalo QT, particularmente cuando se administró metronidazol con fármacos con el potencial de prolongar el intervalo QT.
ADVERTENCIAS
Efectos del sistema nervioso central y periférico
Encefalopatía y neuropatía periférica: Se han notificado casos de encefalopatía y neuropatía periférica (incluyendo neuropatía óptica) con metronidazol.
Se ha informado encefalopatía asociada con toxicidad cerebelosa caracterizada por ataxia, mareos y disartria. Las lesiones del SNC observadas en la resonancia magnética se han descrito en informes de encefalopatía. Los síntomas del SNC generalmente son reversibles en días o semanas después de la interrupción del metronidazol. Las lesiones del SNC observadas en la resonancia magnética también se han descrito como reversibles.
Se ha informado neuropatía periférica, principalmente de tipo sensorial, y se caracteriza por entumecimiento o parestesia de una extremidad.
Se han informado ataques convulsivos en pacientes tratados con metronidazol.
Meningitis aséptica: Se han notificado casos de meningitis aséptica con metronidazol. Los síntomas pueden ocurrir dentro de las horas posteriores a la administración de la dosis y generalmente se resuelven después de que se interrumpe la terapia con metronidazol.
La aparición de signos y síntomas neurológicos anormales exige la pronta evaluación de la relación riesgo/beneficio de la continuación de la terapia (ver REACCIONES ADVERSAS ).
PRECAUCIONES
General
Deterioro hepático
Los pacientes con insuficiencia hepática metabolizan el metronidazol lentamente, con la consiguiente acumulación de metronidazol en el plasma. Para pacientes con insuficiencia hepática grave (Child-Pugh C), se recomienda una dosis reducida de FLAGYL 400 mg. Para pacientes con insuficiencia hepática de leve a moderada, no es necesario ajustar la dosis, pero estos pacientes deben ser monitoreados por eventos adversos asociados con metronidazol (ver FARMACOLOGÍA CLÍNICA y DOSIFICACIÓN Y ADMINISTRACIÓN ).
Insuficiencia renal
Los pacientes con enfermedad renal en etapa terminal pueden excretar metronidazol y metabolitos lentamente en la orina, lo que resulta en una acumulación significativa de metabolitos de metronidazol. Se recomienda monitorear los eventos adversos asociados con metronidazol (ver FARMACOLOGÍA CLÍNICA ).
Sobreinfecciones fúngicas
La candidiasis conocida o no reconocida previamente puede presentar síntomas más prominentes durante la terapia con FLAGYL y requiere tratamiento con un agente candidacida.
Uso en pacientes con discrasias sanguíneas
El metronidazol es un nitroimidazol y debe usarse con precaución en pacientes con evidencia o antecedentes de discrasia sanguínea. Se ha observado una leve leucopenia durante su administración; sin embargo, no se han observado anomalías hematológicas persistentes atribuibles al metronidazol en estudios clínicos. Se recomiendan recuentos leucocitarios totales y diferenciales antes y después del tratamiento.
Bacterias y parásitos resistentes a los medicamentos
Prescribir FLAGYL en ausencia de una infección bacteriana o parasitaria comprobada o fuertemente sospechada o una indicación profiláctica es poco probable que brinde beneficios al paciente y aumenta el riesgo de desarrollo de bacterias y parásitos resistentes a los medicamentos.
Interacciones entre medicamentos y pruebas de laboratorio
El metronidazol puede interferir con ciertos tipos de determinaciones de valores químicos séricos, como aspartato aminotransferasa (AST, SGOT), alanina aminotransferasa (ALT, SGPT), lactato deshidrogenasa (LDH), triglicéridos y glucosa hexoquinasa. Pueden observarse valores de cero. Todos los ensayos en los que se ha informado de interferencia implican el acoplamiento enzimático del ensayo a la oxidación-reducción del dinucleótido de nicotinamida y adenina (NAD+ NADH). La interferencia se debe a la similitud en los picos de absorbancia de NADH (340 nm) y metronidazol (322 nm) a pH 7.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Se han detectado tumores que afectan el hígado, los pulmones, los tejidos mamarios y linfáticos en varios estudios de metronidazol en ratas y ratones, pero no en hámsters.
Se han observado tumores pulmonares en los seis estudios informados en ratones, incluido un estudio en el que los animales recibieron dosis en un programa intermitente (administración cada cuatro semanas solamente). Los tumores hepáticos malignos aumentaron en ratones macho tratados con aproximadamente 1500 mg/m² (similar a la dosis diaria máxima recomendada, según las comparaciones del área de superficie corporal). Los linfomas malignos y las neoplasias pulmonares también aumentaron con la alimentación de por vida del fármaco a los ratones. Los tumores mamarios y hepáticos aumentaron entre las ratas hembra a las que se les administró metronidazol oral en comparación con los controles concurrentes. Se han realizado dos estudios de tumorigenicidad de por vida en hámsteres y se ha informado que son negativos.
El metronidazol ha mostrado actividad mutagénica en sistemas de ensayo in vitro, incluida la prueba de Ames. Los estudios en mamíferos in vivo no han podido demostrar un potencial de daño genético.
El metronidazol no produjo ningún efecto adverso sobre la fertilidad o la función testicular en ratas macho en dosis de hasta 400 mg/kg/día (similar a la dosis clínica máxima recomendada, según las comparaciones del área de superficie corporal) durante 28 días. Sin embargo, las ratas tratadas con la misma dosis durante 6 semanas o más fueron infértiles y mostraron una degeneración severa del epitelio seminífero en los testículos, así como disminuciones marcadas en el recuento de espermátidas testiculares y el recuento de espermatozoides en el epidídimo. La fertilidad se restauró en la mayoría de las ratas después de un período de recuperación sin fármacos de ocho semanas.
El embarazo
Efectos teratogénicos
No existen estudios adecuados y bien controlados de FLAGYL en mujeres embarazadas. Hay datos publicados de estudios de casos y controles, estudios de cohortes y 2 metanálisis que incluyen a más de 5000 mujeres embarazadas que usaron metronidazol durante el embarazo. Muchos estudios incluyeron exposiciones en el primer trimestre. Un estudio mostró un mayor riesgo de labio hendido, con o sin paladar hendido, en lactantes expuestos al metronidazol en el útero; sin embargo, estos hallazgos no fueron confirmados. Además, más de diez ensayos clínicos aleatorios controlados con placebo reclutaron a más de 5000 mujeres embarazadas para evaluar el uso del tratamiento con antibióticos (incluido el metronidazol) para la vaginosis bacteriana en la incidencia de parto prematuro. La mayoría de los estudios no mostraron un mayor riesgo de anomalías congénitas u otros resultados fetales adversos después de la exposición al metronidazol durante el embarazo. Tres estudios realizados para evaluar el riesgo de cáncer infantil después de la exposición al metronidazol durante el embarazo no mostraron un aumento del riesgo; sin embargo, la capacidad de estos estudios para detectar tal señal fue limitada.
El metronidazol atraviesa la barrera placentaria y se desconocen sus efectos sobre la organogénesis fetal humana. Se han realizado estudios de reproducción en ratas, conejos y ratones a dosis similares a la dosis máxima recomendada en humanos en base a comparaciones de área de superficie corporal. No hubo evidencia de daño al feto debido al metronidazol.
Madres lactantes
El metronidazol está presente en la leche humana en concentraciones similares a los niveles séricos maternos, y los niveles séricos infantiles pueden ser cercanos o comparables a los niveles terapéuticos infantiles. Debido al potencial de tumorigenicidad mostrado por el metronidazol en ratones y ratas
estudios, se debe tomar la decisión de suspender la lactancia o suspender el fármaco, teniendo en cuenta la importancia del fármaco para la madre. Alternativamente, una madre lactante puede optar por extraer y desechar la leche humana durante la terapia con metronidazol y durante las 24 horas posteriores a la finalización de la terapia y alimentar a su bebé con leche humana almacenada o fórmula.
Uso geriátrico
En pacientes geriátricos de edad avanzada, se recomienda monitorear los eventos adversos asociados con metronidazol (ver FARMACOLOGÍA CLÍNICA , PRECAUCIONES ). La disminución de la función hepática en pacientes geriátricos puede dar lugar a un aumento de las concentraciones de metronidazol que puede requerir un ajuste de la dosis de metronidazol (ver DOSIFICACIÓN Y ADMINISTRACIÓN ).
Uso pediátrico
No se ha establecido la seguridad y eficacia en pacientes pediátricos, excepto para el tratamiento de la amebiasis.
SOBREDOSIS
Se han informado dosis orales únicas de metronidazol, de hasta 15 g, en intentos de suicidio y sobredosis accidentales. Los síntomas informados incluyen náuseas, vómitos y ataxia.
El metronidazol oral se ha estudiado como un sensibilizador a la radiación en el tratamiento de tumores malignos. Se han informado efectos neurotóxicos, que incluyen convulsiones y neuropatía periférica, después de 5 a 7 días de dosis de 6 a 10,4 g en días alternos.
Tratamiento de sobredosis
No existe un antídoto específico para la sobredosis de metronidazol; por lo tanto, el manejo del paciente debe consistir en terapia sintomática y de apoyo.
CONTRAINDICACIONES
Hipersensibilidad
FLAGYL Tablets está contraindicado en pacientes con antecedentes de hipersensibilidad al metronidazol u otros derivados del nitroimidazol.
En pacientes con tricomoniasis, FLAGYL 200 mg comprimidos está contraindicado durante el primer trimestre del embarazo (ver PRECAUCIONES ).
Reacción psicótica con disulfiram
El uso de metronidazol oral se asocia con reacciones psicóticas en pacientes alcohólicos que estaban usando disulfiram al mismo tiempo. No administre metronidazol a pacientes que hayan tomado disulfiram en las últimas dos semanas (ver PRECAUCIONES , INTERACCIONES CON LA DROGAS ).
Interacción con el alcohol
El uso de metronidazol oral se asocia con una reacción al alcohol similar al disulfiram, que incluye calambres abdominales, náuseas, vómitos, dolores de cabeza y sofocos. Suspender el consumo de alcohol o productos que contengan propilenglicol durante y durante al menos tres días después de la terapia con metronidazol (ver PRECAUCIONES , INTERACCIONES CON LA DROGAS ).
Síndrome de Cockayne
Los comprimidos de 400 mg de FLAGYL están contraindicados en pacientes con síndrome de Cockayne. Se ha notificado hepatotoxicidad grave irreversible/insuficiencia hepática aguda con desenlace mortal después del inicio de metronidazol en pacientes con síndrome de Cockayne (ver REACCIONES ADVERSAS ).
FARMACOLOGÍA CLÍNICA
Absorción
La disposición de metronidazol en el cuerpo es similar para las formas de dosificación oral e intravenosa. Después de la administración oral, el metronidazol se absorbe bien y las concentraciones plasmáticas máximas se alcanzan entre una y dos horas después de la administración.
Las concentraciones plasmáticas de metronidazol son proporcionales a la dosis administrada. La administración oral de 250 mg, 500 mg o 2000 mg produjo concentraciones plasmáticas máximas de 6 mcg/ml, 12 mcg/ml y 40 mcg/ml, respectivamente. Los estudios no revelan diferencias significativas de biodisponibilidad entre hombres y mujeres; sin embargo, debido a las diferencias de peso, los niveles plasmáticos resultantes en los hombres son generalmente más bajos.
Distribución
El metronidazol es el componente principal que aparece en el plasma, con cantidades menores de metabolitos también presentes. Menos del 20% del metronidazol circulante se une a las proteínas plasmáticas. El metronidazol aparece en el líquido cefalorraquídeo, la saliva y la leche materna en concentraciones similares a las que se encuentran en el plasma. También se han detectado concentraciones bactericidas de metronidazol en pus de abscesos hepáticos.
Metabolismo/Excreción
La vía principal de eliminación de metronidazol y sus metabolitos es a través de la orina (60% a 80% de la dosis), y la excreción fecal representa del 6% al 15% de la dosis. Los metabolitos que aparecen en la orina resultan principalmente de la oxidación de la cadena lateral [1-(ßhidroxietil)-2-hidroximetil-5-nitroimidazol y ácido 2-metil-5-nitroimidazol-1-ilacético] y la conjugación de glucurónido, con metronidazol sin cambios. aproximadamente el 20% del total. Tanto el compuesto original como el metabolito hidroxilo poseen actividad antimicrobiana in vitro.
El aclaramiento renal de metronidazol es de aproximadamente 10 ml/min/1,73 m². La vida media de eliminación promedio de metronidazol en sujetos sanos es de ocho horas.
Insuficiencia renal
La disminución de la función renal no altera la farmacocinética de una dosis única de metronidazol.
Los sujetos con enfermedad renal en etapa terminal (ESRD; CLCR= 8,1±9,1 ml/min) y que recibieron una infusión intravenosa única de 500 mg de metronidazol no tuvieron cambios significativos en la farmacocinética de metronidazol, pero tuvieron una Cmax de hidroxi-metronidazol 2 veces mayor y 5 -Cmax veces mayor de acetato de metronidazol, en comparación con sujetos sanos con función renal normal (CLCR= 126±16 ml/min). Por lo tanto, debido a la posible acumulación de metabolitos de metronidazol en pacientes con ESRD, se recomienda monitorear los eventos adversos asociados con metronidazol (ver PRECAUCIONES ).
efecto de la diálisis
Después de una infusión intravenosa única o una dosis oral de 500 mg de metronidazol, se investigó el aclaramiento de metronidazol en sujetos con ESRD sometidos a hemodiálisis o diálisis peritoneal ambulatoria continua (CAPD). Una sesión de hemodiálisis que duró de 4 a 8 horas eliminó del 40% al 65% de la dosis de metronidazol administrada, según el tipo de membrana de dializador utilizada y la duración de la sesión de diálisis. Si la administración de metronidazol no puede separarse de la sesión de diálisis, se debe considerar la suplementación de la dosis de metronidazol después de la hemodiálisis (ver DOSIFICACIÓN Y ADMINISTRACIÓN ). Una sesión de diálisis peritoneal de 7,5 horas eliminó aproximadamente el 10% de la dosis de metronidazol administrada. No es necesario ajustar la dosis de metronidazol en pacientes con ESRD sometidos a CAPD.
Deterioro hepático
Luego de una infusión intravenosa única de 500 mg de metronidazol, el AUC24 promedio de metronidazol fue mayor en un 114 % en pacientes con insuficiencia hepática grave (Child-Pugh C) y en un 54 % y 53 % en pacientes con insuficiencia hepática leve (Child-Pugh A). y insuficiencia hepática moderada (Child-Pugh B), respectivamente, en comparación con sujetos de control sanos. No hubo cambios significativos en el AUC24 de hidroxil-metronidazol en estos pacientes con insuficiencia hepática. Se recomienda una reducción de la dosis de metronidazol en un 50 % en pacientes con insuficiencia hepática grave (Child-Pugh C) (ver DOSIFICACIÓN Y ADMINISTRACIÓN ). No es necesario ajustar la dosis en pacientes con insuficiencia hepática de leve a moderada. Los pacientes con insuficiencia hepática de leve a moderada deben ser monitoreados por eventos adversos asociados con metronidazol (ver PRECAUCIONES y DOSIFICACIÓN Y ADMINISTRACIÓN ).
Pacientes geriátricos
Después de una dosis única oral o intravenosa de 500 mg de metronidazol, los sujetos >70 años sin disfunción renal o hepática aparente tuvieron un AUC promedio de 40% a 80% más alto de hidroxi-metronidazol (metabolito activo), sin aumento aparente en el promedio AUC de metronidazol (compuesto original), en comparación con controles jóvenes sanos PRECAUCIONES ).
Pacientes pediátricos
En un estudio, los recién nacidos parecían demostrar una capacidad disminuida para eliminar el metronidazol. La vida media de eliminación, medida durante los primeros 3 días de vida, estuvo inversamente relacionada con la edad gestacional. En lactantes cuyas edades gestacionales estaban entre 28 y 40 semanas, las semividas de eliminación correspondientes oscilaron entre 109 y 22,5 horas.
Microbiología
Mecanismo de acción
El metronidazol, un nitroimidazol, ejerce efectos antibacterianos en un ambiente anaerobio contra la mayoría de los anaerobios obligados. Una vez que el metronidazol ingresa al organismo por difusión pasiva y se activa en el citoplasma de las bacterias anaerobias susceptibles, se reduce; este proceso incluye proteínas de transporte de electrones intracelulares como la ferredoxina, la transferencia de un electrón al grupo nitro del metronidazol y la formación de un radical libre nitroso de vida corta. Debido a esta alteración de la molécula de metronidazol, se crea y mantiene un gradiente de concentración que favorece el transporte intracelular del fármaco. La forma reducida de metronidazol y los radicales libres pueden interactuar con el ADN, lo que provoca la inhibición de la síntesis y la degradación del ADN, lo que lleva a la muerte de la bacteria. El mecanismo de acción preciso del metronidazol no está claro.
Resistencia
Existe un potencial para el desarrollo de resistencia contra el metronidazol.
La resistencia puede deberse a múltiples mecanismos que incluyen la disminución de la captación del fármaco, la alteración de la eficiencia de reducción, la sobreexpresión de las bombas de expulsión, la inactivación del fármaco y/o el aumento de la reparación del daño del ADN.
Metronidazol no posee ninguna actividad clínicamente relevante contra anaerobios facultativos o aerobios obligados.
Actividad antimicrobiana
Se ha demostrado que el metronidazol es activo contra la mayoría de los aislamientos de las siguientes bacterias, tanto in vitro como en infecciones clínicas, como se describe en la sección INDICACIONES Y USO.
Anaerobios Gram-positivos
Especies de Clostridium Especies de Eubacterium Especies de Peptococcus Especies de Peptostreptococcus
Aerobios Gram-negativos
Grupo Bacteroides fragilis (B. fragilis, B. distasonis, B. ovatus, B. thetaiotaomicron, B. vulgatus) Especies de Fusobacterium
Parásitos protozoarios
Entamoeba histolytica Trichomonas vaginalis
Los siguientes datos in vitro están disponibles, pero se desconoce su significado clínico:
El metronidazol exhibe concentraciones inhibitorias mínimas (MIC) in vitro de 8 mcg/mL o menos contra la mayoría (≥ 90%) de los aislados de las siguientes bacterias; sin embargo, la seguridad y eficacia del metronidazol en el tratamiento de infecciones clínicas debidas a estas bacterias no se han establecido en ensayos clínicos adecuados y bien controlados.
Anaerobios Gram-negativos
Grupo Bacteroides fragilis (B. caccae, B. uniformis) Especies de Prevotella (P. bivia, P. buccae, P. disiens)
Pruebas de susceptibilidad
Para obtener información específica sobre los criterios interpretativos de las pruebas de susceptibilidad y los métodos de prueba asociados y los estándares de control de calidad reconocidos por la FDA para este medicamento, consulte: https://www.fda.gov/STIC.
INFORMACIÓN DEL PACIENTE
Interacción con el alcohol
Suspenda el consumo de bebidas alcohólicas o productos que contengan propilenglicol mientras toma FLAGYL 400 mg y durante al menos tres días después porque pueden presentarse calambres abdominales, náuseas, vómitos, dolores de cabeza y sofocos (ver CONTRAINDICACIONES y PRECAUCIONES , INTERACCIONES CON LA DROGAS ).
Tratamiento de infecciones bacterianas y parasitarias
Se debe advertir a los pacientes que FLAGYL 400 mg solo debe usarse para tratar infecciones bacterianas y parasitarias. FLAGYL 400mg no trata infecciones virales (p. ej., el resfriado común). Cuando se prescribe FLAGYL para tratar una infección bacteriana, se debe informar a los pacientes que, aunque es común que se sientan mejor al principio del tratamiento, el medicamento debe tomarse exactamente como se indica. Omitir dosis o no completar el curso completo de la terapia puede (1) disminuir la eficacia del tratamiento inmediato y (2) aumentar la probabilidad de que las bacterias desarrollen resistencia y no sean tratables con FLAGYL 400 mg en el futuro.
