Duricef 250mg, 500mg Cefadroxil Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Duricef y cómo se usa?
Duricef (cefadroxil) es un antibiótico de cefalosporina que se usa para tratar muchos tipos diferentes de infecciones causadas por bacterias. La marca Duricef está descontinuada y el cefadroxilo está disponible en forma genérica.
¿Cuáles son los efectos secundarios de Duricef?
Los efectos secundarios comunes de Duricef (cefadroxilo) incluyen:
- malestar estomacal o dolor,
- náuseas,
- vómitos,
- Diarrea,
- músculos rígidos o tensos,
- dolor en las articulaciones,
- sentirse inquieto o hiperactivo,
- sabor inusual o desagradable en la boca,
- picazón o sarpullido en la piel, o
- picazón o secreción vaginal.
Informe a su médico si tiene efectos secundarios poco probables pero muy graves de Duricef (cefadroxilo), que incluyen:
- náuseas o vómitos persistentes,
- ojos o piel amarillentos,
- orina oscura,
- nuevos signos de infección (p. ej., dolor de garganta persistente o fiebre),
- moretones o sangrado fácil,
- cambios en la cantidad de orina, o
- cambios mentales/anímicos (por ejemplo, confusión).
DESCRIPCIÓN
DURICEF (cefadroxilo) es un antibiótico cefalosporínico semisintético destinado a la administración oral. Es un polvo cristalino de color blanco a blanco amarillento. Es soluble en agua y estable a los ácidos. Se designa químicamente como ácido 5-tia-l-azabiciclo[4.2.0]oct-2-eno-2-carboxílico, 7-[[amino(4-hidroxifenil)acetil]amino]-3-metil-8-oxo -, monohidrato[6R- [6α,7β(R*)]]-. Tiene la fórmula C16H17N3O5S•H20 y el peso molecular de 381,40. Tiene la siguiente fórmula estructural:
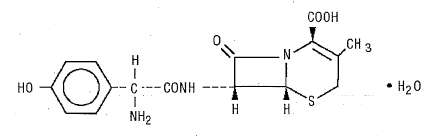
Los comprimidos recubiertos con película DURICEF (cefadroxil), 1 g, contienen los siguientes ingredientes inactivos: celulosa microcristalina, hidroxipropilmetilcelulosa, estearato de magnesio, polietilenglicol, polisorbato 80, emulsión de simeticona y dióxido de titanio.
DURICEF (cefadroxil) para suspensión oral contiene los siguientes ingredientes inactivos: FD&C Yellow No. 6, sabores (naturales y artificiales), polisorbato 80, benzoato de sodio, sacarosa y goma xantana.
Las cápsulas de DURICEF (cefadroxil) contienen los siguientes ingredientes inactivos: D&C Red No. 28, FD&C Blue No. 1, FD&C Red No. 40, gelatina, estearato de magnesio y dióxido de titanio.
INDICACIONES
DURICEF (cefadroxil) está indicado para el tratamiento de pacientes con infección causada por cepas sensibles de los organismos designados en las siguientes enfermedades:
Infecciones del tracto urinario causadas por E. coli; P. mirabilis y especies de Klebsiella.
Infecciones de la piel y estructuras cutáneas causadas por estafilococos y/o estreptococos.
Faringitis y/o amigdalitis causadas por Streptococcus pyogenes (Estreptococos beta-hemolíticos del grupo A).
Nota: Sólo la penicilina por vía intramuscular ha demostrado ser eficaz en la profilaxis de la fiebre reumática. DURICEF (cefadroxil) es generalmente eficaz en la erradicación de los estreptococos de la orofaringe. Sin embargo, no se dispone de datos que establezcan la eficacia de DURICEF (cefadroxilo) para la profilaxis de la fiebre reumática subsiguiente.
Nota: Las pruebas de cultivo y susceptibilidad deben iniciarse antes y durante la terapia. Se deben realizar estudios de función renal cuando esté indicado.
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de DURICEF (cefadroxil) y otros medicamentos antibacterianos, DURICEF (cefadroxil) debe usarse solo para tratar o prevenir infecciones que se haya comprobado o que se sospeche firmemente que son causadas por bacterias susceptibles. Cuando la información de cultivo y susceptibilidad esté disponible, se debe considerar al seleccionar o modificar la terapia antibacteriana. En ausencia de tales datos, la epidemiología local y los patrones de susceptibilidad pueden contribuir a la selección empírica de la terapia.
DOSIFICACIÓN Y ADMINISTRACIÓN
DURICEF (cefadroxilo) es ácido estable y puede administrarse por vía oral sin importar las comidas. La administración con alimentos puede ser útil para disminuir las molestias gastrointestinales potenciales ocasionalmente asociadas con la terapia con cefalosporinas orales.
Adultos
Infecciones del tracto urinario: Para infecciones del tracto urinario inferior no complicadas (es decir, cistitis), la dosis habitual es de 1 ó 2 g por día en dosis única (qd) o dividida (bid).
Para todas las demás infecciones del tracto urinario, la dosis habitual es de 2 g por día en dosis divididas (oferta).
Infecciones de la piel y estructura de la piel: Para infecciones de la piel y de la estructura de la piel, la dosis habitual es de 1 g por día en dosis únicas (qd) o divididas (bid).
Faringitis y Amigdalitis: Tratamiento de faringitis y amigdalitis por estreptococo beta-hemolítico del grupo A: 1 g por día en dosis única (qd) o dividida (bid) durante 10 días.
Niños
Para infecciones del tracto urinario, la dosis diaria recomendada para niños es de 30 mg/kg/día en dosis divididas cada 12 horas. Para faringitis, amigdalitis e impétigo, la dosis diaria recomendada para niños es de 30 mg/kg/día en una dosis única o en dosis divididas en partes iguales cada 12 horas. Para otras infecciones de la piel y de la estructura de la piel, la dosis diaria recomendada es de 30 mg/kg/día en dosis divididas por igual cada 12 horas. En el tratamiento de infecciones por estreptococos beta-hemolíticos, se debe administrar una dosis terapéutica de DURICEF (cefadroxilo) durante al menos 10 días.
Consulte la tabla para conocer la dosis diaria total para niños.
Insuficiencia renal
En pacientes con insuficiencia renal, la dosis de monohidrato de cefadroxilo debe ajustarse de acuerdo con las tasas de depuración de creatinina para evitar la acumulación del fármaco. Se sugiere el siguiente horario. En adultos, la dosis inicial es de 1000 mg de DURICEF (cefadroxilo) y la dosis de mantenimiento (basada en la tasa de depuración de creatinina [ml/min/1,73 M2]) es de 500 mg en los intervalos de tiempo que se indican a continuación.
Los pacientes con tasas de depuración de creatinina superiores a 50 ml/min pueden ser tratados como si fueran pacientes con función renal normal.
CÓMO SUMINISTRADO
DURICEF® (cefadroxil monohidrato, USP) 500 mg Cápsulas: cápsulas de gelatina dura, opacas, granates y blancas, impresas con "PPP" y "784" en un extremo y con "DURICEF (cefadroxil)" y "500 mg" en el otro extremo .
Las cápsulas se suministran de la siguiente manera:
N 0430-0780-19...................Botella de 50
Almacenar a temperatura ambiente controlada 15° - 30° C (59° - 86° F).
DURICEF® (cefadroxilo) Comprimidos de 1 gramo: de color blanco a blanquecino, bisecado en la parte superior, de forma ovalada, impreso con "PPP" en un lado de la bisección y "785" en el otro lado de la bisección. Las tabletas se suministran de la siguiente manera:
N 0430-0781-19...................Botella de 50
Almacenar a temperatura ambiente controlada 15° - 30° C (59° - 86° F).
DURICEF® (cefadroxilo) para suspensión oral tiene sabor a naranja y piña y se suministra de la siguiente manera:
250 mg/5 ml................................N 0430-2782-15 Botella de 50 ml
Antes de la reconstitución: almacenar a temperatura ambiente controlada de 15° a 30° C (59° a 86° F).
Fabricado por Bristol-Myers Squibb Co. Princeton, NJ 08543. Para Warner Chilcott Company, Inc. Fajardo, PR 00738. Comercializado por Warner Chilcott (US), Inc. Rockaway, NJ 07866. Revisado en abril de 2007. Fecha de revisión de la FDA: 6/ 5/2007EFECTOS SECUNDARIOS
Gastrointestinal
Los síntomas de la colitis pseudomembranosa pueden aparecer durante o después del tratamiento con antibióticos (ver ADVERTENCIAS ). En raras ocasiones se han notificado dispepsia, náuseas y vómitos. También se ha producido diarrea.
Hipersensibilidad
Se han observado alergias (en forma de erupción cutánea, urticaria, angioedema y prurito). Estas reacciones generalmente remitieron al suspender el fármaco. También se ha informado anafilaxia.
Otro
Otras reacciones han incluido disfunción hepática que incluye colestasis y elevaciones de la transaminasa sérica, prurito genital, moniliasis genital, vaginitis, neutropenia transitoria moderada, fiebre. Raramente se han informado agranulocitosis, trombocitopenia, insuficiencia hepática idiosincrásica, eritema multiforme, síndrome de Stevens-Johnson, enfermedad del suero y artralgia.
Además de las reacciones adversas enumeradas anteriormente que se observaron en pacientes tratados con cefadroxilo, se informaron las siguientes reacciones adversas y pruebas de laboratorio alteradas para antibióticos de la clase de las cefalosporinas:
Necrólisis epidérmica tóxica, dolor abdominal, sobreinfección, disfunción renal, nefropatía tóxica, anemia aplásica, anemia hemolítica, hemorragia, tiempo de protrombina prolongado, prueba de Coombs positiva, BUN elevado, creatinina elevada, fosfatasa alcalina elevada, aspartato aminotransferasa (AST) elevada alanina aminotransferasa (ALT), bilirrubina elevada, LDH elevada, eosinofilia, pancitopenia, neutropenia.
Se ha implicado a varias cefalosporinas en el desencadenamiento de convulsiones, particularmente en pacientes con insuficiencia renal, cuando no se redujo la dosis (ver DOSIS Y ADMINISTRACION y SOBREDOSIS ). Si se presentan convulsiones asociadas con la terapia con medicamentos, se debe suspender el medicamento. La terapia anticonvulsiva puede ser dada si está clínicamente indicada.
INTERACCIONES CON LA DROGAS
Interacciones entre medicamentos y pruebas de laboratorio
Se han informado pruebas de Coombs directas positivas durante el tratamiento con antibióticos de cefalosporina. En estudios hematológicos o en procedimientos transfusionales de compatibilidad cruzada cuando se realizan pruebas de antiglobulina en el lado menor o en la prueba de Coombs de recién nacidos cuyas madres han recibido antibióticos de cefalosporina antes del parto, se debe reconocer que una prueba de Coombs positiva puede deberse a la droga.
ADVERTENCIAS
ANTES DE INSTALAR LA TERAPIA CON DURICEF (cefadroxilo), SE DEBE REALIZAR UNA INVESTIGACIÓN CUIDADOSA PARA DETERMINAR SI EL PACIENTE HA TENIDO REACCIONES PREVIAS DE HIPERSENSIBILIDAD AL CEFADROXTL, CEFALOSPORINAS, PENICILINAS U OTROS MEDICAMENTOS. SI SE DA ESTE PRODUCTO A PACIENTES SENSIBLES A LA PENICILINA, SE DEBE TENER PRECAUCIÓN PORQUE LA SENSIBILIDAD CRUZADA ENTRE LOS ANTIBIÓTICOS BETA-LACTÁMICOS SE HA DOCUMENTADO CLARAMENTE Y PUEDE OCURRIR HASTA EN EL 10 % DE LOS PACIENTES CON ANTECEDENTES DE ALERGIA A LA PENICILINA.
SI OCURRE UNA REACCIÓN ALÉRGICA A DURIICEF (cefadroxilo), SUSPENDA EL MEDICAMENTO. LAS REACCIONES DE HIPERSENSIBILIDAD AGUDA SERIAS PUEDEN REQUERIR TRATAMIENTO CON EPINEFRINA Y OTRAS MEDIDAS DE EMERGENCIA, INCLUYENDO OXÍGENO, LÍQUIDOS INTRAVENOSOS, ANTIHISTAMÍNICOS INTRAVENOSOS, CORTICOSTEROIDES, AMINAS PRESORAS Y MANEJO DE LAS VÍAS AÉREAS, SEGÚN SE INDIQUE CLÍNICAMENTE.
Se ha informado diarrea asociada a Clostridium difficile (CDAD) con el uso de casi todos los agentes antibacterianos, incluido DURICEF (cefadroxil), y puede variar en gravedad desde diarrea leve hasta colitis fatal. El tratamiento con agentes antibacterianos altera la flora normal del colon y conduce al crecimiento excesivo de C. difficile.
C. difficile produce toxinas A y B que contribuyen al desarrollo de CD AD. Las cepas de C. difficile productoras de hipertoxina causan mayor morbilidad y mortalidad, ya que estas infecciones pueden ser refractarias a la terapia antimicrobiana y pueden requerir colectomía. CD AD debe considerarse en todos los pacientes que presentan diarrea después del uso de antibióticos. Es necesario un historial médico cuidadoso ya que se ha informado que la CD AD ocurre más de dos meses después de la administración de agentes antibacterianos.
Si se sospecha o se confirma CD AD, es posible que se deba suspender el uso continuo de antibióticos no dirigidos contra C. difficile. Se debe instituir el manejo adecuado de líquidos y electrolitos, la suplementación con proteínas, el tratamiento con antibióticos de C. difficile y la evaluación quirúrgica según esté clínicamente indicado.
PRECAUCIONES
General
DURICEF (cefadroxilo) debe usarse con precaución en presencia de insuficiencia renal marcada (tasa de depuración de creatinina de menos de 50 ml/min/1,73 M2). (Ver DOSIFICACIÓN Y ADMINISTRACIÓN .) En pacientes con insuficiencia renal conocida o sospechada, se debe realizar una cuidadosa observación clínica y estudios de laboratorio apropiados antes y durante la terapia.
Es poco probable que la prescripción de DURICEF (cefadroxil) en ausencia de una infección bacteriana comprobada o fuertemente sospechada o una indicación profiláctica brinde beneficios al paciente y aumente el riesgo de desarrollo de bacterias resistentes a los medicamentos.
El uso prolongado de DURICEF (cefadroxil) puede resultar en el crecimiento excesivo de organismos no susceptibles. La observación cuidadosa del paciente es esencial. Si se produce una superinfección durante el tratamiento, se deben tomar las medidas adecuadas.
DURICEF (cefadroxilo) debe prescribirse con precaución en personas con antecedentes de enfermedad gastrointestinal, en particular colitis.
Carcinogénesis, mutagénesis y alteración de la fertilidad
No se han realizado estudios a largo plazo para determinar el potencial carcinogénico. No se han realizado pruebas de toxicidad genética.
El embarazo: Embarazo Categoría B
Se han realizado estudios de reproducción en ratones y ratas a dosis de hasta 11 veces la dosis humana y no han revelado evidencia de alteración de la fertilidad o daño al feto debido al monohidrato de cefadroxilo. Sin embargo, no existen estudios adecuados y bien controlados en mujeres embarazadas. Debido a que los estudios de reproducción en animales no siempre predicen la respuesta humana, este medicamento debe usarse durante el embarazo solo si es claramente necesario.
Trabajo y entrega
DURICEF (cefadroxil) no ha sido estudiado para su uso durante el trabajo de parto y el parto. El tratamiento solo debe administrarse si es claramente necesario.
Madres lactantes
Se debe tener precaución cuando se administra monohidrato de cefadroxilo a una madre lactante.
Uso pediátrico
(Ver DOSIFICACIÓN Y ADMINISTRACIÓN. )
Uso geriátrico
De aproximadamente 650 pacientes que recibieron cefadroxilo para el tratamiento de infecciones del tracto urinario en tres ensayos clínicos, el 28 % tenía 60 años o más, mientras que el 16 % tenía 70 años o más. De aproximadamente 1,000 pacientes que recibieron cefadroxilo para el tratamiento de infecciones de la piel y la estructura de la piel en 14 ensayos clínicos, el 12 % tenía 60 años o más, mientras que el 4 % tenía 70 años o más. No se observaron diferencias generales en la seguridad entre los pacientes de edad avanzada en estos estudios y los pacientes más jóvenes. Estudios clínicos de cefadroxilo para el. el tratamiento de faringitis o amigdalitis no incluyó un número suficiente de pacientes de 65 años o más para determinar si responden de manera diferente a los pacientes más jóvenes. Otra experiencia clínica informada con cefadroxilo no ha identificado diferencias en las respuestas entre pacientes ancianos y jóvenes, pero no se puede descartar una mayor sensibilidad de algunas personas mayores.
El cefadroxilo se excreta sustancialmente por vía renal y está indicado el ajuste de la dosis en pacientes con insuficiencia renal (ver DOSIS Y ADMINISTRACIÓN: Insuficiencia Renal ). Debido a que es más probable que los pacientes de edad avanzada tengan una función renal disminuida, se debe tener cuidado en la selección de la dosis y puede ser útil monitorear la función renal.
SOBREDOSIS
Un estudio de niños menores de seis años sugirió que la ingestión de menos de 250 mg/kg de cefalosporinas no está asociada con resultados significativos. No se requiere ninguna acción más que el apoyo general y la observación. Para cantidades superiores a 250 mg/kg, induzca el vaciamiento gástrico.
En cinco pacientes anúricos, se demostró que un promedio del 63% de una dosis oral de 1 g se extrae del cuerpo durante una sesión de hemodiálisis de 6 a 8 horas.
CONTRAINDICACIONES
DURICEF (cefadroxilo) está contraindicado en pacientes con alergia conocida al grupo de antibióticos de las cefalosporinas.
FARMACOLOGÍA CLÍNICA
DURICEF (cefadroxilo) se absorbe rápidamente después de la administración oral. Luego de dosis únicas de 500 mg y 1000 mg, las concentraciones séricas máximas promedio fueron de aproximadamente 16 y 28 µg/mL, respectivamente. Los niveles mensurables estaban presentes 12 horas después de la administración. Más del 90% del fármaco se excreta sin cambios en la orina en 24 horas. Las concentraciones máximas en orina son de aproximadamente 1800 pg/mL durante el período posterior a una dosis oral única de 500 mg. Los aumentos en la dosis generalmente producen un aumento proporcional en la concentración urinaria de DURIICEF (cefadroxilo monohidrato, USP). La concentración de antibiótico en orina, después de una dosis de 1 g, se mantuvo muy por encima de la CMI de los patógenos urinarios susceptibles durante 20 a 22 horas.
Microbiología
Las pruebas in vitro demuestran que las cefalosporinas son bactericidas debido a su inhibición de la síntesis de la pared celular. Se ha demostrado que el cefadroxilo es activo frente a los siguientes organismos tanto in vitro como en infecciones clínicas (ver INDICACIONES ):
Estreptococos beta-hemolíticos Estafilococos, incluidas las cepas productoras de penicilinasa Streptococcus (Diplococcus) pneumoniae Escherichia coli Proteus mirabilis Especies de Klebsiella Moraxella (Branhamella) catarrhalis
Nota: La mayoría de las cepas de Entervcoccus faecalis (anteriormente Streptococcus faecalis) y Enterococcus faecium (anteriormente Streptococcus faecium) son resistentes a DURICEF (cefadroxilo). No es activo contra la mayoría de las cepas de especies de Enterobacter, Morganella morganii (anteriormente Proteus morganii) y P. vulgaris. No tiene actividad contra especies de Pseudomonas y Acinetobacter calcoaceticus (anteriormente especies de Mima y Herellea).
Pruebas de susceptibilidad: Técnicas de difusión
El uso de métodos de prueba de susceptibilidad de disco a antibióticos que miden el diámetro de la zona proporciona una estimación precisa de la susceptibilidad a los antibióticos. Uno de esos procedimientos estándar1 que se ha recomendado para usar con discos para probar la susceptibilidad de los organismos al cefadroxilo usa el disco de la clase de cefalosporina (cefalotina). La interpretación implica la correlación de los diámetros obtenidos en la prueba del disco con la concentración inhibitoria mínima (MIC) para cefadroxilo.
Los informes del laboratorio que dan los resultados de la prueba estándar de susceptibilidad de un solo disco con un disco de cefalotina de 30 µg deben interpretarse de acuerdo con los siguientes criterios:
Un informe de "Sensible" indica que es probable que el patógeno sea inhibido por los niveles sanguíneos generalmente alcanzables. Un informe de "susceptibilidad intermedia" sugiere que el organismo sería susceptible si se usan dosis altas o si la infección se limita a tejidos y fluidos (p. ej., orina) en los que se alcanzan niveles altos de antibióticos. Un informe de "resistente" indica que es poco probable que las concentraciones alcanzables del antibiótico sean inhibidoras y se debe seleccionar otra terapia.
Los procedimientos estandarizados requieren el uso de organismos de control de laboratorio. El disco de cefalotina de 30 µg debe dar los siguientes diámetros de zona:
Técnicas de dilución
Cuando se usa el método de dilución en agar o dilución en caldo (incluida la microdilución) del NCCLS2 o equivalente, un aislado bacteriano puede considerarse susceptible si el valor de MIC (concentración inhibitoria mínima) para la cefalotina es de 8 µg/mL o menos. Los organismos se consideran resistentes si la MIC es de 32 µg/ml o superior. Los organismos con un valor de MIC inferior a 32 µg/mL pero superior a 8 µg/mL son intermedios.
Al igual que con los métodos de difusión estándar, los procedimientos de dilución requieren el uso de organismos de control de laboratorio. El polvo de cefalotina estándar debe dar valores de MIC en el rango de 0,12 µg/mL y 0,5 µg/mL para Staphylococcus aureus ATCC 29213. Vox Escherichia coli ATCC 25922, el rango de MIC debe estar entre 4,0 µg/mL y 16,0 µg/mL. Para Streptococcus faecalis ATCC 29212, el rango de MIC debe estar entre 8,0 y 32,0 µg/mL.
REFERENCIAS @sesenta y cinco. Comité Nacional de Estándares de Laboratorio Clínico, Estándar Aprobado, Estándares de Desempeño para la Prueba de Susceptibilidad del Disco Antimicrobiano, 4ta Edición, vol. 10 (7): M2-A4, Villanova, PA, abril de 1990. @sesenta y cinco. Comité Nacional de Estándares de Laboratorio Clínico, Estándar Aprobado: Métodos para Pruebas de Susceptibilidad Antimicrobiana de Dilución para Bacterias que Crecen Aeróbicamente, 2da Edición, vol. 10 (8): M7-A2, Villanova, Pensilvania, abril de 1990.INFORMACIÓN DEL PACIENTE
Se debe advertir a los pacientes que los medicamentos antibacterianos, incluido DURICEF (cefadroxil), solo deben usarse para tratar infecciones bacterianas. No tratan infecciones virales (p. ej., el resfriado común). Cuando se prescribe DURICEF (cefadroxilo) para tratar una infección bacteriana, se debe informar a los pacientes que, aunque es común que se sientan mejor al principio del tratamiento, el medicamento debe tomarse exactamente como se indica. Omitir dosis o no completar el curso completo de la terapia puede (1) disminuir la eficacia del tratamiento inmediato y (2) aumentar la probabilidad de que las bacterias desarrollen resistencia y no sean tratables con DURICEF (cefadroxilo) u otros medicamentos antibacterianos en el futuro .
La diarrea es un problema común causado por los antibióticos que generalmente termina cuando se suspende el antibiótico. A veces, después de comenzar el tratamiento con antibióticos, los pacientes pueden desarrollar heces acuosas y sanguinolentas (con o sin calambres estomacales y fiebre) incluso dos o más meses después de haber tomado la última dosis del antibiótico. Si esto ocurre, los pacientes deben comunicarse con su médico lo antes posible.
