Biaxin 250mg, 500mg Clarithromycin Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Biaxin 500mg y cómo se usa?
Biaxin es un medicamento recetado que se usa para tratar los síntomas de muchas infecciones bacterianas diferentes, incluidas las úlceras estomacales y Helicobacter pylori. Biaxin puede usarse solo o con otros medicamentos.
Biaxin 500 mg es un antibiótico.
No se sabe si Biaxin es seguro y eficaz en niños menores de 6 meses de edad.
¿Cuáles son los posibles efectos secundarios de Biaxin 250mg?
Biaxin 500 mg puede causar efectos secundarios graves, que incluyen:
- dolor de estómago severo,
- diarrea que contiene sangre,
- latidos del corazón rápidos o fuertes,
- revoloteando en tu pecho,
- dificultad para respirar,
- mareo repentino,
- confusión,
- sensación de giro,
- pérdida de apetito,
- dolor de estómago superior,
- cansancio,
- orina oscura,
- taburete color arcilla,
- coloración amarillenta de los ojos y la piel (ictericia),
- poca o ninguna orina,
- hinchazón en los pies o los tobillos,
- sensación de cansancio,
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Biaxin incluyen:
- dolor de estómago,
- náuseas,
- vómitos,
- Diarrea,
- sabor inusual o desagradable en la boca,
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Biaxin. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
La claritromicina es un antimicrobiano macrólido semisintético para uso oral. Químicamente, es 6-0metileritromicina. La fórmula molecular es C38H69NO13 y el peso molecular es 747,96. La fórmula estructural es:
Figura 1: Estructura de Claritromicina
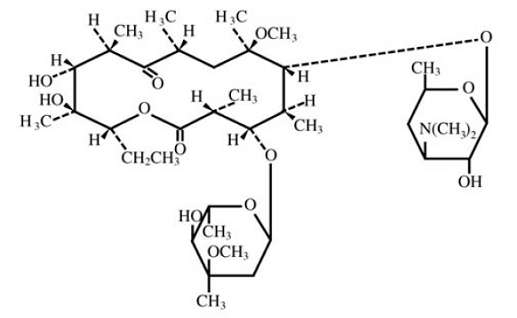
La claritromicina es un polvo cristalino de color blanco a blanquecino. Es soluble en acetona, ligeramente soluble en metanol, etanol y acetonitrilo, y prácticamente insoluble en agua.
BIAXIN está disponible como tabletas de liberación inmediata, tabletas de liberación prolongada y gránulos para suspensión oral.
Cada tableta ovalada amarilla de liberación inmediata de BIAXIN Filmtab (tabletas de claritromicina, USP) contiene 250 mg o 500 mg de claritromicina y los siguientes ingredientes inactivos:
- Comprimidos de 250 mg: hipromelosa, hidroxipropilcelulosa, croscarmelosa sódica, D&C Yellow No. 10, FD&C Blue No. 1, estearato de magnesio, celulosa microcristalina, povidona, almidón pregelatinizado, propilenglicol, dióxido de silicio, ácido sórbico, monooleato de sorbitán, ácido esteárico, talco, dióxido de titanio y vainillina.
- Comprimidos de 500 mg: hipromelosa, hidroxipropilcelulosa, dióxido de silicio coloidal, croscarmelosa sódica, D&C Yellow No. 10, estearato de magnesio, celulosa microcristalina, povidona, propilenglicol, ácido sórbico, monooleato de sorbitán, dióxido de titanio y vainillina.
Cada tableta amarilla ovalada recubierta con película de BIAXIN XL Filmtab (tabletas de liberación prolongada de claritromicina) contiene 500 mg de claritromicina y los siguientes ingredientes inactivos: polímeros celulósicos, D&C Yellow No. 10, lactosa monohidrato, estearato de magnesio, propilenglicol, ácido sórbico, sorbitán monooleato, talco, dióxido de titanio y vainillina.
Cada 5 ml de suspensión reconstituida de BIAXIN de 500 mg (claritromicina para suspensión oral, USP) contiene 125 mg o 250 mg de claritromicina. Cada frasco de gránulos de BIAXIN contiene 1250 mg (tamaño de 50 ml), 2500 mg (tamaños de 50 y 100 ml) o 5000 mg (tamaño de 100 ml) de claritromicina y los siguientes ingredientes inactivos: carbómero, aceite de ricino, ácido cítrico, ftalato de hipromelosa, maltodextrina, sorbato de potasio, povidona, dióxido de silicio, sacarosa, goma xantana, dióxido de titanio y sabor a ponche de frutas.
INDICACIONES
Exacerbación bacteriana aguda de la bronquitis crónica
BIAXIN (Filmtab, gránulos) y BIAXIN XL Filmtab están indicados en adultos para el tratamiento de infecciones leves a moderadas causadas por aislados susceptibles debido a Haemophilus influenzae, Haemophilus parainfluenzae, Moraxella catarrhalis o Streptococcus pneumoniae [ver INDICACIONES Y USO ].
Sinusitis maxilar aguda
BIAXIN (Filmtab, gránulos) y BIAXIN 500 mg XL Filmtab (en adultos) están indicados para el tratamiento de infecciones leves a moderadas causadas por aislados susceptibles debido a Haemophilus influenzae, Moraxella catarrhalis o Streptococcus pneumoniae [ver INDICACIONES Y USO ].
La comunidad adquirió neumonía
BIAXIN (Filmtab, Granules) y BIAXIN XL Filmtab están indicados [ver INDICACIONES Y USO ] para el tratamiento de infecciones leves a moderadas causadas por aislados susceptibles debido a:
- Haemophilus influenzae (en adultos)
- Haemophilus parainfluenzae (BIAXIN 500 mg XL Filmtab en adultos)
- Moraxella catarrhalis (BIAXIN 250mg XL Filmtab en adultos)
- Mycoplasma pneumoniae, Streptococcus pneumoniae, Chlamydophila pneumoniae (BIAXIN 500 mg XL Filmtab [en adultos]; BIAXIN Filmtab y BIAXIN Granules [en adultos y pacientes pediátricos])
Faringitis/Amigdalitis
BIAXIN 500mg Filmtab y BIAXIN 500mg Granules están indicados para el tratamiento de infecciones leves a moderadas causadas por aislados susceptibles debido a Streptococcus pyogenes como una alternativa en personas que no pueden usar la terapia de primera línea.
Infecciones no complicadas de la piel y de la estructura de la piel
BIAXIN Filmtab y BIAXIN Granules están indicados para el tratamiento de infecciones leves a moderadas causadas por aislados susceptibles debido a Staphylococcus aureus o Streptococcus pyogenes.
Otitis media aguda
BIAXIN Filmtab y BIAXIN 250mg Granules están indicados en pacientes pediátricos para el tratamiento de infecciones leves a moderadas causadas por aislados susceptibles debido a Haemophilus influenzae, Moraxella catarrhalis o Streptococcus pneumoniae [ver Estudios clínicos ].
Tratamiento y profilaxis de infecciones micobacterianas diseminadas
BIAXIN 500mg Filmtab y BIAXIN 250mg Granules están indicados para el tratamiento de infecciones leves a moderadas causadas por aislados sensibles debido a Mycobacterium avium o Mycobacterium intracellulare en pacientes con infección avanzada por VIH [ver Estudios clínicos ].
Infección por Helicobacter Pylori y enfermedad por úlcera duodenal
BIAXIN 250 mg Filmtab se administra en combinación con otros medicamentos en adultos como se describe a continuación para erradicar H. pylori. Se ha demostrado que la erradicación de H. pylori reduce el riesgo de recurrencia de la úlcera duodenal [ver Estudios clínicos ].
- BIAXIN Filmtab en combinación con amoxicilina y PREVACID (lansoprazol) o PRILOSEC (omeprazol) Cápsulas de liberación retardada, como terapia triple, está indicado para el tratamiento de pacientes con infección por H. pylori y enfermedad ulcerosa duodenal (activa o con cinco años de evolución duodenal). úlcera) para erradicar H. pylori.
- BIAXIN 250 mg Filmtab en combinación con PRILOSEC (omeprazol) en cápsulas está indicado para el tratamiento de pacientes con úlcera duodenal activa asociada con infección por H. pylori. Los regímenes que contienen BIAXIN 250 mg Filmtab como único agente antibacteriano tienen más probabilidades de estar asociados con el desarrollo de resistencia a la claritromicina entre los pacientes que fracasan en la terapia. Los regímenes que contienen claritromicina no deben usarse en pacientes con aislados resistentes a claritromicina conocidos o sospechados porque la eficacia del tratamiento se reduce en este contexto.
Limitaciones de uso
BIAXIN 500 mg XL Filmtab está indicado solo para la sinusitis maxilar aguda, la exacerbación bacteriana aguda de la bronquitis crónica y la neumonía adquirida en la comunidad en adultos. No se ha establecido la eficacia y seguridad de BIAXIN 500 mg XL Filmtab en el tratamiento de otras infecciones para las cuales BIAXIN Filmtab y BIAXIN Granules están aprobados.
Existe resistencia a los macrólidos en ciertas infecciones bacterianas causadas por Streptococcus pneumoniae y Staphylococcus aureus. Se deben realizar pruebas de susceptibilidad cuando esté clínicamente indicado.
Uso
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de BIAXIN y otros medicamentos antibacterianos, BIAXIN debe usarse solo para tratar o prevenir infecciones que se haya comprobado o que se sospeche firmemente que son causadas por bacterias susceptibles. Cuando la información de cultivo y susceptibilidad esté disponible, se debe considerar al seleccionar o modificar la terapia antibacteriana. En ausencia de tales datos, la epidemiología local y los patrones de susceptibilidad pueden contribuir a la selección empírica de la terapia.
DOSIFICACIÓN Y ADMINISTRACIÓN
Instrucciones de administración importantes
BIAXIN Filmtab y BIAXIN 250 mg Granulado se pueden administrar con o sin alimentos.
BIAXIN XL Filmtab debe tomarse con alimentos. Trague BIAXIN 500 mg XL Filmtab entero; no mastique, rompa ni triture BIAXIN 500 mg XL Filmtab.
Dosis para adultos
Las dosis recomendadas de BIAXIN 250 mg Filmtab y BIAXIN 250 mg XL Filmtab para el tratamiento de infecciones leves a moderadas en adultos se enumeran en la Tabla 1.
Regímenes de dosificación combinados para la infección por H. pylori
- Triple terapia: BIAXIN 500mg Filmtab/lansoprazol/amoxicilina La dosis recomendada para adultos es de 500 mg de BIAXIN, 500 mg de Filmtab, 30 mg de lansoprazol y 1 gramo de amoxicilina, todos administrados cada 12 horas durante 10 o 14 días [ver INDICACIONES Y USO y Estudios clínicos ].
- Triple terapia: BIAXIN Filmtab/omeprazol/amoxicilina La dosis recomendada para adultos es de 500 mg de BIAXIN, 250 mg de Filmtab, 20 mg de omeprazol y 1 gramo de amoxicilina; todos administrados cada 12 horas durante 10 días. En pacientes con una úlcera presente al momento de iniciar la terapia, se recomiendan 18 días adicionales de omeprazol 20 mg una vez al día para la curación de la úlcera y el alivio de los síntomas [ver INDICACIONES Y USO y Estudios clínicos ].
- Terapia dual: BIAXIN 500mg Filmtab/omeprazol La dosis recomendada para adultos es de 500 mg de BIAXIN, 250 mg de Filmtab administrados cada 8 horas y 40 mg de omeprazol administrados una vez por la mañana durante 14 días. Se recomiendan 14 días adicionales de omeprazol 20 mg una vez al día para la cicatrización de la úlcera y el alivio de los síntomas [ver INDICACIONES Y USO y Estudios clínicos ].
Dosis pediátrica
La dosis diaria recomendada es de 15 mg/kg/día repartidos cada 12 horas durante 10 días (hasta la dosis del adulto). Consulte los regímenes de dosificación para infecciones micobacterianas en pacientes pediátricos para obtener información adicional sobre la dosificación [ver Regímenes de dosificación para infecciones micobacterianas ].
Regímenes de dosificación para infecciones micobacterianas
Para el tratamiento de la infección diseminada debida al complejo Mycobacterium avium (MAC), se recomiendan BIAXIN Filmtab y BIAXIN 500mg Granules como agentes primarios. BIAXIN Filmtab y BIAXIN Granules deben usarse en combinación con otros medicamentos antimicobacterianos (p. ej., etambutol) que hayan mostrado actividad in vitro contra MAC o beneficio clínico en el tratamiento de MAC [ver Estudios clínicos ].
Pacientes adultos
Para el tratamiento y profilaxis de infecciones micobacterianas en adultos, la dosis recomendada de BIAXIN es de 500 mg cada 12 horas.
Pacientes pediátricos
Para el tratamiento y profilaxis de infecciones micobacterianas en pacientes pediátricos, la dosis recomendada es de 7,5 mg/kg cada 12 horas hasta 500 mg cada 12 horas. [Ver Uso en poblaciones específicas y Estudios clínicos ].
La terapia con BIAXIN 250 mg debe continuar si se observa una respuesta clínica. BIAXIN puede interrumpirse cuando se considere que el paciente tiene un riesgo bajo de infección diseminada.
Ajuste de dosis en pacientes con insuficiencia renal
Consulte la Tabla 2 para conocer el ajuste de dosis en pacientes con insuficiencia renal moderada o grave con o sin regímenes concomitantes que contienen atazanavir o ritonavir [ver INTERACCIONES CON LA DROGAS ].
Ajuste de dosis debido a interacciones farmacológicas
Disminuya la dosis de BIAXIN 500 mg en un 50 % cuando se administre junto con atazanavir [ver INTERACCIONES CON LA DROGAS ]. Es posible que se recomienden ajustes de dosis para otros medicamentos cuando se coadministran con BIAXIN 250 mg debido a interacciones farmacológicas [ver INTERACCIONES CON LA DROGAS ].
Reconstitución de gránulos de BIAXIN
Los gránulos de 250 mg de BIAXIN suministrados deben reconstituirse con agua antes de la administración de BIAXIN para suspensión oral. La Tabla 3 a continuación indica el volumen de agua que debe agregarse al reconstituir. Para reconstituir:
Agítese bien antes de cada uso. Después de mezclar, almacene a una temperatura de 15° a 30°C (59° a 86°F) y utilícelo dentro de los 14 días. No refrigere.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
BIAXIN 500 mg está disponible como:
- BIAXIN 250 mg Filmtab (comprimido recubierto con película ovalado amarillo):
- 250 mg: impreso en azul con el logo “a” y KT
- 500 mg: grabado con el logotipo "a" en un lado y KL en el lado opuesto
- BIAXIN XL Filmtab (tableta amarilla ovalada recubierta con película de liberación prolongada):
- 500 mg: grabado con el logotipo "a" y KJ
- Gránulos de BIAXIN (gránulos de color blanco a blanquecino antes de la reconstitución; suspensión opaca de color blanco a blanquecino después de la reconstitución):
- Concentración de 125 mg/5 ml disponible en frascos de 50 ml y 100 ml
- Concentración de 250 mg/5 ml disponible en frascos de 50 ml y 100 ml
Almacenamiento y manipulación
BIAXIN 250 mg Filmtab (tabletas de claritromicina, USP) se presenta en forma de comprimidos recubiertos con película ovalados de color amarillo en los siguientes tamaños de envase: comprimidos de 250 mg: (impresos en azul con el logotipo “a” y KT)
Botellas de 60 ( CDN 0074-3368-60) y paquetes de tiras de dosis unitaria de 100 ( CDN 0074-3368-11).
Guarde BIAXIN Filmtab 250 mg a temperatura ambiente controlada de 15° a 30°C (59° a 86°F) en un recipiente bien cerrado. Proteger de la luz.
comprimidos de 500mg : (grabado con el logotipo "a" en un lado y KL en el lado opuesto)
Frascos de 60 (NDC 0074-2586-60) y tiras monodosis de 100 ( CDN 0074-2586-11).
Guarde BIAXIN Filmtab 500 mg a temperatura ambiente controlada de 20° a 25°C (68° a 77°F) en un recipiente bien cerrado.
BIAXIN XL Filmtab (tabletas de liberación prolongada de claritromicina) se presenta en forma de comprimidos recubiertos con película ovalados de color amarillo en los siguientes tamaños de envase:
comprimidos de 500mg : (grabado con el logo “a” y KJ)
Frascos de 60 (NDC 0074-3165-60), paquetes de tiras de dosis unitaria de 100 ( CDN 0074-3165-11), y BIAXIN XL PAC caja de 4 blisters de 14 comprimidos cada uno ( CDN 0074-3165-41).
Guarde BIAXIN 500mg XL Filmtab a una temperatura de 20° a 25°C (68° a 77°F). Excursiones permitidas a 15° a 30°C (59° a 86°F). [Ver Temperatura ambiente controlada por USP .]
BIAXIN 500mg Granules (claritromicina para suspensión oral, USP) se suministra como gránulos de color blanco a blanquecino en las siguientes concentraciones y tamaños:
Guarde los gránulos de BIAXIN de 500 mg por debajo de los 25 °C (77 °F) en un recipiente bien cerrado. No refrigere los gránulos reconstituidos de BIAXIN 500 mg.
BIAXIN Filmtab 250 mg y 500 mg y BIAXIN 250 mg XL Filmtab 500 mg Mfd. por AbbVie LTD, Barceloneta, PR 00617. BIAXIN Gránulos, 125 mg/5 mL y 250 mg/5 mL Mfd. por AbbVie Inc., North Chicago, IL 60064 Para AbbVie Inc., North Chicago, IL 60064, EE. UU. Revisado: noviembre de 2018.
EFECTOS SECUNDARIOS
Las siguientes reacciones adversas graves se describen a continuación y en otras partes de la etiqueta:
- Reacciones de hipersensibilidad aguda [ver ADVERTENCIAS Y PRECAUCIONES ]
- Prolongación QT [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hepatotoxicidad [ver ADVERTENCIAS Y PRECAUCIONES ]
- Reacciones adversas graves debidas al uso concomitante con otros medicamentos [ver ADVERTENCIAS Y PRECAUCIONES ]
- Diarrea asociada a Clostridium difficile [ver ADVERTENCIAS Y PRECAUCIONES ]
- Exacerbación de la miastenia grave [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los estudios clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los estudios clínicos de un fármaco no pueden compararse directamente con las tasas de los estudios clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Sobre la base de los datos agrupados de todas las indicaciones, las reacciones adversas más frecuentes observadas en los ensayos clínicos, tanto en la población adulta como en la pediátrica, son dolor abdominal, diarrea, náuseas, vómitos y disgeusia. También se informaron dispepsia, prueba de función hepática anormal, reacción anafiláctica, candidiasis, dolor de cabeza, insomnio y erupción cutánea.
Las subsecciones siguientes enumeran las reacciones adversas más comunes para la profilaxis y el tratamiento de las infecciones micobacterianas y la úlcera duodenal asociadas con la infección por H. pylori. En general, estos perfiles son consistentes con los datos agrupados descritos anteriormente.
Profilaxis de infecciones micobacterianas
En pacientes con SIDA tratados con BIAXIN durante largos períodos de tiempo para la profilaxis contra M. avium, a menudo fue difícil distinguir las reacciones adversas posiblemente asociadas con la administración de BIAXIN de una enfermedad subyacente por VIH o una enfermedad intercurrente. La mediana de duración del tratamiento fue de 10,6 meses para el grupo de BIAXIN y de 8,2 meses para el grupo de placebo.
Cambios en los valores de laboratorio
En la Tabla 5 se presentan experiencias adversas de laboratorio seleccionadas que se informaron durante la terapia en más del 2 % de los pacientes adultos tratados con BIAXIN en un ensayo clínico aleatorizado doble ciego que involucró a 682 pacientes.
En pacientes inmunocomprometidos que recibían profilaxis contra M. avium, las evaluaciones de los valores de laboratorio se realizaron analizando aquellos valores fuera del valor gravemente anormal (es decir, el límite extremo alto o bajo) para la prueba especificada.
Tratamiento de infecciones micobacterianas
Los perfiles de reacciones adversas para los regímenes de dosis de 500 mg y 1000 mg dos veces al día fueron similares.
En pacientes con SIDA y otros pacientes inmunocomprometidos tratados con dosis más altas de BIAXIN durante largos períodos de tiempo por infecciones micobacterianas, a menudo fue difícil distinguir las reacciones adversas posiblemente asociadas con la administración de 250 mg de BIAXIN de los signos subyacentes de la enfermedad por VIH o una enfermedad intercurrente.
El siguiente análisis resume la experiencia durante las primeras 12 semanas de tratamiento con BIAXIN. Los datos se informan por separado para el ensayo 1 (aleatorizado, doble ciego) y el ensayo 2 (uso compasivo, abierto) y también combinados. Las reacciones adversas se informaron con menos frecuencia en el ensayo 2, lo que puede deberse en parte a las diferencias en el seguimiento entre los dos estudios.
En pacientes adultos que reciben BIAXIN 500 mg dos veces al día, las reacciones adversas notificadas con mayor frecuencia, consideradas posible o posiblemente relacionadas con el fármaco del estudio, con una incidencia del 5 % o mayor, se enumeran a continuación (Tabla 6). Aproximadamente el 8 % de los pacientes que recibieron 500 mg dos veces al día y el 12 % de los pacientes que recibieron 1000 mg dos veces al día interrumpieron el tratamiento debido a reacciones adversas relacionadas con el fármaco durante las primeras 12 semanas de tratamiento; Las reacciones adversas que llevaron a la interrupción en al menos 2 pacientes incluyeron náuseas, vómitos, dolor abdominal, diarrea, erupción cutánea y astenia.
Un número limitado de pacientes pediátricos con SIDA han sido tratados con suspensión de BIAXIN para infecciones micobacterianas. Las reacciones adversas notificadas con mayor frecuencia, excluyendo aquellas debidas a las condiciones concurrentes del paciente, fueron consistentes con las observadas en pacientes adultos.
Cambios en los valores de laboratorio
En las primeras 12 semanas de comenzar con BIAXIN 500 mg dos veces al día, el 3 % de los pacientes tiene aumentos de SGOT y el 2 % de los pacientes tiene aumentos de SGPT > 5 veces el límite superior normal en el ensayo 2 (469 pacientes adultos incluidos), mientras que el ensayo 1 (154 pacientes inscritos) no tenían elevación de transaminasas. Esto incluye solo a pacientes con valores basales dentro del rango normal o en el límite bajo.
Úlcera duodenal asociada con infección por H. pylori
En los ensayos clínicos que utilizan la terapia combinada con BIAXIN 500 mg más omeprazol y amoxicilina, no se observaron reacciones adversas específicas de la combinación de estos medicamentos. Las reacciones adversas que han ocurrido se han limitado a las que se informaron previamente con BIAXIN 250 mg, omeprazol o amoxicilina.
Los perfiles de reacciones adversas se muestran a continuación (Tabla 7) para cuatro ensayos clínicos aleatorizados doble ciego en los que los pacientes recibieron la combinación de BIAXIN 500 mg tres veces al día y omeprazol 40 mg al día durante 14 días, seguido de omeprazol 20 mg una vez al día. día, (tres estudios) o 40 mg una vez al día (un estudio) durante 14 días adicionales. De los 346 pacientes que recibieron la combinación, el 3,5 % de los pacientes suspendió el fármaco debido a reacciones adversas.
Cambios en los valores de laboratorio
Los cambios en los valores de laboratorio con posible significado clínico en pacientes que toman BIAXIN y omeprazol en cuatro ensayos aleatorios doble ciego en 945 pacientes son los siguientes:
Hepático bilirrubina directa elevada
Reacciones adversas menos frecuentes observadas durante los ensayos clínicos de claritromicina
Según los datos combinados de todas las indicaciones, se observaron las siguientes reacciones adversas en ensayos clínicos con claritromicina a una tasa inferior al 1 %:
Trastornos de la sangre y del sistema linfático: Leucopenia, neutropenia, trombocitemia, eosinofilia
Trastornos cardíacos: Electrocardiograma QT prolongado, paro cardíaco, fibrilación auricular, extrasístoles, palpitaciones
Trastornos del oído y del laberinto: Vértigo, tinnitus, problemas de audición
Desórdenes gastrointestinales: Estomatitis, glositis, esofagitis, enfermedad por reflujo gastroesofágico, gastritis, proctalgia, distensión abdominal, estreñimiento, boca seca, eructos, flatulencia
Desordenes generales y condiciones administrativas del sitio: Malestar, pirexia, astenia, dolor torácico, escalofríos, fatiga
Trastornos hepatobiliares: Colestasis, hepatitis
Trastornos del sistema inmunológico: Hipersensibilidad
Infecciones e infestaciones: Celulitis, gastroenteritis, infección, infección vaginal
Investigaciones: Aumento de la bilirrubina en sangre, aumento de la fosfatasa alcalina en sangre, aumento de la lactato deshidrogenasa en sangre, proporción anormal de albúmina y globulina
Trastornos del metabolismo y la nutrición: Anorexia, disminución del apetito
Trastornos musculoesqueléticos y del tejido conjuntivo: Mialgia, espasmos musculares, rigidez de nuca
Trastornos del sistema nervioso: Mareos, temblores, pérdida del conocimiento, discinesia, somnolencia
Desórdenes psiquiátricos: Ansiedad, nerviosismo
Trastornos renales y urinarios: Aumento de la creatinina en sangre, aumento de la urea en sangre
Trastornos respiratorios, torácicos y mediastínicos: Asma, epistaxis, embolismo pulmonar
Trastornos de la piel y del tejido subcutáneo: Urticaria, dermatitis ampollosa, prurito, hiperhidrosis, exantema maculopapular
Reacciones adversas gastrointestinales
En los estudios de exacerbación aguda de bronquitis crónica y sinusitis maxilar aguda, se informaron reacciones adversas gastrointestinales generales en una proporción similar de pacientes que tomaban BIAXIN 250 mg Filmtab o BIAXIN 500 mg XL Filmtab; sin embargo, los pacientes que tomaron BIAXIN 500 mg XL Filmtab informaron síntomas gastrointestinales significativamente menos graves en comparación con los pacientes que tomaron BIAXIN 250 mg Filmtab. Además, los pacientes que tomaron BIAXIN 500 mg XL Filmtab tuvieron significativamente menos interrupciones prematuras por reacciones adversas gastrointestinales o de sabor anormal relacionadas con el medicamento en comparación con BIAXIN Filmtab.
Mortalidad por todas las causas en pacientes con enfermedad de las arterias coronarias de 1 a 10 años después de la exposición a BIAXIN
En un ensayo clínico que evaluó el tratamiento con claritromicina sobre los resultados en pacientes con enfermedad arterial coronaria, se observó un aumento en el riesgo de mortalidad por todas las causas en pacientes aleatorizados a claritromicina. La claritromicina para el tratamiento de la enfermedad arterial coronaria no es una indicación aprobada. Los pacientes fueron tratados con claritromicina o placebo durante 14 días y se observaron los eventos de resultados primarios (p. ej., mortalidad por cualquier causa o eventos cardíacos no fatales) durante varios años.1 Se observó un número numéricamente mayor de eventos de resultados primarios en pacientes asignados al azar para recibir claritromicina. observado con un cociente de riesgos instantáneos de 1,06 (intervalo de confianza del 95 %: 0,98 a 1,14). Sin embargo, en el seguimiento de 10 años después del tratamiento, hubo 866 (40 %) muertes en el grupo de claritromicina y 815 (37 %) muertes en el grupo de placebo, lo que representó un cociente de riesgos instantáneos para la mortalidad por todas las causas de 1,10 (95 % intervalo de confianza de 1,00 a 1,21). La diferencia en el número de muertes surgió después de un año o más después del final del tratamiento.
No se ha establecido la causa de la diferencia en la mortalidad por todas las causas. Otros estudios epidemiológicos que evalúan este riesgo han mostrado resultados variables [ver ADVERTENCIAS Y PRECAUCIONES ].
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de BIAXIN. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Sangre y sistema linfático: Trombocitopenia, agranulocitosis
Cardíaco: Arritmia ventricular, taquicardia ventricular, torsades de pointes
Oído y laberinto: La sordera se informó principalmente en mujeres de edad avanzada y generalmente fue reversible.
Gastrointestinal: Se informó pancreatitis aguda, decoloración de la lengua, decoloración de los dientes y generalmente fue reversible con una limpieza profesional al suspender el medicamento.
Ha habido informes de BIAXIN 250 mg XL Filmtab en las heces, muchos de los cuales han ocurrido en pacientes con trastornos gastrointestinales anatómicos (incluidas ileostomía o colostomía) o funcionales con tiempos de tránsito GI reducidos. En varios informes, se han producido residuos de tabletas en el contexto de la diarrea. Se recomienda que los pacientes que experimenten residuos de tabletas en las heces y no mejoren en su condición deben cambiar a una formulación diferente de claritromicina (p. ej., suspensión) u otro fármaco antibacteriano.
hepatobiliar: Insuficiencia hepática, ictericia hepatocelular. Se han informado reacciones adversas relacionadas con la disfunción hepática con claritromicina [ver ADVERTENCIAS Y PRECAUCIONES ].
Infecciones e infestaciones: Colitis pseudomembranosa [ver ADVERTENCIAS Y PRECAUCIONES ]
Sistema inmunitario: Reacciones anafilácticas, angioedema
Investigaciones: Prolongación del tiempo de protrombina, disminución del recuento de glóbulos blancos, aumento del índice internacional normalizado. Se ha informado color anormal de la orina, asociado con insuficiencia hepática.
Metabolismo y Nutrición: Se ha informado hipoglucemia en pacientes que toman agentes hipoglucemiantes orales o insulina.
Tejido musculoesquelético y conectivo: Se notificó rabdomiólisis por miopatía y, en algunos de los informes, se administró claritromicina de forma concomitante con estatinas, fibratos, colchicina o alopurinol [ver CONTRAINDICACIONES y ADVERTENCIAS Y PRECAUCIONES ].
Sistema nervioso: Parosmia, anosmia, ageusia, parestesia y convulsiones
Psiquiátrico: Comportamiento anormal, estado confusional, despersonalización, desorientación, alucinaciones, depresión, comportamiento maníaco, sueño anormal, trastorno psicótico. Estos trastornos generalmente se resuelven al suspender el fármaco.
Renal y Urinario: Nefritis intersticial, insuficiencia renal
Piel y Tejido Subcutáneo: Síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, erupción medicamentosa con eosinofilia y síntomas sistémicos (DRESS), púrpura de Henoch-Schonlein, acné, pustulosis exantemática aguda generalizada
Vascular: Hemorragia
INTERACCIONES CON LA DROGAS
Se sabe que la coadministración de BIAXIN 250 mg inhibe el CYP3A, y un fármaco metabolizado principalmente por CYP3A puede estar asociado con elevaciones en las concentraciones del fármaco que podrían aumentar o prolongar los efectos terapéuticos y adversos del fármaco concomitante.
BIAXIN debe usarse con precaución en pacientes que reciben tratamiento con otros medicamentos que se sabe que son sustratos de la enzima CYP3A, especialmente si el sustrato de CYP3A tiene un margen de seguridad estrecho (p. ej., carbamazepina) y/o el sustrato es metabolizado extensamente por esta enzima. Ajuste la dosis cuando sea apropiado y controle de cerca las concentraciones séricas de fármacos metabolizados principalmente por CYP3A en pacientes que reciben claritromicina al mismo tiempo.
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Reacciones de hipersensibilidad aguda
En caso de reacciones graves de hipersensibilidad aguda, como anafilaxia, síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, erupción medicamentosa con eosinofilia y síntomas sistémicos (DRESS), púrpura de Henoch-Schonlein y pustulosis exantemática generalizada aguda, suspenda el tratamiento con BIAXIN 250 mg inmediatamente y instaurar un tratamiento adecuado.
Prolongación QT
BIAXIN 500 mg se ha asociado con la prolongación del intervalo QT y casos poco frecuentes de arritmia. Se informaron espontáneamente casos de torsades de pointes durante la vigilancia posterior a la comercialización en pacientes que recibieron BIAXIN. Se han reportado muertes.
Evite BIAXIN en los siguientes pacientes:
- pacientes con prolongación conocida del intervalo QT, arritmia cardiaca ventricular, incluyendo torsades de pointes
- pacientes que reciben medicamentos que se sabe que prolongan el intervalo QT [ver también CONTRAINDICACIONES ]
- pacientes con condiciones proarrítmicas en curso, como hipopotasemia o hipomagnesemia no corregidas, bradicardia clínicamente significativa y en pacientes que reciben agentes antiarrítmicos de Clase IA (p. ej., quinidina, procainamida, disopiramida) o Clase III (p. ej., dofetilida, amiodarona, sotalol).
Los pacientes de edad avanzada pueden ser más susceptibles a los efectos asociados al fármaco en el intervalo QT [ver Uso en poblaciones específicas ].
hepatotoxicidad
Con claritromicina se ha informado disfunción hepática, incluido aumento de las enzimas hepáticas y hepatitis hepatocelular y/o colestásica, con o sin ictericia. Esta disfunción hepática puede ser grave y suele ser reversible. En algunos casos, se ha informado insuficiencia hepática con desenlace fatal y, en general, se ha asociado con enfermedades subyacentes graves y/o medicamentos concomitantes. Los síntomas de la hepatitis pueden incluir anorexia, ictericia, orina oscura, prurito o dolor en el abdomen. Suspender BIAXIN 500 mg inmediatamente si se presentan signos y síntomas de hepatitis.
Reacciones adversas graves debidas al uso concomitante con otros medicamentos
Fármacos metabolizados por CYP3A4
Se han informado reacciones adversas graves en pacientes que toman BIAXIN de forma concomitante con sustratos de CYP3A4. Estos incluyen toxicidad de colchicina con colchicina; rabdomiólisis con simvastatina, lovastatina y atorvastatina; hipoglucemia y arritmias cardíacas (p. ej., torsades de pointes) con disopiramida; hipotensión y lesión renal aguda con bloqueadores de los canales de calcio metabolizados por CYP3A4 (p. ej., verapamilo, amlodipina, diltiazem, nifedipina). La mayoría de los informes de lesión renal aguda con bloqueadores de los canales de calcio metabolizados por CYP3A4 involucraron a pacientes de edad avanzada de 65 años o más. Use BIAXIN 500 mg con precaución cuando se administre junto con medicamentos que inducen la enzima citocromo CYP3A4. Está contraindicado el uso de BIAXIN 250 mg con simvastatina, lovastatina, ergotamina o dihidroergotamina [ver CONTRAINDICACIONES y INTERACCIONES CON LA DROGAS ].
colchicina
Se han informado interacciones farmacológicas mortales y potencialmente mortales en pacientes tratados con BIAXIN y colchicina. La claritromicina es un inhibidor fuerte de CYP3A4 y esta interacción puede ocurrir mientras se usan ambos medicamentos en las dosis recomendadas. Si es necesaria la coadministración de BIAXIN y colchicina en pacientes con función renal y hepática normal, reduzca la dosis de colchicina. Vigilar a los pacientes en busca de síntomas clínicos de toxicidad por colchicina. La administración concomitante de BIAXIN 500 mg y colchicina está contraindicada en pacientes con insuficiencia renal o hepática [ver CONTRAINDICACIONES y INTERACCIONES CON LA DROGAS ].
Inhibidores de la HMG-CoA reductasa (estatinas)
El uso concomitante de BIAXIN con lovastatina o simvastatina está contraindicado [ver CONTRAINDICACIONES ya que estas estatinas son ampliamente metabolizadas por CYP3A4, y el tratamiento concomitante con BIAXIN aumenta su concentración plasmática, lo que aumenta el riesgo de miopatía, incluida la rabdomiolisis. Se han notificado casos de rabdomiólisis en pacientes que toman BIAXIN de forma concomitante con estas estatinas. Si no se puede evitar el tratamiento con BIAXIN, se debe suspender la terapia con lovastatina o simvastatina durante el curso del tratamiento.
Tenga cuidado al prescribir BIAXIN 250 mg con atorvastatina o pravastatina. En situaciones en las que no se pueda evitar el uso concomitante de BIAXIN con atorvastatina o pravastatina, la dosis de atorvastatina no debe exceder los 20 mg diarios y la dosis de pravastatina no debe exceder los 40 mg diarios. Se puede considerar el uso de una estatina que no dependa del metabolismo de CYP3A (p. ej., fluvastatina). Se recomienda prescribir la dosis más baja registrada si no se puede evitar el uso concomitante.
Agentes hipoglucemiantes orales/insulina
El uso concomitante de BIAXIN 500 mg y agentes hipoglucemiantes orales y/o insulina puede provocar una hipoglucemia significativa. Con ciertos medicamentos hipoglucemiantes como nateglinida, pioglitazona, repaglinida y rosiglitazona, la inhibición de la enzima CYP3A por claritromicina puede estar involucrada y podría causar hipoglucemia cuando se usan concomitantemente. Se recomienda un control cuidadoso de la glucosa [ver INTERACCIONES CON LA DROGAS ].
quetiapina
Use quetiapina y claritromicina concomitantemente con precaución. La administración concomitante podría provocar un aumento de la exposición a la quetiapina y toxicidades relacionadas con la quetiapina, como somnolencia, hipotensión ortostática, alteración del estado de conciencia, síndrome neuroléptico maligno y prolongación del intervalo QT. Consulte la información de prescripción de quetiapina para obtener recomendaciones sobre la reducción de la dosis si se administra junto con inhibidores de CYP3A4 como claritromicina [ver INTERACCIONES CON LA DROGAS ].
Anticoagulantes orales
Existe el riesgo de hemorragia grave y elevaciones significativas en el INR y el tiempo de protrombina cuando se administra BIAXIN junto con warfarina. Monitoree el INR y los tiempos de protrombina con frecuencia mientras los pacientes reciben BIAXIN y anticoagulantes orales al mismo tiempo [ver INTERACCIONES CON LA DROGAS ].
Benzodiazepinas
Se ha informado un aumento de la sedación y la prolongación de la sedación con la administración concomitante de BIAXIN 250 mg y triazolobenzodiazepinas, como triazolam y midazolam [ver INTERACCIONES CON LA DROGAS ].
Mortalidad por todas las causas en pacientes con enfermedad de las arterias coronarias de 1 a 10 años después de la exposición a BIAXIN
En un ensayo clínico que evaluó el tratamiento con claritromicina sobre los resultados en pacientes con enfermedad de las arterias coronarias, se observó un aumento en el riesgo de mortalidad por todas las causas un año o más después de finalizar el tratamiento en pacientes aleatorizados para recibir claritromicina.1 Claritromicina para el tratamiento de la enfermedad coronaria la enfermedad arterial no es una indicación aprobada. No se ha establecido la causa del aumento del riesgo. Otros estudios epidemiológicos que evalúan este riesgo han mostrado resultados variables [ver REACCIONES ADVERSAS ]. Considere equilibrar este riesgo potencial con los beneficios del tratamiento cuando prescriba BIAXIN en pacientes con sospecha o confirmación de enfermedad de las arterias coronarias.
Diarrea asociada a Clostridium difficile
Se ha informado diarrea asociada a Clostridium difficile (CDAD) con el uso de casi todos los agentes antibacterianos, incluido BIAXIN, y puede variar en gravedad desde diarrea leve hasta colitis fatal. El tratamiento con agentes antibacterianos altera la flora normal del colon y conduce al crecimiento excesivo de C. difficile.
C. difficile produce toxinas A y B que contribuyen al desarrollo de CDAD. Las cepas de C. difficile productoras de hipertoxina causan mayor morbilidad y mortalidad, ya que estas infecciones pueden ser refractarias a la terapia antimicrobiana y pueden requerir colectomía. Se debe considerar CDAD en todos los pacientes que presenten diarrea después del uso de antibacterianos. Es necesaria una cuidadosa historia clínica ya que se ha informado que la CDAD ocurre más de dos meses después de la administración de agentes antibacterianos.
Si se sospecha o se confirma CDAD, es posible que se deba suspender el uso continuo de antibacterianos no dirigidos contra C. difficile. Se debe instituir el manejo apropiado de líquidos y electrolitos, suplementos de proteínas, tratamiento antibacteriano de C. difficile y evaluación quirúrgica según esté clínicamente indicado.
Toxicidad embriofetal
La claritromicina no debe utilizarse en mujeres embarazadas, excepto en circunstancias clínicas en las que no sea adecuada una terapia alternativa. Si se usa BIAXIN 500 mg durante el embarazo, o si ocurre un embarazo mientras la paciente toma este medicamento, se debe informar a la paciente sobre el peligro potencial para el feto. La claritromicina ha demostrado efectos adversos sobre el resultado del embarazo y/o el desarrollo embriofetal en monos, ratas, ratones y conejos en dosis que produjeron niveles plasmáticos de 2 a 17 veces los niveles séricos alcanzados en humanos tratados con las dosis máximas recomendadas para humanos [ver Uso en poblaciones específicas ].
Exacerbación de la miastenia grave
Se ha informado la exacerbación de los síntomas de la miastenia gravis y la aparición de nuevos síntomas del síndrome miasténico en pacientes que reciben terapia con 250 mg de BIAXIN.
Desarrollo de bacterias resistentes a los medicamentos
Prescribir BIAXIN en ausencia de una infección bacteriana comprobada o fuertemente sospechada o una indicación profiláctica es poco probable que brinde beneficios al paciente y aumenta el riesgo de desarrollo de bacterias resistentes a los medicamentos.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Se han realizado las siguientes pruebas de mutagenicidad in vitro con claritromicina:
- Prueba de Salmonella/Microsomas de Mamíferos
- Prueba de frecuencia de mutación inducida por bacterias
- Prueba de aberraciones cromosómicas in vitro
- Ensayo de síntesis de ADN de hepatocitos de rata
- Ensayo de linfoma de ratón
- Estudio letal dominante del ratón
- Prueba de micronúcleo de ratón
Todas las pruebas dieron resultados negativos excepto la prueba de aberraciones cromosómicas in vitro que fue positiva en una prueba y negativa en otra. Además, se ha realizado una prueba de mutación inversa bacteriana (prueba de Ames) en metabolitos de claritromicina con resultados negativos.
Deterioro de la fertilidad
Los estudios de fertilidad y reproducción han demostrado que dosis diarias de hasta 160 mg/kg/ en ratas macho y hembra no causaron efectos adversos sobre el ciclo estral, la fertilidad, el parto o el número y viabilidad de las crías. Los niveles plasmáticos en ratas después de 150 mg/kg/día fueron el doble de los niveles séricos humanos.
Se produjo atrofia testicular en ratas con dosis de 7 veces, en perros con dosis de 3 veces y en monos con dosis 8 veces mayores que la dosis diaria máxima en humanos (sobre la base del área de superficie corporal).
Uso en poblaciones específicas
El embarazo
Efectos teratogénicos
Embarazo Categoría C
La claritromicina no debe utilizarse en mujeres embarazadas, excepto en circunstancias clínicas en las que no sea adecuada una terapia alternativa. Si ocurre un embarazo mientras toma este medicamento, se debe informar a la paciente sobre el peligro potencial para el feto [ver ADVERTENCIAS Y PRECAUCIONES ].
Cuatro estudios de teratogenicidad en ratas (tres con dosis orales y uno con dosis intravenosas de hasta 160 mg/kg/día administrados durante el período de mayor organogénesis) y dos en conejos con dosis orales de hasta 125 mg/kg/día (aproximadamente el doble de la dosis humana máxima recomendada basada en mg/m²) o dosis intravenosas de 30 mg/kg/día administradas durante los días 6 a 18 de gestación no demostraron teratogenicidad de la claritromicina. Dos estudios orales adicionales en una cepa de rata diferente a dosis y condiciones similares demostraron una baja incidencia de anomalías cardiovasculares a dosis de 150 mg/kg/día administradas durante los días 6 a 15 de gestación.
Los niveles plasmáticos después de 150 mg/kg/día fueron el doble de los niveles séricos humanos. Cuatro estudios en ratones revelaron una incidencia variable de paladar hendido después de dosis orales de 1000 mg/kg/día (2 y 4 veces la dosis humana máxima recomendada en mg/m², respectivamente) durante los días 6 a 15 de gestación. El paladar hendido también fue visto a 500 mg/kg/día. La exposición de 1000 mg/kg/día resultó en niveles plasmáticos 17 veces mayores que los niveles séricos humanos. En monos, una dosis oral de 70 mg/kg/día produjo un retraso en el crecimiento fetal a niveles plasmáticos que eran el doble de los niveles séricos humanos.
Madres lactantes
Se debe tener precaución cuando se administre BIAXIN a mujeres lactantes. Los beneficios para el desarrollo y la salud de la alimentación con leche humana deben considerarse junto con la necesidad clínica de BIAXIN de la madre y cualquier posible efecto adverso en el niño alimentado con leche humana debido al fármaco o a la afección materna subyacente.
La claritromicina y su metabolito activo 14-hidroxi claritromicina se excretan en la leche humana. Se obtuvieron muestras de suero y leche después de 3 días de tratamiento, en estado estacionario, de un estudio publicado de 12 mujeres lactantes que tomaban BIAXIN 250 mg por vía oral dos veces al día. Según los datos limitados de este estudio, y suponiendo un consumo de leche de 150 ml/kg/día, un lactante alimentado exclusivamente con leche humana recibiría un promedio estimado de 136 mcg/kg/día de claritromicina y su metabolito activo, con esta dosis materna. régimen. Esto es menos del 2 % de la dosis materna ajustada al peso (7,8 mg/kg/día, con base en el peso materno promedio de 64 kg) y menos del 1 % de la dosis pediátrica (15 mg/kg/día) para niños mayores de 6 meses de edad.
Un estudio observacional prospectivo de 55 bebés amamantados de madres que tomaban un antibacteriano macrólido (6 fueron expuestos a claritromicina) se comparó con 36 bebés amamantados de madres que tomaban amoxicilina. Las reacciones adversas fueron comparables en ambos grupos. Las reacciones adversas ocurrieron en el 12,7 % de los lactantes expuestos a los macrólidos e incluyeron sarpullido, diarrea, pérdida del apetito y somnolencia.
Uso pediátrico
Se ha establecido la seguridad y eficacia de BIAXIN Filmtab y BIAXIN 500mg Granules para el tratamiento de las siguientes afecciones o enfermedades en pacientes pediátricos de 6 meses en adelante. El uso en estas indicaciones se basa en ensayos clínicos en pacientes pediátricos o estudios adecuados y bien controlados en adultos con datos farmacocinéticos y de seguridad adicionales en pacientes pediátricos:
- Faringitis/Amigdalitis
- La comunidad adquirió neumonía
- Sinusitis maxilar aguda
- Otitis media aguda [ver Estudios clínicos ]
- Infecciones no complicadas de la piel y de la estructura de la piel
Se ha establecido la seguridad y eficacia de BIAXIN 500 mg Filmtab y BIAXIN 500 mg gránulos para la prevención de la enfermedad diseminada del complejo Mycobacterium avium (MAC) en pacientes pediátricos de 20 meses y mayores con infección avanzada por VIH. No se han realizado estudios de BIAXIN para la profilaxis MAC en poblaciones pediátricas y las dosis recomendadas para la profilaxis se derivan de estudios de tratamiento pediátrico MAC.
No se ha establecido la seguridad y eficacia de BIAXIN 500 mg XL Filmtab en el tratamiento de pacientes pediátricos.
No se ha establecido la seguridad y eficacia de BIAXIN 250 mg en pacientes pediátricos menores de 6 meses de edad. No se ha estudiado la seguridad de BIAXIN 500 mg en pacientes con MAC menores de 20 meses.
Uso geriátrico
En un estudio de estado estacionario en el que sujetos sanos de edad avanzada (65 años a 81 años de edad) recibieron 500 mg de BIAXIN cada 12 horas, las concentraciones séricas máximas y el área bajo las curvas de claritromicina y 14-OH claritromicina aumentaron en comparación con los alcanzados en adultos jóvenes sanos. Estos cambios en la farmacocinética son paralelos a las conocidas disminuciones relacionadas con la edad en la función renal. En los ensayos clínicos, los pacientes de edad avanzada no tuvieron una mayor incidencia de reacciones adversas en comparación con los pacientes más jóvenes. Considere el ajuste de la dosis en pacientes de edad avanzada con insuficiencia renal grave. Los pacientes de edad avanzada pueden ser más susceptibles al desarrollo de arritmias torsades de pointes que los pacientes más jóvenes [ver ADVERTENCIAS Y PRECAUCIONES ].
La mayoría de los informes de lesión renal aguda con bloqueadores de los canales de calcio metabolizados por CYP3A4 (p. ej., verapamilo, amlodipina, diltiazem, nifedipina) involucraron a pacientes de edad avanzada de 65 años o más [ver ADVERTENCIAS Y PRECAUCIONES ].
Especialmente en pacientes de edad avanzada, ha habido informes de toxicidad por colchicina con el uso concomitante de claritromicina y colchicina, algunos de los cuales ocurrieron en pacientes con insuficiencia renal. Se han informado muertes en algunos pacientes [ver CONTRAINDICACIONES y ADVERTENCIAS Y PRECAUCIONES ].
Insuficiencia renal y hepática
BIAXIN 500 mg se excreta principalmente por vía hepática y renal. BIAXIN puede administrarse sin ajuste de dosis a pacientes con insuficiencia hepática y función renal normal. Sin embargo, en presencia de insuficiencia renal grave con o sin insuficiencia hepática coexistente, puede ser apropiado reducir la dosis o prolongar los intervalos de dosificación [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
REFERENCIAS
1. Winkel P, Hilden J, Hansen JF, Kastrup J, Kolmos HJ, Kjøller E, et al. La claritromicina para la cardiopatía coronaria estable aumenta la mortalidad cardiovascular y por todas las causas y la morbilidad cerebrovascular durante 10 años en el ensayo clínico aleatorizado y ciego CLARICOR. Int J Cardiol 2015;182:459-65.
SOBREDOSIS
La sobredosis de BIAXIN puede causar síntomas gastrointestinales como dolor abdominal, vómitos, náuseas y diarrea.
Trate las reacciones adversas que acompañan a la sobredosis mediante la pronta eliminación del fármaco no absorbido y las medidas de apoyo. Al igual que con otros macrólidos, no se espera que las concentraciones séricas de BIAXIN se vean afectadas de manera apreciable por la hemodiálisis o la diálisis peritoneal.
CONTRAINDICACIONES
Hipersensibilidad
BIAXIN está contraindicado en pacientes con hipersensibilidad conocida a la claritromicina, la eritromicina o cualquiera de los fármacos antibacterianos macrólidos [ver ADVERTENCIAS Y PRECAUCIONES ].
Arritmia cardíaca
La administración concomitante de BIAXIN con cisaprida y pimozida está contraindicada [ver INTERACCIONES CON LA DROGAS ].
Ha habido informes posteriores a la comercialización de interacciones farmacológicas cuando la claritromicina se coadministra con cisaprida o pimozida, lo que resulta en arritmias cardíacas (prolongación del intervalo QT, taquicardia ventricular, fibrilación ventricular y torsades de pointes) muy probablemente debido a la inhibición del metabolismo de estos fármacos por parte de BIAXIN. . Se han reportado muertes.
Ictericia colestática/disfunción hepática
BIAXIN está contraindicado en pacientes con antecedentes de ictericia colestásica o disfunción hepática asociada con el uso previo de claritromicina.
colchicina
La administración concomitante de BIAXIN y colchicina está contraindicada en pacientes con insuficiencia renal o hepática.
Inhibidores de la HMG-CoA reductasa
No use BIAXIN de forma concomitante con inhibidores de la HMG-CoA reductasa (estatinas) que son ampliamente metabolizados por CYP3A4 (lovastatina o simvastatina), debido al mayor riesgo de miopatía, incluida la rabdomiolisis [ver ADVERTENCIAS Y PRECAUCIONES y INTERACCIONES CON LA DROGAS ].
Alcaloides del cornezuelo de centeno
Está contraindicada la administración concomitante de claritromicina y ergotamina o dihidroergotamina [ver INTERACCIONES CON LA DROGAS ].
Contraindicaciones para medicamentos coadministrados
Para obtener información sobre las contraindicaciones de otros medicamentos indicados en combinación con BIAXIN, consulte la información de prescripción completa (sección de contraindicaciones).
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
La claritromicina es un fármaco antimicrobiano macrólido [ver Microbiología ].
Farmacocinética
Absorción
BIAXIN 250 mg Filmtab Tabletas de liberación inmediata
La biodisponibilidad absoluta de los comprimidos de claritromicina de 250 mg fue de aproximadamente el 50 %. Para una dosis única de 500 mg de claritromicina, los alimentos retrasan levemente el inicio de la absorción de claritromicina, aumentando el tiempo máximo de aproximadamente 2 a 2,5 horas. Los alimentos también aumentan la concentración plasmática máxima de claritromicina en aproximadamente un 24%, pero no afectan el grado de biodisponibilidad de la claritromicina. Los alimentos no afectan el inicio de la formación del metabolito activo, 14-OH claritromicina o su concentración plasmática máxima, pero disminuyen ligeramente el grado de formación del metabolito, indicado por una disminución del 11 % en el área bajo la curva de concentración plasmática-tiempo (AUC) . Por lo tanto, BIAXIN Filmtab se puede administrar sin tener en cuenta los alimentos. En sujetos humanos sanos que no estaban en ayunas (hombres y mujeres), las concentraciones plasmáticas máximas se alcanzaron entre 2 y 3 horas después de la administración oral.
BIAXIN 500mg XL Filmtab Tabletas de Liberación Prolongada
Las tabletas de liberación prolongada de claritromicina proporcionan una absorción prolongada de claritromicina en el tracto gastrointestinal después de la administración oral. En relación con una dosis diaria total igual de tabletas de claritromicina de liberación inmediata, las tabletas de liberación prolongada de claritromicina proporcionan concentraciones plasmáticas máximas en estado estacionario más bajas y tardías, pero un AUC de 24 horas equivalente tanto para la claritromicina como para su metabolito microbiológicamente activo, la claritromicina 14-OH. Si bien el grado de formación de 14-OH claritromicina después de la administración de BIAXIN 500 mg XL Filmtab (2 comprimidos de 500 mg una vez al día) no se ve afectado por los alimentos, la administración en ayunas se asocia con aproximadamente un 30 % menos de AUC de claritromicina en relación con la administración con alimentos. . Por lo tanto, BIAXIN 250 mg XL Filmtab debe tomarse con alimentos.
Figura 2: Perfiles de tiempo-concentración plasmática de claritromicina en estado estacionario 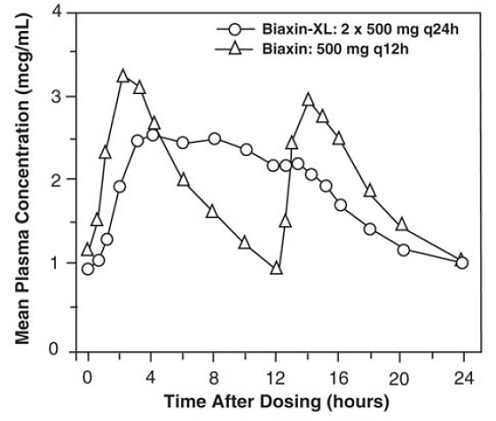
BIAXIN Gránulos para Suspensión Oral
Cuando se administraron dosis de 250 mg de claritromicina como BIAXIN como suspensión oral a sujetos adultos sanos en ayunas, las concentraciones plasmáticas máximas se alcanzaron alrededor de 3 horas después de la dosificación.
Para pacientes adultos, la biodisponibilidad de 10 mL de la suspensión de 125 mg/5 mL o 10 mL de la suspensión de 250 mg/5 mL es similar a la de una tableta de 250 mg o 500 mg, respectivamente.
En adultos que recibieron 250 mg de claritromicina en forma de suspensión (n = 22), los alimentos parecieron disminuir las concentraciones plasmáticas máximas medias de claritromicina de 1,2 (± 0,4) mcg/ml a 1,0 (± 0,4) mcg/ml y el grado de absorción de 7,2 (± 0,4) mcg/ml y el grado de absorción de 7,2 (± 2.5) hr•mcg/mL a 6.5 (± 3.7) hr•mcg/mL.
Distribución
La claritromicina y el metabolito 14-OH de la claritromicina se distribuyen fácilmente en los tejidos y fluidos corporales. No hay datos disponibles sobre la penetración del líquido cefalorraquídeo. Debido a las altas concentraciones intracelulares, las concentraciones tisulares son más altas que las concentraciones séricas. A continuación se presentan ejemplos de concentraciones en tejido y suero.
Metabolismo y eliminación
BIAXIN 500 mg Filmtab Tabletas de liberación inmediata
Las concentraciones plasmáticas máximas de claritromicina en estado estacionario se alcanzaron en 3 días y fueron de aproximadamente 1 mcg/ml a 2 mcg/ml con una dosis de 250 mg administrada cada 12 horas y de 3 mcg/ml a 4 mcg/ml con una dosis de 500 mg administrada cada 12 horas. 8 horas a 12 horas. La vida media de eliminación de la claritromicina fue de aproximadamente 3 a 4 horas con 250 mg administrados cada 12 horas, pero aumentó de 5 a 7 horas con 500 mg administrados cada 8 a 12 horas. La no linealidad de la farmacocinética de la claritromicina es leve a las dosis recomendadas de 250 mg y 500 mg administradas cada 8 a 12 horas. Con una dosificación de 250 mg cada 12 horas, el metabolito principal, claritromicina 14-OH, alcanza una concentración máxima en el estado estacionario de alrededor de 0,6 mcg/mL y tiene una vida media de eliminación de 5 a 6 horas. Con una dosificación de 500 mg cada 8 a 12 horas, la concentración máxima en el estado estacionario de 14-OH claritromicina es ligeramente mayor (hasta 1 mcg/mL) y su vida media de eliminación es de aproximadamente 7 a 9 horas. Con cualquiera de estos regímenes de dosificación, la concentración de estado estacionario de este metabolito generalmente se alcanza dentro de los 3 a 4 días.
Después de una tableta de 250 mg cada 12 horas, aproximadamente el 20% de la dosis se excreta en la orina como claritromicina, mientras que después de una tableta de 500 mg cada 12 horas, la excreción urinaria de claritromicina es algo mayor, aproximadamente un 30%. En comparación, después de una dosis oral de 250 mg (125 mg/5 ml) de suspensión cada 12 horas, aproximadamente el 40 % se excreta en la orina como claritromicina. Sin embargo, el aclaramiento renal de claritromicina es relativamente independiente del tamaño de la dosis y se aproxima a la tasa de filtración glomerular normal. El principal metabolito que se encuentra en la orina es 14-OH claritromicina, que representa un 10% a 15% adicional de la dosis con una tableta de 250 mg o 500 mg administrada cada 12 horas.
BIAXIN 250mg XL Filmtab Tabletas de Liberación Prolongada
En sujetos humanos sanos, se alcanzaron concentraciones plasmáticas máximas de claritromicina en estado estacionario de aproximadamente 2 mcg/mL a 3 mcg/mL aproximadamente de 5 horas a 8 horas después de la administración oral de 1000 mg de BIAXIN 250 mg XL Filmtab una vez al día; para la claritromicina 14-OH, se alcanzaron concentraciones plasmáticas máximas en estado estacionario de aproximadamente 0,8 mcg/mL aproximadamente de 6 a 9 horas después de la dosificación. Se alcanzaron concentraciones plasmáticas máximas de claritromicina en estado estacionario de aproximadamente 1 mcg/mL a 2 mcg/mL alrededor de 5 horas a 6 horas después de la administración oral de una sola dosis de 500 mg de BIAXIN XL Filmtab una vez al día; para la claritromicina 14-OH, se alcanzaron concentraciones plasmáticas máximas en estado estacionario de aproximadamente 0,6 mcg/mL aproximadamente 6 horas después de la dosificación.
Las concentraciones plasmáticas máximas en estado estacionario se alcanzaron en 2 a 3 días y fueron de aproximadamente 2 mcg/mL para claritromicina y 0,7 mcg/mL para 14-OH claritromicina cuando se administraron dosis de 250 mg de la suspensión de claritromicina cada 12 horas. La vida media de eliminación de la claritromicina (3 horas a 4 horas) y la de la 14-OH claritromicina (5 horas a 7 horas) fueron similares a las observadas en el estado estacionario luego de la administración de dosis equivalentes de BIAXIN Filmtab.
Poblaciones específicas para formulaciones de BIAXIN Filmtab, BIAXIN 500mg XL Filmtab y BIAXIN 250mg Granules
BIAXIN Granulado para suspensión oral en pacientes pediátricos
La claritromicina penetra en el líquido del oído medio de los pacientes pediátricos con otitis media secretora.
Cuando a los pacientes pediátricos (n = 10) se les administró una dosis oral única de 7,5 mg/kg de BIAXIN 500 mg como suspensión oral, los alimentos aumentaron las concentraciones plasmáticas máximas medias de claritromicina de 3,6 (± 1,5) mcg/mL a 4,6 (± 2,8) mcg/ mL y el grado de absorción de 10,0 (± 5,5) hr•mcg/mL a 14,2 (± 9,4) hr•mcg/mL.
En pacientes pediátricos que requieren terapia antibacteriana, la administración de 7.5 mg/kg cada 12 horas de BIAXIN como suspensión oral generalmente resultó en concentraciones plasmáticas máximas en estado estacionario de 3 mcg/mL a 7 mcg/mL para claritromicina y 1 mcg/mL a 2 mcg/ml de 14-OH claritromicina.
En pacientes pediátricos infectados por el VIH que tomaban 15 mg/kg de BIAXIN como suspensión oral cada 12 horas, las concentraciones máximas de claritromicina en estado estacionario generalmente oscilaron entre 6 mcg/mL y 15 mcg/mL.
Infección por VIH
Las concentraciones en estado estacionario de claritromicina y claritromicina 14-OH observadas después de la administración de dosis de 500 mg de claritromicina cada 12 horas a pacientes adultos con infección por VIH fueron similares a las observadas en voluntarios sanos. En pacientes adultos infectados por el VIH que tomaban dosis de 500 mg o 1000 mg de claritromicina cada 12 horas, los valores de Cmax de claritromicina en estado estacionario variaron de 2 mcg/ml a 4 mcg/ml y de 5 mcg/ml a 10 mcg/ml, respectivamente. .
Deterioro hepático
Las concentraciones en estado estacionario de claritromicina en sujetos con insuficiencia hepática no diferían de las de sujetos normales; sin embargo, las concentraciones de claritromicina 14-OH fueron más bajas en los sujetos con insuficiencia hepática. La disminución de la formación de claritromicina 14-OH se vio compensada, al menos parcialmente, por un aumento en el aclaramiento renal de claritromicina en los sujetos con insuficiencia hepática en comparación con los sujetos sanos.
Insuficiencia renal
La farmacocinética de la claritromicina también se vio alterada en sujetos con insuficiencia renal [ver Uso en poblaciones específicas y DOSIFICACIÓN Y ADMINISTRACIÓN ].
Interacciones con la drogas
fluconazol
Después de la administración de 200 mg diarios de fluconazol y 500 mg de claritromicina dos veces al día a 21 voluntarios sanos, la Cmin y el AUC de claritromicina en estado estacionario aumentaron un 33 % y un 18 %, respectivamente. Las exposiciones a claritromicina aumentaron y las concentraciones en estado estacionario de 14-OH claritromicina no se vieron afectadas significativamente por la administración concomitante de fluconazol.
colchicina
Cuando se administró una dosis única de 0,6 mg de colchicina con 250 mg de claritromicina dos veces al día durante 7 días, la Cmax de colchicina aumentó un 197 % y el AUC0-∞ aumentó un 239 % en comparación con la administración de colchicina sola.
Atazanavir
Después de la administración de claritromicina (500 mg dos veces al día) con atazanavir (400 mg una vez al día), el AUC de claritromicina aumentó un 94 %, el AUC de 14-OH claritromicina disminuyó un 70 % y el AUC de atazanavir aumentó un 28 %.
ritonavir
La administración concomitante de claritromicina y ritonavir (n = 22) resultó en un aumento del 77 % en el AUC de claritromicina y una disminución del 100 % en el AUC de 14-OH claritromicina.
Saquinavir
Después de la administración de claritromicina (500 mg dos veces al día) y saquinavir (cápsulas de gelatina blanda, 1200 mg tres veces al día) a 12 voluntarios sanos, el AUC y la Cmax de saquinavir en estado estacionario aumentaron un 177 % y un 187 % respectivamente en comparación con la administración de saquinavir solo. El AUC y la Cmax de claritromicina aumentaron un 45 % y un 39 % respectivamente, mientras que el AUC y la Cmax de 14–OH claritromicina disminuyeron un 24 % y un 34 % respectivamente, en comparación con la administración de claritromicina sola.
didanosina
La administración simultánea de comprimidos de claritromicina y didanosina a 12 pacientes adultos infectados por el VIH no produjo cambios estadísticamente significativos en la farmacocinética de didanosina.
Zidovudina
Después de la administración de comprimidos de 500 mg de claritromicina dos veces al día con 100 mg de zidovudina cada 4 horas, el AUC de zidovudina en estado estacionario disminuyó un 12% en comparación con la administración de zidovudina sola (n=4). Los valores individuales oscilaron entre una disminución del 34 % y un aumento del 14 %. Cuando los comprimidos de claritromicina se administraron de dos a cuatro horas antes de la zidovudina, la Cmax de zidovudina en estado estacionario aumentó un 100% mientras que el AUC no se vio afectado (n=24).
omeprazol
Se administraron 500 mg de claritromicina cada 8 horas en combinación con 40 mg diarios de omeprazol a sujetos adultos sanos. Las concentraciones plasmáticas en estado estacionario de omeprazol aumentaron (aumentos de Cmax, AUC0-24 y t½ del 30 %, 89 % y 34 %, respectivamente) por la administración concomitante de claritromicina.
Los niveles plasmáticos de claritromicina y 14-OH claritromicina aumentaron con la administración concomitante de omeprazol. Para la claritromicina, la Cmax media fue un 10 % mayor, la Cmin media fue un 27 % mayor y el AUC0-8 medio fue un 15 % mayor cuando se administró claritromicina con omeprazol que cuando se administró claritromicina sola. Se observaron resultados similares para la 14-OH claritromicina, la Cmax media fue un 45 % mayor, la Cmin media fue un 57 % mayor y la AUC0-8 media fue un 45 % mayor. Las concentraciones de claritromicina en el tejido gástrico y la mucosidad también aumentaron con la administración concomitante de omeprazol.
Concentraciones tisulares de claritromicina 2 horas después de la dosis (mcg/mL)/(mcg/g)
teofilina
En dos estudios en los que se administró teofilina con claritromicina (una formulación de liberación sostenida de teofilina se dosificó a 6,5 mg/kg o 12 mg/kg junto con 250 o 500 mg cada 12 h de claritromicina), los niveles de estado estacionario de Cmax, Cmin, y el área bajo la curva de concentración sérica-tiempo (AUC) de teofilina aumentó aproximadamente un 20 %.
midazolam
Cuando se coadministró una dosis única de midazolam con comprimidos de claritromicina (500 mg dos veces al día durante 7 días), el AUC de midazolam aumentó un 174 % después de la administración intravenosa de midazolam y un 600 % después de la administración oral.
Para obtener información sobre otros medicamentos indicados en combinación con BIAXIN, consulte su información de prescripción completa, FARMACOLOGÍA CLÍNICA sección.
Microbiología
Mecanismo de acción
La claritromicina ejerce su acción antibacteriana al unirse a la subunidad ribosómica 50S de las bacterias susceptibles, lo que inhibe la síntesis de proteínas.
Resistencia
Las principales vías de resistencia son la modificación del ARNr 23S en la subunidad ribosomal 50S a la insensibilidad o bombas de salida de fármacos. La producción de betalactamasas no debería tener efecto sobre la actividad de la claritromicina.
La mayoría de los aislados de estafilococos resistentes a la meticilina y a la oxacilina son resistentes a la claritromicina.
Si H. pylori no se erradica después del tratamiento con regímenes combinados que contienen claritromicina, los pacientes pueden desarrollar resistencia a la claritromicina en aislados de H. pylori. Por lo tanto, para los pacientes en los que fracasa la terapia, se deben realizar pruebas de susceptibilidad a la claritromicina, si es posible. Los pacientes con H. pylori resistente a la claritromicina no deben recibir tratamiento con ninguno de los siguientes: terapia dual de omeprazol/claritromicina; triple terapia con omeprazol/claritromicina/amoxicilina; triple terapia con lansoprazol/claritromicina/amoxicilina; u otros regímenes que incluyen claritromicina como único agente antibacteriano.
Actividad antimicrobiana
Se ha demostrado que la claritromicina es activa frente a la mayoría de los aislados de los siguientes microorganismos tanto in vitro como en infecciones clínicas [ver INDICACIONES Y USO ].
bacterias grampositivas
- estafilococo aureus
- steotococos neumonia
- Streptococcus pyogenes
Bacterias Gram-negativo
- Haemophilus influenzae
- Haemophilus parainfluenzae
- Moraxella catarrhalis
Otros microorganismos
- Chlamydophila pneumoniae
- Helicobacter pylori
- Complejo Mycobacterium avium (MAC) que consta de M. avium y M. intracellulare
- micoplasma pneumoniae
Al menos el 90 por ciento de los microorganismos enumerados a continuación exhiben concentraciones inhibitorias mínimas (MIC) in vitro inferiores o iguales al punto de corte de la MIC sensible a la claritromicina para organismos de tipo similar a los que se muestran en la Tabla 11. Sin embargo, la eficacia de la claritromicina en el tratamiento de infecciones clínicas debido a estos microorganismos no se ha establecido en ensayos clínicos adecuados y bien controlados.
bacterias grampositivas
- Streptococcus agalactiae
- Estreptococos (Grupos C, F, G)
- Estreptococos del grupo viridans
Bacterias Gram-negativo
- Legionella pneumophila
- Pasteurella multicida
Bacteria anaerobica
- Clostridium perfringens
- Peptococcus niger
- Prevotella melaninogenica
- Propionibacterium acnes
Pruebas de susceptibilidad
Para obtener información específica sobre los criterios de interpretación de las pruebas de susceptibilidad y los métodos de prueba asociados y los estándares de control de calidad reconocidos por la FDA para este medicamento, consulte: http://www.fda.gov/STIC.
Toxicología Animal Y/o Farmacología
Ocurrió opacidad de la córnea en perros con dosis 12 veces mayores y en monos con dosis 8 veces mayores que la dosis diaria máxima en humanos (sobre la base del área de superficie corporal). Se produjo depleción linfoide en perros con dosis 3 veces mayores y en monos con dosis 2 veces mayores que la dosis diaria máxima en humanos (sobre la base del área de superficie corporal).
Estudios clínicos
Infecciones micobacterianas
Profilaxis de infecciones micobacterianas
Un ensayo clínico aleatorizado, doble ciego (ensayo 3) comparó la claritromicina 500 mg dos veces al día con un placebo en pacientes con SIDA definido por los CDC y recuentos de CD4 inferiores a 100 células/μL. Este ensayo reunió a 682 pacientes desde noviembre de 1992 hasta enero de 1994, con una mediana de recuento de células CD4 al ingreso de 30 células/mcL. La mediana de duración de BIAXIN 500 mg fue de 10,6 meses frente a 8,2 meses para el placebo. Más pacientes en el grupo de placebo que en el grupo de BIAXIN abandonaron prematuramente el ensayo (75,6 % y 67,4 %, respectivamente). Sin embargo, si se excluyen las interrupciones prematuras debidas al complejo Mycobacterium avium (MAC) o la muerte, porcentajes aproximadamente iguales de pacientes en cada brazo (54,8 %) con BIAXIN y 52,5 % con placebo) interrumpieron el fármaco del estudio antes de tiempo por otras razones. El ensayo fue diseñado para evaluar los siguientes criterios de valoración:
MAC Bacteriemia
En pacientes aleatorizados a BIAXIN, el riesgo de bacteriemia por MAC se redujo en un 69 % en comparación con el placebo. La diferencia entre los grupos fue estadísticamente significativa (p
Supervivencia
Se observó un beneficio de supervivencia estadísticamente significativo de BIAXIN en comparación con el placebo (consulte la Figura 3 y la Tabla 13). Dado que el análisis a los 18 meses incluye pacientes que ya no reciben profilaxis, es posible que se subestime el beneficio de supervivencia de BIAXIN 250 mg.
Figura 3: Supervivencia de todos los pacientes con SIDA aleatorizados a lo largo del tiempo en el Ensayo 3 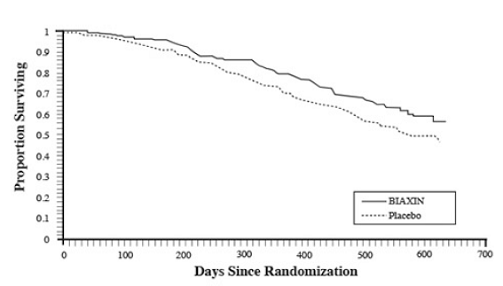
Enfermedad MAC diseminada clínicamente significativa
En asociación con la disminución de la incidencia de bacteriemia MAC, los pacientes del grupo asignado al azar a BIAXIN mostraron reducciones en los signos y síntomas de la enfermedad MAC diseminada, que incluyen fiebre, sudores nocturnos, pérdida de peso y anemia.
Tratamiento de infecciones micobacterianas
Ensayos de monoterapia de rango de dosis en pacientes adultos con SIDA con MAC
Dos ensayos clínicos aleatorizados (ensayos 1 y 2) compararon diferentes dosis de BIAXIN en pacientes con SIDA definido por los CDC y recuentos de CD4 inferiores a 100 células/mcL. Estos ensayos incorporaron pacientes desde mayo de 1991 hasta marzo de 1992. El ensayo 500 fue un ensayo aleatorizado, doble ciego; El ensayo 577 fue un ensayo abierto de uso compasivo. Ambos ensayos utilizaron dosis de BIAXIN de 500 mg y 1000 mg dos veces al día; el ensayo 1 también tuvo un grupo de 2000 mg dos veces al día de BIAXIN de 500 mg. El ensayo 1 inscribió a 154 pacientes adultos y el ensayo 2 inscribió a 469 pacientes adultos. La mayoría de los pacientes tenían recuentos de células CD4 inferiores a 50 células/mcL al ingresar al estudio. Los ensayos se diseñaron para evaluar los siguientes criterios de valoración:
Los resultados del ensayo 1 se describen a continuación. Los resultados del ensayo 2 fueron similares a los resultados del ensayo 1.
MAC Bacteriemia
Se observaron disminuciones en la bacteriemia MAC o hemocultivos negativos en la mayoría de los pacientes en todos los grupos de dosis de 500 mg de BIAXIN. Las reducciones medias en las unidades formadoras de colonias (CFU) de MAC desde el inicio después de 4 semanas de tratamiento en el régimen de 1000 mg (n=32) dos veces al día y 2000 mg (n=26) dos veces al día fue de 2,3 Log CFU en comparación con 1,5 Log CFU en el régimen de BIAXIN 500 mg dos veces al día (n=35). Un ensayo separado con un régimen de cuatro fármacos2 (ciprofloxacina, etambutol, rifampicina y clofazimina) tuvo una reducción media de 1,4 Log CFU.
Los resultados clínicos evaluados con los diferentes regímenes de dosificación de monoterapia con claritromicina se muestran en la Tabla 14. Las dosis de 1000 mg y 2000 mg dos veces al día mostraron un control significativamente mejor de la bacteriemia durante las primeras cuatro semanas de terapia. No se observaron diferencias significativas más allá de ese punto. Todos los aislamientos tenían una CIM inferior a 8 mcg/mL en el pretratamiento. La recaída estuvo casi siempre acompañada de un aumento de la CIM.
Enfermedad MAC diseminada clínicamente significativa
Entre los pacientes que experimentaron sudores nocturnos antes de la terapia, el 84 % mostró resolución o mejoría en algún momento durante las 12 semanas de BIAXIN en dosis de 500 mg a 2000 mg dos veces al día. De manera similar, el 77 % de los pacientes informaron resolución o mejoría de la fiebre en algún momento. Las tasas de respuesta para los signos clínicos de MAC se dan en la Tabla 15 a continuación.
La mediana de duración de la respuesta, definida como mejoría o resolución de los signos y síntomas clínicos, fue de 2 a 6 semanas.
Dado que el ensayo no se diseñó para determinar el beneficio de la monoterapia más allá de las 12 semanas, la duración de la respuesta puede subestimarse para el 25 % al 33 % de los pacientes que continuaron mostrando una respuesta clínica después de las 12 semanas.
Supervivencia
La mediana del tiempo de supervivencia desde el ingreso al ensayo (ensayo 1) fue de 249 días con la dosis de 500 mg dos veces al día en comparación con los 215 días con la dosis de 1000 mg dos veces al día. Sin embargo, durante las primeras 12 semanas de tratamiento, hubo 2 muertes en 53 pacientes del grupo de 500 mg dos veces al día frente a 13 muertes en 51 pacientes del grupo de 1000 mg dos veces al día. Se desconoce el motivo de esta aparente diferencia de mortalidad. La supervivencia en los dos grupos fue similar más allá de las 12 semanas. Los tiempos medios de supervivencia para estas dosis fueron similares a los controles históricos recientes con MAC cuando se trataron con terapias combinadas.2
El tiempo medio de supervivencia desde el ingreso en el ensayo 2 fue de 199 días para la dosis de 500 mg dos veces al día y de 179 días para la dosis de 1000 mg dos veces al día. Durante las primeras cuatro semanas de tratamiento, mientras los pacientes se mantuvieron con la dosis originalmente asignada, hubo 11 muertes en 255 pacientes que tomaban 500 mg dos veces al día y 18 muertes en 214 pacientes que tomaban 1000 mg dos veces al día.
Ensayos de monoterapia de rango de dosis en pacientes pediátricos con SIDA y MAC
El ensayo 4 fue un ensayo pediátrico de 3,75 mg/kg, 7,5 mg/kg y 15 mg/kg de BIAXIN dos veces al día en pacientes con SIDA definido por los CDC y recuentos de CD4 inferiores a 100 células/mcL. El ensayo inscribió a 25 pacientes entre las edades de 1 a 20 años. El ensayo evaluó los mismos criterios de valoración que en los ensayos de adultos 1 y 2. Los resultados con la dosis de 7,5 mg/kg dos veces al día en el ensayo pediátrico fueron comparables a los de la dosis de 500 mg régimen de dos veces al día en los ensayos con adultos.
Terapia combinada en pacientes con SIDA con MAC diseminado
El Ensayo 5 comparó la seguridad y la eficacia de BIAXIN 250 mg en combinación con etambutol versus BIAXIN 250 mg en combinación con etambutol y clofazimina para el tratamiento de la infección por MAC diseminada (dMAC). Este ensayo de 24 semanas inscribió a 106 pacientes con SIDA y dMAC, con 55 pacientes asignados al azar para recibir BIAXIN 500 mg y etambutol, y 51 pacientes asignados al azar para recibir claritromicina, etambutol y clofazima. Las características iniciales entre los brazos de tratamiento fueron similares, con la excepción de que la mediana de los recuentos de UFC fue al menos 1 logaritmo más alta en el brazo de BIAXIN 500 mg, etambutol y clofazima.
En comparación con la experiencia previa con la monoterapia con claritromicina, el régimen de dos fármacos de claritromicina y etambutol prolongó el tiempo hasta la recaída microbiológica, en gran medida mediante la supresión de la aparición de cepas resistentes a la claritromicina. Sin embargo, la adición de clofazimina al régimen no agregó ningún beneficio clínico o microbiológico adicional. La tolerabilidad de ambos regímenes de múltiples fármacos fue comparable con los eventos adversos más comunes de naturaleza gastrointestinal. Los pacientes que recibieron el régimen que contenía clofazimina tuvieron tasas de supervivencia reducidas; sin embargo, sus recuentos iniciales de colonias de micobacterias fueron más altos. Los resultados de este ensayo respaldan la adición de etambutol a la claritromicina para el tratamiento de las infecciones iniciales por dMAC, pero no respaldan la adición de clofazimina como tercer agente.
Otitis media
Ensayo de otitis media de BIAXIN frente a cefalosporina oral
En un ensayo clínico controlado de pacientes pediátricos con otitis media aguda realizado en los Estados Unidos, donde se encontraron tasas significativas de organismos productores de betalactamasas, se comparó BIAXIN 500 mg con una cefalosporina oral. En este ensayo, se utilizaron criterios estrictos de evaluabilidad para determinar la respuesta clínica. Para los 223 pacientes cuya eficacia clínica se evaluó, la tasa de éxito clínico (es decir, curación más mejoría) en la visita posterior a la terapia fue del 88 % para BIAXIN 500 mg y del 91 % para la cefalosporina.
En un número menor de pacientes, las determinaciones microbiológicas se realizaron en la visita previa al tratamiento. Los resultados presuntivos de erradicación bacteriana/cura clínica (es decir, éxito clínico) se muestran en la Tabla 16.
Ensayos de otitis media de BIAXIN frente a antimicrobiano/inhibidor de betalactamasas
En otros dos ensayos clínicos controlados de otitis media aguda realizados en los Estados Unidos, donde se encontraron tasas significativas de organismos productores de betalactamasas, BIAXIN se comparó con un agente antimicrobiano oral que contenía un inhibidor específico de betalactamasas. En estos ensayos, se utilizaron criterios estrictos de evaluabilidad para determinar las respuestas clínicas. En los 233 pacientes en los que se evaluó la eficacia clínica, la tasa de éxito clínico combinada (es decir, curación y mejoría) en la visita posterior a la terapia fue del 91 % tanto para BIAXIN 500 mg como para el control.
Para los pacientes que tenían determinaciones microbiológicas en la visita previa al tratamiento, los resultados presuntivos de erradicación bacteriana/cura clínica (es decir, éxito clínico) se muestran en la Tabla 17.
Erradicación de H. pylori para disminuir el riesgo de recurrencia de la úlcera duodenal
BIAXIN + Lansoprazol Y Amoxicilina
Dos ensayos clínicos aleatorizados, doble ciego en EE. UU. (ensayo 6 y ensayo 7) en pacientes con H. pylori y enfermedad de úlcera duodenal (definida como una úlcera activa o antecedentes de una úlcera activa dentro de un año) evaluaron la eficacia de BIAXIN 500 mg dos veces diariamente en combinación con lansoprazol 30 mg dos veces al día y amoxicilina 1 g dos veces al día como terapia triple de 14 días para la erradicación de H. pylori.
La erradicación de H. pylori se definió como dos pruebas negativas (cultivo e histología) entre 4 y 6 semanas después del final del tratamiento.
La combinación de BIAXIN más lansoprazol y amoxicilina como terapia triple fue eficaz en la erradicación de H. pylori (ver resultados en la Tabla 18). Se ha demostrado que la erradicación de H. pylori reduce el riesgo de recurrencia de la úlcera duodenal.
Un ensayo clínico aleatorizado, doble ciego (ensayo 8) realizado en los EE. UU. en pacientes con H. pylori y enfermedad de úlcera duodenal (definida como una úlcera activa o antecedentes de una úlcera dentro de un año) comparó la eficacia de BIAXIN 250 mg en combinación con lansoprazol y amoxicilina como triple terapia por 10 días y 14 días. Este ensayo estableció que la terapia triple de 10 días fue equivalente a la terapia triple de 14 días para erradicar H. pylori (ver resultados en la Tabla 18).
Terapia BIAXIN + Omeprazol Y Amoxicilina
Tres ensayos clínicos aleatorizados, doble ciego en EE. UU. en pacientes con infección por H. pylori y enfermedad de úlcera duodenal (n = 558) compararon BIAXIN más omeprazol y amoxicilina con BIAXIN 250 mg más amoxicilina. Se realizaron dos ensayos (ensayos 9 y 10) en pacientes con úlcera duodenal activa, y el tercer ensayo (ensayo 11) se realizó en pacientes con úlcera duodenal en los últimos 5 años, pero sin úlcera presente en el momento de la inscripción. . El régimen de dosificación en los ensayos fue BIAXIN 500 mg dos veces al día más omeprazol 20 mg dos veces al día más amoxicilina 1 gramo dos veces al día durante 10 días. En los ensayos 9 y 10, los pacientes que tomaron el régimen de omeprazol también recibieron 20 mg de omeprazol una vez al día durante 18 días adicionales. Los criterios de valoración estudiados fueron la erradicación de H. pylori y la cicatrización de la úlcera duodenal (ensayos 9 y 10 solamente). El estado de H. pylori se determinó mediante CLOtest®, histología y cultivo en los tres ensayos. Para un paciente dado, H. pylori se consideró erradicado si al menos dos de estas pruebas fueron negativas y ninguna fue positiva. La combinación de BIAXIN más omeprazol y amoxicilina fue efectiva en la erradicación de H. pylori (ver resultados en la Tabla 19).
Terapia BIAXIN + Omeprazol
Cuatro ensayos aleatorizados, doble ciego, multicéntricos (ensayos 12, 13, 14 y 15) evaluaron BIAXIN 500 mg tres veces al día más omeprazol 40 mg una vez al día durante 14 días, seguido de omeprazol 20 mg una vez al día ( ensayos 12, 13 y 15) o con omeprazol 40 mg una vez al día (ensayo 14) durante 14 días adicionales en pacientes con úlcera duodenal activa asociada con H. pylori. Los ensayos 12 y 13 se realizaron en EE. UU. y Canadá y reclutaron a 242 y 256 pacientes, respectivamente. La infección por H. pylori y la úlcera duodenal se confirmaron en 219 pacientes del ensayo 12 y en 228 pacientes del ensayo 13. Estos ensayos compararon el régimen combinado con las monoterapias con omeprazol y BIAXIN. Los ensayos 14 y 15 se realizaron en Europa y reclutaron a 154 y 215 pacientes, respectivamente. La infección por H. pylori y la úlcera duodenal se confirmaron en 148 pacientes del ensayo 14 y en 208 pacientes del ensayo 15. Estos ensayos compararon el régimen combinado con la monoterapia con omeprazol. Los resultados de los análisis de eficacia para estos ensayos se describen en las Tablas 20, 21 y 22.
Curación de úlcera duodenal
La combinación de BIAXIN 250 mg y omeprazol fue tan eficaz como el omeprazol solo para curar la úlcera duodenal (consulte la Tabla 20).
Erradicación de H. pylori asociada a úlcera duodenal
La combinación de BIAXIN 500 mg y omeprazol fue efectiva en la erradicación de H. pylori (ver Tabla 21). La erradicación de H. pylori se definió como ninguna prueba positiva (cultivo o histología) a las 4 semanas posteriores al final del tratamiento, y se requerían dos pruebas negativas para considerarse erradicado. En el análisis por protocolo, se excluyeron los siguientes pacientes: abandonos, pacientes con infracciones importantes del protocolo, pacientes a los que les faltaban pruebas de H. pylori después del tratamiento y pacientes en los que no se evaluó la erradicación de H. pylori a las 4 semanas después del final del tratamiento. tratamiento porque se descubrió que tenían una úlcera sin cicatrizar al final del tratamiento.
Recurrencia de úlcera duodenal
Se evaluó la recurrencia de la úlcera a los 6 meses ya los 12 meses después del final del tratamiento para los pacientes en los que las úlceras se curaron después del tratamiento (ver los resultados en la Tabla 22). Por lo tanto, en pacientes con úlcera duodenal asociada con infección por H. pylori, la erradicación de H. pylori redujo la recurrencia de la úlcera.
REFERENCIAS
2.Kemper CA, et al. Tratamiento de la bacteriemia por el complejo Mycobacterium avium en el SIDA con un régimen oral de cuatro fármacos. Ann Intern Med. 1992; 116: 466-472.
INFORMACIÓN DEL PACIENTE
Proporcione las siguientes instrucciones o información sobre BIAXIN 250 mg a los pacientes:
- Aconseje a los pacientes que los medicamentos antibacterianos, incluido BIAXIN (claritromicina), solo deben usarse para tratar infecciones bacterianas. No tratan infecciones virales (p. ej., el resfriado común). Cuando se prescribe BIAXIN 250 mg para tratar una infección bacteriana, se debe informar a los pacientes que, aunque es común que se sientan mejor al principio del tratamiento, el medicamento debe tomarse exactamente como se indica. Omitir dosis o no completar el curso completo de la terapia puede (1) disminuir la eficacia del tratamiento inmediato y (2) aumentar la probabilidad de que las bacterias desarrollen resistencia y no sean tratables con BIAXIN 250 mg u otros medicamentos antibacterianos en el futuro.
- Advierta a los pacientes que la diarrea es un problema común causado por los antibacterianos, incluido BIAXIN (claritromicina), que generalmente desaparece cuando se suspende el antibacteriano. A veces, después de comenzar el tratamiento con antibacterianos, los pacientes pueden desarrollar heces acuosas y sanguinolentas (con o sin calambres estomacales y fiebre) incluso dos o más meses después de haber tomado la última dosis del antibacteriano. Si esto ocurre, indique a los pacientes que se comuniquen con su proveedor de atención médica lo antes posible.
- Advierta a los pacientes que BIAXIN (claritromicina) puede interactuar con algunos medicamentos; por lo tanto, aconseje a los pacientes que informen a su proveedor de atención médica sobre el uso de cualquier otro medicamento.
- Aconseje a los pacientes que BIAXIN (claritromicina) Filmtab y la suspensión oral se pueden tomar con o sin alimentos y se pueden tomar con leche; sin embargo, BIAXIN 250 mg XL Filmtab (tabletas de liberación prolongada de claritromicina) debe tomarse con alimentos. No refrigere la suspensión.
- No hay datos sobre el efecto de BIAXIN (claritromicina) sobre la capacidad para conducir o utilizar máquinas. Sin embargo, aconseje a los pacientes sobre la posibilidad de mareos, vértigo, confusión y desorientación, que pueden ocurrir con el medicamento. Se debe tener en cuenta el potencial de estas reacciones adversas antes de que los pacientes conduzcan o utilicen máquinas.
- Advierta a los pacientes que si se produce un embarazo mientras toma este medicamento, existe un riesgo potencial para el feto [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
- Aconseje a los pacientes que tienen enfermedad de las arterias coronarias que continúen con los medicamentos y las modificaciones del estilo de vida para su enfermedad de las arterias coronarias porque BIAXIN 500 mg puede estar asociado con un mayor riesgo de mortalidad años después del final del tratamiento con BIAXIN.
