Omnicef 300mg Cefdinir Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Omnicef y cómo se usa?
Omnicef (cefdinir) es un antibiótico de cefalosporina que se usa para tratar muchos tipos diferentes de infecciones causadas por bacterias. La marca Omnicef está descontinuada en los EE. UU. Omnicef está disponible en forma genérica.
¿Cuáles son los efectos secundarios de Omnicef?
Los efectos secundarios comunes de Omnicef 300 mg incluyen:
- Diarrea,
- náuseas,
- vómitos,
- dolor de estómago,
- indigestión,
- dolor de cabeza,
- mareo,
- dermatitis del pañal en un bebé que toma cefdinir líquido,
- picazón, o
- erupción cutanea,
Nota: Es posible que esta lista no incluya todos los posibles efectos secundarios.
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de OMNICEF 300 mg y otros medicamentos antibacterianos, OMNICEF debe usarse solo para tratar o prevenir infecciones que se haya comprobado o que se sospeche que sean causadas por bacterias.
DESCRIPCIÓN
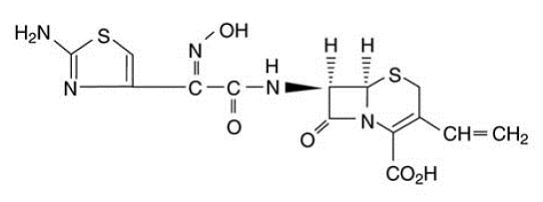
Las cápsulas de OMNICEF (cefdinir) y OMNICEF (cefdinir) para suspensión oral contienen el ingrediente activo cefdinir, una cefalosporina semisintética de espectro extendido, para administración oral. Químicamente, el cefdinir es [6R-[6α, 7β (Z)]]-7-[[(2-amino-4-tiazolil)(hidroxiimino)acetil]amino]3-etenil-8-oxo-5-tia-1 -ácido azabiciclo[4.2.0]oct-2-eno-2-carboxílico. Cefdinir es un sólido de color blanco a amarillo amarillento. Es ligeramente soluble en ácido clorhídrico diluido y escasamente soluble en tampón de fosfato 0,1 M pH 7,0. La fórmula empírica es C14H13N5O5S2 y el peso molecular es 395,42. Cefdinir tiene la fórmula estructural que se muestra a continuación:
Las cápsulas de OMNICEF de 300 mg contienen 300 mg de cefdinir y los siguientes ingredientes inactivos: carboximetilcelulosa cálcica, NF; estearato de polioxilo 40, NF; y estearato de magnesio, NF. Las cubiertas de las cápsulas contienen FD&C Blue #1; rojo n.° 40 de FD&C; rojo D. y C. n.° 28; dióxido de titanio, NF; gelatina, NF; dióxido de silicio, NF; y laurilsulfato de sodio, NF.
OMNICEF 300 mg para suspensión oral, después de la reconstitución, contiene 125 mg de cefdinir por 5 ml o 250 mg de cefdinir por 5 ml y los siguientes ingredientes inactivos: sacarosa, NF; ácido cítrico, USP; citrato de sodio, USP; benzoato de sodio, NF; goma xantana, NF; goma guar, NF; sabores artificiales de fresa y crema; dióxido de silicio, NF; y estearato de magnesio, NF.
INDICACIONES
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de OMNICEF 300 mg y otros medicamentos antibacterianos, OMNICEF 300 mg debe usarse solo para tratar o prevenir infecciones que se haya comprobado o que se sospeche firmemente que son causadas por bacterias susceptibles. Cuando la información de cultivo y susceptibilidad esté disponible, se debe considerar al seleccionar o modificar la terapia antibacteriana. En ausencia de tales datos, la epidemiología local y los patrones de susceptibilidad pueden contribuir a la selección empírica de la terapia.
Las cápsulas de OMNICEF (cefdinir) y OMNICEF (cefdinir) para suspensión oral están indicados para el tratamiento de pacientes con infecciones leves a moderadas causadas por cepas sensibles de los microorganismos designados en las condiciones que se enumeran a continuación.
Adultos y Adolescentes
La comunidad adquirió neumonía
causada por Haemophilus influenzae (incluidas las cepas productoras de β-lactamasa), Haemophilus parainfluenzae (incluidas las cepas productoras de β-lactamasa), Streptococcus pneumoniae (cepas sensibles a la penicilina únicamente) y Moraxella catarrhalis (incluidas las cepas productoras de β-lactamasa) (ver Estudios clínicos ).
Exacerbaciones agudas de la bronquitis crónica
causada por Haemophilus influenzae (incluidas las cepas productoras de β-lactamasa), Haemophilus parainfluenzae (incluidas las cepas productoras de β-lactamasa), Streptococcus pneumoniae (cepas sensibles a la penicilina únicamente) y Moraxella catarrhalis (incluidas las cepas productoras de β-lactamasa).
Sinusitis maxilar aguda
causada por Haemophilus influenzae (incluidas las cepas productoras de β-lactamasa), Streptococcus pneumoniae (cepas sensibles a la penicilina únicamente) y Moraxella catarrhalis (incluidas las cepas productoras de β-lactamasa).
NOTA: Para obtener información sobre el uso en pacientes pediátricos, consulte Uso pediátrico y DOSIFICACIÓN Y ADMINISTRACIÓN .
Faringitis/Amigdalitis
causada por Streptococcus pyogenes (ver Estudios clínicos ).
NOTA: Cefdinir es eficaz en la erradicación de S. pyogenes de la orofaringe. Sin embargo, Cefdinir no se ha estudiado para la prevención de la fiebre reumática después de faringitis/amigdalitis por S. pyogenes. Sólo se ha demostrado que la penicilina intramuscular es eficaz para la prevención de la fiebre reumática.
Infecciones de la estructura de la piel y la piel no complicadas
causada por Staphylococcus aureus (incluidas las cepas productoras de β-lactamasa) y Streptococcus pyogenes.
Pacientes pediátricos
Otitis media bacteriana aguda causada por Haemophilus influenzae (incluidas las cepas productoras de β-lactamasa), Streptococcus pneumoniae (cepas sensibles a la penicilina únicamente) y Moraxella catarrhalis (incluidas las cepas productoras de β-lactamasa).
Faringitis/Amigdalitis
causada por Streptococcus pyogenes (ver Estudios clínicos ).
NOTA: Cefdinir es eficaz en la erradicación de S. pyogenes de la orofaringe. Sin embargo, Cefdinir no se ha estudiado para la prevención de la fiebre reumática después de faringitis/amigdalitis por S. pyogenes. Sólo se ha demostrado que la penicilina intramuscular es eficaz para la prevención de la fiebre reumática.
Infecciones de la estructura de la piel y la piel no complicadas
causada por Staphylococcus aureus (incluidas las cepas productoras de β-lactamasa) y Streptococcus pyogenes.
DOSIFICACIÓN Y ADMINISTRACIÓN
(ver INDICACIONES Y USO por Patógenos indicados )
Cápsulas
La posología recomendada y la duración del tratamiento de infecciones en adultos y adolescentes se describen en el siguiente cuadro; la dosis diaria total para todas las infecciones es de 600 mg. La dosificación una vez al día durante 10 días es tan eficaz como la dosificación BID. No se ha estudiado la dosificación una vez al día en neumonía o infecciones de la piel; por lo tanto, las Cápsulas de OMNICEF deben administrarse dos veces al día en estas infecciones. Las cápsulas de OMNICEF se pueden tomar independientemente de las comidas.
Adultos y adolescentes (mayores de 13 años)
PolvoPara Suspensión Oral
La posología recomendada y la duración del tratamiento de infecciones en pacientes pediátricos se describen en el siguiente cuadro; la dosis diaria total para todas las infecciones es de 14 mg/kg, hasta una dosis máxima de 600 mg por día. La dosificación una vez al día durante 10 días es tan eficaz como la dosificación BID. No se ha estudiado la dosificación una vez al día en infecciones de la piel; por lo tanto, OMNICEF 300 mg para Suspensión Oral debe administrarse dos veces al día en esta infección. OMNICEF para Suspensión Oral puede administrarse independientemente de las comidas.
Pacientes pediátricos (de 6 meses a 12 años de edad)
TABLA DE DOSIFICACIÓN DE OMNICEF PARA SUSPENSIÓN ORAL PEDIÁTRICA
Pacientes con Insuficiencia Renal
Para pacientes adultos con aclaramiento de creatinina
El aclaramiento de creatinina es difícil de medir en pacientes ambulatorios. Sin embargo, la siguiente fórmula puede usarse para estimar el aclaramiento de creatinina (CLcr) en pacientes adultos. Para que las estimaciones sean válidas, los niveles de creatinina sérica deben reflejar los niveles de estado estacionario de la función renal.
donde el aclaramiento de creatinina está en ml/min, la edad está en años, el peso está en kilogramos y la creatinina sérica está en mg/dl.4
La siguiente fórmula se puede utilizar para estimar el aclaramiento de creatinina en pacientes pediátricos:
CLcr = K × longitud o altura corporal/creatinina sérica
donde K = 0,55 para pacientes pediátricos mayores de 1 año5 y 0,45 para lactantes (hasta 1 año)6.
En la ecuación anterior, el aclaramiento de creatinina está en ml/min/1,73 m², la longitud o altura del cuerpo está en centímetros y la creatinina sérica está en mg/dl.
Para pacientes pediátricos con un aclaramiento de creatinina de
Pacientes en hemodiálisis
La hemodiálisis elimina el cefdinir del cuerpo. En pacientes mantenidos en hemodiálisis crónica, el régimen de dosificación inicial recomendado es una dosis de 300 mg o 7 mg/kg en días alternos.
Al final de cada sesión de hemodiálisis, se deben administrar 300 mg (o 7 mg/kg). Las dosis subsiguientes (300 mg o 7 mg/kg) se administran en días alternos.
Instrucciones para mezclar Omnicef 300 mg para suspensión oral
Después de mezclar, la suspensión se puede almacenar a temperatura ambiente (25 °C/77 °F). El envase debe mantenerse bien cerrado y la suspensión debe agitarse bien antes de cada administración. La suspensión se puede utilizar durante 10 días, después de lo cual se debe desechar cualquier porción no utilizada.
CÓMO SUMINISTRADO
OMNICEF Cápsulas , que contiene 300 mg de cefdinir, en cápsulas de lavanda y turquesa con el nombre del producto impreso, están disponibles de la siguiente manera:
60 Cápsulas/Botella CDN 0074-3769-60 Caja de cartón OMNI-PAC™ de 3 unidades de uso, 5 días, 10 cápsulas en blíster CDN 0074-3769-30
OMNICEF 300 mg para suspensión oral es una formulación en polvo de color crema que, cuando se reconstituye según las indicaciones, contiene 125 mg de cefdinir/5 ml o 250 mg de cefdinir/5 ml. Las suspensiones reconstituidas tienen color crema y sabor a fresa. El polvo está disponible de la siguiente manera:
125 mg/5 ml
botellas de 60 ml CDN 0074-3771-60 Botellas de 100 ml CDN 0074-3771-13 250 mg/5 ml Frascos de 60 ml CDN 0074-6151-60 Botellas de 100 ml CDN 0074-6151-13
Guarde las cápsulas y el polvo sin suspender a 25 °C (77 °F); excursiones permitidas a 15°-30°C (59°-86°F) [consulte Temperatura ambiente controlada por USP]. Una vez reconstituida, la suspensión oral puede conservarse a temperatura ambiente controlada durante 10 días.
Fabricado por: CEPH International Corporation Carolina, Puerto Rico 00986. Para: AbbVie Inc., North Chicago, IL 60064, EE. UU., bajo licencia de: Astellas Pharma Inc. Tokio, Japón. Revisado noviembre 2015
EFECTOS SECUNDARIOS
Eventos adversos
Ensayos clínicos - Cápsulas de OMNICEF (pacientes adultos y adolescentes)
En ensayos clínicos, 5093 pacientes adultos y adolescentes (3841 estadounidenses y 1252 no estadounidenses) fueron tratados con la dosis recomendada de cápsulas de cefdinir (600 mg/día). La mayoría de los eventos adversos fueron leves y autolimitados. No se atribuyeron muertes ni discapacidades permanentes al cefdinir. Ciento cuarenta y siete de 5093 (3%) pacientes interrumpieron la medicación debido a eventos adversos que los investigadores consideraron posiblemente, probablemente o definitivamente asociados con la terapia con cefdinir. Las interrupciones se debieron principalmente a trastornos gastrointestinales, generalmente diarrea o náuseas. Diecinueve de 5093 (0,4%) pacientes abandonaron el tratamiento debido a un pensamiento de erupción relacionado con la administración de cefdinir.
En los EE. UU., los investigadores pensaron que los siguientes eventos adversos estaban posiblemente, probablemente o definitivamente relacionados con las cápsulas de cefdinir en ensayos clínicos de dosis múltiples (N = 3841 pacientes tratados con cefdinir):
EVENTOS ADVERSOS ASOCIADOS CON LAS CÁPSULAS DE CEFDINIR ENSAYOS DE EE. UU. EN PACIENTES ADULTOS Y ADOLESCENTES (N = 3841)a
Los siguientes cambios en los valores de laboratorio de posible importancia clínica, independientemente de la relación con el tratamiento con cefdinir, se observaron durante los ensayos clínicos realizados en los EE. UU.:
CAMBIOS DE VALORES DE LABORATORIO OBSERVADOS CON CEFDINIR CÁPSULAS ENSAYOS DE EE. UU. EN PACIENTES ADULTOS Y ADOLESCENTES (N = 3841)
Ensayos clínicos: OMNICEF para suspensión oral (pacientes pediátricos)
En ensayos clínicos, 2289 pacientes pediátricos (1783 de EE. UU. y 506 fuera de EE. UU.) fueron tratados con la dosis recomendada de suspensión de cefdinir (14 mg/kg/día). La mayoría de los eventos adversos fueron leves y autolimitados. No se atribuyeron muertes ni discapacidades permanentes al cefdinir. Cuarenta de 2289 (2%) pacientes suspendieron la medicación debido a eventos adversos considerados por los investigadores como posible, probable o definitivamente asociados con la terapia con cefdinir. Las interrupciones se debieron principalmente a trastornos gastrointestinales, generalmente diarrea. Cinco de 2289 (0,2%) pacientes abandonaron el tratamiento debido a un pensamiento de erupción relacionado con la administración de cefdinir.
En los EE. UU., los investigadores consideraron que los siguientes eventos adversos estaban posiblemente, probablemente o definitivamente relacionados con la suspensión de cefdinir en ensayos clínicos de dosis múltiples (N = 1783 pacientes tratados con cefdinir):
EVENTOS ADVERSOS ASOCIADOS CON LA SUSPENSIÓN DE CEFDINIR ENSAYOS DE EE. UU. EN PACIENTES PEDIÁTRICOS (N = 1783)a
NOTA: Tanto en los pacientes tratados con cefdinir como con los de control, las tasas de diarrea y sarpullido fueron más altas en los pacientes pediátricos más jóvenes. La incidencia de diarrea en pacientes tratados con cefdinir ≤ 2 años fue del 17 % (95/557) en comparación con el 4 % (51/1226) en los mayores de 2 años. La incidencia de erupción cutánea (principalmente dermatitis del pañal en los pacientes más jóvenes) fue del 8 % (43/557) en pacientes ≤ 2 años de edad en comparación con el 1 % (8/1226) en los > 2 años.
Los siguientes cambios en los valores de laboratorio de posible importancia clínica, independientemente de la relación con el tratamiento con cefdinir, se observaron durante los ensayos clínicos realizados en los EE. UU.:
CAMBIOS DE VALORES DE LABORATORIO DE POSIBLE SIGNIFICACIÓN CLÍNICA OBSERVADOS CON LA SUSPENSIÓN DE CEFDINIR ENSAYO DE EE. UU. EN PACIENTES PEDIÁTRICOS (N = 1783)
Experiencia posterior a la comercialización
Las siguientes experiencias adversas y pruebas de laboratorio alteradas, independientemente de su relación con cefdinir, se informaron durante la extensa experiencia posterior a la comercialización, comenzando con la aprobación en Japón en 1991: shock, anafilaxia con casos raros de muerte, edema facial y laríngeo, sensación de asfixia, reacciones similares a la enfermedad del suero, conjuntivitis, estomatitis, síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, dermatitis exfoliativa, eritema multiforme, eritema nodoso, hepatitis aguda, colestasis, hepatitis fulminante, insuficiencia hepática, ictericia, aumento de amilasa, enterocolitis aguda, diarrea sanguinolenta, colitis hemorrágica, melena, colitis pseudomembranosa, pancitopenia, granulocitopenia, leucopenia, trombocitopenia, púrpura trombocitopénica idiopática, anemia hemolítica, insuficiencia respiratoria aguda, ataque asmático, neumonía inducida por fármacos, neumonía eosinofílica, neumonía intersticial idiopática, fiebre, insuficiencia renal aguda, nefropatía, tendencia al sangrado, trastornos de la coagulación coagulación intravascular diseminada, hemorragia digestiva alta, úlcera péptica, íleo, pérdida del conocimiento, vasculitis alérgica, posible interacción entre cefdinir y diclofenaco, insuficiencia cardíaca, dolor torácico, infarto de miocardio, hipertensión, movimientos involuntarios y rabdomiólisis.
Eventos adversos de la clase de cefalosporina
Se han informado los siguientes eventos adversos y pruebas de laboratorio alteradas para los antibióticos de la clase de las cefalosporinas en general:
Reacciones alérgicas, anafilaxia, síndrome de Stevens-Johnson, eritema multiforme, necrólisis epidérmica tóxica, disfunción renal, nefropatía tóxica, disfunción hepática incluyendo colestasis, anemia aplásica, anemia hemolítica, hemorragia, prueba de glucosa urinaria falsamente positiva, neutropenia, pancitopenia y agranulocitosis . Los síntomas de la colitis pseudomembranosa pueden comenzar durante o después del tratamiento con antibióticos (ver ADVERTENCIAS ).
Se ha implicado a varias cefalosporinas en el desencadenamiento de convulsiones, particularmente en pacientes con insuficiencia renal cuando no se redujo la dosis (ver DOSIFICACIÓN Y ADMINISTRACIÓN y SOBREDOSIS ). Si se presentan convulsiones asociadas con la terapia con medicamentos, se debe suspender el medicamento. La terapia anticonvulsiva puede ser dada si está clínicamente indicada.
INTERACCIONES CON LA DROGAS
Antiácidos (que contienen aluminio o magnesio)
La administración concomitante de cápsulas de cefdinir de 300 mg con 30 ml de suspensión de Maalox® TC reduce la tasa (Cmax) y el grado (AUC) de absorción en aproximadamente un 40 %. El tiempo para alcanzar la Cmax también se prolonga en 1 hora. No hay efectos significativos sobre la farmacocinética de cefdinir si el antiácido se administra 2 horas antes o 2 horas después de cefdinir. Si se requieren antiácidos durante la terapia con 300 mg de OMNICEF, se debe tomar 300 mg de OMNICEF al menos 2 horas antes o después del antiácido.
probenecid
Al igual que con otros antibióticos betalactámicos, el probenecid inhibe la excreción renal de cefdinir, lo que resulta en una duplicación aproximada del AUC, un aumento del 54 % en los niveles plasmáticos máximos de cefdinir y una prolongación del 50 % en la semivida de eliminación aparente.
Suplementos de hierro y alimentos fortificados con hierro
La administración concomitante de cefdinir con un suplemento terapéutico de hierro que contiene 60 mg de hierro elemental (como FeSO4) o vitaminas suplementadas con 10 mg de hierro elemental redujo el grado de absorción en un 80 % y un 31 %, respectivamente. Si se requieren suplementos de hierro durante la terapia con 300 mg de OMNICEF, se debe tomar OMNICEF al menos 2 horas antes o después del suplemento.
No se ha estudiado el efecto de los alimentos altamente enriquecidos con hierro elemental (principalmente cereales para el desayuno enriquecidos con hierro) sobre la absorción de cefdinir.
La fórmula infantil fortificada con hierro administrada concomitantemente (2,2 mg de hierro elemental/6 oz) no tiene un efecto significativo sobre la farmacocinética de cefdinir. Por lo tanto, OMNICEF para Suspensión Oral puede administrarse con fórmula infantil fortificada con hierro.
Ha habido informes de heces rojizas en pacientes que reciben cefdinir. En muchos casos, los pacientes también recibían productos que contenían hierro. El color rojizo se debe a la formación de un complejo no absorbible entre cefdinir o sus productos de descomposición y el hierro en el tracto gastrointestinal.
Interacciones entre medicamentos y pruebas de laboratorio
Una reacción falsa positiva para cetonas en la orina puede ocurrir con pruebas que usan nitroprusiato, pero no con aquellas que usan nitroferricianuro. La administración de cefdinir puede resultar en una reacción falsa positiva de glucosa en la orina utilizando Clinitest®, solución de Benedict o solución de Fehling. Se recomienda utilizar pruebas de glucosa basadas en reacciones enzimáticas de glucosa oxidasa (como Clinistix® o Tes-Tape®). Se sabe que las cefalosporinas inducen ocasionalmente una prueba de Coombs directa positiva.
ADVERTENCIAS
ANTES DE INSTALAR LA TERAPIA CON OMNICEF (CEFDINIR), SE DEBE REALIZAR UNA INVESTIGACIÓN CUIDADOSA PARA DETERMINAR SI EL PACIENTE HA TENIDO REACCIONES PREVIAS DE HIPERSENSIBILIDAD AL CEFDINIR, OTRAS CEFALOSPORINAS, PENICILINAS U OTROS MEDICAMENTOS. SI SE DA CEFDINIR A PACIENTES SENSIBLES A LA PENICILINA, SE DEBE TENER PRECAUCIÓN PORQUE LA HIPERSENSIBILIDAD CRUZADA ENTRE ANTIBIÓTICOS β-LACTÁMICOS SE HA DOCUMENTADO CLARAMENTE Y PUEDE OCURRIR HASTA EN EL 10 % DE LOS PACIENTES CON ANTECEDENTES DE ALERGIA A LA PENICILINA. SI OCURRE UNA REACCIÓN ALÉRGICA A CEFDINIR, SE DEBE SUSPENDER EL MEDICAMENTO. LAS REACCIONES DE HIPERSENSIBILIDAD AGUDA SERIAS PUEDEN REQUERIR TRATAMIENTO CON EPINEFRINA Y OTRAS MEDIDAS DE EMERGENCIA, INCLUYENDO OXÍGENO, LÍQUIDOS INTRAVENOSOS, ANTIHISTAMÍNICOS INTRAVENOSOS, CORTICOSTEROIDES, AMINAS PRESORAS Y MANEJO DE LAS VÍAS AÉREAS, SEGÚN SE INDIQUE CLÍNICAMENTE.
Se ha informado diarrea asociada a Clostridium difficile (CDAD) con el uso de casi todos los agentes antibacterianos, incluido OMNICEF, y puede variar en gravedad desde diarrea leve hasta colitis fatal. El tratamiento con agentes antibacterianos altera la flora normal del colon y conduce al crecimiento excesivo de C. difficile.
C. difficile produce toxinas A y B que contribuyen al desarrollo de CDAD. Las cepas de C. difficile productoras de hipertoxina causan mayor morbilidad y mortalidad, ya que estas infecciones pueden ser refractarias a la terapia antimicrobiana y pueden requerir colectomía. Se debe considerar CDAD en todos los pacientes que presenten diarrea después del uso de antibacterianos. Es necesaria una cuidadosa historia clínica ya que se ha informado que la CDAD ocurre más de dos meses después de la administración de agentes antibacterianos.
Si se sospecha o se confirma CDAD, es posible que se deba suspender el uso continuo de antibacterianos no dirigidos contra C. difficile. Se debe instituir el manejo apropiado de líquidos y electrolitos, suplementos de proteínas, tratamiento antibacteriano de C. difficile y evaluación quirúrgica según esté clínicamente indicado.
PRECAUCIONES
General
Prescribir OMNICEF 300 mg en ausencia de una infección bacteriana comprobada o fuertemente sospechada o una indicación profiláctica es poco probable que brinde beneficios al paciente y aumenta el riesgo de desarrollo de bacterias resistentes a los medicamentos.
Al igual que con otros antibióticos de amplio espectro, el tratamiento prolongado puede resultar en la posible aparición y crecimiento excesivo de organismos resistentes. La observación cuidadosa del paciente es esencial. Si se produce una superinfección durante el tratamiento, se debe administrar un tratamiento alternativo apropiado.
Cefdinir, al igual que con otros antimicrobianos de amplio espectro (antibióticos), debe recetarse con precaución en personas con antecedentes de colitis.
En pacientes con insuficiencia renal transitoria o persistente (aclaramiento de creatinina DOSIFICACIÓN Y ADMINISTRACIÓN ).
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
No se ha evaluado el potencial carcinogénico de cefdinir. No se observaron efectos mutagénicos en el ensayo de mutación inversa bacteriana (Ames) o el ensayo de mutación puntual en el locus de hipoxantina-guanina fosforribosiltransferasa (HGPRT) en células de pulmón de hámster chino V79. No se observaron efectos clastogénicos in vitro en el ensayo de aberración cromosómica estructural en células de pulmón de hámster chino V79 o in vivo en el ensayo de micronúcleos en médula ósea de ratón. En ratas, la fertilidad y el rendimiento reproductivo no se vieron afectados por cefdinir en dosis orales de hasta 1000 mg/kg/día (70 veces la dosis humana basada en mg/kg/día, 11 veces basada en mg/m²/día).
El embarazo
Efectos teratogénicos
Embarazo Categoría B
Cefdinir no fue teratogénico en ratas a dosis orales de hasta 1000 mg/kg/día (70 veces la dosis humana basada en mg/kg/día, 11 veces basada en mg/m²/día) o en conejos a dosis orales de hasta 10 mg/kg/día (0,7 veces la dosis humana basada en mg/kg/día, 0,23 veces basada en mg/m²/día). Se observó toxicidad materna (disminución del aumento de peso corporal) en conejos a la dosis máxima tolerada de 10 mg/kg/día sin efectos adversos en la descendencia. Se produjo una disminución del peso corporal en fetos de rata con ≥ 100 mg/kg/día y en crías de rata con ≥ 32 mg/kg/día. No se observaron efectos en los parámetros reproductivos maternos o en la supervivencia, el desarrollo, el comportamiento o la función reproductiva de las crías.
Sin embargo, no existen estudios adecuados y bien controlados en mujeres embarazadas. Debido a que los estudios de reproducción en animales no siempre predicen la respuesta humana, este medicamento debe usarse durante el embarazo solo si es claramente necesario.
Trabajo y entrega
Cefdinir no ha sido estudiado para su uso durante el trabajo de parto y el parto.
Madres lactantes
Tras la administración de dosis únicas de 600 mg, no se detectó cefdinir en la leche materna humana.
Uso pediátrico
No se ha establecido la seguridad y eficacia en recién nacidos y lactantes menores de 6 meses de edad. El uso de cefdinir para el tratamiento de la sinusitis maxilar aguda en pacientes pediátricos (de 6 meses a 12 años de edad) está respaldado por la evidencia de estudios adecuados y bien controlados en adultos y adolescentes, la fisiopatología similar de la sinusitis aguda en pacientes adultos y pediátricos, y datos farmacocinéticos comparativos en la población pediátrica.
Uso geriátrico
La eficacia es comparable en pacientes geriátricos y adultos más jóvenes. Si bien el cefdinir ha sido bien tolerado en todos los grupos de edad, en los ensayos clínicos, los pacientes geriátricos experimentaron una tasa más baja de eventos adversos, incluida la diarrea, que los adultos más jóvenes. No es necesario ajustar la dosis en pacientes de edad avanzada a menos que la función renal esté marcadamente comprometida (ver DOSIFICACIÓN Y ADMINISTRACIÓN ).
SOBREDOSIS
No se dispone de información sobre la sobredosis de cefdinir en humanos. En estudios de toxicidad aguda en roedores, una sola dosis oral de 5600 mg/kg no produjo efectos adversos. Los signos y síntomas tóxicos posteriores a la sobredosis con otros antibióticos β-lactámicos incluyen náuseas, vómitos, malestar epigástrico, diarrea y convulsiones. La hemodiálisis elimina el cefdinir del cuerpo. Esto puede ser útil en el caso de una reacción tóxica grave por sobredosis, particularmente si la función renal está comprometida.
CONTRAINDICACIONES
OMNICEF (cefdinir) está contraindicado en pacientes con alergia conocida a la clase de antibióticos de las cefalosporinas.
FARMACOLOGÍA CLÍNICA
Farmacocinética y metabolismo de fármacos
Absorción
Biodisponibilidad Oral
Las concentraciones plasmáticas máximas de cefdinir ocurren de 2 a 4 horas después de la administración de la cápsula o suspensión. Las concentraciones plasmáticas de cefdinir aumentan con la dosis, pero los aumentos son menos que proporcionales a la dosis de 300 mg (7 mg/kg) a 600 mg (14 mg/kg). Tras la administración de la suspensión a adultos sanos, la biodisponibilidad de cefdinir es del 120 % en relación con las cápsulas. La biodisponibilidad estimada de las cápsulas de cefdinir es del 21 % después de la administración de una dosis en cápsula de 300 mg y del 16 % después de la administración de una dosis en cápsula de 600 mg. La biodisponibilidad absoluta estimada de la suspensión de cefdinir es del 25 %. Se demostró que la suspensión oral de cefdinir de 250 mg/5 ml es bioequivalente a la concentración de 125 mg/5 ml en adultos sanos en ayunas.
Efecto de la comida
La Cmáx y el AUC de cefdinir de las cápsulas se reducen en un 16 % y un 10 %, respectivamente, cuando se administran con una comida rica en grasas. En adultos que recibieron la suspensión oral de 250 mg/5 ml con una comida rica en grasas, la Cmáx y el AUC de cefdinir se redujeron en un 44 % y un 33 %, respectivamente. No es probable que la magnitud de estas reducciones sea clínicamente significativa porque los estudios de seguridad y eficacia de la suspensión oral en pacientes pediátricos se realizaron sin tener en cuenta la ingesta de alimentos. Por lo tanto, cefdinir puede tomarse sin importar la comida.
Cápsulas de cefdinir
Las concentraciones plasmáticas de cefdinir y los valores de los parámetros farmacocinéticos luego de la administración de dosis orales únicas de 300 y 600 mg de cefdinir a sujetos adultos se presentan en la siguiente tabla:
Valores medios (± DE) de parámetros farmacocinéticos de cefdinir en plasma después de la administración de cápsulas a sujetos adultos
Suspensión de cefdinir
Las concentraciones plasmáticas de cefdinir y los valores de los parámetros farmacocinéticos luego de la administración de dosis orales únicas de 7 y 14 mg/kg de cefdinir a sujetos pediátricos (de 6 meses a 12 años) se presentan en la siguiente tabla:
Valores medios (± DE) de los parámetros farmacocinéticos de cefdinir en plasma después de la administración de la suspensión a sujetos pediátricos
Dosificación múltiple
Cefdinir no se acumula en el plasma luego de la administración una o dos veces al día a sujetos con función renal normal.
Distribución
El volumen medio de distribución (Vdarea) de cefdinir en sujetos adultos es de 0,35 l/kg (± 0,29); en sujetos pediátricos (de 6 meses a 12 años), cefdinir Vdarea es de 0,67 l/kg (± 0,38). Cefdinir se une en un 60% a 70% a las proteínas plasmáticas tanto en sujetos adultos como pediátricos; la unión es independiente de la concentración.
ampolla de la piel
En sujetos adultos, se observaron concentraciones medianas (rango) máximas de cefdinir en el líquido de las ampollas de 0,65 (0,33-1,1) y 1,1 (0,49-1,9) μg/ml 4 a 5 horas después de la administración de dosis de 300 y 600 mg, respectivamente. Los valores medios (± SD) de Cmax y AUC (0-∞) en ampollas fueron del 48 % (± 13) y el 91 % (± 18) de los valores plasmáticos correspondientes.
Tejido de amígdalas
En pacientes adultos sometidos a amigdalectomía electiva, las concentraciones medianas respectivas de cefdinir en tejido amigdalino 4 horas después de la administración de dosis únicas de 300 y 600 mg fueron de 0,25 (0,220,46) y 0,36 (0,22-0,80) μg/g. Las concentraciones medias en el tejido de las amígdalas fueron del 24 % (± 8) de las concentraciones plasmáticas correspondientes.
tejido sinusal
En pacientes adultos sometidos a cirugía electiva del seno maxilar y etmoidal, las respectivas concentraciones medianas de cefdinir en el tejido del seno 4 horas después de la administración de dosis únicas de 300 y 600 mg fueron
Tejido pulmonar
En pacientes adultos sometidos a broncoscopia diagnóstica, las concentraciones medianas respectivas de cefdinir en la mucosa bronquial 4 horas después de la administración de dosis únicas de 300 y 600 mg fueron de 0,78 (
Líquido del oído medio
En 14 pacientes pediátricos con otitis media bacteriana aguda, las concentraciones medianas respectivas de cefdinir en el líquido del oído medio 3 horas después de la administración de dosis únicas de 7 y 14 mg/kg fueron de 0,21 (
LCR
No se dispone de datos sobre la penetración de cefdinir en el líquido cefalorraquídeo humano.
Metabolismo y Excreción
Cefdinir no se metaboliza apreciablemente. La actividad se debe principalmente al fármaco original. Cefdinir se elimina principalmente por excreción renal con una semivida de eliminación plasmática media (t½) de 1,7 (± 0,6) horas. En sujetos sanos con función renal normal, el aclaramiento renal es de 2,0 (± 1,0) ml/min/kg y el aclaramiento oral aparente es de 11,6 (± 6,0) y 15,5 (± 5,4) ml/min/kg después de dosis de 300 y 600 -mg, respectivamente. El porcentaje medio de la dosis recuperada sin cambios en la orina después de dosis de 300 y 600 mg es del 18,4 % (± 6,4) y del 11,6 % (± 4,6), respectivamente. El aclaramiento de cefdinir se reduce en pacientes con disfunción renal (ver Poblaciones Especiales - Pacientes con Insuficiencia Renal ).
Debido a que la excreción renal es la vía predominante de eliminación, se debe ajustar la dosis en pacientes con una función renal marcadamente comprometida o que estén sometidos a hemodiálisis (ver DOSIFICACIÓN Y ADMINISTRACIÓN ).
Poblaciones Especiales
Pacientes con Insuficiencia Renal
La farmacocinética de cefdinir se investigó en 21 sujetos adultos con diversos grados de función renal. Las disminuciones en la tasa de eliminación de cefdinir, la depuración oral aparente (CL/F) y la depuración renal fueron aproximadamente proporcionales a la reducción en la depuración de creatinina (CLcr). Como resultado, las concentraciones de cefdinir en plasma fueron más altas y persistieron por más tiempo en sujetos con insuficiencia renal que en aquellos sin insuficiencia renal. En sujetos con CLcr entre 30 y 60 ml/min, la Cmax y la t½ aumentaron aproximadamente 2 veces y el AUC aproximadamente 3 veces. En sujetos con CLcr DOSIFICACIÓN Y ADMINISTRACIÓN ).
Hemodiálisis
La farmacocinética de cefdinir se estudió en 8 sujetos adultos sometidos a hemodiálisis. La diálisis (4 horas de duración) eliminó el 63 % de cefdinir del cuerpo y redujo la t½ de eliminación aparente de 16 (± 3,5) a 3,2 (± 1,2) horas. Se recomienda ajustar la dosis en esta población de pacientes (ver DOSIFICACIÓN Y ADMINISTRACIÓN ).
Enfermedad Hepatica
Debido a que cefdinir se elimina predominantemente por vía renal y no se metaboliza de manera apreciable, no se realizaron estudios en pacientes con insuficiencia hepática. No se espera que sea necesario ajustar la dosis en esta población.
Pacientes geriátricos
El efecto de la edad sobre la farmacocinética de cefdinir después de una dosis única de 300 mg se evaluó en 32 sujetos de 19 a 91 años de edad. La exposición sistémica a cefdinir aumentó sustancialmente en sujetos mayores (N = 16), la Cmax en un 44 % y el AUC en un 86 %. Este aumento se debió a una reducción en el aclaramiento de cefdinir. El volumen de distribución aparente también se redujo, por lo que no se observaron alteraciones apreciables en el t½ de eliminación aparente (ancianos: 2,2 ± 0,6 horas vs. jóvenes: 1,8 ± 0,4 horas). Dado que se ha demostrado que el aclaramiento de cefdinir está relacionado principalmente con cambios en la función renal más que con la edad, los pacientes de edad avanzada no requieren un ajuste de dosis a menos que tengan una función renal marcadamente comprometida (aclaramiento de creatinina Pacientes con Insuficiencia Renal, arriba ).
Género y Raza
Los resultados de un metanálisis de farmacocinética clínica (N = 217) no indicaron un impacto significativo del género o la raza en la farmacocinética de cefdinir.
Microbiología
Mecanismo de acción
Al igual que con otras cefalosporinas, la actividad bactericida de cefdinir resulta de la inhibición de la síntesis de la pared celular. Cefdinir es estable en presencia de algunas, pero no todas, las enzimas β-lactamasa. Como resultado, muchos organismos resistentes a las penicilinas y algunas cefalosporinas son sensibles al cefdinir.
Mecanismo de Resistencia
La resistencia a cefdinir se debe principalmente a la hidrólisis por parte de algunas β-lactamasas, la alteración de las proteínas de unión a penicilina (PBP) y la disminución de la permeabilidad. Cefdinir es inactivo contra la mayoría de las cepas de Enterobacter spp., Pseudomonas spp., Enterococcus spp., estreptococos resistentes a la penicilina y estafilococos resistentes a la meticilina. Las cepas de H. influenzae β-lactamasa negativas, resistentes a la ampicilina (BLNAR) generalmente no son sensibles a cefdinir.
Actividad antimicrobiana
Se ha demostrado que cefdinir es activo contra la mayoría de las cepas de los siguientes microorganismos, tanto in vitro como en infecciones clínicas como se describe en INDICACIONES Y USO .
bacterias grampositivas
Staphylococcus aureus (solo cepas sensibles a la meticilina) Streptococcus pneumoniae (solo cepas sensibles a la penicilina) Streptococcus pyogenes
Bacterias Gram-negativo
Haemophilus influenzae Haemophilus parainfluenzae Moraxella catarrhalis
Los siguientes datos in vitro están disponibles, pero se desconoce su importancia clínica.
Cefdinir exhibe concentraciones inhibitorias mínimas (MIC) in vitro de 1 mcg/mL o menos contra (≥ 90%) cepas de los siguientes microorganismos; sin embargo, la seguridad y eficacia de cefdinir en el tratamiento de infecciones clínicas debidas a estos microorganismos no se han establecido en ensayos clínicos adecuados y bien controlados.
bacterias grampositivas
Staphylococcus epidermidis (solo cepas sensibles a la meticilina) Streptococcus agalactiae Estreptococos del grupo Viridans
Bacterias Gram-negativo
Citrobacter koseri Escherichia coli Klebsiella pneumoniae Proteus mirabilis
Métodos de prueba de susceptibilidad
Cuando esté disponible, el laboratorio de microbiología clínica debe proporcionar informes periódicos que describan el perfil de susceptibilidad regional/local de posibles patógenos nosocomiales y adquiridos en la comunidad. Estos informes deberían ayudar al médico a seleccionar un fármaco antibacteriano para el tratamiento.
Técnicas de dilución
Los métodos cuantitativos se utilizan para determinar las concentraciones inhibitorias mínimas (CIM) antimicrobianas. Estos MIC proporcionan estimaciones de la susceptibilidad de las bacterias a los compuestos antimicrobianos. Las CIM deben determinarse utilizando un método de prueba estandarizado1 (caldo y/o agar). Los valores de MIC deben interpretarse de acuerdo con los criterios proporcionados en la Tabla 1.
Técnicas de difusión
Los métodos cuantitativos que requieren la medición de los diámetros de las zonas también proporcionan estimaciones reproducibles de la susceptibilidad de las bacterias a los compuestos antimicrobianos. El tamaño de la zona debe determinarse utilizando un método estandarizado.2 El procedimiento utiliza discos de papel impregnados con 5 mcg de cefdinir para probar la susceptibilidad de las bacterias. Los criterios de interpretación de la difusión por disco se proporcionan en la Tabla 1.
La susceptibilidad de los estafilococos a cefdinir puede deducirse de la prueba de penicilina y cefoxitina u oxacilina. Los estafilococos sensibles a la oxacilina (cefoxitina) pueden considerarse sensibles a cefdinir.3
Un informe de "Sensible" indica que es probable que el antimicrobiano inhiba el crecimiento del patógeno si el compuesto antimicrobiano alcanza las concentraciones en el sitio de infección necesarias para inhibir el crecimiento del patógeno. Un informe de "Intermedio" indica que el resultado debe considerarse equívoco y, si el microorganismo no es completamente susceptible a fármacos alternativos clínicamente factibles, la prueba debe repetirse. Esta categoría implica una posible aplicabilidad clínica en sitios del cuerpo donde el fármaco se concentra fisiológicamente o en situaciones en las que se puede utilizar una dosis alta del fármaco. Esta categoría también proporciona una zona de amortiguamiento que evita que pequeños factores técnicos no controlados causen grandes discrepancias en la interpretación. Un informe de "Resistente" indica que no es probable que el antimicrobiano inhiba el crecimiento del patógeno si el compuesto antimicrobiano alcanza las concentraciones que normalmente se alcanzan en el sitio de la infección; debe seleccionarse otra terapia.
Control de calidad
Los procedimientos de prueba de susceptibilidad estandarizados requieren el uso de controles de laboratorio para monitorear y garantizar la exactitud y precisión de los suministros y reactivos utilizados en el ensayo, y las técnicas de la persona que realiza la prueba.1,2,3 El polvo de cefdinir estándar debe proporcionar el siguiente rango de los valores de MIC como se indica en la Tabla 2. Para la técnica de difusión que utiliza un disco de 5 mcg, se deben cumplir los criterios de la Tabla 2.
Estudios clínicos
Neumonía bacteriana adquirida en la comunidad
En un estudio doble ciego controlado en adultos y adolescentes realizado en los EE. UU., se comparó cefdinir BID con cefaclor 500 mg TID. Usando criterios estrictos de evaluabilidad y respuesta microbiológica/clínica de 6 a 14 días después de la terapia, se obtuvieron las siguientes tasas de curación clínica, tasas de erradicación microbiológica presuntiva y resultados estadísticos:
Estudio de neumonía adquirida en la comunidad de EE. UU. Cefdinir vs Cefaclor
En un segundo estudio controlado ciego para el investigador en adultos y adolescentes realizado principalmente en Europa, se comparó cefdinir BID con amoxicilina/clavulanato 500/125 mg TID. Usando criterios estrictos de evaluabilidad y respuesta clínica de 6 a 14 días después de la terapia, se obtuvieron las siguientes tasas de curación clínica, tasas de erradicación microbiológica presuntiva y resultados estadísticos:
Estudio de neumonía adquirida en la comunidad europea Cefdinir frente a amoxicilina/clavulanato
Faringitis/amigdalitis estreptocócica
En cuatro estudios controlados realizados en los Estados Unidos, se comparó cefdinir con 10 días de penicilina en pacientes adultos, adolescentes y pediátricos. Dos estudios (uno en adultos y adolescentes, el otro en pacientes pediátricos) compararon 10 días de cefdinir QD o BID con penicilina 250 mg o 10 mg/kg QID. Usando criterios estrictos de evaluabilidad y respuesta microbiológica/clínica de 5 a 10 días después de la terapia, se obtuvieron las siguientes tasas de curación clínica, tasas de erradicación microbiológica y resultados estadísticos:
Estudios Faringitis/Amigdalitis Cefdinir (10 días) vs Penicilina (10 días)
Dos estudios (uno en adultos y adolescentes, el otro en pacientes pediátricos) compararon 5 días de cefdinir BID con 10 días de penicilina 250 mg o 10 mg/kg QID. Usando criterios estrictos de evaluabilidad y respuesta microbiológica/clínica de 4 a 10 días después de la terapia, se obtuvieron las siguientes tasas de curación clínica, tasas de erradicación microbiológica y resultados estadísticos:
Estudios Faringitis/Amigdalitis Cefdinir (5 días) vs Penicilina (10 días)
REFERENCIAS
1. Instituto de Normas Clínicas y de Laboratorio (CLSI). Métodos para pruebas de susceptibilidad antimicrobiana por dilución para bacterias que crecen aeróbicamente; Norma Aprobada – Décima Edición. Documento CLSI M07-A10 [2015], Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, EE. UU.
2. Instituto de Normas Clínicas y de Laboratorio (CLSI). Normas de rendimiento para las pruebas de susceptibilidad a la difusión por disco de antimicrobianos; Norma Aprobada – Duodécima Edición. Documento CLSI M02-A12 [2015], Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, EE. UU.
3. Instituto de Normas Clínicas y de Laboratorio (CLSI). Estándares de Desempeño para Pruebas de Susceptibilidad Antimicrobiana; Vigésimo quinto suplemento informativo, documento CLSI M100-S25 [2015], Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, EE. UU.
4. Cockcroft DW, Gault MH. Predicción del aclaramiento de creatinina a partir de la creatinina sérica. Nephron 1976; 16:31-41.
5. Schwartz GJ, Haycock GB, Edelmann CM, Spitzer A. Una estimación simple de la tasa de filtración glomerular en niños derivada de la longitud corporal y la creatinina plasmática. Pediatría 1976;58:259-63.
6. Schwartz GJ, Feld LG, Langford DJ. Una estimación simple de la tasa de filtración glomerular en recién nacidos a término durante el primer año de vida. J Pediatría 1984;104:849-54.
INFORMACIÓN DEL PACIENTE
Se debe advertir a los pacientes que los medicamentos antibacterianos, incluido OMNICEF 300 mg, solo deben usarse para tratar infecciones bacterianas. No tratan infecciones virales (p. ej., el resfriado común). Cuando se prescribe 300 mg de OMNICEF para tratar una infección bacteriana, se debe informar a los pacientes que, aunque es común que se sientan mejor al principio del tratamiento, el medicamento debe tomarse exactamente como se indica. Omitir dosis o no completar el curso completo de la terapia puede (1) disminuir la eficacia del tratamiento inmediato y (2) aumentar la probabilidad de que las bacterias desarrollen resistencia y no sean tratables con OMNICEF 300 mg u otros medicamentos antibacterianos en el futuro.
Los antiácidos que contienen magnesio o aluminio interfieren con la absorción de cefdinir. Si se requiere este tipo de antiácido durante la terapia con 300 mg de OMNICEF, se debe tomar OMNICEF al menos 2 horas antes o después del antiácido.
Los suplementos de hierro, incluidas las multivitaminas que contienen hierro, interfieren con la absorción de cefdinir. Si se requieren suplementos de hierro durante la terapia con 300 mg de OMNICEF, se debe tomar OMNICEF al menos 2 horas antes o después del suplemento.
La fórmula infantil fortificada con hierro no interfiere significativamente con la absorción de cefdinir. Por lo tanto, OMNICEF 300 mg para Suspensión Oral puede administrarse con fórmula infantil fortificada con hierro.
Los pacientes diabéticos y sus cuidadores deben saber que la suspensión oral contiene 2,86 g de sacarosa por cucharadita.
La diarrea es un problema común causado por los antibióticos que generalmente termina cuando se suspende el antibiótico. A veces, después de comenzar el tratamiento con antibióticos, los pacientes pueden desarrollar heces acuosas y sanguinolentas (con o sin calambres estomacales y fiebre) incluso dos o más meses después de haber tomado la última dosis del antibiótico. Si esto ocurre, los pacientes deben comunicarse con su médico lo antes posible.
