Levaquin 250mg, 500mg, 750mg Levofloxacin Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Levaquin 750 mg y cómo se usa?
Levaquin es un medicamento recetado que se usa para tratar los síntomas de varias infecciones bacterianas. Levaquin se puede usar solo o con otros medicamentos.
Levaquin 500 mg pertenece a una clase de medicamentos llamados fluoroquinolonas.
No se sabe si Levaquin es seguro y efectivo en niños con una duración del tratamiento de más de 14 días.
¿Cuáles son los posibles efectos secundarios de Levaquin 500mg?
Levaquin 750 mg puede causar efectos secundarios graves, que incluyen:
- dolor de cabeza,
- hambre,
- transpiración,
- irritabilidad,
- mareo,
- náuseas,
- frecuencia cardíaca rápida,
- sentirse ansioso o tembloroso,
- entumecimiento u hormigueo en sus manos, brazos, piernas o pies,
- debilidad en sus brazos, manos, piernas o pies,
- dolor ardiente en sus brazos, manos, piernas o pies,
- cambios graves de humor o de comportamiento,
- nerviosismo,
- confusión,
- agitación,
- paranoia,
- alucinaciones,
- problemas de memoria,
- problemas para concentrarse,
- pensamientos de suicidio,
- ruptura de tendón,
- dolor súbito,
- hinchazón,
- hematomas,
- sensibilidad,
- rigidez,
- problemas de movimiento,
- un sonido de chasquido o estallido en cualquiera de sus articulaciones,
- dolor de estómago severo,
- diarrea acuosa o con sangre,
- revoloteando en tu pecho,
- dificultad para respirar,
- erupción cutanea,
- problemas respiratorios,
- ataques (convulsiones),
- dolores de cabeza severos,
- problemas de la vista,
- dolor detrás de tus ojos,
- dolor de estómago superior,
- pérdida de apetito,
- orina oscura,
- heces de color arcilla, y
- coloración amarillenta de la piel o los ojos (ictericia)
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Levaquin 250 mg incluyen:
- náuseas,
- estreñimiento,
- Diarrea,
- dolor de cabeza,
- mareos, y
- problemas para dormir
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Levaquin. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
ADVERTENCIA
REACCIONES ADVERSAS GRAVES INCLUYENDO TENDINITIS, RUPTURA DE TENDONES, NEUROPATÍA PERIFÉRICA, EFECTOS EN EL SISTEMA NERVIOSO CENTRAL Y EXACERBACIÓN DE MIASTENIA GRAVIS
- Las fluoroquinolonas, incluido LEVAQUIN®, se han asociado con reacciones adversas graves incapacitantes y potencialmente irreversibles que han ocurrido juntas [ver ADVERTENCIAS Y PRECAUCIONES], que incluyen:
- Tendinitis y rotura de tendón [ver ADVERTENCIAS Y PRECAUCIONES]
- Neuropatía periférica [ver ADVERTENCIAS Y PRECAUCIONES]
- Efectos sobre el sistema nervioso central [ver ADVERTENCIAS Y PRECAUCIONES]
Suspenda LEVAQUIN® de inmediato y evite el uso de fluoroquinolonas, incluido LEVAQUIN®, en pacientes que experimenten cualquiera de estas reacciones adversas graves [ver ADVERTENCIAS Y PRECAUCIONES]
- Las fluoroquinolonas, incluido LEVAQUIN®, pueden exacerbar la debilidad muscular en pacientes con miastenia grave. Evite LEVAQUIN® en pacientes con antecedentes conocidos de miastenia grave [ver ADVERTENCIAS Y PRECAUCIONES ].
- Debido a que las fluoroquinolonas, incluido LEVAQUIN®, se han asociado con reacciones adversas graves [ver ADVERTENCIAS Y PRECAUCIONES ], reserve LEVAQUIN® para uso en pacientes que no tienen opciones de tratamiento alternativas para las siguientes indicaciones:
- Infección del tracto urinario no complicada [ver INDICACIONES ]
- Exacerbación bacteriana aguda de la bronquitis crónica [ver INDICACIONES ]
- Sinusitis bacteriana aguda [ver INDICACIONES ].
DESCRIPCIÓN
LEVAQUIN® Tablets son agentes antibacterianos sintéticos para administración oral. Químicamente, la levofloxacina, una carboxiquinolona fluorada quiral, es el enantiómero (-)-(S) puro del principio activo racémico ofloxacina. El nombre químico es (-)-(S)-9-fluoro-2,3-dihidro-3-metil-10-(4-metil-1-piperazinil)-7-oxo-7H-pirido[1,2, Hemihidrato del ácido 3-de]-1,4-benzoxazina-6-carboxílico.
Figura 1: La estructura química de la levofloxacina
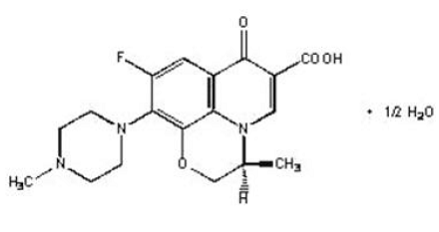
La fórmula empírica es C18H20FN3O4 · ½ H2O y el peso molecular es 370,38. La levofloxacina es un cristal o polvo cristalino de color blanco amarillento claro a blanco amarillento. La molécula existe como un zwitterión en las condiciones de pH en el intestino delgado.
Los datos demuestran que de pH 0,6 a 5,8, la solubilidad de la levofloxacina es esencialmente constante (aproximadamente 100 mg/mL). La levofloxacina se considera de soluble a libremente soluble en este rango de pH, según lo define la nomenclatura de la USP. Por encima de pH 5,8, la solubilidad aumenta rápidamente hasta su máximo a pH 6,7 (272 mg/mL) y se considera libremente soluble en este rango. Por encima de pH 6,7, la solubilidad disminuye y alcanza un valor mínimo (alrededor de 50 mg/mL) a un pH de aproximadamente 6,9.
La levofloxacina tiene el potencial de formar compuestos de coordinación estables con muchos iones metálicos. Este potencial de quelación in vitro tiene el siguiente orden de formación: Al+3>Cu+2>Zn+2>Mg+2>Ca+2.
Las tabletas LEVAQUIN® están disponibles como tabletas recubiertas con película y contienen los siguientes ingredientes inactivos:
- 250 mg (expresado en forma anhidra): crospovidona, hipromelosa, estearato de magnesio, celulosa microcristalina, polietilenglicol, polisorbato 80, óxido de hierro rojo sintético y dióxido de titanio.
- 500 mg (expresado en forma anhidra): crospovidona, hipromelosa, estearato de magnesio, celulosa microcristalina, polietilenglicol, polisorbato 80, óxidos de hierro rojo y amarillo sintéticos y dióxido de titanio.
- 750 mg (expresado en forma anhidra): crospovidona, hipromelosa, estearato de magnesio, celulosa microcristalina, polietilenglicol, polisorbato 80, dióxido de titanio.
INDICACIONES
Neumonía nosocomial
LEVAQUIN® está indicado en pacientes adultos para el tratamiento de la neumonía nosocomial debida a Staphylococcus aureus sensible a la meticilina, Pseudomonas aeruginosa, Serratia marcescens, Escherichia coli, Klebsiella pneumoniae, Haemophilus influenzae o Streptococcus pneumoniae. La terapia adyuvante debe usarse según esté clínicamente indicado. Cuando Pseudomonas aeruginosa es un patógeno presunto o documentado, se recomienda la terapia de combinación con un β-lactámico anti-pseudomonas [ver Estudios clínicos ].
La comunidad adquirió neumonía
Régimen de tratamiento de 7 a 14 días
LEVAQUIN® está indicado en pacientes adultos para el tratamiento de la neumonía adquirida en la comunidad debida a Staphylococcus aureus sensible a la meticilina, Streptococcus pneumoniae (incluido Streptococcus pneumoniae resistente a múltiples fármacos [MDRSP]), Haemophilus influenzae, Haemophilus parainfluenzae, Klebsiella pneumoniae, Moraxella catarrhalis , Chlamydophila pneumoniae, Legionella pneumophila o Mycoplasma pneumoniae [ver DOSIFICACIÓN Y ADMINISTRACIÓN y Estudios clínicos ].
Los aislados de MDRSP son aislados resistentes a dos o más de los siguientes antibacterianos: penicilina (MIC ≥2 mcg/mL), cefalosporinas de segunda generación, por ejemplo, cefuroxima, macrólidos, tetraciclinas y trimetoprima/sulfametoxazol.
La comunidad adquirió neumonía
Régimen de tratamiento de 5 días
LEVAQUIN® está indicado en pacientes adultos para el tratamiento de la neumonía adquirida en la comunidad debida a Streptococcus pneumoniae (excluidos los aislamientos multirresistentes [MDRSP]), Haemophilus influenzae, Haemophilus parainfluenzae, Mycoplasma pneumoniae o Chlamydophila pneumoniae [ver DOSIFICACIÓN Y ADMINISTRACIÓN y Estudios clínicos ].
Infecciones Complicadas De La Piel Y De La Estructura De La Piel
LEVAQUIN® está indicado en pacientes adultos para el tratamiento de infecciones complicadas de la piel y de la estructura de la piel debidas a Staphylococcus aureus, Enterococcus faecalis, Streptococcus pyogenes o Proteus mirabilis sensibles a la meticilina [ver Estudios clínicos ].
Infecciones no complicadas de la piel y de la estructura de la piel
LEVAQUIN® está indicado en pacientes adultos para el tratamiento de infecciones no complicadas de la piel y de la estructura de la piel (leves a moderadas), incluidos abscesos, celulitis, forúnculos, impétigo, pioderma, infecciones de heridas debidas a Staphylococcus aureus sensible a la meticilina o Streptococcus pyogenes.
Prostatitis bacteriana crónica
LEVAQUIN® está indicado en pacientes adultos para el tratamiento de la prostatitis bacteriana crónica debida a Escherichia coli, Enterococcus faecalis o Staphylococcus epidermidis sensible a la meticilina [ver Estudios clínicos ].
Ántrax por inhalación (posterior a la exposición)
LEVAQUIN® está indicado para el ántrax por inhalación (después de la exposición) para reducir la incidencia o progresión de la enfermedad después de la exposición al Bacillus anthracis en aerosol en adultos y pacientes pediátricos, de 6 meses de edad y mayores [ver DOSIFICACIÓN Y ADMINISTRACIÓN ]. La eficacia de LEVAQUIN® se basa en las concentraciones plasmáticas alcanzadas en humanos, un criterio de valoración sustituto con una probabilidad razonable de predecir el beneficio clínico.
LEVAQUIN® no ha sido probado en humanos para la prevención posterior a la exposición al ántrax por inhalación. No se ha estudiado la seguridad de LEVAQUIN® en adultos para tratamientos de más de 28 días o en pacientes pediátricos para tratamientos de más de 14 días. La terapia prolongada con LEVAQUIN® solo debe usarse cuando el beneficio supere el riesgo [ver Estudios clínicos ].
Plaga
LEVAQUIN® está indicado para el tratamiento de la peste, incluida la peste neumónica y septicémica, debida a Yersinia pestis (Y. pestis) y la profilaxis de la peste en adultos y pacientes pediátricos, a partir de los 6 meses de edad [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
No se pudieron realizar estudios de eficacia de LEVAQUIN® en humanos con peste por razones éticas y de factibilidad. Por lo tanto, la aprobación de esta indicación se basó en un estudio de eficacia realizado en animales [ver Estudios clínicos ].
Infecciones complicadas del tracto urinario
Régimen de tratamiento de 5 días
LEVAQUIN® está indicado en pacientes adultos para el tratamiento de infecciones urinarias complicadas debidas a Escherichia coli, Klebsiella pneumoniae o Proteus mirabilis [ver Estudios clínicos ].
Infecciones complicadas del tracto urinario
Régimen de tratamiento de 10 días
LEVAQUIN® está indicado en pacientes adultos para el tratamiento de infecciones complicadas del tracto urinario (leves a moderadas) debidas a Enterococcus faecalis, Enterobacter cloacae, Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis o Pseudomonas aeruginosa [ver Estudios clínicos ].
Pielonefritis aguda
Régimen de tratamiento de 5 o 10 días
LEVAQUIN® está indicado en pacientes adultos para el tratamiento de la pielonefritis aguda causada por Escherichia coli, incluidos los casos con bacteriemia concurrente [ver Estudios clínicos ].
Infecciones del tracto urinario no complicadas
LEVAQUIN® está indicado en pacientes adultos para el tratamiento de infecciones del tracto urinario no complicadas (leve a moderadas) debidas a Escherichia coli, Klebsiella pneumoniae o Staphylococcus saprophyticus.
Debido a que las fluoroquinolonas, incluido LEVAQUIN®, se han asociado con reacciones adversas graves [ver ADVERTENCIAS Y PRECAUCIONES y para algunos pacientes, la infección del tracto urinario no complicada es autolimitada, reserve LEVAQUIN® para el tratamiento de infecciones del tracto urinario no complicadas en pacientes que no tienen opciones de tratamiento alternativas.
Exacerbación bacteriana aguda de la bronquitis crónica
LEVAQUIN® está indicado en pacientes adultos para el tratamiento de la exacerbación bacteriana aguda de la bronquitis crónica (ABECB) debida a Staphylococcus aureus sensible a la meticilina, Streptococcus pneumoniae, Haemophilus influenzae, Haemophilus parainfluenzae o Moraxella catarrhalis.
Debido a que las fluoroquinolonas, incluido LEVAQUIN®, se han asociado con reacciones adversas graves [ver ADVERTENCIAS Y PRECAUCIONES ] y para algunos pacientes ABECB es autolimitado, reserve LEVAQUIN® para el tratamiento de ABECB en pacientes que no tienen opciones de tratamiento alternativas.
Sinusitis bacteriana aguda
Regímenes de tratamiento de 5 días y de 10 a 14 días
LEVAQUIN® está indicado en pacientes adultos para el tratamiento de la sinusitis bacteriana aguda (ABS) debida a Streptococcus pneumoniae, Haemophilus influenzae o Moraxella catarrhalis [ver Estudios clínicos ].
Debido a que las fluoroquinolonas, incluido LEVAQUIN®, se han asociado con reacciones adversas graves [ver ADVERTENCIAS Y PRECAUCIONES y para algunos pacientes el ABS es autolimitado, reserve LEVAQUIN® para el tratamiento del ABS en pacientes que no tienen opciones de tratamiento alternativas.
Uso
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de LEVAQUIN® y otros medicamentos antibacterianos, LEVAQUIN® debe usarse solo para tratar o prevenir infecciones que se compruebe o se sospeche fuertemente que son causadas por bacterias susceptibles. Cuando la información de cultivo y susceptibilidad esté disponible, se debe considerar al seleccionar o modificar la terapia antibacteriana. En ausencia de tales datos, la epidemiología local y los patrones de susceptibilidad pueden contribuir a la selección empírica de la terapia.
Pruebas de cultivo y susceptibilidad
Se deben realizar cultivos y pruebas de susceptibilidad apropiados antes del tratamiento para aislar e identificar los organismos que causan la infección y determinar su susceptibilidad a la levofloxacina [ver Microbiología ]. La terapia con LEVAQUIN® puede iniciarse antes de que se conozcan los resultados de estas pruebas; una vez que los resultados estén disponibles, se debe seleccionar la terapia adecuada.
Al igual que con otros medicamentos de esta clase, algunos aislados de Pseudomonas aeruginosa pueden desarrollar resistencia con bastante rapidez durante el tratamiento con LEVAQUIN®. Las pruebas de cultivo y susceptibilidad realizadas periódicamente durante la terapia proporcionarán información sobre la susceptibilidad continua de los patógenos al agente antimicrobiano y también sobre la posible aparición de resistencia bacteriana.
DOSIFICACIÓN Y ADMINISTRACIÓN
Dosis de tabletas de LEVAQUIN® en pacientes adultos con aclaramiento de creatinina ≥ 50 ml/minuto
La dosis habitual de LEVAQUIN® Tabletas es de 250 mg, 500 mg o 750 mg administrados por vía oral cada 24 horas, según lo indique la infección y se describe en la Tabla 1.
Estas recomendaciones se aplican a pacientes con aclaramiento de creatinina ≥ 50 ml/minuto. Para pacientes con depuración de creatinina inferior a 50 ml/min, se requieren ajustes en el régimen de dosificación [ver Ajuste de dosis en adultos con insuficiencia renal ].
Dosis de tabletas de LEVAQUIN® en pacientes pediátricos con carbunco inhalatorio o peste
La dosis de LEVAQUIN® Tabletas para el ántrax por inhalación (posterior a la exposición) y la peste en pacientes pediátricos que pesan 30 kg o más se describe a continuación en la Tabla 2. LEVAQUIN® Tabletas no se puede administrar a pacientes que pesan menos de 30 kg debido a las limitaciones de la fuerza disponible. Se pueden considerar formulaciones alternativas de levofloxacino para pacientes pediátricos que pesan menos de 30 kg.
Ajuste de dosis en adultos con insuficiencia renal
Administrar LEVAQUIN® con precaución en pacientes con insuficiencia renal. Se debe realizar una cuidadosa observación clínica y estudios de laboratorio apropiados antes y durante la terapia ya que la eliminación de levofloxacino puede verse reducida en estos pacientes.
En pacientes con insuficiencia renal (aclaramiento de creatinina inferior a 50 ml/min), es necesario ajustar el régimen de dosificación para evitar la acumulación de levofloxacino debido a la disminución del aclaramiento [ver Uso en poblaciones específicas ]. No es necesario realizar ningún ajuste en pacientes con un aclaramiento de creatinina mayor o igual a 50 ml/minuto.
La Tabla 3 muestra cómo ajustar la dosis según el aclaramiento de creatinina.
Interacción farmacológica con agentes de quelación
Antiácidos, sucralfato, cationes metálicos, multivitamínicos
Las tabletas de LEVAQUIN® deben administrarse al menos dos horas antes o dos horas después de los antiácidos que contienen magnesio, aluminio, así como sucralfato, cationes metálicos como el hierro y las preparaciones multivitamínicas con tabletas masticables/tamponadas de zinc o didanosina o el polvo pediátrico para solución oral. [ver INTERACCIONES CON LA DROGAS y INFORMACIÓN DEL PACIENTE ].
Instrucciones de administración
Los comprimidos de LEVAQUIN® pueden administrarse independientemente de los alimentos.
Hidratación para pacientes que reciben tabletas de LEVAQUIN®
Se debe mantener una hidratación adecuada de los pacientes que reciben LEVAQUIN® para evitar la formación de orina altamente concentrada. Se han informado cristaluria y cilindruria con quinolonas [ver REACCIONES ADVERSAS y INFORMACIÓN DEL PACIENTE ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
TABLETAS, recubiertas con película, en forma de cápsula
- Comprimidos de color rosa terracota de 250 mg, impresos con "250" en un lado y "LEVAQUIN" en el otro lado
- Tabletas de melocotón de 500 mg, impresas con "500" en un lado y "LEVAQUIN" en el otro lado
- Comprimidos blancos de 750 mg, impresos con "750" en un lado y "LEVAQUIN" en el otro lado
Almacenamiento y manipulación
Los comprimidos de LEVAQUIN® se suministran en comprimidos recubiertos en forma de cápsula de 250, 500 y 750 mg.
LEVAQUIN® Tabletas se envasan en botellas en las siguientes configuraciones:
- Los comprimidos de 250 mg son de color rosa terracota y están impresos: "LEVAQUIN®" en un lado y "250" en el otro lado
- botellas de 50 ( CDN 50458-920-50)
- Las tabletas de 500 mg son de color melocotón y están impresas: "LEVAQUIN®" en un lado y "500" en el otro lado
- botellas de 50 ( CDN 50458-925-50)
- Los comprimidos de 750 mg son blancos y tienen impreso "LEVAQUIN®" en un lado y "750" en el otro lado
- botellas de 20 ( CDN 50458-930-20)
Las tabletas de LEVAQUIN® deben almacenarse a una temperatura de 15° a 30°C (59° a 86°F) en recipientes bien cerrados.
Fabricado por: Ingrediente activo Hecho en Japón. Revisado: julio de 2018
EFECTOS SECUNDARIOS
Reacciones adversas graves y de otro modo importantes
Las siguientes reacciones adversas graves y de otro modo importantes se analizan con mayor detalle en otras secciones del etiquetado:
- Reacciones adversas graves incapacitantes y potencialmente irreversibles [ver ADVERTENCIAS Y PRECAUCIONES ]
- Tendinitis y ruptura de tendón [ver ADVERTENCIAS Y PRECAUCIONES ]
- Neuropatía periférica [ver ADVERTENCIAS Y PRECAUCIONES ]
- Efectos sobre el sistema nervioso central [ver ADVERTENCIAS Y PRECAUCIONES ]
- Exacerbación de la miastenia grave [ver ADVERTENCIAS Y PRECAUCIONES ]
- Otras reacciones graves y, en ocasiones, mortales [ver ADVERTENCIAS Y PRECAUCIONES ]
- Reacciones de hipersensibilidad [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hepatotoxicidad [ver ADVERTENCIAS Y PRECAUCIONES ]
- Diarrea asociada a Clostridium difficile [ver ADVERTENCIAS Y PRECAUCIONES ]
- Prolongación del intervalo QT [ver ADVERTENCIAS Y PRECAUCIONES ]
- Trastornos musculoesqueléticos en pacientes pediátricos [ver ADVERTENCIAS Y PRECAUCIONES ]
- Alteraciones de la glucosa en sangre [ver ADVERTENCIAS Y PRECAUCIONES ]
- Fotosensibilidad/Fototoxicidad [ver ADVERTENCIAS Y PRECAUCIONES ]
- Desarrollo de bacterias resistentes a los medicamentos [ver ADVERTENCIAS Y PRECAUCIONES ]
Se han informado cristaluria y cilindruria con quinolonas, incluido LEVAQUIN®. Por lo tanto, se debe mantener una hidratación adecuada de los pacientes que reciben LEVAQUIN® para evitar la formación de una orina altamente concentrada [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Los datos que se describen a continuación reflejan la exposición a LEVAQUIN® en 7537 pacientes en 29 ensayos clínicos de fase 3 combinados. La población estudiada tenía una edad media de 50 años (aproximadamente el 74 % de la población tenía INDICACIONES ]. Los pacientes recibieron dosis de LEVAQUIN® de 750 mg una vez al día, 250 mg una vez al día o 500 mg una o dos veces al día.
La duración del tratamiento fue generalmente de 3 a 14 días, y el número medio de días de tratamiento fue de 10 días.
La incidencia general, el tipo y la distribución de las reacciones adversas fue similar en los pacientes que recibieron dosis de LEVAQUIN® de 750 mg una vez al día, 250 mg una vez al día y 500 mg una o dos veces al día.
La suspensión de LEVAQUIN® debido a reacciones adversas al medicamento ocurrió en el 4,3 % de los pacientes en general, el 3,8 % de los pacientes tratados con las dosis de 250 mg y 500 mg y el 5,4 % de los pacientes tratados con la dosis de 750 mg. Las reacciones adversas al fármaco más frecuentes que dieron lugar a la suspensión de las dosis de 250 y 500 mg fueron gastrointestinales (1,4 %), principalmente náuseas (0,6 %); vómitos (0,4%); mareos (0,3%); y cefalea (0,2%). Las reacciones adversas al fármaco más frecuentes que dieron lugar a la suspensión de la dosis de 750 mg fueron gastrointestinales (1,2 %), principalmente náuseas (0,6 %), vómitos (0,5 %); mareos (0,3%); y cefalea (0,3%).
Las reacciones adversas que ocurren en ≥1% de los pacientes tratados con LEVAQUIN® y las reacciones adversas menos comunes, que ocurren en 0.1 a
En ensayos clínicos que utilizan terapia de dosis múltiples, se han observado anomalías oftalmológicas, incluidas cataratas y múltiples opacidades lenticulares puntiformes, en pacientes que reciben tratamiento con quinolonas, incluido LEVAQUIN®. La relación de las drogas con estos eventos no está establecida actualmente.
Experiencia posterior a la comercialización
La Tabla 6 enumera las reacciones adversas que se han identificado durante el uso posterior a la aprobación de LEVAQUIN®. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
INTERACCIONES CON LA DROGAS
Agentes de quelación
Antiácidos, sucralfato, cationes metálicos, multivitamínicos
Si bien la quelación por cationes divalentes es menos marcada que con otras fluoroquinolonas, la administración simultánea de tabletas de LEVAQUIN® con antiácidos que contienen magnesio o aluminio, así como sucralfato, cationes metálicos como hierro y preparaciones multivitamínicas con zinc pueden interferir con la absorción gastrointestinal. de levofloxacina, dando como resultado niveles sistémicos considerablemente más bajos de lo deseado. Las tabletas con antiácidos que contienen magnesio, aluminio, así como sucralfato, cationes metálicos como el hierro y las preparaciones multivitamínicas con zinc o didanosina pueden interferir sustancialmente con la absorción gastrointestinal de levofloxacina, dando como resultado niveles sistémicos considerablemente más bajos de lo deseado. Estos agentes deben tomarse al menos dos horas antes o dos horas después de la administración oral de LEVAQUIN®.
warfarina
No se detectó ningún efecto significativo de LEVAQUIN® sobre las concentraciones plasmáticas máximas, el AUC y otros parámetros de disposición de la warfarina R y S en un estudio clínico en el que participaron voluntarios sanos. De manera similar, no se observó ningún efecto aparente de la warfarina sobre la absorción y disposición de levofloxacina. Sin embargo, ha habido informes durante la experiencia posterior a la comercialización en pacientes de que LEVAQUIN® potencia los efectos de la warfarina. Las elevaciones del tiempo de protrombina en el marco del uso simultáneo de warfarina y LEVAQUIN® se han asociado con episodios de sangrado. El tiempo de protrombina, el índice internacional normalizado (INR) u otras pruebas de anticoagulación adecuadas deben controlarse de cerca si LEVAQUIN® se administra concomitantemente con warfarina. Los pacientes también deben ser monitoreados en busca de evidencia de sangrado [ver REACCIONES ADVERSAS y INFORMACIÓN DEL PACIENTE ].
Agentes antidiabéticos
Se han notificado alteraciones de la glucosa en sangre, incluidas hiperglucemia e hipoglucemia, en pacientes tratados de forma concomitante con fluoroquinolonas y un agente antidiabético. Por lo tanto, se recomienda un control cuidadoso de la glucosa en sangre cuando estos agentes se administran conjuntamente [ver ADVERTENCIAS Y PRECAUCIONES , REACCIONES ADVERSAS , y INFORMACIÓN DEL PACIENTE ].
Fármacos anti-inflamatorios no esteroideos
La administración concomitante de un fármaco antiinflamatorio no esteroideo con una fluoroquinolona, incluido LEVAQUIN®, puede aumentar el riesgo de estimulación del SNC y ataques convulsivos [ver ADVERTENCIAS Y PRECAUCIONES ].
teofilina
No se detectó ningún efecto significativo de LEVAQUIN® sobre las concentraciones plasmáticas, el AUC y otros parámetros de disposición de la teofilina en un estudio clínico en el que participaron voluntarios sanos. De manera similar, no se observó ningún efecto aparente de la teofilina sobre la absorción y disposición de levofloxacina. Sin embargo, la administración concomitante de otras fluoroquinolonas con teofilina ha resultado en una vida media de eliminación prolongada, niveles séricos elevados de teofilina y un aumento posterior en el riesgo de reacciones adversas relacionadas con la teofilina en la población de pacientes. Por lo tanto, los niveles de teofilina deben controlarse de cerca y deben realizarse los ajustes de dosis apropiados cuando se coadministra LEVAQUIN®. Las reacciones adversas, incluidas las convulsiones, pueden ocurrir con o sin una elevación de los niveles séricos de teofilina [ver ADVERTENCIAS Y PRECAUCIONES ].
ciclosporina
No se detectó ningún efecto significativo de LEVAQUIN® sobre las concentraciones plasmáticas máximas, el AUC y otros parámetros de disposición de la ciclosporina en un estudio clínico en el que participaron voluntarios sanos. Sin embargo, se han informado niveles séricos elevados de ciclosporina en la población de pacientes cuando se administra junto con otras fluoroquinolonas. La Cmax y ke de levofloxacino fueron ligeramente inferiores, mientras que Tmax y t1/2 fueron ligeramente más largas en presencia de ciclosporina que las observadas en otros estudios sin medicación concomitante. Las diferencias, sin embargo, no se consideran clínicamente significativas. Por lo tanto, no es necesario ajustar la dosis de LEVAQUIN® o ciclosporina cuando se administran de forma concomitante.
Digoxina
No se detectó ningún efecto significativo de LEVAQUIN® sobre las concentraciones plasmáticas máximas, el AUC y otros parámetros de disposición de la digoxina en un estudio clínico en el que participaron voluntarios sanos. La cinética de absorción y disposición de levofloxacino fue similar en presencia o ausencia de digoxina. Por lo tanto, no es necesario ajustar la dosis de LEVAQUIN® o digoxina cuando se administran de forma concomitante.
probenecid y cimetidina
No se observó ningún efecto significativo de probenecid o cimetidina sobre la Cmax de levofloxacino en un estudio clínico en el que participaron voluntarios sanos. El AUC y la t1/2 de levofloxacino fueron mayores, mientras que CL/F y CLR fueron menores durante el tratamiento concomitante de LEVAQUIN® con probenecid o cimetidina en comparación con LEVAQUIN® solo. Sin embargo, estos cambios no justifican el ajuste de la dosis de LEVAQUIN® cuando se administran simultáneamente probenecid o cimetidina.
Interacciones con pruebas de laboratorio o de diagnóstico
Algunas fluoroquinolonas, incluida LEVAQUIN®, pueden producir resultados falsos positivos en el análisis de orina para opiáceos utilizando kits de inmunoensayo disponibles en el mercado. Puede ser necesaria la confirmación de exámenes de detección de opiáceos positivos mediante métodos más específicos.
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Reacciones adversas graves incapacitantes y potencialmente irreversibles, incluidas tendinitis y ruptura de tendones, neuropatía periférica y efectos sobre el sistema nervioso central
Las fluoroquinolonas, incluido LEVAQUIN®, se han asociado con reacciones adversas graves incapacitantes y potencialmente irreversibles de diferentes sistemas corporales que pueden ocurrir juntas en el mismo paciente. Las reacciones adversas comúnmente observadas incluyen tendinitis, ruptura de tendón, artralgia, mialgia, neuropatía periférica y efectos en el sistema nervioso central (alucinaciones, ansiedad, depresión, insomnio, dolores de cabeza intensos y confusión). Estas reacciones pueden ocurrir dentro de horas o semanas después de comenzar con LEVAQUIN®. Pacientes de cualquier edad o sin factores de riesgo preexistentes han experimentado estas reacciones adversas [ver Tendinitis y rotura de tendones, neuropatía periférica, efectos sobre el sistema nervioso central ].
Suspender LEVAQUIN® inmediatamente ante los primeros signos o síntomas de cualquier reacción adversa grave. Además, evite el uso de fluoroquinolonas, incluido LEVAQUIN®, en pacientes que hayan experimentado alguna de estas reacciones adversas graves asociadas con las fluoroquinolonas.
Tendinitis Y Rotura De Tendón
Las fluoroquinolonas, incluido LEVAQUIN®, se han asociado con un mayor riesgo de tendinitis y ruptura del tendón en todas las edades [ver Reacciones adversas graves incapacitantes y potencialmente irreversibles, incluidas tendinitis y ruptura de tendones, neuropatía periférica y efectos sobre el sistema nervioso central y REACCIONES ADVERSAS ]. Esta reacción adversa afecta con mayor frecuencia al tendón de Aquiles y también se ha informado en el manguito de los rotadores (el hombro), la mano, el bíceps, el pulgar y otros sitios tendinosos. La tendinitis o la ruptura del tendón pueden ocurrir horas o días después de comenzar con LEVAQUIN® o hasta varios meses después de completar la terapia con fluoroquinolonas. La tendinitis y la ruptura del tendón pueden ocurrir bilateralmente.
El riesgo de desarrollar tendinitis asociada con fluoroquinolonas y ruptura de tendones aumenta en pacientes mayores de 60 años, en aquellos que toman corticosteroides y en pacientes con trasplantes de riñón, corazón o pulmón. Otros factores que pueden aumentar de forma independiente el riesgo de ruptura del tendón incluyen la actividad física extenuante, la insuficiencia renal y los trastornos previos de los tendones, como la artritis reumatoide. Se han notificado casos de tendinitis y ruptura de tendones en pacientes que toman fluoroquinolonas y que no tienen los factores de riesgo anteriores. Suspender LEVAQUIN® inmediatamente si el paciente experimenta dolor, hinchazón, inflamación o ruptura de un tendón. Se debe recomendar a los pacientes que descansen ante el primer signo de tendinitis o ruptura del tendón, y que se comuniquen con su proveedor de atención médica para cambiar a un fármaco antimicrobiano sin quinolonas. Evite LEVAQUIN® en pacientes que tienen antecedentes de trastornos de los tendones o ruptura del tendón [ver REACCIONES ADVERSAS y INFORMACIÓN DEL PACIENTE ].
Neuropatía periférica
Las fluoroquinolonas, incluido LEVAQUIN®, se han asociado con un mayor riesgo de neuropatía periférica. Se han notificado casos de polineuropatía axonal sensitiva o sensitivomotora que afecta axones pequeños y/o grandes que provocan parestesias, hipoestesias, disestesias y debilidad en pacientes que reciben fluoroquinolonas, incluido LEVAQUIN®. Los síntomas pueden ocurrir poco después del inicio de LEVAQUIN® y pueden ser irreversibles en algunos pacientes [ver Reacciones adversas graves incapacitantes y potencialmente irreversibles, incluidas tendinitis y ruptura de tendones, neuropatía periférica y efectos sobre el sistema nervioso central y REACCIONES ADVERSAS ].
Descontinúe LEVAQUIN® inmediatamente si el paciente experimenta síntomas de neuropatía que incluyen dolor, ardor, hormigueo, entumecimiento y/o debilidad u otras alteraciones de la sensación, como tacto leve, dolor, temperatura, sentido de la posición y sensación vibratoria. Evite las fluoroquinolonas, incluido LEVAQUIN®, en pacientes que hayan experimentado previamente neuropatía periférica [ver REACCIONES ADVERSAS y INFORMACIÓN DEL PACIENTE ].
Efectos del sistema nervioso central
Las fluoroquinolonas, incluido LEVAQUIN®, se han asociado con un mayor riesgo de efectos en el sistema nervioso central (SNC), incluidas convulsiones, psicosis tóxicas, aumento de la presión intracraneal (incluido el pseudotumor cerebral). Las fluoroquinolonas también pueden causar estimulación del sistema nervioso central, lo que puede provocar temblores, inquietud, ansiedad, mareos, confusión, alucinaciones, paranoia, depresión, pesadillas e insomnio. También pueden ocurrir pensamientos suicidas e intento o suicidio consumado, especialmente en pacientes con antecedentes médicos de depresión o un factor de riesgo subyacente para la depresión. Estas reacciones pueden ocurrir después de la primera dosis. Si estas reacciones ocurren en pacientes que reciben LEVAQUIN®, suspenda LEVAQUIN® e instituya las medidas apropiadas. Al igual que con otras fluoroquinolonas, LEVAQUIN® debe usarse con precaución en pacientes con un trastorno conocido o sospechado del sistema nervioso central (SNC) que pueda predisponerlos a sufrir convulsiones o disminuir el umbral convulsivo (p. ej., arteriosclerosis cerebral grave, epilepsia) o en presencia de de otros factores de riesgo que pueden predisponerlos a convulsiones o reducir el umbral convulsivo (p. ej., ciertos tratamientos farmacológicos, disfunción renal). [ver REACCIONES ADVERSAS , INTERACCIONES CON LA DROGAS , y INFORMACIÓN DEL PACIENTE ].
Exacerbación de la miastenia grave
Las fluoroquinolonas, incluido LEVAQUIN®, tienen actividad de bloqueo neuromuscular y pueden exacerbar la debilidad muscular en pacientes con miastenia grave. Las reacciones adversas graves posteriores a la comercialización, incluidas la muerte y la necesidad de soporte ventilatorio, se han asociado con el uso de fluoroquinolonas en pacientes con miastenia grave. Evite LEVAQUIN® en pacientes con antecedentes conocidos de miastenia grave [ver REACCIONES ADVERSAS y INFORMACIÓN DEL PACIENTE ].
Otras reacciones adversas graves y, en ocasiones, mortales
En raras ocasiones se han informado otras reacciones adversas graves ya veces mortales, algunas debidas a hipersensibilidad y otras de etiología incierta, en pacientes que reciben terapia con fluoroquinolonas, incluido LEVAQUIN®. Estos eventos pueden ser graves y generalmente ocurren después de la administración de dosis múltiples. Las manifestaciones clínicas pueden incluir una o más de las siguientes:
- fiebre, sarpullido o reacciones dermatológicas graves (p. ej., necrólisis epidérmica tóxica, síndrome de Stevens-Johnson);
- vasculitis; artralgia; mialgia; enfermedad del suero;
- neumonitis alérgica;
- nefritis intersticial; insuficiencia o falla renal aguda;
- hepatitis; ictericia; necrosis o insuficiencia hepática aguda;
- anemia, incluyendo hemolítica y aplásica; trombocitopenia, incluyendo púrpura trombocitopénica trombótica; leucopenia; agranulocitosis; pancitopenia; y/u otras anomalías hematológicas.
Interrumpa LEVAQUIN® inmediatamente ante la primera aparición de erupción cutánea, ictericia o cualquier otro signo de hipersensibilidad e instituya medidas de apoyo [ver REACCIONES ADVERSAS y INFORMACIÓN DEL PACIENTE ].
Reacciones hipersensibles
Se han informado hipersensibilidad grave y ocasionalmente fatal y/o reacciones anafilácticas en pacientes que reciben terapia con fluoroquinolonas, incluido LEVAQUIN®. Estas reacciones a menudo ocurren después de la primera dosis. Algunas reacciones han estado acompañadas de colapso cardiovascular, hipotensión/choque, convulsiones, pérdida del conocimiento, hormigueo, angioedema (incluyendo edema/hinchazón de la lengua, laringe, garganta o cara), obstrucción de las vías respiratorias (incluyendo broncoespasmo, falta de aliento y dificultad respiratoria aguda). angustia), disnea, urticaria, picazón y otras reacciones cutáneas graves. LEVAQUIN® debe suspenderse inmediatamente ante la primera aparición de una erupción cutánea o cualquier otro signo de hipersensibilidad. Las reacciones graves de hipersensibilidad aguda pueden requerir tratamiento con epinefrina y otras medidas de reanimación, como oxígeno, fluidos intravenosos, antihistamínicos, corticosteroides, aminas presoras y control de las vías respiratorias, según esté clínicamente indicado [ver REACCIONES ADVERSAS y INFORMACIÓN DEL PACIENTE ].
hepatotoxicidad
Se han recibido informes posteriores a la comercialización de hepatotoxicidad severa (incluyendo hepatitis aguda y eventos fatales) para pacientes tratados con LEVAQUIN®. No se detectó evidencia de hepatotoxicidad grave asociada con el fármaco en ensayos clínicos de más de 7000 pacientes. La hepatotoxicidad severa generalmente ocurrió dentro de los 14 días posteriores al inicio de la terapia y la mayoría de los casos ocurrieron dentro de los 6 días. La mayoría de los casos de hepatotoxicidad grave no se asociaron con hipersensibilidad [ver Otras reacciones adversas graves y, en ocasiones, mortales ].
La mayoría de los informes fatales de hepatotoxicidad ocurrieron en pacientes de 65 años o más y la mayoría no se asoció con hipersensibilidad. LEVAQUIN® debe suspenderse inmediatamente si el paciente desarrolla signos y síntomas de hepatitis [ver REACCIONES ADVERSAS y INFORMACIÓN DEL PACIENTE ].
Diarrea asociada a Clostridium difficile
Se ha informado diarrea asociada a Clostridium difficile (CDAD) con el uso de casi todos los agentes antibacterianos, incluido LEVAQUIN®, y puede variar en gravedad desde diarrea leve hasta colitis fatal. El tratamiento con agentes antibacterianos altera la flora normal del colon y conduce al crecimiento excesivo de C. difficile.
C. difficile produce toxinas A y B que contribuyen al desarrollo de CDAD. Las cepas de C. difficile productoras de hipertoxina causan mayor morbilidad y mortalidad, ya que estas infecciones pueden ser refractarias a la terapia antimicrobiana y pueden requerir colectomía. Se debe considerar CDAD en todos los pacientes que presenten diarrea después del uso de antibióticos. Es necesaria una cuidadosa historia clínica ya que se ha informado que la CDAD ocurre más de dos meses después de la administración de agentes antibacterianos.
Si se sospecha o se confirma CDAD, es posible que deba suspenderse el uso continuo de antibióticos no dirigidos contra C. difficile. Se debe instituir el manejo adecuado de líquidos y electrolitos, la suplementación con proteínas, el tratamiento con antibióticos de C. difficile y la evaluación quirúrgica según esté clínicamente indicado [ver REACCIONES ADVERSAS y INFORMACIÓN DEL PACIENTE ].
Prolongación del intervalo QT
Algunas fluoroquinolonas, incluida LEVAQUIN®, se han asociado con la prolongación del intervalo QT en el electrocardiograma y casos poco frecuentes de arritmia. Se informaron espontáneamente casos raros de torsade de pointes durante la vigilancia posterior a la comercialización en pacientes que recibieron fluoroquinolonas, incluido LEVAQUIN®. LEVAQUIN® debe evitarse en pacientes con prolongación conocida del intervalo QT, pacientes con hipopotasemia no corregida y pacientes que reciben agentes antiarrítmicos de Clase IA (quinidina, procainamida) o Clase III (amiodarona, sotalol). Los pacientes de edad avanzada pueden ser más susceptibles a los efectos asociados al fármaco en el intervalo QT [ver REACCIONES ADVERSAS , Uso en poblaciones específicas , y INFORMACIÓN DEL PACIENTE ].
Trastornos musculoesqueléticos en pacientes pediátricos y efectos artropáticos en animales
LEVAQUIN® está indicado en pacientes pediátricos (6 meses de edad y mayores) solo para la prevención del ántrax por inhalación (posterior a la exposición) y para la peste [ver INDICACIONES ]. Se ha observado una mayor incidencia de trastornos musculoesqueléticos (artralgia, artritis, tendinopatía y anomalías de la marcha) en comparación con los controles en pacientes pediátricos que reciben LEVAQUIN® [ver Uso en poblaciones específicas ].
En ratas y perros inmaduros, la administración oral e intravenosa de levofloxacino provocó un aumento de la osteocondrosis. El examen histopatológico de las articulaciones que soportan peso de perros inmaduros que recibieron dosis de levofloxacino reveló lesiones persistentes del cartílago. Otras fluoroquinolonas también producen erosiones similares en las articulaciones que soportan peso y otros signos de artropatía en animales inmaduros de varias especies [ver Farmacología Animal ].
Alteraciones de la glucosa en sangre
Al igual que con otras fluoroquinolonas, se han informado alteraciones de la glucosa en sangre, incluidas hiperglucemia e hipoglucemia sintomáticas, con LEVAQUIN®, generalmente en pacientes diabéticos que reciben tratamiento concomitante con un agente hipoglucemiante oral (p. ej., gliburida) o con insulina. En estos pacientes, se recomienda un control cuidadoso de la glucosa en sangre. Si ocurre una reacción hipoglucémica en un paciente que está siendo tratado con LEVAQUIN®, se debe suspender LEVAQUIN® y se debe iniciar la terapia adecuada de inmediato [ver REACCIONES ADVERSAS , INTERACCIONES CON LA DROGAS y INFORMACIÓN DEL PACIENTE ].
Fotosensibilidad/Fototoxicidad
Reacciones de fotosensibilidad/fototoxicidad de moderadas a graves, la última de las cuales puede manifestarse como reacciones exageradas de quemadura solar (p. ej., ardor, eritema, exudación, vesículas, ampollas, edema) en áreas expuestas a la luz (por lo general, la cara, el área en "V" del cuello , superficies extensoras de los antebrazos, dorso de las manos), puede asociarse con el uso de fluoroquinolonas después de la exposición solar o a la luz ultravioleta. Por lo tanto, debe evitarse la exposición excesiva a estas fuentes de luz. El tratamiento farmacológico debe suspenderse si se produce fotosensibilidad/fototoxicidad [ver REACCIONES ADVERSAS y INFORMACIÓN DEL PACIENTE ].
Desarrollo de bacterias resistentes a los medicamentos
Prescribir LEVAQUIN® en ausencia de una infección bacteriana comprobada o fuertemente sospechada o una indicación profiláctica es poco probable que brinde beneficios al paciente y aumenta el riesgo de desarrollo de bacterias resistentes a los medicamentos [ver INFORMACIÓN DEL PACIENTE ].
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( Guía de medicamentos ).
Reacciones adversas graves
Aconseje a los pacientes que dejen de tomar LEVAQUIN® si experimentan una reacción adversa y que llamen a su proveedor de atención médica para recibir asesoramiento sobre cómo completar el ciclo completo de tratamiento con otro fármaco antibacteriano.
Informe a los pacientes sobre las siguientes reacciones adversas graves que se han asociado con LEVAQUIN® u otras fluoroquinolonas:
- Reacciones adversas graves incapacitantes y potencialmente irreversibles que pueden ocurrir juntas: Informe a los pacientes que las reacciones adversas graves incapacitantes y potencialmente irreversibles, que incluyen tendinitis y ruptura de tendones, neuropatías periféricas y efectos en el sistema nervioso central, se han asociado con el uso de LEVAQUIN® y pueden ocurrir juntas en el mismo paciente. Informe a los pacientes que dejen de tomar LEVAQUIN® de inmediato si experimentan una reacción adversa y que llamen a su proveedor de atención médica.
- Tendinitis y Rotura de Tendón: Indique a los pacientes que se comuniquen con su proveedor de atención médica si experimentan dolor, hinchazón o inflamación de un tendón, o debilidad o incapacidad para usar una de sus articulaciones; descansar y abstenerse de hacer ejercicio; y suspenda el tratamiento con LEVAQUIN®. Los síntomas pueden ser irreversibles. El riesgo de trastorno grave de los tendones con fluoroquinolonas es mayor en pacientes mayores, generalmente mayores de 60 años, en pacientes que toman corticosteroides y en pacientes con trasplantes de riñón, corazón o pulmón.
- Neuropatías periféricas: Informe a los pacientes que se han asociado neuropatías periféricas con el uso de levofloxacino, los síntomas pueden ocurrir poco después del inicio de la terapia y pueden ser irreversibles. Si se desarrollan síntomas de neuropatía periférica que incluyen dolor, ardor, hormigueo, entumecimiento y/o debilidad, suspenda inmediatamente LEVAQUIN® y dígale que se comunique con su médico.
- Efectos del sistema nervioso central (por ejemplo, convulsiones, mareos, aturdimiento, aumento de la presión intracraneal): Informe a los pacientes que se han informado convulsiones en pacientes que reciben fluoroquinolonas, incluida la levofloxacina. Indique a los pacientes que notifiquen a su médico antes de tomar este medicamento si tienen antecedentes de convulsiones. Informe a los pacientes que deben saber cómo reaccionan a LEVAQUIN® antes de operar un automóvil o maquinaria o participar en otras actividades que requieran agudeza mental y coordinación. Indique a los pacientes que notifiquen a su médico si se produce un dolor de cabeza persistente con o sin visión borrosa.
- Exacerbación de la miastenia grave: Indique a los pacientes que informen a su médico sobre cualquier antecedente de miastenia gravis. Indique a los pacientes que notifiquen a su médico si experimentan algún síntoma de debilidad muscular, incluidas las dificultades respiratorias.
- Reacciones hipersensibles : Informe a los pacientes que la levofloxacina puede causar reacciones de hipersensibilidad, incluso después de una dosis única, y que suspenda el medicamento ante el primer signo de erupción cutánea, urticaria u otras reacciones cutáneas, latidos cardíacos rápidos, dificultad para tragar o respirar, cualquier hinchazón que sugiera angioedema ( por ejemplo, hinchazón de labios, lengua, cara, opresión en la garganta, ronquera) u otros síntomas de una reacción alérgica.
- Hepatotoxicidad: Informe a los pacientes que se ha informado hepatotoxicidad grave (que incluye hepatitis aguda y eventos fatales) en pacientes que toman LEVAQUIN®. Indique a los pacientes que informen a su médico si experimentan signos o síntomas de daño hepático, incluidos: pérdida de apetito, náuseas, vómitos, fiebre, debilidad, cansancio, sensibilidad en el cuadrante superior derecho, picazón, piel y ojos amarillentos, heces de color claro. u orina de color oscuro.
- Diarrea: La diarrea es un problema común causado por los antibióticos que generalmente termina cuando se suspende el antibiótico. A veces, después de comenzar el tratamiento con antibióticos, los pacientes pueden desarrollar heces acuosas y sanguinolentas (con o sin calambres estomacales y fiebre) incluso dos o más meses después de haber tomado la última dosis del antibiótico. Si esto ocurre, indique a los pacientes que se comuniquen con su médico lo antes posible.
- Prolongación del Intervalo QT: Indique a los pacientes que informen a su médico sobre cualquier antecedente personal o familiar de prolongación del intervalo QT o condiciones proarrítmicas como hipopotasemia, bradicardia o isquemia miocárdica reciente; si están tomando cualquier agente antiarrítmico de Clase IA (quinidina, procainamida) o Clase III (amiodarona, sotalol). Indique a los pacientes que notifiquen a su médico si tienen algún síntoma de prolongación del intervalo QT, incluidas palpitaciones cardíacas prolongadas o pérdida del conocimiento.
- Trastornos musculoesqueléticos en pacientes pediátricos: Indique a los padres que informen al médico de su hijo si el niño tiene antecedentes de problemas relacionados con las articulaciones antes de tomar este medicamento. Informe a los padres de pacientes pediátricos que notifiquen al médico de su hijo sobre cualquier problema relacionado con las articulaciones que ocurra durante o después de la terapia con levofloxacina [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
- Fotosensibilidad/Fototoxicidad: Informe a los pacientes que se ha notificado fotosensibilidad/fototoxicidad en pacientes que reciben fluoroquinolonas. Informar a los pacientes para minimizar o evitar la exposición a la luz solar natural o artificial (camas de bronceado o tratamiento UVA/B) mientras toman fluoroquinolonas. Si los pacientes necesitan estar al aire libre mientras usan fluoroquinolonas, indíqueles que usen ropa holgada que proteja la piel de la exposición al sol y hable con su médico sobre otras medidas de protección solar. Si se produce una reacción similar a una quemadura de sol o una erupción en la piel, indique a los pacientes que se comuniquen con su médico.
Resistencia antibacteriana
Los medicamentos antibacterianos, incluido LEVAQUIN®, solo deben usarse para tratar infecciones bacterianas. No tratan infecciones virales (p. ej., el resfriado común). Cuando se prescribe LEVAQUIN® para tratar una infección bacteriana, se debe informar a los pacientes que, aunque es común que se sientan mejor al comienzo de la terapia, el medicamento debe tomarse exactamente como se indica. Omitir dosis o no completar el curso completo de la terapia puede (1) disminuir la eficacia del tratamiento inmediato y (2) aumentar la probabilidad de que las bacterias desarrollen resistencia y no sean tratables con LEVAQUIN® u otros medicamentos antibacterianos en el futuro.
Administración con alimentos, líquidos y medicamentos concomitantes
Se debe informar a los pacientes que los comprimidos de LEVAQUIN® pueden tomarse con o sin alimentos. Los comprimidos deben tomarse a la misma hora todos los días.
Los pacientes deben beber abundantes líquidos mientras toman LEVAQUIN® para evitar la formación de una orina altamente concentrada y la formación de cristales en la orina.
Los antiácidos que contienen magnesio o aluminio, así como sucralfato, cationes metálicos como el hierro y las preparaciones multivitamínicas con zinc o didanosina deben tomarse al menos dos horas antes o dos horas después de la administración oral de LEVAQUIN®.
Interacciones farmacológicas con insulina, hipoglucemiantes orales y warfarina
Se debe informar a los pacientes que si son diabéticos y están siendo tratados con insulina o un agente hipoglucemiante oral y ocurre una reacción hipoglucémica, deben suspender LEVAQUIN® y consultar a un médico.
Se debe informar a los pacientes que la administración concurrente de warfarina y LEVAQUIN® se ha asociado con aumentos del índice internacional normalizado (INR) o tiempo de protrombina y episodios clínicos de sangrado. Los pacientes deben notificar a su médico si están tomando warfarina, ser monitoreados por evidencia de sangrado y también deben controlar de cerca sus pruebas de anticoagulación mientras toman warfarina concomitantemente.
Estudios de peste y ántrax
Se debe informar a los pacientes que reciben LEVAQUIN® para estas afecciones que los estudios de eficacia no se pueden realizar en humanos por razones éticas y de viabilidad. Por lo tanto, la aprobación de estas condiciones se basó en estudios de eficacia realizados en animales.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
En un bioensayo de por vida en ratas, la levofloxacina no mostró potencial carcinogénico luego de la administración dietética diaria durante 2 años; la dosis más alta (100 mg/kg/día) fue 1,4 veces la dosis humana más alta recomendada (750 mg) según el área de superficie corporal relativa. La levofloxacina no acortó el tiempo de desarrollo tumoral de los tumores cutáneos inducidos por UV en ratones albinos sin pelo (Skh-1) con cualquier nivel de dosis de levofloxacina y, por lo tanto, no fue fotocarcinogénico en las condiciones de este estudio. Las concentraciones dérmicas de levofloxacino en los ratones sin pelo oscilaron entre 25 y 42 mcg/g en el nivel de dosis de levofloxacino más alto (300 mg/kg/día) utilizado en el estudio de fotocarcinogenicidad. En comparación, las concentraciones dérmicas de levofloxacina en sujetos humanos que recibieron 750 mg de LEVAQUIN® promediaron aproximadamente 11,8 mcg/ga Cmax.
La levofloxacina no fue mutagénica en los siguientes ensayos: ensayo de mutación bacteriana de Ames (S. typhimurium y E. coli), ensayo de mutación directa de CHO/HGPRT, prueba de micronúcleo de ratón, prueba letal dominante en ratón, ensayo de síntesis de ADN no programada en rata y cromátida hermana de ratón ensayo de intercambio Fue positivo en los ensayos in vitro de aberración cromosómica (línea celular CHL) y de intercambio de cromátidas hermanas (línea celular CHL/IU).
La levofloxacina no causó deterioro de la fertilidad o el rendimiento reproductivo en ratas a dosis orales de hasta 360 mg/kg/día, que corresponde a 4,2 veces la dosis humana más alta recomendada según el área de superficie corporal relativa y dosis intravenosas de hasta 100 mg/kg/ día, correspondiente a 1,2 veces la dosis humana más alta recomendada en función del área de superficie corporal relativa.
Uso en poblaciones específicas
El embarazo
Embarazo Categoría C
La levofloxacina no fue teratogénica en ratas en dosis de hasta 810 mg/kg/día, lo que corresponde a 9,4 veces la dosis oral más alta recomendada en humanos según el área de superficie corporal relativa. La dosis oral de 810 mg/kg/día a ratas provocó una disminución del peso corporal fetal y un aumento de la mortalidad fetal. No se observó teratogenicidad cuando a los conejos se les administró una dosis oral de hasta 50 mg/kg/día, lo que corresponde a 1,1 veces la dosis oral más alta recomendada para humanos en función del área de superficie corporal relativa.
Sin embargo, no existen estudios adecuados y bien controlados en mujeres embarazadas. LEVAQUIN® debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto.
Madres lactantes
Según los datos de otras fluoroquinolonas y los datos muy limitados de LEVAQUIN®, se puede suponer que la levofloxacina se excretará en la leche humana. Debido al potencial de reacciones adversas graves de LEVAQUIN® en lactantes, se debe tomar la decisión de suspender la lactancia o suspender el medicamento, teniendo en cuenta la importancia del medicamento para la madre.
Uso pediátrico
Las quinolonas, incluida la levofloxacina, causan artropatía y osteocondrosis en animales jóvenes de varias especies. [ver ADVERTENCIAS Y PRECAUCIONES y Farmacología Animal ].
Ántrax por inhalación (posterior a la exposición)
La levofloxacina está indicada en pacientes pediátricos de 6 meses de edad y mayores, para el ántrax por inhalación (posexposición). La evaluación de riesgo-beneficio indica que la administración de levofloxacino a pacientes pediátricos es adecuada. No se ha estudiado la seguridad de levofloxacino en pacientes pediátricos tratados durante más de 14 días [ver INDICACIONES , DOSIFICACIÓN Y ADMINISTRACIÓN y Estudios clínicos ].
Plaga
La levofloxacina está indicada en pacientes pediátricos, a partir de los 6 meses de edad, para el tratamiento de la peste, incluida la peste neumónica y septicémica debida a Yersinia pestis (Y. pestis) y la profilaxis de la peste. Los estudios de eficacia de LEVAQUIN® no se pudieron realizar en humanos con peste neumónica por razones éticas y de factibilidad. Por lo tanto, la aprobación de esta indicación se basó en un estudio de eficacia realizado en animales. La evaluación de riesgo-beneficio indica que la administración de levofloxacino a pacientes pediátricos es apropiada [ver INDICACIONES , DOSIFICACIÓN Y ADMINISTRACIÓN y Estudios clínicos ].
No se ha establecido la seguridad y eficacia de LEVAQUIN® en pacientes pediátricos menores de seis meses.
Farmacocinética después de la administración intravenosa
La farmacocinética de levofloxacino después de una dosis intravenosa única se investigó en pacientes pediátricos con edades comprendidas entre los seis meses y los 16 años. Los pacientes pediátricos eliminaron levofloxacino más rápido que los pacientes adultos, lo que resultó en exposiciones plasmáticas más bajas que los adultos para una dosis determinada de mg/kg [ver FARMACOLOGÍA CLÍNICA y Estudios clínicos ].
Posología en pacientes pediátricos con carbunco inhalatorio o peste
Para conocer la dosis recomendada de comprimidos de LEVAQUIN® en pacientes pediátricos con ántrax por inhalación o peste, consulte DOSIFICACIÓN Y ADMINISTRACIÓN . Las tabletas de LEVAQUIN® no se pueden administrar a pacientes pediátricos que pesen menos de 30 kg debido a las limitaciones de las concentraciones disponibles. Se pueden considerar formulaciones alternativas de levofloxacino para pacientes pediátricos que pesen menos de 30 kg.
Reacciones adversas
En ensayos clínicos, 1534 pacientes pediátricos (6 meses a 16 años de edad) fueron tratados con LEVAQUIN® oral e intravenoso. Los pacientes pediátricos de 6 meses a 5 años recibieron LEVAQUIN® 10 mg/kg dos veces al día y los pacientes pediátricos mayores de 5 años recibieron 10 mg/kg una vez al día (máximo 500 mg por día) durante aproximadamente 10 días. Las tabletas de LEVAQUIN® solo se pueden administrar a pacientes pediátricos con ántrax por inhalación (posterior a la exposición) o peste que pesan 30 kg o más debido a las limitaciones de las concentraciones disponibles [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Un subconjunto de pacientes pediátricos en los ensayos clínicos (1340 tratados con LEVAQUIN® y 893 tratados sin fluoroquinolonas) se inscribieron en un estudio prospectivo de vigilancia a largo plazo para evaluar la incidencia de trastornos musculoesqueléticos definidos en el protocolo (artralgia, artritis, tendinopatía, anomalías en la marcha). ) durante 60 días y 1 año después de la primera dosis del fármaco del estudio. Los pacientes pediátricos tratados con LEVAQUIN® tuvieron una incidencia significativamente mayor de trastornos musculoesqueléticos en comparación con los niños no tratados con fluoroquinolonas, como se ilustra en la Tabla 7. Las tabletas de LEVAQUIN® solo se pueden administrar a pacientes pediátricos con ántrax por inhalación (posterior a la exposición) o peste. que pesan 30 kg o más debido a las limitaciones de las fuerzas disponibles [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
La artralgia fue el trastorno musculoesquelético más frecuente en ambos grupos de tratamiento. La mayoría de los trastornos musculoesqueléticos en ambos grupos involucraron múltiples articulaciones que soportan peso. Los trastornos fueron moderados en 8/46 (17%) niños y leves en 35/46 (76%) pacientes pediátricos tratados con LEVAQUIN® y la mayoría fueron tratados con analgésicos. El tiempo medio de resolución fue de 7 días para los pacientes pediátricos tratados con LEVAQUIN® y de 9 días para los niños no tratados con fluoroquinolonas (aproximadamente el 80 % se resolvió en 2 meses en ambos grupos). Ningún paciente pediátrico presentó un trastorno grave o grave y todos los trastornos musculoesqueléticos se resolvieron sin secuelas.
Los vómitos y la diarrea fueron las reacciones adversas notificadas con mayor frecuencia, con una frecuencia similar en los pacientes pediátricos tratados con LEVAQUIN® y los no tratados con fluoroquinolonas.
Además de las reacciones adversas notificadas en pacientes pediátricos en ensayos clínicos, las reacciones adversas notificadas en adultos durante los ensayos clínicos o la experiencia posterior a la comercialización [ver REACCIONES ADVERSAS ] también se puede esperar que ocurra en pacientes pediátricos.
Uso geriátrico
Los pacientes geriátricos tienen un mayor riesgo de desarrollar trastornos graves de los tendones, incluida la ruptura del tendón, cuando reciben tratamiento con una fluoroquinolona como LEVAQUIN®. Este riesgo aumenta aún más en pacientes que reciben tratamiento concomitante con corticosteroides. La tendinitis o ruptura del tendón puede afectar el tendón de Aquiles, la mano, el hombro u otros sitios del tendón y puede ocurrir durante o después de completar la terapia; Se han informado casos que ocurrieron hasta varios meses después del tratamiento con fluoroquinolonas. Se debe tener precaución al prescribir LEVAQUIN® a pacientes de edad avanzada, especialmente a aquellos que toman corticosteroides. Se debe informar a los pacientes sobre este posible efecto secundario y aconsejarles que descontinúen LEVAQUIN® y se comuniquen con su proveedor de atención médica si se presentan síntomas de tendinitis o ruptura del tendón [ver CUADRO DE ADVERTENCIA ; ADVERTENCIAS Y PRECAUCIONES ; y REACCIONES ADVERSAS ].
En los ensayos clínicos de fase 3, 1945 pacientes tratados con LEVAQUIN® (26 %) tenían ≥ 65 años de edad. De estos, 1081 pacientes (14 %) tenían entre 65 y 74 años y 864 pacientes (12 %) tenían 75 años o más. No se observaron diferencias generales en seguridad o eficacia entre estos sujetos y sujetos más jóvenes, pero no se puede descartar una mayor sensibilidad de algunos individuos mayores.
Se han informado casos graves, y en ocasiones fatales, de hepatotoxicidad después de la comercialización en asociación con LEVAQUIN®. La mayoría de los informes fatales de hepatotoxicidad ocurrieron en pacientes de 65 años o más y la mayoría no se asoció con hipersensibilidad. LEVAQUIN® debe suspenderse inmediatamente si el paciente desarrolla signos y síntomas de hepatitis [ver ADVERTENCIAS Y PRECAUCIONES ].
Los pacientes de edad avanzada pueden ser más susceptibles a los efectos asociados al fármaco en el intervalo QT. Por lo tanto, se debe tener precaución cuando se usa LEVAQUIN® con medicamentos concomitantes que pueden resultar en la prolongación del intervalo QT (p. ej., antiarrítmicos Clase IA o Clase III) o en pacientes con factores de riesgo de torsade de pointes (p. ej., prolongación QT conocida, hipopotasemia) [ver ADVERTENCIAS Y PRECAUCIONES ].
Las propiedades farmacocinéticas de levofloxacino en adultos jóvenes y ancianos no difieren significativamente cuando se tiene en cuenta el aclaramiento de creatinina. Sin embargo, dado que se sabe que el fármaco se excreta sustancialmente por vía renal, el riesgo de reacciones tóxicas a este fármaco puede ser mayor en pacientes con insuficiencia renal. Debido a que es más probable que los pacientes de edad avanzada tengan una función renal disminuida, se debe tener cuidado en la selección de la dosis y puede ser útil monitorear la función renal [ver FARMACOLOGÍA CLÍNICA ].
Insuficiencia renal
El aclaramiento de levofloxacino se reduce sustancialmente y la vida media de eliminación plasmática se prolonga sustancialmente en pacientes con insuficiencia renal (aclaramiento de creatinina DOSIFICACIÓN Y ADMINISTRACIÓN ].
Deterioro hepático
No se han realizado estudios farmacocinéticos en pacientes con insuficiencia hepática. Debido al alcance limitado del metabolismo de levofloxacino, no se espera que la farmacocinética de levofloxacino se vea afectada por la insuficiencia hepática.
SOBREDOSIS
En caso de sobredosis aguda, se debe vaciar el estómago. Se debe observar al paciente y mantener una hidratación adecuada. La levofloxacina no se elimina de manera eficaz mediante hemodiálisis o diálisis peritoneal.
LEVAQUIN® presenta un bajo potencial de toxicidad aguda. Ratones, ratas, perros y monos exhibieron los siguientes signos clínicos después de recibir una sola dosis alta de LEVAQUIN®: ataxia, ptosis, disminución de la actividad locomotora, disnea, postración, temblores y convulsiones. Dosis superiores a 1500 mg/kg por vía oral y 250 mg/kg IV produjeron una mortalidad significativa en roedores.
CONTRAINDICACIONES
LEVAQUIN® está contraindicado en personas con hipersensibilidad conocida a la levofloxacina u otros antibacterianos de quinolona [ver ADVERTENCIAS Y PRECAUCIONES ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
Levofloxacina es un miembro de la clase de fluoroquinolonas de agentes antibacterianos. ver Microbiología ].
Farmacocinética
Los parámetros farmacocinéticos medios ± DE de levofloxacino determinados en condiciones únicas y de estado estacionario después de la administración de los comprimidos orales se resumen en la Tabla 8.
La farmacocinética de levofloxacino es lineal y predecible después de regímenes de dosificación orales o IV únicos y múltiples. Las condiciones de estado estacionario se alcanzan dentro de las 48 horas posteriores a un régimen de dosificación de 500 mg o 750 mg una vez al día. Las concentraciones plasmáticas máximas y mínimas medias ± DE alcanzadas después de múltiples regímenes de dosificación oral una vez al día fueron aproximadamente 5,7 ± 1,4 y 0,5 ± 0,2 mcg/ml después de las dosis de 500 mg, y 8,6 ± 1,9 y 1,1 ± 0,4 mcg/ml después de las dosis de 750 mg. mg dosis, respectivamente. Las concentraciones plasmáticas máximas y mínimas medias ± DE alcanzadas después de múltiples regímenes intravenosos una vez al día fueron de aproximadamente 6,4 ± 0,8 y 0,6 ± 0,2 mcg/ml después de las dosis de 500 mg, y de 12,1 ± 4,1 y 1,3 ± 0,71 mcg/ml después de las dosis de 750 mg. dosis, respectivamente.
Absorción
Levofloxacino se absorbe rápida y esencialmente por completo después de la administración oral. Las concentraciones plasmáticas máximas generalmente se alcanzan una o dos horas después de la administración oral. La biodisponibilidad absoluta de levofloxacina de una tableta de 500 mg y una tableta de 750 mg de LEVAQUIN® es aproximadamente del 99 %, lo que demuestra una absorción oral completa de levofloxacina. Después de una dosis intravenosa única de LEVAQUIN® a voluntarios sanos, la concentración plasmática máxima media ± DE alcanzada fue de 6,2 ± 1,0 mcg/mL después de una dosis de 500 mg infundida durante 60 minutos y de 11,5 ± 4,0 mcg/mL después de una dosis de 750 mg infundida durante 60 minutos. 90 minutos. La administración oral de una dosis de 500 mg de LEVAQUIN® con alimentos prolonga el tiempo hasta la concentración máxima en aproximadamente 1 hora y disminuye la concentración máxima en aproximadamente un 14 % después de la tableta y aproximadamente un 25 % después de la administración de la solución oral. Por lo tanto, las tabletas de LEVAQUIN® se pueden administrar sin tener en cuenta los alimentos.
El perfil de concentración plasmática de levofloxacino después de la administración IV es similar y comparable en el grado de exposición (AUC) al observado para las tabletas de LEVAQUIN® cuando se administran dosis iguales (mg/mg). Por lo tanto, las vías de administración oral e IV pueden considerarse intercambiables.
Distribución
El volumen medio de distribución de levofloxacino generalmente oscila entre 74 y 112 l después de dosis únicas y múltiples de 500 mg o 750 mg, lo que indica una amplia distribución en los tejidos corporales. La levofloxacina alcanza sus niveles máximos en los tejidos de la piel y en el líquido de las ampollas de sujetos sanos aproximadamente 3 horas después de la dosificación. La relación entre el AUC de la biopsia de tejido cutáneo y el plasma es de aproximadamente 2 y la relación entre el AUC del líquido de la ampolla y el plasma es de aproximadamente 1 después de la administración oral múltiple una vez al día de dosis de 750 mg y 500 mg de LEVAQUIN®, respectivamente, a sujetos sanos. La levofloxacina también penetra bien en los tejidos pulmonares. Las concentraciones en tejido pulmonar fueron generalmente de 2 a 5 veces más altas que las concentraciones plasmáticas y oscilaron entre aproximadamente 2,4 y 11,3 mcg/g durante un período de 24 horas después de una dosis oral única de 500 mg.
In vitro, en un rango clínicamente relevante (1 a 10 mcg/mL) de concentraciones de levofloxacina en suero/plasma, la levofloxacina se une aproximadamente en un 24 a 38 % a las proteínas séricas en todas las especies estudiadas, según lo determinado por el método de diálisis de equilibrio. Levofloxacino se une principalmente a la albúmina sérica en humanos. La unión de levofloxacino a las proteínas séricas es independiente de la concentración del fármaco.
Eliminación
Metabolismo
Levofloxacina es estereoquímicamente estable en plasma y orina y no se invierte metabólicamente a su enantiómero, D-ofloxacina. La levofloxacina sufre un metabolismo limitado en humanos y se excreta principalmente como fármaco inalterado en la orina. Luego de la administración oral, aproximadamente el 87 % de la dosis administrada se recuperó como fármaco inalterado en la orina dentro de las 48 horas, mientras que menos del 4 % de la dosis se recuperó en las heces en 72 horas. Menos del 5% de una dosis administrada se recuperó en la orina como metabolitos desmetilado y N-óxido, los únicos metabolitos identificados en humanos. Estos metabolitos tienen poca actividad farmacológica relevante.
Excreción
La levofloxacina se excreta en gran medida como fármaco inalterado en la orina. La semivida de eliminación plasmática terminal media de levofloxacino oscila entre aproximadamente 6 y 8 horas después de dosis únicas o múltiples de levofloxacino administradas por vía oral o intravenosa. La depuración corporal total aparente media y la depuración renal oscilan entre aproximadamente 144 y 226 ml/min y entre 96 y 142 ml/min, respectivamente. El aclaramiento renal superior a la tasa de filtración glomerular sugiere que se produce una secreción tubular de levofloxacina además de su filtración glomerular. La administración concomitante de cimetidina o probenecid produce una reducción de aproximadamente un 24 % y un 35 % en el aclaramiento renal de levofloxacino, respectivamente, lo que indica que la secreción de levofloxacino se produce en el túbulo proximal renal. No se encontraron cristales de levofloxacina en ninguna de las muestras de orina recién recolectadas de sujetos que recibieron LEVAQUIN®.
Poblaciones Específicas
Pacientes geriátricos
No hay diferencias significativas en la farmacocinética de levofloxacino entre sujetos jóvenes y ancianos cuando los sujetos' se tienen en cuenta las diferencias en el aclaramiento de creatinina. Luego de una dosis oral de 500 mg de LEVAQUIN® a sujetos sanos de edad avanzada (66 a 80 años de edad), la vida media de eliminación plasmática terminal promedio de levofloxacino fue de aproximadamente 7,6 horas, en comparación con aproximadamente 6 horas en adultos más jóvenes. La diferencia se atribuyó a la variación en el estado de la función renal de los sujetos y no se consideró clínicamente significativa. La absorción del fármaco parece no verse afectada por la edad. No es necesario ajustar la dosis de LEVAQUIN® basándose únicamente en la edad [ver Uso en poblaciones específicas ].
Pacientes pediátricos
Se investigó la farmacocinética de levofloxacino después de una dosis intravenosa única de 7 mg/kg en pacientes pediátricos con edades comprendidas entre los 6 meses y los 16 años. Los pacientes pediátricos eliminaron levofloxacino más rápido que los pacientes adultos, lo que resultó en exposiciones plasmáticas más bajas que los adultos para una dosis determinada de mg/kg. Los análisis farmacocinéticos posteriores predijeron que un régimen de dosificación de 8 mg/kg cada 12 horas (sin exceder los 250 mg por dosis) para pacientes pediátricos de 6 meses a 17 años de edad lograría exposiciones plasmáticas en estado estacionario comparables (AUC0-24 y Cmax) a los observados en pacientes adultos a los que se administró 500 mg de levofloxacino una vez cada 24 horas. Las tabletas de LEVAQUIN® solo se pueden administrar a pacientes pediátricos con ántrax por inhalación (posterior a la exposición) o peste que pesan 30 kg o más debido a las limitaciones de las concentraciones disponibles [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Sujetos masculinos y femeninos
No existen diferencias significativas en la farmacocinética de levofloxacina entre sujetos masculinos y femeninos cuando los sujetos' se tienen en cuenta las diferencias en el aclaramiento de creatinina. Después de una dosis oral de 500 mg de LEVAQUIN® a hombres sanos, la vida media de eliminación plasmática terminal media de levofloxacino fue de aproximadamente 7,5 horas, en comparación con aproximadamente 6,1 horas en mujeres. Esta diferencia se atribuyó a la variación en el estado de la función renal de los sujetos masculinos y femeninos y no se consideró clínicamente significativa. La absorción del fármaco parece no verse afectada por el género de los sujetos. No es necesario ajustar la dosis basándose únicamente en el sexo.
Grupos raciales o étnicos
El efecto de la raza en la farmacocinética de levofloxacino se examinó a través de un análisis de covariables realizado en datos de 72 sujetos: 48 blancos y 24 no blancos. El aclaramiento corporal total aparente y el volumen de distribución aparente no se vieron afectados por la raza de los sujetos.
Pacientes con insuficiencia renal
El aclaramiento de levofloxacino se reduce sustancialmente y la vida media de eliminación plasmática se prolonga sustancialmente en pacientes adultos con insuficiencia renal (aclaramiento de creatinina DOSIFICACIÓN Y ADMINISTRACIÓN y Uso en poblaciones específicas ].
Pacientes con insuficiencia hepática
No se han realizado estudios farmacocinéticos en pacientes con insuficiencia hepática. Debido al alcance limitado del metabolismo de levofloxacino, no se espera que la farmacocinética de levofloxacino se vea afectada por la insuficiencia hepática [ver Uso en poblaciones específicas ].
Pacientes con infección bacteriana
La farmacocinética de levofloxacino en pacientes con infecciones bacterianas graves adquiridas en la comunidad es comparable a la observada en sujetos sanos.
Estudios de interacción farmacológica
Se ha evaluado el potencial de interacciones medicamentosas farmacocinéticas entre LEVAQUIN® y antiácidos, warfarina, teofilina, ciclosporina, digoxina, probenecid y cimetidina [ver INTERACCIONES CON LA DROGAS ].
Microbiología
Mecanismo de acción
La levofloxacina es el isómero L del racemato ofloxacina, un agente antimicrobiano de quinolona. La actividad antibacteriana de la ofloxacina reside principalmente en el isómero L. El mecanismo de acción de la levofloxacina y otras fluoroquinolonas antimicrobianas implica la inhibición de la topoisomerasa IV bacteriana y la girasa del ADN (ambas son topoisomerasas tipo II), enzimas necesarias para la replicación, transcripción, reparación y recombinación del ADN.
Resistencia
La resistencia a las fluoroquinolonas puede surgir a través de mutaciones en regiones definidas de la ADN girasa o la topoisomerasa IV, denominadas regiones determinantes de la resistencia a las quinolonas (QRDR), o a través de un flujo de salida alterado.
Las fluoroquinolonas, incluida la levofloxacina, difieren en estructura química y modo de acción de los aminoglucósidos, macrólidos y antibióticos β-lactámicos, incluidas las penicilinas. Por lo tanto, las fluoroquinolonas pueden ser activas contra las bacterias resistentes a estos antimicrobianos.
La resistencia a levofloxacino debido a mutación espontánea in vitro es rara (rango: 10-9 a 10-10). Se ha observado resistencia cruzada entre levofloxacino y algunas otras fluoroquinolonas, algunos microorganismos resistentes a otras fluoroquinolonas pueden ser sensibles a levofloxacino.
Actividad antimicrobiana
Levofloxacino tiene actividad in vitro contra bacterias Gram-negativas y Gram-positivas.
Se ha demostrado que la levofloxacina es activa contra la mayoría de los aislados de las siguientes bacterias, tanto in vitro como en infecciones clínicas, como se describe en el ver INDICACIONES :
bacterias aeróbicas
bacterias grampositivas
Enterococcus faecalis Staphylococcus aureus (aislados sensibles a la meticilina) Staphylococcus epidermidis (aislados sensibles a la meticilina) Staphylococcus saprophyticus Streptococcus pneumoniae (incluidos los aislados multirresistentes [MDRSP]1) Streptococcus pyogenes
Bacterias Gram-negativo
Enterobacter cloacaeEscherichia coliHaemophilus influenzaeHaemophilus parainfluenzaeKlebsiella pneumoniaeLegionella pneumophilaMoraxella catarrhalisProteus mirabilisPseudomonas aeruginosaSerratia marcescens
Otros microorganismos
Chlamydophila pneumoniaeMycoplasma pneumoniae
Los siguientes datos in vitro están disponibles, pero se desconoce su importancia clínica: la levofloxacina exhibe concentraciones inhibitorias mínimas in vitro (valores MIC) de 2 mcg/mL o menos contra la mayoría (≥90%) de los siguientes microorganismos aislados; sin embargo, la seguridad y eficacia de LEVAQUIN® en el tratamiento de infecciones clínicas debidas a estas bacterias no se han establecido en ensayos clínicos adecuados y bien controlados.
Los aislados MDRSP (Streptococcus pneumoniae resistentes a múltiples fármacos) son aislados resistentes a dos o más de los siguientes antibióticos: penicilina (MIC ≥2 mcg/mL), cefalosporinas de segunda generación, por ejemplo, cefuroxima; macrólidos, tetraciclinas y trimetoprim/sulfametoxazol.
bacterias aeróbicas
bacterias grampositivas
Staphylococcus haemolyticus Streptococcus β-hemolítico (Grupo C/F) Streptococcus β-hemolítico (Grupo G) Streptococcus agalactiae Streptococcus milleri Estreptococo del grupo Viridans Bacillus anthracis
Bacterias Gram-negativo
Acinetobacter baumanniiAcinetobacter lwoffiiBordetella pertussisCitrobacter koseriCitrobacter freundiiEnterobacter aerogenesEnterobacter sakazakiiKlebsiella oxytocaMorganella morganiiPantoea agglomeransProteus vulgarisProvidencia rettgeriProvidencia stuartiiPseudomonas fluorescensYersinia pestis
Bacteria anaerobica
bacterias grampositivas
Clostridium perfringens
Pruebas de susceptibilidad
Para obtener información específica sobre los criterios de interpretación de las pruebas de susceptibilidad y los métodos de prueba asociados y los estándares de control de calidad reconocidos por la FDA para este medicamento, consulte: https://www.fda.gov/STIC.
Toxicología Animal Y/o Farmacología
Se ha demostrado que la levofloxacina y otras quinolonas causan artropatía en animales inmaduros de la mayoría de las especies analizadas [ver ADVERTENCIAS Y PRECAUCIONES ]. En perros inmaduros (4-5 meses de edad), dosis orales de 10 mg/kg/día durante 7 días y dosis intravenosas de 4 mg/kg/día durante 14 días de levofloxacino produjeron lesiones artropáticas. La administración de dosis orales de 300 mg/kg/día durante 7 días y dosis intravenosas de 60 mg/kg/día durante 4 semanas produjo artropatía en ratas jóvenes. Los perros beagle de tres meses de edad que recibieron una dosis oral de levofloxacina de 40 mg/kg/día exhibieron una artrotoxicidad clínicamente grave que resultó en la terminación de la dosificación en el día 8 de una rutina de dosificación de 14 días. Los efectos clínicos musculoesqueléticos leves, en ausencia de efectos patológicos o histopatológicos graves, resultaron del nivel de dosis más bajo de 2,5 mg/kg/día (aproximadamente 0,2 veces la dosis pediátrica según las comparaciones del AUC). Se observaron sinovitis y lesiones del cartílago articular con los niveles de dosis de 10 y 40 mg/kg (aproximadamente 0,7 veces y 2,4 veces la dosis pediátrica, respectivamente, según las comparaciones del AUC). La patología macroscópica y la histopatología del cartílago articular persistieron hasta el final del período de recuperación de 18 semanas para aquellos perros de los niveles de dosis de 10 y 40 mg/kg/día.
Cuando se probó en un bioensayo de hinchazón de orejas de ratón, la levofloxacina mostró una fototoxicidad similar en magnitud a la ofloxacina, pero menos fototoxicidad que otras quinolonas.
Si bien se ha observado cristaluria en algunos estudios intravenosos en ratas, los cristales urinarios no se forman en la vejiga, están presentes solo después de la micción y no están asociados con nefrotoxicidad.
En ratones, el efecto estimulador del SNC de las quinolonas aumenta con la administración concomitante de fármacos antiinflamatorios no esteroideos.
En perros, la levofloxacina administrada a 6 mg/kg o más por inyección intravenosa rápida produjo efectos hipotensores. Se consideró que estos efectos estaban relacionados con la liberación de histamina.
Los estudios in vitro e in vivo en animales indican que la levofloxacina no es ni un inductor ni un inhibidor enzimático en el rango de concentración plasmática terapéutica humana; por lo tanto, no se prevén interacciones relacionadas con las enzimas metabolizadoras de fármacos con otros fármacos o agentes.
Estudios clínicos
Neumonía nosocomial
Se incluyeron pacientes adultos con neumonía nosocomial documentada clínica y radiológicamente en un estudio multicéntrico, aleatorizado y abierto que comparó LEVAQUIN® intravenoso (750 mg una vez al día) seguido de LEVAQUIN® oral (750 mg una vez al día) durante un total de 7 a 15 días. a imipenem/cilastatina por vía intravenosa (500 a 1 000 mg cada 6 a 8 horas al día) seguida de ciprofloxacina oral (750 mg cada 12 horas al día) durante un total de 7 a 15 días. Los pacientes tratados con LEVAQUIN® recibieron un promedio de 7 días de terapia intravenosa (rango: 1–16 días); los pacientes tratados con el comparador recibieron un promedio de 8 días de terapia intravenosa (rango: 1-19 días).
En general, en la población clínica y microbiológicamente evaluable, la terapia adyuvante se inició empíricamente al ingreso al estudio en 56 de 93 (60,2 %) pacientes en el brazo de LEVAQUIN® y 53 de 94 (56,4 %) pacientes en el brazo de comparación. La duración promedio de la terapia adyuvante fue de 7 días en el brazo de LEVAQUIN® y de 7 días en el de comparación. En pacientes evaluables clínica y microbiológicamente con infección documentada por Pseudomonas aeruginosa, 15 de 17 (88,2 %) recibieron ceftazidima (N = 11) o piperacilina/tazobactam (N = 4) en el brazo de LEVAQUIN® y 16 de 17 (94,1 %) recibieron una aminoglucósido en el brazo de comparación. En general, en pacientes evaluables clínica y microbiológicamente, se añadió vancomicina al régimen de tratamiento de 37 de 93 (39,8 %) pacientes en el brazo de LEVAQUIN® y 28 de 94 (29,8 %) pacientes en el brazo de comparación por sospecha de S. infección aureus.
Las tasas de éxito clínico en pacientes evaluables desde el punto de vista clínico y microbiológico en la visita posterior a la terapia (criterio principal de valoración del estudio evaluado entre los días 3 y 15 después de completar la terapia) fueron del 58,1 % para LEVAQUIN® y del 60,6 % para el comparador. El IC del 95 % para la diferencia de las tasas de respuesta (LEVAQUIN® menos el comparador) fue [-17,2, 12,0]. Las tasas de erradicación microbiológica en la visita posterior a la terapia fueron del 66,7 % para LEVAQUIN® y del 60,6 % para el comparador. El IC del 95 % para la diferencia de las tasas de erradicación (LEVAQUIN® menos el comparador) fue [-8,3, 20,3]. Las tasas de éxito clínico y de erradicación microbiológica por patógeno se detallan en la Tabla 9.
La comunidad adquirió neumonía
Régimen de tratamiento de 7 a 14 días
Se evaluaron pacientes adultos hospitalizados y ambulatorios con diagnóstico de neumonía bacteriana adquirida en la comunidad en 2 estudios clínicos fundamentales. En el primer estudio, 590 pacientes se inscribieron en un ensayo prospectivo, multicéntrico, aleatorizado, no ciego, que comparó LEVAQUIN® 500 mg una vez al día por vía oral o intravenosa durante 7 a 14 días con ceftriaxona de 1 a 2 gramos por vía intravenosa una vez o en dosis divididas por igual dos veces al día seguido de cefuroxima axetil 500 mg por vía oral dos veces al día durante un total de 7 a 14 días. A los pacientes asignados al tratamiento con el régimen de control se les permitió recibir eritromicina (o doxiciclina si no toleraban la eritromicina) si se sospechaba o probaba una infección debida a patógenos atípicos. Se realizaron evaluaciones clínicas y microbiológicas durante el tratamiento, 5 a 7 días después de la terapia y 3 a 4 semanas después de la terapia. El éxito clínico (cura más mejoría) con LEVAQUIN® entre 5 y 7 días después de la terapia, la principal variable de eficacia en este estudio, fue superior (95 %) al grupo de control (83 %). El IC del 95 % para la diferencia de las tasas de respuesta (LEVAQUIN® menos el comparador) fue [-6, 19]. En el segundo estudio, 264 pacientes se inscribieron en un ensayo prospectivo, multicéntrico y no comparativo de 500 mg de LEVAQUIN® administrados por vía oral o intravenosa una vez al día durante 7 a 14 días. El éxito clínico para los pacientes clínicamente evaluables fue del 93 %. Para ambos estudios, la tasa de éxito clínico en pacientes con neumonía atípica debida a Chlamydophila pneumoniae, Mycoplasma pneumoniae y Legionella pneumophila fue del 96 %, 96 % y 70 %, respectivamente. Las tasas de erradicación microbiológica en ambos estudios se presentan en la Tabla 10.
Neumonía adquirida en la comunidad por Streptococcus pneumoniae resistente a múltiples fármacos
LEVAQUIN® fue eficaz para el tratamiento de la neumonía adquirida en la comunidad causada por Streptococcus pneumoniae resistente a múltiples fármacos (MDRSP). Los aislados MDRSP son aislados resistentes a dos o más de los siguientes antibacterianos: penicilina (MIC ≥2 mcg/ml), cefalosporinas de segunda generación (p. ej., cefuroxima, macrólidos, tetraciclinas y trimetoprima/sulfametoxazol). De 40 pacientes microbiológicamente evaluables con aislamientos de MDRSP, 38 pacientes (95,0 %) lograron éxito clínico y bacteriológico después de la terapia. Las tasas de éxito clínico y bacteriano se muestran en la Tabla 11.
No todos los aislamientos fueron resistentes a todas las clases de antimicrobianos probados. Las tasas de éxito y erradicación se resumen en la Tabla 12.
La comunidad adquirió neumonía
Régimen de tratamiento de 5 días
Para evaluar la seguridad y la eficacia de la dosis más alta y el ciclo más corto de LEVAQUIN®, se evaluaron 528 pacientes ambulatorios y adultos hospitalizados con neumonía adquirida en la comunidad de leve a grave determinada clínica y radiológicamente en un estudio doble ciego, aleatorizado, prospectivo, multicéntrico que comparó LEVAQUIN ® 750 mg, IV u oral, todos los días durante cinco días o LEVAQUIN® 500 mg IV u oral, todos los días durante 10 días.
Las tasas de éxito clínico (cura más mejora) en la población clínicamente evaluable fueron del 90,9 % en el grupo de LEVAQUIN® 750 mg y del 91,1 % en el grupo de LEVAQUIN® 500 mg. El IC del 95 % para la diferencia de las tasas de respuesta (LEVAQUIN® 750 menos LEVAQUIN® 500) fue [-5,9, 5,4]. En la población clínicamente evaluable (31 a 38 días después de la inscripción), se observó neumonía en 7 de 151 pacientes en el grupo de LEVAQUIN® 750 mg y en 2 de 147 pacientes en el grupo de LEVAQUIN® 500 mg. Dado el pequeño número observado, la importancia de este hallazgo no puede determinarse estadísticamente. La eficacia microbiológica del régimen de 5 días se documentó para las infecciones enumeradas en la Tabla 13.
Sinusitis bacteriana aguda
Regímenes de tratamiento de 5 días y de 10 a 14 días
LEVAQUIN® está aprobado para el tratamiento de la sinusitis bacteriana aguda (ABS) usando 750 mg por vía oral × 5 días o 500 mg por vía oral una vez al día × 10–14 días. Para evaluar la seguridad y la eficacia de un ciclo corto de dosis alta de LEVAQUIN®, se evaluaron 780 pacientes adultos ambulatorios con sinusitis bacteriana aguda determinada clínica y radiológicamente en un estudio multicéntrico, prospectivo, aleatorizado, doble ciego, que comparó LEVAQUIN® 750 mg por vía oral una vez al día. durante cinco días a LEVAQUIN® 500 mg por vía oral una vez al día durante 10 días.
Las tasas de éxito clínico (definidas como la resolución completa o parcial de los signos y síntomas de ABS previos al tratamiento hasta el punto de que no se consideró necesario un tratamiento antibiótico adicional) en la población microbiológicamente evaluable fueron del 91,4 % (139/152) en LEVAQUIN® grupo de 750 mg y 88,6 % (132/149) en el grupo de LEVAQUIN® 500 mg en la visita de prueba de curación (TOC) (IC del 95 % [-4,2, 10,0] para LEVAQUIN® 750 mg menos LEVAQUIN® 500 mg) .
Las tasas de éxito clínico por patógeno en la población microbiológicamente evaluable a la que se obtuvieron muestras mediante punción antral al ingresar al estudio mostraron resultados comparables para los regímenes de cinco y diez días en la visita de prueba de curación 22 días después del tratamiento (consulte la Tabla 14). .
Infecciones Complicadas De La Piel Y De La Estructura De La Piel
Trescientos noventa y nueve pacientes se inscribieron en un estudio comparativo, aleatorizado y de etiqueta abierta para infecciones complicadas de la piel y la estructura de la piel. Los pacientes fueron aleatorizados para recibir LEVAQUIN® 750 mg una vez al día (IV seguido de oral) o un comparador aprobado durante una mediana de 10 ± 4,7 días. Como es de esperar en las infecciones complicadas de la piel y de la estructura de la piel, se realizaron procedimientos quirúrgicos en los grupos de LEVAQUIN® y de comparación. La cirugía (incisión y drenaje o desbridamiento) se realizó en el 45 % de los pacientes tratados con LEVAQUIN® y en el 44 % de los pacientes tratados con el comparador, ya sea poco antes o durante el tratamiento con antibióticos y formó parte integral de la terapia para esta indicación.
Entre los que pudieron ser evaluados clínicamente de 2 a 5 días después de completar el fármaco del estudio, las tasas generales de éxito (mejoría o curación) fueron 116/138 (84,1 %) para los pacientes tratados con LEVAQUIN® y 106/132 (80,3 %) para los pacientes tratados con el comparador.
Las tasas de éxito variaron según el tipo de diagnóstico, desde el 68 % en pacientes con úlceras infectadas hasta el 90 % en pacientes con heridas y abscesos infectados. Estas tasas fueron equivalentes a las observadas con fármacos de comparación.
Prostatitis bacteriana crónica
Pacientes adultos con un diagnóstico clínico de prostatitis y resultados de cultivos microbiológicos de muestras de orina recolectadas después de un masaje prostático (VB3) o muestras de secreción prostática expresada (EPS) obtenidas a través del procedimiento Meares-Stamey se inscribieron en un estudio multicéntrico, aleatorizado, doble ciego que comparó LEVAQUIN® oral 500 mg, una vez al día durante un total de 28 días a ciprofloxacina oral 500 mg, dos veces al día durante un total de 28 días. El criterio principal de valoración de la eficacia fue la eficacia microbiológica en pacientes microbiológicamente evaluables. Se incluyeron un total de 136 y 125 pacientes microbiológicamente evaluables en los grupos de LEVAQUIN® y ciprofloxacina, respectivamente. La tasa de erradicación microbiológica por infección del paciente entre 5 y 18 días después de finalizar el tratamiento fue del 75,0 % en el grupo de LEVAQUIN® y del 76,8 % en el grupo de ciprofloxacina (IC del 95 % [-12,58, 8,98] para LEVAQUIN® menos ciprofloxacina). Las tasas generales de erradicación de los patógenos de interés se presentan en la Tabla 15.
Las tasas de erradicación de S. epidermidis cuando se encuentra con otros co-patógenos son consistentes con las tasas observadas en aislamientos puros.
Las tasas de éxito clínico (curación + mejoría sin necesidad de tratamiento antibiótico adicional) en la población evaluable microbiológicamente 5 a 18 días después de finalizar el tratamiento fueron del 75,0 % para los pacientes tratados con LEVAQUIN® y del 72,8 % para los pacientes tratados con ciprofloxacina (IC del 95 % [- 8.87, 13.27] para LEVAQUIN® menos ciprofloxacina). Las tasas de éxito clínico a largo plazo (24 a 45 días después de completar la terapia) fueron del 66,7 % para los pacientes tratados con LEVAQUIN® y del 76,9 % para los pacientes tratados con ciprofloxacina (IC del 95 % [-23,40, 2,89] para LEVAQUIN® sin ciprofloxacina).
Infecciones complicadas del tracto urinario y pielonefritis aguda
Régimen de tratamiento de 5 días
Para evaluar la seguridad y eficacia de la dosis más alta y el ciclo más corto de LEVAQUIN®, 1109 pacientes con cUTI y PA se inscribieron en un ensayo clínico aleatorizado, doble ciego y multicéntrico realizado en los EE. mg IV o por vía oral una vez al día durante 5 días (546 pacientes) con ciprofloxacina 400 mg IV o 500 mg por vía oral dos veces al día durante 10 días (563 pacientes). Se excluyeron los pacientes con PA complicada por enfermedades renales subyacentes o condiciones como obstrucción completa, cirugía, trasplante, infección concurrente o malformación congénita. La eficacia se midió mediante la erradicación bacteriológica de los organismos basales en la visita posterior a la terapia en pacientes con un patógeno identificado al inicio. La visita posterior a la terapia (prueba de curación) ocurrió de 10 a 14 días después de la última dosis activa de LEVAQUIN® y de 5 a 9 días después de la última dosis de ciprofloxacina activa.
Las tasas de curación bacteriológica en general para LEVAQUIN® y el control en la visita de prueba de curación (TOC) para el grupo de todos los pacientes con un patógeno documentado al inicio (intención de tratar modificada o mITT) y el grupo de pacientes en la población mITT que siguieron de cerca el protocolo (microbiológicamente evaluable) se resumen en la Tabla 16.
Las tasas de erradicación microbiológica en la población evaluable microbiológicamente en TOC para patógenos individuales recuperados de pacientes asignados aleatoriamente al tratamiento con LEVAQUIN® se presentan en la Tabla 17.
Infecciones complicadas del tracto urinario y pielonefritis aguda
Régimen de tratamiento de 10 días
Para evaluar la seguridad y la eficacia de la dosis de 250 mg, el régimen de 10 días de LEVAQUIN®, 567 pacientes con ITU no complicada, ITUc de leve a moderada y PA de leve a moderada se inscribieron en un estudio multicéntrico aleatorizado, doble ciego. ensayo clínico realizado en los EE. UU. desde junio de 1993 hasta enero de 1995 que comparó LEVAQUIN® 250 mg por vía oral una vez al día durante 10 días (285 pacientes) con ciprofloxacina 500 mg por vía oral dos veces al día durante 10 días (282 pacientes). Los pacientes con un patógeno resistente, UTI recurrente, mujeres mayores de 55 años y con un catéter permanente fueron inicialmente excluidos, antes de la modificación del protocolo que tuvo lugar después del 30 % de la inscripción. La eficacia microbiológica se midió mediante la erradicación bacteriológica de los organismos basales entre 1 y 12 días después de la terapia en pacientes con un patógeno identificado al inicio.
Las tasas de curación bacteriológica en general para LEVAQUIN® y el control en la visita de prueba de curación (TOC) para el grupo de todos los pacientes con un patógeno documentado al inicio (intención de tratar modificada o mITT) y el grupo de pacientes en la población mITT que siguieron de cerca el protocolo (microbiológicamente evaluable) se resumen en la Tabla 18.
Ántrax por inhalación (posterior a la exposición)
La eficacia de LEVAQUIN® para esta indicación se basa en las concentraciones plasmáticas alcanzadas en humanos, un criterio de valoración sustituto con una probabilidad razonable de predecir el beneficio clínico. LEVAQUIN® no ha sido probado en humanos para la prevención posterior a la exposición al ántrax por inhalación. Las concentraciones plasmáticas medias de LEVAQUIN® asociadas con una mejora estadísticamente significativa en la supervivencia sobre el placebo en el modelo de mono rhesus de ántrax por inhalación se alcanzan o superan en pacientes adultos y pediátricos que reciben los regímenes de dosificación orales e intravenosas recomendados [ver INDICACIONES y DOSIFICACIÓN Y ADMINISTRACIÓN ].
La farmacocinética de levofloxacino ha sido evaluada en pacientes adultos y pediátricos. La concentración plasmática máxima media (± DE) en el estado estacionario en adultos humanos que reciben 500 mg por vía oral o intravenosa una vez al día es de 5,7 ± 1,4 y 6,4 ± 0,8 mcg/ml, respectivamente; y la correspondiente exposición plasmática total (AUC) es de 47,5 ± 6,7 y 54,6 ± 11,1 mcg.h/mL, respectivamente. Se calculó que los parámetros farmacocinéticos en estado estacionario previstos en pacientes pediátricos con edades comprendidas entre los 6 meses y los 17 años que recibieron 8 mg/kg por vía oral cada 12 horas (sin exceder los 250 mg por dosis) eran comparables a los observados en adultos que recibieron 500 mg por vía oral una vez al día [ver FARMACOLOGÍA CLÍNICA ].
Las tabletas de LEVAQUIN® solo se pueden administrar a pacientes pediátricos con ántrax por inhalación (postexposición) o peste que pesan 30 kg o más debido a las limitaciones de las concentraciones disponibles [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
En adultos, la seguridad de LEVAQUIN® para tratamientos de hasta 28 días está bien caracterizada. Sin embargo, la información relacionada con el uso prolongado de 500 mg diarios hasta 60 días es limitada. La terapia prolongada con LEVAQUIN® en adultos solo debe usarse cuando el beneficio supere el riesgo.
En pacientes pediátricos, no se ha estudiado la seguridad de levofloxacino para tratamientos de más de 14 días de duración. Se ha observado una mayor incidencia de eventos adversos musculoesqueléticos (artralgia, artritis, tendinopatía, anomalías en la marcha) en comparación con los controles en estudios clínicos con una duración del tratamiento de hasta 14 días. Los datos de seguridad a largo plazo, incluidos los efectos sobre el cartílago, después de la administración de levofloxacino a pacientes pediátricos son limitados [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
Se realizó un estudio en animales controlado con placebo en monos rhesus expuestos a una dosis media inhalada de 49 LD50 (~2,7 × 106) esporas (rango 17 - 118 LD50) de B. anthracis (cepa Ames). La concentración inhibitoria mínima (MIC) de levofloxacino para la cepa de ántrax utilizada en este estudio fue de 0,125 mcg/mL. En los animales estudiados, las concentraciones plasmáticas medias de levofloxacino alcanzadas en el Tmáx esperado (1 hora después de la dosis) después de la dosificación oral hasta el estado estacionario oscilaron entre 2,79 y 4,87 mcg/ml. Las concentraciones mínimas en estado estacionario a las 24 horas posteriores a la dosis oscilaron entre 0,107 y 0,164 mcg/mL. El AUC0-24 medio (DE) en estado estacionario fue de 33,4 ± 3,2 mcg.h/ml (rango de 30,4 a 36,0 mcg.h/ml). La mortalidad por ántrax para los animales que recibieron un régimen de 30 días de LEVAQUIN® oral que comenzó 24 horas después de la exposición fue significativamente menor (1/10), en comparación con el grupo placebo (9/10) [P = 0,0011, 2 lados Fisher 39;s prueba exacta]. El único animal tratado con levofloxacina que murió de ántrax lo hizo después del período de administración del fármaco de 30 días.
Plaga
Los estudios de eficacia de LEVAQUIN® no se pudieron realizar en humanos con peste neumónica por razones éticas y de factibilidad. Por lo tanto, la aprobación de esta indicación se basó en un estudio de eficacia realizado en animales.
Las concentraciones plasmáticas medias de LEVAQUIN® asociadas con una mejora estadísticamente significativa en la supervivencia con respecto al placebo en un modelo de mono verde africano con peste neumónica se alcanzan o superan en pacientes adultos y pediátricos que reciben los regímenes de dosificación oral e intravenosa recomendados [ver INDICACIONES y DOSIFICACIÓN Y ADMINISTRACIÓN ].
La farmacocinética de levofloxacino ha sido evaluada en pacientes adultos y pediátricos. La concentración plasmática máxima media (± DE) en el estado estacionario en adultos humanos que reciben 500 mg por vía oral o intravenosa una vez al día es de 5,7 ± 1,4 y 6,4 ± 0,8 mcg/ml, respectivamente; y la exposición plasmática total correspondiente (AUC0-24) es 47,5 ± 6,7 y 54,6 ± 11,1 mcg.h/mL, respectivamente. Se calculó que los parámetros farmacocinéticos en estado estacionario previstos en pacientes pediátricos con edades comprendidas entre los 6 meses y los 17 años que recibieron 8 mg/kg por vía oral cada 12 horas (sin exceder los 250 mg por dosis) eran comparables a los observados en adultos que recibieron 500 mg por vía oral una vez al día [ver FARMACOLOGÍA CLÍNICA ]. Las tabletas de LEVAQUIN® solo se pueden administrar a pacientes pediátricos con ántrax por inhalación (postexposición) o peste que pesan 30 kg o más debido a las limitaciones de las concentraciones disponibles [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Se realizó un estudio en animales controlado con placebo en monos verdes africanos expuestos a una dosis media inhalada de 65 LD (rango de 3 a 145 LD50) de Yersinia pestis (cepa CO92). La concentración inhibitoria mínima (MIC) de levofloxacina para la cepa de Y. pestis utilizada en este estudio fue de 0,03 mcg/mL. Las concentraciones plasmáticas medias de levofloxacina alcanzadas al final de una única infusión de 30 minutos oscilaron entre 2,84 y 3,50 mcg/ml en monos verdes africanos. Las concentraciones mínimas a las 24 horas posteriores a la dosis oscilaron entre
INFORMACIÓN DEL PACIENTE
LEVAQUIN® (Deje ah kwin) (levofloxacina) tabletas
¿Cuál es la información más importante que debo saber sobre LEVAQUIN 500mg?
LEVAQUIN 500 mg, un antibiótico de fluoroquinolona, puede causar efectos secundarios graves. Algunos de estos efectos secundarios graves pueden ocurrir al mismo tiempo y causar la muerte.
Si tiene alguno de los siguientes efectos secundarios graves mientras toma LEVAQUIN 500 mg, debe dejar de tomar LEVAQUIN inmediatamente y obtener ayuda médica de inmediato.
- Los problemas de los tendones pueden ocurrir en personas de todas las edades que toman LEVAQUIN. Los tendones son cordones resistentes de tejido que conectan los músculos a los huesos. Algunos problemas de los tendones incluyen:
- dolor
- hinchazón
- desgarros e hinchazón de los tendones, incluida la parte posterior del tobillo (Aquiles), el hombro, la mano u otros sitios de los tendones.
- El riesgo de tener problemas en los tendones mientras toma LEVAQUIN es mayor si usted:
- son mayores de 60 años
- ha tenido un trasplante de riñón, corazón o pulmón.
- Los problemas de los tendones pueden ocurrir en personas que no tienen los factores de riesgo anteriores cuando toman LEVAQUIN.
- Otras razones que pueden aumentar el riesgo de problemas en los tendones pueden incluir:
- actividad física o ejercicio
- insuficiencia renal
- problemas de tendones en el pasado, como en personas con artritis reumatoide (AR)
- Deje de tomar LEVAQUIN inmediatamente y obtenga ayuda médica de inmediato ante el primer signo de dolor, hinchazón o inflamación en los tendones. Evite el ejercicio y el uso de la zona afectada.
- El área más común de dolor e inflamación es el tendón de Aquiles en la parte posterior del tobillo. Esto también puede ocurrir con otros tendones. Es posible que necesite un antibiótico diferente que no sea una fluoroquinolona para tratar su infección.
- La ruptura del tendón puede ocurrir mientras está tomando o después de haber terminado de tomar LEVAQUIN. Las rupturas de tendones pueden ocurrir horas o días después de tomar LEVAQUIN y han ocurrido hasta varios meses después de que las personas terminaron de tomar su fluoroquinolona.
- Deje de tomar LEVAQUIN 750 mg inmediatamente y obtenga ayuda médica de inmediato si presenta alguno de los siguientes signos o síntomas de ruptura de un tendón:
- escuchar o sentir un chasquido o estallido en el área de un tendón
- hematomas justo después de una lesión en el área de un tendón
- incapaz de mover el área afectada o soportar peso
- dolor
- incendio
- hormigueo
- entumecimiento
- debilidad
El daño a los nervios puede ser permanente.
- convulsiones
- escuchar voces, ver cosas o sentir cosas que no existen (alucinaciones)
- sentirse inquieto
- temblores
- sentirse ansioso o nervioso
- confusión
- depresión
- problemas para dormir
- pesadillas
- sentirse aturdido o mareado
- sentirse más sospechoso (paranoia)
- pensamientos o actos suicidas
- dolores de cabeza que no desaparecen, con o sin visión borrosa
¿Qué es LEVAQUIN?
LEVAQUIN 500 mg es un medicamento antibiótico de fluoroquinolona que se usa en adultos mayores de 18 años para tratar ciertas infecciones causadas por ciertos gérmenes llamados bacterias. Estas infecciones bacterianas incluyen:
- neumonía nosocomial
- la comunidad adquirió neumonía
- infecciones de la piel, complicadas y no complicadas
- infeccion cronica de prostata
- gérmenes de ántrax por inhalación
- Plaga
- infecciones del tracto urinario, complicadas y no complicadas
- infección renal aguda (pielonefritis)
- infección sinusal aguda
- empeoramiento agudo o bronquitis crónica
Los estudios de LEVAQUIN para su uso en el tratamiento de la peste y el ántrax se realizaron solo en animales, porque la peste y el ántrax no se pudieron estudiar en personas.
LEVAQUIN no debe usarse en pacientes con infecciones del tracto urinario no complicadas, exacerbación bacteriana aguda de bronquitis crónica o sinusitis bacteriana aguda si hay otras opciones de tratamiento disponibles.
Las tabletas de 750 mg de LEVAQUIN también se usan para tratar a niños que pesan al menos 66 libras (o al menos 30 kilogramos) y pueden haber respirado gérmenes de ántrax, tener peste o haber estado expuestos a gérmenes de peste. No se sabe si LEVAQUIN es seguro y efectivo en niños menores de 6 meses de edad.
Se desconoce la seguridad y eficacia en niños tratados con LEVAQUIN® durante más de 14 días.
¿Quién no debe tomar LEVAQUIN 750mg?
No tome LEVAQUIN: si alguna vez ha tenido una reacción alérgica grave a un antibiótico conocido como fluoroquinolona, o si es alérgico a la levofloxacina o a cualquiera de los ingredientes de LEVAQUIN. Consulte el final de este folleto para obtener una lista completa de los ingredientes de LEVAQUIN.
Antes de tomar LEVAQUIN, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si usted:
- tiene problemas en los tendones; LEVAQUIN 250 mg no debe usarse en personas que tienen antecedentes de problemas en los tendones.
- tiene un problema que provoca debilidad muscular (miastenia grave); LEVAQUIN no debe usarse en personas con antecedentes conocidos de miastenia grave.
- tiene problemas del sistema nervioso central, como convulsiones (epilepsia).
- tiene problemas nerviosos; LEVAQUIN 250 mg no debe usarse en pacientes con antecedentes de un problema nervioso llamado neuropatía periférica.
- tiene o alguien en su familia tiene latidos cardíacos irregulares, especialmente una condición llamada "prolongación del intervalo QT".
- tiene niveles bajos de potasio en la sangre (hipopotasemia).
- tiene problemas en los huesos.
- tiene problemas en las articulaciones, incluida la artritis reumatoide (AR).
- tiene problemas renales. Es posible que necesite una dosis más baja de LEVAQUIN si sus riñones no funcionan bien.
- tiene problemas hepáticos.
- tiene diabetes o problemas con niveles bajos de azúcar en la sangre (hipoglucemia).
- está embarazada o planea quedar embarazada. No se sabe si LEVAQUIN 750mg dañará al feto.
- están amamantando o planean amamantar. No se sabe si LEVAQUIN pasa a la leche materna. Usted y su proveedor de atención médica deben decidir si tomará LEVAQUIN 250 mg o si amamantará. Usted no debe hacer las dos cosas.
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos a base de hierbas.
LEVAQUIN y otros medicamentos pueden afectarse entre sí causando efectos secundarios.
Informe especialmente a su proveedor de atención médica si toma:
- un medicamento esteroide.
- un medicamento antipsicótico.
- un antidepresivo tricíclico.
- una pastilla de agua (diurético).
- Ciertos medicamentos pueden impedir que LEVAQUIN 750 mg funcione correctamente. Tome LEVAQUIN® 2 horas antes o 2 horas después de tomar estos medicamentos o suplementos:
- un antiácido, multivitamínico u otros medicamentos o suplementos que contengan magnesio, aluminio, hierro o zinc
- sucralfato (Carafate®)
- didanosina (Videx®, Videx® EC)
- un anticoagulante (warfarina, Coumadin, Jantoven).
- un medicamento oral contra la diabetes o insulina.
- un AINE (medicamento antiinflamatorio no esteroideo). Muchos medicamentos comunes para aliviar el dolor son los AINE. Tomar un AINE mientras toma LEVAQUIN 250 mg u otras fluoroquinolonas puede aumentar su riesgo de sufrir efectos en el sistema nervioso central y convulsiones.
- teofilina (Theo-24®, Elixophyllin®, Theochron®, Uniphyl®, Theolair®).
- un medicamento para controlar la frecuencia o el ritmo cardíaco (antiarrítmicos).
Pregúntele a su proveedor de atención médica si no está seguro de si alguno de sus medicamentos se encuentra en la lista anterior. Conozca los medicamentos que toma. Mantenga una lista de sus medicamentos y muéstresela a su proveedor de atención médica y farmacéutico cuando obtenga un nuevo medicamento.
¿Cómo debo tomar LEVAQUIN 500mg?
- Tome LEVAQUIN exactamente como se lo indique su proveedor de atención médica.
- Tome LEVAQUIN 750 mg aproximadamente a la misma hora todos los días.
- Beba muchos líquidos mientras toma LEVAQUIN.
- LEVAQUIN se puede tomar con o sin alimentos.
- Si olvida una dosis de LEVAQUIN 500 mg, tómela tan pronto como lo recuerde. No tome más de 1 dosis en 1 día.
- No omita ninguna dosis de LEVAQUIN 750 mg ni deje de tomarlo, incluso si comienza a sentirse mejor, hasta que termine el tratamiento prescrito a menos que:
- Tienes problemas en los tendones. Ver "¿Cuál es la información más importante que debo saber sobre LEVAQUIN 500mg?".
- Tienes un problema de nervios. Ver "¿Cuáles son los posibles efectos secundarios de LEVAQUIN?".
- usted tiene un problema del sistema nervioso central. Ver "¿Cuáles son los posibles efectos secundarios de LEVAQUIN 750mg?".
- tiene una reacción alérgica grave. Ver "¿Cuáles son los posibles efectos secundarios de LEVAQUIN 250mg?".
- su proveedor de atención médica le indica que deje de tomar LEVAQUIN.
Tomar todas sus dosis de LEVAQUIN de 500 mg ayudará a asegurarse de que se eliminen todas las bacterias. Tomar todas sus dosis de LEVAQUIN de 250 mg lo ayudará a reducir la posibilidad de que las bacterias se vuelvan resistentes a LEVAQUIN. Si su infección no mejora mientras toma LEVAQUIN 750 mg, puede significar que las bacterias que causan su infección pueden ser resistentes a LEVAQUIN. Si su infección no mejora, llame a su proveedor de atención médica. Si su infección no mejora, es posible que LEVAQUIN y otros antibióticos similares no funcionen para usted en el futuro.
- Si toma demasiado LEVAQUIN, llame a su proveedor de atención médica o busque ayuda médica de inmediato.
¿Qué debo evitar mientras tomo levaquin 500mg?
- LEVAQUIN puede hacerle sentir mareado y aturdido. No haga conducir, operar maquinaria o realizar otras actividades que requieran agilidad mental o coordinación hasta que sepa cómo le afecta LEVAQUIN.
- Evite las lámparas solares, las camas de bronceado y trate de limitar el tiempo que pasa bajo el sol. LEVAQUIN 750 mg puede hacer que su piel se vuelva sensible al sol (fotosensibilidad) y a la luz de las lámparas solares y camas de bronceado. Podría sufrir quemaduras solares graves, ampollas o hinchazón de la piel. Si tiene alguno de estos síntomas mientras toma LEVAQUIN, llame a su proveedor de atención médica de inmediato. Debes usar bloqueador solar y usar un sombrero y ropa que cubra tu piel si tienes que estar bajo la luz del sol.
¿Cuáles son los posibles efectos secundarios de LEVAQUIN 750mg?
LEVAQUIN 750 mg puede causar efectos secundarios graves, que incluyen:
- Ver "¿Cuál es la información más importante que debo saber sobre LEVAQUIN 250mg?"
- Reacciones alérgicas graves.
Pueden ocurrir reacciones alérgicas en personas que toman fluoroquinolonas, incluido LEVAQUIN 500 mg, incluso después de solo 1 dosis. Deje de tomar LEVAQUIN 500 mg y obtenga atención médica de emergencia de inmediato si tiene alguno de los siguientes síntomas de una reacción alérgica grave:
- urticaria
- dificultad para respirar o tragar
- hinchazón de los labios, lengua, cara
- opresión en la garganta, ronquera
- latidos rápidos
- tenue
- erupción cutanea
La erupción cutánea puede ocurrir en personas que toman LEVAQUIN 500 mg, incluso después de solo 1 dosis. Deje de tomar LEVAQUIN 250 mg al primer signo de erupción cutánea y llame de inmediato a su proveedor de atención médica. La erupción cutánea puede ser un signo de una reacción más grave a LEVAQUIN.
- Daño hepático (hepatotoxicidad): La hepatotoxicidad puede ocurrir en personas que toman LEVAQUIN®. Llame a su proveedor de atención médica de inmediato si tiene síntomas inexplicables, como:
- náuseas o vómitos
- dolor de estómago
- fiebre
- debilidad
- dolor o sensibilidad abdominal
- Comezón
- cansancio inusual
- pérdida de apetito
- evacuaciones intestinales de color claro
- orina de color oscuro
- coloración amarillenta de la piel o del blanco de los ojos
Deje de tomar LEVAQUIN 750 mg e informe a su proveedor de atención médica de inmediato si tiene coloración amarillenta en la piel o parte blanca de los ojos, o si tiene orina oscura. Estos pueden ser signos de una reacción grave a LEVAQUIN (un problema hepático).
- Infección intestinal (colitis pseudomembranosa) La colitis pseudomembranosa puede ocurrir con muchos antibióticos, incluido LEVAQUIN. Llame a su proveedor de atención médica de inmediato si tiene diarrea acuosa, diarrea que no desaparece o heces con sangre. Es posible que tenga calambres estomacales y fiebre. La colitis pseudomembranosa puede ocurrir 2 o más meses después de haber terminado su antibiótico.
- Cambios graves en el ritmo cardíaco (prolongación del intervalo QT y torsades depointes) Informe a su proveedor de atención médica de inmediato si tiene un cambio en los latidos de su corazón (latidos cardíacos rápidos o irregulares) o si se desmaya. LEVAQUIN 250 mg puede causar un problema cardíaco raro conocido como prolongación del intervalo QT. Esta condición puede causar latidos cardíacos anormales y puede ser muy peligrosa. Las posibilidades de que esto suceda son mayores en las personas:
- que son ancianos
- con antecedentes familiares de prolongación del intervalo QT
- con niveles bajos de potasio en sangre (hipopotasemia)
- que toman ciertos medicamentos para controlar el ritmo cardíaco (antiarrítmicos)
- Problemas en las articulaciones Puede haber una mayor probabilidad de problemas con las articulaciones y los tejidos alrededor de las articulaciones en los niños. Informe al proveedor de atención médica de su hijo si tiene algún problema en las articulaciones durante o después del tratamiento con LEVAQUIN.
- Cambios en el azúcar en la sangre Las personas que toman LEVAQUIN y otras fluoroquinolonas con medicamentos orales contra la diabetes o con insulina pueden tener niveles bajos de azúcar en la sangre (hipoglucemia) y niveles altos de azúcar en la sangre (hiperglucemia). Siga las instrucciones de su proveedor de atención médica sobre la frecuencia con la que debe controlar su nivel de azúcar en la sangre. Si tiene diabetes y tiene un nivel bajo de azúcar en la sangre mientras toma LEVAQUIN, deje de tomar LEVAQUIN 500 mg y llame a su proveedor de atención médica de inmediato. Es posible que sea necesario cambiar su medicamento antibiótico.
- Sensibilidad a la luz solar (fotosensibilidad) Ver "¿Qué debo evitar mientras tomo LEVAQUIN?" Los efectos secundarios más comunes de LEVAQUIN 250mg incluyen:
- náuseas
- dolor de cabeza
- Diarrea
- insomnio
- estreñimiento
- mareo
En niños de 6 meses y mayores que toman LEVAQUIN para tratar la enfermedad del ántrax o la peste, los vómitos también son comunes.
LEVAQUIN puede causar resultados de detección de orina falsos positivos para opiáceos cuando la prueba se realiza con algunos kits disponibles comercialmente. Un resultado positivo debe confirmarse mediante una prueba más específica. Estos no son todos los posibles efectos secundarios de LEVAQUIN.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA llamando al 1-800-FDA-1088.
¿Cómo debo conservar LEVAQUIN 250mg?
- Guarde LEVAQUIN 500 mg a temperatura ambiente, entre 15 °C y 30 °C (59 °F y 86 °F).
- Mantenga LEVAQUIN 500 mg en un recipiente bien cerrado.
Información general sobre el uso seguro y eficaz de LEVAQUIN.
veces, los medicamentos se recetan para fines distintos a los enumerados en la Guía del medicamento. No use LEVAQUIN para una condición para la cual no está recetado. No le dé LEVAQUIN 500 mg a otras personas, incluso si tienen los mismos síntomas que usted tiene. Puede que les haga daño. Esta Guía del medicamento resume la información más importante sobre LEVAQUIN. Si desea obtener más información sobre LEVAQUIN 750 mg, hable con su proveedor de atención médica. Puede pedirle a su proveedor de atención médica o farmacéutico información sobre LEVAQUIN 500 mg que está escrita para profesionales de la salud.
¿Cuáles son los ingredientes de LEVAQUIN 500mg?
Ingrediente activo: levofloxacino
Ingredientes inactivos : crospovidona, hipromelosa, estearato de magnesio, celulosa microcristalina, polietilenglicol, polisorbato 80, dióxido de titanio.
Los comprimidos de LEVAQUIN 250 mg también contienen óxido de hierro rojo sintético.
Los comprimidos de LEVAQUIN 500 mg también contienen óxido de hierro rojo sintético y óxido de hierro amarillo sintético.
Esta Guía del medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de EE. UU.
