Keflex 250mg, 500mg Cephalexin Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Keflex 250 mg y cómo se usa?
Keflex es un medicamento recetado que se usa para tratar los síntomas de varias infecciones bacterianas al detener el crecimiento de bacterias. Keflex 500 mg se puede usar solo o con otros medicamentos.
Keflex es conocido como un antibiótico de cefalosporina.
¿Cuáles son los efectos secundarios de Keflex?
Keflex puede causar efectos secundarios graves que incluyen:
- dolor de estómago severo,
- diarrea acuosa o con sangre,
- cansancio inusual,
- sentirse mareado o sin aliento,
- moretones con facilidad,
- sangrado inusual,
- manchas moradas o rojas debajo de la piel,
- embargo,
- piel pálida,
- manos y pies fríos,
- piel amarillenta, orina de color oscuro,
- fiebre,
- debilidad ,
- dolor en el costado o en la parte baja de la espalda,
- dolor al orinar,
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Keflex 500 mg incluyen:
- Diarrea,
- náuseas,
- vómitos,
- indigestión,
- dolor de estómago,
- picazón o secreción vaginal,
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Keflex. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
KEFLEX® (cefalexina) Cápsulas, USP es un fármaco antibacteriano de cefalosporina semisintético destinado a la administración oral. Es monohidrato de ácido 7-(D-α-Amino-α-fenilacetamido)-3-metil-3-cefem-4-carboxílico. La cefalexina tiene la fórmula molecular C16H17N3O4S•H2O y el peso molecular es 365,41.
La cefalexina tiene la siguiente fórmula estructural:
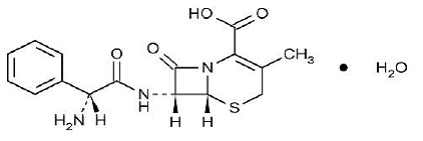
Cada cápsula contiene monohidrato de cefalexina equivalente a 250 mg, 500 mg o 750 mg de cefalexina. Las cápsulas también contienen carboximetilcelulosa sódica, D&C Yellow No. 10, dimeticona, FD&C Blue No. 1, FD&C Yellow No. 6, gelatina, estearato de magnesio, celulosa microcristalina y dióxido de titanio.
INDICACIONES
Infecciones del Tracto Respiratorio
KEFLEX está indicado para el tratamiento de infecciones del tracto respiratorio causadas por aislados sensibles de Streptococcus pneumoniae y Streptococcus pyogenes.
Otitis media
KEFLEX está indicado para el tratamiento de la otitis media causada por aislamientos susceptibles de Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus, Streptococcus pyogenes y Moraxella catarrhalis.
Infecciones De La Piel Y De La Estructura De La Piel
KEFLEX 250 mg está indicado para el tratamiento de infecciones de la piel y de la estructura de la piel causadas por aislados sensibles de las siguientes bacterias Gram positivas: Staphylococcus aureus y Streptococcus pyogenes.
Infecciones óseas
KEFLEX 250 mg está indicado para el tratamiento de infecciones óseas causadas por aislamientos susceptibles de Staphylococcus aureus y Proteus mirabilis.
Infecciones del tracto genitourinario
KEFLEX está indicado para el tratamiento de infecciones del tracto genitourinario, incluida la prostatitis aguda, causada por aislados susceptibles de Escherichia coli, Proteus mirabilis y Klebsiella pneumoniae.
Uso
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de KEFLEX 250 mg y otros medicamentos antibacterianos, KEFLEX 500 mg debe usarse solo para tratar infecciones que se compruebe o se sospeche que son causadas por bacterias susceptibles. Cuando se dispone de información sobre cultivos y susceptibilidad, esta información debe tenerse en cuenta al seleccionar o modificar la terapia antibacteriana. En ausencia de tales datos, la epidemiología local y los patrones de susceptibilidad pueden contribuir a la selección empírica de la terapia.
DOSIFICACIÓN Y ADMINISTRACIÓN
Adultos y pacientes pediátricos de al menos 15 años de edad
La dosis habitual de KEFLEX oral de 250 mg es de 250 mg cada 6 horas, pero se puede administrar una dosis de 500 mg cada 12 horas. El tratamiento se administra durante 7 a 14 días.
Para infecciones más graves, se pueden necesitar dosis más grandes de KEFLEX oral, hasta 4 gramos diarios en dos o cuatro dosis divididas por igual.
Pacientes pediátricos (mayores de 1 año)
La dosis diaria total recomendada de KEFLEX oral de 500 mg para pacientes pediátricos es de 25 a 50 mg/kg administrados en dosis divididas por igual durante 7 a 14 días. En el tratamiento de infecciones por estreptococos β-hemolíticos, se recomienda una duración de al menos 10 días. En infecciones graves, se puede administrar una dosis diaria total de 50 a 100 mg/kg dividida en dosis iguales.
Para el tratamiento de la otitis media, la dosis diaria recomendada es de 75 a 100 mg/kg administrados en dosis divididas por igual.
Ajustes de dosis en pacientes adultos y pediátricos de al menos 15 años de edad con insuficiencia renal
Administre los siguientes regímenes de dosificación de KEFLEX a pacientes con insuficiencia renal [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Cápsulas de 250 mg: un polvo de color blanco a amarillo claro que se introduce en una cápsula de color blanco opaco y verde oscuro opaco que está impresa con KEFLEX 250 mg en tinta negra comestible en el cuerpo blanco.
Cápsulas de 500 mg: un polvo de color blanco a amarillo claro que se introduce en una cápsula opaca de color verde claro y verde oscuro opaco que está impresa con KEFLEX 500 mg en tinta negra comestible en el cuerpo de color verde claro.
Cápsulas de 750 mg: un polvo de color blanco a amarillo claro que se introduce en una cápsula alargada opaca de color verde oscuro y opaca de color verde oscuro que está impresa con KEFLEX 750 mg en tinta blanca comestible en el cuerpo verde oscuro.
Almacenamiento y manipulación
Cápsulas de KEFLEX (cefalexina) , USP, se suministra de la siguiente manera:
Cápsulas de 250 mg, frascos de 100 – CDN 59630-112-10 500 mg Cápsulas, frascos de 100 – CDN 59630-113-10 750 mg Cápsulas, frascos de 50 – CDN 59630-115-05
KEFLEX debe almacenarse a 25 °C (77 °F); excursiones permitidas a 15° a 30°C (59° a 86°F) [ver Temperatura ambiente controlada por USP ].
Dispensar en un recipiente hermético resistente a la luz.
Fabricado para: Shionogi Inc. Florham Park, NJ 07932. Fabricado por: Sandoz GmbH Kundl, Austria. Revisado: octubre de 2015.
EFECTOS SECUNDARIOS
Los siguientes eventos graves se describen con mayor detalle en la sección Advertencias y precauciones:
- Reacciones de hipersensibilidad [ver ADVERTENCIAS Y PRECAUCIONES ]
- Diarrea asociada a Clostridium difficile [ver ADVERTENCIAS Y PRECAUCIONES ]
- Prueba de seroconversión directa de Coombs [ver ADVERTENCIAS Y PRECAUCIONES ]
- Potencial de convulsiones [ver ADVERTENCIAS Y PRECAUCIONES ]
- Efecto sobre la actividad de la protrombina [ver ADVERTENCIAS Y PRECAUCIONES ]
- Desarrollo de bacterias resistentes a los medicamentos [ver ADVERTENCIAS Y PRECAUCIONES ]
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
En los ensayos clínicos, la reacción adversa más frecuente fue la diarrea. También se han presentado náuseas y vómitos, dispepsia, gastritis y dolor abdominal. Al igual que con las penicilinas y otras cefalosporinas, se han notificado casos de hepatitis transitoria e ictericia colestásica.
Otras reacciones han incluido reacciones de hipersensibilidad, prurito genital y anal, candidiasis genital, vaginitis y secreción vaginal, mareos, fatiga, dolor de cabeza, agitación, confusión, alucinaciones, artralgia, artritis y trastornos articulares. Se ha informado nefritis intersticial reversible. Se han notificado eosinofilia, neutropenia, trombocitopenia, anemia hemolítica y ligeras elevaciones de la aspartato transaminasa (AST) y la alanina transaminasa (ALT).
Además de las reacciones adversas enumeradas anteriormente que se observaron en pacientes tratados con KEFLEX 500 mg, se informaron las siguientes reacciones adversas y otras pruebas de laboratorio alteradas para medicamentos antibacterianos de la clase de las cefalosporinas:
Otras reacciones adversas
Fiebre, colitis, anemia aplásica, hemorragia, disfunción renal y nefropatía tóxica.
Pruebas de laboratorio alteradas
Prolongación del tiempo de protrombina, aumento del nitrógeno ureico en sangre (BUN), aumento de la creatinina, aumento de la fosfatasa alcalina, aumento de la bilirrubina, aumento de la lactato deshidrogenasa (LDH), pancitopenia, leucopenia y agranulocitosis.
INTERACCIONES CON LA DROGAS
metformina
La administración de KEFLEX 250 mg con metformina produce un aumento de las concentraciones plasmáticas de metformina y una disminución del aclaramiento renal de metformina.
Se recomienda un control cuidadoso del paciente y el ajuste de la dosis de metformina en pacientes que toman KEFLEX y metformina de forma concomitante [ver FARMACOLOGÍA CLÍNICA ].
probenecid
Probenecid inhibe la excreción renal de KEFLEX. No se recomienda la administración conjunta de probenecid con KEFLEX 500 mg.
Interacción con laboratorio o pruebas de diagnóstico
Puede ocurrir una reacción falsa positiva cuando se prueba la presencia de glucosa en la orina usando la solución de Benedict o la solución de Fehling.
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Reacciones hipersensibles
Se han informado reacciones alérgicas en forma de erupción cutánea, urticaria, angioedema, anafilaxia, eritema multiforme, síndrome de Stevens-Johnson o necrólisis epidérmica tóxica con el uso de KEFLEX. Antes de iniciar la terapia con KEFLEX 500 mg, pregunte si el paciente tiene antecedentes de reacciones de hipersensibilidad a la cefalexina, cefalosporinas, penicilinas u otras drogas. La hipersensibilidad cruzada entre los fármacos antibacterianos betalactámicos puede ocurrir hasta en un 10% de los pacientes con antecedentes de alergia a la penicilina.
Si ocurre una reacción alérgica a KEFLEX 500 mg, suspenda el medicamento e instituya el tratamiento adecuado.
Diarrea asociada a Clostridium difficile
Se ha informado diarrea asociada a Clostridium difficile (CDAD) con el uso de casi todos los agentes antibacterianos, incluido KEFLEX 500 mg, y puede variar en gravedad desde diarrea leve hasta colitis fatal. El tratamiento con agentes antibacterianos altera la flora normal del colon y conduce al crecimiento excesivo de C. difficile.
C. difficile produce toxinas A y B, que contribuyen al desarrollo de CDAD. Las cepas de C. difficile productoras de hipertoxina causan mayor morbilidad y mortalidad, ya que estas infecciones pueden ser refractarias a la terapia antimicrobiana y pueden requerir colectomía. Se debe considerar CDAD en todos los pacientes que presenten diarrea después del uso de antibióticos. Es necesaria una cuidadosa historia clínica ya que se ha informado que la CDAD ocurre más de dos meses después de la administración de agentes antibacterianos.
Si se sospecha o se confirma CDAD, es posible que deba suspenderse el uso continuo de antibióticos no dirigidos contra C. difficile. Se debe instituir el manejo adecuado de líquidos y electrolitos, la suplementación con proteínas, el tratamiento con antibióticos de C. difficile y la evaluación quirúrgica según esté clínicamente indicado.
Prueba de seroconversión directa de Coombs
Se han informado pruebas de Coombs directas positivas durante el tratamiento con medicamentos antibacterianos de cefalosporina, incluida la cefalexina. Se ha notificado hemólisis intravascular aguda inducida por el tratamiento con cefalexina. Si se desarrolla anemia durante o después de la terapia con cefalexina, realice un estudio de diagnóstico para anemia hemolítica inducida por medicamentos, suspenda la cefalexina e instituya la terapia adecuada.
Potencial de convulsiones
Se ha implicado a varias cefalosporinas en el desencadenamiento de convulsiones, particularmente en pacientes con insuficiencia renal cuando no se redujo la dosis. Si se producen convulsiones, suspenda KEFLEX. La terapia anticonvulsiva puede ser dada si está clínicamente indicada.
Tiempo de protrombina prolongado
Las cefalosporinas pueden estar asociadas con un tiempo de protrombina prolongado. Los que están en riesgo incluyen pacientes con insuficiencia renal o hepática, o un estado nutricional deficiente, así como pacientes que reciben un ciclo prolongado de terapia antibacteriana y pacientes que reciben terapia anticoagulante. Vigile el tiempo de protrombina en pacientes de riesgo y maneje según lo indicado.
Desarrollo de bacterias resistentes a los medicamentos
Prescribir KEFLEX en ausencia de una infección bacteriana comprobada o fuertemente sospechada es poco probable que brinde beneficios al paciente y aumenta el riesgo de desarrollo de bacterias resistentes a los medicamentos.
El uso prolongado de KEFLEX puede resultar en el crecimiento excesivo de organismos no sensibles. La observación cuidadosa del paciente es esencial. Si se produce una superinfección durante el tratamiento, se deben tomar las medidas adecuadas.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
No se han realizado estudios de por vida en animales para evaluar el potencial carcinogénico de la cefalexina. No se han realizado pruebas para determinar el potencial mutagénico de la cefalexina. En ratas macho y hembra, la fertilidad y el rendimiento reproductivo no se vieron afectados por dosis orales de cefalexina de hasta 1,5 veces la dosis humana más alta recomendada según el área de superficie corporal.
Uso en poblaciones específicas
El embarazo
Embarazo Categoría B
No existen estudios adecuados y bien controlados en mujeres embarazadas. Debido a que los estudios de reproducción en animales no siempre predicen la respuesta humana, este medicamento debe usarse durante el embarazo solo si es claramente necesario.
Se han realizado estudios de reproducción en ratones y ratas utilizando dosis orales de monohidrato de cefalexina de 0,6 y 1,5 veces la dosis máxima diaria en humanos (66 mg/kg/día) según el área de superficie corporal, y no han revelado evidencia de alteración de la fertilidad o daño a la salud. el feto
Madres lactantes
La cefalexina se excreta en la leche humana. Se debe tener precaución cuando se administre KEFLEX a una mujer lactante.
Uso pediátrico
La seguridad y eficacia de KEFLEX 500 mg en pacientes pediátricos se estableció en ensayos clínicos para las dosis descritas en la sección de dosificación y administración [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Uso geriátrico
De los 701 sujetos en 3 estudios clínicos publicados de cefalexina, 433 (62%) tenían 65 años o más. No se observaron diferencias generales en la seguridad o la eficacia entre estos sujetos y los sujetos más jóvenes, y otra experiencia clínica notificada no ha identificado diferencias en las respuestas entre los pacientes de edad avanzada y los más jóvenes.
Este fármaco se excreta sustancialmente por vía renal y el riesgo de reacciones tóxicas a este fármaco puede ser mayor en pacientes con insuficiencia renal. Debido a que es más probable que los pacientes de edad avanzada tengan una función renal disminuida, se debe tener cuidado al seleccionar la dosis [ver ADVERTENCIAS Y PRECAUCIONES ].
Insuficiencia renal
KEFLEX debe administrarse con precaución en presencia de insuficiencia renal (aclaramiento de creatinina DOSIFICACIÓN Y ADMINISTRACIÓN ].
REFERENCIAS
1. Instituto de Normas Clínicas y de Laboratorio (CLSI). Métodos para pruebas de susceptibilidad antimicrobiana por dilución para bacterias que crecen aeróbicamente; Norma Aprobada - Décima Edición. Documento CLSI M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, EE. UU., 2015.
2. Instituto de Normas Clínicas y de Laboratorio (CLSI). Estándares de Desempeño para las Pruebas de Susceptibilidad a los Antimicrobianos; Vigésimo Quinto Suplemento Informativo. Documento CLSI M100-S25, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, EE. UU., 2015.
3. Instituto de Normas Clínicas y de Laboratorio (CLSI). Estándares de rendimiento para pruebas de susceptibilidad de disco antimicrobiano; Norma Aprobada - Duodécima Edición. Documento CLSI M02-A12, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, EE. UU., 2015.
SOBREDOSIS
Los síntomas de una sobredosis oral pueden incluir náuseas, vómitos, malestar epigástrico, diarrea y hematuria. En caso de sobredosis, instaurar medidas generales de apoyo.
No se ha establecido que la diuresis forzada, la diálisis peritoneal, la hemodiálisis o la hemoperfusión con carbón sean beneficiosas para una sobredosis de cefalexina.
CONTRAINDICACIONES
KEFLEX está contraindicado en pacientes con hipersensibilidad conocida a la cefalexina u otros miembros de la clase de fármacos antibacterianos de las cefalosporinas.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
La cefalexina es un fármaco antibacteriano de cefalosporina [ver Microbiología ].
Farmacocinética
Absorción
La cefalexina es estable a los ácidos y puede administrarse independientemente de las comidas. Luego de dosis de 250 mg, 500 mg y 1 g, se obtuvieron niveles séricos máximos promedio de aproximadamente 9, 18 y 32 mcg/mL, respectivamente, en 1 hora. Los niveles séricos fueron detectables 6 horas después de la administración (a un nivel de detección de 0,2 mcg/mL).
Distribución
La cefalexina se une aproximadamente del 10% al 15% a las proteínas plasmáticas.
Excreción
La cefalexina se excreta en la orina por filtración glomerular y secreción tubular. Los estudios demostraron que más del 90 % del fármaco se excretaba sin cambios en la orina en un plazo de 8 horas. Durante este período, las concentraciones máximas en orina después de las dosis de 250 mg, 500 mg y 1 g fueron de aproximadamente 1000, 2200 y 5000 mcg/ml, respectivamente.
Interacciones con la drogas
En sujetos sanos que recibieron dosis únicas de 500 mg de cefalexina y metformina, la Cmáx y el AUC medios de metformina en plasma aumentaron en un promedio de 34 % y 24 %, respectivamente, y el aclaramiento renal medio de metformina disminuyó en un 14 %. No hay información disponible sobre la interacción de cefalexina y metformina luego de múltiples dosis de cualquiera de los dos medicamentos.
Microbiología
Mecanismo de acción
La cefalexina es un agente bactericida que actúa mediante la inhibición de la síntesis de la pared celular bacteriana.
Resistencia
Los estafilococos resistentes a la meticilina y la mayoría de los aislamientos de enterococos son resistentes a la cefalexina. La cefalexina no es activa contra la mayoría de los aislamientos de Enterobacter spp., Morganella morganii y Proteus vulgaris. La cefalexina no tiene actividad contra Pseudomonas spp. o Acinetobacter calcoaceticus. El Streptococcus pneumoniae resistente a la penicilina suele tener resistencia cruzada a los fármacos antibacterianos betalactámicos.
Actividad antimicrobiana
Se ha demostrado que la cefalexina es activa contra la mayoría de los aislados de las siguientes bacterias tanto in vitro como en infecciones clínicas [ver INDICACIONES Y USO ].
bacterias grampositivas
Staphylococcus aureus (solo aislados sensibles a la meticilina) Streptococcus pneumoniae (aislados sensibles a la penicilina) Streptococcus pyogenes
Bacterias Gram-negativo
Escherichia coli Haemophilus influenzae Klebsiella pneumoniae Moraxella catarrhalis Proteus mirabilis
Métodos de prueba de susceptibilidad
Cuando esté disponible, el laboratorio de microbiología clínica debe proporcionar al médico los resultados de las pruebas de susceptibilidad in vitro de los medicamentos antimicrobianos utilizados en los hospitales residentes como informes periódicos que describen el perfil de susceptibilidad de los patógenos nosocomiales y adquiridos en la comunidad. Estos informes deberían ayudar al médico a seleccionar un medicamento antibacteriano para el tratamiento.
En los casos de infección del tracto urinario no complicada únicamente, la susceptibilidad de E. coli, K. pneumoniae y P. mirabilis a la cefalexina se puede inferir analizando la cefazolina2.
Técnicas de dilución
Los métodos cuantitativos se utilizan para determinar las concentraciones inhibitorias mínimas (CIM) antimicrobianas. Estos MIC proporcionan estimaciones de la susceptibilidad de las bacterias a los compuestos antimicrobianos. Las CIM deben determinarse utilizando métodos de prueba estandarizados (caldo o agar)1,2.
Técnicas de difusión
Los métodos cuantitativos que requieren la medición de los diámetros de las zonas también proporcionan estimaciones reproducibles de la susceptibilidad de las bacterias a los compuestos antimicrobianos. El tamaño de la zona proporciona una estimación de la susceptibilidad de las bacterias a los compuestos antimicrobianos. El tamaño de la zona debe determinarse utilizando un método de prueba estandarizado2,3.
Un informe de Susceptible (S) indica que es probable que el fármaco antimicrobiano inhiba el crecimiento del patógeno si el fármaco antimicrobiano alcanza la concentración que normalmente se alcanza en el sitio de la infección. Un informe de Intermedio (I) indica que el resultado debe considerarse equívoco, y si el microorganismo no es totalmente susceptible a fármacos alternativos clínicamente factibles, la prueba debe repetirse. Esta categoría implica una posible aplicabilidad clínica en sitios del cuerpo donde el fármaco se concentra fisiológicamente o en situaciones en las que se puede utilizar una dosis alta del fármaco. Esta categoría también proporciona una zona de amortiguamiento que evita que pequeños factores técnicos no controlados causen grandes discrepancias en la interpretación. Un informe de Resistente (R) indica que no es probable que el fármaco antimicrobiano inhiba el crecimiento del patógeno si el fármaco antimicrobiano alcanza las concentraciones que normalmente se alcanzan en el sitio de la infección; debe seleccionarse otra terapia.
Control de calidad
Los procedimientos de prueba de susceptibilidad estandarizados requieren el uso de controles de laboratorio para monitorear y garantizar la exactitud y precisión de los suministros y reactivos utilizados en el ensayo, y las técnicas de la persona que realiza la prueba1,2,3.
INFORMACIÓN DEL PACIENTE
- Advierta a los pacientes que pueden ocurrir reacciones alérgicas, incluidas reacciones alérgicas graves, y que las reacciones graves requieren tratamiento inmediato. Pregúntele al paciente sobre cualquier reacción de hipersensibilidad previa a KEFLEX, otros betalactámicos (incluidas las cefalosporinas) u otros alérgenos.
- Advierta a los pacientes que la diarrea es un problema común causado por los medicamentos antibacterianos y generalmente se resuelve cuando se suspende el medicamento. A veces, puede ocurrir diarrea acuosa o con sangre frecuente y puede ser un signo de una infección intestinal más grave. Si se desarrolla una diarrea acuosa o sanguinolenta severa, aconseje a los pacientes que se comuniquen con su proveedor de atención médica.
- Aconseje a los pacientes que los medicamentos antibacterianos, incluido KEFLEX, solo deben usarse para tratar infecciones bacterianas. No tratan infecciones virales (p. ej., el resfriado común). Cuando se prescribe KEFLEX 500 mg para tratar una infección bacteriana, dígales a los pacientes que, aunque es común sentirse mejor al comienzo de la terapia, el medicamento debe tomarse exactamente como se indica. Omitir dosis o no completar el curso completo de la terapia puede (1) disminuir la eficacia del tratamiento inmediato y (2) aumentar la probabilidad de que las bacterias desarrollen resistencia y no sean tratables con KEFLEX u otros medicamentos antibacterianos en el futuro.
