Aceon 2mg, 4mg, 8mg Perindopril Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Aceon 4 mg y cómo se usa?
Aceon 8mg es un medicamento recetado que se usa para tratar los síntomas de la presión arterial alta (hipertensión) y la enfermedad arterial coronaria estable (CAD). Aceon se puede usar solo o con otros medicamentos.
Aceon pertenece a una clase de medicamentos llamados inhibidores de la ECA.
No se sabe si Aceon es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Aceon 4mg?
Aceon puede causar efectos secundarios graves que incluyen:
- urticaria,
- respiración dificultosa,
- hinchazón de la cara, los labios, la lengua o la garganta,
- debilidad,
- latidos del corazón lentos o irregulares,
- desmayo,
- náuseas,
- vómitos,
- pérdida de apetito,
- dolor abdominal,
- coloración amarillenta de los ojos o la piel (ictericia),
- orina oscura y
- mareos severos
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Aceon 2 mg incluyen:
- mareo,
- aturdimiento,
- cansancio, y
- tos seca
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Aceon. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
ADVERTENCIA
TOXICIDAD FETAL
- Cuando se detecte un embarazo, suspenda ACEON 4 mg lo antes posible. ADVERTENCIAS Y PRECAUCIONES
- Los medicamentos que actúan directamente sobre el sistema renina-angiotensina pueden causar lesiones y la muerte del feto en desarrollo. ADVERTENCIAS Y PRECAUCIONES
DESCRIPCIÓN
Las tabletas ACEON® (perindopril erbumine) contienen la sal de terc-butilamina de perindopril, el éster etílico de un inhibidor de la enzima convertidora de angiotensina (ECA) que no es sulfhidrilo. La erbumina de perindopril se describe químicamente como (2S,3DS,7DS)-1-[(S)-N-[(S)-1-carboxi-butil]alanil]hexahidro-2-indolincarboxílico, 1-éster etílico, compuesto con terc-butilamina (1:1). Su fórmula molecular es C19H32N2O5C4H11N. Su fórmula estructural es:
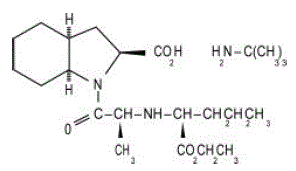
La erbumina de perindopril es un polvo cristalino blanco con un peso molecular de 368,47 (ácido libre) o 441,61 (forma de sal). Es libremente soluble en agua (60% p/p), alcohol y cloroformo.
Perindopril es la forma de ácido libre de perindopril erbumina, es un profármaco y se metaboliza in vivo por hidrólisis del grupo éster para formar perindoprilato, el metabolito biológicamente activo.
ACEON está disponible en concentraciones de 2 mg, 4 mg y 8 mg para administración oral. Además de perindopril erbumina, cada comprimido contiene los siguientes ingredientes inactivos: sílice coloidal (hidrofóbica), lactosa, estearato de magnesio y celulosa microcristalina. Los comprimidos de 4 mg y 8 mg también contienen óxido de hierro.
INDICACIONES
Hipertensión
ACEON está indicado para el tratamiento de pacientes con hipertensión esencial. ACEON puede usarse solo o administrarse con otras clases de antihipertensivos, especialmente diuréticos tiazídicos.
Enfermedad arterial coronaria estable
ACEON 8mg está indicado para el tratamiento de pacientes con enfermedad arterial coronaria estable para reducir el riesgo de mortalidad cardiovascular o infarto de miocardio no fatal. ACEON se puede utilizar con el tratamiento convencional para el tratamiento de la enfermedad de las arterias coronarias, como la terapia antiplaquetaria, antihipertensiva o reductora de lípidos.
DOSIFICACIÓN Y ADMINISTRACIÓN
Hipertensión
Uso en pacientes hipertensos sin complicaciones
En pacientes con hipertensión esencial, la dosis inicial recomendada es de 4 mg una vez al día. La dosis puede titularse, según sea necesario, hasta un máximo de 16 mg por día. El rango de dosis de mantenimiento habitual es de 4 mg a 8 mg administrados como una dosis diaria única o en dos dosis divididas.
Uso en pacientes de edad avanzada
La dosis diaria inicial recomendada de 4 mg de ACEON para ancianos es de 4 mg al día, dividida en una o dos dosis. La experiencia con ACEON es limitada en pacientes de edad avanzada a dosis superiores a 8 mg. Las dosis superiores a 8 mg deben administrarse con un control cuidadoso de la presión arterial y ajuste de la dosis [ver Uso en poblaciones específicas ].
Uso con diuréticos
En pacientes que actualmente están siendo tratados con un diurético, puede ocurrir hipotensión sintomática luego de la dosis inicial de ACEON. Considere reducir la dosis de diurético antes de comenzar con ACEON [ver INTERACCIONES CON LA DROGAS ].
Enfermedad arterial coronaria estable
En pacientes con enfermedad arterial coronaria estable, ACEON 4 mg debe administrarse a una dosis inicial de 4 mg una vez al día durante 2 semanas y luego aumentarse según la tolerancia, a una dosis de mantenimiento de 8 mg una vez al día. En pacientes de edad avanzada (mayores de 70 años), ACEON debe administrarse en una dosis de 2 mg una vez al día en la primera semana, seguida de 4 mg una vez al día en la segunda semana y 8 mg una vez al día como dosis de mantenimiento si se tolera.
Ajuste de dosis en insuficiencia renal y diálisis
La eliminación de perindoprilato está disminuida en pacientes con insuficiencia renal. ACEON no se recomienda en pacientes con depuración de creatinina
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Las tabletas son oblongas con una ranura en un lado.
La tableta de 2 mg es blanca y tiene grabado "ACN 2" en el lado sin ranurar.
La tableta de 4 mg es de color rosa y tiene grabado "ACN 4" en el lado sin marcar.
La tableta de 8 mg es de color salmón y tiene grabado "ACN 8" en el lado sin ranurar.
Almacenamiento y manipulación
Las tabletas son oblongas con una ranura en un lado.
Mantener fuera del alcance de los niños.
Almacenar a temperatura ambiente controlada de 20° a 25°C (68° a 77°F) [ver USP]. Proteger de la humedad.
Para obtener más información, llame sin cargo a nuestro departamento de comunicaciones médicas al 888-985-7657.
Fabricado por: Patheon Pharmaceuticals, Inc. Cincinnati, OH 45237 EE. UU. Revisado: septiembre de 2017
EFECTOS SECUNDARIOS
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy diversas, las tasas de eventos adversos observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Experiencia en ensayos clínicos
Las siguientes reacciones adversas se analizan en otra parte del etiquetado:
- Reacciones anafilactoides, incluyendo angioedema [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hipotensión [ver ADVERTENCIAS Y PRECAUCIONES ]
- Neutropenia y agranulocitosis [ver ADVERTENCIAS Y PRECAUCIONES ]
- Deterioro de la función renal [ver ADVERTENCIAS Y PRECAUCIONES ]
- Hiperpotasemia [ver ADVERTENCIAS Y PRECAUCIONES ]
- Tos [ver ADVERTENCIAS Y PRECAUCIONES ]
Hipertensión
Se evaluó la seguridad de 4 mg de ACEON en aproximadamente 3400 pacientes con hipertensión en ensayos clínicos en EE. UU. y en el extranjero. Los datos presentados aquí se basan en los resultados de los 1.417 pacientes tratados con ACEON que participaron en los ensayos clínicos de EE. UU. Más de 220 de estos pacientes fueron tratados con ACEON® (perindopril erbumine) durante al menos un año.
En ensayos clínicos controlados con placebo en EE. UU., la incidencia de interrupción prematura de la terapia debido a eventos adversos fue del 6,5 % en pacientes tratados con 2 mg de ACEON y del 6,7 % en pacientes tratados con placebo. Las causas más frecuentes fueron tos, cefalea, astenia y mareos.
Entre 1012 pacientes en ensayos estadounidenses controlados con placebo, la frecuencia general de eventos adversos informados fue similar en pacientes tratados con ACEON y en aquellos tratados con placebo (aproximadamente 75% en cada grupo). Los únicos eventos adversos cuya incidencia con ACEON 4 mg fue al menos un 2 % mayor que con el placebo fueron tos (12 % frente a 4,5 %) y dolor de espalda (5,8 % frente a 3,1 %).
No se notificó mareo con más frecuencia en el grupo de perindopril (8,2 %) que en el grupo de placebo (8,5 %), pero su probabilidad aumentó con la dosis, lo que sugiere una relación causal con perindopril.
Enfermedad arterial coronaria estable
Se evaluó la seguridad de perindopril en EUROPA, un estudio doble ciego controlado con placebo en 12.218 pacientes con enfermedad arterial coronaria estable. La tasa general de discontinuación fue de alrededor del 22 % con el fármaco y el placebo. Las razones médicas más comunes para la discontinuación que fueron más frecuentes con perindopril que con placebo fueron tos, intolerancia al fármaco e hipotensión.
Experiencia posterior a la comercialización
Los informes voluntarios de eventos adversos en pacientes que toman ACEON que se han recibido desde la introducción en el mercado y cuya relación causal con ACEON 8 mg se desconoce incluyen: paro cardíaco, neumonitis eosinofílica, neutropenia/agranulocitosis, pancitopenia, anemia (incluyendo hemolítica y aplásica), trombocitopenia, insuficiencia renal, nefritis, insuficiencia hepática, ictericia (hepatocelular o colestática), hiponatremia sintomática, penfigoide ampolloso, pénfigo, pancreatitis aguda, caídas, psoriasis, dermatitis exfoliativa y un síndrome que puede incluir: artralgia/artritis, vasculitis, serositis, mialgia, fiebre , erupción cutánea u otras manifestaciones dermatológicas, anticuerpos antinucleares (ANA) positivos, leucocitosis, eosinofilia o velocidad de sedimentación globular (VSG) elevada.
Hallazgos de pruebas de laboratorio clínico
Hematología
Pequeñas disminuciones en la hemoglobina y el hematocrito ocurren con frecuencia en pacientes hipertensos tratados con 8 mg de ACEON, pero rara vez tienen importancia clínica. En ensayos clínicos controlados, ningún paciente interrumpió el tratamiento debido al desarrollo de anemia. Se observó leucopenia (incluida la neutropenia) en el 0,1 % de los pacientes en ensayos clínicos en EE. UU. [ver ADVERTENCIAS Y PRECAUCIONES ].
Pruebas de función hepática
Se han observado elevaciones en ALT (1,6 % de ACEON frente a 0,9 % de placebo) y AST (0,5 % de ACEON de 2 mg frente a 0,4 % de placebo) en ensayos clínicos controlados con placebo. Las elevaciones fueron generalmente leves y transitorias y se resolvieron después de la interrupción de la terapia.
INTERACCIONES CON LA DROGAS
diuréticos
Los pacientes que toman diuréticos, y especialmente los que comenzaron recientemente, pueden experimentar ocasionalmente una reducción excesiva de la presión arterial después del inicio de la terapia con ACEON. La posibilidad de efectos hipotensores puede minimizarse disminuyendo la dosis o suspendiendo el diurético o aumentando la ingesta de sal antes de iniciar el tratamiento con perindopril. Si no se puede modificar la terapia con diuréticos, proporcione una estrecha supervisión médica con la primera dosis de ACEON, durante al menos dos horas y hasta que la presión arterial se haya estabilizado durante otra hora [ver ADVERTENCIAS Y PRECAUCIONES ].
La velocidad y el grado de absorción y eliminación de perindopril no se ven afectados por los diuréticos concomitantes. Sin embargo, los diuréticos redujeron la biodisponibilidad de perindoprilato y esto se asoció con una disminución de la inhibición de la ECA en plasma.
Suplementos de potasio y diuréticos ahorradores de potasio
ACEON 8 mg puede aumentar el potasio sérico debido a su potencial para disminuir la producción de aldosterona. El uso de diuréticos ahorradores de potasio (espironolactona, amilorida, triamtereno y otros), suplementos de potasio u otros fármacos capaces de aumentar el potasio sérico (indometacina, heparina, ciclosporina y otros) puede aumentar el riesgo de hiperpotasemia. Por lo tanto, si está indicado el uso concomitante de dichos agentes, controle con frecuencia el potasio sérico del paciente.
Litio
Se han notificado aumentos de litio sérico y síntomas de toxicidad por litio en pacientes que reciben tratamiento concomitante con litio e inhibidores de la ECA. Se recomienda un control frecuente de la concentración sérica de litio. El uso de un diurético puede aumentar aún más el riesgo de toxicidad por litio.
Oro
Raramente se han informado reacciones nitritoides (los síntomas incluyen enrojecimiento facial, náuseas, vómitos e hipotensión) en pacientes que reciben tratamiento con oro inyectable (aurotiomalato de sodio) y tratamiento concomitante con inhibidores de la ECA, incluido ACEON.
Digoxina
Un estudio farmacocinético controlado no mostró ningún efecto sobre las concentraciones plasmáticas de digoxina cuando se coadministró con ACEON, pero no se excluyó un efecto de la digoxina sobre la concentración plasmática de perindopril/perindoprilato.
gentamicina
Los datos en animales han sugerido la posibilidad de interacción entre perindopril y gentamicina. Sin embargo, esto no ha sido investigado en estudios humanos.
Agentes antiinflamatorios no esteroideos, incluidos los inhibidores selectivos de la ciclooxigenasa-2 (inhibidores de la COX-2)
En pacientes de edad avanzada, con depleción de volumen (incluidos los que reciben tratamiento con diuréticos) o con función renal comprometida, la administración concomitante de AINE, incluidos los inhibidores selectivos de la COX-2, con inhibidores de la ECA, incluido perindopril, puede provocar el deterioro de la función renal. , incluida la posible insuficiencia renal aguda. Estos efectos suelen ser reversibles. Monitoree la función renal periódicamente en pacientes que reciben perindopril y terapia con AINE.
El efecto antihipertensivo de los inhibidores de la ECA, incluido el perindopril, puede verse atenuado por los AINE, incluidos los inhibidores selectivos de la COX-2.
Bloqueo dual del sistema renina-angiotensina (RAS)
El bloqueo dual del RAS con bloqueadores de los receptores de angiotensina, inhibidores de la ECA o aliskiren se asocia con un mayor riesgo de hipotensión, hiperpotasemia y cambios en la función renal (incluida la insuficiencia renal aguda) en comparación con la monoterapia. La mayoría de los pacientes que reciben la combinación de dos inhibidores de RAS no obtienen ningún beneficio adicional en comparación con la monoterapia. En general, evite el uso combinado de inhibidores de RAS. Controle de cerca la presión arterial, la función renal y los electrolitos en pacientes que toman 2 mg de ACEON y otros agentes que afectan el RAS.
No coadministre aliskiren con ACEON 8 mg en pacientes con diabetes. Evite el uso de aliskiren con ACEON 2 mg en pacientes con insuficiencia renal (TFG
Inhibidores de mTOR
Los pacientes que reciben tratamiento concomitante con inhibidores de mTOR (objetivo de rapamicina en mamíferos) pueden tener un mayor riesgo de angioedema [ver ADVERTENCIAS Y PRECAUCIONES ].
Inhibidor de neprilisina
Los pacientes que toman inhibidores de neprilisina concomitantes pueden tener un mayor riesgo de angioedema. [ver ADVERTENCIAS Y PRECAUCIONES ]
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Reacciones anafilactoides y posiblemente relacionadas
Presumiblemente debido a que los inhibidores de la enzima convertidora de angiotensina afectan el metabolismo de los eicosanoides y polipéptidos, incluida la bradiquinina endógena, los pacientes que reciben inhibidores de la ECA (incluida la ACEON) pueden estar sujetos a una variedad de eventos adversos, algunos de ellos graves. Los pacientes negros que reciben inhibidores de la ECA tienen una mayor incidencia de angioedema en comparación con los no negros.
Angioedema de cabeza y cuello
Se ha informado angioedema de la cara, las extremidades, los labios, la lengua, la glotis o la laringe en pacientes tratados con inhibidores de la ECA, incluido ACEON (0,1 % de los pacientes tratados con ACEON en ensayos clínicos en EE. UU.). El angioedema asociado con la afectación de la lengua, la glotis o la laringe puede ser mortal. En tales casos, suspenda el tratamiento con ACEON inmediatamente y observe hasta que desaparezca la hinchazón. Cuando parezca probable que la afectación de la lengua, la glotis o la laringe provoque una obstrucción de las vías respiratorias, administre el tratamiento adecuado, como una solución subcutánea de epinefrina 1:1000 (0,3 a 0,5 ml), de inmediato.
Los pacientes que reciben tratamiento concomitante con un inhibidor de mTOR (p. ej., temsirolimus) o un inhibidor de neprilisina pueden tener un mayor riesgo de angioedema [ver INTERACCIONES CON LA DROGAS ].
Angioedema intestinal
Se ha notificado angioedema intestinal en pacientes tratados con inhibidores de la ECA. Estos pacientes presentaron dolor abdominal (con o sin náuseas o vómitos); en algunos casos no había antecedentes de angioedema facial y los niveles de esterasa C-1 eran normales. El angioedema se diagnosticó mediante procedimientos que incluyeron una tomografía computarizada abdominal o una ecografía, o en una cirugía, y los síntomas se resolvieron después de suspender el inhibidor de la ECA. El angioedema intestinal debe incluirse en el diagnóstico diferencial de los pacientes tratados con inhibidores de la ECA que presentan dolor abdominal.
Hipotensión
ACEON 4mg puede causar hipotensión sintomática. ACEON se ha asociado con hipotensión en el 0,3 % de los pacientes hipertensos sin complicaciones en ensayos controlados con placebo en EE. UU. Los síntomas relacionados con la hipotensión ortostática se informaron en otro 0,8% de los pacientes.
La hipotensión sintomática es más probable que ocurra en pacientes con depleción de volumen o de sal como resultado de una terapia prolongada con diuréticos, restricción de sal en la dieta, diálisis, diarrea o vómitos [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Los inhibidores de la ECA pueden causar hipotensión excesiva y pueden estar asociados con oliguria o azotemia, y rara vez con insuficiencia renal aguda y muerte. En pacientes con cardiopatía isquémica o enfermedad cerebrovascular, una caída excesiva de la presión arterial podría provocar un infarto de miocardio o un accidente cerebrovascular.
En pacientes con riesgo de hipotensión excesiva, la terapia con ACEON debe iniciarse bajo supervisión médica muy estrecha. Los pacientes deben ser seguidos de cerca durante las dos primeras semanas de tratamiento y cada vez que se aumente la dosis de ACEON 2 mg y/o diurético.
Si se produce una hipotensión excesiva, el paciente debe colocarse inmediatamente en posición supina y, si es necesario, tratarse con una infusión intravenosa de solución salina fisiológica. El tratamiento con 4 mg de ACEON generalmente se puede continuar después de la restauración del volumen y la presión arterial.

Neutropenia/Agranulocitosis
Los inhibidores de la ECA se han asociado con agranulocitosis y depresión de la médula ósea, con mayor frecuencia en pacientes con insuficiencia renal, especialmente en pacientes con una enfermedad del colágeno vascular como el lupus eritematoso sistémico o la esclerodermia.
Toxicidad Fetal
Embarazo Categoría D
El uso de fármacos que actúan sobre el sistema renina-angiotensina durante el segundo y tercer trimestre del embarazo reduce la función renal fetal y aumenta la morbilidad y muerte fetal y neonatal. El oligohidramnios resultante puede asociarse con hipoplasia pulmonar fetal y deformaciones esqueléticas. Los posibles efectos adversos neonatales incluyen hipoplasia craneal, anuria, hipotensión, insuficiencia renal y muerte. Cuando se detecte un embarazo, suspenda ACEON 4 mg lo antes posible [ver Uso en poblaciones específicas ].
Insuficiencia renal
Como consecuencia de la inhibición del sistema renina-angiotensina-aldosterona, pueden anticiparse cambios en la función renal en individuos susceptibles. La función renal debe controlarse periódicamente en pacientes que reciben ACEON [ver DOSIFICACIÓN Y ADMINISTRACIÓN ], [ver INTERACCIONES CON LA DROGAS ].
En pacientes con insuficiencia cardíaca congestiva grave, en los que la función renal puede depender de la actividad del sistema renina-angiotensina-aldosterona, el tratamiento con inhibidores de la ECA, incluido ACEON, puede estar asociado con oliguria, azotemia progresiva y, en raras ocasiones, insuficiencia renal aguda y muerte.
En pacientes hipertensos con estenosis de la arteria renal unilateral o bilateral, pueden ocurrir aumentos en el nitrógeno ureico en sangre y en la creatinina sérica; generalmente reversible al suspender el inhibidor de la ECA. En tales pacientes, se debe controlar la función renal durante las primeras semanas de tratamiento.
Algunos pacientes tratados con ACEON han desarrollado aumentos menores y transitorios del nitrógeno ureico en sangre y la creatinina sérica, especialmente en aquellos tratados concomitantemente con un diurético.
hiperpotasemia
Se han observado elevaciones del potasio sérico en algunos pacientes tratados con inhibidores de la ECA, incluido ACEON. La mayoría de los casos fueron valores únicos aislados que no parecían clínicamente relevantes y rara vez fueron motivo de retiro. Los factores de riesgo para el desarrollo de hiperpotasemia incluyen insuficiencia renal, diabetes mellitus y el uso concomitante de agentes como diuréticos ahorradores de potasio, suplementos de potasio y/o sustitutos de la sal que contienen potasio [ver INTERACCIONES CON LA DROGAS ].
El potasio sérico debe controlarse periódicamente en pacientes que reciben ACEON.
Tos
Presuntamente debido a la inhibición de la degradación de la bradicinina endógena, se ha notificado tos no productiva persistente con todos los inhibidores de la ECA, que por lo general se resuelve después de interrumpir el tratamiento. Considere la tos inducida por inhibidores de la ACE en el diagnóstico diferencial de la tos.
Falla hepática
En raras ocasiones, los inhibidores de la ACE se han asociado con un síndrome que comienza con ictericia colestásica y progresa a necrosis hepática fulminante y, a veces, a la muerte. El mecanismo de este síndrome no se entiende. Los pacientes que reciben inhibidores de la ECA que desarrollan ictericia o elevaciones marcadas de las enzimas hepáticas deben suspender el inhibidor de la ECA y recibir el seguimiento médico adecuado.
Cirugía/Anestesia
En pacientes sometidos a cirugía o durante la anestesia con agentes que producen hipotensión, ACEON puede bloquear la formación de angiotensina II que, de lo contrario, ocurriría como consecuencia de la liberación compensatoria de renina. La hipotensión atribuible a este mecanismo puede corregirse mediante expansión de volumen.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Carcinogenicidad
No se observó evidencia de efecto carcinogénico en estudios en ratas y ratones cuando se administró perindopril en dosis de hasta 20 veces (mg/kg) o de 2 a 4 veces (mg/m2) la dosis clínica máxima propuesta (16 mg/día) para 104 semanas.
mutagénesis
No se detectó potencial genotóxico para ACEON, perindoprilato y otros metabolitos en varias investigaciones in vitro e in vivo, incluida la prueba de Ames, la prueba D4 de Saccharomyces cerevisiae, linfocitos humanos cultivados, ensayo de linfoma de ratón TK ±, pruebas de micronúcleo de ratón y rata y hámster chino. ensayo de médula ósea.
Deterioro de la fertilidad
No hubo un efecto significativo sobre el rendimiento reproductivo o la fertilidad en las ratas que recibieron hasta 30 veces (mg/kg) o 6 veces (mg/m2) la dosis clínica máxima propuesta de 2 mg de ACEON durante el período de espermatogénesis en machos u ovogénesis y gestación en hembras
Uso en poblaciones específicas
El embarazo
Embarazo Categoría D [ver CUADRO DE ADVERTENCIA y ADVERTENCIAS Y PRECAUCIONES ].
El uso de fármacos que actúan sobre el sistema renina-angiotensina durante el segundo y tercer trimestre del embarazo reduce la función renal fetal y aumenta la morbilidad y muerte fetal y neonatal. El oligohidramnios resultante puede asociarse con hipoplasia pulmonar fetal y deformaciones esqueléticas. Los posibles efectos adversos neonatales incluyen hipoplasia craneal, anuria, hipotensión, insuficiencia renal y muerte. Cuando se detecte un embarazo, suspenda ACEON tan pronto como sea posible. Estos resultados adversos generalmente se asocian con el uso de estos medicamentos en el segundo y tercer trimestre del embarazo. La mayoría de los estudios epidemiológicos que examinan las anomalías fetales después de la exposición al uso de antihipertensivos en el primer trimestre no han distinguido los fármacos que afectan al sistema renina-angiotensina de otros agentes antihipertensivos.
El manejo adecuado de la hipertensión materna durante el embarazo es importante para optimizar los resultados tanto para la madre como para el feto.
En el caso inusual de que no exista una alternativa adecuada a la terapia con medicamentos que afectan el sistema renina-angiotensina para un paciente en particular, informe a la madre del riesgo potencial para el feto. Realice exámenes de ultrasonido en serie para evaluar el entorno intraamniótico. Si se observa oligohidramnios, suspenda ACEON 2 mg, a menos que se considere que salva la vida de la madre. Las pruebas fetales pueden ser apropiadas, según la semana de embarazo. Sin embargo, los pacientes y los médicos deben ser conscientes de que es posible que el oligohidramnios no aparezca hasta después de que el feto haya sufrido una lesión irreversible. Observe de cerca a los bebés con antecedentes de exposición en el útero a ACEON para detectar hipotensión, oliguria e hiperpotasemia [ver Uso pediátrico ].
La radioactividad fue detectable en los fetos después de la administración de 14C-perindopril a ratas preñadas.
Madres lactantes
La leche de ratas lactantes contenía radioactividad tras la administración de 14C-perindopril. No se sabe si perindopril se excreta en la leche humana. Debido a que muchos medicamentos se secretan en la leche humana, se debe tener precaución cuando se administra ACEON a madres lactantes.
Uso pediátrico
Recién nacidos con antecedentes de exposición en el útero a ACEON
Si ocurre oliguria o hipotensión, dirija la atención hacia el apoyo de la presión arterial y la perfusión renal. Es posible que se requieran exanguinotransfusiones o diálisis como medio para revertir la hipotensión y/o sustituir la función renal alterada. Perindopril, que atraviesa la placenta, teóricamente puede eliminarse de la circulación neonatal por estos medios, pero la experiencia limitada no ha demostrado que dicha eliminación sea fundamental para el tratamiento de estos lactantes.
No se ha establecido la seguridad y eficacia de ACEON 8 mg en pacientes pediátricos.
Uso geriátrico
El efecto de perindopril sobre la presión arterial media fue algo menor en pacientes mayores de 60 años que en pacientes más jóvenes, aunque la diferencia no fue significativa. Las concentraciones plasmáticas tanto de perindopril como de perindoprilato aumentaron en pacientes de edad avanzada en comparación con las concentraciones en pacientes más jóvenes. Ningún efecto adverso aumentó claramente en pacientes de edad avanzada, con la excepción de mareos y posiblemente sarpullido.
Comience con una dosis baja y ajuste lentamente según sea necesario. Controle los mareos debido a la posibilidad de caídas.
La experiencia con 8 mg de ACEON en pacientes de edad avanzada en dosis diarias superiores a 8 mg es limitada.
Insuficiencia renal
Puede ser necesario ajustar la dosis en pacientes con insuficiencia renal [ver DOSIFICACIÓN Y ADMINISTRACIÓN y FARMACOLOGÍA CLÍNICA ].
Deterioro hepático
La biodisponibilidad de perindoprilato aumenta en pacientes con insuficiencia hepática [ver FARMACOLOGÍA CLÍNICA ].
SOBREDOSIS
En animales, las dosis de perindopril de hasta 2500 mg/kg en ratones, 3000 mg/kg en ratas y 1600 mg/kg en perros no fueron letales. Las experiencias pasadas fueron escasas, pero sugirieron que los humanos también toleraron bastante bien la sobredosis con otros inhibidores de la ECA. La manifestación más probable es la hipotensión y el tratamiento debe ser sintomático y de apoyo. Se debe suspender la terapia con el inhibidor de la ECA y se debe observar al paciente. La deshidratación, el desequilibrio electrolítico y la hipotensión deben tratarse mediante los procedimientos establecidos.
Entre los casos informados de sobredosis de perindopril, los pacientes que se sabía que habían ingerido una dosis de 80 mg a 120 mg requirieron ventilación asistida y apoyo circulatorio. Un paciente adicional desarrolló hipotermia, paro circulatorio y murió luego de la ingestión de hasta 180 mg de perindopril. La intervención para la sobredosis de perindopril puede requerir un apoyo vigoroso.
Las determinaciones de laboratorio de los niveles séricos de perindopril y sus metabolitos no están ampliamente disponibles y, en cualquier caso, dichas determinaciones no tienen un papel establecido en el tratamiento de la sobredosis de perindopril.
No hay datos disponibles que sugieran maniobras fisiológicas (p. ej., maniobras para cambiar el pH de la orina) que puedan acelerar la eliminación de perindopril y sus metabolitos. Perindopril puede eliminarse por hemodiálisis, con un aclaramiento de 52 ml/min para perindopril y 67 ml/min para perindoprilato.
Presumiblemente, la angiotensina II podría servir como un antídoto-antagonista específico para resolver una sobredosis de perindopril, pero la angiotensina II esencialmente no está disponible fuera de las instalaciones de investigación dispersas. Debido a que el efecto hipotensor de perindopril se logra a través de la vasodilatación y la hipovolemia efectiva, es razonable tratar la sobredosis de perindopril mediante la infusión de solución salina normal.
CONTRAINDICACIONES
ACEON® (perindopril erbumine) está contraindicado en pacientes con hipersensibilidad conocida (incluido el angioedema) a este producto o a cualquier otro inhibidor de la ECA. ACEON 4 mg también está contraindicado en pacientes con angioedema hereditario o idiopático.
No coadministre aliskiren con ACEON en pacientes con diabetes. [ver INTERACCIONES CON LA DROGAS ]
ACEON está contraindicado en combinación con un inhibidor de neprilisina (p. ej., sacubitrilo). No administre 8 mg de ACEON dentro de las 36 horas posteriores al cambio a sacubitrilo/valsartán, un inhibidor de la neprilisina [ver ADVERTENCIAS Y PRECAUCIONES ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
ACEON® (perindopril erbumine) es un profármaco del perindoprilato, que inhibe la ECA en sujetos humanos y animales. Se cree que el mecanismo a través del cual el perindoprilato reduce la presión arterial es principalmente la inhibición de la actividad de la ECA. La ACE es una peptidil dipeptidasa que cataliza la conversión del decapéptido inactivo, angiotensina I, al vasoconstrictor, angiotensina II. La angiotensina II es un potente vasoconstrictor periférico que estimula la secreción de aldosterona por la corteza suprarrenal y proporciona una retroalimentación negativa sobre la secreción de renina. La inhibición de la ECA da como resultado una disminución de la angiotensina II plasmática, lo que conduce a una disminución de la vasoconstricción, un aumento de la actividad de la renina plasmática y una disminución de la secreción de aldosterona. Este último da como resultado diuresis y natriuresis y puede estar asociado con un pequeño aumento del potasio sérico.
La ACE es idéntica a la cininasa II, una enzima que degrada la bradicinina. Queda por dilucidar si los niveles elevados de bradicinina, un potente péptido vasodepresor, juegan un papel en los efectos terapéuticos de ACEON 4 mg.
Si bien se cree que el mecanismo principal del perindopril en la reducción de la presión arterial es a través del sistema renina-angiotensina-aldosterona, los inhibidores de la ECA tienen algún efecto incluso en la hipertensión aparente con niveles bajos de renina. El perindopril se ha estudiado en relativamente pocos pacientes de raza negra, generalmente una población con renina baja, y la respuesta promedio de la presión arterial diastólica al perindopril fue aproximadamente la mitad de la respuesta observada en pacientes que no eran de raza negra, un hallazgo consistente con la experiencia previa con otros inhibidores de la ECA.
Farmacodinámica
Después de la administración de perindopril, la ECA se inhibe de manera relacionada con la dosis y la concentración sanguínea, con una inhibición máxima del 80 al 90% alcanzada por 8 mg que persiste durante 10 a 12 horas. La inhibición de la ECA de veinticuatro horas es de alrededor del 60% después de estas dosis. El grado de inhibición de la ECA logrado por una dosis dada parece disminuir con el tiempo (aumenta la ID50). La respuesta presora a una infusión de angiotensina I se reduce con perindopril, pero este efecto no es tan persistente como el efecto sobre la ACE; hay alrededor de un 35% de inhibición a las 24 horas después de una dosis de 12 mg.
Farmacocinética
Absorción
La administración oral de ACEON da como resultado concentraciones plasmáticas máximas que ocurren aproximadamente en 1 hora. La biodisponibilidad oral absoluta de perindopril es de alrededor del 75%. Después de la absorción, aproximadamente del 30 al 50 % del perindopril disponible sistémicamente se hidroliza a su metabolito activo, perindoprilato, que tiene una biodisponibilidad media de alrededor del 25 %. Las concentraciones plasmáticas máximas de perindoprilato se alcanzan de 3 a 7 horas después de la administración de perindopril. La administración oral de 8 mg de ACEON con alimentos no reduce significativamente la tasa o el grado de absorción de perindopril en relación con el estado de ayuno. Sin embargo, el grado de biotransformación de perindopril en el metabolito activo, perindoprilato, se reduce aproximadamente un 43 %, lo que da como resultado una reducción de la curva de inhibición de la ECA en plasma de aproximadamente un 20 %, probablemente clínicamente insignificante. En los ensayos clínicos, el perindopril generalmente se administró sin ayunar.
Con dosis de 4 mg, 8 mg y 16 mg de ACEON, la Cmáx y el AUC de perindopril y perindoprilato aumentan de forma proporcional a la dosis después de la administración oral única y en el estado estacionario durante un régimen de dosificación múltiple una vez al día.
Distribución
Aproximadamente el 60 % del perindopril circulante se une a las proteínas plasmáticas y sólo del 10 al 20 % del perindoprilato se une. Por lo tanto, no se prevén interacciones farmacológicas mediadas por efectos sobre la unión a proteínas.
Metabolismo y eliminación
Tras la administración oral, perindopril presenta una farmacocinética multicompartimental, incluido un compartimento de tejido profundo (sitios de unión a la ACE). La semivida media de perindopril asociada con la mayor parte de su eliminación es de aproximadamente 0,8 a 1 hora.
Perindopril se metaboliza extensamente después de la administración oral, y solo del 4 al 12% de la dosis se recupera sin cambios en la orina. Se han identificado seis metabolitos resultantes de la hidrólisis, la glucuronidación y la ciclación por deshidratación. Estos incluyen el inhibidor de la ECA activo, perindoprilato (perindopril hidrolizado), perindopril y glucurónidos de perindoprilato, perindopril deshidratado y los diastereoisómeros de perindoprilato deshidratado. En humanos, la esterasa hepática parece ser la responsable de la hidrólisis de perindopril.
El metabolito activo, perindoprilato, también muestra una farmacocinética multicompartimental luego de la administración oral de ACEON. La formación de perindoprilato es gradual con concentraciones plasmáticas máximas entre 3 y 7 horas. La disminución subsiguiente de la concentración plasmática muestra una semivida media aparente de 3 a 10 horas para la mayor parte de la eliminación, con una semivida de eliminación terminal prolongada de 30 a 120 horas como resultado de la disociación lenta de perindoprilato de la unión a la ACE en plasma/tejidos. sitios Durante la dosificación oral repetida una vez al día con perindopril, el perindoprilato se acumula alrededor de 1,5 a 2 veces y alcanza niveles plasmáticos de estado estacionario en 3 a 6 días. El aclaramiento de perindoprilato y sus metabolitos es casi exclusivamente renal.
Anciano
Las concentraciones plasmáticas tanto de perindopril como de perindoprilato en pacientes de edad avanzada (mayores de 70 años) son aproximadamente el doble de las observadas en pacientes más jóvenes, lo que refleja tanto una mayor conversión de perindopril a perindoprilato como una disminución de la excreción renal de perindoprilato [ver DOSIFICACIÓN Y ADMINISTRACIÓN y Uso en poblaciones específicas ].
Insuficiencia cardiaca
El aclaramiento de perindoprilato se reduce en pacientes con insuficiencia cardíaca congestiva, lo que resulta en un AUC del intervalo de dosis un 40 % mayor.
Insuficiencia renal
Con dosis de perindopril de 2 mg a 4 mg, el AUC de perindoprilato aumenta con la disminución de la función renal. Con aclaramientos de creatinina de 30 a 80 ml/min, el AUC es casi el doble que con 100 ml/min. Cuando la depuración de creatinina cae por debajo de 30 ml/min, el AUC aumenta más marcadamente.
En un número limitado de pacientes estudiados, el aclaramiento de perindopril por diálisis osciló entre 40 y 80 ml/min. El aclaramiento de perindoprilato por diálisis osciló entre 40 y 90 ml/min [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Deterioro hepático
La biodisponibilidad de perindoprilato aumenta en pacientes con insuficiencia hepática. Las concentraciones plasmáticas de perindoprilato en pacientes con función hepática alterada fueron aproximadamente un 50% más altas que las observadas en sujetos sanos o pacientes hipertensos con función hepática normal.
Estudios clínicos
Hipertensión
En estudios controlados con placebo de monoterapia con perindopril (2 mg a 16 mg una vez al día) en pacientes con una presión arterial media de alrededor de 150/100 mm Hg, 2 mg tuvieron poco efecto, pero dosis de 4 mg a 16 mg redujeron la presión arterial. Las dosis de 8 mg y 16 mg fueron indistinguibles y ambas tuvieron un efecto mayor que la dosis de 4 mg. En estos estudios, las dosis de 8 mg y 16 mg por día produjeron reducciones mínimas de la presión arterial en decúbito supino de 9 a 15/5 a 6 mm Hg. Cuando se compararon las dosis de una vez al día y de dos veces al día, el régimen de dosificación de dos veces al día fue generalmente ligeramente superior, pero no más de aproximadamente 0,5 mm Hg a 1 mm Hg. Después de dosis de 2 mg a 16 mg de perindopril, los efectos mínimos de la presión arterial sistólica y diastólica media fueron aproximadamente del 75 al 100 % de los efectos máximos.
Los efectos de perindopril sobre la presión arterial fueron similares cuando se administró solo o en combinación con 25 mg de hidroclorotiazida. En general, el efecto de perindopril se produjo rápidamente, y los efectos aumentaron ligeramente durante varias semanas.
No se han realizado estudios formales de interacción de ACEON® (perindopril erbumine) con agentes antihipertensivos distintos de las tiazidas. La experiencia limitada en ensayos controlados y no controlados en los que se coadministró ACEON 2 mg con un bloqueador de los canales de calcio, un diurético del asa o una terapia triple (betabloqueante, vasodilatador y diurético) no sugiere interacciones inesperadas. En general, los inhibidores de la ECA tienen menos efectos aditivos cuando se administran con bloqueadores beta-adrenérgicos, presumiblemente porque ambos funcionan en parte a través del sistema renina angiotensina.
En estudios no controlados en pacientes con diabetes insulinodependiente, el perindopril no pareció afectar el control glucémico. En el uso a largo plazo, no se observó ningún efecto sobre la excreción urinaria de proteínas en estos pacientes.
La eficacia de 4 mg de ACEON no estuvo influenciada por el sexo y fue menos eficaz en pacientes negros que en pacientes no negros. En pacientes de edad avanzada (mayores o iguales a 60 años), el efecto de la presión arterial media fue algo menor que en pacientes más jóvenes, aunque la diferencia no fue significativa.
Enfermedad arterial coronaria estable
El ensayo EUROpeo sobre la reducción de eventos cardíacos con perindopril en enfermedad arterial coronaria estable (EUROPA) fue un estudio multicéntrico, aleatorizado, doble ciego y controlado con placebo realizado en 12.218 pacientes que tenían evidencia de enfermedad arterial coronaria estable sin insuficiencia cardíaca clínica. Los pacientes tenían evidencia de enfermedad arterial coronaria documentada por infarto de miocardio previo más de 3 meses antes de la selección, revascularización coronaria más de 6 meses antes de la selección, evidencia angiográfica de estenosis (al menos 70 % de estrechamiento de una o más arterias coronarias principales) o estrés positivo prueba en hombres con antecedentes de dolor torácico. Después de un período de preinclusión de 4 semanas durante el cual todos los pacientes recibieron perindopril de 2 mg a 8 mg, los pacientes fueron asignados aleatoriamente a perindopril 8 mg una vez al día (n=6110) o al placebo correspondiente (n=6108). El seguimiento medio fue de 4,2 años. El estudio examinó los efectos a largo plazo de perindopril sobre el tiempo hasta el primer evento de mortalidad cardiovascular, infarto de miocardio no fatal o paro cardíaco en pacientes con enfermedad arterial coronaria estable.
La edad media de los pacientes fue de 60 años; El 85 % eran hombres, el 92 % tomaba inhibidores plaquetarios, el 63 % tomaba bloqueadores β y el 56 % tomaba tratamiento hipolipemiante. El estudio EUROPA mostró que perindopril redujo significativamente el riesgo relativo de los eventos del punto final primario (Tabla 1). Este efecto beneficioso se atribuye en gran medida a la reducción del riesgo de infarto de miocardio no mortal. Este efecto beneficioso de perindopril sobre el resultado primario fue evidente después de aproximadamente un año de tratamiento (Figura 1). El resultado fue similar en todos los subgrupos predefinidos por edad, enfermedad subyacente o medicación concomitante (Figura 2).
Figura 1. Tiempo hasta la primera ocurrencia del punto final primario 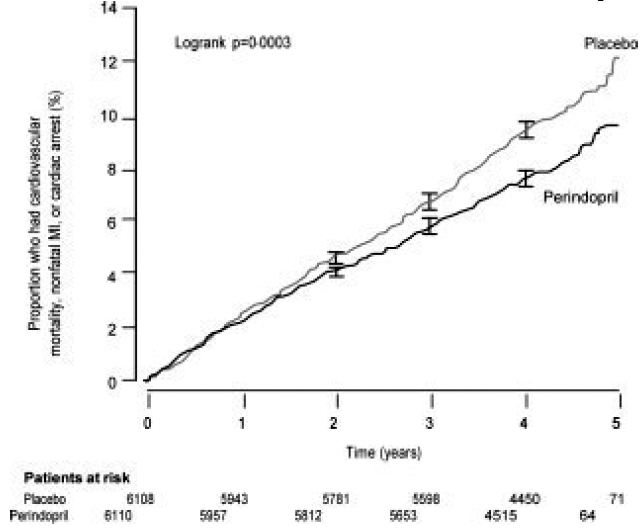
Figura 2. Efecto beneficioso del tratamiento con perindopril en el criterio principal de valoración en subgrupos predefinidos 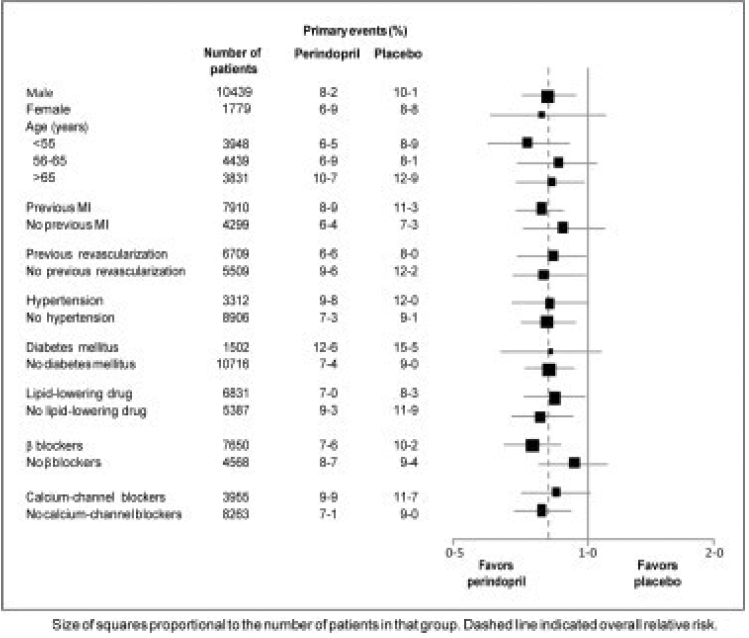
INFORMACIÓN DEL PACIENTE
Se debe informar a las pacientes en edad fértil sobre las consecuencias de la exposición a ACEON 2 mg durante el embarazo. Analice las opciones de tratamiento con las mujeres que planean quedar embarazadas. Se debe pedir a los pacientes que informen de los embarazos a sus médicos lo antes posible.
Indique a los pacientes que notifiquen de inmediato cualquier indicación de infección (p. ej., dolor de garganta, fiebre) que podría ser un signo de neutropenia.
