Procardia 30mg Nifedipine Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Procardia 30 mg y cómo se usa?
Procardia es un medicamento recetado que se usa para tratar los síntomas del dolor de pecho (angina), la presión arterial alta (hipertensión) y la hipertensión pulmonar. Procardia 30 mg se puede usar solo o con otros medicamentos.
Procardia pertenece a una clase de medicamentos llamados bloqueadores de los canales de calcio; Bloqueadores de canales de calcio, dihidropiridina.
No se sabe si Procardia es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Procardia?
Procardia puede causar efectos secundarios graves que incluyen:
- fiebre,
- dolor de garganta,
- ojos irritados,
- dolor de piel,
- erupción cutánea roja o morada con ampollas y descamación,
- empeoramiento del dolor en el pecho,
- latidos del corazón palpitantes,
- revoloteando en tu pecho,
- aturdimiento,
- hinchazón en sus manos o piernas,
- dolor en la parte superior del estómago y
- coloración amarillenta de la piel o los ojos (ictericia)
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Procardia 30 mg incluyen:
- hinchazón,
- enrojecimiento (calor, enrojecimiento o sensación de hormigueo),
- dolor de cabeza,
- mareo,
- náuseas,
- acidez estomacal, y
- sentirse débil o cansado
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Procardia. Para obtener más información, consulte a su médico o farmacéutico.
DESCRIPCIÓN
PROCARDIA® (nifedipino) es un fármaco antianginoso que pertenece a una clase de agentes farmacológicos, los bloqueadores de los canales de calcio. La nifedipina es ácido 3,5-piridindicarboxílico, 1,4-dihidro-2,6-dimetil-4-(2-nitrofenil)-, éster dimetílico, C17H18N2O6, y tiene la fórmula estructural:
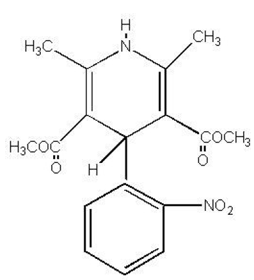
La nifedipina es una sustancia cristalina amarilla, prácticamente insoluble en agua pero soluble en etanol. Tiene un peso molecular de 346,3. Las cápsulas de PROCARDIA están formuladas como cápsulas de gelatina blanda para administración oral, cada una de las cuales contiene 10 mg de nifedipina.
Los ingredientes inertes en la formulación son: glicerina; aceite de menta; polietilenglicol; cápsulas de gelatina blanda (que contienen amarillo 6 y pueden contener óxido férrico rojo y otros ingredientes inertes); y agua. Las cápsulas de 10 mg también contienen sacarina sódica.
INDICACIONES
Angina vasoespástica
PROCARDIA (nifedipino) está indicado para el tratamiento de la angina vasoespástica confirmada por cualquiera de los siguientes criterios: 1) patrón clásico de angina en reposo acompañado de elevación del segmento ST, 2) angina o espasmo de la arteria coronaria provocado por ergonovina, o 3) demostrado angiográficamente. espasmo de la arteria coronaria. En aquellos pacientes a los que se les ha realizado una angiografía, la presencia de enfermedad obstructiva fija significativa no es incompatible con el diagnóstico de angina vasoespástica, siempre que se cumplan los criterios anteriores. PROCARDIA 30 mg también puede usarse cuando la presentación clínica sugiere un posible componente vasoespástico pero cuando el vasoespasmo no ha sido confirmado, por ejemplo, cuando el dolor tiene un umbral variable con el esfuerzo o cuando la angina es refractaria a nitratos y/o dosis adecuadas de betabloqueantes.
Angina crónica estable (angina clásica asociada al esfuerzo)
PROCARDIA 30 mg está indicado para el tratamiento de la angina estable crónica (angina asociada al esfuerzo) sin evidencia de vasoespasmo en pacientes que continúan sintomáticos a pesar de las dosis adecuadas de betabloqueantes y/o nitratos orgánicos o que no pueden tolerar esos agentes.
En la angina estable crónica (angina asociada al esfuerzo), PROCARDIA ha sido eficaz en ensayos controlados de hasta ocho semanas de duración para reducir la frecuencia de la angina y aumentar la tolerancia al ejercicio, pero la confirmación de la eficacia sostenida y la evaluación de la seguridad a largo plazo en estos pacientes son incompletas. .
Los estudios controlados en un pequeño número de pacientes sugieren que el uso concomitante de PROCARDIA 30 mg y agentes betabloqueantes puede ser beneficioso en pacientes con angina estable crónica, pero la información disponible no es suficiente para predecir con confianza los efectos del tratamiento concurrente, especialmente en pacientes con función ventricular izquierda comprometida. o alteraciones de la conducción cardíaca. Al introducir tal terapia concomitante, se debe tener cuidado de monitorear de cerca la presión arterial ya que puede ocurrir hipotensión severa por los efectos combinados de las drogas. (Ver ADVERTENCIAS .)
DOSIFICACIÓN Y ADMINISTRACIÓN
La dosis de PROCARDIA 30 mg necesaria para suprimir la angina y que puede ser tolerada por el paciente debe establecerse mediante titulación. Dosis excesivas pueden resultar en hipotensión.
La terapia debe iniciarse con la cápsula de 10 mg. La dosis inicial es una cápsula de 10 mg, tragada entera, 3 veces al día. El rango de dosis efectiva habitual es de 10 a 20 mg tres veces al día. Algunos pacientes, especialmente aquellos con evidencia de espasmo de la arteria coronaria, responden solo a dosis más altas, a una administración más frecuente oa ambas. En tales pacientes, las dosis de 20 a 30 mg tres o cuatro veces al día pueden ser eficaces. Rara vez son necesarias dosis superiores a 120 mg diarios. No se recomiendan más de 180 mg por día.
En la mayoría de los casos, la titulación de PROCARDIA debe realizarse durante un período de 7 a 14 días para que el médico pueda evaluar la respuesta a cada nivel de dosis y monitorear la presión arterial antes de continuar con dosis más altas.
Si los síntomas lo justifican, la titulación puede proceder más rápidamente siempre que el paciente sea evaluado con frecuencia. Según el nivel de actividad física del paciente, la frecuencia de los ataques y el consumo de nitroglicerina sublingual, la dosis de PROCARDIA 30 mg puede aumentarse de 10 mg tres veces al día a 20 mg tres veces al día y luego a 30 mg tres veces al día durante un período de tres días.
En pacientes hospitalizados bajo estrecha observación, la dosis puede aumentarse en incrementos de 10 mg durante períodos de cuatro a seis horas según sea necesario para controlar el dolor y las arritmias debidas a la isquemia. Una dosis única rara vez debe exceder los 30 mg.
Evite la coadministración de nifedipina con jugo de toronja (ver FARMACOLOGÍA CLÍNICA y INTERACCIONES CON LA DROGAS ).
No se ha observado un “efecto rebote” tras la suspensión de PROCARDIA. Sin embargo, si es necesaria la interrupción de PROCARDIA, la práctica clínica sólida sugiere que la dosis debe reducirse gradualmente con una estrecha supervisión médica.
Coadministración con otros fármacos antianginosos
La nitroglicerina sublingual se puede tomar según sea necesario para el control de las manifestaciones agudas de la angina, particularmente durante la titulación de PROCARDIA. Ver INTERACCIONES CON LA DROGAS , para obtener información sobre la administración conjunta de PROCARDIA 30 mg con bloqueadores beta o nitratos de acción prolongada.
CÓMO SUMINISTRADO
PROCARDIA Las cápsulas de gelatina blanda se suministran en:
Frascos de 100: 10 mg ( CDN 0069-2600-66)
Las cápsulas deben protegerse de la luz y la humedad y almacenarse a temperatura ambiente controlada, 59° a 77°F (15° a 25°C) en el envase original del fabricante.
Distribuido por: Pfizer Labs, Division of Pfizer Inc, NY, NY 10017. Revisado: julio de 2016
EFECTOS SECUNDARIOS
En estudios de dosis múltiples controlados en los Estados Unidos y en el extranjero en los que las reacciones adversas se informaron espontáneamente, los efectos adversos fueron frecuentes pero generalmente no graves y rara vez requirieron la interrupción de la terapia o el ajuste de la dosis. La mayoría eran consecuencias esperadas de los efectos vasodilatadores de PROCARDIA.
También hay una gran experiencia no controlada en más de 2100 pacientes en los Estados Unidos. La mayoría de los pacientes tenían angina de pecho vasoespástica o resistente, y aproximadamente la mitad tenía tratamiento concomitante con agentes bloqueadores betaadrenérgicos. Los eventos adversos más comunes fueron:
Incidencia Aproximadamente 10%
Cardiovascular: Edema periférico
Sistema nervioso central: mareos o aturdimiento
Gastrointestinal: náuseas
sistémico: dolor de cabeza y sofocos, debilidad
Incidencia Aproximadamente 5%
Cardiovascular: hipotensión transitoria
Incidencia 2% o menos
Cardiovascular: palpitación
Respiratorio: congestión nasal y torácica, dificultad para respirar
Gastrointestinal: diarrea, estreñimiento, calambres, flatulencia
Musculoesquelético: inflamación, rigidez de las articulaciones, calambres musculares
Sistema nervioso central: temblores, nerviosismo, inquietud, trastornos del sueño, visión borrosa, dificultades en el equilibrio
Otro: dermatitis, prurito, urticaria, fiebre, sudoración, escalofríos, dificultades sexuales
Incidencia Aproximadamente 0,5%
Cardiovascular: síncope (principalmente con la dosis inicial y/o un aumento de la dosis), eritromelalgia
Incidencia inferior al 0,5 %
hematológico: trombocitopenia, anemia, leucopenia, púrpura
Gastrointestinal: hepatitis alérgica
Cara y garganta: angioedema (principalmente edema orofaríngeo con dificultad para respirar en algunos pacientes), hiperplasia gingival
SNC: depresión, síndrome paranoide
Sentidos especiales: ceguera transitoria en el pico del nivel plasmático, tinnitus
urogenitales: nicturia, poliuria
Otro: artritis con ANA (+), dermatitis exfoliativa, ginecomastia
Musculoesquelético: mialgia
Varios de estos efectos secundarios parecen estar relacionados con la dosis. Se produjo edema periférico en aproximadamente uno de cada 25 pacientes con dosis inferiores a 60 mg por día y en aproximadamente un paciente de cada ocho con 120 mg por día o más. La hipotensión transitoria, generalmente de gravedad leve a moderada y que rara vez requiere la interrupción del tratamiento, ocurrió en uno de 50 pacientes con menos de 60 mg por día y en uno de 20 pacientes con 120 mg por día o más.
En muy raras ocasiones, la introducción del tratamiento con PROCARDIA 30 mg se asoció con un aumento del dolor anginoso, posiblemente debido a la hipotensión asociada. También ha ocurrido pérdida transitoria unilateral de la visión.
Además, se observaron eventos adversos más graves, no fácilmente distinguibles de la historia natural de la enfermedad en estos pacientes. Sin embargo, sigue siendo posible que algunos o muchos de estos eventos estuvieran relacionados con las drogas. Se produjo infarto de miocardio en aproximadamente el 4% de los pacientes e insuficiencia cardíaca congestiva o edema pulmonar en aproximadamente el 2%. Se produjeron arritmias ventriculares o trastornos de la conducción en menos del 0,5 % de los pacientes.
En un subgrupo de más de 1000 pacientes que recibieron PROCARDIA 30 mg con terapia betabloqueante concomitante, el patrón y la incidencia de experiencias adversas no fueron diferentes de los del grupo completo de pacientes tratados con PROCARDIA (nifedipina). (Ver PRECAUCIONES .)
En un subgrupo de aproximadamente 250 pacientes con diagnóstico de insuficiencia cardíaca congestiva y angina de pecho (alrededor del 10 % de la población total de pacientes), se produjeron mareos o aturdimiento, edema periférico, dolor de cabeza o sofocos en uno de cada ocho pacientes. Se produjo hipotensión en aproximadamente uno de cada 20 pacientes. El síncope ocurrió en aproximadamente un paciente de cada 250. El infarto de miocardio o los síntomas de insuficiencia cardíaca congestiva ocurrieron cada uno en aproximadamente un paciente de cada 15. Las arritmias auriculares o ventriculares ocurrieron cada una en aproximadamente un paciente de cada 150.
En la experiencia posterior a la comercialización, ha habido informes raros de dermatitis exfoliativa causada por nifedipina. Ha habido informes raros de eventos adversos de piel exfoliativa o ampollosa (como eritema multiforme, síndrome de Stevens-Johnson y necrólisis epidérmica tóxica) y reacciones de fotosensibilidad. También se ha informado pustulosis exantemática generalizada aguda.
INTERACCIONES CON LA DROGAS
Agentes bloqueadores beta-adrenérgicos
(Ver INDICACIONES Y USO y ADVERTENCIAS .) La experiencia en más de 1400 pacientes en un ensayo clínico no comparativo ha demostrado que la administración concomitante de PROCARDIA 30 mg y agentes betabloqueantes generalmente se tolera bien, pero ha habido informes ocasionales en la literatura que sugieren que la combinación puede aumentar la probabilidad de insuficiencia cardíaca congestiva. hipotensión grave o exacerbación de la angina.
Nitratos de acción prolongada
PROCARDIA 30 mg se puede coadministrar de forma segura con nitratos, pero no se han realizado estudios controlados para evaluar la eficacia antianginosa de esta combinación.
Digital
Dado que ha habido informes aislados de pacientes con niveles elevados de digoxina, y dado que existe una posible interacción entre la digoxina y la nifedipina, se recomienda monitorear los niveles de digoxina al iniciar, ajustar y suspender la nifedipina para evitar una posible digitalización excesiva o insuficiente. .
quinidina
Ha habido informes raros de una interacción entre la quinidina y la nifedipina (con una disminución del nivel plasmático de quinidina).
Anticoagulantes cumarínicos
Ha habido informes raros de aumento del tiempo de protrombina en pacientes que toman anticoagulantes cumarínicos a los que se les administró PROCARDIA. Sin embargo, la relación con la terapia con PROCARDIA es incierta.
cimetidina
Un estudio en seis voluntarios sanos mostró un aumento significativo en los niveles plasmáticos máximos de nifedipina (80 %) y el área bajo la curva (74 %) después de un curso de una semana de cimetidina a 1000 mg por día y nifedipina a 40 mg por día. día. La ranitidina produjo aumentos más pequeños y no significativos. El efecto puede estar mediado por la conocida inhibición de la cimetidina sobre el citocromo P-450 hepático, el sistema enzimático probablemente responsable del metabolismo de primer paso de la nifedipina. Si se inicia la terapia con nifedipina en un paciente que actualmente recibe cimetidina, se recomienda una titulación cuidadosa.
La nifedipina es metabolizada por CYP3A4. La coadministración de nifedipino con fenitoína, un inductor de CYP3A4, reduce la exposición sistémica a nifedipino en aproximadamente un 70 %. Evite la administración conjunta de nifedipina con fenitoína o cualquier inductor conocido de CYP3A4 o considere una terapia antihipertensiva alternativa.
Los inhibidores de CYP3A como fluconazol, itraconazol, claritromicina, eritromicina, nefazodona, fluoxetina, saquinavir, indinavir y nelfinavir pueden aumentar la exposición a la nifedipina cuando se administran conjuntamente. Puede ser necesario un control cuidadoso y un ajuste de la dosis; considere iniciar nifedipino a la dosis más baja disponible si se administra concomitantemente con estos medicamentos.
Otras interacciones
Jugo de uva
La coadministración de nifedipino con jugo de toronja resultó en aproximadamente el doble del AUC y Cmax de nifedipino sin cambios en la vida media. Lo más probable es que el aumento de las concentraciones plasmáticas se deba a la inhibición del metabolismo de primer paso relacionado con CYP 3A4. Evite la ingestión de toronja y jugo de toronja mientras toma nifedipina.
ADVERTENCIAS
Hipotensión excesiva
Aunque, en la mayoría de los pacientes, el efecto hipotensor de PROCARDIA 30 mg es modesto y bien tolerado, algunos pacientes han tenido hipotensión excesiva y mal tolerada. Estas respuestas por lo general han ocurrido durante la titulación inicial o en el momento del ajuste de dosis ascendente subsiguiente. Aunque los pacientes rara vez experimentaron hipotensión excesiva con PROCARDIA 30 mg solo, esto puede ser más común en pacientes con terapia concomitante con betabloqueantes. Aunque no está aprobado para este fin, PROCARDIA y otras cápsulas de nifedipina de liberación inmediata se han utilizado (por vía oral y sublingual) para la reducción aguda de la presión arterial. Varios informes bien documentados describen casos de hipotensión profunda, infarto de miocardio y muerte cuando se usó nifedipina de liberación inmediata de esta manera. Las cápsulas de PROCARDIA no deben utilizarse para la reducción aguda de la presión arterial.
Se han notificado casos de hipotensión grave y/o aumento de los requisitos de volumen de líquidos en pacientes que recibieron PROCARDIA 30 mg junto con un agente betabloqueante que se sometieron a una cirugía de derivación de la arteria coronaria utilizando anestesia con dosis altas de fentanilo. La interacción con dosis altas de fentanilo parece deberse a la combinación de PROCARDIA y un betabloqueante, pero no se puede descartar la posibilidad de que ocurra con PROCARDIA 30 mg solo, con dosis bajas de fentanilo, en otros procedimientos quirúrgicos o con otros analgésicos narcóticos. descartado En los pacientes tratados con PROCARDIA en los que se contempla la cirugía con anestesia con dosis altas de fentanilo, el médico debe ser consciente de estos posibles problemas y, si el estado del paciente lo permite, se debe dejar pasar suficiente tiempo (al menos 36 horas) para que PROCARDIA 30 mg se elimine por lavado. el cuerpo antes de la cirugía.
Angina aumentada y/o infarto de miocardio
En raras ocasiones, los pacientes, particularmente aquellos que tienen enfermedad arterial coronaria obstructiva grave, han desarrollado un aumento bien documentado de la frecuencia, duración y/o gravedad de la angina o del infarto agudo de miocardio al comenzar con PROCARDIA 30 mg o al momento de aumentar la dosis. El mecanismo de este efecto no está establecido.
Varios ensayos aleatorios bien controlados estudiaron el uso de nifedipina de liberación inmediata en pacientes que acababan de sufrir un infarto de miocardio. En ninguno de estos ensayos, la nifedipina de liberación inmediata pareció proporcionar algún beneficio. En algunos de los ensayos, los pacientes que recibieron nifedipina de liberación inmediata tuvieron resultados significativamente peores que los pacientes que recibieron placebo. Las cápsulas de 30 mg de PROCARDIA no deben administrarse dentro de la primera o segunda semana después del infarto de miocardio, y también deben evitarse en el contexto del síndrome coronario agudo (cuando el infarto puede ser inminente).
Uso en hipertensión esencial
PROCARDIA 30 mg y otras cápsulas de nifedipina de liberación inmediata también se han utilizado para el control a largo plazo de la hipertensión esencial, aunque las cápsulas de PROCARDIA 30 mg no han sido aprobadas para este fin y no se han realizado estudios debidamente controlados para definir una dosis o intervalo de dosis adecuados. para tal tratamiento. PROCARDIA 30 mg cápsulas no debe utilizarse para el control de la hipertensión esencial.
Retiro del bloqueador beta
Los pacientes a los que se les suspendió recientemente el tratamiento con bloqueadores beta pueden desarrollar un síndrome de abstinencia con aumento de la angina, probablemente relacionado con una mayor sensibilidad a las catecolaminas. El inicio del tratamiento con PROCARDIA 30 mg no evitará que esto ocurra y es de esperar que lo exacerbe al provocar la liberación refleja de catecolaminas. Ha habido informes ocasionales de aumento de la angina en un contexto de abstinencia de betabloqueantes e inicio de PROCARDIA. Es importante reducir gradualmente los bloqueadores beta si es posible, en lugar de detenerlos abruptamente antes de comenzar con PROCARDIA.
Insuficiencia cardíaca congestiva
En raras ocasiones, los pacientes, generalmente los que reciben un bloqueador beta, han desarrollado insuficiencia cardíaca después de comenzar con PROCARDIA. Los pacientes con estenosis aórtica estrecha pueden correr un mayor riesgo de sufrir tal evento, ya que se esperaría que el efecto de descarga de PROCARDIA 30 mg fuera de menor beneficio para estos pacientes, debido a su impedancia fija para fluir a través de la válvula aórtica.
PRECAUCIONES
General
Hipotensión
Debido a que PROCARDIA disminuye la resistencia vascular periférica, se sugiere un control cuidadoso de la presión arterial durante la administración inicial y la titulación de PROCARDIA 30 mg. Se recomienda especialmente una estrecha observación para los pacientes que ya toman medicamentos que se sabe que reducen la presión arterial. (Ver ADVERTENCIAS .)
Edema periférico
El edema periférico de leve a moderado, típicamente asociado con vasodilatación arterial y no debido a disfunción ventricular izquierda, ocurre en aproximadamente uno de cada diez pacientes tratados con PROCARDIA (nifedipina). Este edema ocurre principalmente en las extremidades inferiores y generalmente responde a la terapia con diuréticos. Con pacientes cuya angina se complica con insuficiencia cardíaca congestiva, se debe tener cuidado para diferenciar este edema periférico de los efectos del aumento de la disfunción ventricular izquierda.
Pruebas de laboratorio
Se han observado elevaciones raras, generalmente transitorias, pero ocasionalmente significativas de enzimas como la fosfatasa alcalina, CPK, LDH, SGOT y SGPT. La relación con el tratamiento con PROCARDIA es incierta en la mayoría de los casos, pero probable en algunos. Estas anomalías de laboratorio rara vez se han asociado con síntomas clínicos; sin embargo, se ha informado colestasis con o sin ictericia. Se han informado casos raros de hepatitis alérgica.
PROCARDIA 30 mg, al igual que otros bloqueadores de los canales de calcio, disminuye la agregación plaquetaria in vitro. Estudios clínicos limitados han demostrado una disminución moderada pero estadísticamente significativa en la agregación plaquetaria y un aumento en el tiempo de sangrado en algunos pacientes con PROCARDIA. Se cree que esto es una función de la inhibición del transporte de calcio a través de la membrana plaquetaria. No se ha demostrado la importancia clínica de estos hallazgos.
Se ha informado una prueba de Coombs directa positiva con/sin anemia hemolítica, pero no se pudo determinar una relación causal entre la administración de PROCARDIA y la positividad de esta prueba de laboratorio, incluida la hemólisis.
Aunque PROCARDIA 30 mg se ha utilizado de forma segura en pacientes con disfunción renal y se ha informado que ejerce un efecto beneficioso, en ciertos casos, se han informado elevaciones raras y reversibles del BUN y la creatinina sérica en pacientes con insuficiencia renal crónica preexistente. La relación con el tratamiento con PROCARDIA es incierta en la mayoría de los casos, pero probable en algunos.
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
La nifedipina se administró por vía oral a ratas durante dos años y no se demostró que fuera cancerígena. Cuando se administró a ratas antes del apareamiento, la nifedipina redujo la fertilidad en una dosis de aproximadamente 5 veces la dosis máxima recomendada en humanos. Hay un informe de la literatura de reducción reversible en la capacidad de los espermatozoides humanos obtenidos de un número limitado de hombres infértiles que toman las dosis recomendadas de nifedipina para unirse y fertilizar un óvulo in vitro. Los estudios de mutagenicidad in vivo fueron negativos.
El embarazo
Se ha demostrado que la nifedipina produce resultados teratogénicos en ratas y conejos, incluidas anomalías digitales similares a las notificadas para la fenitoína. Se ha informado que ocurren anomalías digitales con otros miembros de la clase de dihidropiridina y posiblemente sean el resultado de un flujo sanguíneo uterino comprometido. La administración de nifedipino se asoció con una variedad de efectos embriotóxicos, placentotóxicos y fetotóxicos, incluidos fetos atrofiados (ratas, ratones, conejos), deformidades de las costillas (ratones), paladar hendido (ratones), placentas pequeñas y vellosidades coriónicas subdesarrolladas (monos), embriones y muertes fetales (ratas, ratones, conejos), y embarazo prolongado/disminución de la supervivencia neonatal (ratas; no evaluado en otras especies). Sobre la base de mg/kg, todas las dosis asociadas con los efectos embriotóxicos o fetotóxicos teratogénicos en animales fueron más altas (de 5 a 50 veces) que la dosis máxima recomendada en humanos de 120 mg/día. Sobre la base de mg/m², algunas dosis fueron más altas y otras más bajas que la dosis humana máxima recomendada, pero todas estuvieron dentro de un orden de magnitud de la misma. Las dosis asociadas con efectos placentotóxicos en monos fueron equivalentes o inferiores a la dosis máxima recomendada en humanos en mg/m².
No existen estudios adecuados y bien controlados en mujeres embarazadas. PROCARDIA debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial.
Lactancia
La nifedipina se transfiere a través de la leche materna. PROCARDIA debe utilizarse durante la lactancia sólo si el beneficio potencial justifica el riesgo potencial.
Uso pediátrico
No se ha establecido la seguridad y eficacia en pacientes pediátricos. No se recomienda el uso en población pediátrica.
Uso geriátrico
La edad parece tener un efecto significativo sobre la farmacocinética de la nifedipina. El aclaramiento disminuye, lo que resulta en un AUC más alto en los ancianos. Estos cambios no se deben a cambios en la función renal (ver FARMACOLOGÍA CLÍNICA , Farmacocinética ).
SOBREDOSIS
La experiencia con la sobredosis de nifedipina es limitada. En general, la sobredosis de nifedipina que conduce a una hipotensión pronunciada exige un apoyo cardiovascular activo que incluye el control de la función cardiovascular y respiratoria, la elevación de las extremidades y el uso juicioso de la infusión de calcio, los agentes presores y los líquidos. Se esperaría que la depuración de nifedipina se prolongue en pacientes con insuficiencia hepática. Dado que la nifedipina se une en gran medida a las proteínas, es poco probable que la diálisis sea beneficiosa; sin embargo, la plasmaféresis puede ser beneficiosa.
CONTRAINDICACIONES
Reacción de hipersensibilidad conocida a PROCARDIA.
FARMACOLOGÍA CLÍNICA
PROCARDIA es un inhibidor de la entrada de iones de calcio (bloqueador de canales lentos o antagonista de los iones de calcio) e inhibe la entrada transmembrana de iones de calcio en el músculo cardíaco y el músculo liso. Los procesos contráctiles del músculo cardíaco y del músculo liso vascular dependen del movimiento de iones de calcio extracelulares hacia el interior de estas células a través de canales iónicos específicos. PROCARDIA 30 mg inhibe selectivamente la entrada de iones de calcio a través de la membrana celular del músculo cardíaco y el músculo liso vascular sin cambiar las concentraciones séricas de calcio.
Mecanismo de acción
Los medios precisos por los cuales esta inhibición alivia la angina no se han determinado por completo, pero incluyen al menos los dos mecanismos siguientes:
Relajación y prevención del espasmo de la arteria coronaria
PROCARDIA dilata las principales arterias coronarias y las arteriolas coronarias, tanto en regiones normales como isquémicas, y es un potente inhibidor del espasmo de las arterias coronarias, ya sea espontáneo o inducido por ergonovina. Esta propiedad aumenta el suministro de oxígeno al miocardio en pacientes con espasmo de la arteria coronaria y es responsable de la eficacia de PROCARDIA 30 mg en la angina vasoespástica (de Prinzmetal o variante). No está claro si este efecto juega algún papel en la angina clásica, pero los estudios de tolerancia al ejercicio no han mostrado un aumento en el producto máximo de frecuencia de ejercicio-presión, una medida ampliamente aceptada de la utilización de oxígeno. Esto sugiere que, en general, el alivio del espasmo o la dilatación de las arterias coronarias no es un factor importante en la angina clásica.
Reducción de la utilización de oxígeno
PROCARDIA reduce periódicamente la presión arterial en reposo y en un determinado nivel de ejercicio dilatando las arteriolas periféricas y reduciendo la resistencia periférica total (poscarga) contra la que trabaja el corazón. Esta descarga del corazón reduce el consumo de energía del miocardio y las necesidades de oxígeno y probablemente explica la eficacia de PROCARDIA en la angina crónica estable.
Farmacocinética y Metabolismo
PROCARDIA se absorbe rápida y completamente después de la administración oral. El fármaco es detectable en el suero 10 minutos después de la administración oral y los niveles máximos en sangre se alcanzan aproximadamente a los 30 minutos. La biodisponibilidad es proporcional a la dosis de 10 a 30 mg; la vida media no cambia significativamente con la dosis. Hay poca diferencia en la biodisponibilidad relativa cuando las cápsulas de PROCARDIA se administran por vía oral y se tragan enteras, se muerden y se tragan, o se muerden y se sostienen por vía sublingual. Sin embargo, morder la cápsula antes de tragarla produce concentraciones plasmáticas ligeramente más tempranas (27 ng/mL 10 minutos después de 10 mg) que si las cápsulas se tragaran intactas. PROCARDIA 30 mg se une en gran medida a las proteínas séricas. PROCARDIA se convierte ampliamente en metabolitos inactivos y aproximadamente el 80 por ciento de PROCARDIA 30 mg y los metabolitos se eliminan a través de los riñones. La vida media de eliminación de la nifedipina es de aproximadamente dos horas. Dado que la biotransformación hepática es la ruta predominante para la eliminación de nifedipina, la farmacocinética puede verse alterada en pacientes con enfermedad hepática crónica. Los pacientes con insuficiencia hepática (cirrosis hepática) tienen una vida media de disposición más larga y una mayor biodisponibilidad de nifedipina que los voluntarios sanos. El grado de unión a proteínas séricas de la nifedipina es alto (92-98%). La unión a proteínas puede verse muy reducida en pacientes con insuficiencia renal o hepática.
Después de la administración intravenosa, el aclaramiento de nifedipino disminuyó en un 33 % en sujetos sanos de edad avanzada en relación con sujetos sanos jóvenes.
hemodinámica
Al igual que otros bloqueadores de los canales lentos, PROCARDIA ejerce un efecto inotrópico negativo sobre el tejido miocárdico aislado. Esto rara vez, si es que alguna vez, se ve en animales intactos o en el hombre, probablemente debido a las respuestas reflejas a sus efectos vasodilatadores. En el hombre, PROCARDIA 30 mg provoca una disminución de la resistencia vascular periférica y una caída de la presión sistólica y diastólica, generalmente modesta (5-10 mm Hg sistólica), pero a veces mayor. Por lo general, hay un pequeño aumento en la frecuencia cardíaca, una respuesta refleja a la vasodilatación. Las mediciones de la función cardíaca en pacientes con función ventricular normal generalmente han encontrado un pequeño aumento en el índice cardíaco sin efectos importantes sobre la fracción de eyección, la presión diastólica final del ventrículo izquierdo (LVEDP) o el volumen (LVEDV). En pacientes con deterioro de la función ventricular, la mayoría de los estudios agudos han mostrado cierto aumento en la fracción de eyección y reducción en la presión de llenado del ventrículo izquierdo.
Efectos electrofisiológicos
Aunque, al igual que otros miembros de su clase, PROCARDIA disminuye la función del nódulo sinoauricular y la conducción auriculoventricular en preparaciones miocárdicas aisladas, tales efectos no se han observado en estudios en animales intactos o en humanos. En estudios electrofisiológicos formales, predominantemente en pacientes con sistemas de conducción normales, PROCARDIA 30 mg no ha tenido tendencia a prolongar la conducción auriculoventricular, prolongar el tiempo de recuperación del nódulo sinusal o disminuir la frecuencia sinusal.
INFORMACIÓN DEL PACIENTE
No se proporcionó información. por favor refiérase a ADVERTENCIAS y PRECAUCIONES secciones.
