Prinivil 2.5mg, 5mg, 10mg Lisinopril Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Prinivil 2,5 mg y cómo se usa?
Prinivil es un medicamento recetado que se usa para tratar los síntomas de la presión arterial alta (hipertensión) después de un ataque cardíaco o insuficiencia cardíaca. Prinivil se puede usar solo o con otros medicamentos.
- Prinivil pertenece a una clase de medicamentos llamados inhibidores de la ECA.
- No se sabe si Prinivil es seguro y efectivo en niños menores de 6 años.
¿Cuáles son los posibles efectos secundarios de Prinivil?
Prinivil puede causar efectos secundarios graves que incluyen:
- aturdimiento,
- fiebre,
- dolor de garganta,
- náuseas,
- debilidad,
- sensación de hormigueo,
- Dolor de pecho,
- latidos irregulares del corazón,
- pérdida de movimiento,
- orinar poco o nada,
- hinchazón en los pies o los tobillos,
- sensación de cansancio,
- falta de aliento,
- dolor de estómago superior,
- Comezón,
- sensación de cansancio,
- pérdida de apetito,
- orina oscura,
- heces de color arcilla, y
- coloración amarillenta de la piel o los ojos (ictericia)
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Prinivil 5 mg incluyen:
- dolor de cabeza,
- mareo,
- tos, y
- Dolor de pecho
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Prinivil. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
ADVERTENCIA
TOXICIDAD FETAL
- Cuando se detecte un embarazo, suspenda PRINIVIL lo antes posible [ver ADVERTENCIAS Y PRECAUCIONES].
- Los medicamentos que actúan directamente sobre el sistema renina-angiotensina pueden causar lesiones y la muerte del feto en desarrollo [ver ADVERTENCIAS Y PRECAUCIONES].
DESCRIPCIÓN
PRINIVIL contiene lisinopril, un derivado peptídico sintético, y un inhibidor de la enzima convertidora de angiotensina de acción prolongada por vía oral. Lisinopril se describe químicamente como (S)-1-[N2-(1-carboxi-3-fenilpropil)-Lisil]-L-prolina dihidrato. Su fórmula empírica es C21H31N3O5•2H2O y su fórmula estructural es:
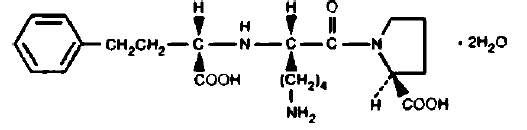
Lisinopril es un polvo cristalino de color blanco a blanquecino, con un peso molecular de 441,52. Es soluble en agua y poco soluble en metanol y prácticamente insoluble en etanol.
PRINIVIL 10 mg se presenta en comprimidos de 5 mg, 10 mg y 20 mg para administración oral. Además del ingrediente activo, lisinopril, cada tableta contiene los siguientes ingredientes inactivos: fosfato de calcio, manitol, estearato de magnesio y almidón. Los comprimidos de 10 mg y 20 mg también contienen óxido de hierro.
INDICACIONES
Hipertensión
PRINIVIL está indicado para el tratamiento de la hipertensión en pacientes adultos y pacientes pediátricos mayores de 6 años para disminuir la presión arterial. La reducción de la presión arterial reduce el riesgo de eventos cardiovasculares fatales y no fatales, principalmente accidentes cerebrovasculares e infartos de miocardio. Estos beneficios se han observado en ensayos controlados de fármacos antihipertensivos de una amplia variedad de clases farmacológicas.
El control de la presión arterial alta debe ser parte del manejo integral del riesgo cardiovascular, incluido, según corresponda, el control de los lípidos, el manejo de la diabetes, la terapia antitrombótica, el abandono del hábito de fumar, el ejercicio y la ingesta limitada de sodio. Muchos pacientes requerirán más de 1 fármaco para lograr los objetivos de presión arterial. Para obtener consejos específicos sobre objetivos y manejo, consulte las pautas publicadas, como las del Comité Nacional Conjunto para la Prevención, Detección, Evaluación y Tratamiento de la Presión Arterial Alta (JNC) del Programa Nacional de Educación sobre la Presión Arterial Alta.
Numerosos fármacos antihipertensivos, de una variedad de clases farmacológicas y con diferentes mecanismos de acción, han demostrado en ensayos controlados aleatorios que reducen la morbilidad y mortalidad cardiovascular, y se puede concluir que es la reducción de la presión arterial, y no alguna otra propiedad farmacológica de las drogas, que es en gran parte responsable de esos beneficios. El beneficio de resultado cardiovascular más grande y consistente ha sido una reducción en el riesgo de accidente cerebrovascular, pero también se han observado regularmente reducciones en el infarto de miocardio y la mortalidad cardiovascular.
La presión sistólica o diastólica elevada provoca un aumento del riesgo cardiovascular, y el aumento del riesgo absoluto por mmHg es mayor con presiones arteriales más altas, de modo que incluso reducciones modestas de la hipertensión grave pueden proporcionar un beneficio sustancial. La reducción del riesgo relativo de la reducción de la presión arterial es similar en poblaciones con riesgo absoluto variable, por lo que el beneficio absoluto es mayor en pacientes que tienen un riesgo más alto independientemente de su hipertensión (por ejemplo, pacientes con diabetes o hiperlipidemia), y se esperaría que tales pacientes beneficiarse de un tratamiento más agresivo para lograr un objetivo de presión arterial más bajo.
Algunos medicamentos antihipertensivos tienen efectos menores sobre la presión arterial (como monoterapia) en pacientes de raza negra, y muchos medicamentos antihipertensivos tienen indicaciones y efectos adicionales aprobados (p. ej., angina, insuficiencia cardíaca o enfermedad renal diabética). Estas consideraciones pueden guiar la selección de la terapia.
PRINIVIL puede administrarse solo o con otros agentes antihipertensivos [ver Estudios clínicos ].
Insuficiencia cardiaca
PRINIVIL está indicado para reducir los signos y síntomas de insuficiencia cardíaca en pacientes que no responden adecuadamente a los diuréticos y digitálicos [ver Estudios clínicos ].
Infarto agudo del miocardio
PRINIVIL está indicado para la reducción de la mortalidad en el tratamiento de pacientes hemodinámicamente estables dentro de las 24 horas posteriores a un infarto agudo de miocardio. Los pacientes deben recibir, según corresponda, los tratamientos estándar recomendados, como trombolíticos, aspirina y betabloqueantes [ver Estudios clínicos ].
DOSIFICACIÓN Y ADMINISTRACIÓN
Hipertensión
Terapia inicial en adultos: La dosis inicial recomendada es de 10 mg una vez al día. Ajuste la dosis de acuerdo con la respuesta de la presión arterial. El rango de dosificación habitual es de 20 a 40 mg por día administrados en una sola dosis diaria. Se han utilizado dosis de hasta 80 mg, pero no parecen dar un mayor efecto.
Uso con diuréticos en adultos
Si la presión arterial no se controla con PRINIVIL 10 mg solo, se puede agregar una dosis baja de un diurético (p. ej., hidroclorotiazida 12,5 mg).
La dosis inicial recomendada en pacientes adultos con hipertensión que toman diuréticos es de 5 mg una vez al día [ver INTERACCIONES CON LA DROGAS ].
Pacientes pediátricos de 6 años de edad y mayores con hipertensión
Para pacientes pediátricos con tasa de filtración glomerular >30 ml/min/1,73 m², la dosis inicial recomendada es de 0,07 mg/kg una vez al día (hasta 5 mg en total). La dosis debe ajustarse de acuerdo con la respuesta de la presión arterial hasta un máximo de 0,61 mg/kg (hasta 40 mg) una vez al día. No se han estudiado dosis superiores a 0,61 mg/kg (o superiores a 40 mg) en pacientes pediátricos [ver FARMACOLOGÍA CLÍNICA ].
No se recomienda PRINIVIL 2,5 mg en pacientes pediátricos Uso en poblaciones específicas y Estudios clínicos ].
Insuficiencia cardiaca
La dosis inicial recomendada de PRINIVIL 2,5 mg, cuando se usa con diuréticos y (normalmente) digitálicos como tratamiento adyuvante, es de 5 mg una vez al día. La dosis inicial recomendada en estos pacientes con hiponatremia (sodio sérico
Es posible que sea necesario ajustar la dosis de diurético para ayudar a minimizar la hipovolemia, que puede contribuir a la hipotensión [ver ADVERTENCIAS Y PRECAUCIONES y INTERACCIONES CON LA DROGAS ]. La aparición de hipotensión después de la dosis inicial de PRINIVIL no impide la posterior titulación cuidadosa de la dosis del fármaco, luego de un manejo eficaz de la hipotensión.
Infarto agudo del miocardio
En pacientes hemodinámicamente estables dentro de las 24 horas del inicio de los síntomas de infarto agudo de miocardio, administre PRINIVIL 5 mg por vía oral, seguido de 5 mg después de 24 horas, 10 mg después de 48 horas y luego 10 mg una vez al día. La dosificación debe continuar durante al menos 6 semanas.
Iniciar terapia con 2,5 mg en pacientes con presión arterial sistólica baja (100-120 mmHg) durante los primeros 3 días posteriores al infarto [ver ADVERTENCIAS Y PRECAUCIONES ]. Si se presenta hipotensión (presión arterial sistólica ≤100 mmHg) considerar dosis de 2,5 o 5 mg. Si ocurre hipotensión prolongada (presión arterial sistólica
Dosis en pacientes con insuficiencia renal
No es necesario ajustar la dosis de PRINIVIL 2,5 mg en pacientes con aclaramiento de creatinina >30 ml/min. En pacientes con aclaramiento de creatinina de 10 a 30 ml/min, reduzca la dosis inicial de PRINIVIL a la mitad de la dosis habitual recomendada (es decir, hipertensión, 5 mg; insuficiencia cardíaca o IM agudo, 2,5 mg). Para pacientes en hemodiálisis o depuración de creatinina Uso en poblaciones específicas y FARMACOLOGÍA CLÍNICA ].
Preparación de la suspensión
Para preparar 200 mL de una suspensión a 1,0 mg/mL, agregue 10 mL de Agua Purificada USP a una botella de tereftalato de polietileno (PET) que contiene diez tabletas de 20 mg de PRINIVIL 5 mg y agite durante al menos un minuto. Agregue 30 ml de solución oral de citrato de sodio y ácido cítrico o diluyente Cytra-2 y 160 ml de Ora-Sweet SF™ al concentrado en la botella de PET y agite suavemente durante varios segundos para dispersar los ingredientes. La suspensión debe almacenarse a una temperatura igual o inferior a 25 °C (77 °F) y puede almacenarse hasta por cuatro semanas. Agite la suspensión antes de cada uso.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
Comprimidos PRINIVIL, 5 mg, son comprimidos blancos de forma ovalada con el código MSD 19 en una cara y ranurados en la otra cara.
Comprimidos PRINIVIL, 10 mg, son comprimidos comprimidos de forma ovalada de color amarillo claro con el código MSD 106 en una cara y ranurados en la otra cara.
Las tabletas PRINIVIL, 20 mg, son tabletas comprimidas de forma ovalada de color melocotón con el código MSD 207 en un lado y ranurado en el otro lado.
Almacenamiento y manipulación
PRINIVIL 10 mg se presenta en comprimidos comprimidos de forma ovalada ranurados por una cara.
Almacenamiento
Almacenar a temperatura ambiente controlada, 15-30°C (59-86°F), y proteger de la humedad.
Dispense en un recipiente hermético, si el paquete del producto está subdividido.
Distribuido por: Merck Sharp & Dohme Corp., una subsidiaria de MERCK & CO., INC., Whitehouse Station, NJ 08889, EE. UU. Revisado: noviembre de 2021
EFECTOS SECUNDARIOS
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los estudios clínicos de un fármaco no pueden compararse directamente con las tasas de los estudios clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Hipertensión
Las siguientes reacciones adversas (eventos un 2 % mayores con PRINIVIL 5 mg que con placebo) se observaron con PRINIVIL 2,5 mg frente a placebo: dolor de cabeza (5,7 % frente a 1,9 %), mareos (5,4 % frente a 1,9 %), tos (3,5 % frente a 1,0 % ).
Insuficiencia cardiaca
En estudios controlados en pacientes con insuficiencia cardiaca, se interrumpió el tratamiento en el 8,1 % de los pacientes tratados con PRINIVIL 10 mg durante 12 semanas, en comparación con el 7,7 % de los pacientes tratados con placebo durante 12 semanas.
Se observaron las siguientes reacciones adversas (eventos un 2 % mayores con PRINIVIL 2,5 mg que con placebo) con PRINIVIL frente a placebo: hipotensión (4,4 % frente a 0,6 %), dolor torácico (3,4 % frente a 1,3 %).
En el ensayo ATLAS [ver Estudios clínicos ] en pacientes con insuficiencia cardíaca, los retiros por reacciones adversas fueron similares en los grupos de dosis baja y alta. Las siguientes reacciones adversas, en su mayoría relacionadas con la inhibición de la ECA, se informaron con mayor frecuencia en el grupo de dosis alta:
Infarto agudo del miocardio
Los pacientes del estudio GISSI-3, tratados con PRINIVIL 10 mg, tuvieron una mayor incidencia de hipotensión (9,0 % frente a 3,7 %) y disfunción renal (2,4 % frente a 1,1 %) en comparación con los pacientes que no tomaban PRINIVIL.
Otras reacciones adversas clínicas que ocurren en el 1 % o más de los pacientes con hipertensión o insuficiencia cardíaca tratados con PRINIVIL 2.5 mg en ensayos clínicos controlados y que no aparecen en otras secciones de la etiqueta se enumeran a continuación:
Cuerpo en su conjunto: Fatiga, astenia, efectos ortostáticos.
Digestivo: Pancreatitis, estreñimiento, flatulencia, boca seca, diarrea.
hematológico: Casos raros de depresión de la médula ósea, anemia hemolítica, leucopenia/neutropenia y trombocitopenia.
Endocrino: Diabetes mellitus, secreción inadecuada de hormona antidiurética.
Metabólico: Gota
Piel: Urticaria, alopecia, fotosensibilidad, eritema, rubefacción, diaforesis, pseudolinfoma cutáneo, necrólisis epidérmica tóxica, síndrome de Stevens-Johnson y prurito.
Sentidos especiales: Pérdida visual, diplopía, visión borrosa, tinnitus, fotofobia, alteraciones del gusto, alteraciones del olfato.
urogenitales: Impotencia
Misceláneas: Se ha notificado un complejo de síntomas que puede incluir ANA positivo, velocidad de sedimentación globular elevada, artralgia/artritis, mialgia, fiebre, vasculitis, eosinofilia, leucocitosis, parestesia y vértigo. Erupción, fotosensibilidad u otras manifestaciones dermatológicas pueden ocurrir solas o en combinación con estos síntomas.
Hallazgos de pruebas de laboratorio clínico
Potasio sérico
En los ensayos clínicos, se produjo hiperpotasemia (potasio sérico >5,7 mEq/l) en el 2,2 % y el 4,8 % de los pacientes con hipertensión e insuficiencia cardíaca tratados con PRINIVIL, respectivamente [ver ADVERTENCIAS Y PRECAUCIONES ].
Creatinina, nitrógeno ureico en sangre
Se observaron aumentos menores en el nitrógeno ureico en sangre y la creatinina sérica, reversibles al interrumpir el tratamiento, en aproximadamente el 2 % de los pacientes con hipertensión tratados con PRINIVIL 5 mg solo. Los aumentos fueron más comunes en pacientes que recibieron diuréticos concomitantes y en pacientes con estenosis de la arteria renal [ver ADVERTENCIAS Y PRECAUCIONES ]. Se observaron aumentos menores reversibles en el nitrógeno ureico en sangre y la creatinina sérica en el 11,6 % de los pacientes con insuficiencia cardíaca en tratamiento concomitante con diuréticos. Con frecuencia, estas anomalías se resolvieron cuando se redujo la dosis del diurético.
Los pacientes con infarto agudo de miocardio en el ensayo GISSI-3 tratados con PRINIVIL tuvieron una incidencia más alta (2,4 % frente a 1,1 % en placebo) de disfunción renal en el hospital y a las 6 semanas (aumentando la concentración de creatinina a más de 3 mg/dl o duplicando o más de la concentración de creatinina sérica basal).
Hemoglobina y hematocrito
Pequeñas disminuciones en la hemoglobina (media 0,4 mg/dl) y el hematocrito (media 1,3 %) ocurrieron con frecuencia en pacientes tratados con PRINIVIL 5 mg, pero rara vez tuvieron importancia clínica en pacientes sin alguna otra causa de anemia. En los ensayos clínicos, menos del 0,1 % de los pacientes interrumpieron el tratamiento por anemia.
Enzimas del hígado
En raras ocasiones, se han producido elevaciones de las enzimas hepáticas y/o la bilirrubina sérica [ver ADVERTENCIAS Y PRECAUCIONES ].
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de lisinopril que no están incluidas en otras secciones de la etiqueta. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco. Otras reacciones incluyen:
Trastornos del metabolismo y la nutrición
Hiponatremia [ver ADVERTENCIAS Y PRECAUCIONES ], casos de hipoglucemia en pacientes diabéticos con antidiabéticos orales o insulina [ver INTERACCIONES CON LA DROGAS ]
Sistema nervioso y trastornos psiquiátricos
Alteraciones del estado de ánimo (incluyendo síntomas depresivos), confusión mental
INTERACCIONES CON LA DROGAS
diuréticos
El inicio de PRINIVIL en pacientes que toman diuréticos puede resultar en una reducción excesiva de la presión arterial. La posibilidad de efectos hipotensores con PRINIVIL puede minimizarse ya sea disminuyendo o descontinuando el diurético o aumentando la ingesta de sal antes de iniciar el tratamiento con PRINIVIL. Si esto no es posible, reduzca la dosis inicial de PRINIVIL [ver DOSIFICACIÓN Y ADMINISTRACIÓN y ADVERTENCIAS Y PRECAUCIONES ].
PRINIVIL 2,5 mg atenúa la pérdida de potasio provocada por los diuréticos de tipo tiazídico. Los diuréticos ahorradores de potasio (espironolactona, amilorida, triamtereno y otros) u otros medicamentos que pueden aumentar el potasio sérico pueden aumentar el riesgo de hiperpotasemia. Por lo tanto, si está indicado el uso concomitante de tales agentes, controle con frecuencia el potasio sérico del paciente.
Antidiabéticos
La administración concomitante de PRINIVIL 10 mg y medicamentos antidiabéticos (insulinas, hipoglucemiantes orales) puede causar un aumento del efecto hipoglucemiante con riesgo de hipoglucemia.
Agentes antiinflamatorios no esteroideos, incluidos los inhibidores selectivos de la ciclooxigenasa-2 (inhibidores de la COX-2)
En pacientes de edad avanzada, con depleción de volumen (incluidos los que reciben tratamiento con diuréticos) o con función renal comprometida, la coadministración de AINE, incluidos los inhibidores selectivos de la COX-2, con inhibidores de la ECA, incluido lisinopril, puede provocar el deterioro de la función renal, incluidos posible insuficiencia renal aguda. Estos efectos suelen ser reversibles. Monitoree la función renal periódicamente en pacientes que reciben terapia con lisinopril y AINE.
El efecto antihipertensivo de los inhibidores de la ECA, incluido el lisinopril, puede verse atenuado por los AINE.
Bloqueo dual del sistema renina-angiotensina (RAS)
El bloqueo dual del RAS con bloqueadores de los receptores de angiotensina, inhibidores de la ECA o inhibidores directos de la renina (como aliskiren) se asocia con un mayor riesgo de hipotensión, síncope, hiperpotasemia y cambios en la función renal (incluida la insuficiencia renal aguda) en comparación con la monoterapia.
El ensayo Nephropathy in Diabetes (VA NEPHRON-D) de Asuntos de Veteranos inscribió a 1448 pacientes con diabetes tipo 2, índice elevado de albúmina a creatinina en orina y tasa de filtración glomerular estimada disminuida (TFG de 30 a 89,9 ml/min), los aleatorizó para lisinopril o placebo en un contexto de terapia con losartán y los siguieron durante una mediana de 2,2 años. Los pacientes que recibieron la combinación de losartán y lisinopril no obtuvieron ningún beneficio adicional en comparación con la monoterapia para el criterio de valoración combinado de disminución de la TFG, enfermedad renal en etapa terminal o muerte, pero experimentaron una mayor incidencia de hiperpotasemia y lesión renal aguda en comparación con el grupo de monoterapia. .
En general, evite el uso combinado de inhibidores de RAS. Controle la presión arterial, la función renal y los electrolitos en pacientes con PRINIVIL 5 mg y otros agentes que afectan el RAS.
No coadministrar aliskiren con PRINIVIL en pacientes con diabetes. Evitar el uso de aliskireno con PRINIVIL 2,5 mg en pacientes con insuficiencia renal (TFG
Litio
Se ha informado toxicidad por litio en pacientes que reciben litio concomitantemente con medicamentos que provocan la eliminación de sodio, incluidos los inhibidores de la ECA. La toxicidad por litio generalmente fue reversible al suspender el litio y el inhibidor de la ECA. Controle los niveles séricos de litio durante el uso concurrente.
Oro
Raramente se han informado reacciones nitritoides (los síntomas incluyen enrojecimiento facial, náuseas, vómitos e hipotensión) en pacientes en tratamiento con oro inyectable (aurotiomalato de sodio) y tratamiento concomitante con inhibidores de la ECA, incluido PRINIVIL.
Inhibidores de la diana de rapamicina en mamíferos (mTOR)
Los pacientes que reciben tratamiento concomitante con un inhibidor de mTOR (p. ej., temsirolimus, sirolimus, everolimus) pueden tener un mayor riesgo de angioedema [ver ADVERTENCIAS Y PRECAUCIONES ].
Inhibidores de neprilisina
Los pacientes que toman un inhibidor de neprilisina concomitante (p. ej., sacubitrilo) pueden tener un mayor riesgo de angioedema [ver CONTRAINDICACIONES y ADVERTENCIAS Y PRECAUCIONES ].
ADVERTENCIAS
Incluido como parte de la PRECAUCIONES sección.
PRECAUCIONES
Toxicidad Fetal
PRINIVIL puede causar daño fetal cuando se administra a una mujer embarazada. El uso de fármacos que actúan sobre el sistema renina-angiotensina durante el segundo y tercer trimestre del embarazo reduce la función renal fetal y aumenta la morbilidad y muerte fetal y neonatal. El oligohidramnios resultante puede asociarse con hipoplasia pulmonar fetal y deformaciones esqueléticas. Los posibles efectos adversos neonatales incluyen hipoplasia craneal, anuria, hipotensión, insuficiencia renal y muerte. Cuando se detecte un embarazo, suspenda PRINIVIL lo antes posible [ver Uso en poblaciones específicas ].
Angioedema y reacciones anafilactoides
angioedema
Angioedema de cabeza y cuello
Se ha producido angioedema de la cara, extremidades, labios, lengua, glotis y/o laringe, incluidas algunas reacciones mortales, en pacientes tratados con inhibidores de la enzima convertidora de angiotensina, incluido PRINIVIL, en cualquier momento durante el tratamiento. Es probable que los pacientes con afectación de la lengua, la glotis o la laringe experimenten obstrucción de las vías respiratorias, especialmente aquellos con antecedentes de cirugía de las vías respiratorias. PRINIVIL 5 mg debe suspenderse de inmediato y debe proporcionarse la terapia y el control adecuados hasta que se produzca una resolución completa y sostenida de los signos y síntomas del angioedema.
Los pacientes con antecedentes de angioedema no relacionado con la terapia con inhibidores de la ECA pueden tener un mayor riesgo de angioedema mientras reciben un inhibidor de la ECA [ver CONTRAINDICACIONES ]. Los inhibidores de la ECA se han asociado con una tasa más alta de angioedema en pacientes negros que en pacientes no negros.
Los pacientes que reciben tratamiento concomitante con un inhibidor de la ECA y un inhibidor de mTOR (objetivo de rapamicina en mamíferos) (p. ej., temsirolimus, sirolimus, everolimus) pueden tener un mayor riesgo de angioedema [ver INTERACCIONES CON LA DROGAS ].
Los pacientes que reciben tratamiento concomitante con un inhibidor de la ECA y un inhibidor de la neprilisina pueden tener un mayor riesgo de angioedema [ver CONTRAINDICACIONES y INTERACCIONES CON LA DROGAS ].
Angioedema intestinal
Se ha producido angioedema intestinal en pacientes tratados con inhibidores de la ECA. Estos pacientes presentaron dolor abdominal (con o sin náuseas o vómitos); en algunos casos no había antecedentes de angioedema facial y los niveles de esterasa C-1 eran normales. En algunos casos, el angioedema se diagnosticó mediante procedimientos que incluían una tomografía computarizada abdominal o una ecografía, o en una cirugía, y los síntomas se resolvieron después de suspender el inhibidor de la ECA.
Reacciones anafilactoides
Reacciones anafilactoides durante la desensibilización
Dos pacientes sometidos a tratamiento desensibilizante con veneno de himenópteros mientras recibían inhibidores de la ECA sufrieron reacciones anafilactoides potencialmente mortales.
Reacciones anafilactoides durante la diálisis
Se han producido reacciones anafilactoides repentinas y potencialmente mortales en algunos pacientes dializados con membranas de alto flujo y tratados concomitantemente con un inhibidor de la ECA. En tales pacientes, la diálisis debe suspenderse de inmediato y debe iniciarse una terapia agresiva para las reacciones anafilactoides. Los antihistamínicos no han aliviado los síntomas en estas situaciones. En estos pacientes, se debe considerar el uso de un tipo diferente de membrana de diálisis o una clase diferente de agente antihipertensivo. También se han informado reacciones anafilactoides en pacientes sometidos a aféresis de lipoproteínas de baja densidad con absorción de sulfato de dextrano.
Insuficiencia renal
Vigilar periódicamente la función renal en pacientes tratados con PRINIVIL. Los cambios en la función renal, incluida la insuficiencia renal aguda, pueden ser causados por fármacos que inhiben el sistema renina-angiotensina. Los pacientes cuya función renal puede depender en parte de la actividad del sistema renina-angiotensina (p. ej., pacientes con estenosis de la arteria renal, enfermedad renal crónica, insuficiencia cardíaca congestiva grave, posinfarto de miocardio o depleción de volumen) pueden correr un riesgo particular de desarrollar insuficiencia renal aguda en PRINIVIL. Considere suspender o interrumpir el tratamiento en pacientes que desarrollen una disminución clínicamente significativa de la función renal con PRINIVIL [ver REACCIONES ADVERSAS y INTERACCIONES CON LA DROGAS ].
Hipotensión
PRINIVIL puede causar hipotensión sintomática, a veces complicada con oliguria, azotemia progresiva, insuficiencia renal aguda o muerte. Los pacientes con riesgo de hipotensión excesiva incluyen aquellos con las siguientes condiciones o características: insuficiencia cardíaca con presión arterial sistólica por debajo de 100 mmHg, cardiopatía isquémica, enfermedad cerebrovascular, hiponatremia, tratamiento diurético en dosis altas, diálisis renal o depleción grave de volumen y/o sal de cualquier etiología.
En estos pacientes, comience PRINIVIL bajo supervisión médica y siga a dichos pacientes durante las dos primeras semanas de tratamiento y cada vez que se aumente la dosis de PRINIVIL y/o diurético. Evite el uso de PRINIVIL 2,5 mg en pacientes hemodinámicamente inestables después de un infarto de miocardio agudo.
La hipotensión sintomática también es posible en pacientes con estenosis aórtica grave o miocardiopatía hipertrófica.
Cirugía/Anestesia
En pacientes sometidos a cirugía mayor o durante la anestesia con agentes que producen hipotensión, PRINIVIL puede bloquear la formación de angiotensina II secundaria a la liberación compensatoria de renina. Si se produce hipotensión y se considera que se debe a este mecanismo, puede corregirse mediante expansión de volumen.
hiperpotasemia
Monitoree el potasio sérico periódicamente en pacientes que reciben PRINIVIL. Los fármacos que inhiben el sistema renina-angiotensina pueden causar hiperpotasemia. Los factores de riesgo para el desarrollo de hiperpotasemia incluyen insuficiencia renal, diabetes mellitus y el uso concomitante de diuréticos ahorradores de potasio, suplementos de potasio, sustitutos de la sal que contienen potasio u otros medicamentos que pueden aumentar el potasio sérico [ver INTERACCIONES CON LA DROGAS ].
Falla hepática
Los inhibidores de la ACE se han asociado con un síndrome que comienza con ictericia colestásica o hepatitis y progresa a necrosis hepática fulminante y, en ocasiones, a la muerte. El mecanismo de este síndrome no se entiende. Los pacientes que reciben inhibidores de la ECA que desarrollan ictericia o elevaciones marcadas de las enzimas hepáticas deben suspender el inhibidor de la ECA y recibir el tratamiento médico adecuado.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
No hubo evidencia de un efecto tumorigénico cuando se administró lisinopril durante 105 semanas a ratas macho y hembra en dosis de hasta 90 mg por kg por día o durante 92 semanas a ratones macho y hembra en dosis de hasta 135 mg por kg por día. Estas dosis son 10 veces y 7 veces, respectivamente, la MRHDD cuando se comparan sobre la base del área de superficie corporal.
Lisinopril no fue mutagénico en la prueba de mutágeno microbiano de Ames con o sin activación metabólica. También fue negativo en un ensayo de mutación directa utilizando células de pulmón de hámster chino. Lisinopril no produjo roturas de ADN monocatenario en un ensayo de hepatocitos de rata de elución alcalina in vitro. Además, lisinopril no produjo aumentos en las aberraciones cromosómicas en una prueba in vitro en células de ovario de hámster chino o en un estudio in vivo en médula ósea de ratón.
No hubo efectos adversos sobre el rendimiento reproductivo en ratas macho y hembra tratadas con hasta 300 mg/kg/día de lisinopril (33 veces la MRHDD en comparación con el área de superficie corporal).
Los estudios en ratas indican que lisinopril atraviesa mal la barrera hematoencefálica. Dosis múltiples de lisinopril en ratas no dan como resultado acumulación en ningún tejido. La leche de ratas lactantes contiene radiactividad tras la administración de 14C lisinopril. Mediante autorradiografía de todo el cuerpo, se encontró radioactividad en la placenta después de la administración del fármaco marcado a ratas preñadas, pero no se encontró nada en los fetos.
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
PRINIVIL puede causar daño fetal cuando se administra a una mujer embarazada. El uso de fármacos que actúan sobre el sistema renina-angiotensina durante el segundo y tercer trimestre del embarazo reduce la función renal fetal y aumenta la morbilidad y muerte fetal y neonatal. La mayoría de los estudios epidemiológicos que examinan las anomalías fetales después de la exposición al uso de antihipertensivos en el primer trimestre no han distinguido los fármacos que afectan al sistema renina-angiotensina de otros agentes antihipertensivos. Cuando se detecte un embarazo, suspenda PRINIVIL 5 mg lo antes posible.
Se desconoce el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo para la población indicada. Todos los embarazos tienen un riesgo de fondo de defecto congénito, pérdida u otros resultados adversos. En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 al 4 % y del 15 al 20 %, respectivamente.
Consideraciones clínicas
Riesgo materno y/o embrionario/fetal asociado a la enfermedad
La hipertensión en el embarazo aumenta el riesgo materno de preeclampsia, diabetes gestacional, parto prematuro y complicaciones del parto (p. ej., necesidad de cesárea y hemorragia posparto). La hipertensión aumenta el riesgo fetal de restricción del crecimiento intrauterino y muerte intrauterina. Las mujeres embarazadas con hipertensión deben ser monitoreadas cuidadosamente y tratadas en consecuencia.
Reacciones adversas fetales/neonatales
El oligohidramnios en mujeres embarazadas que usan medicamentos que afectan el sistema renina-angiotensina en el segundo y tercer trimestre del embarazo puede resultar en lo siguiente: función renal fetal reducida que conduce a anuria e insuficiencia renal, hipoplasia pulmonar fetal y deformaciones esqueléticas, incluida hipoplasia del cráneo, hipotensión y muerte. En el caso inusual de que no exista una terapia alternativa adecuada a los medicamentos que afectan el sistema renina-angiotensina para un paciente en particular, informe a la madre del riesgo potencial para el feto.
En pacientes que toman PRINIVIL durante el embarazo, realice ecografías seriadas para evaluar el entorno intraamniótico. Las pruebas fetales pueden ser apropiadas, según la semana de gestación. Si se observa oligohidramnios, suspenda PRINIVIL 10 mg, a menos que se considere que salva la vida de la madre. Sin embargo, los pacientes y los médicos deben ser conscientes de que es posible que el oligohidramnios no aparezca hasta después de que el feto haya sufrido una lesión irreversible.
Observe de cerca a los lactantes con antecedentes de exposición intrauterina a PRINIVIL en busca de hipotensión, oliguria e hiperpotasemia. En recién nacidos con antecedentes de exposición intrauterina a PRINIVIL, si se presenta oliguria o hipotensión, mantener la presión arterial y la perfusión renal. Es posible que se requieran exanguinotransfusiones o diálisis como medio para revertir la hipotensión y/o sustituir la función renal alterada.
Lactancia
Resumen de riesgos
No hay datos disponibles sobre la presencia de lisinopril en la leche humana o los efectos de lisinopril en el lactante o en la producción de leche. Lisinopril está presente en la leche de rata. Debido a que muchos medicamentos se secretan en la leche humana y debido al potencial de reacciones adversas graves en los lactantes amamantados por los inhibidores de la ECA, suspenda la lactancia o suspenda PRINIVIL.
Uso pediátrico
Se han establecido los efectos antihipertensivos y la seguridad de PRINIVIL en pacientes pediátricos de 6 a 16 años [ver DOSIFICACIÓN Y ADMINISTRACIÓN y Estudios clínicos ]. No se identificaron diferencias relevantes entre el perfil de reacciones adversas para pacientes pediátricos y pacientes adultos.
No se ha establecido la seguridad y la eficacia de PRINIVIL en pacientes pediátricos menores de 6 años o en pacientes pediátricos con una tasa de filtración glomerular FARMACOLOGÍA CLÍNICA y Estudios clínicos ].
Uso geriátrico
No es necesario ajustar la dosis con PRINIVIL 2,5 mg en pacientes de edad avanzada. En un estudio clínico de PRINIVIL 10 mg en pacientes con infartos de miocardio (ensayo GISSI-3), 4413 (47 %) tenían 65 años o más, mientras que 1656 (18 %) tenían 75 años o más. En este estudio, el 4,8 % de los pacientes de 75 años o más interrumpieron el tratamiento con PRINIVIL 5 mg debido a una disfunción renal frente al 1,3 % de los pacientes menores de 75 años. No se observaron otras diferencias en seguridad o eficacia entre los pacientes de edad avanzada y los más jóvenes, pero no se puede descartar una mayor sensibilidad de algunas personas de mayor edad.
La raza
Los inhibidores de la ECA, incluido PRINIVIL, tienen un efecto sobre la presión arterial que es menor en los pacientes de raza negra que en los no negros.
Insuficiencia renal
Se requiere ajuste de dosis de PRINIVIL en pacientes sometidos a hemodiálisis o cuyo aclaramiento de creatinina es ≤30 ml/min. No es necesario ajustar la dosis de PRINIVIL 5 mg en pacientes con aclaramiento de creatinina >30 ml/min [ver DOSIFICACIÓN Y ADMINISTRACIÓN y FARMACOLOGÍA CLÍNICA ].
SOBREDOSIS
Después de una dosis oral única de 20 g/kg, no se produjo letalidad en ratas y se produjo la muerte en uno de los 20 ratones que recibieron la misma dosis. La manifestación más probable de sobredosificación sería la hipotensión, para lo cual el tratamiento habitual sería la infusión intravenosa de solución salina normal.
Lisinopril se puede eliminar mediante hemodiálisis [ver ADVERTENCIAS Y PRECAUCIONES ].
CONTRAINDICACIONES
PRINIVIL 10 mg está contraindicado en pacientes con:
- antecedentes de angioedema o hipersensibilidad relacionada con un tratamiento previo con un inhibidor de la enzima convertidora de angiotensina
- angioedema hereditario o idiopático.
No coadministrar aliskiren con PRINIVIL 5 mg en pacientes con diabetes [ver INTERACCIONES CON LA DROGAS ]. PRINIVIL está contraindicado en combinación con un inhibidor de neprilisina (p. ej., sacubitrilo). No administre PRINIVIL 2,5 mg dentro de las 36 horas posteriores al cambio a sacubitrilo/valsartán, un producto que contiene un inhibidor de la neprilisina [ver ADVERTENCIAS Y PRECAUCIONES y INTERACCIONES CON LA DROGAS ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
Lisinopril inhibe la enzima convertidora de angiotensina (ACE) en sujetos humanos y animales. La ECA es una peptidil dipeptidasa que cataliza la conversión de angiotensina I en la sustancia vasoconstrictora angiotensina II. La angiotensina II también estimula la secreción de aldosterona por la corteza suprarrenal. Los efectos beneficiosos del lisinopril en la hipertensión y la insuficiencia cardiaca parecen resultar principalmente de la supresión del sistema renina-angiotensina-aldosterona. La inhibición de la ECA da como resultado una disminución de la angiotensina II en plasma, lo que conduce a una disminución de la actividad vasopresora y a una disminución de la secreción de aldosterona. Esta última disminución puede resultar en un pequeño aumento del potasio sérico. En pacientes hipertensos con función renal normal tratados con PRINIVIL 10 mg solo durante un máximo de 24 semanas, el aumento medio del potasio sérico fue de aproximadamente 0,1 mEq/L; sin embargo, aproximadamente el 15 % de los pacientes tuvo aumentos superiores a 0,5 mEq/L y aproximadamente el 6 % tuvo una disminución superior a 0,5 mEq/L. En el mismo estudio, los pacientes tratados con PRINIVIL 2,5 mg e hidroclorotiazida durante un máximo de 24 semanas tuvieron una disminución media del potasio sérico de 0,1 mEq/L; aproximadamente el 4 % de los pacientes tuvo aumentos superiores a 0,5 mEq/L y aproximadamente el 12 % tuvo una disminución superior a 0,5 mEq/L [ver ADVERTENCIAS Y PRECAUCIONES ]. La eliminación de la retroalimentación negativa de la angiotensina II sobre la secreción de renina conduce a un aumento de la actividad de la renina plasmática.
La ECA es idéntica a la cininasa, una enzima que degrada la bradicinina. Queda por dilucidar si los niveles elevados de bradicinina, un potente péptido vasodepresor, juegan un papel en los efectos terapéuticos de PRINIVIL 5 mg.
Si bien se cree que el mecanismo a través del cual PRINIVIL 2.5 mg reduce la presión arterial es principalmente la supresión del sistema renina-angiotensina-aldosterona, PRINIVIL es antihipertensivo incluso en pacientes con hipertensión con niveles bajos de renina. Aunque PRINIVIL 10 mg fue antihipertensivo en todas las razas estudiadas, los pacientes negros hipertensos (generalmente una población hipertensa con bajo nivel de renina) tuvieron una respuesta promedio más pequeña a la monoterapia que los pacientes no negros.
La administración concomitante de PRINIVIL 5 mg e hidroclorotiazida redujo aún más la presión arterial en pacientes negros y no negros y ya no fue evidente ninguna diferencia racial en la respuesta de la presión arterial.
Farmacodinámica
Hipertensión
Pacientes adultos
La administración de PRINIVIL a pacientes con hipertensión da como resultado una reducción de la presión arterial en decúbito supino y de pie en aproximadamente el mismo grado sin taquicardia compensatoria. La hipotensión postural sintomática generalmente no se observa aunque puede ocurrir y debe anticiparse en pacientes con depleción de volumen y/o sal [ver ADVERTENCIAS Y PRECAUCIONES ]. Cuando se administran junto con diuréticos de tipo tiazídico, los efectos reductores de la presión arterial de los dos fármacos son aproximadamente aditivos.
En la mayoría de los pacientes estudiados, el inicio de la actividad antihipertensiva se observó una hora después de la administración oral de una dosis individual de PRINIVIL, con una reducción máxima de la presión arterial alcanzada a las 6 horas. Aunque se observó un efecto antihipertensivo 24 horas después de la administración de las dosis diarias únicas recomendadas, el efecto fue más constante y el efecto medio fue considerablemente mayor en algunos estudios con dosis de 20 mg o más que con dosis más bajas. Sin embargo, en todas las dosis estudiadas, el efecto antihipertensivo medio fue sustancialmente menor 24 horas después de la dosificación que 6 horas después de la dosificación.
Los efectos antihipertensivos de PRINIVIL se mantienen durante la terapia a largo plazo. La suspensión abrupta de PRINIVIL 10 mg no se ha asociado con un aumento rápido de la presión arterial o un aumento significativo de la presión arterial en comparación con los niveles previos al tratamiento.
Farmacocinética
Pacientes adultos
Después de la administración oral de PRINIVIL, las concentraciones séricas máximas de lisinopril se alcanzan en aproximadamente 7 horas, aunque hubo una tendencia a un pequeño retraso en el tiempo necesario para alcanzar las concentraciones séricas máximas en pacientes con infarto agudo de miocardio. Las concentraciones séricas decrecientes presentan una fase terminal prolongada que no contribuye a la acumulación del fármaco. Esta fase terminal probablemente representa una unión saturable a la ACE y no es proporcional a la dosis. En dosis múltiples, lisinopril exhibe una vida media efectiva de 12 horas.
Lisinopril no parece unirse a otras proteínas séricas. Lisinopril no se metaboliza y se excreta completamente sin cambios en la orina. Según la recuperación urinaria, el grado medio de absorción de lisinopril es de aproximadamente el 25 %, con una gran variabilidad entre sujetos (6-60 %) en todas las dosis probadas (5-80 mg). La absorción de lisinopril no está influenciada por la presencia de alimentos en el tracto gastrointestinal. La biodisponibilidad absoluta de lisinopril se reduce a alrededor del 16 por ciento en pacientes con insuficiencia cardíaca congestiva clase II-IV estable de la NYHA, y el volumen de distribución parece ser ligeramente menor que en sujetos normales.
La biodisponibilidad oral de lisinopril en pacientes con infarto agudo de miocardio es similar a la de voluntarios sanos.
La función renal alterada disminuye la eliminación de lisinopril, que se excreta principalmente a través de los riñones, pero esta disminución se vuelve clínicamente importante solo cuando la tasa de filtración glomerular es inferior a 30 ml/min. Por encima de esta tasa de filtración glomerular, la vida media de eliminación cambia poco. Sin embargo, con un deterioro mayor, aumentan los niveles máximo y mínimo de lisinopril, aumenta el tiempo hasta la concentración máxima y se prolonga el tiempo para alcanzar el estado estacionario. Los pacientes mayores, en promedio, tienen (aproximadamente el doble) niveles sanguíneos más altos y un área bajo la curva de tiempo de concentración plasmática (AUC) que los pacientes más jóvenes [ver DOSIFICACIÓN Y ADMINISTRACIÓN ]. Lisinopril se puede eliminar por hemodiálisis.
Los estudios en ratas indican que lisinopril atraviesa mal la barrera hematoencefálica. Dosis múltiples de lisinopril en ratas no dan como resultado acumulación en ningún tejido. La leche de ratas lactantes contiene radiactividad tras la administración de 14C lisinopril. Mediante autorradiografía de todo el cuerpo, se encontró radioactividad en la placenta después de la administración del fármaco marcado a ratas preñadas, pero no se encontró nada en los fetos.
Pacientes pediátricos
Se estudió la farmacocinética de lisinopril en 29 pacientes hipertensos pediátricos de entre 6 y 16 años con tasa de filtración glomerular >30 ml/min/1,73 m². Después de dosis de 0,1 a 0,2 mg/kg, las concentraciones plasmáticas máximas de lisinopril en el estado estacionario ocurrieron dentro de las 6 horas y el grado de absorción basado en la recuperación urinaria fue de alrededor del 28%. Estos valores son similares a los obtenidos previamente en adultos. El valor típico de aclaramiento oral de lisinopril (aclaramiento sistémico/biodisponibilidad absoluta) en un niño de 30 kg de peso es de 10 l/h, que aumenta en proporción a la función renal.
Estudios clínicos
Hipertensión
Pacientes adultos
Se realizaron dos estudios de dosis-respuesta utilizando un régimen de una vez al día en 438 pacientes con hipertensión leve a moderada que no tomaban un diurético. La presión arterial se midió 24 horas después de la dosificación. Se observó un efecto antihipertensivo de PRINIVIL con 5 mg en algunos pacientes. Sin embargo, en ambos estudios la reducción de la presión arterial se produjo antes y fue mayor en los pacientes tratados con 10, 20 u 80 mg de PRINIVIL. En estudios clínicos controlados en pacientes con hipertensión leve a moderada, PRINIVIL 20-80 mg se comparó con hidroclorotiazida 12,5-50 mg y con atenolol 50-500 mg, y en pacientes con hipertensión moderada a grave con metoprolol 100-200 mg. Fue superior a la hidroclorotiazida en los efectos sobre la presión arterial sistólica y diastólica en una población que era 75% caucásica. PRINIVIL 10 mg fue aproximadamente equivalente a atenolol y metoprolol en cuanto a los efectos sobre la presión arterial diastólica y tuvo efectos algo mayores sobre la presión arterial sistólica.
PRINIVIL tuvo una eficacia y efectos adversos similares en pacientes más jóvenes y mayores (>65 años). Fue menos eficaz en los negros que en los caucásicos.
En estudios hemodinámicos de PRINIVIL 5 mg en pacientes con hipertensión esencial, la reducción de la presión arterial se acompañó de una reducción de la resistencia arterial periférica con poco o ningún cambio en el gasto cardíaco y la frecuencia cardíaca. En un estudio en nueve pacientes hipertensos, luego de la administración de PRINIVIL 5 mg, hubo un aumento en el flujo sanguíneo renal medio que no fue significativo. Los datos de varios estudios pequeños son inconsistentes con respecto al efecto de lisinopril sobre la tasa de filtración glomerular en pacientes hipertensos con función renal normal, pero sugieren que los cambios, si los hay, no son grandes.
En pacientes con hipertensión renovascular, PRINIVIL ha demostrado ser bien tolerado y eficaz para reducir la presión arterial [ver ADVERTENCIAS Y PRECAUCIONES ].
Pacientes pediátricos
En un estudio clínico en el que participaron 115 pacientes pediátricos hipertensos de 6 a 16 años de edad, los pacientes que pesaban 1,25 mg (0,02 mg/kg). Este efecto se confirmó en una fase de retirada, en la que la presión diastólica aumentó aproximadamente 9 mmHg más en los pacientes aleatorizados a placebo que en los pacientes aleatorizados para permanecer con las dosis media y alta de lisinopril. El efecto antihipertensivo dependiente de la dosis de lisinopril fue constante en varios subgrupos demográficos: edad, estadio de Tanner, sexo y raza. En este estudio, lisinopril fue generalmente bien tolerado.
En los estudios pediátricos anteriores, lisinopril se administró en tabletas o en suspensión para aquellos niños y bebés que no podían tragar las tabletas o que requerían una dosis más baja que la disponible en forma de tabletas [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Insuficiencia cardiaca
En dos estudios clínicos de 12 semanas, controlados con placebo, se comparó la adición de PRINIVIL 2,5 mg hasta 20 mg al día con digitálicos y diuréticos solos. La combinación de PRINIVIL, digitálicos y diuréticos redujo los siguientes signos y síntomas de insuficiencia cardiaca: edema, estertores, disnea paroxística nocturna y distensión venosa yugular. En uno de los estudios, la combinación de PRINIVIL 2,5 mg, digitálicos y diuréticos redujo la ortopnea, la presencia de tercer ruido cardíaco y el número de pacientes clasificados como clase III y IV de la NYHA, y mejoró la tolerancia al ejercicio. Un gran estudio de supervivencia (más de 3000 pacientes), el ensayo ATLAS, que comparó 2,5 y 35 mg de lisinopril en pacientes con insuficiencia cardíaca sistólica, mostró que la dosis más alta de lisinopril tuvo resultados al menos tan favorables como la dosis más baja. Durante los ensayos clínicos controlados de referencia, en pacientes que recibieron digital y diuréticos, dosis únicas de PRINIVIL 5 mg dieron como resultado disminuciones en la presión de enclavamiento de los capilares pulmonares, la resistencia vascular sistémica y la presión arterial, acompañadas de un aumento del gasto cardíaco y ningún cambio en la frecuencia cardíaca.
Infarto agudo del miocardio
El estudio Gruppo Italiano per lo Studio della Sopravvienza nell'Infarto Miocardico (GISSI-3) fue un ensayo clínico multicéntrico, controlado, aleatorizado y no ciego realizado en 19 394 pacientes con infarto agudo de miocardio (IM) ingresados en una unidad de cuidados coronarios. Fue diseñado para examinar los efectos del tratamiento a corto plazo (6 semanas) con lisinopril, nitratos, su combinación o ningún tratamiento sobre la mortalidad a corto plazo (6 semanas) y sobre la muerte a largo plazo y una función cardíaca marcadamente alterada. Los pacientes hemodinámicamente estables que se presentaron dentro de las 24 horas posteriores al inicio de los síntomas fueron aleatorizados, en un diseño factorial 2 x 2, a 6 semanas de 1) PRINIVIL solo (n=4841), 2) nitratos solos (n=4869), 3 ) PRINIVIL 2,5 mg más nitratos (n=4841), o 4) control abierto (n=4843). Todos los pacientes recibieron terapias de rutina, incluidos trombolíticos (72 %), aspirina (84 %) y un betabloqueante (31 %), según correspondiera, normalmente utilizados en pacientes con infarto agudo de miocardio (IM).
El protocolo excluyó a los pacientes con hipotensión (presión arterial sistólica ≤ 100 mmHg), insuficiencia cardiaca grave, shock cardiogénico y disfunción renal (creatinina sérica > 2 mg/dl y/o proteinuria > 500 mg por 24 h). Los pacientes asignados al azar a PRINIVIL 5 mg recibieron 5 mg dentro de las 24 horas posteriores al inicio de los síntomas, 5 mg después de 24 horas y luego 10 mg diarios a partir de entonces. Los pacientes con presión arterial sistólica inferior a 120 mmHg al inicio del estudio recibieron 2,5 mg de PRINIVIL. Si ocurría hipotensión, se reducía la dosis de PRINIVIL 10 mg o si ocurría hipotensión grave, se interrumpía PRINIVIL [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
Los resultados primarios del ensayo fueron la mortalidad general a las 6 semanas y un criterio de valoración combinado a los 6 meses después del infarto de miocardio, consistente en el número de pacientes que fallecieron, tuvieron insuficiencia cardíaca congestiva clínica tardía (día 4) o tuvieron enfermedad ventricular izquierda extensa. daño definido como fracción de eyección ≤35%, o una puntuación acinética-disquinética [AD] ≥45%. Los pacientes que recibieron PRINIVIL (n=9646), solo o con nitratos, tuvieron un 11 % menos de riesgo de muerte (p =0,04) en comparación con los pacientes que no recibieron PRINIVIL (n=9672) (6,4 % frente a 7,2 %, respectivamente) a las 6 semanas. Aunque a los pacientes aleatorizados para recibir PRINIVIL durante un máximo de 6 semanas también les fue numéricamente mejor en el criterio de valoración combinado a los 6 meses, la naturaleza abierta de la evaluación de la insuficiencia cardíaca, la pérdida sustancial durante la ecocardiografía de seguimiento y el uso excesivo sustancial de PRINIVIL 10 mg, entre 6 semanas y 6 meses en el grupo aleatorizado a 6 semanas de lisinopril, excluye cualquier conclusión sobre este criterio de valoración.
Los pacientes con infarto agudo de miocardio, tratados con PRINIVIL 10 mg, tuvieron una mayor incidencia (9,0 % frente a 3,7 %) de hipotensión persistente (presión arterial sistólica REACCIONES ADVERSAS ].
INFORMACIÓN DEL PACIENTE
NOTA: Esta información está destinada a ayudar en el uso seguro y eficaz de este medicamento. No es una divulgación de todos los posibles efectos adversos o previstos.
El embarazo
Informe a las pacientes en edad fértil sobre las consecuencias de la exposición a PRINIVIL 10 mg durante el embarazo. Analice las opciones de tratamiento con las mujeres que planean quedar embarazadas. Dígales a los pacientes que informen los embarazos a sus médicos lo antes posible.
angioedema
El angioedema, incluido el edema laríngeo, puede ocurrir en cualquier momento durante el tratamiento con inhibidores de la enzima convertidora de angiotensina, incluido PRINIVIL. Indique a los pacientes que notifiquen de inmediato cualquier signo o síntoma que sugiera angioedema (hinchazón de la cara, extremidades, ojos, labios, lengua, dificultad para tragar o respirar) y que no tomen más medicamento hasta que hayan consultado con el médico prescriptor.
Hipotensión sintomática
Indique a los pacientes que notifiquen mareos, especialmente durante los primeros días de tratamiento. Si ocurre un síncope real, dígale al paciente que suspenda el medicamento hasta que haya consultado con el médico que lo recetó.
Informe a los pacientes que la transpiración excesiva y la deshidratación pueden provocar una caída excesiva de la presión arterial debido a la reducción del volumen de líquidos. Otras causas de depleción de volumen, como vómitos o diarrea, también pueden provocar una caída de la presión arterial; aconsejar a los pacientes en consecuencia.
hiperpotasemia
Dígales a los pacientes que no usen sustitutos de la sal que contengan potasio sin consultar a su médico.
Hipoglucemia
Indique a los pacientes diabéticos tratados con agentes antidiabéticos orales o insulina que comienzan con un inhibidor de la ECA que controlen de cerca la hipoglucemia, especialmente durante el primer mes de uso combinado [ver INTERACCIONES CON LA DROGAS ].
Leucopenia/Neutropenia
Indique a los pacientes que notifiquen de inmediato cualquier indicación de infección (p. ej., dolor de garganta, fiebre), que puede ser un signo de leucopenia/neutropenia.
