Minipress 1mg, 2mg Prazosin Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Minipress y cómo se usa?
Minipress (clorhidrato de prazosina) es un bloqueador alfa-adrenérgico que se usa para tratar la hipertensión (presión arterial alta).
¿Cuáles son los efectos secundarios de Minipress 2mg?
Los efectos secundarios comunes de Minipress 1 mg incluyen:
- dolor de cabeza,
- somnolencia,
- cansancio,
- debilidad,
- visión borrosa,
- náuseas,
- vómitos,
- diarrea, o
- estreñimiento a medida que su cuerpo se adapta a la medicación
Otros efectos secundarios de Minipress 2mg incluyen:
- aturdimiento o mareos al ponerse de pie, especialmente después de la primera dosis y poco después de tomar una dosis del medicamento durante la primera semana de tratamiento.
Informe a su médico si experimenta efectos secundarios graves de Minipress 1 mg, incluidos latidos cardíacos rápidos o fuertes o aleteo en el pecho, sensación de desmayo, dificultad para respirar, hinchazón en las manos o los pies, o una erección que es dolorosa o dura 4 horas o más largo.
DESCRIPCIÓN
MINIPRESS® (clorhidrato de prazosina), un derivado de la quinazolina, es el primero de una nueva clase química de antihipertensivos. Es la sal clorhidrato de 1-(4-amino-6,7-dimetoxi-2-quinazolinil)-4-(2-furoil) piperazina y su fórmula estructural es:
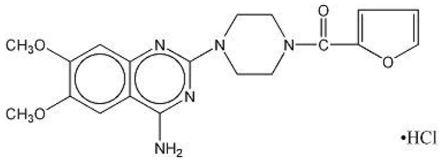
Fórmula molecular C19H21N5O4•HCl
Es una sustancia blanca, cristalina, ligeramente soluble en agua y solución salina isotónica, y tiene un peso molecular de 419,87. Cada cápsula de 1 mg de MINIPRESS para uso oral contiene el fármaco equivalente a 1 mg de base libre.
Los ingredientes inertes en las formulaciones son: cápsulas de gelatina dura (que pueden contener Azul 1, Rojo 3, Rojo 28, Rojo 40 y otros ingredientes inertes); estearato de magnesio; Lauril Sulfato de Sodio; almidón; sacarosa
INDICACIONES
MINIPRESS 1mg está indicado para el tratamiento de la hipertensión, para bajar la presión arterial. La reducción de la presión arterial reduce el riesgo de eventos cardiovasculares fatales y no fatales, principalmente accidentes cerebrovasculares e infartos de miocardio. Estos beneficios se han observado en ensayos controlados de fármacos antihipertensivos de una amplia variedad de clases farmacológicas, incluido este fármaco.
El control de la presión arterial alta debe ser parte del manejo integral del riesgo cardiovascular, incluido, según corresponda, el control de los lípidos, el manejo de la diabetes, la terapia antitrombótica, el abandono del hábito de fumar, el ejercicio y la ingesta limitada de sodio. Muchos pacientes requerirán más de un fármaco para lograr los objetivos de presión arterial. Para obtener consejos específicos sobre objetivos y manejo, consulte las pautas publicadas, como las del Comité Nacional Conjunto sobre Prevención, Detección, Evaluación y Tratamiento de la Presión Arterial Alta (JNC) del Programa Nacional de Educación sobre la Presión Arterial Alta.
Numerosos fármacos antihipertensivos, de una variedad de clases farmacológicas y con diferentes mecanismos de acción, han demostrado en ensayos controlados aleatorios que reducen la morbilidad y mortalidad cardiovascular, y se puede concluir que es la reducción de la presión arterial, y no alguna otra propiedad farmacológica de las drogas, que es en gran parte responsable de esos beneficios. El beneficio de resultado cardiovascular más grande y consistente ha sido una reducción en el riesgo de accidente cerebrovascular, pero también se han observado regularmente reducciones en el infarto de miocardio y la mortalidad cardiovascular.
La presión sistólica o diastólica elevada provoca un aumento del riesgo cardiovascular, y el aumento del riesgo absoluto por mmHg es mayor con presiones arteriales más altas, de modo que incluso reducciones modestas de la hipertensión grave pueden proporcionar un beneficio sustancial. La reducción del riesgo relativo de la reducción de la presión arterial es similar en poblaciones con riesgo absoluto variable, por lo que el beneficio absoluto es mayor en pacientes que tienen un riesgo más alto independientemente de su hipertensión (por ejemplo, pacientes con diabetes o hiperlipidemia), y se esperaría que tales pacientes beneficiarse de un tratamiento más agresivo para lograr un objetivo de presión arterial más bajo.
Algunos medicamentos antihipertensivos tienen efectos menores sobre la presión arterial (como monoterapia) en pacientes de raza negra, y muchos medicamentos antihipertensivos tienen indicaciones y efectos adicionales aprobados (p. ej., angina, insuficiencia cardíaca o nefropatía diabética). Estas consideraciones pueden guiar la selección de la terapia.
MINIPRESS se puede utilizar solo o en combinación con otros fármacos antihipertensivos como diuréticos o bloqueadores beta-adrenérgicos.
DOSIFICACIÓN Y ADMINISTRACIÓN
La dosis de MINIPRESS 1 mg debe ajustarse de acuerdo con la respuesta individual de la presión arterial del paciente. La siguiente es una guía para su administración:
Dosis inicial
1 mg dos o tres veces al día (ver ADVERTENCIAS .)
Dosis de mantenimiento
La dosis puede aumentarse lentamente hasta una dosis diaria total de 20 mg administrada en dosis divididas. Las dosis terapéuticas empleadas más comúnmente han oscilado entre 6 mg y 15 mg diarios administrados en dosis divididas. Las dosis superiores a 20 mg generalmente no aumentan la eficacia, sin embargo, algunos pacientes pueden beneficiarse de aumentos adicionales hasta una dosis diaria de 40 mg administrada en dosis divididas. Después de la titulación inicial, algunos pacientes pueden mantenerse adecuadamente con un régimen de dosificación de dos veces al día.
Uso con otras drogas
Cuando se añada un diurético u otro agente antihipertensivo, la dosis de MINIPRESS 1 mg debe reducirse a 1 mg o 2 mg tres veces al día y luego volver a realizar la titulación.
La administración concomitante de MINIPRESS 1 mg con un inhibidor de la PDE-5 puede provocar efectos reductores de la presión arterial aditivos e hipotensión sintomática; por lo tanto, la terapia con inhibidores de la PDE-5 debe iniciarse con la dosis más baja en pacientes que toman MINIPRESS.
CÓMO SUMINISTRADO
Distribuido por: Pfizer Labs, División de Pfizer Inc., NY, NY 10017. Revisado: febrero de 2015
EFECTOS SECUNDARIOS
Se realizaron ensayos clínicos en más de 900 pacientes. Durante estos ensayos y la experiencia de comercialización posterior, las reacciones más frecuentes asociadas con la terapia MINIPRESS son: mareos 10,3 %, dolor de cabeza 7,8 %, somnolencia 7,6 %, falta de energía 6,9 %, debilidad 6,5 %, palpitaciones 5,3 % y náuseas 4,9 %. En la mayoría de los casos, los efectos secundarios desaparecieron con la terapia continua o se toleraron sin disminuir la dosis del fármaco.
Las reacciones adversas menos frecuentes que se informa que ocurren en 1-4% de los pacientes son:
Gastrointestinal: vómitos, diarrea, estreñimiento.
Cardiovascular: edema, hipotensión ortostática, disnea, síncope.
Sistema nervioso central: vértigo, depresión, nerviosismo.
Dermatológico: sarpullido.
Genitourinario: frecuencia urinaria.
EVENTO: visión borrosa, esclerótica enrojecida, epistaxis, boca seca, congestión nasal.
Además, menos del 1% de los pacientes informaron lo siguiente (en algunos casos, no se han establecido relaciones causales exactas):
Gastrointestinal: malestar y/o dolor abdominal, anomalías de la función hepática, pancreatitis.
Cardiovascular: taquicardia.
Sistema nervioso central: parestesias, alucinaciones.
Dermatológico: prurito, alopecia, liquen plano.
Genitourinario: incontinencia, impotencia, priapismo.
EVENTO: tinnitus.
Otro: diaforesis, fiebre, título positivo de ANA, artralgia.
Se han informado informes únicos de moteado pigmentario y retinopatía serosa, y algunos informes de desarrollo o desaparición de cataratas. En estos casos, no se ha establecido la relación causal exacta porque las observaciones de línea de base con frecuencia eran inadecuadas.
En estudios más específicos con lámpara de hendidura y funduscópicos, que incluyeron exámenes de referencia adecuados, no se informaron hallazgos oftalmológicos anormales relacionados con el fármaco.
Existen informes en la literatura que asocian la terapia con MINIPRESS 1 mg con un empeoramiento de la narcolepsia preexistente. Una relación causal es incierta en estos casos.
En la experiencia posterior a la comercialización, se han informado los siguientes eventos adversos:
Sistema nervioso autónomo: enrojecimiento
Cuerpo como un todo: reacción alérgica, astenia, malestar general, dolor.
Cardiovasculares, Generales: angina de pecho, hipotensión.
Endocrino: ginecomastia.
Ritmo/frecuencia cardíaca: bradicardia.
Psiquiátrico: insomnio.
Piel/Anexos: urticaria.
Vascular (Extracardíaca): vasculitis
Visión: dolor de ojo.
Sentidos especiales: Durante la cirugía de cataratas, se ha notificado una variante del síndrome de la pupila pequeña conocida como síndrome del iris fláccido intraoperatorio (IFIS) en asociación con la terapia con bloqueadores alfa-1 (ver PRECAUCIONES ).
INTERACCIONES CON LA DROGAS
MINIPRESS 2 mg se ha administrado sin ninguna interacción farmacológica adversa en la experiencia clínica limitada hasta la fecha con los siguientes: (1) glucósidos cardíacos, digitálicos y digoxina; (2) hipoglucemiantes: insulina, clorpropamida, fenformina, tolazamida y tolbutamida; (3) tranquilizantes y sedantes: clordiazepóxido, diazepam y fenobarbital; (4) antigota-alopurinol, colchicina y probenecid; (5) antiarrítmicos: procainamida, propranolol (ver ADVERTENCIAS sin embargo) y quinidina; y (6) analgésicos, antipiréticos y antiinflamatorios: propoxifeno, aspirina, indometacina y fenilbutazona.
Se ha demostrado que la adición de un diurético u otro agente antihipertensivo a MINIPRESS 2 mg causa un efecto hipotensor aditivo. Este efecto se puede minimizar reduciendo la dosis de MINIPRESS de 1 a 2 mg tres veces al día, introduciendo con precaución medicamentos antihipertensivos adicionales y luego volviendo a titular MINIPRESS en función de la respuesta clínica. La administración concomitante de MINIPRESS con un inhibidor de la fosfodiesterasa-5 (PDE-5) puede resultar en efectos reductores de la presión arterial aditivos e hipotensión sintomática (ver DOSIFICACIÓN Y ADMINISTRACIÓN ).
Interacciones entre medicamentos y pruebas de laboratorio
En un estudio en cinco pacientes que recibieron de 12 a 24 mg de prazosin por día durante 10 a 14 días, hubo un aumento promedio del 42 % en el metabolito urinario de la norepinefrina y un aumento promedio en el VMA urinario del 17 %. Por lo tanto, pueden ocurrir resultados falsos positivos en las pruebas de detección de feocromocitoma en pacientes que están siendo tratados con prazosin. Si se encuentra un VMA elevado, se debe suspender la prazosina y se debe volver a realizar la prueba al paciente después de un mes.
Pruebas de laboratorio
En los estudios clínicos en los que se siguieron los perfiles de lípidos, generalmente no se observaron cambios adversos entre los niveles de lípidos antes y después del tratamiento.
ADVERTENCIAS
Al igual que con todos los bloqueadores alfa, MINIPRESS puede causar síncope con pérdida repentina del conocimiento. En la mayoría de los casos, se cree que esto se debe a un efecto hipotensor postural excesivo, aunque ocasionalmente el sincopalepisodio ha sido precedido por un ataque de taquicardia severa con frecuencias cardíacas de 120 a 160 latidos por minuto. Los sincopalepisodes generalmente han ocurrido dentro de los 30 a 90 minutos posteriores a la dosis inicial del fármaco; ocasionalmente, se han informado en asociación con aumentos rápidos de la dosis o la introducción de otro fármaco antihipertensivo en el régimen de un paciente que toma dosis altas de MINIPRESS. La incidencia de sincopalepisodios es de aproximadamente el 1% en pacientes que reciben una dosis inicial de 2 mg o más. Los ensayos clínicos realizados durante la fase de investigación de este fármaco sugieren que los episodios de síncope se pueden minimizar limitando la dosis inicial del fármaco a 1 mg, aumentando posteriormente la dosis lentamente e introduciendo cualquier fármaco antihipertensivo adicional en el régimen del paciente. con precaución (ver DOSIS Y ADMINISTRACIÓN). Se puede desarrollar hipotensión en pacientes que reciben MINIPRESS y que también reciben un betabloqueante como propranolol.
Si se produce un síncope, se debe colocar al paciente en posición de decúbito y recibir tratamiento de apoyo según sea necesario. Este efecto adverso es autolimitado y en la mayoría de los casos no reaparece después del período inicial de tratamiento o durante la titulación de la dosis posterior.
Los pacientes siempre deben comenzar con las cápsulas de 1 mg de MINIPRESS. Las cápsulas de 2 y 5 mg no están indicadas para la terapia inicial.
Más comunes que la pérdida de conciencia son los síntomas que a menudo se asocian con la disminución de la presión arterial, a saber, mareos y aturdimiento. Se debe advertir al paciente acerca de estos posibles efectos adversos y aconsejarle qué medidas tomar en caso de que se presenten. También se debe advertir al paciente que evite situaciones en las que se puedan producir lesiones en caso de que se produzca un síncope durante el inicio del tratamiento con MINIPRESS 2 mg.
priapismo
Se han informado erecciones prolongadas y priapismo con bloqueadores alfa-1, incluida la prazosina, en la experiencia posterior a la comercialización. En caso de una erección que persista más de 4 horas, busque asistencia médica inmediata. Si el priapismo no se trata de inmediato, se pueden producir daños en el tejido del pene y pérdida permanente de la potencia.
PRECAUCIONES
General
Se ha observado el síndrome del iris flácido intraoperatorio (IFIS) durante la cirugía de cataratas en algunos pacientes tratados con bloqueadores alfa-1. Esta variante del síndrome de la pupila pequeña se caracteriza por la combinación de un iris flácido que se hincha en respuesta a las corrientes de irrigación intraoperatorias, miosis intraoperatoria progresiva a pesar de la dilatación preoperatoria con midriáticos estándar y posible prolapso del iris hacia las incisiones de facoemulsificación. El oftalmólogo del paciente debe estar preparado para posibles modificaciones en la técnica quirúrgica, como la utilización de ganchos de iris, anillos dilatadores de iris o sustancias viscoelásticas. No parece haber ningún beneficio en suspender la terapia con bloqueadores alfa-1 antes de la cirugía de cataratas.
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
No se demostró potencial carcinogénico en un estudio de 18 meses en ratas con MINIPRESS 1 mg a niveles de dosis más de 225 veces la dosis máxima recomendada en humanos de 20 mg por día. MINIPRESS 2mg no fue mutagénico en estudios de toxicología genética in vivo. En un estudio de fertilidad y rendimiento reproductivo general en ratas, tanto machos como hembras, tratadas con 75 mg/kg (225 veces la dosis máxima recomendada en humanos), se demostró una disminución de la fertilidad, mientras que las tratadas con 25 mg/kg (75 veces la dosis habitual dosis humana máxima recomendada) no lo hizo.
En estudios crónicos (un año o más) de MINIPRESS en ratas y perros, se produjeron cambios testiculares consistentes en atrofia y necrosis a 25 mg/kg/día (75 veces la dosis máxima recomendada en humanos). No se observaron cambios testiculares en ratas o perros con 10 mg/kg/día (30 veces la dosis máxima recomendada en humanos). En vista de los cambios testiculares observados en animales, se controló la excreción de 17 cetosteroides en 105 pacientes que recibieron tratamiento MINIPRESS a largo plazo y no se observaron cambios que indicaran un efecto del fármaco. Además, 27 hombres que recibieron MINIPRESS 1 mg durante un máximo de 51 meses no tuvieron cambios en la morfología del esperma que sugirieran el efecto del fármaco.
Uso en el embarazo
Embarazo Categoría C. Se ha demostrado que MINIPRESS 1 mg está asociado con una disminución del tamaño de la camada al nacer, 1, 4 y 21 días de edad en ratas cuando se les administran dosis de más de 225 veces la dosis máxima recomendada en humanos. No se observaron evidencias de anomalías fetales externas, viscerales o esqueléticas relacionadas con el fármaco. No se observaron anomalías externas, viscerales o esqueléticas relacionadas con el fármaco en fetos de conejas preñadas y monas preñadas a dosis de más de 225 veces y 12 veces la dosis máxima recomendada en humanos, respectivamente.
El uso de prazosina y un betabloqueante para el control de la hipertensión grave en 44 mujeres embarazadas no reveló anomalías fetales ni efectos adversos relacionados con el fármaco. La terapia con prazosin se continuó durante 14 semanas.1
Prazosin también se ha utilizado solo o en combinación con otros agentes hipotensores en la hipertensión severa del embarazo por otros investigadores. No se han reportado anomalías fetales o neonatales con el uso de prazosin.2
No existen estudios adecuados y bien controlados que establezcan la seguridad de MINIPRESS en mujeres embarazadas. MINIPRESS debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para la madre y el feto.
Madres lactantes
Se ha demostrado que MINIPRESS 1 mg se excreta en pequeñas cantidades en la leche humana. Se debe tener precaución cuando se administra MINIPRESS 2 mg a una mujer lactante.
Uso en niños
No se ha establecido la seguridad y eficacia en niños.
REFERENCIAS
1. Lubbe, WF y Hodge, JV: New Zealand Med J, 94 (691) 169-172, 1981.
2. Davey, DA y Dommisse, J: SA Med J, 4 de octubre de 1980 (551-556).
SOBREDOSIS
La ingestión accidental de al menos 50 mg de MINIPRESS en un niño de dos años provocó una profunda somnolencia y depresión de los reflejos. No se observó disminución de la presión arterial. La recuperación transcurrió sin incidentes.
Si la sobredosis conduce a hipotensión, el apoyo del sistema cardiovascular es de primera importancia. La restauración de la presión arterial y la normalización de la frecuencia cardíaca pueden lograrse manteniendo al paciente en posición supina. Si esta medida es inadecuada, el choque debe tratarse primero con expansores de volumen. Si es necesario, entonces se deben usar vasopresores. La función renal debe ser monitoreada y apoyada según sea necesario. Los datos de laboratorio indican que MINIPRESS no es dializable porque se une a proteínas.
CONTRAINDICACIONES
MINIPRESS está contraindicado en pacientes con sensibilidad conocida a las quinazolinas, la prazosina o cualquiera de los ingredientes inertes.
FARMACOLOGÍA CLÍNICA
Se desconoce el mecanismo exacto de la acción hipotensora de la prazosina. Prazosin causa una disminución en la resistencia periférica total y originalmente se pensó que tenía una acción relajante directa sobre el músculo liso vascular. Sin embargo, estudios recientes en animales han sugerido que el efecto vasodilatador de la prazosina también está relacionado con el bloqueo de los adrenoceptores alfa postsinápticos. Los resultados de los experimentos con las extremidades anteriores de los perros demuestran que el efecto vasodilatador periférico de la prazosina se limita principalmente al nivel de los vasos de resistencia (arteriolas). A diferencia de los bloqueadores alfa convencionales, la acción antihipertensiva de la prazosina no suele ir acompañada de una taquicardia refleja. No se ha observado que se desarrolle tolerancia en la terapia a largo plazo.
Se han llevado a cabo estudios hemodinámicos en humanos después de la administración de una dosis única aguda y durante el curso de la terapia de mantenimiento a largo plazo. Los resultados confirman que el efecto terapéutico es una caída de la presión arterial no acompañada de un cambio clínicamente significativo en el gasto cardíaco, la frecuencia cardíaca, el flujo sanguíneo renal y la tasa de filtración glomerular. No hay efecto cronotrópico negativo medible.
En los estudios clínicos realizados hasta la fecha, el clorhidrato de prazosina no ha aumentado la actividad de la renina plasmática.
En el hombre, la presión arterial se reduce tanto en posición supina como de pie. Este efecto es más pronunciado en la presión arterial diastólica.
Después de la administración oral, las concentraciones plasmáticas humanas alcanzan un pico alrededor de las tres horas con una vida media plasmática de dos a tres horas. El fármaco se une en gran medida a las proteínas plasmáticas. Los estudios de biodisponibilidad han demostrado que la absorción total relativa al fármaco en una solución alcohólica al 20 % es del 90 %, lo que da como resultado niveles máximos de aproximadamente el 65 % de los del fármaco en solución. Los estudios en animales indican que el clorhidrato de prazosina se metaboliza ampliamente, principalmente por desmetilación y conjugación, y se excreta principalmente a través de la bilis y las heces. Estudios humanos menos extensos sugieren un metabolismo y una excreción similares en el hombre.
En los estudios clínicos en los que se siguieron los perfiles de lípidos, generalmente no se observaron cambios adversos entre los niveles de lípidos antes y después del tratamiento.
INFORMACIÓN DEL PACIENTE
Se pueden producir mareos o somnolencia después de la primera dosis de este medicamento. Evite conducir o realizar tareas peligrosas durante las primeras 24 horas después de tomar este medicamento o cuando se aumente la dosis. Puede causar mareos, aturdimiento o desmayo, especialmente al levantarse de una posición acostada o sentada. Levantarse lentamente puede ayudar a disminuir el problema. Estos efectos también pueden ocurrir si bebe alcohol, permanece de pie durante largos períodos de tiempo, hace ejercicio o si hace calor. Mientras toma MINIPRESS, tenga cuidado con la cantidad de alcohol que bebe. Además, tenga especial cuidado durante el ejercicio o el clima cálido, o si está de pie por períodos prolongados. Consulte con su médico si tiene alguna pregunta.
