Benicar 10mg, 20mg, 40mg Olmesartan Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Benicar 40mg y cómo se usa?
Benicar es un medicamento recetado que se usa para tratar los síntomas de la presión arterial alta (hipertensión). Benicar 10 mg se puede usar solo o con otros medicamentos.
Benicar es un bloqueador del receptor de angiotensina II o ARB.
No se sabe si Benicar es seguro y efectivo en niños menores de 6 años.
¿Cuáles son los posibles efectos secundarios de Benicar 40mg?
Benicar puede causar efectos secundarios graves que incluyen:
- aturdimiento
- orinar poco o nada
- hinchazón en las manos o los pies
- náuseas
- debilidad
- sensación de hormigueo
- Dolor de pecho
- latidos del corazón rápidos o irregulares
- pérdida de movimiento
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Benicar incluyen:
- mareo
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Benicar. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
ADVERTENCIA
TOXICIDAD FETAL
- Cuando se detecte un embarazo, suspenda Benicar 40 mg lo antes posible [ver ADVERTENCIAS Y PRECAUCIONES]
- Los medicamentos que actúan directamente sobre el sistema renina-angiotens pueden causar lesiones y la muerte del feto en desarrollo [ver ADVERTENCIAS Y PRECAUCIONES]
DESCRIPCIÓN
Olmesartán medoxomilo, un profármaco, se hidroliza a olmesartán durante la absorción en el tracto gastrointestinal. Olmesartán es un antagonista selectivo del receptor de angiotensina II del subtipo AT1.
Olmesartán medoxomilo se describe químicamente como 2,3-dihidroxi-2-butenil 4-(1 hidroxi-1-metiletil)-2-propil-1-[p-(o-1H-tetrazol-5-ilfenil)bencil]imidazol- 5 carboxilato, 2,3-carbonato cíclico.
Su fórmula empírica es C29H30N6O6 y su fórmula estructural es:
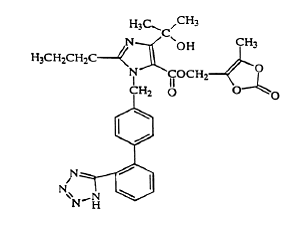
Olmesartán medoxomilo es un polvo de color blanco a blanco amarillento claro o un polvo cristalino con un peso molecular de 558,59. Es prácticamente insoluble en agua y escasamente soluble en metanol. Benicar 20 mg está disponible para uso oral como comprimidos recubiertos con película que contienen 5 mg, 20 mg o 40 mg de olmesartán medoxomilo y los siguientes ingredientes inactivos: hidroxipropilcelulosa, hipromelosa, lactosa monohidrato, hidroxipropilcelulosa de baja sustitución, estearato de magnesio, celulosa microcristalina , talco, dióxido de titanio y (solo 5 mg) óxido de hierro amarillo.
INDICACIONES
Benicar 40mg está indicado para el tratamiento de la hipertensión en adultos y niños mayores de seis años, para disminuir la presión arterial. La reducción de la presión arterial reduce el riesgo de eventos cardiovasculares fatales y no fatales, principalmente accidentes cerebrovasculares e infartos de miocardio. Estos beneficios se han observado en ensayos controlados de fármacos antihipertensivos de una amplia variedad de clases farmacológicas, incluida la clase a la que pertenece principalmente este fármaco. No existen ensayos controlados que demuestren la reducción del riesgo con Benicar.
El control de la presión arterial alta debe ser parte del manejo integral del riesgo cardiovascular, incluido, según corresponda, el control de los lípidos, el manejo de la diabetes, la terapia antitrombótica, el abandono del hábito de fumar, el ejercicio y la ingesta limitada de sodio. Muchos pacientes requerirán más de un fármaco para lograr los objetivos de presión arterial. Para obtener consejos específicos sobre objetivos y manejo, consulte las pautas publicadas, como las del Comité Nacional Conjunto sobre Prevención, Detección, Evaluación y Tratamiento de la Presión Arterial Alta (JNC) del Programa Nacional de Educación sobre la Presión Arterial Alta.
Numerosos fármacos antihipertensivos, de una variedad de clases farmacológicas y con diferentes mecanismos de acción, han demostrado en ensayos controlados aleatorios que reducen la morbilidad y mortalidad cardiovascular, y se puede concluir que es la reducción de la presión arterial, y no alguna otra propiedad farmacológica de las drogas, que es en gran parte responsable de esos beneficios. El beneficio de resultado cardiovascular más grande y consistente ha sido una reducción en el riesgo de accidente cerebrovascular, pero también se han observado regularmente reducciones en el infarto de miocardio y la mortalidad cardiovascular.
La presión sistólica o diastólica elevada provoca un aumento del riesgo cardiovascular, y el aumento del riesgo absoluto por mmHg es mayor con presiones arteriales más altas, de modo que incluso reducciones modestas de la hipertensión grave pueden proporcionar un beneficio sustancial. La reducción del riesgo relativo de la reducción de la presión arterial es similar en poblaciones con riesgo absoluto variable, por lo que el beneficio absoluto es mayor en pacientes que tienen un riesgo más alto independientemente de su hipertensión (por ejemplo, pacientes con diabetes o hiperlipidemia), y se esperaría que tales pacientes beneficiarse de un tratamiento más agresivo para lograr un objetivo de presión arterial más bajo.
Algunos medicamentos antihipertensivos tienen efectos menores sobre la presión arterial (como monoterapia) en pacientes de raza negra, y muchos medicamentos antihipertensivos tienen indicaciones y efectos adicionales aprobados (p. ej., angina, insuficiencia cardíaca o nefropatía diabética). Estas consideraciones pueden guiar la selección de la terapia.
Puede usarse solo o en combinación con otros agentes antihipertensivos.
DOSIFICACIÓN Y ADMINISTRACIÓN
Hipertensión en adultos
La dosis debe ser individualizada. La dosis inicial recomendada habitual de Benicar 20 mg es de 20 mg una vez al día cuando se utiliza como monoterapia en pacientes que no tienen volumen reducido. Para los pacientes que requieran una mayor reducción de la presión arterial después de 2 semanas de tratamiento, la dosis de Benicar puede aumentarse a 40 mg. Dosis superiores a 40 mg no parecen tener mayor efecto. La dosificación dos veces al día no ofrece ninguna ventaja sobre la misma dosis total administrada una vez al día.
Para los pacientes con posible agotamiento del volumen intravascular (p. ej., pacientes tratados con diuréticos, particularmente aquellos con función renal alterada), inicie Benicar bajo estrecha supervisión médica y considere el uso de una dosis inicial más baja [ver ADVERTENCIAS Y PRECAUCIONES ].
Hipertensión pediátrica (6 años de edad y mayores)
La dosis debe ser individualizada. Para los niños que pueden tragar tabletas, la dosis inicial recomendada habitual de Benicar es de 10 mg una vez al día para pacientes que pesan entre 20 y
No se recomienda el uso de Benicar 10 mg en niños ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
Para niños que no pueden tragar comprimidos, se puede administrar la misma dosis usando una suspensión improvisada como se describe a continuación [ver FARMACOLOGÍA CLÍNICA ]. Siga las instrucciones de preparación de la suspensión a continuación para administrar Benicar como suspensión.
Preparación de Suspensión (Para 200 mL de una Suspensión de 2 mg/mL)
Agregue 50 ml de agua purificada a una botella de tereftalato de polietileno (PET) de color ámbar que contiene veinte tabletas de Benicar 20 mg y deje reposar durante un mínimo de 5 minutos. Agite el recipiente durante al menos 1 minuto y deje reposar la suspensión durante al menos 1 minuto. Repita 1 minuto de agitación y 1 minuto de reposo cuatro veces más. Agregue 100 mL de ORA-Sweet® y 50 mL de ORA-Plus®* a la suspensión y agite bien durante al menos 1 minuto. La suspensión debe refrigerarse a 2-8 °C (36-46 °F) y puede almacenarse hasta por 4 semanas. Agite bien la suspensión antes de cada uso y regrésela inmediatamente al refrigerador.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
- Comprimidos de 5 mg, amarillos, redondos, recubiertos con película, sin ranuras, grabados con Sankyo en una cara y C12 en la otra.
- Comprimidos de 20 mg, blancos, redondos, recubiertos con película, sin ranuras, grabados con Sankyo en una cara y C14 en la otra.
- Comprimidos recubiertos con película, blancos, ovalados, de 40 mg, sin ranuras, grabados con Sankyo en una cara y C15 en la otra.
Almacenamiento y manipulación
Benicar se presenta en comprimidos amarillos, redondos, recubiertos con película, sin ranurar, que contienen 5 mg de olmesartán medoxomilo, como comprimidos blancos, redondos, recubiertos con película, sin ranurar, que contienen 20 mg de olmesartán medoxomilo, y como comprimidos blancos, de forma ovalada. Comprimidos recubiertos con película, sin ranurar, que contienen 40 mg de olmesartán medoxomilo. Las tabletas están grabadas con Sankyo en un lado y C12, C14 o C15 en el otro lado de las tabletas de 5, 20 y 40 mg, respectivamente.
Las tabletas se suministran de la siguiente manera:
Almacenamiento
Almacenar a 20-25°C (68-77°F) [ver Temperatura ambiente controlada por USP].
Fabricado para Daiichi Sankyo, Inc., Basking Ridge, NJ 07920. Revisado: octubre de 2019
EFECTOS SECUNDARIOS
Experiencia en ensayos clínicos
Debido a que los estudios clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los estudios clínicos de un fármaco no pueden compararse directamente con las tasas de los estudios clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Hipertensión en adultos
Se ha evaluado la seguridad de Benicar en más de 3825 pacientes/sujetos, incluidos más de 3275 pacientes tratados por hipertensión en ensayos controlados. Esta experiencia incluyó alrededor de 900 pacientes tratados durante al menos 6 meses y más de 525 durante al menos 1 año. Los eventos generalmente fueron leves, transitorios y no tuvieron relación con la dosis de Benicar.
El análisis de los grupos de género, edad y raza no demostró diferencias entre Benicar 40 mg y los pacientes tratados con placebo. La tasa de retiros debido a reacciones adversas en todos los ensayos de pacientes hipertensos fue del 2,4 % (es decir, 79/3278) de los pacientes tratados con Benicar 40 mg y del 2,7 % (es decir, 32/1179) de los pacientes de control. En los ensayos controlados con placebo, la única reacción adversa que se produjo en más del 1 % de los pacientes tratados con Benicar 20 mg y con una incidencia mayor que con el placebo fue mareo (3 % frente al 1 %).
Se notificó edema facial en cinco pacientes que recibieron Benicar. Se ha notificado angioedema con antagonistas de la angiotensina II.
Hipertensión pediátrica
No se identificaron diferencias relevantes entre el perfil de experiencias adversas para pacientes pediátricos de 1 a 16 años y el informado previamente para pacientes adultos.
Experiencia posterior a la comercialización
Las siguientes reacciones adversas se han informado en la experiencia posterior a la comercialización. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Cuerpo como un todo: Astenia, angioedema, reacciones anafilácticas
Gastrointestinal: Vómitos, enteropatía tipo esprúe [ver ADVERTENCIAS Y PRECAUCIONES ]
Trastornos metabólicos y nutricionales: hiperpotasemia
Musculoesquelético: Rabdomiolisis
Sistema urogenital: Insuficiencia renal aguda, aumento de los niveles de creatinina en sangre
Piel y apéndices: Alopecia, prurito, urticaria
Los datos de un ensayo controlado y un estudio epidemiológico han sugerido que altas dosis de olmesartán pueden aumentar el riesgo cardiovascular (CV) en pacientes diabéticos, pero los datos generales no son concluyentes. El ensayo ROADMAP, aleatorizado, controlado con placebo, doble ciego (Randomized Olmesartan And Diabetes MicroAlbuminuria Prevention trial, n=4447) examinó el uso de olmesartán, 40 mg al día, frente a placebo en pacientes con diabetes mellitus tipo 2, normoalbuminuria y al menos un factor de riesgo adicional de enfermedad CV. El ensayo cumplió con su criterio principal de valoración, la aparición tardía de microalbuminuria, pero el olmesartán no tuvo ningún efecto beneficioso sobre la disminución de la tasa de filtración glomerular (TFG). Hubo un hallazgo de aumento de la mortalidad CV (muerte cardíaca súbita adjudicada, infarto de miocardio fatal, accidente cerebrovascular fatal, muerte por revascularización) en el grupo de olmesartán en comparación con el grupo de placebo (15 olmesartán vs. 3 placebo, HR 4.9, intervalo de confianza del 95% [IC ], 1,4, 17), pero el riesgo de infarto de miocardio no mortal fue menor con olmesartán (HR 0,64, IC del 95 % 0,35, 1,18).
El estudio epidemiológico incluyó pacientes de 65 años o más con una exposición general de > 300 000 años-paciente. En el subgrupo de pacientes diabéticos que recibieron dosis altas de olmesartán (40 mg/d) durante > 6 meses, pareció haber un mayor riesgo de muerte (HR 2,0, IC del 95 % 1,1, 3,8) en comparación con pacientes similares que tomaron otros bloqueadores de los receptores de angiotensina. Por el contrario, el uso de dosis altas de olmesartán en pacientes no diabéticos pareció estar asociado con una disminución del riesgo de muerte (HR 0,46, IC del 95%: 0,24, 0,86) en comparación con pacientes similares que toman otros bloqueadores de los receptores de angiotensina. No se observaron diferencias entre los grupos que recibieron dosis más bajas de olmesartán en comparación con otros bloqueadores de la angiotensina o los que recibieron terapia durante
En general, estos datos plantean la preocupación de un posible aumento del riesgo CV asociado con el uso de dosis altas de olmesartán en pacientes diabéticos. Sin embargo, existen preocupaciones con respecto a la credibilidad del hallazgo de un mayor riesgo CV, en particular la observación en el gran estudio epidemiológico de un beneficio de supervivencia en los no diabéticos de una magnitud similar al hallazgo adverso en los diabéticos.
INTERACCIONES CON LA DROGAS
Agentes que aumentan el potasio sérico
El uso concomitante de olmesartán con otros agentes que bloquean el sistema renina-angiotensina, diuréticos ahorradores de potasio (p. ej., espironolactona, triamtereno, amilorida), suplementos de potasio, sustitutos de la sal que contienen potasio u otros fármacos que pueden aumentar los niveles de potasio (p. ej., heparina) puede conducir a aumentos en el potasio sérico. Si se considera necesaria la medicación concomitante, se recomienda la monitorización del potasio sérico.
Agentes antiinflamatorios no esteroideos, incluidos los inhibidores selectivos de la ciclooxigenasa-2 (inhibidores de la COX-2)
En pacientes de edad avanzada, con depleción de volumen (incluidos los que reciben tratamiento con diuréticos) o con función renal comprometida, la coadministración de AINE, incluidos los inhibidores selectivos de la COX-2, con antagonistas de los receptores de la angiotensina II, incluido el olmesartán medoxomilo, puede provocar un deterioro. de la función renal, incluida la posible insuficiencia renal aguda. Estos efectos suelen ser reversibles. Monitoree la función renal periódicamente en pacientes que reciben olmesartán medoxomilo y terapia con AINE.
El efecto antihipertensivo de los antagonistas de los receptores de la angiotensina II, incluido el olmesartán medoxomilo, puede verse atenuado por los AINE, incluidos los inhibidores selectivos de la COX-2.
Bloqueo dual del sistema renina-angiotensina (RAS)
El bloqueo dual del RAS con bloqueadores de los receptores de angiotensina, inhibidores de la ECA o aliskiren se asocia con un mayor riesgo de hipotensión, hiperpotasemia y cambios en la función renal (incluida la insuficiencia renal aguda) en comparación con la monoterapia. La mayoría de los pacientes que reciben la combinación de dos inhibidores de RAS no obtienen ningún beneficio adicional en comparación con la monoterapia. En general, evite el uso combinado de inhibidores de RAS. Monitoree de cerca la presión arterial, la función renal y los electrolitos en pacientes que toman Benicar y otros agentes que afectan el RAS.
No coadministre aliskiren con Benicar en pacientes con diabetes [ver CONTRAINDICACIONES ]. Evitar el uso de aliskireno con Benicar 40 mg en pacientes con insuficiencia renal (TFG
Litio
Se han informado aumentos en las concentraciones séricas de litio y toxicidad por litio durante la administración concomitante de litio con antagonistas de los receptores de angiotensina II, incluido BENICAR. Controle los niveles séricos de litio durante el uso concomitante.
clorhidrato de colesevelam
La administración concomitante de clorhidrato de colesevelam, agente secuestrador de ácidos biliares, reduce la exposición sistémica y la concentración plasmática máxima de olmesartán. La administración de olmesartán al menos 4 horas antes del clorhidrato de colesevelam disminuyó el efecto de la interacción farmacológica. Considere administrar olmesartán al menos 4 horas antes de la dosis de clorhidrato de colesevelam [ver FARMACOLOGÍA CLÍNICA ].
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Toxicidad Fetal
Benicar 10 mg puede causar daño fetal cuando se administra a una mujer embarazada. El uso de fármacos que actúan sobre el sistema renina-angiotensina (RAS) durante el segundo y tercer trimestre del embarazo reduce la función renal fetal y aumenta la morbilidad y muerte fetal y neonatal. El oligohidramnios resultante puede asociarse con hipoplasia pulmonar fetal y deformaciones esqueléticas. Los posibles efectos adversos neonatales incluyen hipoplasia craneal, anuria, hipotensión, insuficiencia renal y muerte. Cuando se detecte un embarazo, suspenda Benicar lo antes posible [ver Uso en poblaciones específicas ].
Morbilidad en lactantes
No se recomienda el uso de Benicar en niños Uso en poblaciones específicas ].
Hipotensión en pacientes con depleción de volumen o sal
En pacientes con un sistema renina-angiotensina-aldosterona activado, como pacientes con depleción de volumen y/o sal (p. ej., aquellos que están siendo tratados con altas dosis de diuréticos), se puede anticipar hipotensión sintomática después de iniciar el tratamiento con Benicar. Inicie el tratamiento bajo estrecha supervisión médica y considere comenzar con una dosis más baja. Si ocurre hipotensión, coloque al paciente en posición supina y, si es necesario, administre una infusión intravenosa de solución salina normal [ver DOSIFICACIÓN Y ADMINISTRACIÓN ]. Una respuesta hipotensiva transitoria no es una contraindicación para continuar con el tratamiento, que generalmente puede continuarse sin dificultad una vez que la presión arterial se ha estabilizado.
Insuficiencia renal
Como consecuencia de la inhibición del sistema renina-angiotensina-aldosterona, se pueden anticipar cambios en la función renal en individuos susceptibles tratados con Benicar. En pacientes cuya función renal puede depender de la actividad del sistema renina-angiotensina-aldosterona (p. ej., pacientes con insuficiencia cardíaca congestiva grave), el tratamiento con inhibidores de la enzima convertidora de angiotensina (ECA) y antagonistas de los receptores de angiotensina se ha asociado con oliguria y/o azotemia progresiva. y rara vez con insuficiencia renal aguda y/o muerte. Se pueden anticipar resultados similares en pacientes tratados con Benicar [ver DOSIFICACIÓN Y ADMINISTRACIÓN , INTERACCIONES CON LA DROGAS , Uso en poblaciones específicas y FARMACOLOGÍA CLÍNICA ].
En estudios de inhibidores de la ECA en pacientes con estenosis de la arteria renal unilateral o bilateral, se informaron aumentos en la creatinina sérica o el nitrógeno ureico en sangre (BUN). No ha habido uso a largo plazo de Benicar en pacientes con estenosis de la arteria renal unilateral o bilateral, pero se pueden esperar resultados similares.
Enteropatía tipo sprue
Se ha informado diarrea crónica severa con pérdida de peso sustancial en pacientes que toman olmesartán meses o años después del inicio del fármaco. Las biopsias intestinales de los pacientes a menudo demostraron atrofia de las vellosidades. Si un paciente desarrolla estos síntomas durante el tratamiento con olmesartán, excluya otras etiologías. Considere una terapia antihipertensiva alternativa en los casos en que no se identifique otra etiología.
hiperpotasemia
Se debe controlar el potasio sérico en pacientes que reciben Benicar. Los fármacos que inhiben el sistema renina angiotensina pueden causar hiperpotasemia. Los factores de riesgo para el desarrollo de hiperpotasemia incluyen insuficiencia renal, diabetes mellitus y el uso concomitante de diuréticos ahorradores de potasio, suplementos de potasio y/o sustitutos de la sal que contienen potasio [ver INTERACCIONES CON LA DROGAS ].
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
Olmesartán medoxomilo no fue cancerígeno cuando se administró en la dieta a ratas durante un máximo de 2 años. La dosis más alta probada (2000 mg/kg/día) fue, en mg/m2, aproximadamente 480 veces la dosis humana máxima recomendada (MRHD) de 40 mg/día. Dos estudios de carcinogenicidad realizados en ratones, un estudio de alimentación forzada de 6 meses en el ratón knockout para p53 y un estudio de administración dietética de 6 meses en el ratón transgénico Hras2, en dosis de hasta 1000 mg/kg/día (alrededor de 120 veces la MRHD) , no reveló evidencia de un efecto carcinogénico de olmesartán medoxomilo.
Tanto olmesartán medoxomilo como olmesartán dieron negativo en el ensayo de transformación de células de embrión de hámster sirio in vitro y no mostraron evidencia de toxicidad genética en la prueba de Ames (mutagenicidad bacteriana). Sin embargo, se demostró que ambos inducen aberraciones cromosómicas en células cultivadas in vitro (pulmón de hámster chino) y dieron positivo para mutaciones de timidina quinasa en el ensayo de linfoma de ratón in vitro. Olmesartán medoxomilo resultó negativo in vivo para mutaciones en el intestino y riñón de MutaMouse y para clastogenicidad en médula ósea de ratón (prueba de micronúcleos) a dosis orales de hasta 2000 mg/kg (olmesartán no probado).
La fertilidad de las ratas no se vio afectada por la administración de olmesartán medoxomilo en dosis de hasta 1000 mg/kg/día (240 veces la MRHD) en un estudio en el que la dosificación se inició 2 (hembra) o 9 (macho) semanas antes del apareamiento.
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
Benicar 10 mg puede causar daño fetal cuando se administra a una mujer embarazada. El uso de fármacos que actúan sobre el sistema renina-angiotensina durante el segundo y tercer trimestre del embarazo reduce la función renal fetal y aumenta la morbilidad y muerte fetal y neonatal. La mayoría de los estudios epidemiológicos que examinan las anomalías fetales después de la exposición al uso de antihipertensivos en el primer trimestre no han distinguido los fármacos que afectan al sistema renina-angiotensina de otros agentes antihipertensivos. En estudios de reproducción animal, el tratamiento con Benicar durante la organogénesis resultó en un aumento de la toxicidad embriofetal en ratas a dosis más bajas que las dosis tóxicas para la madre.
Cuando se detecte un embarazo, suspenda Benicar lo antes posible. Considere una terapia antihipertensiva alternativa durante el embarazo.
Se desconoce el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo para la población indicada. Todos los embarazos tienen un riesgo de fondo de defecto congénito, pérdida u otros resultados adversos. En la población general de los EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos reconocidos clínicamente es del 2 % al 4 % y del 15 % al 20 %, respectivamente.
Consideraciones clínicas
Riesgo materno y/o embrionario/fetal asociado a la enfermedad
La hipertensión en el embarazo aumenta el riesgo materno de preeclampsia, diabetes gestacional, parto prematuro y complicaciones del parto (p. ej., necesidad de cesárea y hemorragia posparto). La hipertensión aumenta el riesgo fetal de restricción del crecimiento intrauterino y muerte intrauterina. Las mujeres embarazadas con hipertensión deben ser monitoreadas cuidadosamente y tratadas en consecuencia.
Reacciones adversas fetales/neonatales
El oligohidramnios en mujeres embarazadas que usan medicamentos que afectan el sistema renina-angiotensina en el segundo y tercer trimestre del embarazo puede provocar lo siguiente: función renal fetal reducida que conduce a anuria e insuficiencia renal, hipoplasia pulmonar fetal, deformaciones esqueléticas, incluida hipoplasia del cráneo, hipotensión y muerte En pacientes que toman Benicar 20 mg durante el embarazo, realice exámenes de ultrasonido en serie para evaluar el entorno intraamniótico. Las pruebas fetales pueden ser apropiadas, según la semana de gestación. Sin embargo, los pacientes y los médicos deben ser conscientes de que es posible que el oligohidramnios no aparezca hasta después de que el feto haya sufrido una lesión irreversible.
Observe de cerca a los bebés con antecedentes de exposición en el útero a Benicar 40 mg por hipotensión, oliguria e hiperpotasemia. En recién nacidos con antecedentes de exposición intrauterina a Benicar, si se presenta oliguria o hipotensión, utilice medidas para mantener una presión arterial y una perfusión renal adecuadas. Es posible que se requieran exanguinotransfusiones o diálisis como medio para revertir la hipotensión y apoyar la función renal.
Datos
Datos de animales
No se observaron efectos teratogénicos cuando se administró olmesartán medoxomilo a ratas preñadas en dosis orales de hasta 1000 mg/kg/día (240 veces la dosis máxima recomendada en humanos (DMRH) en mg/m2) o conejas preñadas en dosis orales de hasta 1 mg/kg/día (la mitad de la MRHD sobre una base de mg/m2; no se pudieron evaluar los efectos de dosis más altas sobre el desarrollo fetal ya que eran letales para las hembras). En ratas, se observaron disminuciones significativas en el peso al nacer de las crías y aumento de peso a dosis ≥1,6 mg/kg/día, y retrasos en los hitos del desarrollo (retraso en la separación de las aurículas de las orejas, erupción de los incisivos inferiores, aparición de vello abdominal, descenso de los testículos, y separación de los párpados) y se observaron aumentos dependientes de la dosis en la incidencia de dilatación de la pelvis renal a dosis ≥ 8 mg/kg/día. La dosis sin efecto observado para la toxicidad del desarrollo en ratas es de 0,3 mg/kg/día, aproximadamente una décima parte de la MRHD de 40 mg/día.
Lactancia
Resumen de riesgos
No hay información sobre la presencia de olmesartán en la leche humana, los efectos sobre el lactante o los efectos sobre la producción de leche. Olmesartán se secreta en bajas concentraciones en la leche de ratas lactantes (ver Datos ). Debido al potencial de efectos adversos en el lactante, se debe tomar la decisión de suspender la lactancia o suspender el fármaco, teniendo en cuenta la importancia del fármaco para la madre.
Datos
Se observó la presencia de olmesartán en la leche después de una administración oral única de 5 mg/kg [14C] de olmesartán medoxomilo a ratas lactantes.
Uso pediátrico
Los efectos antihipertensivos de Benicar se evaluaron en un estudio clínico aleatorizado, doble ciego en pacientes pediátricos de 1 a 16 años de edad [ver Estudios clínicos ]. La farmacocinética de Benicar se evaluó en pacientes pediátricos de 1 a 16 años de edad [ver FARMACOLOGÍA CLÍNICA ]. Benicar 10 mg fue generalmente bien tolerado en pacientes pediátricos y el perfil de experiencias adversas fue similar al descrito para adultos.
No se ha demostrado que Benicar 20 mg sea eficaz para la hipertensión en niños menores de 6 años.
No se recomienda el uso de Benicar en niños ADVERTENCIAS Y PRECAUCIONES ]. El sistema renina-angiotensina-aldosterona (SRAA) desempeña un papel fundamental en el desarrollo renal. Se ha demostrado que el bloqueo de RAAS conduce a un desarrollo renal anormal en ratones muy jóvenes. La administración de fármacos que actúan directamente sobre el sistema renina-angiotensina aldosterona (SRAA) puede alterar el desarrollo renal normal.
Uso geriátrico
Del número total de pacientes hipertensos que recibieron Benicar en estudios clínicos, más del 20 % tenían 65 años o más, mientras que más del 5 % tenían 75 años o más. No se observaron diferencias generales en la eficacia o la seguridad entre pacientes de edad avanzada y pacientes más jóvenes. Otra experiencia clínica informada no ha identificado diferencias en las respuestas entre los ancianos y los pacientes más jóvenes, pero no se puede descartar una mayor sensibilidad de algunos individuos mayores [ver FARMACOLOGÍA CLÍNICA ].
Deterioro hepático
Se observaron aumentos en AUC0-∞ y Cmax en pacientes con insuficiencia hepática moderada en comparación con los controles emparejados, con un aumento en AUC de alrededor del 60 %. No se recomienda un ajuste de dosis inicial para pacientes con disfunción hepática de moderada a marcada [ver FARMACOLOGÍA CLÍNICA ].
Insuficiencia renal
Los pacientes con insuficiencia renal tienen concentraciones séricas elevadas de olmesartán en comparación con sujetos con función renal normal. Después de dosis repetidas, el AUC se triplicó aproximadamente en pacientes con insuficiencia renal grave (aclaramiento de creatinina DOSIFICACIÓN Y ADMINISTRACIÓN , ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ].
Pacientes negros
El efecto antihipertensivo de Benicar 10 mg fue menor en pacientes de raza negra (por lo general, una población con niveles bajos de renina), como se ha observado con los inhibidores de la ECA, los betabloqueantes y otros bloqueadores de los receptores de angiotensina.
SOBREDOSIS
Hay datos limitados disponibles relacionados con la sobredosis en humanos. Las manifestaciones más probables de sobredosis serían hipotensión y taquicardia; se podría encontrar bradicardia si ocurre estimulación parasimpática (vagal). Si se produce hipotensión sintomática, inicie un tratamiento de apoyo. Se desconoce la dializabilidad de olmesartán.
CONTRAINDICACIONES
No coadministre aliskireno con Benicar 20 mg en pacientes con diabetes [ver INTERACCIONES CON LA DROGAS ].
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
La angiotensina II se forma a partir de la angiotensina I en una reacción catalizada por la enzima convertidora de angiotensina (ACE, cininasa II). La angiotensina II es el principal agente presor del sistema renina-angiotensina, con efectos que incluyen vasoconstricción, estimulación de la síntesis y liberación de aldosterona, estimulación cardiaca y reabsorción renal de sodio. Olmesartán bloquea los efectos vasoconstrictores de la angiotensina II mediante el bloqueo selectivo de la unión de la angiotensina II al receptor AT1 en el músculo liso vascular. Su acción es, por tanto, independiente de las vías de síntesis de la angiotensina II.
También se encuentra un receptor AT2 en muchos tejidos, pero no se sabe que este receptor esté asociado con la homeostasis cardiovascular. Olmesartán tiene una afinidad 12.500 veces mayor por el receptor AT1 que por el receptor AT2.
El bloqueo del sistema renina-angiotensina con inhibidores de la ECA, que inhiben la biosíntesis de angiotensina II a partir de angiotensina I, es un mecanismo de muchos fármacos utilizados para tratar la hipertensión. Los inhibidores de la ACE también inhiben la degradación de la bradicinina, una reacción también catalizada por la ACE. Debido a que olmesartán medoxomilo no inhibe la ECA (cininasa II), no afecta la respuesta a la bradicinina. Aún no se sabe si esta diferencia tiene relevancia clínica.
El bloqueo del receptor de angiotensina II inhibe la retroalimentación reguladora negativa de la angiotensina II sobre la secreción de renina, pero el aumento resultante de la actividad de la renina plasmática y los niveles circulantes de angiotensina II no superan el efecto del olmesartán sobre la presión arterial.
Farmacodinámica
Las dosis de Benicar de 2,5 mg a 40 mg inhiben los efectos presores de la infusión de angiotensina I. La duración del efecto inhibitorio se relacionó con la dosis, con dosis de Benicar >40 mg dando >90% de inhibición a las 24 horas.
Las concentraciones plasmáticas de angiotensina I y angiotensina II y la actividad de la renina plasmática (PRA) aumentan después de la administración única y repetida de Benicar 10 mg a sujetos sanos y pacientes hipertensos. La administración repetida de hasta 80 mg de Benicar tuvo una influencia mínima sobre los niveles de aldosterona y ningún efecto sobre el potasio sérico.
Farmacocinética
Absorción
Olmesartán medoxomilo se bioactiva rápida y completamente por hidrólisis del éster a olmesartán durante la absorción en el tracto gastrointestinal.
Las tabletas de Benicar y la formulación en suspensión preparada a partir de las tabletas de Benicar son bioequivalentes [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
La biodisponibilidad absoluta de olmesartán es de aproximadamente 26%. Después de la administración oral, la concentración plasmática máxima (Cmax) de olmesartán se alcanza después de 1 a 2 horas. Los alimentos no afectan la biodisponibilidad de olmesartán. Benicar puede administrarse con o sin alimentos.
Distribución
El volumen de distribución de olmesartán es de aproximadamente 17 l. Olmesartán se une en gran medida a las proteínas plasmáticas (99 %) y no penetra en los glóbulos rojos. La unión a proteínas es constante a concentraciones plasmáticas de olmesartán muy por encima del rango alcanzado con las dosis recomendadas.
En ratas, el olmesartán cruzó la barrera hematoencefálica pobremente, si es que lo hizo. Olmesartán atravesó la barrera placentaria en ratas y se distribuyó al feto. Olmesartán se distribuyó en la leche en niveles bajos en ratas.
Metabolismo y excreción
Después de la conversión rápida y completa de olmesartán medoxomilo a olmesartán durante la absorción, prácticamente no hay más metabolismo de olmesartán. El aclaramiento plasmático total de olmesartán es de 1,3 l/h, con un aclaramiento renal de 0,6 l/h. Aproximadamente del 35% al 50% de la dosis absorbida se recupera en la orina, mientras que el resto se elimina en las heces a través de la bilis.
Olmesartán parece eliminarse de manera bifásica con una vida media de eliminación terminal de aproximadamente 13 horas. Olmesartán muestra una farmacocinética lineal después de dosis orales únicas de hasta 320 mg y dosis orales múltiples de hasta 80 mg. Los niveles de estado estacionario de olmesartán se alcanzan dentro de los 3 a 5 días y no se produce acumulación en el plasma con la dosificación una vez al día.
Poblaciones Específicas
Pacientes geriátricos
La farmacocinética de olmesartán se estudió en ancianos (≥65 años). En general, las concentraciones plasmáticas máximas de olmesartán fueron similares en adultos jóvenes y ancianos. Se observó una acumulación modesta de olmesartán en ancianos con dosis repetidas; AUCss, τ fue un 33 % mayor en pacientes de edad avanzada, lo que corresponde a una reducción aproximada del 30 % en CLR [ver DOSIFICACIÓN Y ADMINISTRACIÓN y Uso en poblaciones específicas ].
Pacientes pediátricos
La farmacocinética de olmesartán se estudió en pacientes hipertensos pediátricos de 1 a 16 años. El aclaramiento de olmesartán en pacientes pediátricos fue similar al de pacientes adultos cuando se ajustó por el peso corporal [ver Uso en poblaciones específicas ].
No se ha investigado la farmacocinética de olmesartán en pacientes pediátricos menores de 1 año [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
Pacientes masculinos y femeninos
Se observaron diferencias menores en la farmacocinética de olmesartán en mujeres en comparación con hombres. El AUC y la Cmax fueron un 10-15 % más altos en mujeres que en hombres.
Pacientes con insuficiencia hepática
Se observaron aumentos en AUC0-∞ y Cmax en pacientes con insuficiencia hepática moderada en comparación con los controles emparejados, con un aumento en AUC de alrededor del 60 % [ver DOSIFICACIÓN Y ADMINISTRACIÓN y Uso en poblaciones específicas ].
Pacientes con insuficiencia renal
En pacientes con insuficiencia renal, las concentraciones séricas de olmesartán fueron elevadas en comparación con sujetos con función renal normal. Después de dosis repetidas, el AUC se triplicó aproximadamente en pacientes con insuficiencia renal grave (aclaramiento de creatinina DOSIFICACIÓN Y ADMINISTRACIÓN , ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
Estudios de interacción farmacológica
Agente secuestrante de ácidos biliares Colesevelam
La administración concomitante de 40 mg de olmesartán medoxomilo y 3750 mg de hidrocloruro de colesevelam en sujetos sanos dio como resultado una reducción del 28 % en la Cmax y una reducción del 39 % en el AUC de olmesartán. Cuando se administró olmesartán medoxomilo 4 horas antes que el clorhidrato de colesevelam [ver INTERACCIONES CON LA DROGAS ].
Otros estudios
No se informaron interacciones farmacológicas significativas en estudios en los que se administró olmesartán medoxomilo junto con digoxina o warfarina en voluntarios sanos.
La biodisponibilidad de olmesartán no se vio significativamente alterada por la administración concomitante de antiácidos [Al(OH)3/Mg(OH)2].
Olmesartán medoxomilo no es metabolizado por el sistema del citocromo P450 y no tiene efectos sobre las enzimas P450; por lo tanto, no se esperan interacciones con fármacos que inhiban, induzcan o sean metabolizados por esas enzimas.
Estudios clínicos
Hipertensión en adultos
Los efectos antihipertensivos de Benicar 10 mg se han demostrado en siete estudios controlados con placebo en dosis que oscilan entre 2,5 mg y 80 mg durante 6 a 12 semanas, cada uno de los cuales muestra reducciones estadísticamente significativas en la presión arterial máxima y mínima. Se estudiaron un total de 2693 pacientes (2145 Benicar; 548 placebo) con hipertensión esencial. Benicar 40 mg una vez al día redujo la presión arterial diastólica y sistólica. La respuesta estuvo relacionada con la dosis, como se muestra en el siguiente gráfico. Una dosis de Benicar de 20 mg diarios produce una reducción mínima de la presión arterial (PA) sentado sobre el placebo de aproximadamente 10/6 mmHg y una dosis de 40 mg diarios produce una reducción mínima de la PA sentado sobre el placebo de aproximadamente 12/7 mmHg. Las dosis de 10 mg de Benicar superiores a 40 mg tuvieron poco efecto adicional. El inicio del efecto antihipertensivo ocurrió dentro de 1 semana y se manifestó en gran medida después de 2 semanas.
Benicar 40 mg Respuesta a la dosis Reducción de la presión arterial ajustada al placebo (mmHg) 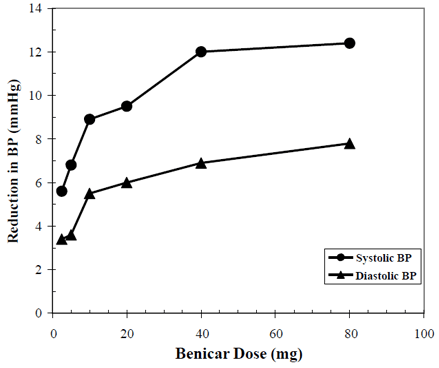
Los datos anteriores son de siete estudios controlados con placebo (2145 pacientes con Benicar, 548 pacientes con placebo). El efecto reductor de la presión arterial se mantuvo durante todo el período de 24 horas con Benicar una vez al día, con proporciones mínimas y máximas para la respuesta sistólica y diastólica entre 60 y 80 %.
El efecto reductor de la presión arterial de Benicar 40 mg, con y sin hidroclorotiazida, se mantuvo en pacientes tratados hasta por 1 año. No hubo evidencia de taquifilaxia durante el tratamiento a largo plazo con Benicar o efecto rebote después de la suspensión abrupta de olmesartán medoxomilo después de 1 año de tratamiento.
El efecto antihipertensivo de Benicar fue similar en hombres y mujeres y en pacientes mayores y menores de 65 años. El efecto fue menor en pacientes de raza negra (por lo general, una población con niveles bajos de renina), como se ha observado con los inhibidores de la ECA, los betabloqueantes y otros bloqueadores de los receptores de angiotensina. Benicar tuvo un efecto reductor adicional de la presión arterial cuando se agregó a la hidroclorotiazida.
No existen ensayos de Benicar que demuestren reducciones en el riesgo cardiovascular en pacientes con hipertensión, pero al menos un fármaco farmacológicamente similar ha demostrado tales beneficios.
Hipertensión pediátrica
Los efectos antihipertensivos de Benicar 40 mg en la población pediátrica se evaluaron en un estudio aleatorizado, doble ciego, en el que participaron 302 pacientes hipertensos de 6 a 16 años. La población del estudio consistió en una cohorte completamente negra de 112 pacientes y una cohorte racial mixta de 190 pacientes, incluidos 38 pacientes negros. La etiología de la hipertensión fue predominantemente hipertensión esencial (87% de la cohorte negra y 67% de la cohorte mixta). Los pacientes que pesaban entre 20 y
En el mismo estudio, 59 pacientes de 1 a 5 años que pesaban ≥5 kg recibieron 0,3 mg/kg de Benicar 10 mg una vez al día durante tres semanas en una fase abierta y luego se aleatorizaron para recibir Benicar o placebo en un estudio doble ciego. fase. Al final de la segunda semana de retiro, la presión arterial sistólica/diastólica media en el punto mínimo fue 3/3 mmHg más baja en el grupo aleatorizado a Benicar; esta diferencia en la presión arterial no fue estadísticamente significativa (IC del 95%: -2 a 7/-1 a 7).
INFORMACIÓN DEL PACIENTE
El embarazo
Asesorar a las pacientes en edad fértil sobre las consecuencias de la exposición a Benicar 20 mg durante el embarazo. Analice las opciones de tratamiento con las mujeres que planean quedar embarazadas. Dígales a los pacientes que informen los embarazos a sus médicos lo antes posible [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ].
Lactancia
Aconseje a las mujeres lactantes que no amamanten durante el tratamiento con BENICAR [ver Uso en poblaciones específicas ].
hiperpotasemia
Aconseje a los pacientes que no usen suplementos de potasio o sustitutos de la sal que contengan potasio sin consultar a su proveedor de atención médica [ver INTERACCIONES CON LA DROGAS ].
