Adalat 10mg, 20mg, 30mg Nifedipine Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Adalat y cómo se usa?
Adalat es un medicamento recetado que se usa para tratar los síntomas de dolor en el pecho (angina), presión arterial alta (hipertensión) e hipertensión pulmonar. Adalat 30 mg se puede usar solo o con otros medicamentos.
Adalat 20 mg pertenece a una clase de medicamentos llamados bloqueadores de los canales de calcio; Bloqueadores de canales de calcio, dihidropiridina.
No se sabe si Adalat 30 mg es seguro y eficaz en niños menores de 6 años.
¿Cuáles son los posibles efectos secundarios de Adalat 10 mg?
Adalat puede causar efectos secundarios graves que incluyen:
- urticaria,
- respiración dificultosa,
- hinchazón en la cara o la garganta,
- fiebre,
- dolor de garganta,
- ojos irritados,
- dolor de piel,
- erupción cutánea roja o morada con ampollas y descamación,
- empeoramiento del dolor en el pecho,
- latidos del corazón palpitantes,
- revoloteando en tu pecho,
- aturdimiento,
- hinchazón en las manos o la parte inferior de las piernas,
- dolor en la parte superior del estómago y
- coloración amarillenta de la piel o los ojos (ictericia)
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Adalat incluyen:
- hinchazón,
- enrojecimiento (calor, enrojecimiento o sensación de hormigueo),
- dolor de cabeza,
- mareo,
- náuseas,
- acidez estomacal, y
- sentirse débil o cansado
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Adalat. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
Adalat® CC es una forma de dosificación en comprimidos de liberación prolongada del bloqueador de los canales de calcio nifedipina. La nifedipina es ácido 3,5-piridindicarboxílico, 1,4-dihidro-2,6-dimetil-4-(2-nitrofenil)-dimetil éster, C17H18N2O6, y tiene la fórmula estructural:
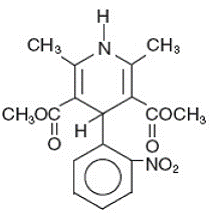
La nifedipina es una sustancia cristalina amarilla, prácticamente insoluble en agua pero soluble en etanol. Tiene un peso molecular de 346,3. Los comprimidos de Adalat CC constan de una capa externa y un núcleo interno. Ambos contienen nifedipina, la cubierta como formulación de liberación lenta y el núcleo como formulación de liberación rápida. Las tabletas de Adalat CC contienen: 30, 60 o 90 mg de nifedipina para administración oral una vez al día.
Los ingredientes inertes de la formulación son: hidroxipropilcelulosa, lactosa, almidón de maíz, crospovidona, celulosa microcristalina, dióxido de silicio y estearato de magnesio. Los ingredientes inertes del recubrimiento pelicular de Adalat 30 mg CC 30 y 60 son: hipromelosa, polietilenglicol, óxido férrico y dióxido de titanio. Los ingredientes inertes del recubrimiento pelicular de Adalat 20 mg CC 90 son: hipromelosa, polietilenglicol y óxido férrico.
INDICACIONES
Adalat 10 mg CC está indicado para el tratamiento de la hipertensión. Puede usarse solo o en combinación con otros agentes antihipertensivos.
DOSIFICACIÓN Y ADMINISTRACIÓN
La dosis debe ajustarse de acuerdo con las necesidades de cada paciente. Se recomienda que Adalat 20 mg CC se administre por vía oral una vez al día con el estómago vacío. Adalat 10mg CC es una forma de dosificación de liberación prolongada y las tabletas deben tragarse enteras, no mordidas ni divididas. En general, la titulación debe realizarse durante un período de 7 a 14 días, comenzando con 30 mg una vez al día. La titulación ascendente debe basarse en la eficacia y seguridad terapéuticas. La dosis habitual de mantenimiento es de 30 mg a 60 mg una vez al día. No se recomienda la titulación a dosis superiores a 90 mg diarios.
Si es necesaria la interrupción de Adalat 30 mg CC, la práctica clínica sólida sugiere que la dosis debe reducirse gradualmente con una estrecha supervisión médica.
Debe evitarse la coadministración de nifedipino con jugo de toronja (Ver FARMACOLOGÍA CLÍNICA y PRECAUCIONES ).
Se debe tener cuidado al administrar Adalat CC para asegurarse de que se haya recetado la forma de dosificación de liberación prolongada.
CÓMO SUMINISTRADO
Adalat CC Las tabletas de liberación prolongada se suministran como tabletas redondas recubiertas con película de 30 mg, 60 mg y 90 mg. Las diferentes fortalezas se pueden identificar de la siguiente manera:
Adalat® CC Tabletas se suministran en:
Las tabletas deben protegerse de la luz y la humedad y almacenarse por debajo de 86 °F (30 °C). Dispensar en recipientes herméticos, resistentes a la luz.
Fabricado para: Bayer HealthCare Pharmaceuticals Inc., Wayne, NJ 07470. Fabricado en Alemania. Revisado: diciembre de 2015
EFECTOS SECUNDARIOS
Experiencias adversas
La incidencia de eventos adversos durante el tratamiento con Adalat CC en dosis de hasta 90 mg diarios se derivó de ensayos clínicos multicéntricos controlados con placebo en 370 pacientes hipertensos. Atenolol 50 mg una vez al día se utilizó concomitantemente en 187 de los 370 pacientes con Adalat CC y en 64 de los 126 pacientes con placebo. Todos los eventos adversos informados durante la terapia con Adalat 30 mg CC se tabularon independientemente de su relación causal con la medicación.
El evento adverso más común informado con Adalat 10 mg CC fue edema periférico. Esto estuvo relacionado con la dosis y la frecuencia fue del 18 % con Adalat 30 mg CC 30 mg al día, 22 % con Adalat 30 mg CC 60 mg al día y 29 % con Adalat 10 mg CC 90 mg al día frente al 10 % con placebo.
Otros eventos adversos comunes informados en los ensayos controlados con placebo anteriores incluyen:
Cuando la frecuencia de eventos adversos con Adalat 20 mg CC y placebo es similar, no se puede establecer una relación causal.
Se informaron los siguientes eventos adversos con una incidencia del 3% o menos en dosis diarias de hasta 90 mg:
Cuerpo como un Todo/Sistémico: dolor en el pecho, dolor en las piernas
Sistema nervioso central: parestesia, vértigo
Dermatológico: sarpullido
Gastrointestinal: estreñimiento
Musculoesquelético: calambres en las piernas
Respiratorio: epistaxis, rinitis
urogenitales: impotencia, frecuencia urinaria
Otros eventos adversos informados con una incidencia de menos del 1,0% fueron:
Cuerpo como un Todo/Sistémico: reacción alérgica, astenia, celulitis, dolor torácico subesternal, escalofríos, edema facial, pruebas de laboratorio anormales, malestar general, dolor de cuello, dolor pélvico, dolor, reacción de fotosensibilidad Cardiovasculares: fibrilación auricular, bradicardia, paro cardíaco, extrasístole, hipotensión, migraña, palpitaciones , flebitis, hipotensión postural, taquicardia, angiectasias cutáneas
Sistema nervioso central: ansiedad, confusión, disminución de la libido, depresión, hipertonía, hipoestesia, insomnio, somnolencia
Dermatológico: angioedema, erupción petequial, prurito, sudoración
Gastrointestinal: dolor abdominal, diarrea, sequedad de boca, disfagia, dispepsia, eructos, esofagitis, flatulencia, trastorno gastrointestinal, hemorragia gastrointestinal, aumento de GGT, trastorno de las encías, hemorragia de las encías, vómitos
hematológico: eosinofilia, linfadenopatía
Metabólico: gota, pérdida de peso
Musculoesquelético: artralgia, artritis, trastorno de las articulaciones, mialgia, miastenia
Respiratorio: disnea, aumento de la tos, estertores, faringitis, estridor
Sentidos especiales : visión anormal, ambliopía, conjuntivitis, diplopía, trastorno ocular, hemorragia ocular, tinnitus
Urogenital/Reproductivo: disuria, cálculos renales, nocturia, ingurgitación mamaria, poliuria, trastorno urogenital, disfunción eréctil (DE)
Raramente se han informado los siguientes eventos adversos en pacientes que recibieron nifedipina en el núcleo de la capa u otras formulaciones: hepatitis alergénica, alopecia, reacción anafiláctica, anemia, artritis con ANA (+), depresión, eritromelalgia, dermatitis exfoliativa, fiebre, hiperplasia gingival, ginecomastia, hiperglucemia, ictericia, leucopenia, cambios de humor, calambres musculares, nerviosismo, síndrome paranoide, púrpura, temblores, trastornos del sueño, síndrome de Stevens-Johnson, síncope, alteración del gusto, trombocitopenia, necrólisis epidérmica tóxica, ceguera transitoria en el nivel plasmático máximo, temblor y urticaria.
INTERACCIONES CON LA DROGAS
La nifedipina se elimina principalmente por metabolismo y es un sustrato de CYP3A. Los inhibidores e inductores de CYP3A pueden afectar la exposición a la nifedipina y, en consecuencia, sus efectos deseables e indeseables. Los datos in vitro e in vivo indican que la nifedipina puede inhibir el metabolismo de fármacos que son sustratos de CYP3A, aumentando así la exposición a otros fármacos. La nifedipina es un vasodilatador y la administración conjunta de otros medicamentos que afectan la presión arterial puede provocar interacciones farmacodinámicas.
Inhibidores de CYP3A
Inhibidores de CYP3A como ketoconazol, fluconazol, itraconazol, claritromicina, eritromicina (la azitromicina, aunque estructuralmente relacionada con la clase de antibiótico macrólido carece de inhibición clínicamente relevante de CYP3A4), toronja, nefazodona, fluoxetina, saquinavir, indinavir, nelfinavir y ritonavir pueden resultar en una mayor exposición a la nifedipina cuando se administra de forma conjunta. Puede ser necesario un control cuidadoso y un ajuste de la dosis; considere iniciar nifedipino a la dosis más baja disponible si se administra concomitantemente con estos medicamentos.
Fuertes inductores de CYP3A
Los inductores potentes de CYP3A, como la rifampicina, la rifabutina, el fenobarbital, la fenitoína, la carbamazepina y la hierba de San Juan reducen la biodisponibilidad y la eficacia de la nifedipina; por lo tanto, la nifedipina no debe usarse en combinación con inductores potentes de CYP3A como la rifampicina (ver CONTRAINDICACIONES ).
Medicamentos cardiovasculares
antiarrítmicos
Quinidina: La quinidina es un sustrato de CYP3A y se ha demostrado que inhibe CYP3A in vitro. La coadministración de dosis múltiples de sulfato de quinidina, 200 mg tres veces al día, y nifedipina, 20 mg tres veces al día, aumentó la Cmáx y el AUC de nifedipina en voluntarios sanos por factores de 2,30 y 1,37, respectivamente. La frecuencia cardíaca en el intervalo inicial después de la administración del fármaco aumentó hasta 17,9 latidos/minuto. La exposición a la quinidina no cambió de manera importante en presencia de nifedipina. Se recomienda la monitorización de la frecuencia cardíaca y el ajuste de la dosis de nifedipino, si es necesario, cuando se añade quinidina a un tratamiento con nifedipino.
Flecainida: Ha habido muy poca experiencia con la coadministración de Tambocor con nifedipina para recomendar el uso concomitante.
Bloqueadores de los canales de calcio
diltiazem: El pretratamiento de voluntarios sanos con 30 mg o 90 mg tres veces al día de diltiazem po aumentó el AUC de nifedipina después de una dosis única de 20 mg de nifedipina por factores de 2,2 y 3,1, respectivamente. Los valores correspondientes de Cmax de nifedipina aumentaron en factores de 2,0 y 1,7, respectivamente. Se debe tener precaución cuando se coadministre diltiazem y nifedipino y se debe considerar una reducción de la dosis de nifedipino.
Verapamilo: El verapamilo, un inhibidor de CYP3A, puede inhibir el metabolismo de la nifedipina y aumentar la exposición a la nifedipina durante la terapia concomitante. Se debe controlar la presión arterial y considerar la reducción de la dosis de nifedipino.
Inhibidores de la ECA
benazepril: En voluntarios sanos que recibieron una dosis única de 20 mg de nifedipina ER y 10 mg de benazepril, las concentraciones plasmáticas de benazeprilato y nifedipina en presencia y ausencia de cada uno no fueron estadísticamente significativas. Solo se observó un efecto hipotensor después de la administración conjunta de los dos fármacos. El efecto taquicárdico de la nifedipina se atenuó en presencia de benazepril.
Bloqueadores de angiotensina-II
Irbesartán: Los estudios in vitro muestran una inhibición significativa de la formación de metabolitos de irbesartán oxidados por la nifedipina. Sin embargo, en estudios clínicos, la nifedipina concomitante no tuvo efecto sobre la farmacocinética de irbesartán.
candesartán: No se han informado interacciones farmacológicas significativas en estudios con candesartán cilexitil administrado junto con nifedipina. Debido a que el candesartán no es metabolizado significativamente por el sistema del citocromo P450 y en concentraciones terapéuticas no tiene efecto sobre las enzimas del citocromo P450, no se esperarían interacciones con medicamentos que inhiban o sean metabolizados por esas enzimas.
Bloqueadores beta
Adalat 10 mg CC fue bien tolerado cuando se administró en combinación con bloqueadores beta en 187 pacientes hipertensos en un ensayo clínico controlado con placebo. Sin embargo, ha habido informes ocasionales en la literatura que sugieren que la combinación de nifedipina y fármacos bloqueadores beta-adrenérgicos puede aumentar la probabilidad de insuficiencia cardíaca congestiva, hipotensión grave o exacerbación de angina en pacientes con enfermedad cardiovascular. Se recomienda vigilancia clínica y se debe considerar un ajuste de dosis de nifedipina.
Timolol: Es más probable que ocurra hipotensión si se coadministran antagonistas del calcio dihidropiridínicos, como nifedipino, con timolol.
Bloqueadores alfa1 centrales
Doxazosina: Voluntarios sanos que participaron en un estudio de interacción de dosis múltiples de doxazosina-nifedipina recibieron 2 mg de doxazosina una vez al día, solos o combinados con 20 mg de nifedipina ER dos veces al día. en ausencia de nifedipino, respectivamente. En presencia de doxazosina, el AUC y la Cmax de nifedipina aumentaron en factores de 1,13 y 1,23, respectivamente. En comparación con la monoterapia con nifedipina, la presión arterial fue menor en presencia de doxazosina. Se debe controlar la presión arterial cuando se coadministra doxazosina con nifedipina y se debe considerar la reducción de la dosis de nifedipina.
Digital
Digoxina: La administración simultánea de nifedipino y digoxina puede conducir a una reducción del aclaramiento, lo que resulta en un aumento de las concentraciones plasmáticas de digoxina. Dado que ha habido informes aislados de pacientes con niveles elevados de digoxina, y existe una posible interacción entre la digoxina y Adalat CC, se recomienda controlar los niveles de digoxina al iniciar, ajustar y suspender Adalat 10 mg CC para evitar posibles niveles excesivos o insuficientes. digitalización.
Antitrombóticos
Cumarinas: Ha habido informes raros de aumento del tiempo de protrombina en pacientes que toman anticoagulantes cumarínicos a los que se les administró nifedipina. Sin embargo, la relación con el tratamiento con nifedipina es incierta.
Inhibidores de la agregación plaquetaria
Clopidogrel: No se observaron interacciones farmacodinámicas clínicamente significativas cuando se coadministró clopidrogrel con nifedipina.
tirofibán: La coadministración de nifedipina no alteró de manera importante la exposición a tirofibán.
Otro
Diuréticos, inhibidores de la PDE5, alfa-metildopa: La nifedipina puede aumentar el efecto reductor de la presión arterial de estos agentes administrados de forma concomitante.
Medicamentos no cardiovasculares
Medicamentos antimicóticos
Ketoconazol, itraconazol y fluconazol son inhibidores de CYP3A y pueden inhibir el metabolismo de nifedipina y aumentar la exposición a nifedipina durante la terapia concomitante. Se debe controlar la presión arterial y considerar una reducción de la dosis de nifedipina.
Fármacos antisecretores
Omeprazol: En voluntarios sanos que recibieron una dosis única de 10 mg de nifedipina, el AUC y la Cmax de nifedipina después del pretratamiento con 20 mg de omeprazol una vez al día durante 8 días fueron 1,26 y 0,87 veces mayores que después del pretratamiento con placebo. El pretratamiento o la coadministración de omeprazol no afectó el efecto de la nifedipina sobre la presión arterial o la frecuencia cardíaca. No es probable que el impacto del omeprazol sobre la nifedipina tenga relevancia clínica.
Pantoprazol: En voluntarios sanos, la exposición a ningún fármaco cambió significativamente en presencia del otro fármaco.
ranitidina: Cinco estudios en voluntarios sanos investigaron el impacto de múltiples dosis de ranitidina en la farmacocinética de dosis única o múltiple de nifedipina. Dos estudios investigaron el impacto de la ranitidina coadministrada sobre la presión arterial en sujetos hipertensos que tomaban nifedipina. La coadministración de ranitidina no tuvo efectos relevantes sobre la exposición a nifedipina que afectó la presión arterial o la frecuencia cardíaca en sujetos normotensos o hipertensos.
Cimetidina: Cinco estudios en voluntarios sanos investigaron el impacto de dosis múltiples de cimetidina en la farmacocinética de dosis única o múltiple de nifedipina. Dos estudios investigaron el impacto de la coadministración de cimetidina sobre la presión arterial en sujetos hipertensos tratados con nifedipino. En sujetos normotensos que recibieron dosis únicas de 10 mg o dosis múltiples de hasta 20 mg tres veces al día de nifedipino solo o junto con cimetidina hasta 1000 mg/día, los valores de AUC de nifedipino en presencia de cimetidina fueron entre 1,52 y 2,01 veces mayores que los del grupo. ausencia de cimetidina. Los valores de Cmax de nifedipino en presencia de cimetidina aumentaron por factores que oscilaron entre 1,60 y 2,02. El aumento de la exposición a la nifedipina por parte de la cimetidina se acompañó de cambios relevantes en la presión arterial o la frecuencia cardiaca en sujetos normotensos. Los sujetos hipertensos que recibieron 10 mg una vez al día de nifedipina sola o en combinación con cimetidina 1000 mg una vez al día también experimentaron cambios importantes en la presión arterial cuando se agregó cimetidina a la nifedipina. La interacción entre cimetidina y nifedipino tiene relevancia clínica y se debe controlar la presión arterial y considerar una reducción de la dosis de nifedipino.
Cisaprida: La administración simultánea de cisaprida y nifedipina puede aumentar las concentraciones plasmáticas de nifedipina.
Medicamentos antibacterianos
Quinupristina/Dalfopristina: Los estudios de interacción farmacológica in vitro han demostrado que la quinupristina/dalfopristina inhibe significativamente el metabolismo CYP3A de la nifedipina. La administración concomitante de quinupristina/dalfopristina y nifedipina (dosis oral repetida) en voluntarios sanos aumentó el AUC y la Cmax de nifedipina en factores de 1,44 y 1,18, respectivamente, en comparación con la monoterapia con nifedipina. Tras la coadministración de quinupristina/dalfopristina con nifedipina, se debe controlar la presión arterial y se debe considerar una reducción de la dosis de nifedipina.
Eritromicina: La eritromicina, un inhibidor de CYP3A, puede inhibir el metabolismo de la nifedipina y aumentar la exposición a la nifedipina durante la terapia concomitante. Se debe controlar la presión arterial y considerar la reducción de la dosis de nifedipino.
Fármacos antituberculosos
Rifampicina: Los inductores potentes de CYP3A, como la rifampicina, la rifapentina y la rifabutina, reducen la biodisponibilidad de la nifedipina, lo que puede reducir la eficacia de la nifedipina; por lo tanto, la nifedipina no debe usarse en combinación con inductores potentes de CYP3A como la rifampicina (ver CONTRAINDICACIONES ). En un estudio clínico se evaluó el impacto de múltiples dosis orales de 600 mg de rifampicina sobre la farmacocinética de nifedipina después de una dosis oral única de 20 mg de nifedipina en cápsula. Doce voluntarios varones sanos recibieron una dosis oral única de 20 mg de nifedipina en cápsulas el día 1 del estudio. A partir del día 2 del estudio, los sujetos recibieron 600 mg de rifampicina una vez al día durante 14 días. El día 15 del estudio, se administró una segunda dosis oral única de 20 mg de cápsula de nifedipina junto con la última dosis de rifampicina. En comparación con el día 1 del estudio, el pretratamiento de 14 días con rifampicina redujo la Cmax y el AUC de la nifedipina administrada concomitantemente en un promedio de 95 % y 97 %, respectivamente.

Medicamentos Antivirales
Amprenavir, atanazavir, delavirina, fosamprinavir, indinavir, nelfinavir y ritonavir, como inhibidores de CYP3A, pueden inhibir el metabolismo de nifedipino y aumentar la exposición a nifedipino. Se recomienda precaución y se recomienda el control clínico de los pacientes.
Fármacos del SNC
La nefazodona, un inhibidor de CYP3A, puede inhibir el metabolismo de la nifedipina y aumentar la exposición a la nifedipina durante la terapia concomitante. Se debe controlar la presión arterial y considerar una reducción de la dosis de nifedipino.
La fluoxetina, un inhibidor de CYP3A, puede inhibir el metabolismo de la nifedipina y aumentar la exposición a la nifedipina durante la terapia concomitante. Se debe controlar la presión arterial y considerar una reducción de la dosis de nifedipino.
El ácido valproico puede aumentar la exposición a la nifedipina durante la terapia concomitante. Se debe controlar la presión arterial y considerar una reducción de la dosis de nifedipino.
Fenitoína, fenobarbital y carbamazepina: La nifedipina es metabolizada por CYP3A. La coadministración de una cápsula de nifedipina de 10 mg y una tableta con núcleo de nifedipina de 60 mg con fenitoína, un inductor de CYP3A, redujo el AUC y la Cmax de nifedipina en aproximadamente un 70 %. El fenobarbital y la carbamazepina también son inductores de CYP3A. Se debe considerar una terapia antihipertensiva alternativa en pacientes que toman fenitoína, fenobarbital y carbamazepina.
Medicamentos antieméticos
Dolasetrón: En pacientes que tomaban dolasetrón por vía oral o intravenosa y nifedipina, no se observó ningún efecto sobre el aclaramiento de hidrodolasetrón.
Medicamentos inmunosupresores
Tacrolimus: Se ha demostrado que el tacrolimus se metaboliza a través del sistema CYP3A. Se ha demostrado que la nifedipina inhibe el metabolismo de tacrolimus in vitro. Los pacientes trasplantados con tacrolimus y nifedipina necesitaron dosis entre un 26 % y un 38 % más pequeñas que los pacientes que no recibieron nifedipina. La nifedipina puede aumentar la exposición a tacrolimus. Cuando se coadministra nifedipino con tacrolimus, se deben controlar las concentraciones sanguíneas de tacrolimus y se debe considerar una reducción de la dosis de tacrolimus.
Sirolimus: Se administró una dosis única de 60 mg de nifedipino y una dosis única de 10 mg de solución oral de sirolimus a 24 voluntarios sanos. No se observaron interacciones medicamentosas farmacocinéticas clínicamente significativas.
Medicamentos para bajar la glucosa
Pioglitazona: La coadministración de pioglitazona durante 7 días con 30 mg de nifedipina ER administrada por vía oral una vez al día durante 4 días a voluntarios masculinos y femeninos dio como resultado valores medios mínimos cuadrados (90 % IC) para la nifedipina sin cambios de 0,83 (0,73-0,95) para Cmax y 0,88 ( 0,80-0,96) para el AUC en relación con la monoterapia con nifedipina. En vista de la gran variabilidad de la farmacocinética de nifedipino, se desconoce el significado clínico de este hallazgo.
Rosiglitazona: Se demostró que la coadministración de rosiglitazona (4 mg dos veces al día) no tiene un efecto clínicamente relevante sobre la farmacocinética de la nifedipina.
Metformina: Un estudio de interacción de dosis única de metformina-nifedipina en voluntarios sanos normales demostró que la administración conjunta de nifedipina aumentó la Cmax y el AUC de metformina en plasma en un 20 % y un 9 %, respectivamente, y aumentó la cantidad de metformina excretada en la orina. Tmax y la vida media no se vieron afectados. La nifedipina parece mejorar la absorción de la metformina.
Miglitol: No se observó ningún efecto de miglitol sobre la farmacocinética y farmacodinámica de nifedipino.
Repaglinida: La coadministración de 10 mg de nifedipina con una dosis única de 2 mg de repaglinida (después de 4 días de nifedipina 10 mg tres veces al día y repaglinida 2 mg tres veces al día) dio como resultado valores de AUC y Cmax sin cambios para ambos fármacos.
Acarbosa: La nifedipina tiende a producir hiperglucemia y puede conducir a la pérdida del control de la glucosa. Si se coadministra nifedipina con acarbosa, se deben controlar cuidadosamente los niveles de glucosa en sangre y se debe considerar un ajuste de la dosis de nifedipina.
Fármacos que interfieren con la absorción de alimentos
Orlistat: En 17 sujetos de peso normal que recibieron orlistat 120 mg tres veces al día durante 6 días, orlistat no alteró la biodisponibilidad de 60 mg de nifedipina (tabletas de liberación prolongada).
Suplementos dietéticos
Jugo de uva: En voluntarios sanos, la coadministración de una dosis única de 250 ml de jugo de toronja de doble concentración con 10 mg de nifedipina aumentó el AUC y la Cmax en factores de 1,35 y 1,13, respectivamente. La ingestión de dosis repetidas de jugo de toronja (5 x 200 ml en 12 horas) después de la administración de 20 mg de nifedipina ER aumentó el AUC y la Cmax de nifedipina en un factor de 2. Los pacientes que toman nifedipina deben evitar el jugo de toronja. La ingesta de jugo de toronja debe suspenderse al menos 3 días antes de iniciar a los pacientes con nifedipina.
Hierbas
Hierba de San Juan: La hierba de San Juan es un inductor de CYP3A y puede disminuir la exposición a la nifedipina. Se debe considerar una terapia antihipertensiva alternativa en pacientes en los que sea necesaria la terapia con la hierba de San Juan.
Medicamento de sonda CYP2D6
Debrisoquina: En voluntarios sanos, el pretratamiento con nifedipina 20 mg tres veces al día durante 5 días no cambió la proporción metabólica de hidroxidebrisoquina a detritoquina medida en la orina después de una dosis única de 10 mg de detritoquina. Por lo tanto, es improbable que la nifedipina inhiba in vivo el metabolismo de otros fármacos que son sustratos de CYP2D6.
ADVERTENCIAS
Hipotensión excesiva
Aunque en la mayoría de los pacientes el efecto hipotensor de la nifedipina es modesto y bien tolerado, algunos pacientes han tenido hipotensión excesiva y mal tolerada. Estas respuestas generalmente ocurrieron durante la titulación inicial o en el momento del ajuste posterior de la dosis y pueden ser más probables en pacientes que usan betabloqueantes concomitantes.
Se han notificado casos de hipotensión grave y/o aumento de los requisitos de volumen de líquidos en pacientes que recibieron cápsulas de liberación inmediata junto con un agente betabloqueante y que se sometieron a una cirugía de derivación de la arteria coronaria utilizando anestesia con dosis altas de fentanilo. La interacción con dosis altas de fentanilo parece deberse a la combinación de nifedipino y un betabloqueante, pero no se puede descartar la posibilidad de que pueda ocurrir con nifedipino solo, con dosis bajas de fentanilo, en otros procedimientos quirúrgicos o con otros analgésicos narcóticos. descartado En los pacientes tratados con nifedipino en los que se contempla la cirugía con dosis altas de fentanilo, el médico debe ser consciente de estos posibles problemas y, si el estado del paciente lo permite, se debe dejar pasar suficiente tiempo (al menos 36 horas) para que el nifedipino se elimine por lavado. el cuerpo antes de la cirugía.
Angina aumentada y/o infarto de miocardio
En raras ocasiones, los pacientes, particularmente aquellos que tienen enfermedad arterial coronaria obstructiva grave, han desarrollado un aumento bien documentado de la frecuencia, duración y/o gravedad de angina o infarto agudo de miocardio al comenzar con nifedipino o en el momento del aumento de la dosis. El mecanismo de este efecto no está establecido.
Retiro del bloqueador beta
Cuando se suspende un betabloqueante, es importante disminuir la dosis, si es posible, en lugar de detenerse abruptamente antes de comenzar con la nifedipina. Los pacientes a los que se les suspendió recientemente el tratamiento con bloqueadores beta pueden desarrollar un síndrome de abstinencia con aumento de la angina, probablemente relacionado con una mayor sensibilidad a las catecolaminas. El inicio del tratamiento con nifedipino no evitará que esto ocurra y, en ocasiones, se ha informado que lo aumenta.
Insuficiencia cardíaca congestiva
En raras ocasiones, los pacientes (generalmente mientras reciben un bloqueador beta) han desarrollado insuficiencia cardíaca después de comenzar con nifedipina. Los pacientes con estenosis aórtica estrecha pueden correr un mayor riesgo de tal evento, ya que se esperaría que el efecto de descarga de la nifedipina fuera de menor beneficio para estos pacientes, debido a su impedancia fija para fluir a través de la válvula aórtica.
PRECAUCIONES
General
Hipotensión
Debido a que la nifedipina disminuye la resistencia vascular periférica, se sugiere un control cuidadoso de la presión arterial durante la administración inicial y la titulación de Adalat CC. Se recomienda especialmente una estrecha observación para los pacientes que ya toman medicamentos que se sabe que reducen la presión arterial (ver ADVERTENCIAS ).
Edema periférico
El edema periférico de leve a moderado ocurre de manera dependiente de la dosis con Adalat CC. La tasa de sustracción del placebo es de aproximadamente 8 % con 30 mg, 12 % con 60 mg y 19 % con 90 mg al día. Este edema es un fenómeno localizado, que se cree que está asociado con la vasodilatación de las arteriolas dependientes y los vasos sanguíneos pequeños y no se debe a una disfunción del ventrículo izquierdo o una retención generalizada de líquidos. Con pacientes cuya hipertensión se complica con insuficiencia cardíaca congestiva, se debe tener cuidado para diferenciar este edema periférico de los efectos del aumento de la disfunción ventricular izquierda.
Uso en pacientes cirróticos
El aclaramiento de nifedipina se reduce y la exposición sistémica aumenta en pacientes con cirrosis. Se desconoce cómo se puede alterar la exposición sistémica en pacientes con insuficiencia hepática moderada o grave. Puede ser necesario un control cuidadoso y una reducción de la dosis; considere iniciar la terapia con la dosis más baja disponible.
Pruebas de laboratorio
Se han observado elevaciones raras, generalmente transitorias, pero ocasionalmente significativas de enzimas como la fosfatasa alcalina, CPK, LDH, SGOT y SGPT. La relación con el tratamiento con nifedipina es incierta en la mayoría de los casos, pero probable en algunos. Estas anomalías de laboratorio rara vez se han asociado con síntomas clínicos; sin embargo, se ha informado colestasis con o sin ictericia. Se observó un pequeño aumento (
La nifedipina, al igual que otros bloqueadores de los canales de calcio, disminuye la agregación plaquetaria in vitro. Estudios clínicos limitados han demostrado una disminución moderada pero estadísticamente significativa en la agregación plaquetaria y un aumento en el tiempo de sangrado en algunos pacientes con nifedipina. Se cree que esto es una función de la inhibición del transporte de calcio a través de la membrana plaquetaria. No se ha demostrado la importancia clínica de estos hallazgos.
Se ha informado una prueba de Coombs directa positiva con o sin anemia hemolítica, pero no se pudo determinar una relación causal entre la administración de nifedipina y la positividad de esta prueba de laboratorio, incluida la hemólisis.
Aunque la nifedipina se ha utilizado de forma segura en pacientes con disfunción renal y se ha informado que ejerce un efecto beneficioso en ciertos casos, rara vez se han informado elevaciones reversibles del BUN y la creatinina sérica en pacientes con insuficiencia renal crónica preexistente. La relación con el tratamiento con nifedipina es incierta en la mayoría de los casos, pero probable en algunos.
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
La nifedipina se administró por vía oral a ratas durante dos años y no se demostró que fuera cancerígena. Cuando se administró a ratas antes del apareamiento, la nifedipina redujo la fertilidad en una dosis de aproximadamente 30 veces la dosis máxima recomendada en humanos. Hay un informe de la literatura de reducción reversible en la capacidad de los espermatozoides humanos obtenidos de un número limitado de hombres infértiles que toman las dosis recomendadas de nifedipina para unirse y fertilizar un óvulo in vitro. Los estudios de mutagenicidad in vivo fueron negativos.
El embarazo
Embarazo Categoría C
En roedores, conejos y monos, se ha demostrado que la nifedipina tiene una variedad de efectos embriotóxicos, placentotóxicos, teratogénicos y fetotóxicos, que incluyen fetos atrofiados (ratas, ratones y conejos), anomalías digitales (ratas y conejos), deformidades de las costillas (ratones), paladar hendido (ratones), placentas pequeñas y vellosidades coriónicas subdesarrolladas (monos), muertes embrionarias y fetales (ratas, ratones y conejos), embarazo prolongado (ratas; no evaluado en otras especies) y disminución de la supervivencia neonatal (ratas; no evaluado en otras especies). otras especies). Sobre la base de mg/kg o mg/m², algunas de las dosis asociadas con estos diversos efectos son más altas que la dosis humana máxima recomendada y algunas son más bajas, pero todas están dentro de un orden de magnitud de la misma.
Las anomalías digitales que se observan en las crías de conejo expuestas a la nifedipina son sorprendentemente similares a las que se observan en las crías expuestas a la fenitoína y, a su vez, son similares a las deformidades de las falanges, que son las malformaciones más comunes que se observan en los niños humanos expuestos a la fenitoína en el útero.
A partir de la evidencia clínica disponible, no se ha identificado un riesgo prenatal específico. Sin embargo, se ha informado un aumento de la asfixia perinatal, el parto por cesárea, la prematuridad y el retraso del crecimiento intrauterino.
Se debe realizar un control cuidadoso de la presión arterial en mujeres embarazadas cuando se administre nifedipina en combinación con sulfato de magnesio IV debido a la posibilidad de una caída excesiva de la presión arterial que podría dañar a la madre y al feto.
No existen estudios adecuados y bien controlados en mujeres embarazadas.
Madres lactantes
La nifedipina se excreta en la leche humana. Se aconseja a las madres lactantes que no amamanten a sus bebés mientras toman el medicamento.
Uso pediátrico
No se ha establecido la seguridad y eficacia de Adalat 30 mg CC en pacientes pediátricos.
Uso geriátrico
Aunque pequeños estudios farmacocinéticos han identificado un aumento de la vida media y un aumento de Cmax y AUC (Ver FARMACOLOGÍA CLÍNICA : Farmacocinética y Metabolismo ), los estudios clínicos de nifedipino no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes. Otra experiencia clínica informada no ha identificado diferencias en las respuestas entre los ancianos y los pacientes más jóvenes. En general, la selección de la dosis para un paciente de edad avanzada debe ser cautelosa, generalmente comenzando en el extremo inferior del rango de dosificación, lo que refleja la mayor frecuencia de disminución de la función hepática, renal o cardíaca, y de enfermedades concomitantes u otra terapia con medicamentos.
Pacientes con intolerancia a la galactosa
Dado que este medicamento contiene lactosa, los pacientes con problemas hereditarios raros de intolerancia a la galactosa, deficiencia de lactasa de Lapp o malabsorción de glucosa o galactosa no deben tomar este medicamento.
SOBREDOSIS
La experiencia con la sobredosis de nifedipina es limitada. Los síntomas asociados con una sobredosis grave de nifedipina incluyen pérdida del conocimiento, disminución de la presión arterial, alteraciones del ritmo cardíaco, acidosis metabólica, hipoxia, shock cardiogénico con edema pulmonar. En general, la sobredosis de nifedipino que conduce a una hipotensión pronunciada exige un soporte cardiovascular activo que incluya el control de la función cardiovascular y respiratoria, la elevación de las extremidades, el uso juicioso de la infusión de calcio, los agentes presores y los líquidos. Después de la ingestión oral, está indicado un lavado gástrico completo, si es necesario en combinación con la irrigación del intestino delgado. En los casos de sobredosis de un producto de liberación lenta como el nifedipino, la eliminación debe ser lo más completa posible, incluso desde el intestino delgado, para evitar la posterior absorción del principio activo. El líquido o volumen adicional debe administrarse con precaución debido al riesgo de sobrecarga de líquidos.
Se esperaría que la depuración de nifedipina se prolongue en pacientes con insuficiencia hepática. Dado que la nifedipina se une en gran medida a las proteínas, es poco probable que la diálisis sea beneficiosa; sin embargo, la plasmaféresis puede ser beneficiosa.
Ha habido un caso informado de sobredosis masiva con tabletas de otra formulación de liberación prolongada de nifedipina. Los principales efectos de la ingestión de aproximadamente 4800 mg de nifedipina en un hombre joven que intentó suicidarse como resultado de la depresión inducida por la cocaína fueron mareos iniciales, palpitaciones, sofocos y nerviosismo. Varias horas después de la ingestión, se desarrollaron náuseas, vómitos y edema generalizado. No se apreció hipotensión significativa en la presentación, 18 horas después de la ingestión. Las anormalidades de la química sanguínea consistieron en una elevación leve y transitoria de la creatinina sérica y elevaciones modestas de LDH y CPK, pero SGOT normal. Los signos vitales se mantuvieron estables, no se observaron anomalías electrocardiográficas y la función renal volvió a la normalidad en un plazo de 24 a 48 horas solo con las medidas de apoyo de rutina. No se observaron secuelas prolongadas.
El efecto de una sola ingestión de 900 mg de cápsulas de nifedipina en un paciente con angina deprimida que tomaba antidepresivos tricíclicos fue la pérdida del conocimiento dentro de los 30 minutos posteriores a la ingestión e hipotensión profunda, que respondió a la infusión de calcio, agentes presores y reposición de líquidos. Se observó una variedad de anomalías en el ECG en este paciente con antecedentes de bloqueo de rama del haz de His, incluida la bradicardia sinusal y diversos grados de bloqueo AV. Estos dictaron la colocación profiláctica de un marcapasos ventricular temporal, pero por lo demás se resolvieron espontáneamente. Inicialmente se observó hiperglucemia significativa en este paciente, pero los niveles de glucosa en plasma se normalizaron rápidamente sin tratamiento adicional.
Un paciente joven hipertenso con insuficiencia renal avanzada ingirió 280 mg de cápsulas de nifedipino de una sola vez, con una marcada hipotensión resultante que respondió a la infusión de calcio y líquidos. No se observaron anomalías en la conducción AV, arritmias o cambios pronunciados en la frecuencia cardíaca, ni hubo un mayor deterioro de la función renal.
Las alteraciones bradicardiacas del ritmo cardiaco pueden tratarse sintomáticamente con ß-simpaticomiméticos, y en caso de alteraciones bradicardiacas del ritmo cardiaco que pongan en peligro la vida, puede ser recomendable la terapia temporal con marcapasos.
CONTRAINDICACIONES
La administración concomitante con inductores potentes de P450, como la rifampicina, está contraindicada ya que la eficacia de los comprimidos de nifedipino podría reducirse significativamente. (Ver INTERACCIONES CON LA DROGAS )
El nifedipino no debe utilizarse en casos de shock cardiogénico.
Adalat está contraindicado en pacientes con hipersensibilidad conocida a cualquier componente de la tableta.
FARMACOLOGÍA CLÍNICA
La nifedipina es un inhibidor de la entrada de iones de calcio (bloqueador de canales lentos o antagonista de los iones de calcio) que inhibe la entrada de iones de calcio a través de la membrana en el músculo liso vascular y el músculo cardíaco. Los procesos contráctiles del músculo liso vascular y del músculo cardíaco dependen del movimiento de iones de calcio extracelulares hacia el interior de estas células a través de canales iónicos específicos. La nifedipina inhibe selectivamente la entrada de iones de calcio a través de la membrana celular del músculo liso vascular y el músculo cardíaco sin alterar las concentraciones séricas de calcio.
Mecanismo de acción
El mecanismo por el cual la nifedipina reduce la presión arterial implica la vasodilatación arterial periférica y, en consecuencia, una reducción de la resistencia vascular periférica. El aumento de la resistencia vascular periférica, una causa subyacente de la hipertensión, resulta de un aumento de la tensión activa en el músculo liso vascular. Los estudios han demostrado que el aumento de la tensión activa refleja un aumento del calcio libre citosólico.
El nifedipino es un vasodilatador arterial periférico que actúa directamente sobre el músculo liso vascular. La unión de nifedipina a canales dependientes de voltaje y posiblemente operados por receptores en el músculo liso vascular da como resultado una inhibición de la entrada de calcio a través de estos canales. Las reservas de calcio intracelular en el músculo liso vascular son limitadas y, por lo tanto, dependen de la entrada de calcio extracelular para que se produzca la contracción. La reducción de la entrada de calcio por la nifedipina provoca vasodilatación arterial y disminución de la resistencia vascular periférica, lo que da como resultado una reducción de la presión arterial.
Farmacocinética y Metabolismo
La nifedipina se absorbe completamente después de la administración oral. La biodisponibilidad de la nifedipina como Adalat CC en relación con la nifedipina de liberación inmediata está en el rango de 84% a 89%. Después de la ingestión de las tabletas de Adalat CC en ayunas, las concentraciones plasmáticas alcanzan su punto máximo alrededor de las 2,5 a 5 horas con un segundo pico pequeño u hombro evidente aproximadamente a las 6 a 12 horas después de la dosis. La vida media de eliminación de la nifedipina administrada como Adalat CC es de aproximadamente 7 horas en contraste con la vida media de eliminación conocida de 2 horas de la nifedipina administrada como una cápsula de liberación inmediata.
Cuando Adalat CC se administra en múltiplos de comprimidos de 30 mg en un rango de dosis de 30 mg a 90 mg, el área bajo la curva (AUC) es proporcional a la dosis; sin embargo, la concentración plasmática máxima para la dosis de 90 mg administrada como 3 x 30 mg es un 29 % mayor que la prevista para las dosis de 30 mg y 60 mg.
Se pueden intercambiar dos comprimidos de Adalat CC de 30 mg por un comprimido de Adalat CC de 60 mg. Sin embargo, tres comprimidos de Adalat CC de 30 mg dan como resultado valores de Cmax sustancialmente más altos que los obtenidos después de un único comprimido de Adalat CC de 90 mg y 20 mg. Por lo tanto, tres comprimidos de 30 mg no deben considerarse intercambiables con un comprimido de 90 mg.
La dosificación una vez al día de Adalat CC en condiciones de ayuno da como resultado una disminución de las fluctuaciones en la concentración plasmática de nifedipina en comparación con la dosificación tres veces al día con cápsulas de nifedipina de liberación inmediata. La concentración plasmática máxima media de nifedipino después de un comprimido de 90 mg de Adalat 30 mg CC, administrado en ayunas, es de aproximadamente 115 ng/ml. Cuando Adalat CC se administra inmediatamente después de una comida rica en grasas en voluntarios sanos, se produce un aumento promedio del 60 % en la concentración plasmática máxima de nifedipina, una prolongación en el tiempo hasta la concentración máxima, pero ningún cambio significativo en el AUC. Las concentraciones plasmáticas de nifedipina cuando se toma Adalat 20 mg CC después de una comida grasosa dan como resultado picos ligeramente más bajos en comparación con la misma dosis diaria de la formulación de liberación inmediata administrada en tres dosis divididas. Esto puede deberse, en parte, a que Adalat CC es menos biodisponible que la formulación de liberación inmediata.
La nifedipina se metaboliza ampliamente a metabolitos inactivos altamente solubles en agua que representan del 60% al 80% de la dosis excretada en la orina. Solo se pueden detectar trazas (menos del 0,1% de la dosis) de la forma inalterada en la orina. El resto se excreta en las heces en forma metabolizada, muy probablemente como resultado de la excreción biliar.
La nifedipina se metaboliza a través del sistema del citocromo P450 3A4. Los fármacos que se sabe que inhiben o inducen este sistema enzimático pueden alterar el primer paso o la depuración de nifedipina.
No se han realizado estudios con Adalat 30 mg CC en pacientes con insuficiencia renal; sin embargo, no se han informado alteraciones significativas en la farmacocinética de las cápsulas de liberación inmediata de nifedipina en pacientes sometidos a hemodiálisis o diálisis peritoneal ambulatoria crónica. Dado que la absorción de nifedipina de Adalat CC podría verse modificada por la enfermedad renal, se debe tener precaución al tratar a estos pacientes.
Debido a que la nifedipina se metaboliza a través del sistema del citocromo P450 3A4, su farmacocinética puede verse alterada en pacientes con enfermedad hepática crónica. Adalat 20 mg CC no se ha estudiado en pacientes con enfermedad hepática; sin embargo, en pacientes con insuficiencia hepática (cirrosis hepática), la nifedipina tiene una vida media de eliminación más prolongada y una mayor biodisponibilidad que en voluntarios sanos.
El grado de unión a proteínas de la nifedipina es alto (92%-98%). La unión a proteínas puede verse muy reducida en pacientes con insuficiencia renal o hepática.
Después de la administración de Adalat 30 mg CC a hombres y mujeres ancianos sanos (edad > 60 años), la Cmáx media es un 36 % superior y la concentración plasmática media es un 70 % superior que en pacientes más jóvenes.
En sujetos sanos, la vida media de eliminación de una formulación diferente de nifedipino de liberación sostenida fue más prolongada en sujetos de edad avanzada (6,7 h) en comparación con sujetos jóvenes (3,8 h) después de la administración oral. También se observó una disminución del aclaramiento en ancianos (348 ml/min) en comparación con sujetos jóvenes (519 ml/min) después de la administración intravenosa.
La administración concomitante de nifedipino con jugo de toronja produce un aumento de hasta dos veces en el AUC y la Cmax debido a la inhibición del metabolismo de primer paso relacionado con CYP3A. Se debe evitar la ingestión de pomelo y jugo de pomelo mientras se toma nifedipina.
Estudios clínicos
Adalat CC de 10 mg produjo disminuciones relacionadas con la dosis en la presión arterial sistólica y diastólica, como se demostró en dos ensayos doble ciego, aleatorizados y controlados con placebo en los que se trató a más de 350 pacientes con Adalat CC de 30, 60 o 90 mg una vez al día durante 6 semanas. En el primer estudio, Adalat 10 mg CC se administró como monoterapia y en el segundo estudio, Adalat 20 mg CC se agregó a un betabloqueante en pacientes que no estaban controlados con un betabloqueante solo. Los resultados medios de la presión arterial mínima (24 horas después de la dosis) de estos estudios se muestran a continuación:
REDUCCIONES MEDIAS EN LA PRESIÓN ARTERIAL SUPINA MÍNIMA (mmHg) SISTÓLICA/DIASTÓLICA
Las proporciones mínima/máxima estimadas a partir de la monitorización de la presión arterial durante 24 horas oscilaron entre el 41 % y el 78 % para la presión arterial diastólica y entre el 46 % y el 91 % para la presión arterial sistólica.
hemodinámica
Al igual que otros bloqueadores de los canales lentos, la nifedipina ejerce un efecto inotrópico negativo sobre el tejido miocárdico aislado. Esto rara vez, si es que alguna vez, se ve en animales intactos o en el hombre, probablemente debido a las respuestas reflejas a sus efectos vasodilatadores. En el hombre, la nifedipina disminuye la resistencia vascular periférica, lo que conduce a una caída de las presiones sistólica y diastólica, normalmente mínima en voluntarios normotensos (menos de 5-10 mm Hg sistólica), pero a veces mayor. Con Adalat 30 mg CC, estas disminuciones de la presión arterial no van acompañadas de ningún cambio significativo en la frecuencia cardíaca. Los estudios hemodinámicos de la formulación de nifedipina de liberación inmediata en pacientes con función ventricular normal generalmente han encontrado un pequeño aumento en el índice cardíaco sin efectos importantes sobre la fracción de eyección, la presión diastólica final del ventrículo izquierdo (PTVI) o el volumen (LVEDV). En pacientes con deterioro de la función ventricular, la mayoría de los estudios agudos han mostrado cierto aumento en la fracción de eyección y reducción en la presión de llenado del ventrículo izquierdo.
Efectos electrofisiológicos
Aunque, al igual que otros miembros de su clase, la nifedipina causa una ligera depresión de la función del nódulo sinoauricular y la conducción auriculoventricular en preparaciones miocárdicas aisladas, tales efectos no se han observado en estudios en animales intactos o en humanos. En estudios electrofisiológicos formales, predominantemente en pacientes con sistemas de conducción normales, la nifedipina administrada como cápsula de liberación inmediata no ha tenido tendencia a prolongar la conducción auriculoventricular o el tiempo de recuperación del nódulo sinusal, ni a disminuir la frecuencia sinusal.
INFORMACIÓN DEL PACIENTE
Adalat CC es una tableta de liberación prolongada y debe tragarse entera y con el estómago vacío. No debe administrarse con alimentos. No mastique, divida ni triture las tabletas.
