Cozaar 25mg, 50mg, 100mg Losartan Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Cozaar 50 mg y cómo se usa?
Cozaar es un medicamento recetado que se usa para tratar los síntomas de la presión arterial alta (hipertensión), reducir el riesgo de accidente cerebrovascular en ciertas personas con enfermedades cardíacas y dolor nervioso diabético (neuropatía). Cozaar 100 mg se puede usar solo o con otros medicamentos.
Cozaar 25 mg pertenece a una clase de medicamentos llamados antagonistas del receptor de angiotensina II (ARB).
No se sabe si Cozaar 25 mg es seguro y eficaz en niños menores de 6 años.
¿Cuáles son los posibles efectos secundarios de Cozaar 100 mg?
Cozaar 100 mg puede causar efectos secundarios graves, que incluyen:
- aturdimiento,
- dolor o ardor al orinar,
- náuseas,
- debilidad,
- sensación de hormigueo,
- Dolor de pecho,
- latidos irregulares del corazón,
- pérdida de movimientos,
- orinar poco o nada,
- rápido aumento de peso, y
- hinchazón en las manos, los pies o los tobillos
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Cozaar incluyen:
- mareo,
- dolor de espalda, y
- síntomas de resfriado (nariz tapada, estornudos, dolor de garganta)
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Cozaar. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
ADVERTENCIA
TOXICIDAD FETAL
Cuando se detecte un embarazo, suspenda COZAAR tan pronto como sea posible. Los medicamentos que actúan directamente sobre el sistema renina-angiotensina pueden causar lesiones y la muerte del feto en desarrollo [ver ADVERTENCIAS Y PRECAUCIONES ].
DESCRIPCIÓN
COZAAR (losartan potásico) es un bloqueador del receptor de angiotensina II que actúa sobre el subtipo de receptor AT1. El losartán potásico, una molécula no peptídica, se describe químicamente como sal monopotásica de 2-butil-4-cloro-1-[p-(o-1H-tetrazol-5-ilfenil)bencil]imidazol-5-metanol.
Su fórmula empírica es C22H22ClKN6O, y su fórmula estructural es:
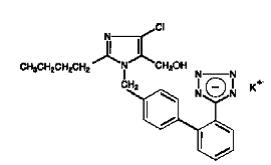
El losartán potásico es un polvo cristalino de flujo libre de color blanco a blanquecino con un peso molecular de 461,01. Es totalmente soluble en agua, soluble en alcoholes y ligeramente soluble en solventes orgánicos comunes, como acetonitrilo y metiletilcetona. La oxidación del grupo 5-hidroximetilo en el anillo de imidazol da como resultado el metabolito activo de losartán.
COZAAR 100 mg está disponible en comprimidos para administración oral que contienen 25 mg, 50 mg o 100 mg de losartán potásico y los siguientes ingredientes inactivos: celulosa microcristalina, lactosa hidratada, almidón pregelatinizado, estearato de magnesio, hidroxipropilcelulosa, hipromelosa y dióxido de titanio.
Los comprimidos de COZAAR de 25 mg, 50 mg y 100 mg contienen potasio en las siguientes cantidades: 2,12 mg (0,054 mEq), 4,24 mg (0,108 mEq) y 8,48 mg (0,216 mEq), respectivamente. COZAAR 25 mg, COZAAR 50 mg y COZAAR 100 mg también pueden contener cera de carnauba.
INDICACIONES
Hipertensión
COZAAR® está indicado para el tratamiento de la hipertensión en adultos y pacientes pediátricos mayores de 6 años, para disminuir la presión arterial. Reducir la presión arterial reduce el riesgo de eventos cardiovasculares (CV) fatales y no fatales, principalmente accidentes cerebrovasculares e infarto de miocardio. Estos beneficios se han observado en ensayos controlados de fármacos antihipertensivos de una amplia variedad de clases farmacológicas, incluido losartán.
El control de la presión arterial alta debe ser parte del manejo integral del riesgo cardiovascular, incluido, según corresponda, el control de los lípidos, el manejo de la diabetes, la terapia antitrombótica, el abandono del hábito de fumar, el ejercicio y la ingesta limitada de sodio. Muchos pacientes requerirán más de 1 fármaco para lograr los objetivos de presión arterial. Para obtener consejos específicos sobre objetivos y manejo, consulte las pautas publicadas, como las del Comité Nacional Conjunto sobre Prevención, Detección, Evaluación y Tratamiento de la Presión Arterial Alta (JNC) del Programa Nacional de Educación sobre la Presión Arterial Alta.
Numerosos fármacos antihipertensivos, de una variedad de clases farmacológicas y con diferentes mecanismos de acción, han demostrado en ensayos controlados aleatorios que reducen la morbilidad y mortalidad cardiovascular, y se puede concluir que es la reducción de la presión arterial, y no alguna otra propiedad farmacológica de la medicamentos, eso es en gran parte responsable de esos beneficios. El beneficio de resultado cardiovascular más grande y consistente ha sido una reducción en el riesgo de accidente cerebrovascular, pero también se han observado regularmente reducciones en el infarto de miocardio y la mortalidad cardiovascular.
La presión sistólica o diastólica elevada provoca un aumento del riesgo cardiovascular, y el aumento del riesgo absoluto por mmHg es mayor con presiones arteriales más altas, por lo que incluso las reducciones modestas de la hipertensión grave pueden proporcionar un beneficio sustancial. La reducción del riesgo relativo a partir de la reducción de la presión arterial es similar en poblaciones con riesgo absoluto variable, por lo que el beneficio absoluto es mayor en pacientes que tienen un riesgo más alto independientemente de su hipertensión (por ejemplo, pacientes con diabetes o hiperlipidemia), y se esperaría que dichos pacientes se beneficiaran de un tratamiento más agresivo a una meta de presión arterial más baja.
Algunos medicamentos antihipertensivos tienen efectos menores sobre la presión arterial (como monoterapia) en pacientes de raza negra, y muchos medicamentos antihipertensivos tienen indicaciones y efectos aprobados adicionales (p. ej., angina, insuficiencia cardíaca o enfermedad renal diabética). Estas consideraciones pueden guiar la selección de la terapia.
COZAAR puede administrarse con otros agentes antihipertensivos.
Pacientes hipertensos con hipertrofia ventricular izquierda
COZAAR 25 mg está indicado para reducir el riesgo de accidente cerebrovascular en pacientes con hipertensión e hipertrofia ventricular izquierda, pero existe evidencia de que este beneficio no se aplica a los pacientes de raza negra [ver Uso en poblaciones específicas y FARMACOLOGÍA CLÍNICA ] .
Nefropatía en pacientes diabéticos tipo 2
COZAAR está indicado para el tratamiento de la nefropatía diabética con creatinina sérica elevada y proteinuria (proporción de albúmina a creatinina en orina ≥300 mg/g) en pacientes con diabetes tipo 2 y antecedentes de hipertensión. En esta población, COZAAR 50 mg reduce la tasa de progresión de la nefropatía medida por la aparición de duplicación de la creatinina sérica o enfermedad renal en etapa terminal (necesidad de diálisis o trasplante renal) [ver Estudios clínicos ] .
DOSIFICACIÓN Y ADMINISTRACIÓN
Hipertensión
Hipertensión en adultos
La dosis inicial habitual de COZAAR 50 mg es de 50 mg una vez al día. La dosis se puede aumentar a una dosis máxima de 100 mg una vez al día según sea necesario para controlar la presión arterial [ver Estudios clínicos ] . Se recomienda una dosis inicial de 25 mg para pacientes con posible agotamiento intravascular (p. ej., en tratamiento con diuréticos).
Hipertensión pediátrica
La dosis inicial recomendada habitual es de 0,7 mg por kg una vez al día (hasta un total de 50 mg) administrados en forma de comprimido o suspensión [ver Preparación de suspensión (para 200 ml de una suspensión de 2,5 mg/ml) ] .La dosis debe ajustarse de acuerdo con la respuesta de la presión arterial. Las dosis superiores a 1,4 mg por kg (o superiores a 100 mg) al día no se han estudiado en pacientes pediátricos [ver FARMACOLOGÍA CLÍNICA , Estudios clínicos y ADVERTENCIAS Y PRECAUCIONES ] .
No se recomienda COZAAR en pacientes pediátricos menores de 6 años o en pacientes pediátricos con una tasa de filtración glomerular estimada inferior a 30 ml/min/1,73 m 2 [ver Uso en poblaciones específicas , FARMACOLOGÍA CLÍNICA y Estudios clínicos ] .
Pacientes hipertensos con hipertrofia ventricular izquierda
La dosis inicial habitual es de 50 mg de COZAAR una vez al día. Se debe agregar hidroclorotiazida 12,5 mg al día y/o se debe aumentar la dosis de COZAAR a 100 mg una vez al día seguido de un aumento de hidroclorotiazida a 25 mg una vez al día en función de la respuesta de la presión arterial [ver Estudios clínicos ] .
Nefropatía en pacientes diabéticos tipo 2
La dosis inicial habitual es de 50 mg una vez al día. La dosis debe aumentarse a 100 mg una vez al día en función de la respuesta de la presión arterial [ver Estudios clínicos ] .
Modificaciones de dosis en pacientes con insuficiencia hepática
En pacientes con insuficiencia hepática de leve a moderada, la dosis inicial recomendada de COZAAR es de 25 mg una vez al día. COZAAR no se ha estudiado en pacientes con insuficiencia hepática grave [ver Uso en poblaciones específicas y FARMACOLOGÍA CLÍNICA ] .
Preparación de suspensión (para 200 ml de una suspensión de 2,5 mg/ml)
Agregue 10 ml de agua purificada USP a una botella de tereftalato de polietileno (PET) ámbar de 8 onzas (240 ml) que contiene diez tabletas de COZAAR de 50 mg. Agitar inmediatamente durante al menos 2 minutos. Deje reposar el concentrado durante 1 hora y luego agite durante 1 minuto para dispersar el contenido de la tableta. Prepare por separado una mezcla volumétrica 50/50 de Ora-Plus™ y Ora-Sweet SF™. Agregue 190 mL de la mezcla 50/50 Ora-Plus™/Ora-Sweet SF™ a la tableta y la suspensión de agua en la botella de PET y agite durante 1 minuto para dispersar los ingredientes. La suspensión debe refrigerarse a 2-8 °C (36-46 °F) y puede almacenarse hasta por 4 semanas. Agite la suspensión antes de cada uso y devuélvala inmediatamente al refrigerador.
CÓMO SUMINISTRADO
Formas de dosificación y concentraciones
- COZAAR 100 mg, 25 mg, son comprimidos recubiertos con película de color blanco, ovalados, con el código 951 en una cara.
- COZAAR, 50 mg, son comprimidos recubiertos con película de color blanco, ovalados, con el código 952 en una cara y ranurados en la otra.
- COZAAR 25 mg, 100 mg, son comprimidos recubiertos con película de color blanco, en forma de lágrima, con el código 960 en una cara.
Almacenamiento y manipulación
COZAAR es un comprimido recubierto con película de color blanco que se presenta de la siguiente manera:
Almacenar a 25°C (77°F); excursiones permitidas a 15-30°C (59-86°F) [consulte Temperatura ambiente controlada por USP]. Mantener el contenedor bien cerrado. Proteger de la luz.
Fabricado para: Organon LLC, una subsidiaria de ORGANON & Co., Jersey City, NJ 07302, EE. UU. Revisado: octubre de 2021.
EFECTOS SECUNDARIOS
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se realizan en condiciones muy diversas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas en los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Hipertensión
Se evaluó la seguridad de COZAAR en más de 3300 pacientes adultos tratados por hipertensión esencial y 4058 pacientes/sujetos en general. Más de 1200 pacientes fueron tratados durante más de 6 meses y más de 800 durante más de un año.
El tratamiento con COZAAR 25 mg fue bien tolerado con una incidencia general de eventos adversos similar a la del placebo. En ensayos clínicos controlados, la interrupción de la terapia por eventos adversos ocurrió en el 2,3 % de los pacientes tratados con COZAAR 25 mg y en el 3,7 % de los pacientes que recibieron placebo. En 4 ensayos clínicos en los que participaron más de 1000 pacientes con varias dosis (10-150 mg) de losartán potásico y más de 300 pacientes que recibieron placebo, los eventos adversos que ocurrieron en ≥2 % de los pacientes tratados con COZAAR 25 mg y con mayor frecuencia que con placebo fueron: mareos (3 % frente a 2 %), infección de las vías respiratorias superiores (8 % frente a 7 %), congestión nasal (2 % frente a 1 %) y dolor de espalda (2 % frente a 1 %).
Se han notificado las siguientes reacciones adversas menos frecuentes:
Trastornos de la sangre y del sistema linfático: Anemia.
Desórdenes psiquiátricos: Depresión.
Trastornos del sistema nervioso: Somnolencia, dolor de cabeza, trastornos del sueño, parestesia, migraña.
Trastornos del oído y del laberinto: Vértigo, tinnitus.
Trastornos cardíacos: Palpitaciones, síncope, fibrilación auricular, ACV.
Trastornos respiratorios, torácicos y mediastínicos: Disnea.
Desórdenes gastrointestinales: Dolor abdominal, estreñimiento, náuseas, vómitos.
Trastornos de la piel y del tejido subcutáneo: Urticaria, prurito, exantema, fotosensibilidad.
Trastornos musculoesqueléticos y del tejido conjuntivo: Mialgia, artralgia.
Trastornos del aparato reproductor y de la mama: Impotencia.
Desordenes generales y condiciones administrativas del sitio: Edema.
Tos
La tos seca persistente (con una incidencia de un pequeño porcentaje) se ha asociado con el uso de inhibidores de la ECA y, en la práctica, puede ser una causa de interrupción de la terapia con inhibidores de la ECA. Se realizaron dos ensayos prospectivos, de grupos paralelos, doble ciego, aleatorizados y controlados para evaluar los efectos de losartán en la incidencia de tos en pacientes hipertensos que habían experimentado tos mientras recibían terapia con inhibidores de la ECA. Los pacientes que tenían la tos típica del inhibidor de la ECA cuando se desafiaron con lisinopril, cuya tos desapareció con el placebo, fueron aleatorizados para recibir 50 mg de losartán, 20 mg de lisinopril o placebo (un estudio, n = 97) o 25 mg de hidroclorotiazida (n = 135). El período de tratamiento doble ciego duró hasta 8 semanas. La incidencia de tos se muestra en la Tabla 1 a continuación.
Estos estudios demuestran que la incidencia de tos asociada con la terapia con losartán, en una población que tenía tos asociada con la terapia con inhibidores de la ECA, es similar a la asociada con la terapia con hidroclorotiazida o placebo.
Se han informado casos de tos, incluidas nuevas provocaciones positivas, con el uso de losartán en la experiencia posterior a la comercialización.
Pacientes Hipertensos con Hipertrofia Ventricular Izquierda
En el estudio Losartan Intervention for Endpoint (LIFE), las reacciones adversas con COZAAR 100 mg fueron similares a las reportadas previamente para pacientes con hipertensión.
Nefropatía en pacientes diabéticos tipo 2
En el estudio Reduction of Endpoints in NIDDM with the Angiotensin II Receptor Antagonist Losartan (RENAAL) en el que participaron 1513 pacientes tratados con COZAAR 100 mg o placebo, las incidencias generales de eventos adversos informados fueron similares para los dos grupos. Las interrupciones de COZAAR debido a los efectos secundarios fueron similares a las del placebo (19 % para COZAAR 100 mg, 24 % para placebo). Los eventos adversos, independientemente de la relación con el fármaco, informados con una incidencia de ≥4 % de los pacientes tratados con COZAAR 50 mg y que ocurrieron con una diferencia de ≥2 % en el grupo de losartán frente a placebo en un contexto de tratamiento antihipertensivo convencional, fueron astenia/fatiga, dolor torácico , hipotensión, hipotensión ortostática, diarrea, anemia, hiperpotasemia, hipoglucemia, dolor de espalda, debilidad muscular e infección del tracto urinario.
Experiencia posterior a la comercialización
Las siguientes reacciones adversas adicionales se informaron en la experiencia posterior a la comercialización con COZAAR. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar su frecuencia de manera confiable o establecer una relación causal con la exposición al fármaco:
Digestivo: Hepatitis.
Desordenes generales y condiciones administrativas del sitio: Malestar.
hematológico: Trombocitopenia.
Hipersensibilidad: Rara vez se ha informado angioedema, incluida la hinchazón de la laringe y la glotis, que causa obstrucción de las vías respiratorias y/o hinchazón de la cara, los labios, la faringe y/o la lengua en pacientes tratados con losartán; algunos de estos pacientes experimentaron previamente angioedema con otros medicamentos, incluidos los inhibidores de la ECA. Se ha informado vasculitis, incluida la púrpura de Henoch-Schönlein. Se han informado reacciones anafilácticas.
Metabólica y Nutrición: Hiponatremia.
Musculoesquelético: Rabdomiólisis.
Trastornos del sistema nervioso: Disgeusia.
Piel: Eritrodermia.
INTERACCIONES CON LA DROGAS
Agentes que aumentan el potasio sérico
La coadministración de losartán con otros fármacos que elevan los niveles séricos de potasio puede provocar hiperpotasemia. Controle el potasio sérico en tales pacientes.
Litio
Se han informado aumentos en las concentraciones séricas de litio y toxicidad por litio durante la administración concomitante de litio con antagonistas de los receptores de angiotensina II. Controle los niveles séricos de litio durante el uso concomitante.
Fármacos antiinflamatorios no esteroideos (AINE) incluidos los inhibidores selectivos de la ciclooxigenasa-2 (inhibidores de la COX-2)
En pacientes de edad avanzada, con depleción de volumen (incluidos los que reciben tratamiento con diuréticos) o con función renal comprometida, la coadministración de AINE, incluidos los inhibidores selectivos de la COX-2, con antagonistas de los receptores de la angiotensina II (incluido losartán) puede provocar el deterioro de la función renal. incluida la posible insuficiencia renal aguda. Estos efectos suelen ser reversibles. Monitoree la función renal periódicamente en pacientes que reciben terapia con losartán y AINE.
El efecto antihipertensivo de los antagonistas de los receptores de la angiotensina II, incluido el losartán, puede atenuarse con los AINE, incluidos los inhibidores selectivos de la COX-2.
Bloqueo dual del sistema renina-angiotensina (RAS)
El bloqueo dual del RAS con bloqueadores de los receptores de angiotensina, inhibidores de la ECA o aliskiren se asocia con un mayor riesgo de hipotensión, síncope, hiperpotasemia y cambios en la función renal (incluida la insuficiencia renal aguda) en comparación con la monoterapia.
El ensayo Nephropathy in Diabetes (VA NEPHRON-D) de Asuntos de Veteranos inscribió a 1448 pacientes con diabetes tipo 2, proporción elevada de albúmina urinaria a creatinina y tasa de filtración glomerular estimada disminuida (TFG de 30 a 89,9 ml/min), los aleatorizó para recibir lisinopril o placebo en un contexto de terapia con losartán y los siguieron durante una mediana de 2,2 años. Los pacientes que recibieron la combinación de losartán y lisinopril no obtuvieron ningún beneficio adicional en comparación con la monoterapia para el criterio de valoración combinado de disminución de la TFG, enfermedad renal en etapa terminal o muerte, pero experimentaron una mayor incidencia de hiperpotasemia y lesión renal aguda en comparación con el grupo de monoterapia.
En la mayoría de los pacientes no se ha asociado ningún beneficio con el uso concomitante de dos inhibidores de RAS. En general, evite el uso combinado de inhibidores de RAS. Controle de cerca la presión arterial, la función renal y los electrolitos en pacientes que toman COZAAR 100 mg y otros agentes que afectan el RAS.
No coadministrar aliskireno con COZAAR 100 mg en pacientes con diabetes. Evite el uso de aliskiren con COZAAR en pacientes con insuficiencia renal (TFG
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Toxicidad Fetal
COZAAR puede causar daño fetal cuando se administra a una mujer embarazada. El uso de fármacos que actúan sobre el sistema renina-angiotensina durante el segundo y tercer trimestre del embarazo reduce la función renal fetal y aumenta la morbilidad y muerte fetal y neonatal. El oligohidramnios resultante puede asociarse con hipoplasia pulmonar fetal y deformaciones esqueléticas. Los posibles efectos adversos neonatales incluyen hipoplasia craneal, anuria, hipotensión, insuficiencia renal y muerte. Cuando se detecte un embarazo, suspender COZAAR 100 mg lo antes posible [ver Uso en poblaciones específicas ] .
Hipotensión en pacientes con depleción de volumen o de sal
En pacientes con un sistema renina-angiotensina activado, como pacientes con depleción de volumen o sal (p. ej., aquellos que están siendo tratados con altas dosis de diuréticos), puede ocurrir hipotensión sintomática después de iniciar el tratamiento con COZAAR. Corrija el volumen o la depleción de sal antes de la administración de COZAAR [ver DOSIFICACIÓN Y ADMINISTRACIÓN ] .
Deterioro de la función renal
Los cambios en la función renal, incluida la insuficiencia renal aguda, pueden ser causados por fármacos que inhiben el sistema renina-angiotensina y por diuréticos. Los pacientes cuya función renal puede depender en parte de la actividad del sistema renina-angiotensina (p. ej., pacientes con estenosis de la arteria renal, enfermedad renal crónica, insuficiencia cardíaca congestiva grave o depleción de volumen) pueden tener un riesgo particular de desarrollar insuficiencia renal aguda con COZAAR. Vigilar la función renal periódicamente en estos pacientes. Considere suspender o interrumpir el tratamiento en pacientes que desarrollen una disminución clínicamente significativa de la función renal con COZAAR [ver INTERACCIONES CON LA DROGAS y Uso en poblaciones específicas ] .
hiperpotasemia
Monitoree el potasio sérico periódicamente y trate apropiadamente. Puede ser necesaria una reducción de la dosis o la suspensión de COZAAR 25 mg [ver REACCIONES ADVERSAS ] .
El uso concomitante de otros medicamentos que pueden aumentar el potasio sérico puede provocar hiperpotasemia [ver INTERACCIONES CON LA DROGAS ] .
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA (Información para el paciente).
El embarazo
Asesorar a las pacientes en edad fértil sobre las consecuencias de la exposición a COZAAR 100 mg durante el embarazo. Analice las opciones de tratamiento con las mujeres que planean quedar embarazadas. Dígales a los pacientes que informen los embarazos a sus médicos lo antes posible [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ] .
Suplementos de potasio
Aconseje a los pacientes que reciben COZAAR que no usen suplementos de potasio o sustitutos de la sal que contengan potasio sin consultar a su proveedor de atención médica [ver INTERACCIONES CON LA DROGAS ] .
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
El losartán potásico no fue cancerígeno cuando se administró a las dosis máximas toleradas a ratas y ratones durante 105 y 92 semanas, respectivamente. Las ratas hembra que recibieron la dosis más alta (270 mg/kg/día) tuvieron una incidencia ligeramente mayor de adenoma acinar pancreático. Las dosis máximas toleradas (270 mg/kg/día en ratas, 200 mg/kg/día en ratones) proporcionaron exposiciones sistémicas para losartán y su metabolito farmacológicamente activo que fueron aproximadamente 160 y 90 veces (ratas) y 30 y 15 veces (ratones) la exposición de un ser humano de 50 kg que recibe 100 mg por día.
El losartán potásico fue negativo en los ensayos de mutagénesis microbiana y de mutagénesis de células de mamífero V-79 y en los ensayos de elución alcalina in vitro y de aberración cromosómica in vitro e in vivo. Además, el metabolito activo no mostró evidencia de genotoxicidad en los ensayos de mutagénesis microbiana, elución alcalina in vitro y aberración cromosómica in vitro.
La fertilidad y el rendimiento reproductivo no se vieron afectados en estudios con ratas macho que recibieron dosis orales de losartán potásico de hasta aproximadamente 150 mg/kg/día. La administración de niveles de dosificación tóxicos en mujeres (300/200 mg/kg/día) se asoció con una disminución significativa (p
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
COZAAR puede causar daño fetal cuando se administra a una mujer embarazada. El uso de fármacos que actúan sobre el sistema renina-angiotensina durante el segundo y tercer trimestre del embarazo reduce la función renal fetal y aumenta la morbilidad y muerte fetal y neonatal. La mayoría de los estudios epidemiológicos que examinan las anomalías fetales después de la exposición al uso de antihipertensivos en el primer trimestre no han distinguido los fármacos que afectan al sistema renina-angiotensina de otros agentes antihipertensivos. Cuando se detecte un embarazo, suspenda COZAAR lo antes posible (ver Consideraciones clínicas ).
Se desconoce el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo para la población indicada. Todos los embarazos tienen un riesgo de fondo de anomalías congénitas, pérdidas u otros resultados adversos. En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 % al 4 % y del 15 % al 20 %, respectivamente.
Consideraciones clínicas
Riesgo materno y/o embrionario/fetal asociado a la enfermedad
La hipertensión en el embarazo aumenta el riesgo materno de preeclampsia, diabetes gestacional, parto prematuro y complicaciones del parto (p. ej., necesidad de cesárea, hemorragia posparto). La hipertensión aumenta el riesgo fetal de restricción del crecimiento intrauterino y muerte intrauterina. Las mujeres embarazadas con hipertensión deben ser cuidadosamente monitoreadas y tratadas en consecuencia.
Reacciones adversas fetales/neonatales
El oligohidramnios en mujeres embarazadas que usan medicamentos que afectan el sistema renina-angiotensina en el segundo y tercer trimestre del embarazo puede resultar en lo siguiente: función renal fetal reducida que conduce a anuria e insuficiencia renal, hipoplasia pulmonar fetal, deformaciones esqueléticas, incluida hipoplasia del cráneo, hipotensión y muerte. En el caso inusual de que no exista una alternativa adecuada a la terapia con medicamentos que afectan el sistema renina-angiotensina para un paciente en particular, informe a la madre del riesgo potencial para el feto.
En pacientes que toman COZAAR durante el embarazo, realice exámenes de ultrasonido en serie para evaluar el entorno intraamniótico. Las pruebas fetales pueden ser apropiadas, según la semana de gestación. Si se observa oligohidramnios, suspenda COZAAR 50 mg, a menos que se considere que salva la vida de la madre. Sin embargo, los pacientes y los médicos deben tener en cuenta que es posible que el oligohidramnios no aparezca hasta después de que el feto haya sufrido una lesión irreversible.
Observe de cerca a los recién nacidos con antecedentes de exposición intrauterina a COZAAR para detectar hipotensión, oliguria e hiperpotasemia. En recién nacidos con antecedentes de exposición intrauterina a COZAAR 100 mg, si se presenta oliguria o hipotensión, mantener la presión arterial y la perfusión renal. Es posible que se requieran exanguinotransfusiones o diálisis como medio para revertir la hipotensión y reemplazar la función renal.
Datos
Datos de animales
Losartán potásico se administró por vía oral a ratas durante el período de gestación tardía hasta la lactancia (Día 15 de gestación hasta Día 20 de lactancia) en dosis de 10, 25 y 100 mg/kg/día. Se ha demostrado que el losartán potásico produce efectos adversos en fetos y recién nacidos de rata, que incluyen disminución del peso corporal, retraso en el desarrollo físico y del comportamiento, mortalidad y toxicidad renal. Con la excepción del aumento de peso neonatal (que se vio afectado con dosis tan bajas como 10 mg/kg/día), las dosis asociadas con estos efectos excedieron los 25 mg/kg/día (aproximadamente tres veces la dosis máxima recomendada en humanos de 100 mg por dosis de mg). base /m). Estos hallazgos se atribuyen a la exposición al fármaco al final de la gestación y durante la lactancia. Se demostró la presencia de niveles significativos de losartán y su metabolito activo en el plasma fetal de rata durante la gestación tardía y en la leche de rata.
Lactancia
Resumen de riesgos
No se sabe si losartán se excreta en la leche humana, pero se demostró la presencia de niveles significativos de losartán y su metabolito activo en la leche de rata. Debido al potencial de efectos adversos en el lactante, se debe tomar la decisión de suspender la lactancia o suspender el fármaco, teniendo en cuenta la importancia del fármaco para la madre.
Uso pediátrico
Los efectos antihipertensivos de COZAAR se han establecido en pacientes pediátricos hipertensos de 6 a 16 años. No se ha establecido la seguridad y la eficacia en pacientes pediátricos menores de 6 años o en pacientes pediátricos con tasa de filtración glomerular DOSIFICACIÓN Y ADMINISTRACIÓN , FARMACOLOGÍA CLÍNICA y Estudios clínicos ] .
Uso geriátrico
Del número total de pacientes que recibieron COZAAR 25 mg en estudios clínicos controlados para la hipertensión, 391 pacientes (19 %) tenían 65 años o más, mientras que 37 pacientes (2 %) tenían 75 años o más. En un estudio clínico controlado para la protección renal en pacientes diabéticos tipo 2 con proteinuria, 248 pacientes (33%) tenían 65 años o más. En un estudio clínico controlado para la reducción del riesgo combinado de muerte cardiovascular, accidente cerebrovascular e infarto de miocardio en pacientes hipertensos con hipertrofia ventricular izquierda, 2857 pacientes (62 %) tenían 65 años o más, mientras que 808 pacientes (18 %) tenían 75 años o más . No se observaron diferencias generales en la eficacia o la seguridad entre estos pacientes y los pacientes más jóvenes, pero no se puede descartar una mayor sensibilidad de algunos individuos mayores.
La raza
En el estudio LIFE, los pacientes de raza negra con hipertensión e hipertrofia ventricular izquierda tratados con atenolol tenían un riesgo menor de experimentar el criterio principal de valoración compuesto en comparación con los pacientes de raza negra tratados con COZAAR (ambos cotratados con hidroclorotiazida en la mayoría de los pacientes). El criterio principal de valoración fue la primera aparición de accidente cerebrovascular, infarto de miocardio o muerte cardiovascular, analizada mediante un enfoque por intención de tratar (ITT). En el subgrupo de pacientes de raza negra (n=533, 6 % de los pacientes del estudio LIFE), hubo 29 criterios de valoración primarios entre 263 pacientes con atenolol (11 %, 26 por 1000 años-paciente) y 46 criterios de valoración primarios entre 270 pacientes (17 % , 42 por 1000 años-paciente) en COZAAR. Este hallazgo no pudo explicarse sobre la base de diferencias en las poblaciones distintas de la raza o sobre cualquier desequilibrio entre los grupos de tratamiento. Además, las reducciones de la presión arterial en ambos grupos de tratamiento fueron consistentes entre pacientes negros y no negros. Dada la dificultad para interpretar las diferencias de subconjuntos en ensayos grandes, no se puede saber si la diferencia observada es el resultado de la casualidad. Sin embargo, el estudio LIFE no proporciona evidencia de que los beneficios de COZAAR 100 mg en la reducción del riesgo de eventos cardiovasculares en pacientes hipertensos con hipertrofia ventricular izquierda se apliquen a los pacientes de raza negra [ver Estudios clínicos ] .
Insuficiencia renal
Los pacientes con insuficiencia renal tienen concentraciones plasmáticas elevadas de losartán y su metabolito activo en comparación con sujetos con función renal normal. No es necesario ajustar la dosis en pacientes con insuficiencia renal a menos que un paciente con insuficiencia renal también tenga depleción de volumen [ver DOSIFICACIÓN Y ADMINISTRACIÓN , ADVERTENCIAS Y PRECAUCIONES y FARMACOLOGÍA CLÍNICA ] .
Deterioro hepático
La dosis inicial recomendada de COZAAR es de 25 mg en pacientes con insuficiencia hepática de leve a moderada. Después de la administración oral en pacientes con insuficiencia hepática de leve a moderada, las concentraciones plasmáticas de losartán y su metabolito activo fueron, respectivamente, 5 veces y 1,7 veces las observadas en voluntarios sanos. COZAAR no se ha estudiado en pacientes con insuficiencia hepática grave [ver DOSIFICACIÓN Y ADMINISTRACIÓN y FARMACOLOGÍA CLÍNICA ] .
SOBREDOSIS
Se observó una letalidad significativa en ratones y ratas después de la administración oral de 1000 mg/kg y 2000 mg/kg, respectivamente, aproximadamente 44 y 170 veces la dosis máxima recomendada en humanos en base a mg/m2.
Hay datos limitados disponibles con respecto a la sobredosis en humanos. La manifestación más probable de sobredosis sería hipotensión y taquicardia; podría ocurrir bradicardia debido a la estimulación parasimpática (vagal). Si ocurriera hipotensión sintomática, se debe instituir un tratamiento de soporte.
Ni losartán ni su metabolito activo pueden ser eliminados por hemodiálisis.
CONTRAINDICACIONES
COZAAR 50mg está contraindicado:
- En pacientes hipersensibles a cualquiera de los componentes de este producto.
- Para la coadministración con aliskiren en pacientes con diabetes.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
La angiotensina II [formada a partir de la angiotensina I en una reacción catalizada por la enzima convertidora de angiotensina (ECA, cininasa II)] es un potente vasoconstrictor, la principal hormona vasoactiva del sistema renina-angiotensina y un componente importante en la fisiopatología de la hipertensión. También estimula la secreción de aldosterona por la corteza suprarrenal. Losartán y su principal metabolito activo bloquean los efectos vasoconstrictores y secretores de aldosterona de la angiotensina II mediante el bloqueo selectivo de la unión de la angiotensina II al receptor AT1 que se encuentra en muchos tejidos (p. ej., músculo liso vascular, glándula suprarrenal). También hay un receptor AT1 que se encuentra en muchos tejidos, pero no se sabe si está asociado con la homeostasis cardiovascular. Ni losartán ni su principal metabolito activo muestran actividad agonista parcial en el receptor AT1, y ambos tienen una afinidad mucho mayor (alrededor de 1000 veces) por el receptor AT1 que por el receptor AT1. Los estudios de unión in vitro indican que losartán es un inhibidor competitivo y reversible del receptor AT1. El metabolito activo es de 10 a 40 veces más potente en peso que losartán y parece ser un inhibidor reversible y no competitivo del receptor AT1.
Ni losartán ni su metabolito activo inhiben la ECA (cininasa II, la enzima que convierte la angiotensina I en angiotensina II y degrada la bradicinina), ni se unen ni bloquean otros receptores hormonales o canales iónicos que se sabe que son importantes en la regulación cardiovascular.
Farmacodinámica
Losartán inhibe el efecto presor de las infusiones de angiotensina II (así como de angiotensina I). Una dosis de 100 mg inhibe el efecto presor en aproximadamente un 85 % en el pico con una inhibición del 25-40 % que persiste durante 24 horas. La eliminación de la retroalimentación negativa de la angiotensina II provoca una duplicación o triplicación de la actividad de la renina plasmática y el consiguiente aumento de la concentración plasmática de angiotensina II en pacientes hipertensos. Losartán no afecta la respuesta a la bradiquinina, mientras que los inhibidores de la ECA aumentan la respuesta a la bradiquinina. Las concentraciones plasmáticas de aldosterona descienden tras la administración de losartán. A pesar del efecto de losartán sobre la secreción de aldosterona, se observó muy poco efecto sobre el potasio sérico.
El efecto de losartan está sustancialmente presente dentro de una semana pero en algunos estudios el efecto máximo ocurrió en 3-6 semanas. En estudios de seguimiento a largo plazo (sin control con placebo), el efecto de losartán pareció mantenerse hasta por un año. No hay un efecto de rebote aparente después de la suspensión abrupta de losartán. Esencialmente, no hubo cambios en la frecuencia cardíaca promedio en pacientes tratados con losartán en ensayos controlados.
Farmacocinética
Absorción
Después de la administración oral, losartán se absorbe bien y experimenta un metabolismo sustancial de primer paso. La biodisponibilidad sistémica de losartan es de aproximadamente 33%. Las concentraciones máximas medias de losartán y su metabolito activo se alcanzan en 1 hora y en 3-4 horas, respectivamente. Si bien las concentraciones plasmáticas máximas de losartán y su metabolito activo son aproximadamente iguales, el AUC (área bajo la curva) del metabolito es aproximadamente 4 veces mayor que la de losartán. Una comida retarda la absorción de losartán y disminuye su Cmax, pero solo tiene efectos menores en el AUC de losartán o en el AUC del metabolito (disminución de ~10 %). La farmacocinética de losartán y su metabolito activo es lineal con dosis orales de losartán de hasta 200 mg y no cambia con el tiempo.
Distribución
El volumen de distribución de losartan y el metabolito activo es de aproximadamente 34 litros y 12 litros, respectivamente. Tanto losartán como su metabolito activo se unen en gran medida a las proteínas plasmáticas, principalmente a la albúmina, con fracciones libres en plasma de 1,3% y 0,2%, respectivamente. La unión a proteínas plasmáticas es constante en el rango de concentración logrado con las dosis recomendadas. Los estudios en ratas indican que losartán cruza mal la barrera hematoencefálica, si es que lo hace.
Metabolismo
Losartán es un agente activo por vía oral que sufre un importante metabolismo de primer paso por las enzimas del citocromo P450. Se convierte, en parte, en un metabolito de ácido carboxílico activo que es responsable de la mayor parte del antagonismo del receptor de angiotensina II que sigue al tratamiento con losartán. Alrededor del 14% de una dosis de losartán administrada por vía oral se convierte en el metabolito activo. Además del metabolito ácido carboxílico activo, se forman varios metabolitos inactivos. Los estudios in vitro indican que el citocromo P450 2C9 y 3A4 están involucrados en la biotransformación de losartán a sus metabolitos.
Eliminación
El aclaramiento plasmático total de losartán y el metabolito activo es de aproximadamente 600 ml/min y 50 ml/min, respectivamente, con un aclaramiento renal de aproximadamente 75 ml/min y 25 ml/min, respectivamente. La semivida terminal de losartán es de unas 2 horas y la del metabolito es de unas 6-9 horas. Después de dosis únicas de losartán administradas por vía oral, alrededor del 4 % de la dosis se excreta sin cambios en la orina y alrededor del 6 % se excreta en la orina como metabolito activo. La excreción biliar contribuye a la eliminación de losartán y sus metabolitos. Después de losartán oral marcado con 14C, alrededor del 35 % de la radiactividad se recupera en la orina y alrededor del 60 % en las heces. Después de una dosis intravenosa de losartan marcado con 14C, aproximadamente el 45% de la radioactividad se recupera en la orina y el 50% en las heces. Ni losartán ni su metabolito se acumulan en el plasma tras la administración repetida una vez al día.
Poblaciones Específicas
Pediátrico
Los parámetros farmacocinéticos después de dosis múltiples de losartán (dosis promedio 0,7 mg/kg, rango de 0,36 a 0,97 mg/kg) como tableta a 25 pacientes hipertensos de 6 a 16 años se muestran en la Tabla 4 a continuación. La farmacocinética de losartán y su metabolito activo fue generalmente similar en los grupos de edad estudiados y similar a los datos farmacocinéticos históricos en adultos. Los principales parámetros farmacocinéticos en adultos y niños se muestran en la siguiente tabla.
La biodisponibilidad de la formulación en suspensión se comparó con los comprimidos de losartán en adultos sanos. La suspensión y la tableta son similares en su biodisponibilidad con respecto a losartán y al metabolito activo [ver DOSIFICACIÓN Y ADMINISTRACIÓN ] .
Geriatría Y Género
La farmacocinética de losartán se ha investigado en ancianos (65-75 años) y en ambos sexos. Las concentraciones plasmáticas de losartán y su metabolito activo son similares en ancianos y jóvenes hipertensos. Las concentraciones plasmáticas de losartán fueron aproximadamente el doble en mujeres hipertensas que en hombres hipertensos, pero las concentraciones del metabolito activo fueron similares en hombres y mujeres. No es necesario ajustar la dosis [ver DOSIFICACIÓN Y ADMINISTRACIÓN ] .
La raza
No se han estudiado las diferencias farmacocinéticas debidas a la raza [ver Uso en poblaciones específicas ] .
Insuficiencia renal
Después de la administración oral, las concentraciones plasmáticas y el AUC de losartán y su metabolito activo aumentan en un 50-90 % en pacientes con insuficiencia renal leve (aclaramiento de creatinina de 50 a 74 ml/min) o moderada (aclaramiento de creatinina de 30 a 49 ml/min). . En este estudio, el aclaramiento renal se redujo entre un 55% y un 85% tanto para losartán como para su metabolito activo en pacientes con insuficiencia renal leve o moderada. Ni losartán ni su metabolito activo pueden eliminarse mediante hemodiálisis [ver ADVERTENCIAS Y PRECAUCIONES y Uso en poblaciones específicas ] .
insuficiencia hepática
Después de la administración oral en pacientes con cirrosis hepática alcohólica de leve a moderada, las concentraciones plasmáticas de losartán y su metabolito activo fueron, respectivamente, 5 veces y alrededor de 1,7 veces las de los voluntarios varones jóvenes. En comparación con sujetos normales, el aclaramiento plasmático total de losartán en pacientes con insuficiencia hepática fue aproximadamente un 50 % menor y la biodisponibilidad oral se duplicó aproximadamente. Use una dosis inicial de 25 mg para pacientes con insuficiencia hepática de leve a moderada. COZAAR 50 mg no se ha estudiado en pacientes con insuficiencia hepática grave [ver DOSIFICACIÓN Y ADMINISTRACIÓN y Uso en poblaciones específicas ] .
Interacciones con la drogas
No se han encontrado interacciones farmacológicas clínicamente significativas en estudios de losartán potásico con hidroclorotiazida, digoxina, warfarina, cimetidina y fenobarbital. Sin embargo, se ha demostrado que la rifampicina disminuye el AUC de losartán y su metabolito activo en un 30 % y un 40 %, respectivamente. Fluconazol, un inhibidor del citocromo P450 2C9, disminuyó el AUC del metabolito activo en aproximadamente un 40 %, pero aumentó el AUC de losartán en aproximadamente un 70 % después de dosis múltiples. La conversión de losartán en su metabolito activo después de la administración intravenosa no se ve afectada por ketoconazol. un inhibidor de P450 3A4. El AUC del metabolito activo después de losartán oral no se vio afectado por la eritromicina, un inhibidor de P450 3A4, pero el AUC de losartán aumentó en un 30 %.
No se han examinado las consecuencias farmacodinámicas del uso concomitante de losartán e inhibidores de P450 2C9. Se ha demostrado que los sujetos que no metabolizan losartán a su metabolito activo tienen un defecto raro y específico en el citocromo P450 2C9. Estos datos sugieren que la conversión de losartan a su metabolito activo está mediada principalmente por P450 2C9 y no por P450 3A4.
Estudios clínicos
Hipertensión
Hipertensión en adultos
Los efectos antihipertensivos de COZAAR 25 mg se demostraron principalmente en 4 ensayos controlados con placebo, de 6 a 12 semanas de dosis de 10 a 150 mg por día en pacientes con presión arterial diastólica inicial de 95-115. Los estudios permitieron comparaciones de dos dosis (50-100 mg/día) como regímenes de una o dos veces al día, comparaciones de los efectos máximos y mínimos, y comparaciones de respuesta por sexo, edad y raza. Tres estudios adicionales examinaron los efectos antihipertensivos de losartán e hidroclorotiazida en combinación.
Los 4 estudios de monoterapia con losartán incluyeron un total de 1075 pacientes aleatorizados a varias dosis de losartán y 334 a placebo. Las dosis de 10 y 25 mg produjeron algún efecto en el punto máximo (6 horas después de la dosificación) pero respuestas mínimas pequeñas e inconsistentes (24 horas). Las dosis de 50, 100 y 150 mg una vez al día produjeron disminuciones medias sistólica/diastólica estadísticamente significativas en la presión arterial, en comparación con el placebo en el rango de 5,5-10,5/3,5-7,5 mmHg, y la dosis de 150 mg no produjo un efecto mayor que 50- 100 miligramos La dosificación dos veces al día de 50-100 mg/día proporcionó respuestas mínimas consistentemente mayores que la dosificación una vez al día con la misma dosis total. Los efectos máximos (6 horas) fueron uniformemente, pero moderadamente, más grandes que los efectos mínimos, con una relación mínimo-máximo para las respuestas sistólica y diastólica de 50-95% y 60-90%, respectivamente.
La adición de una dosis baja de hidroclorotiazida (12,5 mg) a 50 mg de losartán una vez al día produjo reducciones de la presión arterial ajustadas con placebo de 15,5/9,2 mmHg.
El análisis de los subgrupos de edad, género y raza de los pacientes mostró que los hombres y las mujeres, y los pacientes mayores y menores de 65 años, tenían respuestas generalmente similares. COZAAR 25 mg fue eficaz para reducir la presión arterial independientemente de la raza, aunque el efecto fue algo menor en pacientes de raza negra (por lo general, una población con bajo nivel de renina).
Hipertensión pediátrica
El efecto antihipertensivo de losartán se estudió en un ensayo en el que participaron 177 pacientes pediátricos hipertensos de 6 a 16 años de edad. Los niños que pesaban DOSIFICACIÓN Y ADMINISTRACIÓN . La mayoría de los niños tenían hipertensión asociada con enfermedad renal y urogenital. La presión arterial diastólica en sedestación (SiDBP, por sus siglas en inglés) al ingresar al estudio era superior al nivel del percentil 95 para la edad, el sexo y la altura del paciente. Al final de las tres semanas, losartán redujo la presión arterial sistólica y diastólica, medida en el punto mínimo, de forma dependiente de la dosis. En general, las dos dosis más altas (25 a 50 mg en pacientes
Pacientes hipertensos con hipertrofia ventricular izquierda
El estudio LIFE fue un estudio doble ciego multinacional que comparó COZAAR 50 mg y atenolol en 9193 pacientes hipertensos con hipertrofia ventricular izquierda documentada por ECG. Se excluyeron los pacientes con infarto de miocardio o accidente cerebrovascular dentro de los seis meses anteriores a la aleatorización. Los pacientes fueron aleatorizados para recibir una vez al día COZAAR 50 mg o atenolol 50 mg. Si no se alcanzaba la presión arterial objetivo (
De los pacientes aleatorizados, 4963 (54 %) eran mujeres y 533 (6 %) eran negros. La edad media fue de 67 años con 5704 (62%) edad ≥ 65 años. Al inicio, 1195 (13%) tenían diabetes, 1326 (14%) tenían hipertensión sistólica aislada, 1469 (16%) tenían enfermedad coronaria y 728 (8%) tenían enfermedad cerebrovascular. La presión arterial media inicial fue de 174/98 mmHg en ambos grupos de tratamiento. La duración media del seguimiento fue de 4,8 años. Al final del estudio o en la última visita antes de un criterio de valoración principal, el 77 % del grupo tratado con COZAAR 50 mg y el 73 % del grupo tratado con atenolol seguían tomando la medicación del estudio. De los pacientes que seguían tomando la medicación del estudio, las dosis medias de COZAAR y atenolol eran de unos 80 mg/día, y el 15 % tomaba atenolol o losartán como monoterapia, mientras que el 77 % también recibía hidroclorotiazida (a una dosis media de 20 mg/día en cada grupo). La reducción de la presión arterial medida en el punto mínimo fue similar para ambos grupos de tratamiento, pero la presión arterial no se midió en ningún otro momento del día. Al final del estudio o en la última visita antes de un criterio de valoración principal, las presiones arteriales medias fueron de 144,1/81,3 mmHg para el grupo tratado con COZAAR y de 145,4/80,9 mmHg para el grupo tratado con atenolol; la diferencia en la presión arterial sistólica (PAS) de 1,3 mmHg fue significativa (p
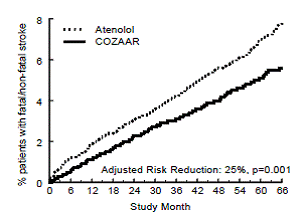
El punto final primario fue la primera aparición de muerte cardiovascular, accidente cerebrovascular no fatal o infarto de miocardio no fatal. Los pacientes con eventos no mortales permanecieron en el ensayo, por lo que también se examinó el primer evento de cada tipo incluso si no era el primer evento (p. ej., un accidente cerebrovascular después de un infarto de miocardio inicial se contaría en el análisis de accidente cerebrovascular). El tratamiento con 50 mg de COZAAR dio como resultado una reducción del 13 % (p = 0,021) en el riesgo del criterio principal de valoración en comparación con el grupo de atenolol (consulte la Figura 1 y la Tabla 3); esta diferencia fue principalmente el resultado de un efecto sobre el accidente cerebrovascular fatal y no fatal. El tratamiento con COZAAR redujo el riesgo de accidente cerebrovascular en un 25 % en relación con el atenolol (p=0,001) (consulte la Figura 2 y la Tabla 3).
Figura 1: Estimaciones de Kaplan-Meier del criterio principal de valoración del tiempo hasta la muerte cardiovascular, accidente cerebrovascular no fatal o infarto de miocardio no fatal en los grupos tratados con COZAAR 100 mg y atenolol. La reducción del riesgo se ajusta según la puntuación de riesgo de Framingham inicial y el nivel de hipertrofia electrocardiográfica del ventrículo izquierdo.
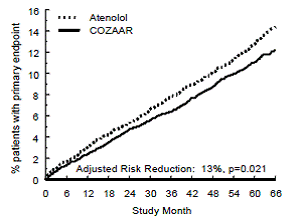
Figura 2: Estimaciones de Kaplan-Meier del tiempo hasta el accidente cerebrovascular fatal/no fatal en los grupos tratados con COZAAR 50 mg y atenolol. La reducción del riesgo se ajusta según la puntuación de riesgo de Framingham inicial y el nivel de hipertrofia electrocardiográfica del ventrículo izquierdo.
La Tabla 3 muestra los resultados para el criterio principal de valoración compuesto y los criterios de valoración individuales. El criterio principal de valoración fue la primera aparición de accidente cerebrovascular, infarto de miocardio o muerte cardiovascular, analizada mediante un enfoque ITT. La tabla muestra el número de eventos para cada componente de dos maneras diferentes. Los componentes del punto final primario (como primer evento) cuentan solo los eventos que definen el punto final principal, mientras que los puntos finales secundarios cuentan todos los primeros eventos de un tipo particular, ya sea que hayan sido precedidos o no por un tipo de evento diferente.
Aunque el estudio LIFE favoreció a COZAAR sobre atenolol con respecto al criterio principal de valoración (p=0,021), este resultado es de un solo estudio y, por lo tanto, es menos convincente que la diferencia entre COZAAR y placebo. Aunque no se midió directamente, la diferencia entre COZAAR y el placebo es convincente porque existe evidencia de que el atenolol en sí mismo es efectivo (frente al placebo) para reducir los eventos cardiovasculares, incluido el accidente cerebrovascular, en pacientes hipertensos.
Otros criterios de valoración clínicos del estudio LIFE fueron: mortalidad total, hospitalización por insuficiencia cardíaca o angina de pecho, procedimientos de revascularización coronaria o periférica y paro cardíaco resucitado. No hubo diferencias significativas en las tasas de estos criterios de valoración entre los grupos COZAAR y atenolol.
Para el criterio principal de valoración y accidente cerebrovascular, los efectos de COZAAR 25 mg en subgrupos de pacientes definidos por edad, sexo, raza y presencia o ausencia de hipertensión sistólica aislada (ISH), diabetes y antecedentes de enfermedad cardiovascular (ECV) se muestran en la Figura 3 a continuación. . Los análisis de subgrupos pueden ser difíciles de interpretar y no se sabe si representan diferencias verdaderas o efectos aleatorios.
Figura 3: Eventos de criterio de valoración principal† dentro de los subgrupos demográficos
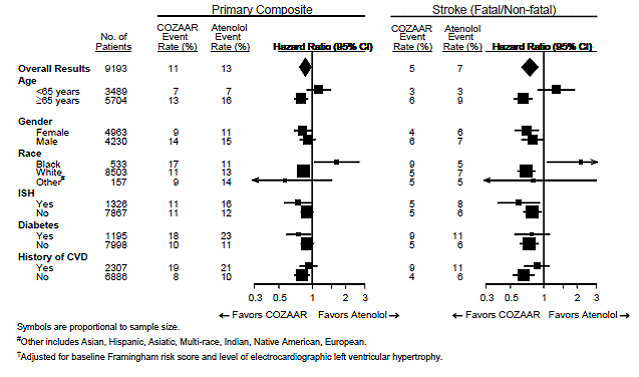
Nefropatía en pacientes diabéticos tipo 2
El estudio RENAAL fue un estudio aleatorizado, controlado con placebo, doble ciego, multicéntrico realizado en todo el mundo en 1513 pacientes con diabetes tipo 2 con nefropatía (definida como creatinina sérica de 1,3 a 3,0 mg/dl en mujeres o hombres ≤60 kg y 1,5 a 3,0 mg /dL en varones >60 kg y proteinuria [proporción albúmina/creatinina en orina ≥300 mg/g]).
Los pacientes fueron aleatorizados para recibir COZAAR 50 mg una vez al día o placebo en un contexto de tratamiento antihipertensivo convencional, excluyendo inhibidores de la ECA y antagonistas de la angiotensina II. Después de un mes, se indicó a los investigadores que titularan el fármaco del estudio a 100 mg una vez al día si no se alcanzaba el objetivo de presión arterial mínima (140/90 mmHg). En general, el 72 % de los pacientes recibieron la dosis diaria de 100 mg más del 50 % del tiempo que estuvieron tomando el fármaco del estudio. Debido a que el estudio fue diseñado para lograr el mismo control de la presión arterial en ambos grupos, se podrían agregar otros agentes antihipertensivos (diuréticos, bloqueadores de los canales de calcio, bloqueadores alfa o beta y agentes de acción central) según sea necesario en ambos grupos. Los pacientes fueron seguidos durante una duración media de 3,4 años.
La población del estudio fue diversa con respecto a la raza (16,7 % asiático, 15,2 % negro, 18,3 % hispano, 48,6 % blanco). En general, el 63,2% de los pacientes eran hombres y el 66,4% tenían menos de 65 años. Casi todos los pacientes (96,6 %) tenían antecedentes de hipertensión y los pacientes ingresaron al ensayo con una creatinina sérica media de 1,9 mg/dl y una proteinuria media (albúmina/creatinina urinaria) de 1808 mg/g al inicio del estudio.
El criterio principal de valoración del estudio fue el tiempo hasta la primera aparición de cualquiera de los siguientes eventos: duplicación de la creatinina sérica, enfermedad renal en etapa terminal (ESRD) (necesidad de diálisis o trasplante) o muerte. El tratamiento con COZAAR dio como resultado una reducción del riesgo del 16 % en este criterio de valoración (consulte la Figura 4 y la Tabla 4). El tratamiento con COZAAR también redujo la duplicación sostenida de la creatinina sérica en un 25 % y la ESRD en un 29 % como criterios de valoración separados, pero no tuvo ningún efecto sobre la mortalidad general (consulte la Tabla 4).
Las presiones arteriales iniciales medias fueron de 152/82 mmHg para COZAAR más tratamiento antihipertensivo convencional y de 153/82 mmHg para placebo más tratamiento antihipertensivo convencional. Al final del estudio, la presión arterial media fue de 143/76 mmHg para el grupo tratado con COZAAR 100 mg y de 146/77 mmHg para el grupo tratado con placebo.
Figura 4: Curva de Kaplan-Meier para el criterio principal de valoración compuesto de duplicación de la creatinina sérica, enfermedad renal en etapa terminal (necesidad de diálisis o trasplante) o muerte
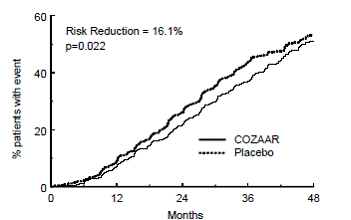
Los criterios de valoración secundarios del estudio fueron el cambio en la proteinuria, el cambio en la tasa de progresión de la enfermedad renal y el compuesto de morbilidad y mortalidad por causas cardiovasculares (hospitalización por insuficiencia cardíaca, infarto de miocardio, revascularización, accidente cerebrovascular, hospitalización por angina inestable o enfermedad cardiovascular). muerte). En comparación con el placebo, COZAAR redujo significativamente la proteinuria en un promedio del 34 %, un efecto que fue evidente dentro de los 3 meses posteriores al inicio de la terapia, y redujo significativamente la tasa de disminución de la tasa de filtración glomerular durante el estudio en un 13 %, según lo medido por el recíproco de la concentración de creatinina sérica. No hubo diferencias significativas en la incidencia del criterio de valoración compuesto de morbilidad y mortalidad cardiovascular.
Los efectos favorables de COZAAR se observaron en pacientes que también tomaban otros medicamentos antihipertensivos (no se permitieron los antagonistas de los receptores de angiotensina II ni los inhibidores de la enzima convertidora de angiotensina), agentes hipoglucemiantes orales y agentes hipolipemiantes.
Para el criterio principal de valoración y la ESRD, los efectos de COZAAR en subgrupos de pacientes definidos por edad, sexo y raza se muestran en la Tabla 5 a continuación. Los análisis de subgrupos pueden ser difíciles de interpretar y no se sabe si representan diferencias verdaderas o efectos aleatorios.
INFORMACIÓN DEL PACIENTE
COZAAR® (CO-zar) (tabletas de losartán potásico) 25 mg, 50 mg, 100 mg
Lea la Información para el paciente que viene con COZAAR antes de comenzar a tomarlo y cada vez que renueve su receta. Es posible que haya nueva información. Este prospecto no reemplaza la conversación con su médico acerca de su condición y tratamiento.
¿Cuál es la información más importante que debo saber sobre COZAAR?
- COZAAR puede causar daño o la muerte a un bebé nonato.
- Hable con su médico acerca de otras formas de reducir su presión arterial si planea quedar embarazada.
- Si queda embarazada mientras toma COZAAR, informe a su médico de inmediato.
¿Qué es COZAAR 100mg?
COZAAR 100 mg es un medicamento recetado llamado bloqueador del receptor de angiotensina (ARB). Esta usado:
- solo o con otros medicamentos para la presión arterial para reducir la presión arterial alta (hipertensión).
- para reducir la posibilidad de accidente cerebrovascular en pacientes con presión arterial alta y un problema cardíaco llamado hipertrofia ventricular izquierda. Es posible que COZAAR no ayude a los pacientes negros con este problema.
- para retrasar el empeoramiento de la enfermedad renal diabética (nefropatía) en pacientes con diabetes tipo 2 que tienen o han tenido presión arterial alta.
COZAAR 25 mg no ha sido estudiado en niños menores de 6 años o en niños con ciertos problemas renales.
Presión arterial alta (hipertensión) La presión arterial es la fuerza en sus vasos sanguíneos cuando su corazón late y cuando su corazón descansa. Tiene presión arterial alta cuando la fuerza es demasiada. COZAAR 25 mg puede ayudar a que sus vasos sanguíneos se relajen para que su presión arterial sea más baja.
Hipertrofia Ventricular Izquierda (HVI) es un agrandamiento de las paredes de la cámara izquierda del corazón (la principal cámara de bombeo del corazón). La HVI puede ocurrir por varias cosas. La presión arterial alta es la causa más común de HVI.
Diabetes tipo 2 con nefropatía . La diabetes tipo 2 es un tipo de diabetes que ocurre principalmente en adultos. Si tiene nefropatía diabética, significa que sus riñones no funcionan correctamente debido al daño causado por la diabetes.
¿Quién no debe tomar COZAAR 100mg?
- No tome COZAAR 25 mg si es alérgico a alguno de los ingredientes de COZAAR . Consulte el final de este folleto para obtener una lista completa de los ingredientes de COZAAR.
- No tome COZAAR si tiene diabetes y está tomando un medicamento llamado aliskiren para reducir la presión arterial.
¿Qué debo decirle a mi médico antes de tomar COZAAR 50 mg?
Informe a su médico sobre todas sus afecciones médicas, incluso si usted:
- está embarazada o planea quedar embarazada. Ver " ¿Cuál es la información más importante que debo saber sobre COZAAR 25mg? "
- están amamantando . No se sabe si COZAAR 50 mg pasa a la leche materna. Debe elegir tomar COZAAR 50 mg o amamantar, pero no ambos.
- está vomitando mucho o tiene mucha diarrea
- tiene problemas hepáticos
- tiene problemas renales
Informe a su médico sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, las vitaminas y los suplementos a base de hierbas. COZAAR y algunos otros medicamentos pueden interactuar entre sí. Especialmente informe a su médico si está tomando:
- suplementos de potasio
- sustitutos de la sal que contienen potasio
- otros medicamentos que pueden aumentar el potasio sérico
- pastillas de agua (diuréticos)
- litio (un medicamento utilizado para tratar cierto tipo de depresión)
- medicamentos utilizados para tratar el dolor y la artritis, denominados antiinflamatorios no esteroideos (AINE), incluidos los inhibidores de la COX-2
- otros medicamentos para reducir la presión arterial
¿Cómo debo tomar COZAAR 25mg?
- Tome COZAAR 100 mg exactamente según lo prescrito por su médico. Su médico puede cambiar la dosis si es necesario.
- COZAAR 50 mg se puede tomar con o sin alimentos.
- Si olvida una dosis, tómela tan pronto como lo recuerde. Si está cerca de su próxima dosis, no tome la dosis olvidada. Sólo toma la siguiente dosis a tu hora regular.
- Si toma demasiado COZAAR, llame a su médico o al centro de toxicología, o vaya de inmediato a la sala de emergencias del hospital más cercano.
¿Cuáles son los posibles efectos secundarios de COZAAR?
COZAAR 25 mg puede causar los siguientes efectos secundarios que pueden ser graves:
- Lesión o muerte de bebés por nacer. Ver "¿Cuál es la información más importante que debo saber sobre COZAAR?"
- Reacción alérgica Los síntomas de una reacción alérgica son hinchazón de la cara, los labios, la garganta o la lengua. Obtenga ayuda médica de emergencia de inmediato y deje de tomar COZAAR.
- Presión arterial baja (hipotensión) . La presión arterial baja puede hacer que se sienta débil o mareado. Acuéstese si se siente débil o mareado. Llame a su doctor inmediatamente.
- Para las personas que ya tienen problemas renales, es posible que vean un empeoramiento en el funcionamiento de sus riñones. Llame a su médico si se le hinchan los pies, los tobillos o las manos, o si aumenta de peso sin motivo aparente.
- Altos niveles de potasio en la sangre
Los efectos secundarios más comunes de COZAAR 50 mg en personas con presión arterial alta son:
- "resfriados" (infección de las vías respiratorias superiores)
- mareo
- congestión nasal
- dolor de espalda
Los efectos secundarios más comunes de COZAAR 50 mg en personas con diabetes tipo 2 con enfermedad renal diabética son:
- Diarrea
- cansancio
- baja azúcar en la sangre
- Dolor de pecho
- potasio alto en la sangre
- presión arterial baja
Informe a su médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Esto es no una lista completa de efectos secundarios. Para obtener una lista completa, consulte a su médico o farmacéutico.
¿Cómo conservo COZAAR 100 mg?
- Guarde las tabletas de COZAAR a una temperatura de 59 °F a 86 °F (15 °C a 30 °C).
- Mantenga COZAAR en un recipiente bien cerrado que proteja el medicamento de la luz.
- Mantenga COZAAR y todos los medicamentos fuera del alcance de los niños.
Información general sobre COZAAR
A veces se recetan medicamentos para afecciones que no se mencionan en los folletos de información para el paciente. No use COZAAR para una condición para la cual no fue recetado. No le dé COZAAR a otras personas, incluso si tienen los mismos síntomas que usted tiene. Puede que les haga daño.
Este folleto resume la información más importante sobre COZAAR. Si desea obtener más información, hable con su médico. Puede pedirle a su farmacéutico o médico información sobre COZAAR escrita para profesionales de la salud.
¿Cuáles son los ingredientes de COZAAR 25mg?
Ingredientes activos: losartán potásico
Ingredientes inactivos:
celulosa microcristalina, lactosa hidratada, almidón pregelatinizado, estearato de magnesio, hidroxipropilcelulosa, hipromelosa y dióxido de titanio. COZAAR 25 mg, COZAAR 50 mg y COZAAR 100 mg también pueden contener cera de carnauba.
