Coreg 3.12mg, 6.25mg, 12.5mg, 25mg Carvedilol Uso, efectos secundarios, resistencia y dosis. Precio en farmacia online. Medicamentos genericos sin receta.
¿Qué es Coreg 25mg y cómo se usa?
Coreg es un medicamento recetado que se usa para tratar los síntomas de la insuficiencia cardíaca y la presión arterial alta (hipertensión). Coreg 25 mg se puede usar solo o con otros medicamentos.
Coreg pertenece a una clase de medicamentos llamados Beta-Blockers, Alpha Activity.
No se sabe si Coreg 25 mg es seguro y efectivo en niños.
¿Cuáles son los posibles efectos secundarios de Coreg?
Coreg puede causar efectos secundarios graves que incluyen:
- aturdimiento,
- latidos cardíacos lentos o irregulares,
- sensación de frío o entumecimiento en los dedos de las manos o de los pies,
- Dolor de pecho,
- tos seca,
- sibilancias,
- opresión en el pecho,
- hinchazón,
- rápido aumento de peso,
- sintiendo dificultad para respirar,
- aumento de la sed,
- aumento de la micción,
- boca seca, y
- aliento con olor afrutado
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes de Coreg 6.25mg incluyen:
- mareo,
- latidos lentos del corazón,
- Diarrea,
- aumento de peso,
- ojos secos, y
- dificultad para usar lentes de contacto
Informe al médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de Coreg. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
DESCRIPCIÓN
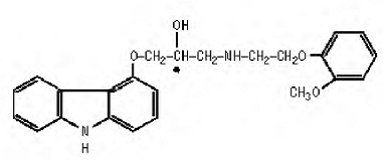
El carvedilol es un agente bloqueador β-adrenérgico no selectivo con actividad bloqueadora α1. Es (±)-1(Carbazol-4-iloxi)-3-[[2-(o-metoxifenoxi)etil]amino]-2-propanol. Carvedilol es una mezcla racémica con la siguiente estructura:
COREG 6,25 mg es un comprimido recubierto con película, blanco, ovalado, que contiene 3,125 mg, 6,25 mg, 12,5 mg o 25 mg de carvedilol. Las tabletas de 6,25 mg, 12,5 mg y 25 mg son tabletas TILTAB. Los ingredientes inactivos consisten en dióxido de silicio coloidal, crospovidona, hipromelosa, lactosa, estearato de magnesio, polietilenglicol, polisorbato 80, povidona, sacarosa y dióxido de titanio.
El carvedilol es un polvo de color blanco a blanquecino con un peso molecular de 406,5 y una fórmula molecular de C24H26N2O4. Es libremente soluble en dimetilsulfóxido; soluble en cloruro de metileno y metanol; escasamente soluble en etanol al 95% e isopropanol; ligeramente soluble en éter etílico; y prácticamente insoluble en agua, fluido gástrico (simulado, TS, pH 1,1) y fluido intestinal (simulado, TS sin pancreatina, pH 7,5).
INDICACIONES
Insuficiencia cardiaca
COREG está indicado para el tratamiento de la insuficiencia cardíaca crónica de leve a grave de origen isquémico o cardiomiopático, generalmente además de diuréticos, inhibidores de la ECA y digitálicos, para aumentar la supervivencia y, también, para reducir el riesgo de hospitalización [ver INTERACCIONES CON LA DROGAS , Estudios clínicos ].
Disfunción del ventrículo izquierdo después de un infarto de miocardio
COREG está indicado para reducir la mortalidad cardiovascular en pacientes clínicamente estables que han sobrevivido a la fase aguda de un infarto de miocardio y tienen una fracción de eyección del ventrículo izquierdo menor o igual al 40 % (con o sin insuficiencia cardíaca sintomática) [ver Estudios clínicos ].
Hipertensión
COREG 25 mg está indicado para el tratamiento de la hipertensión esencial [ver Estudios clínicos ]. Puede usarse solo o en combinación con otros agentes antihipertensivos, especialmente diuréticos de tipo tiazídico [ver INTERACCIONES CON LA DROGAS ].
DOSIFICACIÓN Y ADMINISTRACIÓN
COREG debe tomarse con alimentos para disminuir la tasa de absorción y reducir la incidencia de efectos ortostáticos.
Insuficiencia cardiaca
LA DOSIS DEBE SER INDIVIDUALIZADA Y SUPERVISADA DE CERCA POR UN MÉDICO DURANTE LA AJUSTE ASCENDENTE. Antes de iniciar COREG 12,5 mg, se recomienda minimizar la retención de líquidos. La dosis inicial recomendada de COREG es de 3,125 mg dos veces al día durante 2 semanas. Si se tolera, se puede aumentar la dosis de los pacientes a 6,25, 12,5 y 25 mg dos veces al día en intervalos sucesivos de al menos 2 semanas. Los pacientes deben mantenerse con dosis más bajas si no se toleran dosis más altas. Se ha administrado una dosis máxima de 50 mg dos veces al día a pacientes con insuficiencia cardíaca de leve a moderada que pesen más de 85 kg (187 libras).
Se debe advertir a los pacientes que el inicio del tratamiento y (en menor grado) los aumentos de dosis pueden estar asociados con síntomas transitorios de mareos o aturdimiento (y rara vez síncope) dentro de la primera hora después de la administración de la dosis. Durante estos períodos, los pacientes deben evitar situaciones como conducir o realizar tareas peligrosas, donde los síntomas podrían provocar lesiones. Los síntomas vasodilatadores a menudo no requieren tratamiento, pero puede ser útil separar el momento de la dosificación de COREG 6,25 mg del inhibidor de la ECA o reducir temporalmente la dosis del inhibidor de la ECA. La dosis de COREG 12,5 mg no debe aumentarse hasta que se hayan estabilizado los síntomas de empeoramiento de la insuficiencia cardíaca o vasodilatación.
La retención de líquidos (con o sin un empeoramiento transitorio de los síntomas de insuficiencia cardíaca) debe tratarse aumentando la dosis de diuréticos.
La dosis de COREG debe reducirse si los pacientes experimentan bradicardia (frecuencia cardíaca inferior a 55 latidos por minuto).
Los episodios de mareos o retención de líquidos durante el inicio de COREG 3,12 mg generalmente pueden controlarse sin interrumpir el tratamiento y no impiden una posterior titulación exitosa de carvedilol o una respuesta favorable al mismo.
Disfunción del ventrículo izquierdo después de un infarto de miocardio
LA DOSIS DEBE SER INDIVIDUALIZADA Y MONITORIZADA DURANTE LA AJUSTE ASCENDENTE. El tratamiento con COREG puede iniciarse como paciente hospitalizado o ambulatorio y debe iniciarse después de que el paciente esté hemodinámicamente estable y se haya minimizado la retención de líquidos. Se recomienda que COREG 3,12 mg se inicie con 6,25 mg dos veces al día y se aumente después de 3 a 10 días, según la tolerabilidad, a 12,5 mg dos veces al día, luego nuevamente a la dosis objetivo de 25 mg dos veces al día. Se puede usar una dosis inicial más baja (3,125 mg dos veces al día) y/o la velocidad de aumento de la titulación se puede reducir si está clínicamente indicado (p. ej., debido a presión arterial o frecuencia cardíaca bajas, o retención de líquidos). Los pacientes deben mantenerse con dosis más bajas si no se toleran dosis más altas. No es necesario modificar el régimen posológico recomendado en pacientes que recibieron tratamiento con un β-bloqueante intravenoso u oral durante la fase aguda del infarto de miocardio.
Hipertensión
LA DOSIS DEBE SER INDIVIDUALIZADA. La dosis inicial recomendada de COREG 6,25 mg es de 6,25 mg dos veces al día. Si se tolera esta dosis, usando como guía la presión sistólica en bipedestación medida aproximadamente 1 hora después de la administración, la dosis debe mantenerse durante 7 a 14 días y luego aumentarse a 12,5 mg dos veces al día si es necesario, según la presión arterial mínima, nuevamente usando presión sistólica de pie 1 hora después de la dosificación como guía para la tolerancia. Esta dosis también debe mantenerse durante 7 a 14 días y luego puede ajustarse hacia arriba a 25 mg dos veces al día si se tolera y es necesario. El efecto antihipertensivo completo de COREG 6,25 mg se observa entre 7 y 14 días. La dosis diaria total no debe exceder los 50 mg.
Se puede esperar que la administración concomitante con un diurético produzca efectos aditivos y exagere el componente ortostático de la acción del carvedilol.
Deterioro hepático
COREG 25 mg no debe administrarse a pacientes con insuficiencia hepática grave [ver CONTRAINDICACIONES ].
CÓMO SUMINISTRADO
Dosis y fortalezas
Los comprimidos recubiertos con película, blancos, ovalados, están disponibles en las siguientes concentraciones:
- 3.125 mg – grabado con “39” y “SB”
- 6,25 mg - grabado con "4140" y "SB"
- 12,5 mg - grabado con "4141" y "SB"
- 25 mg - grabado con "4142" y "SB"
Almacenamiento y manipulación
Los comprimidos recubiertos con película, blancos, ovalados, están disponibles en las siguientes concentraciones:
- 3.125 mg – grabado con “39” y “SB”
- 6,25 mg - grabado con "4140" y "SB"
- 12,5 mg - grabado con "4141" y "SB"
- 25 mg - grabado con "4142" y "SB"
Las tabletas de 6,25 mg, 12,5 mg y 25 mg son tabletas TILTAB.
- Frascos de 3,125 mg de 100: CDN 0007-4139-20
- Frascos de 6,25 mg de 100: CDN 0007-4140-20
- Frascos de 12,5 mg de 100: CDN 0007-4141-20
- Frascos de 25 mg de 100: CDN 0007-4142-20
Almacenar por debajo de 30°C (86°F). Proteger de la humedad. Dispensar en un recipiente hermético resistente a la luz.
Fabricado para: GlaxoSmithKline Research Triangle Park, NC 27709. Revisado: septiembre de 2017.
EFECTOS SECUNDARIOS
Experiencia en estudios clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Se ha evaluado la seguridad de COREG 25 mg en sujetos con insuficiencia cardíaca (leve, moderada y grave), en sujetos con disfunción ventricular izquierda después de un infarto de miocardio y en sujetos hipertensos. El perfil de eventos adversos observado fue consistente con la farmacología del fármaco y el estado de salud de los sujetos en los ensayos clínicos. Los eventos adversos informados para cada una de estas poblaciones de pacientes se proporcionan a continuación. Se excluyen los eventos adversos que se consideran demasiado generales para ser informativos y aquellos que no están razonablemente asociados con el uso del medicamento porque estaban asociados con la afección que se está tratando o son muy comunes en la población tratada. Las tasas de eventos adversos fueron generalmente similares entre los subconjuntos demográficos (hombres y mujeres, ancianos y no ancianos, negros y no negros).
Insuficiencia cardiaca
Se evaluó la seguridad de COREG 12,5 mg en la insuficiencia cardíaca en más de 4500 sujetos en todo el mundo, de los cuales más de 2100 participaron en ensayos clínicos controlados con placebo. Aproximadamente el 60 % de la población total tratada en ensayos clínicos controlados con placebo recibió COREG 3,12 mg durante al menos 6 meses y el 30 % recibió COREG durante al menos 12 meses. En el ensayo COMET, 1.511 sujetos con insuficiencia cardíaca de leve a moderada fueron tratados con COREG durante un máximo de 5,9 años (media: 4,8 años). Tanto en ensayos clínicos estadounidenses en insuficiencia cardíaca leve a moderada que compararon COREG 3,12 mg en dosis diarias de hasta 100 mg (n = 765) con placebo (n = 437), como en un ensayo clínico multinacional en insuficiencia cardíaca grave (COPERNICUS ) que comparó COREG en dosis diarias de hasta 50 mg (n = 1156) con placebo (n = 1133), las tasas de interrupción por experiencias adversas fueron similares en los sujetos con carvedilol y con placebo. En ensayos clínicos controlados con placebo, la única causa de interrupción superior al 1 % y que se produjo con más frecuencia con carvedilol fue el mareo (1,3 % con carvedilol, 0,6 % con placebo en el ensayo COPERNICUS).
La Tabla 1 muestra los eventos adversos informados en sujetos con insuficiencia cardíaca de leve a moderada inscritos en ensayos clínicos controlados con placebo en EE. UU. y con insuficiencia cardíaca grave inscritos en el ensayo COPERNICUS. Se muestran los eventos adversos que ocurrieron con mayor frecuencia en sujetos tratados con fármacos que en sujetos tratados con placebo con una incidencia mayor al 3% en sujetos tratados con carvedilol independientemente de la causalidad. La mediana de exposición a la medicación del ensayo fue de 6,3 meses para los sujetos con carvedilol y placebo en los ensayos de insuficiencia cardíaca leve a moderada y de 10,4 meses en el ensayo de sujetos con insuficiencia cardíaca grave. El perfil de eventos adversos de COREG 3.12 mg observado en el ensayo COMET a largo plazo fue generalmente similar al observado en los ensayos de insuficiencia cardíaca de EE. UU.
En estos ensayos también se informaron insuficiencia cardíaca y disnea, pero las tasas fueron iguales o mayores en los sujetos que recibieron placebo.
Los siguientes eventos adversos se informaron con una frecuencia mayor al 1 % pero menor o igual al 3 % y con mayor frecuencia con COREG 3.12 mg en los ensayos controlados con placebo en EE. UU. en sujetos con insuficiencia cardíaca leve a moderada o en sujetos con insuficiencia cardiaca grave en el ensayo COPERNICUS.
Incidencia mayor del 1% a menor o igual al 3%
Cuerpo como un todo: Alergia, malestar general, hipovolemia, fiebre, edema de piernas.
Cardiovascular: Sobrecarga de líquidos, hipotensión postural, angina de pecho agravada, bloqueo AV, palpitaciones, hipertensión.
Sistema Nervioso Central y Periférico: Hipestesia, vértigo, parestesia.
Gastrointestinal: Melena, periodontitis.
Hígado y Sistema Biliar: SGPT aumentó, SGOT aumentó.
Metabólicas y Nutricionales: Hiperuricemia, hipoglucemia, hiponatremia, aumento de la fosfatasa alcalina, glucosuria, hipervolemia, diabetes mellitus, aumento de la GGT, pérdida de peso, hiperpotasemia, aumento de la creatinina.
Musculoesquelético: Calambres musculares.
Plaquetas, sangrado y coagulación: Protrombina disminuida, púrpura, trombocitopenia.
Psiquiátrico: Somnolencia.
Reproductivo, masculino: Impotencia.
Sentidos especiales: Visión borrosa.
Sistema urinario: Insuficiencia renal, albuminuria, hematuria.
Disfunción del ventrículo izquierdo después de un infarto de miocardio
Se evaluó la seguridad de COREG en sobrevivientes de un infarto agudo de miocardio con disfunción ventricular izquierda en el ensayo CAPRICORN en el que participaron 969 sujetos que recibieron 6,25 mg de COREG y 980 que recibieron placebo. Aproximadamente el 75 % de los sujetos recibieron COREG 25 mg durante al menos 6 meses y el 53 % recibieron COREG 12,5 mg durante al menos 12 meses. Los sujetos fueron tratados durante un promedio de 12,9 meses y 12,8 meses con COREG 12,5 mg y placebo, respectivamente.
Los eventos adversos más comunes informados con COREG 25 mg en el ensayo CAPRICORN fueron consistentes con el perfil del fármaco en los ensayos de insuficiencia cardíaca de EE. UU. y el ensayo COPERNICUS. Los únicos eventos adversos adicionales informados en CAPRICORNIO en más del 3% de los sujetos y más comúnmente en carvedilol fueron disnea, anemia y edema pulmonar. Los siguientes eventos adversos se informaron con una frecuencia mayor al 1% pero menor o igual al 3% y con mayor frecuencia con COREG: síndrome gripal, accidente cerebrovascular, trastorno vascular periférico, hipotonía, depresión, dolor gastrointestinal, artritis y gota. Las tasas generales de interrupciones debido a eventos adversos fueron similares en ambos grupos de sujetos. En esta base de datos, la única causa de discontinuación superior al 1 % y que ocurrió con más frecuencia con carvedilol fue la hipotensión (1,5 % con carvedilol, 0,2 % con placebo).
Hipertensión
Se evaluó la seguridad de COREG en hipertensión en más de 2193 sujetos en ensayos clínicos en los EE. UU. y en 2976 sujetos en ensayos clínicos internacionales. Aproximadamente el 36% de la población total tratada recibió COREG durante al menos 6 meses. La mayoría de los eventos adversos informados durante la terapia con COREG 25 mg fueron de gravedad leve a moderada. En ensayos clínicos controlados en EE. UU. que compararon directamente COREG 12,5 mg en dosis de hasta 50 mg (n = 1142) con placebo (n = 462), el 4,9 % de los sujetos que recibieron COREG 6,25 mg interrumpieron el tratamiento por eventos adversos frente al 5,2 % de los sujetos que recibieron placebo. Aunque no hubo una diferencia general en las tasas de discontinuación, las discontinuaciones fueron más comunes en el grupo de carvedilol por hipotensión postural (1% versus 0). La incidencia general de eventos adversos en los ensayos controlados con placebo en EE. UU. aumentó con el aumento de la dosis de COREG. Para eventos adversos individuales, esto solo se pudo distinguir por mareos, cuya frecuencia aumentó del 2% al 5% a medida que la dosis diaria total aumentaba de 6,25 mg a 50 mg.
La Tabla 2 muestra los eventos adversos en ensayos clínicos controlados con placebo en EE. UU. para la hipertensión que ocurrieron con una incidencia mayor o igual al 1 % independientemente de la causalidad y que fueron más frecuentes en sujetos tratados con medicamentos que en sujetos tratados con placebo.
En estos ensayos también se informaron disnea y fatiga, pero las tasas fueron iguales o mayores en los sujetos que recibieron placebo.
Los siguientes eventos adversos no descritos anteriormente se informaron como posiblemente o probablemente relacionados con COREG 25 mg en ensayos abiertos o controlados en todo el mundo con COREG 12,5 mg en sujetos con hipertensión o insuficiencia cardíaca.
Incidencia mayor a 0.1% a menor o igual a 1%
Cardiovascular: Isquemia periférica, taquicardia.
Sistema Nervioso Central y Periférico m: Hipocinesia.
Gastrointestinal: Bilirrubinemia, aumento de las enzimas hepáticas (el 0,2 % de los pacientes con hipertensión y el 0,4 % de los pacientes con insuficiencia cardíaca interrumpieron el tratamiento debido al aumento de las enzimas hepáticas) [ver Experiencia posterior a la comercialización ].
Psiquiátrico: Nerviosismo, trastorno del sueño, depresión agravada, problemas de concentración, pensamiento anormal, paroniria, labilidad emocional.
Sistema respiratorio: Asma [ver CONTRAINDICACIONES ].
Reproductivo, masculino: Disminución de la libido.
Piel y apéndices: Prurito, exantema eritematoso, exantema maculopapular, exantema psoriaforme, reacción de fotosensibilidad.
Sentidos especiales: Tinnitus.
Sistema urinario: Aumento de la frecuencia de la micción.
Sistema nervioso autónomo: Boca seca, aumento de la sudoración.
Metabólicas y Nutricionales: Hipopotasemia, hipertrigliceridemia.
hematológico: Anemia, leucopenia.
Los siguientes eventos se informaron en menos del 0,1 % de los sujetos o en el mismo porcentaje y son potencialmente importantes: bloqueo AV completo, bloqueo de rama, isquemia miocárdica, trastorno cerebrovascular, convulsiones, migraña, neuralgia, paresia, reacción anafilactoide, alopecia, dermatitis exfoliativa, amnesia, hemorragia GI, broncoespasmo, edema pulmonar, disminución de la audición, alcalosis respiratoria, aumento del BUN, disminución del HDL, pancitopenia y linfocitos atípicos.
Anomalías de laboratorio
Se han observado elevaciones reversibles de las transaminasas séricas (ALT o AST) durante el tratamiento con COREG. Las tasas de elevaciones de transaminasas (2 a 3 veces el límite superior de lo normal) observadas durante los ensayos clínicos controlados han sido generalmente similares entre los sujetos tratados con COREG y los tratados con placebo. Sin embargo, se han observado elevaciones de transaminasas, confirmadas por reexposición, con COREG. En un ensayo a largo plazo controlado con placebo en insuficiencia cardíaca grave, los sujetos tratados con COREG 25 mg tenían valores más bajos de transaminasas hepáticas que los sujetos tratados con placebo, posiblemente porque las mejoras en la función cardíaca inducidas por COREG 6,25 mg condujeron a una menor congestión hepática y/ o mejora del flujo sanguíneo hepático.
COREG 25 mg no se ha asociado con cambios clínicamente significativos en el potasio sérico, los triglicéridos totales, el colesterol total, el colesterol HDL, el ácido úrico, el nitrógeno ureico en sangre o la creatinina. No se observaron cambios clínicamente relevantes en la glucosa sérica en ayunas en pacientes hipertensos; La glucosa sérica en ayunas no se evaluó en los ensayos clínicos de insuficiencia cardíaca.
Experiencia posterior a la comercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de COREG. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Trastornos de la sangre y del sistema linfático
Anemia aplásica.
Trastornos del sistema inmunológico
Hipersensibilidad (por ejemplo, reacciones anafilácticas, angioedema, urticaria).
Trastornos renales y urinarios
Incontinencia urinaria.
Trastornos respiratorios, torácicos y mediastínicos
Neumonitis intersticial.
Trastornos de la piel y del tejido subcutáneo
Síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, eritema multiforme.
INTERACCIONES CON LA DROGAS
Inhibidores de CYP2D6 y metabolizadores lentos
No se han estudiado las interacciones de carvedilol con inhibidores potentes de la isoenzima CYP2D6 (como quinidina, fluoxetina, paroxetina y propafenona), pero se espera que estos medicamentos aumenten los niveles sanguíneos del enantiómero R(+) de carvedilol [ver FARMACOLOGÍA CLÍNICA ]. El análisis retrospectivo de los efectos secundarios en los ensayos clínicos mostró que los metabolizadores lentos de 2D6 tenían una mayor tasa de mareos durante la titulación, presumiblemente como resultado de los efectos vasodilatadores de las concentraciones más altas del enantiómero R(+) bloqueador α.
Agentes hipotensores
Los pacientes que toman un β-bloqueador y un fármaco que puede reducir las catecolaminas (p. ej., reserpina e inhibidores de la monoaminooxidasa) deben ser observados de cerca en busca de signos de hipotensión y/o bradicardia grave.
La administración concomitante de clonidina con un β-bloqueador puede causar hipotensión y bradicardia. Cuando se deba interrumpir el tratamiento concomitante con un β-bloqueador y clonidina, primero se debe suspender el β-bloqueador. La terapia con clonidina puede interrumpirse varios días después disminuyendo gradualmente la dosis.
ciclosporina
Se observaron aumentos modestos en las concentraciones mínimas medias de ciclosporina después del inicio del tratamiento con carvedilol en 21 sujetos con trasplante renal que padecían rechazo vascular crónico. En aproximadamente el 30% de los sujetos, la dosis de ciclosporina tuvo que reducirse para mantener las concentraciones de ciclosporina dentro del rango terapéutico, mientras que en el resto no fue necesario ningún ajuste. En promedio para el grupo, la dosis de ciclosporina se redujo en un 20% en estos sujetos. Debido a la amplia variabilidad interindividual en el ajuste de la dosis requerida, se recomienda monitorear de cerca las concentraciones de ciclosporina después de iniciar la terapia con carvedilol y que la dosis de ciclosporina se ajuste según corresponda.
Glucósidos digitálicos
Tanto los glucósidos digitálicos como los bloqueadores β retardan la conducción auriculoventricular y disminuyen la frecuencia cardíaca. El uso concomitante puede aumentar el riesgo de bradicardia. Las concentraciones de digoxina aumentan aproximadamente un 15% cuando se administran concomitantemente digoxina y carvedilol. Por lo tanto, se recomienda un mayor control de la digoxina al iniciar, ajustar o suspender COREG [ver FARMACOLOGÍA CLÍNICA ].
Inductores/inhibidores del metabolismo hepático
La rifampicina redujo las concentraciones plasmáticas de carvedilol en aproximadamente un 70% [ver FARMACOLOGÍA CLÍNICA ]. La cimetidina aumentó el AUC en aproximadamente un 30 %, pero no provocó cambios en la Cmax [ver FARMACOLOGÍA CLÍNICA ].
amiodarona
La amiodarona y su metabolito desetil amiodarona, los inhibidores de CYP2C9 y la glicoproteína P aumentaron las concentraciones del enantiómero S(-) de carvedilol al menos dos veces [ver FARMACOLOGÍA CLÍNICA ]. La administración concomitante de amiodarona u otros inhibidores de CYP2C9, como fluconazol, con COREG puede aumentar la actividad de bloqueo β, lo que provoca una mayor disminución de la frecuencia cardíaca o de la conducción cardíaca. Se debe observar a los pacientes en busca de signos de bradicardia o bloqueo cardíaco, particularmente cuando se agrega un agente al tratamiento preexistente con el otro.
Bloqueadores de los canales de calcio
Se han observado alteraciones de la conducción (raramente con compromiso hemodinámico) cuando COREG 25 mg se coadministra con diltiazem. Al igual que con otros bloqueadores β, si COREG 25 mg se administra con bloqueadores de los canales de calcio del tipo verapamilo o diltiazem, se recomienda controlar el ECG y la presión arterial.
Insulina o hipoglucemiantes orales
Los bloqueadores β pueden aumentar el efecto reductor del azúcar en la sangre de la insulina y los hipoglucemiantes orales. Por lo tanto, en pacientes que toman insulina o hipoglucemiantes orales, se recomienda un control regular de la glucosa en sangre [ver ADVERTENCIAS Y PRECAUCIONES ].
Anestesia
Si se va a continuar el tratamiento con COREG perioperatoriamente, se debe tener especial cuidado cuando se usan agentes anestésicos que deprimen la función miocárdica, como éter, ciclopropano y tricloroetileno [ver SOBREDOSIS ].
ADVERTENCIAS
Incluido como parte de la "PRECAUCIONES" Sección
PRECAUCIONES
Cese de la terapia
Se debe advertir a los pacientes con enfermedad de las arterias coronarias que están siendo tratados con COREG que no interrumpan abruptamente la terapia. Se han notificado exacerbaciones graves de la angina y la aparición de infarto de miocardio y arritmias ventriculares en pacientes con angina tras la interrupción brusca del tratamiento con bloqueadores beta. Las últimas 2 complicaciones pueden ocurrir con o sin exacerbación previa de la angina de pecho. Al igual que con otros β-bloqueantes, cuando se planifique la interrupción de COREG, se debe observar cuidadosamente a los pacientes y aconsejarles que limiten la actividad física al mínimo. COREG debe suspenderse durante 1 a 2 semanas siempre que sea posible. Si la angina empeora o se desarrolla insuficiencia coronaria aguda, se recomienda que COREG se reinstituya de inmediato, al menos temporalmente. Debido a que la enfermedad de las arterias coronarias es común y puede pasar desapercibida, puede ser prudente no suspender la terapia con COREG 3.12 mg abruptamente, incluso en pacientes tratados solo por hipertensión o insuficiencia cardíaca.
bradicardia
En ensayos clínicos, COREG 25 mg provocó bradicardia en aproximadamente el 2 % de los sujetos hipertensos, el 9 % de los sujetos con insuficiencia cardíaca y el 6,5 % de los sujetos con infarto de miocardio y disfunción ventricular izquierda. Si la frecuencia del pulso cae por debajo de 55 latidos por minuto, se debe reducir la dosis.
Hipotensión
En ensayos clínicos de insuficiencia cardíaca principalmente de leve a moderada, se produjo hipotensión e hipotensión postural en el 9,7 % y síncope en el 3,4 % de los sujetos que recibieron COREG en comparación con el 3,6 % y el 2,5 % de los sujetos que recibieron placebo, respectivamente. El riesgo de estos eventos fue mayor durante los primeros 30 días de dosificación, correspondientes al período de aumento de dosis y fue la causa de la interrupción de la terapia en el 0,7 % de los sujetos que recibieron COREG 12,5 mg, en comparación con el 0,4 % de los sujetos que recibieron placebo. En un ensayo a largo plazo controlado con placebo en insuficiencia cardíaca grave (COPERNICUS), se produjo hipotensión e hipotensión postural en el 15,1 % y síncope en el 2,9 % de los sujetos con insuficiencia cardíaca que recibieron COREG en comparación con el 8,7 % y el 2,3 % de los sujetos que recibieron placebo, respectivamente. Estos eventos fueron la causa de la suspensión del tratamiento en el 1,1 % de los sujetos que recibieron COREG, en comparación con el 0,8 % de los sujetos que recibieron placebo.
Se produjo hipotensión postural en el 1,8 % y síncope en el 0,1 % de los sujetos hipertensos, principalmente después de la dosis inicial o en el momento del aumento de la dosis y fue motivo de interrupción del tratamiento en el 1 % de los sujetos.
En el ensayo CAPRICORN de sobrevivientes de un infarto agudo de miocardio, se produjo hipotensión o hipotensión postural en el 20,2 % de los sujetos que recibieron COREG en comparación con el 12,6 % de los sujetos que recibieron placebo. Se notificó síncope en el 3,9 % y el 1,9 % de los sujetos, respectivamente. Estos eventos fueron la causa de la interrupción de la terapia en el 2,5 % de los sujetos que recibieron COREG, en comparación con el 0,2 % de los sujetos que recibieron placebo.
Comenzar con una dosis baja, administrarla con alimentos y aumentar gradualmente la titulación debería disminuir la probabilidad de síncope o hipotensión excesiva [ver DOSIFICACIÓN Y ADMINISTRACIÓN ]. Durante el inicio de la terapia, se debe advertir al paciente que evite situaciones como conducir o realizar tareas peligrosas, en las que se podrían producir lesiones en caso de síncope.
Insuficiencia cardíaca/retención de líquidos
Puede ocurrir un empeoramiento de la insuficiencia cardíaca o retención de líquidos durante la titulación ascendente de carvedilol. Si se presentan tales síntomas, se deben aumentar los diuréticos y no se debe adelantar la dosis de carvedilol hasta que se reanude la estabilidad clínica [ver DOSIFICACIÓN Y ADMINISTRACIÓN ]. Ocasionalmente es necesario disminuir la dosis de carvedilol o suspenderla temporalmente. Dichos episodios no impiden la posterior titulación exitosa de carvedilol o una respuesta favorable al mismo. En un ensayo controlado con placebo de sujetos con insuficiencia cardíaca grave, se informó un empeoramiento de la insuficiencia cardíaca durante los primeros 3 meses en un grado similar con carvedilol y con placebo. Cuando el tratamiento se mantuvo más allá de los 3 meses, el empeoramiento de la insuficiencia cardíaca se notificó con menos frecuencia en los sujetos tratados con carvedilol que en los tratados con placebo. Es más probable que el empeoramiento de la insuficiencia cardíaca observado durante la terapia a largo plazo esté relacionado con la enfermedad subyacente de los pacientes que con el tratamiento con carvedilol.
Broncoespasmo no alérgico
Los pacientes con enfermedad broncoespástica (p. ej., bronquitis crónica, enfisema) no deben, en general, recibir bloqueadores β. COREG puede usarse con precaución, sin embargo, en pacientes que no responden o no pueden tolerar otros agentes antihipertensivos. Es prudente, si se usa COREG, usar la dosis efectiva más pequeña, de modo que se minimice la inhibición de los agonistas β endógenos o exógenos.
En ensayos clínicos de sujetos con insuficiencia cardíaca, se inscribieron sujetos con enfermedad broncoespástica si no requerían medicación oral o inhalada para tratar su enfermedad broncoespástica. En tales pacientes, se recomienda usar carvedilol con precaución. Las recomendaciones de dosificación deben seguirse de cerca y la dosis debe reducirse si se observa cualquier evidencia de broncoespasmo durante la titulación ascendente.
Control glucémico en diabetes tipo 2
En general, los bloqueadores β pueden enmascarar algunas de las manifestaciones de la hipoglucemia, en particular la taquicardia. Los bloqueadores β no selectivos pueden potenciar la hipoglucemia inducida por insulina y retrasar la recuperación de los niveles séricos de glucosa. Se debe advertir sobre estas posibilidades a los pacientes sujetos a hipoglucemia espontánea o a los pacientes diabéticos que reciben insulina o agentes hipoglucemiantes orales.
En pacientes con insuficiencia cardiaca y diabetes, el tratamiento con carvedilol puede provocar un empeoramiento de la hiperglucemia, que responde a la intensificación del tratamiento hipoglucemiante. Se recomienda controlar la glucosa en sangre cuando se inicia, ajusta o interrumpe la dosificación de carvedilol. No se han realizado ensayos diseñados para examinar los efectos del carvedilol en el control glucémico en pacientes con diabetes e insuficiencia cardíaca.
En un ensayo diseñado para examinar los efectos del carvedilol en el control glucémico en una población con hipertensión de leve a moderada y diabetes mellitus tipo 2 bien controlada, el carvedilol no tuvo efectos adversos en el control glucémico, según las mediciones de HbA1c [ver Estudios clínicos ].
Enfermedad vascular periférica
Los bloqueadores β pueden precipitar o agravar los síntomas de insuficiencia arterial en pacientes con enfermedad vascular periférica. Se debe tener precaución en tales individuos.
Deterioro de la función renal
En raras ocasiones, el uso de carvedilol en pacientes con insuficiencia cardíaca ha resultado en un deterioro de la función renal. Los pacientes en riesgo parecen ser aquellos con presión arterial baja (presión arterial sistólica inferior a 100 mm Hg), cardiopatía isquémica y enfermedad vascular difusa y/o insuficiencia renal subyacente. La función renal ha vuelto a la línea de base cuando se suspendió el carvedilol. En pacientes con estos factores de riesgo, se recomienda controlar la función renal durante la titulación ascendente de carvedilol y suspender el fármaco o reducir la dosis si se produce un empeoramiento de la función renal.
Cirujía importante
La terapia β-bloqueante administrada crónicamente no debe retirarse de forma rutinaria antes de una cirugía mayor; sin embargo, el deterioro de la capacidad del corazón para responder a los estímulos adrenérgicos reflejos puede aumentar los riesgos de la anestesia general y los procedimientos quirúrgicos.
tirotoxicosis
El bloqueo β-adrenérgico puede enmascarar signos clínicos de hipertiroidismo, como taquicardia. La interrupción abrupta del bloqueo β puede ser seguida por una exacerbación de los síntomas de hipertiroidismo o puede precipitar una tormenta tiroidea.
Feocromocitoma
En pacientes con feocromocitoma, se debe iniciar un agente bloqueador α antes del uso de cualquier agente bloqueador β. Aunque el carvedilol tiene actividades farmacológicas de bloqueo tanto α como β, no ha habido experiencia con su uso en esta condición. Por lo tanto, se debe tener precaución en la administración de carvedilol a pacientes con sospecha de feocromocitoma.
Angina variante de Prinzmetal
Los agentes con actividad β-bloqueante no selectiva pueden provocar dolor torácico en pacientes con angina variante de Prinzmetal. No ha habido experiencia clínica con carvedilol en estos pacientes, aunque la actividad de bloqueo alfa puede prevenir tales síntomas. Sin embargo, se debe tener precaución en la administración de carvedilol a pacientes con sospecha de angina variante de Prinzmetal.
Riesgo de reacción anafiláctica
Mientras toman bloqueadores β, los pacientes con antecedentes de reacción anafiláctica grave a una variedad de alérgenos pueden ser más reactivos a la provocación repetida, ya sea accidental, diagnóstica o terapéutica. Dichos pacientes pueden no responder a las dosis habituales de epinefrina utilizadas para tratar la reacción alérgica.
Síndrome del iris flácido intraoperatorio
Se ha observado el síndrome del iris flácido intraoperatorio (IFIS) durante la cirugía de cataratas en algunos pacientes tratados con bloqueadores alfa-1 (COREG es un bloqueador alfa/beta). Esta variante del síndrome de la pupila pequeña se caracteriza por la combinación de un iris flácido que se hincha en respuesta a las corrientes de irrigación intraoperatorias, miosis intraoperatoria progresiva a pesar de la dilatación preoperatoria con midriáticos estándar y posible prolapso del iris hacia las incisiones de facoemulsificación. El oftalmólogo del paciente debe estar preparado para posibles modificaciones en la técnica quirúrgica, como la utilización de ganchos de iris, anillos dilatadores de iris o sustancias viscoelásticas. No parece haber ningún beneficio en suspender la terapia con bloqueadores alfa-1 antes de la cirugía de cataratas.
Información de asesoramiento para pacientes
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA ( INFORMACIÓN DEL PACIENTE ).
Los pacientes que toman COREG deben ser informados de lo siguiente:
- Los pacientes deben tomar COREG con alimentos.
- Los pacientes no deben interrumpir o descontinuar el uso de COREG 25 mg sin el consejo de un médico.
- Los pacientes con insuficiencia cardíaca deben consultar a su médico si experimentan signos o síntomas de empeoramiento de la insuficiencia cardíaca, como aumento de peso o aumento de la dificultad para respirar.
- Los pacientes pueden experimentar una disminución de la presión arterial cuando están de pie, lo que provoca mareos y, en raras ocasiones, desmayos. Los pacientes deben sentarse o acostarse cuando se presenten estos síntomas de disminución de la presión arterial.
- Si experimenta mareos o fatiga, los pacientes deben evitar conducir o realizar tareas peligrosas.
- Los pacientes deben consultar a un médico si experimentan mareos o desmayos, en caso de que se deba ajustar la dosis.
- Los pacientes diabéticos deben informar a su médico sobre cualquier cambio en los niveles de azúcar en la sangre.
- Los usuarios de lentes de contacto pueden experimentar una disminución del lagrimeo.
COREG 25 mg, COREG 3,12 mg CR y TILTAB son marcas comerciales propiedad del grupo de empresas GSK o con licencia para este.
La otra marca enumerada es una marca comercial propiedad de su propietario o con licencia para este y no es propiedad ni tiene licencia del grupo de empresas GSK. El fabricante de esta marca no está afiliado ni respalda al grupo de empresas GSK ni a sus productos.
Toxicología no clínica
Carcinogénesis, Mutagénesis, Deterioro De La Fertilidad
En estudios de 2 años realizados en ratas que recibieron carvedilol en dosis de hasta 75 mg por kg por día (12 veces la MRHD como mg por m2) o en ratones que recibieron hasta 200 mg por kg por día (16 veces la MRHD como mg por m2), el carvedilol no tuvo efecto cancerígeno.
El carvedilol fue negativo cuando se probó en una batería de ensayos de genotoxicidad, incluidos los ensayos Ames y CHO/HGPRT para mutagenicidad y micronúcleos de hámster in vitro y pruebas de células de linfocitos humanos in vivo para clastogenicidad.
En un estudio combinado de fertilidad/desarrollo/toxicidad posnatal, a las ratas se les administró carvedilol (12, 60, 300 mg por kg por día) por vía oral por sonda durante 2 semanas antes del apareamiento y durante el apareamiento, la gestación y el destete para las hembras y durante 62 días antes y durante el apareamiento para los machos. A una dosis de 300 mg por kg por día (mayor o igual a 50 veces la MRHD como mg por m2), el carvedilol fue tóxico para las ratas adultas (sedación, aumento de peso reducido) y se asoció con un número reducido de apareamientos exitosos, tiempo de apareamiento, menos cuerpos lúteos e implantes por madre, menos crías vivas por camada y retrasos en el crecimiento/desarrollo físico. El nivel sin efecto para la toxicidad manifiesta y el deterioro de la fertilidad fue de 60 mg por kg por día (10 veces la MRHD como mg por m2).
Uso en poblaciones específicas
El embarazo
Resumen de riesgos
Los datos disponibles sobre el uso de COREG 12,5 mg en mujeres embarazadas son insuficientes para determinar si existen riesgos asociados con el fármaco de resultados adversos del desarrollo. Hay riesgos para la madre y el feto asociados con la hipertensión mal controlada durante el embarazo. El uso de bloqueadores beta durante el tercer trimestre del embarazo puede aumentar el riesgo de hipotensión, bradicardia, hipoglucemia y depresión respiratoria en el recién nacido. ver Consideraciones clínicas ]. En estudios de reproducción animal, no hubo evidencia de resultados adversos en el desarrollo a dosis clínicamente relevantes [ ver Datos ]. La administración oral de carvedilol a ratas preñadas durante la organogénesis resultó en una pérdida posterior a la implantación, una disminución del peso corporal fetal y una mayor frecuencia de retraso en el desarrollo del esqueleto fetal en dosis tóxicas para la madre que eran 50 veces la dosis máxima recomendada en humanos (MRHD). Además, la administración oral de carvedilol a conejas preñadas durante la organogénesis resultó en un aumento de las pérdidas posteriores a la implantación en dosis 25 veces superiores a la MRHD [ ver Datos ].
Se desconoce el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo para las poblaciones indicadas. Todos los embarazos tienen un riesgo de fondo de defecto congénito, pérdida u otros resultados adversos. En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 % al 4 % y del 15 % al 20 %, respectivamente.
Consideraciones clínicas
Riesgo materno y/o embrionario/fetal asociado a la enfermedad
La hipertensión en el embarazo aumenta el riesgo materno de preeclampsia, diabetes gestacional, parto prematuro y complicaciones del parto (p. ej., necesidad de cesárea y hemorragia posparto). La hipertensión aumenta el riesgo fetal de restricción del crecimiento intrauterino y muerte intrauterina. Las mujeres embarazadas con hipertensión deben ser monitoreadas cuidadosamente y tratadas en consecuencia.
Reacciones adversas fetales/neonatales
Los recién nacidos de mujeres con hipertensión que reciben tratamiento con bloqueadores beta durante el tercer trimestre del embarazo pueden tener un mayor riesgo de hipotensión, bradicardia, hipoglucemia y depresión respiratoria. Observe a los recién nacidos en busca de síntomas de hipotensión, bradicardia, hipoglucemia y depresión respiratoria y trátelos en consecuencia.
Datos
Datos de animales
Los estudios realizados en ratas y conejos que recibieron carvedilol durante la organogénesis fetal revelaron una mayor pérdida posterior a la implantación en ratas con una dosis tóxica para la madre de 300 mg por kg por día (50 veces la MRHD como mg por m2) y en conejos (en ausencia de la madre). toxicidad) en dosis de 75 mg por kg por día (25 veces la MRHD como mg por m2). En las ratas, también hubo una disminución en el peso corporal fetal con 300 mg por kg por día (50 veces la MRHD como mg por m2) acompañada de una mayor incidencia de fetos con desarrollo esquelético retrasado. En ratas, el nivel sin efecto para la toxicidad embriofetal fue de 60 mg por kg por día (10 veces la MRHD como mg por m2); en conejos, fue de 15 mg por kg por día (5 veces la MRHD como mg por m2). En un estudio de desarrollo pre y posnatal en ratas a las que se administró carvedilol desde el final de la gestación hasta la lactancia, se observó un aumento de la letalidad embrionaria con una dosis tóxica para la madre de 200 mg por kg por día (aproximadamente 32 veces la MRHD como mg por m2), y se observaron mortalidad de crías y retrasos en el crecimiento/desarrollo físico con 60 mg por kg por día (10 veces la MRHD como mg por m2) en ausencia de toxicidad materna. El nivel sin efecto fue de 12 mg por kg por día (2 veces la MRHD como mg por m2). El carvedilol estaba presente en tejido fetal de rata.
Lactancia
Resumen de riesgos
No hay datos sobre la presencia de carvedilol en la leche humana, los efectos sobre el lactante o los efectos sobre la producción de leche. El carvedilol está presente en la leche de ratas lactantes. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de COREG y cualquier posible efecto adverso en el bebé amamantado de COREG 3.12 mg o de la condición materna subyacente.
Uso pediátrico
No se ha establecido la eficacia de COREG 3,12 mg en pacientes menores de 18 años.
En un ensayo doble ciego, 161 niños (edad media: 6 años; rango: 2 meses a 17 años; 45 % menores de 2 años) con insuficiencia cardíaca crónica [NYHA clase II-IV, fracción de eyección del ventrículo izquierdo inferior al 40 % para niños con un ventrículo izquierdo (VI) sistémico y disfunción ventricular moderada-grave cualitativamente por ecografía para aquellos con un ventrículo sistémico que no era un VI] que estaban recibiendo un tratamiento de base estándar fueron aleatorizados para recibir placebo o 2 niveles de dosis de carvedilol. Estos niveles de dosis produjeron una reducción de la frecuencia cardíaca corregida con placebo de 4 a 6 latidos cardíacos por minuto, lo que indica actividad de bloqueo β. La exposición pareció ser menor en sujetos pediátricos que en adultos. Después de 8 meses de seguimiento, no hubo un efecto significativo del tratamiento sobre los resultados clínicos. Las reacciones adversas en este ensayo que ocurrieron en más del 10 % de los sujetos tratados con COREG y al doble de la tasa de los sujetos tratados con placebo incluyeron dolor torácico (17 % frente a 6 %), mareos (13 % frente a 2 %) y disnea ( 11% versus 0%).
Uso geriátrico
De los 765 sujetos con insuficiencia cardíaca asignados aleatoriamente a COREG 6,25 mg en los ensayos clínicos de EE. UU., el 31 % (235) tenía 65 años o más y el 7,3 % (56) tenía 75 años o más. De los 1.156 sujetos aleatorizados a COREG 3,12 mg en un ensayo a largo plazo controlado con placebo en insuficiencia cardíaca grave, el 47 % (547) tenía 65 años o más y el 15 % (174) tenía 75 años o más. De 3.025 sujetos que recibieron COREG 6,25 mg en ensayos de insuficiencia cardíaca en todo el mundo, el 42 % tenía 65 años o más.
De los 975 sujetos con infarto de miocardio asignados al azar a COREG en el ensayo CAPRICORN, el 48 % (468) tenía 65 años o más y el 11 % (111) tenía 75 años o más.
De los 2065 sujetos hipertensos en ensayos clínicos de eficacia o seguridad en los EE. UU. que fueron tratados con COREG 25 mg, el 21 % (436) tenían 65 años o más. De 3.722 sujetos que recibieron COREG en ensayos clínicos de hipertensión realizados en todo el mundo, el 24 % tenía 65 años o más.
Con la excepción de los mareos en sujetos hipertensos (incidencia del 8,8 % en ancianos frente al 6 % en sujetos más jóvenes), no se observaron diferencias generales en la seguridad o la eficacia (véanse las Figuras 2 y 4) entre los sujetos mayores y los sujetos más jóvenes en cada uno de los aspectos. estas poblaciones. De manera similar, otra experiencia clínica informada no ha identificado diferencias en las respuestas entre los ancianos y los sujetos más jóvenes, pero no se puede descartar una mayor sensibilidad de algunos individuos mayores.
SOBREDOSIS
La sobredosis puede causar hipotensión grave, bradicardia, insuficiencia cardíaca, shock cardiogénico y paro cardíaco. También pueden ocurrir problemas respiratorios, broncoespasmos, vómitos, lapsos de conciencia y convulsiones generalizadas.
El paciente debe colocarse en posición supina y, cuando sea necesario, mantenerse bajo observación y ser tratado en condiciones de cuidados intensivos. Se pueden administrar los siguientes agentes:
Para bradicardia excesiva : Atropina, 2 mg IV.
Para apoyar la función cardiovascular Glucagón, 5 a 10 mg IV rápidamente durante 30 segundos, seguido de una infusión continua de 5 mg por hora; simpaticomiméticos (dobutamina, isoprenalina, adrenalina) a dosis según peso corporal y efecto.
Si domina la vasodilatación periférica, puede ser necesario administrar adrenalina o noradrenalina con vigilancia continua de las condiciones circulatorias. Para la bradicardia resistente a la terapia, se debe realizar una terapia con marcapasos. Para el broncoespasmo, se deben administrar simpaticomiméticos β (como aerosol o IV) o aminofilina IV. En caso de convulsiones, se recomienda la inyección intravenosa lenta de diazepam o clonazepam.
NOTA: En caso de intoxicación grave con síntomas de shock, se debe continuar el tratamiento con antídotos durante un período de tiempo suficientemente prolongado que coincida con la vida media de 7 a 10 horas del carvedilol.
Se han notificado casos de sobredosis con COREG 3,12 mg solo o en combinación con otros fármacos. Las cantidades ingeridas en algunos casos superaban los 1.000 miligramos. Los síntomas experimentados incluyeron presión arterial baja y frecuencia cardíaca. Se proporcionó tratamiento de apoyo estándar y los individuos se recuperaron.
CONTRAINDICACIONES
COREG 25 mg está contraindicado en las siguientes condiciones:
- Asma bronquial o condiciones broncoespásticas relacionadas. Se han informado muertes por estado asmático después de dosis únicas de COREG.
- Bloqueo AV de segundo o tercer grado.
- Síndrome del seno enfermo.
- Bradicardia grave (a menos que tenga colocado un marcapasos permanente).
- Pacientes con shock cardiogénico o que presenten insuficiencia cardiaca descompensada que requieran el uso de terapia inotrópica intravenosa. Dichos pacientes deben retirarse primero de la terapia intravenosa antes de iniciar COREG.
- Pacientes con insuficiencia hepática grave.
- Pacientes con antecedentes de una reacción de hipersensibilidad grave (p. ej., síndrome de Stevens-Johnson, reacción anafiláctica, angioedema) a cualquier componente de este medicamento u otros medicamentos que contengan carvedilol.
FARMACOLOGÍA CLÍNICA
Mecanismo de acción
COREG 3.12 mg es una mezcla racémica en la que la actividad bloqueadora no selectiva de los receptores adrenérgicos β está presente en el enantiómero S(-) y la actividad bloqueadora adrenérgica α1 está presente en los enantiómeros R(+) y S(-) a la misma potencia. COREG 6,25 mg no tiene actividad simpaticomimética intrínseca.
Farmacodinámica
Insuficiencia cardiaca
No se ha establecido la base de los efectos beneficiosos de COREG en la insuficiencia cardíaca.
Dos ensayos controlados con placebo compararon los efectos hemodinámicos agudos de COREG con las mediciones iniciales en 59 y 49 sujetos con insuficiencia cardíaca clase II-IV de la NYHA que recibían diuréticos, inhibidores de la ECA y digitálicos. Hubo reducciones significativas en la presión arterial sistémica, la presión de la arteria pulmonar, la presión de enclavamiento de los capilares pulmonares y la frecuencia cardíaca. Los efectos iniciales sobre el gasto cardíaco, el índice de volumen sistólico y la resistencia vascular sistémica fueron pequeños y variables.
Estos ensayos midieron los efectos hemodinámicos nuevamente a las 12 a 14 semanas. COREG 25 mg redujo significativamente la presión arterial sistémica, la presión de la arteria pulmonar, la presión de la aurícula derecha, la resistencia vascular sistémica y la frecuencia cardíaca, mientras que el índice de volumen sistólico aumentó.
Entre 839 sujetos con insuficiencia cardíaca de clase II-III de la NYHA tratados durante 26 a 52 semanas en 4 ensayos controlados con placebo en los EE. UU., la fracción de eyección (EF) del ventrículo izquierdo promedio medida por ventriculografía con radionúclidos aumentó en 9 unidades EF (%) en sujetos que recibieron COREG 6.25 mg y por 2 unidades EF en sujetos con placebo a una dosis objetivo de 25 a 50 mg dos veces al día. Los efectos del carvedilol sobre la fracción de eyección estaban relacionados con la dosis. Las dosis de 6,25 mg dos veces al día, 12,5 mg dos veces al día y 25 mg dos veces al día se asociaron con aumentos corregidos con placebo en EF de 5 unidades EF, 6 unidades EF y 8 unidades EF, respectivamente; cada uno de estos efectos fue nominalmente estadísticamente significativo.
Disfunción del ventrículo izquierdo después de un infarto de miocardio
No se ha establecido la base de los efectos beneficiosos de COREG 25 mg en pacientes con disfunción ventricular izquierda después de un infarto agudo de miocardio.
Hipertensión
No se ha establecido el mecanismo por el cual el β-bloqueo produce un efecto antihipertensivo.
La actividad bloqueadora de los receptores adrenérgicos β ha sido demostrada en estudios en animales y humanos que muestran que el carvedilol (1) reduce el gasto cardíaco en sujetos normales, (2) reduce la taquicardia inducida por ejercicio y/o isoproterenol, y (3) reduce la taquicardia ortostática refleja. Por lo general, se observa un efecto bloqueador significativo de los receptores adrenérgicos β dentro de la primera hora de la administración del fármaco.
La actividad de bloqueo de los receptores adrenérgicos α1 se ha demostrado en estudios en humanos y animales, lo que demuestra que el carvedilol (1) atenúa los efectos presores de la fenilefrina, (2) causa vasodilatación y (3) reduce la resistencia vascular periférica. Estos efectos contribuyen a la reducción de la presión arterial y generalmente se observan dentro de los 30 minutos posteriores a la administración del fármaco.
Debido a la actividad de bloqueo de los receptores α1 del carvedilol, la presión arterial disminuye más en bipedestación que en decúbito supino, y pueden presentarse síntomas de hipotensión postural (1,8%), incluidos casos raros de síncope. Después de la administración oral, cuando se ha producido hipotensión postural, ha sido transitoria y es poco frecuente cuando COREG se administra con alimentos a la dosis inicial recomendada y se siguen de cerca los incrementos de titulación [ver DOSIFICACIÓN Y ADMINISTRACIÓN ].
En pacientes hipertensos con función renal normal, las dosis terapéuticas de COREG disminuyeron la resistencia vascular renal sin cambios en la tasa de filtración glomerular o el flujo plasmático renal. Los cambios en la excreción de sodio, potasio, ácido úrico y fósforo en pacientes hipertensos con función renal normal fueron similares después de COREG y placebo.
COREG 3,12 mg tiene poco efecto sobre las catecolaminas plasmáticas, la aldosterona plasmática o los niveles de electrolitos, pero reduce significativamente la actividad de la renina plasmática cuando se administra durante al menos 4 semanas. También aumenta los niveles de péptido natriurético auricular.
Farmacocinética
COREG se absorbe rápida y extensamente luego de la administración oral, con una biodisponibilidad absoluta de aproximadamente 25% a 35% debido a un grado significativo de metabolismo de primer paso. Después de la administración oral, la semivida de eliminación terminal media aparente del carvedilol oscila generalmente entre 7 y 10 horas. Las concentraciones plasmáticas alcanzadas son proporcionales a la dosis oral administrada. Cuando se administra con alimentos, la velocidad de absorción se reduce, como lo demuestra el retraso en el tiempo para alcanzar los niveles plasmáticos máximos, sin diferencias significativas en el grado de biodisponibilidad. Tomar COREG con alimentos debe minimizar el riesgo de hipotensión ortostática.
El carvedilol se metaboliza ampliamente. Después de la administración oral de carvedilol radiomarcado a voluntarios sanos, el carvedilol representó solo alrededor del 7 % de la radiactividad total en plasma medida por el área bajo la curva (AUC). Menos del 2% de la dosis se excretó sin cambios en la orina. El carvedilol se metaboliza principalmente por oxidación del anillo aromático y glucuronidación.
Los metabolitos oxidativos se metabolizan aún más por conjugación mediante glucuronidación y sulfatación. Los metabolitos del carvedilol se excretan principalmente a través de la bilis en las heces. La desmetilación y la hidroxilación en el anillo de fenol producen 3 metabolitos activos con actividad bloqueadora de los receptores β. Según estudios preclínicos, el metabolito 4'-hidroxifenilo es aproximadamente 13 veces más potente que el carvedilol para el bloqueo β.
En comparación con carvedilol, los 3 metabolitos activos exhiben una actividad vasodilatadora débil. Las concentraciones plasmáticas de los metabolitos activos son aproximadamente una décima parte de las observadas para carvedilol y tienen una farmacocinética similar a la original.
Carvedilol sufre un metabolismo de primer paso estereoselectivo con niveles plasmáticos de R(+)-carvedilol aproximadamente 2 a 3 veces más altos que S(-)-carvedilol luego de la administración oral en sujetos sanos. La semivida de eliminación terminal aparente media del R(+)-carvedilol varía de 5 a 9 horas en comparación con las 7 a 11 horas del enantiómero S(-).
Las principales enzimas P450 responsables del metabolismo de R(+) y S(-)-carvedilol en microsomas hepáticos humanos fueron CYP2D6 y CYP2C9 y, en menor medida, CYP3A4, 2C19, 1A2 y 2E1. Se cree que CYP2D6 es la enzima principal en la hidroxilación 4' y 5' del carvedilol, con una contribución potencial de 3A4. Se cree que CYP2C9 tiene una importancia primordial en la ruta de O-metilación del S(-)-carvedilol.
El carvedilol está sujeto a los efectos del polimorfismo genético con metabolizadores lentos de la ruinoquina (un marcador para el citocromo P450 2D6) que exhiben concentraciones plasmáticas de R(+)-carvedilol de 2 a 3 veces más altas en comparación con los metabolizadores rápidos. Por el contrario, los niveles plasmáticos de S(-)-carvedilol aumentan solo entre un 20 % y un 25 % en los metabolizadores lentos, lo que indica que este enantiómero se metaboliza en menor medida por el citocromo P450 2D6 que el R(+)-carvedilol. La farmacocinética de carvedilol no parece ser diferente en metabolizadores lentos de S-mefenitoína (pacientes con deficiencia de citocromo P450 2C19).
Carvedilol se une en más del 98% a las proteínas plasmáticas, principalmente a la albúmina. La unión a proteínas plasmáticas es independiente de la concentración en el rango terapéutico. El carvedilol es un compuesto lipofílico básico con un volumen de distribución en estado estacionario de aproximadamente 115 l, lo que indica una distribución sustancial en los tejidos extravasculares. El aclaramiento plasmático oscila entre 500 y 700 ml/min.
Poblaciones Específicas
Insuficiencia cardiaca
Las concentraciones plasmáticas en estado estacionario de carvedilol y sus enantiómeros aumentaron proporcionalmente en el rango de dosis de 6,25 a 50 mg en sujetos con insuficiencia cardíaca. En comparación con los sujetos sanos, los sujetos con insuficiencia cardíaca habían aumentado los valores medios de AUC y Cmax para carvedilol y sus enantiómeros, observándose valores de hasta un 50 % a un 100 % más altos en 6 sujetos con insuficiencia cardíaca de clase IV de la NYHA. La semivida de eliminación terminal aparente media del carvedilol fue similar a la observada en sujetos sanos.
geriátrico
Los niveles plasmáticos de carvedilol en promedio son un 50 % más altos en los ancianos en comparación con los sujetos jóvenes. Insuficiencia hepática En comparación con sujetos sanos, los pacientes con insuficiencia hepática grave (cirrosis) muestran un aumento de 4 a 7 veces en los niveles de carvedilol. Carvedilol está contraindicado en pacientes con insuficiencia hepática grave.
Insuficiencia renal
Aunque el carvedilol se metaboliza principalmente en el hígado, se ha informado que las concentraciones plasmáticas de carvedilol aumentan en pacientes con insuficiencia renal. Según los datos medios del AUC, se observaron concentraciones plasmáticas de carvedilol entre un 40 % y un 50 % más altas en sujetos con hipertensión e insuficiencia renal de moderada a grave en comparación con un grupo de control de sujetos con hipertensión y función renal normal. Sin embargo, los rangos de valores de AUC fueron similares para ambos grupos. Los cambios en los niveles plasmáticos máximos medios fueron menos pronunciados, aproximadamente entre un 12 % y un 26 % más altos en sujetos con insuficiencia renal.
En consonancia con su alto grado de unión a proteínas plasmáticas, el carvedilol no parece eliminarse significativamente mediante hemodiálisis.
Interacciones fármaco-fármaco
Dado que el carvedilol sufre un metabolismo oxidativo sustancial, el metabolismo y la farmacocinética del carvedilol pueden verse afectados por la inducción o inhibición de las enzimas del citocromo P450.
amiodarona
En un ensayo farmacocinético realizado en 106 sujetos japoneses con insuficiencia cardíaca, la coadministración de pequeñas dosis de carga y de mantenimiento de amiodarona con carvedilol resultó en un aumento de al menos dos veces en las concentraciones mínimas en estado estacionario de S(-)-carvedilol [ver INTERACCIONES CON LA DROGAS ].
cimetidina
En un ensayo farmacocinético realizado en 10 sujetos varones sanos, la cimetidina (1000 mg por día) aumentó el AUC de carvedilol en estado estacionario en un 30 % sin cambios en la Cmax [ver INTERACCIONES CON LA DROGAS ].
Digoxina
Después de la administración concomitante de carvedilol (25 mg una vez al día) y digoxina (0,25 mg una vez al día) durante 14 días, el AUC en estado estacionario y las concentraciones mínimas de digoxina aumentaron un 14 % y un 16 %, respectivamente, en 12 sujetos con hipertensión [ver INTERACCIONES CON LA DROGAS ].
Gliburida
En 12 sujetos sanos, la administración combinada de carvedilol (25 mg una vez al día) y una dosis única de gliburida no produjo una interacción farmacocinética clínicamente relevante para ninguno de los compuestos.
hidroclorotiazida
Una dosis oral única de carvedilol de 25 mg no alteró la farmacocinética de una dosis oral única de hidroclorotiazida de 25 mg en 12 sujetos con hipertensión. Asimismo, la hidroclorotiazida no tuvo efecto sobre la farmacocinética del carvedilol.
rifampicina
En un ensayo farmacocinético realizado en 8 sujetos masculinos sanos, la rifampicina (600 mg al día durante 12 días) disminuyó el AUC y la Cmax de carvedilol en aproximadamente un 70 % [ver INTERACCIONES CON LA DROGAS ].
Torsemida
En un ensayo de 12 sujetos sanos, la administración oral combinada de 25 mg de carvedilol una vez al día y 5 mg de torsemida una vez al día durante 5 días no produjo diferencias significativas en su farmacocinética en comparación con la administración de los fármacos solos.
warfarina
Carvedilol (12,5 mg dos veces al día) no tuvo efecto sobre los índices de tiempo de protrombina en estado estacionario y no alteró la farmacocinética de R(+)- y S(-)-warfarina luego de la administración concomitante con warfarina en 9 voluntarios sanos.
Estudios clínicos
Insuficiencia cardiaca
Se evaluó un total de 6975 sujetos con insuficiencia cardíaca de leve a grave en ensayos controlados con placebo de carvedilol.
Insuficiencia cardíaca leve a moderada
El carvedilol se estudió en 5 ensayos multicéntricos controlados con placebo y en 1 ensayo con control activo (ensayo COMET) en sujetos con insuficiencia cardíaca de leve a moderada.
Cuatro ensayos controlados con placebo, doble ciego, multicéntricos en EE. UU. incluyeron a 1094 sujetos (696 asignados aleatoriamente a carvedilol) con insuficiencia cardíaca clase II-III de la NYHA y fracción de eyección menor o igual a 0,35. La gran mayoría tomaba digitálicos, diuréticos y un inhibidor de la ECA al ingresar al ensayo. Los pacientes fueron asignados a los ensayos en función de la capacidad de ejercicio. Un ensayo doble ciego controlado con placebo de Australia y Nueva Zelanda inscribió a 415 sujetos (la mitad asignados al azar a carvedilol) con insuficiencia cardíaca menos grave. Todos los protocolos excluyeron a los sujetos que se esperaba que se sometieran a un trasplante cardíaco durante los 7,5 a 15 meses de seguimiento doble ciego. Todos los sujetos aleatorizados habían tolerado un curso de 2 semanas con 6,25 mg de carvedilol dos veces al día.
En cada ensayo, hubo un punto final primario, ya sea la progresión de la insuficiencia cardíaca (1 ensayo de EE. UU.) o la tolerancia al ejercicio (2 ensayos de EE. UU. cumplieron con los objetivos de inscripción y el ensayo de Australia y Nueva Zelanda). Hubo muchos puntos finales secundarios especificados en estos ensayos, incluida la clasificación de la NYHA, las evaluaciones globales del paciente y el médico y la hospitalización cardiovascular. Otros análisis no planeados prospectivamente incluyeron la suma de muertes y hospitalizaciones cardiovasculares totales. En situaciones en las que los puntos finales primarios de un ensayo no muestran un beneficio significativo del tratamiento, la asignación de valores significativos a los otros resultados es compleja y dichos valores deben interpretarse con cautela.
Los resultados de los ensayos de EE. UU. y Australia-Nueva Zelanda fueron los siguientes:
Disminución de la progresión de la insuficiencia cardíaca
Un ensayo multicéntrico de EE. UU. (366 sujetos) tuvo como punto final primario la suma de la mortalidad cardiovascular, la hospitalización cardiovascular y el aumento sostenido de los medicamentos para la insuficiencia cardíaca. La progresión de la insuficiencia cardíaca se redujo, durante un seguimiento promedio de 7 meses, en un 48 % (p = 0,008).
En el ensayo de Australia y Nueva Zelanda, la muerte y el total de hospitalizaciones se redujeron en aproximadamente un 25 % durante 18 a 24 meses. En los 3 ensayos más grandes de EE. UU., la muerte y el total de hospitalizaciones se redujeron en un 19 %, 39 % y 49 %, nominalmente significativo desde el punto de vista estadístico en los últimos 2 ensayos. Los resultados de Australia y Nueva Zelanda estuvieron estadísticamente en el límite.
Medidas funcionales
Ninguno de los ensayos multicéntricos tenía la clasificación de la NYHA como punto final primario, pero todos esos ensayos la tenían como punto final secundario. Hubo al menos una tendencia hacia la mejora en la clase NYHA en todos los ensayos. La tolerancia al ejercicio fue el punto final primario en 3 ensayos; en ninguno se encontró un efecto estadísticamente significativo.
Medidas subjetivas
La calidad de vida relacionada con la salud, medida con un cuestionario estándar (un criterio principal de valoración en 1 ensayo), no se vio afectada por carvedilol. Sin embargo, las evaluaciones globales de los pacientes y los investigadores mostraron una mejora significativa en la mayoría de los ensayos.
Mortalidad
La muerte no fue un punto final preespecificado en ningún ensayo, pero se analizó en todos los ensayos. En general, en estos 4 ensayos de EE. UU., la mortalidad se redujo, nominalmente de manera significativa en 2 ensayos.
El ensayo COMET
En este ensayo doble ciego, 3029 sujetos con insuficiencia cardíaca clase II-IV de la NYHA (fracción de eyección del ventrículo izquierdo menor o igual al 35 %) fueron aleatorizados para recibir carvedilol (dosis objetivo: 25 mg dos veces al día) o metoprolol de liberación inmediata. tartrato (dosis objetivo: 50 mg dos veces al día). La edad media de los sujetos era de aproximadamente 62 años, el 80 % eran hombres y la fracción de eyección del ventrículo izquierdo media al inicio del estudio era del 26 %. Aproximadamente el 96% de los sujetos tenían insuficiencia cardíaca clase II o III de la NYHA. El tratamiento concomitante incluyó diuréticos (99 %), inhibidores de la ECA (91 %), digitálicos (59 %), antagonistas de la aldosterona (11 %) y agentes hipolipemiantes “estatinas” (21 %). La duración media del seguimiento fue de 4,8 años. La dosis media de carvedilol fue de 42 mg al día.
El ensayo tuvo 2 puntos finales primarios: mortalidad por todas las causas y el compuesto de muerte más hospitalización por cualquier motivo. Los resultados de COMET se presentan en la Tabla 3 a continuación. La mortalidad por todas las causas tuvo la mayor parte del peso estadístico y fue el principal determinante del tamaño del ensayo. La mortalidad por todas las causas fue del 34 % en los sujetos tratados con carvedilol y del 40 % en el grupo de metoprolol de liberación inmediata (P = 0,0017; índice de riesgo = 0,83, IC del 95 %: 0,74 a 0,93). El efecto sobre la mortalidad se debió principalmente a una reducción de la muerte cardiovascular. La diferencia entre los 2 grupos con respecto al punto final compuesto no fue significativa (p = 0,122). La supervivencia media estimada fue de 8,0 años con carvedilol y de 6,6 años con metoprolol de liberación inmediata.
No se sabe si esta formulación de metoprolol en cualquier dosis o esta dosis baja de metoprolol en cualquier formulación tiene algún efecto sobre la supervivencia o la hospitalización en pacientes con insuficiencia cardíaca. Por lo tanto, este ensayo amplía el tiempo durante el cual el carvedilol manifiesta beneficios en la supervivencia en la insuficiencia cardíaca, pero no hay pruebas de que el carvedilol mejore el resultado con respecto a la formulación de metoprolol (TOPROL-XL) con beneficios en la insuficiencia cardíaca.
Insuficiencia cardíaca grave (COPERNICUS)
En un ensayo doble ciego (COPERNICUS), 2289 sujetos con insuficiencia cardíaca en reposo o con esfuerzo mínimo y fracción de eyección del ventrículo izquierdo inferior al 25 % (media del 20 %), a pesar de digitálicos (66 %), diuréticos (99 %) y Los inhibidores de la ECA (89 %) se asignaron al azar a placebo o carvedilol. El carvedilol se tituló desde una dosis inicial de 3,125 mg dos veces al día hasta la dosis máxima tolerada o hasta 25 mg dos veces al día durante un mínimo de 6 semanas. La mayoría de los sujetos alcanzaron la dosis objetivo de 25 mg. El ensayo se llevó a cabo en Europa oriental y occidental, Estados Unidos, Israel y Canadá. Números similares de sujetos por grupo (alrededor de 100) se retiraron durante el período de titulación.
El criterio principal de valoración del ensayo fue la mortalidad por todas las causas, pero también se examinaron la mortalidad por causas específicas y el riesgo de muerte u hospitalización (total, cardiovascular [CV] o insuficiencia cardíaca [IC]). Los datos del ensayo en desarrollo fueron seguidos por un comité de monitoreo de datos, y los análisis de mortalidad se ajustaron para estas miradas múltiples. El ensayo se detuvo después de una mediana de seguimiento de 10 meses debido a una reducción observada del 35 % en la mortalidad (del 19,7 % por año-paciente con placebo al 12,8 % con carvedilol; índice de riesgo 0,65, IC del 95 %: 0,52 a 0,81, P = 0,0014, ajustado) (ver Figura 1). Los resultados de COPERNICUS se muestran en la Tabla 4.
Figura 1. Análisis de supervivencia para COPERNICUS (intención de tratar) 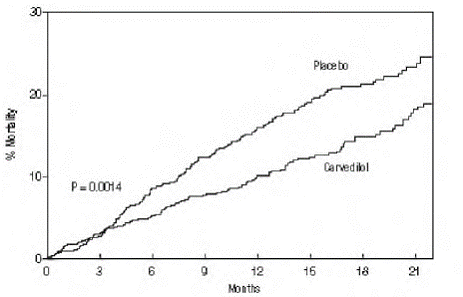
El efecto sobre la mortalidad fue principalmente el resultado de una reducción en la tasa de muerte súbita entre los sujetos sin empeoramiento de la insuficiencia cardíaca.
Las evaluaciones globales de los pacientes, en las que los sujetos tratados con carvedilol se compararon con placebo, se basaron en autoevaluaciones periódicas preespecificadas de los pacientes con respecto a si el estado clínico posterior al tratamiento mostró una mejora, un empeoramiento o ningún cambio en comparación con el valor inicial. Los sujetos tratados con carvedilol mostraron mejoras significativas en las evaluaciones globales en comparación con los tratados con placebo en COPERNICUS.
El protocolo también especificaba que se evaluarían las hospitalizaciones. Menos sujetos con COREG 6,25 mg que con placebo fueron hospitalizados por cualquier motivo (372 frente a 432, p = 0,0029), por motivos cardiovasculares (246 frente a 314, p = 0,0003) o por empeoramiento de la insuficiencia cardíaca (198 frente a 268, p = 0,0001). ).
COREG 6.25 mg tuvo un efecto consistente y beneficioso sobre la mortalidad por todas las causas, así como los puntos finales combinados de mortalidad por todas las causas más hospitalización (total, CV o por insuficiencia cardíaca) en la población general del ensayo y en todos los subgrupos examinados, incluidos hombres y mujeres, ancianos y no ancianos, negros y no negros, diabéticos y no diabéticos (ver Figura 2).
Figura 2. Efectos sobre la mortalidad por subgrupos en COPERNICUS 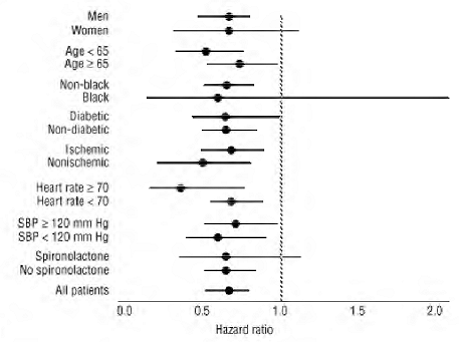
Disfunción del ventrículo izquierdo después de un infarto de miocardio
CAPRICORN fue un ensayo doble ciego que comparó el carvedilol y el placebo en 1959 sujetos con un infarto de miocardio reciente (dentro de los 21 días) y una fracción de eyección del ventrículo izquierdo menor o igual al 40 %, con (47 %) o sin síntomas de insuficiencia cardíaca. Los sujetos a los que se administró carvedilol recibieron 6,25 mg dos veces al día, ajustados según la tolerancia a 25 mg dos veces al día. Los sujetos debían tener una presión arterial sistólica superior a 90 mm Hg, una frecuencia cardíaca en sedestación superior a 60 latidos por minuto y ninguna contraindicación para el uso de bloqueadores beta. El tratamiento del infarto índice incluyó aspirina (85 %), betabloqueantes intravenosos u orales (37 %), nitratos (73 %), heparina (64 %), trombolíticos (40 %) y angioplastia aguda (12 %). El tratamiento de base incluía inhibidores de la ECA o bloqueadores de los receptores de angiotensina (97 %), anticoagulantes (20 %), hipolipemiantes (23 %) y diuréticos (34 %). Las características de la población inicial incluyeron una edad promedio de 63 años, 74 % hombres, 95 % caucásicos, presión arterial media de 121/74 mm Hg, 22 % con diabetes y 54 % con antecedentes de hipertensión. La dosis media alcanzada de carvedilol fue de 20 mg dos veces al día; la duración media del seguimiento fue de 15 meses.
La mortalidad por todas las causas fue del 15 % en el grupo de placebo y del 12 % en el grupo de carvedilol, lo que indica una reducción del riesgo del 23 % en los sujetos tratados con carvedilol (IC del 95 %: 2 % a 40 %, P = 0,03), como se muestra en la Figura 3. Los efectos sobre la mortalidad en varios subgrupos se muestran en la Figura 4. Casi todas las muertes fueron cardiovasculares (que se redujeron en un 25 % con carvedilol), y la mayoría de estas muertes fueron súbitas o relacionadas con la falla de la bomba (ambos tipos de muerte se redujeron por carvedilol). Otro criterio de valoración del ensayo, la mortalidad total y la hospitalización por todas las causas, no mostró una mejora significativa.
También se observó una reducción significativa del 40 % en el infarto de miocardio mortal o no mortal en el grupo tratado con carvedilol (IC del 95 %: 11 % a 60 %, P = 0,01). También se observó una reducción similar en el riesgo de infarto de miocardio en un metanálisis de ensayos controlados con placebo de carvedilol en la insuficiencia cardíaca.
Figura 3. Análisis de supervivencia para CAPRICORNIO (intención de tratar) 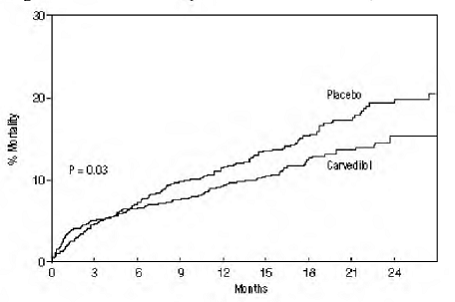
Figura 4. Efectos sobre la Mortalidad por Subgrupos en CAPRICORNIO 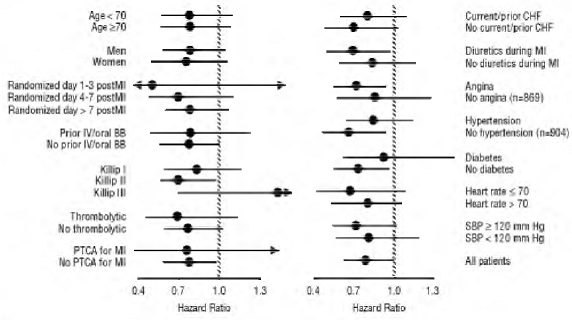
Hipertensión
COREG 25 mg se estudió en 2 ensayos controlados con placebo que utilizaron dosificación dos veces al día en dosis diarias totales de 12,5 a 50 mg. En estos y otros ensayos, la dosis inicial no superó los 12,5 mg. A 50 mg por día, COREG redujo la presión arterial mínima sentado (12 horas) en alrededor de 9/5,5 mm Hg; a 25 mg por día, el efecto fue de aproximadamente 7,5/3,5 mm Hg. Las comparaciones de la presión arterial mínima-máxima mostraron una relación mínima-máxima para la respuesta de la presión arterial de alrededor del 65 %. La frecuencia cardíaca se redujo en alrededor de 7,5 latidos por minuto a 50 mg por día. En general, como ocurre con otros bloqueadores β, las respuestas fueron menores en los sujetos de raza negra que en los no negros. No hubo diferencias relacionadas con la edad o el género en la respuesta.
El efecto antihipertensivo máximo se produjo de 1 a 2 horas después de una dosis. La respuesta de la presión arterial relacionada con la dosis se acompañó de un aumento de los efectos adversos relacionado con la dosis [ver REACCIONES ADVERSAS ].
Hipertensión Con Diabetes Mellitus Tipo 2
En un ensayo doble ciego (GEMINI), se evaluó COREG 25 mg, agregado a un inhibidor de la ECA o un bloqueador de los receptores de angiotensina, en una población con hipertensión leve a moderada y diabetes mellitus tipo 2 bien controlada. La HbA1c media al inicio del estudio fue del 7,2 %. COREG se ajustó a una dosis media de 17,5 mg dos veces al día y se mantuvo durante 5 meses. COREG no tuvo ningún efecto adverso sobre el control glucémico, según las mediciones de HbA1c (cambio medio desde el inicio de 0,02 %, IC del 95 %: -0,06 a 0,10, P = NS) [ver ADVERTENCIAS Y PRECAUCIONES ].
INFORMACIÓN DEL PACIENTE
COREG (Co-REG) (carvedilol) Tabletas
Lea la Información para el paciente que viene con COREG antes de comenzar a tomarlo y cada vez que renueve su receta. Es posible que haya nueva información. Esta información no reemplaza la conversación con su médico sobre su condición médica o su tratamiento. Si tiene alguna duda sobre COREG 3,12 mg, pregunte a su médico o farmacéutico.
¿Qué es COREG 3.12mg?
COREG es un medicamento de venta con receta que pertenece a un grupo de medicamentos denominados “betabloqueantes”. COREG 6,25 mg se usa, a menudo con otros medicamentos, para las siguientes condiciones:
- para tratar pacientes con ciertos tipos de insuficiencia cardiaca
- para tratar a pacientes que sufrieron un ataque al corazón que empeoró el bombeo del corazón
- para tratar pacientes con presión arterial alta (hipertensión)
COREG no está aprobado para su uso en niños menores de 18 años.
¿Quién no debe tomar COREG?
No tome COREG 6,25 mg si:
- tiene insuficiencia cardíaca grave y está hospitalizado en la unidad de cuidados intensivos o requiere ciertos medicamentos intravenosos que ayudan a mantener la circulación (medicamentos inotrópicos).
- son propensos al asma u otros problemas respiratorios.
- tiene latidos cardíacos lentos o un corazón que se salta un latido (latidos cardíacos irregulares).
- tiene problemas hepáticos.
- es alérgico a alguno de los ingredientes de COREG. El principio activo es carvedilol. Consulte el final de este folleto para obtener una lista de todos los ingredientes en COREG.
¿Qué debo decirle a mi médico antes de tomar COREG?
Informe a su médico sobre todas sus afecciones médicas, incluso si usted:
- tiene asma u otros problemas pulmonares (como bronquitis o enfisema).
- tiene problemas con el flujo de sangre en sus pies y piernas (enfermedad vascular periférica). COREG 3.12mg puede empeorar algunos de sus síntomas.
- tener diabetes
- tiene problemas de tiroides.
- tienen una condición llamada feocromocitoma.
- ha tenido reacciones alérgicas graves.
- está embarazada o tratando de quedar embarazada. No se sabe si COREG es seguro para su bebé por nacer. Usted y su médico deben hablar sobre la mejor manera de controlar su presión arterial alta durante el embarazo.
- están amamantando. No se sabe si COREG pasa a la leche materna. Hable con su médico sobre la mejor manera de alimentar a su bebé si está tomando COREG.
- están programados para cirugía y se les administrarán agentes anestésicos.
- está programado para una cirugía de cataratas y ha tomado o está tomando actualmente COREG.
- está tomando medicamentos recetados o de venta libre, vitaminas y suplementos herbales. COREG y ciertos otros medicamentos pueden afectarse entre sí y causar efectos secundarios graves. COREG 3,12 mg puede afectar la forma en que actúan otros medicamentos. Además, otros medicamentos pueden afectar la eficacia de COREG 25 mg.
Mantenga una lista de todos los medicamentos que toma. Muestre esta lista a su médico y farmacéutico antes de comenzar un nuevo medicamento.
¿Cómo debo tomar COREG?
Es importante que tome su medicamento todos los días según las indicaciones de su médico. Si deja de tomar COREG repentinamente, podría tener dolor en el pecho y/o un ataque al corazón. Si su médico decide que debe dejar de tomar COREG 6,25 mg, su médico puede reducir lentamente su dosis durante un período de tiempo antes de suspenderlo por completo.
- Tome COREG exactamente según lo prescrito. Su médico le indicará cuántos comprimidos debe tomar y con qué frecuencia. Para minimizar los posibles efectos secundarios, su médico podría comenzar con una dosis baja y luego aumentarla lentamente.
- No deje de tomar COREG y no cambie la cantidad de COREG que toma sin consultar a su médico.
- Informe a su médico si aumenta de peso o tiene problemas para respirar mientras toma COREG.
- Tome COREG con alimentos.
- Si olvida una dosis de COREG 3.12 mg, tome su dosis tan pronto como lo recuerde, a menos que sea el momento de tomar su próxima dosis. Tome su siguiente dosis a la hora habitual. No tome 2 dosis al mismo tiempo.
- Si toma demasiado COREG 25 mg, llame a su médico o al centro de toxicología de inmediato.
¿Qué debo evitar mientras tomo COREG 3.12mg?
- COREG puede hacer que se sienta mareado, cansado o desmayado. No conduzca un automóvil, use maquinaria ni haga nada que requiera que esté alerta si tiene estos síntomas.
¿Cuáles son los posibles efectos secundarios de COREG?
- Presión arterial baja (que puede causar mareos o desmayos al ponerse de pie). Si esto sucede, siéntese o acuéstese de inmediato e informe a su médico.
- Cansancio. Si se siente cansado o mareado, no debe conducir, usar maquinaria ni hacer nada que requiera que esté alerta.
- Latido del corazón lento.
- Cambios en su nivel de azúcar en la sangre. Si tiene diabetes, informe a su médico si tiene algún cambio en sus niveles de azúcar en la sangre.
- COREG puede ocultar algunos de los síntomas de un nivel bajo de azúcar en la sangre, especialmente un latido cardíaco acelerado.
- COREG puede enmascarar los síntomas del hipertiroidismo (tiroides hiperactiva).
- Empeoramiento de reacciones alérgicas graves.
- Se han producido reacciones alérgicas raras pero graves (que incluyen urticaria o hinchazón de la cara, los labios, la lengua y/o la garganta que pueden causar dificultad para respirar o tragar) en pacientes que tomaban COREG. Estas reacciones pueden poner en peligro la vida.
Otros efectos secundarios de COREG incluyen dificultad para respirar, aumento de peso, diarrea y menos lágrimas u ojos secos que se vuelven molestos si usa lentes de contacto.
Llame a su médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA1088.
¿Cómo debo almacenar COREG 6.25mg?
- Almacene COREG a menos de 86°F (30°C). Mantenga las tabletas secas.
- Deseche de manera segura el COREG que esté vencido o que ya no necesite.
- Mantenga COREG 6,25 mg y todos los medicamentos fuera del alcance de los niños.
Información general sobre COREG
A veces se recetan medicamentos para condiciones distintas a las descritas en los folletos de información para el paciente. No use COREG 3.12mg para una condición para la cual no fue recetado. No le dé COREG a otras personas, incluso si tienen los mismos síntomas que usted tiene. Puede que les haga daño.
Este folleto resume la información más importante sobre COREG. Si desea obtener más información, hable con su médico. Puede pedirle a su médico o farmacéutico información sobre COREG 6.25 mg que está escrita para profesionales de la salud.
¿Cuáles son los ingredientes en COREG?
Principio activo: carvedilol.
Ingredientes inactivos: dióxido de silicio coloidal, crospovidona, hipromelosa, lactosa, estearato de magnesio, polietilenglicol, polisorbato 80, povidona, sacarosa y dióxido de titanio.
Las tabletas de carvedilol vienen en las siguientes concentraciones: 3,125 mg, 6,25 mg, 12,5 mg, 25 mg.
¿Qué es la presión arterial alta (hipertensión)?
La presión arterial es la fuerza de la sangre en los vasos sanguíneos cuando el corazón late y cuando el corazón descansa. Tiene presión arterial alta cuando la fuerza es demasiado. La presión arterial alta hace que el corazón trabaje más para bombear sangre a través del cuerpo y daña los vasos sanguíneos. COREG puede ayudar a que sus vasos sanguíneos se relajen para que su presión arterial sea más baja. Los medicamentos que reducen la presión arterial pueden reducir su probabilidad de sufrir un derrame cerebral o un ataque al corazón.
